Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Probengewinnung und gleichzeitige chromatographische Quantifizierung von Doxorubicin und Mitomycin C nach Kombination Medikamentenabgabe in Nanopartikel zur Tumor-tragenden Mäusen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine effiziente und komfortable analytischen Prozess der Probengewinnung und gleichzeitige Bestimmung von mehreren Medikamenten, Doxorubicin (DOX), Mitomycin C (MMC) und ein Cardio-toxische DOX Metabolit, Doxorubicinol (DOXol), in der biologischen Proben aus einem präklinischen Brust-Tumor-Modell mit Nanopartikel Formulierungen von synergistischen Arzneimittelkombination behandelt.
Zusammenfassung
Kombinations-Chemotherapie wird häufig in der Klinik zur Behandlung von Krebs verwendet; damit verbundenen negative Auswirkungen auf Normalgewebe schränken jedoch seine therapeutischen Nutzen. Nanopartikel-basierte Arzneimittelkombination hat sich gezeigt, um die Probleme der freien Kombination der Arzneimitteltherapie zu mildern. Unsere früheren Studien haben gezeigt, dass die Kombination von zwei Krebsmedikamente, Doxorubicin (DOX) und Mitomycin C (MMC), produziert einen synergistischen Effekt gegen beide Murine und menschlichen Brustkrebs Zellen in Vitro. DOX und MMC Co geladenen Polymer-Lipid Hybrid Nanopartikel (DMPLN) umgangen verschiedenen Efflux-Transporter-Pumpen, die multidrug-Resistenz und nachgewiesene verbesserte Wirksamkeit bei Brustkrebs Tumormodellen übertragen. Im Vergleich zu konventionellen Lösung Formen, wurde diese überlegene Wirksamkeit von DMPLN die synchronisierten Pharmakokinetik von DOX und MMC und erhöhte intrazelluläre Medikament Bioverfügbarkeit innerhalb von Tumorzellen aktiviert, indem die Nanocarrier PLN. zugeschrieben
Zur Bewertung der Pharmakokinetik und Bio-Vertrieb von verwaltet Co DOX und MMC in kostenlose Lösung und Nanopartikel Formen, eine einfache und effiziente Multi-Drug-Analysemethode mit Reverse-Phase Hochleistungs-Flüssigkeitschromatographie (HPLC) wurde entwickelt. Im Gegensatz zu den bisher gemeldeten Methoden, die DOX oder MMC einzeln im Plasma analysiert, ist diese neue HPLC-Methode in der Lage, gleichzeitig DOX, MMC und ein großer Cardio-toxische DOX Metabolit, Doxorubicinol (DOXol), in verschiedenen biologischen Matrizen ( quantitate z. B. Vollblut, Brusttumor und Herz). Ein dual fluoreszierende und UV absorbierende Sonde 4-Methylumbelliferone (4-MU) diente als interner Standard (I.S.) für einstufige Erkennung von mehreren Drogen-Analyse mit verschiedenen Wellenlängen. Diese Methode wurde erfolgreich eingesetzt, um die Konzentrationen von DOX und MMC geliefert durch Nanopartikel und Lösung Ansätze im Vollblut und verschiedenen Geweben in einer orthotopen Brust Tumor Mausmodell zu bestimmen. Die analytische Methode vorgestellt ist ein nützliches Werkzeug für die prä-klinischen Analyse von Nanopartikel-basierte Lieferung von Medikamenten-Kombinationen.
Einleitung
Chemotherapie ist eine primäre Behandlungsmethode für viele Krebsarten, dennoch es oft mit schweren Nebenwirkungen und begrenzte Wirksamkeit aufgrund von Resistenzen und anderen Faktoren1,2,3 ist. Um das Ergebnis der Chemotherapie zu verbessern, wurden Drogen Kombination Therapien angewendet in der Klinik basierend auf Kriterien wie nicht-überlappende Toxizitäten, verschiedene Mechanismen der Wirkdauer und nicht Kreuz Medikament Widerstand4,5 , 6. in klinischen Studien eine bessere Tumor-Response-Rate wurde oft beobachtet, gleichzeitig mit Medikamenten-Kombinationen im Vergleich zu einer Therapie von sequentiellen Medikament Lieferung7,8verabreicht. Gleichzeitige Injektion von mehreren Medikamenten kann jedoch durch suboptimale Bio-Verteilung des freien Arzneiformen, prominente Normalgewebe Toxizität verursachen, die die therapeutische Wirkung9,10,11überwiegt. Nanocarrier-based Drug-Delivery hat sich gezeigt, die Pharmakokinetik und Bio-Vertrieb von gekapselten Medikamenten, Verbesserung der Tumor gezielt Ansammlung12,13,14ändern. Wie in unserem letzten Artikel überprüft, haben Nanopartikel Co geladen mit synergistischen Wirkstoffkombinationen die Fähigkeit, die Probleme der freien Medikamenten-Kombinationen aufgrund ihrer kontrollierten zeitlichen und räumlichen Co Lieferung von mildern gezeigt. mehrere Medikamente zur Tumor-Gewebe, so dass synergistische Drogenwirkungen gegen Krebs Zellen4,15,16. Infolgedessen wurden in beiden präklinischen und klinischen Studien4,17,18überlegenen therapeutischen Wirksamkeit und geringe Toxizität nachgewiesen.
Unsere bisherigen in-vitro- Studien festgestellt, dass die Kombination von zwei Krebsmedikamente, Doxorubicin (DOX) und Mitomycin C (MMC), eine synergistische Wirkung gegen mehrere Brust-Krebs-Zelllinien hergestellt und darüber hinaus Co laden DOX und MMC innerhalb Polymer-Lipid-Hybrid-Nanopartikel (DMPLN) überwand verschiedenen multiresistenten verbunden Efflux Pumpen (z. B. P-Glykoprotein und Brust Krebs beständig Protein)19,20,21. In Vivo, konnten DMPLN räumlich-zeitliche Co Lieferung von DOX und MMC zu Tumor Websites und erhöhte Bioverfügbarkeit von Medikamenten innerhalb von Krebszellen, wie durch Moderation der Bildung von DOX Metaboliten Doxorubicinol (DOXol)22angegeben. Infolgedessen verbessert die DMPLN Tumor Zelle Apoptosis, Tumor Wachstumshemmung und längeren Host überleben im Vergleich um zu kostenlosen DOX und MMC-Kombination oder eine liposomale DOX Formulierung22,23,24, 25.
Die tatsächliche Menge an Drogen Co geliefert durch eine Nanocarrier Analyse ist von entscheidender Bedeutung für die Gestaltung effektiver Nanopartikel Formulierungen. Viele Methoden wurden entwickelt, um die Plasmaspiegel von DOX oder MMC Einzeldosen mit Hochleistungs-Flüssigkeitschromatographie (HPLC) allein oder in Kombination mit Massenspektrometrie (MS)26,27,28 analysieren , 29 , 30 , 31 , 32 , 33 , 34. diese Methoden sind jedoch oft zeitaufwändig und unpraktisch für Kombinationstherapie wie eine große Anzahl von biologischen Proben muss separat für die Analyse von mehreren Medikamenten (manchmal einschließlich Droge Metaboliten) vorbereitet werden. Neben der starken Plasmaproteinbindung von DOX und MMC haben roten Blutkörperchen auch eine große Fähigkeit zu binden und konzentrieren sich viele Krebsmedikamente35,36. So kann Plasmaanalyse DOX oder MMC tatsächliche Droge Blutkonzentrationen verschleiern. Die vorliegende Arbeit (Abbildung 1) beschreibt eine einfache und robuste mehrere Drogen Analysemethode mit umgekehrter Phase HPLC gleichzeitig extrahieren und quantitate DOX, MMC und DOX Metaboliten Doxorubicinol (DOXol) aus Vollblut und verschiedenen Geweben ( z. B. Tumoren). Sie ist erfolgreich angewendet worden, um die Pharmakokinetik und Bio-Vertrieb von DOX und MMC sowie die Bildung von DOXol nach Drug-Delivery über kostenlose Lösungen oder Nanopartikel Formulare (d.h., DMPLN und liposomalen DOX) in einer Orthotopically zu bestimmen implantiert murinen Brusttumor Mausmodell nach intravenösen (i.v.) Injektion22.
Protokoll
alle Tierversuche wurden genehmigt durch die Animal Care Ausschuss des University Health Network am Ontario Cancer Institute und im Einklang mit dem Canadian Council über Animal Care Leitlinien.
1. biologische Probenvorbereitung
- sammeln die Vollblut, wichtige Organe und Brust-Tumor zu vorgegebenen Zeitpunkten nach der intravenösen (i.v.) Verabreichung von wirkstoffhaltigen Formulierungen (z.B. DMPLN, liposomale DOX)
- injizieren ein Brust-Tumor-tragenden Maus i.v. mit einer vorbereiteten wirkstoffhaltigen Formulierung.
- Die Maus zu festgelegten Zeitpunkten (z.B., 15 min) zu betäuben, indem man inhalierbare 2 % Isofluran in einer verschlossenen Kammer.
- Legen die narkotisierten Maus auf den Rücken und legte seine Nase durch einen Nasensteg, der ständig 2 % Isofluran versorgt.
Hinweis: Zur Gewährleistung die Maus erfährt Tiefe Narkose sanft kneifen vorderen Gliedmaßen der Maus und suchen Sie nach einer zuckenden Bewegung. - Gründlich reinigen, die Brust und Bauch Regionen mit 70 % Ethanol und führen Sie dann ein terminal Verfahren der Herzpunktion auf die tiefen narkotisierten Mäuse mit einer heparinisierten 1 mL Spritze und Nadel 23 G.
- Sammeln die Vollblut in einer beschrifteten Natrium Heparin gespritzt Kunststoffrohr und sanft schwenken Sie das Rohr um gesammelten Vollblut kommt in Kontakt mit dem beschichteten Heparin der Rohrwand zu gewährleisten. Sammeln Sie ein Minimum von 50 µL Vollblut. Immer die Proben auf Eis
- Band alle vier Gliedmaßen der Maus, um es zu sichern und öffnen Sie den Bauchraum und Brustkorb der Maus mit einem paar der Schere und Zange. Verschieben Sie den Darm zur Seite und drücken der Leber nach oben in die Pfortader ausreichend verfügbar zu machen. Schneiden Sie die Pfortader zur Entwässerung Blut.
- Durchspülen die ganze Maus Körper mit 50 mL eiskaltes 0,9 % Kochsalzlösung durch das Herz mit einer 10 mL Spritze mit einer Nadel 25 G.
Hinweis: Biegen Sie die Nadel im 90 °-Winkel zur Führung der Spritze in die Pfortader. - Verbrauchsteuern Organe in folgender Reihenfolge: Herz, Lunge, Leber, Milz, Nieren. Trennen Sie der Brusttumor dann, das umgebende Bindegewebe mit einem Einschnitt Schere an der rechten Mamma Fettlappen der Maus. Sammeln Sie alle Organe einzeln in 1,5 mL Polypropylenröhrchen und schnell einfrieren in flüssigem Stickstoff.
Hinweis: die Gallenblase von der Leber trennen. - Der Vollblut bei 4 ° C und ausgeschnittenen Gewebe im-80 ° C Gefrierschrank aufbewahren, bis zur späteren HPLC Analyse.
- Extrahieren DOX, MMC und DOXol aus biologischen Matrizen.
- Wiegen alle gefrorenen seziert Gewebe schnell und in einem 13 mL gerundet unten konische Rohr übertragen. Um mögliche Arzneimittelstoffwechsel oder Verschlechterung zu vermeiden, halten Sie die Proben auf Ice
- Hinzufügen 1-5 mL eiskaltes Zelle Lysis Puffer in die Röhre.
Hinweis: Die Lautstärke des Puffers zu verwenden, hängt das Gewebe Gewicht bezogen auf das Gewebe-Puffer-Verhältnis von 1 g: 5 mL (w/V); für die kleinen Organe, wie Herz und Milz, das Verhältnis ist 1 g: 2 mL. - Verwenden eine Hubbewegung von oben-unten, um die Gewebeproben auf Eis mit einer Geschwindigkeit von 18.000 u/min mit einem elektrischen Hand-Homogenisator homogenisieren.
Hinweis: Vollständige Homogenisierung erfordert ca. 3 bis 5 Wiederholungen eines kurzen Homogenisierung Prozesses von weniger als 15 s, gefolgt von Gewebe Kühlung über Eis zwischen einzelnen kurzen Homogenisierung. - Waschen die 10 mm Sägezahn Generatorsonde des Homogenisators mit destilliertem deionisiertes (DDI) H 2 O, 70 % Ethanol und dann DDI H 2 O zwischen jede Gewebeprobe um Kreuzkontaminationen zu vermeiden.
- Transfer 50 µL Gewebe Homogenat oder Vollblut in einem 1,5 mL Polypropylen Mikro-Zentrifugenröhrchen und Spike mit 5 µL einer internen standard (I.S.) 4-Methylumbelliferone (4-MU) (2000 ng/mL) in das Rohr.
Hinweis: 4-MU-Lösung bereit war, in Methanol hier. - Fügen Sie 250 µL eines Lösungsmittels eiskalte Extraktion in das Röhrchen mit Blut oder Gewebe Homogenat.
Hinweis: Das Lösungsmittel Extraktion besteht aus 60 % Acetonitril (ACN) und 40 % Ammoniumacetat (5 mM) mit pH-Wert eingestellt auf pH = 3,5 mit 0,05 % Ameisensäure. Verwenden Sie eine 1:5 (V/V) Beispiel: Extraktion Lösungsmittel zum Volumenverhältnis. - Kräftig Wirbel die Mischung für 2 min, Zentrifuge bei 3.000 x g-Kraft bei 4 o C für 10 min und Pipettieren 200 µL Überstand in ein anderes vorgekühlt frische Mikro-Zentrifugenröhrchen.
- Verflüchtigen Überstand bei 60 ° C unter einer langsamen Strom von Stickstoffgas mit Lichtschutz.
- Rekonstruieren Sie die getrockneten Reste mit 100 µL eiskalte Methanol, kräftig vortexen 30 s und Zentrifuge bei 3000 X g bei 4 ° C für eine weitere 5 min.
- Den Überstand in einer HPLC Vials einfügen und Probengefäße in einem Autosampler Tray Injektionslösung.
2. HPLC-Instrumentierung und Betriebsparameter
- bereiten HPLC Mobile-Phase mit konsistenten Reproduzierbarkeit
- 500 mL HPLC-Klasse H 2 O mit einem Messzylinder messen.
- 500 mL HPLC-Grade Acetonitril (ACN) mit einem separaten Messzylinder messen.
- Vorsichtig hinzugeben 0,5 mL Trifluoroacetic Säure (TFA) (Vorsicht) in jeweils 500 mL H 2 O und ACN zu der mobilen Phase von H 2 O und ACN mit 0,1 % TFA, bzw..
Hinweis: TFA ist ätzend und giftig und sollte unter einem Labor Abzug gehandhabt werden. Alle Lösemittelgemische sind bei Raumtemperatur vorbereitet. - Filter mobile Phasen durch ein Nylon-Membranfilter mit 0,45 µm Porengröße und in saubere Flaschen der HPLC-Reservoir übertragen.
- Set-up HPLC Instrumentierung für die simultane Detektion von DOX, MMC, und DOXol und I.S. 4-MU.
- Schalten Sie den Gradienten Pumpe de-Gasser, Auto-Sampler, Photodiode Array Detektor und Multi λ Fluoreszenz Detektor.
- Geben die Anfangsbedingungen des Mobile-Phasenzusammensetzung auf 16,5 % H 2 O (0,1 % TFA) und 83,5 % ACN (0,1 % TFA) (V/V).
- Set UV-Detektor auf zwei Kanälen, jeweils 310 nm für 4-MU (I.S.) und andererseits bei 360 nm für MMC.
- Einstellen den Fluoreszenz-Detektor auf zwei Kanälen, bei λ ex / λ Em = 365/445 nm für 4-MU und die andere am λ ex / λ Em = 480 nm/560 nm für DOX und DOXol, bzw..
- Legen Sie eine isokratische Durchfluss von 1,0 mL/min
- Eine vorinstallierte umgekehrter Phase C 18 Säule (4,6 mm x 250 mm, 5 µm) bei Raumtemperatur für 10 min für Grundlinie Einrichtung equilibrate.
- Trennen Drogen (DOX, MMC, DOXol und 4-MU) mit Farbverlauf Mobile-Phasenlage.
- Injizieren 15 µL extrahiert und neu konzentrierte Proben mit der Auto-Sampler.
- Nach und nach ändern der Anfangsbedingung Mobile-Phase (siehe Protokoll Schritt 2.2.2) zu 100 % ACN (0,1 % TFA) über 18 min mit Farbverlauf Automatikpumpe.
Hinweis: Bei der Trennung, vier Kanäle (zwei UV-absorbierenden und zwei Leuchtstoffröhren) erscheinen gleichzeitig mit jedem Kanal ein Medikament zusammengesetzten anzeigen (siehe Protokoll Schritt 2.2.3 und 2.2.4). - 100 % von ACN halten (0,1 % TFA) für 1 min und dann zurück auf den ersten mobilen Phase Zustand innerhalb von 1 min.
- Neu Zustand die Spalte mit der mobilen Anfangsphase bei Durchfluss von 1,5 mL/min für 4 min für die nächste Probeninjektion.
3. HPLC-Validierung
- bereiten Arbeitsstandards DOX, MMC und DOXol und 4-MU (I.S.).
- Wiegen separat 1 mg DOX und MMC Medikament Pulver (Vorsicht) und 4-MU auf ein frisches, klein mit einem Gewicht von Papier (3 x 3 Zoll 2).
Beachten Sie, dass alle Krebsmedikamente gesundheitsschädlich gelten, die akute Toxizität und Keimzelle Mutagenität auf Einatmen oder Verschlucken verursachen können. Sie sollten vorsichtig mit Handschuhen und Masken behandelt werden. - Übertragen die gewogenen DOX, MMC und 4-MU in eine neue individuelle 1,5 mL Polypropylen Mikro-Zentrifugenröhrchen.
- Fügen Sie 1 mL methAnol und Vortex kurz zu 1 mg/mL Konzentration von DOX und MMC.
- Fügen Sie 1 mL Methanol in ein Fläschchen mit vorgewogene 1 mg DOXol (Vorsicht) und Vortex kurz zu 1 mg/mL Konzentration von DOXol.
Hinweis: DOXol ist ein Cardio-toxische Metaboliten und sollte vorsichtig behandelt werden. - Pipette 20 µL bereit Stammlösungen DOX, MMC, DOXol und 4-MU in ein neues 1,5 mL Polypropylen Mikro-Zentrifugenröhrchen trennen und fügen 980 µL von Methanol, einen funktionierende Standard von 20 µg/mL jedes Medikament zu erhalten.
- Verdünnen 20 µg/mL DOX, MMC und DOXol unter Verwendung von Methanol zu Arbeitsstandards 50 ng - 20 µg /mL DOX, MMC und DOXol und 2000 ng/mL für I.S. 4-MU.
- Dichtung die Kappe des Rohres der Gebrauchslösungen mit einem schmalen Stück Paraffin Film Abdeckung an Methanol Verdunstung zu verhindern, wickeln das gesamte Rohr mit Alufolie zu meiden, direktes Licht und bei-20 ° c
- Wiegen separat 1 mg DOX und MMC Medikament Pulver (Vorsicht) und 4-MU auf ein frisches, klein mit einem Gewicht von Papier (3 x 3 Zoll 2).
- Bestimmen die Linearität, Präzision und Genauigkeit der DOX, MMC und DOXol in biologischen Matrizen (d.h., Vollblut und Tumor-Homogenat).
- Gleichzeitig Spike 5 µL Arbeitsstandards DOX und DOXol (50 ng/mL - 20 µg/mL), MMC (1.000 ng/mL - 16 µg/mL), und 4-MU (2 µg/mL) in 50 µL leer Vollblut oder Gewebe Homogenat in Mikro-Zentrifuge Polypropylenröhrchen zu die standard Konzentrationskurve von 5-2000 ng/mL für Wirkstoffe und 200 ng/mL für 4-MU (I.S.) bis hin zu erhalten.
- Führen Sie die Droge Extraktion Assay im Protokoll 1.2 beschrieben.
- Verwenden Sie niedrige, mittlere und hohe Konzentrationen von DOX und DOXol (50, 500 und 2.000 ng/mL) und MMC (100, 1000, 2.000 ng/mL) für Intra - und inter - Tag Präzision und Genauigkeit.
Hinweis: Bereiten Sie frische standard Konzentrationen am Tag der Analyse.
- Analyse von Proben
- injizieren 15 µL der Probe mit der Auto-Sampler.
- Nach und nach ändern die mobile Phase über 0 bis 18 min, die Zusammensetzung von ACN über das Intervall zu erhöhen.
- Nach 18 min, halten Sie die mobile Phase Voraussetzung für 1 min.
- Wieder in den Ursprungszustand über die nächsten 2 min, dann wieder für 4 min vor der nächsten Injektion equilibrate.
- Nach jeder Probe laufen, beachten Sie, dass die Gipfel der Wirkstoffe mit ihren Retentionszeit wie folgt angezeigt werden: MMC, DOXol, 4-MU (I.S.) und DOX.
- Die Peakfläche unter der Kurve (AUC) Wirkstoffe mittels HPLC-Software zu integrieren.
- Das AUC Verhältnis zwischen einzelnen Droge zusammengesetzte und I.S. (Gleichung 1) zu berechnen und verwenden die Standardkurven unter der gleichen Extraktionsverfahren vorbereitet, die Droge-Konzentrationen von DOX, MMC und DOXol in DMPLN Formulierung bestimmen.
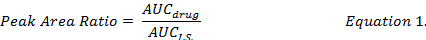
- berechnen die Droge Erholung Prozentsatz (Gleichung 2) durch den Vergleich der Droge Konzentrationen wieder hergestellt unter Verwendung von Methanol aus den Extrakten von Spike biologischen Proben, der Norm (" ordentlich ") medikamentöse Lösung in Methanol.
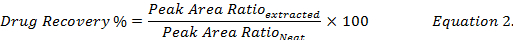
Ergebnisse
Zwei Krebsmedikamente, DOX und MMC sowie der DOX Metabolit, DOXol, wurden gleichzeitig ohne biologische Störungen unter der gleichen angewandte Gradienten HPLC Zustand mit 4-MU als die I.S. für die Fluoreszenz und die UV-Detektoren nachgewiesen. DOX, MMC, DOXol und 4-MU waren gut getrennt voneinander mit Retentionszeiten von 5,7 min für MMC, 10,4 min für DOXol, 10,9 min für 4-MU und 11,1 min für DOX (Abbildung 2). Jedes Medikament im Vollblut und versch...
Diskussion
Im Vergleich zu anderen chromatographischen Methoden, die den Nachweis einer einzigen Wirkstoff-Spezies zu einem Zeitpunkt zu ermöglichen, ist dieses HPLC-Protokolls in der Lage, gleichzeitig drei Wirkstoffe (DOX, MMC und DOXol) in der gleichen biologischen Matrix ohne die Notwendigkeit zu ändern quantitate die mobile Phase. Diese Vorbereitung und Analyse-Methode wurde erfolgreich eingesetzt, um die Pharmakokinetik und Bio-Vertrieb von zwei Nanopartikel-based Drug Delivery Systeme bestimmen (z. B. liposomalen ...
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen und Interessenkonflikte.
Danksagungen
Die Autoren erkennen dankbar der Anlagen Zuschuss von naturwissenschaftlichen und technischen Forschung (NSERC) Council of Canada für HPLC, Betriebskostenzuschuss seitens des Canadian Institute of Health Research (CIHR) und Canadian Breast Cancer Research (CBCR) Allianz X.Y. Wu und der University of Toronto-Stipendium für R.X. Zhang und T. Zhang.
Materialien
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
Referenzen
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten