Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In Vivo EPR-Bewertung der pH, pO2, Redox-Status, und Konzentrationen von Phosphat und Glutathion in der Tumor-Mikroumgebung
In diesem Artikel
Zusammenfassung
Low-Bereich (L-Band, 1,2 GHz) Elektron paramagnetischen Resonanz mit löslichen Nitroxyl und Trityl Sonden wird zur Beurteilung der physiologisch wichtigen Parameter in den Tumor Mikroumgebung in Mausmodellen von Brustkrebs gezeigt.
Zusammenfassung
Dieses Protokoll zeigt die Fähigkeit der Low-Bereich Elektron paramagnetischen Resonanz (EPR)-basierte Techniken in Kombination mit funktionalen paramagnetischen Sonden quantitative Angaben zu den chemischen Tumor Mikroumgebung (TME), einschließlich p O2, pH-Wert, Redox-Status, Konzentrationen von interstitiellen anorganischem Phosphat (Pi) und intrazellulären Glutathion (GSH). Insbesondere eine Anwendung einer neu entwickelten lösliche multifunktionale Trityl Sonde bietet unübertroffene Möglichkeit für in Vivo gleichzeitige Messungen von pH, pO2 und Pi E Xtracellular Raum (Hoffnung Sonde). Die Messungen der drei Parameter, die mit einer einzigen Sonde erlauben ihre Korrelation Analysen unabhängig von Sonde Verteilung und Zeit der Messungen.
Einleitung
Eine zentrale Rolle des TME in der Tumorprogression und Therapie ist immer geschätzt1. Unter wichtige physiologische Parameter von TME in soliden Tumoren, Gewebe Hypoxie2, Azidose3,4, hohe Reduzierung Kapazität5, erhöhte Konzentrationen von intrazellulären GSH-6,-7, und interstitielle Pi8 sind gut dokumentiert. Nicht-invasive in-vivo pO2, pH-Wert, Pi, GSH und Redox Bewertungen bieten einzigartige Einblicke in die biologischen Prozesse im TME und voraus-Tools für präklinische Screening von Anti-Krebs-Medikamente und TME-gezielte therapeutische Strategien zu helfen. Eine vernünftigen Radiofrequenz Eindringtiefe im Gewebe durch Magnetresonanz-Bildgebung (MRI) und Low-Bereich EPR-basierte Techniken macht sie das am besten geeignete Ansätze für nicht-invasive Beurteilung dieser TME-Parameter. MRI stützt sich weitgehend auf bildgebende Wasser Protonen und ist weit verbreitet in klinischen Einrichtungen, anatomische Auflösung bieten aber funktionelle Lösung fehlt. Die Kernspinresonanz Phosphor-31 (31P-NMR) Messungen der extrazellulären Pi Konzentration und pH-Wert basierend auf ein Signal von endogenen Phosphat sind potentiell attraktiv für TME Charakterisierung, aber sind normalerweise um ein Vielfaches maskiert höheren intrazellulären Pi Konzentrationen9,10. Im Gegensatz dazu EPR-Messungen setzen auf Spektroskopie und Bildgebung des speziell entworfen paramagnetische Sonden, funktionelle Lösung bereitzustellen. Beachten Sie, dass exogene EPR-Sonden einen Vorteil gegenüber exogenen haben Sonden NMR wegen der viel höheren inneren Empfindlichkeit des EPR und Fehlen von endogenen Hintergrund EPR Signalen. Die jüngste Entwicklung von einer Doppelfunktion pH und Redox Nitroxyl probe11 und multifunktionale Trityl Sonde12 bietet unübertroffene Möglichkeiten für in Vivo gleichzeitige Messungen von mehreren TME-Parameter und ihre Korrelation Analysen unabhängiger Sonde Verteilung und Uhrzeit der Messung. Unseres Wissens gibt es keine anderen Methoden zur Verfügung, um gleichzeitig in Vivo physiologisch wichtigen chemischen TME Parameter in lebendigen Subjekten, z. B. pO2pHe, Pi, Redox und GSH bewerten.
Sonden für In Vivo Funktionsmessungen:
Abbildung 1 zeigt die chemische Strukturen der paramagnetischen Sonden TME Zugriff auf Parameter, darunter Partikel- und lösliche Sonden verwendet. Hohe funktionale Empfindlichkeit, Stabilität in lebendem Gewebe und minimale Toxizität sind ein paar Vorteile, die partikuläre Sonden bevorzugt über lösliche Sonden für in Vivo EPR Pulsoxymetrie machen. Zum Beispiel haben partikuläre Sonden Retentionszeiten auf dem Gelände des Gewebes Implantat im Vergleich zu löslichen Sonden für longitudinale Messung des Gewebes pO2 über mehrere Wochen erhöht. Auf der anderen Seite lösliche Sonden übertreffen partikuläre Sonden durch die Bereitstellung von räumlichen gelöst Messungen mittels EPR-basierte bildgebende Verfahren sowie die begleitende Analysen von mehreren Funktionalitäten (pO2, pH, Pi, Redox, und GSH).

Abbildung 1. Chemische Strukturen der paramagnetischen Sonden, die TME Bewertung Assay zusammenbauen. Dazu gehören die Partikel pO2 Sonde, LiNc-Auftrieb (R = - O (CH2)3CH3), und lösliche Sonden: Doppelfunktion pH und Redox Sonde, NR; GSH-Sensitive Sonde, RSSR; und multifunktionale pO2, pH und Pi-Sonde von der extrazellulären Mikroumgebung, die Hoffnung Sonde. Die Synthese von diese Sonden wurde in die angegebenen Referenzen 11,12beschrieben. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protokoll
Alle tierische Arbeit erfolgte gemäß Protokoll von WVU IACUC genehmigt.
(1) Sonde Synthese und Kalibrierung
- Partikelfilter pO2-sensible LiNc-Auftrieb Sonde
Hinweis: LiNc-Auftrieb Mikrokristalle synthetisiert und wie in Referenz13beschrieben. Sie sind sehr stabil und können jahrelang bei Raumtemperatur aufbewahrt werden. Der EPR Linewidth der LiNc-Auftrieb Partikel Sonde ist eine pO2-sensible Parameter. LiNc-Auftrieb Mikrokristalle zeigen ideale lineare Abhängigkeit des die Linienbreite auf Sauerstoff-Konzentration im Bereich von anoxischen Bedingungen bis zu 760 MmHg pO2 Partialdruck13, mit den Werten der intrinsischen Linewidth in Abwesenheit der Sauerstoff und die Neigung der Sauerstoff Abhängigkeit (gemessen in mG/MmHg) leicht variieren für verschiedene Chargen der weiteren Vorbereitung. Daher ist die Kalibrierung für jeden bestimmten Charge erforderlich.- Wiegen Sie 60 mg LiNc-Auftrieb Mikrokristalle.
- Für Sauerstoff Empfindlichkeit Kalibrierung Mikrokristalle in 3 mL Dulbeccos geändert Eagle Media (DMEM) Medium (in einer Konzentration von 20 mg/mL) und für 5 min auf Eis mit einer Sonde Sonikator bei 20 kHz mit 7 W Leistung in einer 5 mL Rundboden Glasröhre beschallen.
- Platz 1 mL der beschallten Mikrokristalle in einem Glas Rohr im Resonator Oberfläche Spule L-Band (1,2 GHz) EPR-Spektrometers und kontinuierlichen Wellen (CW) EPR-Spektren in der physiologischen Temperatur von 37 ° C und Sauerstoff-Konzentrationen von 0, 1, 2, 4, 8 zu erwerben , und 20,9 %. Pflegen Sie die Sauerstoffkonzentration von sprudelnden Lösung mit Gas-Gemisch aus einem Gas-Controller geliefert und behalten Sie die Temperatur mit einem Wasserbad mit einem Thermostat verbunden. Verwenden Sie die folgenden Spektrometer Aufnahmeparameter EPR: Amplitude Modulation, 100 mG; Modulationsfrequenz, 100 kHz; fegen Sie breite, 5 G; Sweep-Zeit, 60 s.
- Um ein besseres Signal-Rausch-Verhältnis (SNR) zu erreichen, verwenden Sie eine Modulation Amplitudenwert von 60 % des die Linienbreite (z.B., verwenden Sie eine Amplitude Modulation 0,6 G für die Linienstärke von 1 G).
- Alternative vereinfacht Kalibrierung: Notieren Sie die EPR-Spektren in Luft sprudelte und anoxischen Lösungen14. Pflegen Sie im letzteren Fall Sauerstoffmangel in den Proben durch die Zugabe von 10 mM Glukose und 100 U/mL Glukose-Oxidase zu 1 mL Sonde Lösungen nach Referenz14.
- Passen Sie die EPR-Spektren mit der Lorentzian Funktion um die Linienbreite, LW zu finden. Bewerten Sie die Empfindlichkeit der Mikrokristalle, pO2 als eine Steigung von der Abhängigkeit von LW pO2, nämlich als einen Wert von (LWLuft−LWAnoxie) /pO2air, wo LWLuft und LWAnoxie Spektren Linewidth in Luft und Anoxie Bedingungen bzw.; p O2air = 152 MmHg.
- Doppelfunktion pH und Redox Sonde, NR
Hinweis: Die NR-Sonde wird synthetisiert, wie in Referenz11beschrieben. Es ist bei Raumtemperatur stabil, als Feststoff und in wässrigen Lösungen. Die synthetisierte NR-Sonde ist bei 4 ° c aufbewahrt. Die Stickstoff-Hyperfein-Spaltung, einNund die Zerfallsrate Signal Amplitude sind die spektralen Parameter der NR-Sonde, die empfindlich auf pH-Wert (pKeine Sonde = 6,6 bei 37 ° C, der pH-Wert Empfindlichkeitsbereich von 5,6 bis 7.6) und die Verringerung der Sonde Mikroumgebung, beziehungsweise.- Entfernen Sie die NR aus der Tiefkühltruhe und ermöglichen Sie den Container auf Raumtemperatur (10-15 min). 6,34 mg die NR Abwiegen, in 1 mL Kochsalzlösung auflösen, und stellen Sie den pH-Wert auf 7.2 mit kleinen Aliquote HCl oder NaOH mit dem pH-Meter. Verwenden Sie die fertige NR-Lösung (10 mM) als eine Stammlösung.
- Führen Sie die pH-Kalibrierung der Sonde NR wie folgt (siehe Referenz-11). Fügen Sie zunächst 0,1 mL der Vorratslösung NR zu 2 mM Na-Phosphat-Puffer, 150 mM NaCl 0,9 mL. Die erhaltenen 1 mM NR-Lösung mit aliquoten HCl oder NaOH auf den erforderlichen pH-Wert mit einem pH-Meter zu titrieren. Kontrollieren Sie die Temperatur mit einem Wasserbad mit einem Thermostat verbunden.
- Notieren Sie die EPR-Spektren der Proben in 1,5 mL Mikrozentrifugenröhrchen mit L-Band EPR-Spektrometer. Verwenden Sie die folgenden Spektrometer Aufnahmeparameter EPR: Amplitude Modulation, 2,5 G; Modulationsfrequenz, 100 kHz; fegen Sie breite, 60 G; Sweep-Zeit, 20 s.
- Messen Sie der Hyperfein Aufteilung konstant (N) als die Hälfte des Abstandes zwischen Low und High Feldkomponenten der EPR-Spektren und versus pH-Wert, die Eichkurve für L-Band EPR-Messungen des pH-Wertes zu plotten.
- GSH-Sensitive RSSR Sonde
Hinweis: Die RSSR Sonde wird synthetisiert, wie in der Referenz15beschrieben. Speichern der synthetisierten NR Sonde bei 4 ° C. Die lipophilen RSSR Disulfid Biradical zusammengesetzte diffundiert leicht über der Zellmembran mit intrazellulären GSH reagieren und bieten einen zuverlässigen Ansatz zur Bestimmung GSH in Vivo mit EPR16,17. Diese Methode basiert auf die hohe Reaktionsgeschwindigkeiten der vorherrschende intrazellulären Pool der GSH Thiole mit der RSSR-Sonde. Die Reaktion der RSSR Biradical mit GSH spaltet seine Disulfid Bindung (siehe Schema 1) führt die Aufhebung des Spin-Austausch zwischen den zwei radikale Fragmente und manifestiert sich in einem Rückgang der Biradical spektrale Komponenten und entsprechenden Erhöhung der Monoradical Komponenten. Für die Biradical RSSR Sonde der Anstieg der Amplitude der Monoradical Komponente ist proportional zu der GSH-Konzentration und ist ein bequemer GSH-Sensitive EPR spektrale Parameter. Um GSH-Konzentration aus den in-Vivo -EPR-Messungen zu bewerten, muss die vorhergehende Kalibrierung von der Rate der RSSR Reaktion mit GSH bei der entsprechenden Temperatur und pH-Wert wie folgt durchgeführt werden.- Entfernen Sie der RSSR aus dem Gefrierschrank und den Container auf Raumtemperatur (10-15 min). 4,05 mg die NR Abwiegen und in 1 mL DMSO-Lösung auflösen. Verwenden Sie die fertige RSSR-Lösung (10 mM) als eine Stammlösung.
- Ermitteln Sie den Wert der Rate konstant, kObs, der Reaktion der RSSR mit GSH bei wünschenswert Temperatur und pH-Wert wie folgt.
- Fügen Sie zunächst 20 µL der RSSR Vorratslösung (10 mM) bis 0,98 mL 1 mM Na-Phosphat-Puffer, pH 7,2, 150 mM NaCl, erhalten eine 0,2 mM RSSR Sonde Lösung.
- Lösungen der 1, 2 und 5 mM Konzentrationen von GSH in 0,1 M Na-Phosphat-Puffer bei pH 7,2 vorzubereiten. Um GSH-Konzentration in den Zellen der gezielten Orgel von in Vivo Messungen genau zu bewerten, muss die in-vitro- Kalibrierung bei einem pH-Wert nahe an den Wert des intrazellulären pH durchgeführt werden.
- Mischen Sie gleiche Volumina von 0,2 mM RSSR Lösung und eines der GSH-Lösungen im Schritt 1.3.4 vorbereitet. für eine Endkonzentration von der Sonde bei 0,1 mM und der GSH bei 0,5, 1 oder 2, 5 mM.
- Unmittelbar nach RSSR und GSH Lösung mischen legen Sie die Probe in der EPR-Resonator und Aufzeichnen der EPR-Spektren alle 12 Sekunden für 10 Minuten. Dann berechnen Sie die Kinetik der Erhöhung der spektralen Amplitude Monoradical. Verwenden Sie die folgenden Spektrometer Aufnahmeparameter EPR: Amplitude Modulation, 1 G; Modulationsfrequenz, 100 kHz; fegen Sie breite, 60 G; Wobbelzeit, 10-60 s.
- Passen Sie die gemessenen EPR-Kinetik, die Monoexponents und berechnen Sie die Zeitkonstante der exponentiellen Kinetik, τ zu. Die lineare Regression (1/τ = kObs × [GSH]) bietet die beobachtete Rate konstanten Wert der Reaktion zwischen GSH und RSSR (z. B.bei 34 ° C und pH 7,2, kObs = 2,8 ± 0,2 M-1s-1)11.
- Multifunktionale Hoffnung Sonde für pO2, pH und Pi-Bewertung
Hinweis: Die Monophosphonated-Trityl, die Hoffnung Sonde synthetisiert wird, wie in beschrieben12 zu verweisen und ist bei 4 ° c aufbewahrt Die CW EPR-Spektren der Hoffnung bei pH << pKa (A - Säureform) und pH >> pKa (B - Grundform) werden durch die Dubletten durch Phosphor Hyperfein teilen, einemPdargestellt. Typisches Instrumenteinstellungen sind wie folgt: Amplitude Modulation, 37,5 mG; Modulationsfrequenz, 100 kHz; fegen Sie breite, 0,9 G; Sweep-Zeit, 20-60 s. Bei mittleren pH (5 < pH < 8) das EPR-Spektrum der Hoffnung Sonde zeichnet sich durch ein Quartett wenn beide A und B Staaten vorhanden sind. Die einzelnen EPR Linewidth der Hoffnung ist ein pO2 Marker (Genauigkeit, ≈ 1 MmHg; p O2 Bereich 1-100 MmHg). Der Anteil der protonierten Hoffnung (eine Form) ist ein Marker der pH-Wert im Bereich von 6 bis 8.0 (Genauigkeit, ± 0,05). Der Wert des Proton Wechselkurses (ausgedrückt in mG) mit Pi extrahiert von Spektren Simulation ist ein Pi-Marker (Genauigkeit, ± 0,1 mM, Bereich, 0,1-20 mM). Kalibrierverfahren erfolgt bei physiologischen Temperatur (37 ° C), Ionenstärke der Lösung (NaCl, 150 mM) und Hoffnung Sonde Konzentration von 0,2 mM, wie zuvor in Referenzen12,18 beschrieben, und unten genau geschildert.- Entfernen der Hoffnung-Sonde aus dem Gefrierschrank und den Container auf Raumtemperatur (10-15 min).
- Wiegen Sie 10,7 mg des Prüfpunkts Hoffnung ab, in 1 mL Kochsalzlösung lösen Sie auf, und einstellen Sie den pH-Wert 7,4. Hinzufügen von 20 µL der vorbereiteten Vorratslösung der Hoffnung (10 mM) bis 0,98 mL Kochsalzlösung zu einem 0,2 mM Hoffnung Sonde Lösung.
- Titrieren Sie für die Kalibrierung der Sonde des pH-Werts 0,2 mM der Hoffnung Sonde Lösung durch die Zugabe einer kleinen Menge an NaOH oder HCl, mit die letzte Verdünnung der Probe weniger als 1 %. Messen Sie den pH-Wert mit einem pH-Elektrode kalibriert bei 37 ° C über die pH-Werte für die Referenzlösung empfohlen von National Bureau of Standards (US). Verwenden Sie einen doppelwandigen Reaktion Becher an ein Thermostat angeschlossen, um Temperatur des Referenz- und betitelten Lösungen sorgfältig während der pH-Messung zu halten. Anoxische Bedingungen durch die Zugabe von 10 mM Glukose und 100 U/mL Glukose-Oxidase, die Sonde Lösungen zu erhalten.
- Erwerben Sie die EPR-Spektren der A und B Formen bei pH ≤ 5 und pH ≥ 8, bzw. unter anoxischen Bedingungen in Ermangelung von Phosphat.
- Verwenden Sie die entsprechenden Spektren intrinsische spektrale Parameter zu erhalten. Nämlich, simulieren Sie die Spektrallinie als die Faltung der Lorentzian Funktion mit der Gaußschen Funktion, die die ungelösten super Hyperfein-Struktur der Hoffnung Sonde nähert. Die Montage der berechneten EPR-Spektren der experimentellen Spektren ergibt die Werte einesP und Lorentzian Linewidth (ΔLpp), bestimmt durch die transversale Entspannung-Rate 1/T2 (wo 1/T2 = (√3/2) Lpp für die gemessenen Ableitung von der RF-Absorptionslinie im CW EPR), und die Linienbreite der Gauß-Verteilung, G.
Hinweis: Im folgenden werden die Parameter aus den Spektren gemessen an den in Schritt 1.4.2 festgelegten Bedingungen erhalten: einP(A) = 3,63 G, einP(B) = 3,37 G; 1/T2(A) = 23,6 mG; 1/T2(B) = 9 mG; G(A) = 40 mG; Angegeben = 45 mG (siehe Hinweis8). - Erwerben die EPR-Spektren der Hoffnung bei mittleren pH (5 < pH < 8). Die hohen eingereicht Komponente der erworbenen EPR-Spektren, die mit der Theorie des Austausches zwischen mehreren Standorten in nicht gekoppelt oder lose gekoppelte Systeme adaptiert von Referenz19 als zuvor beschriebenen18zu simulieren. Verwendung der systeminternen Parameter für A erhalten und B-Staaten (siehe Schritt 1.4.5), die Anzahl der Variablen zu verringern. Passen Sie die berechnete Spektren, die experimentelle, um die Werte des Bruchs einer (pA) zu finden, und Plotten Sie die Abhängigkeit von den p-A -Wert von pH. Verwenden Sie die Abhängigkeit des pA auf pH in weiteren Studien als eine Kalibrierungskurve pH.
Hinweis: Montage der pH-Abhängigkeit der pA mit einer standard-Titration-Kurve stellt den Wert der Dissoziation konstant, pKein (Hoffnung) = 6,98. In in-Vivo -Studien ist erwerben die volle EPR-Spektren des Prüfpunkts Hoffnung unpraktisch wegen der zusätzlichen Zeit benötigt, um die Lücke zwischen niedrig und Hochfeld-Komponenten von der Phosphor-Hyperfein Spaltung in das EPR-Spektrum zu erwerben. Daher hat in weiteren beispielhaft Studien nur die hohen eingereicht Komponente des EPR-Spektrums gemessen analysiert und. - Erwerben Sie für die Kalibrierung der Sonde von pO2EPR Spektren des Prüfpunkts Hoffnung bei verschiedenen Sauerstoffkonzentrationen.
- Control pO2 -Werte der Lösungen von sprudelnden mit Gas-Gemisch aus einem Gas-Controller geliefert. Kontrolle der Temperatur der Lösung (37 ° C) mit einem Wasserbad mit einem Thermostat verbunden.
- Simulieren Sie die EPR-Spektren zu und passen sie die experimentelle, wie unter Schritt 1.4.6 zur Bestimmung der Werte der Sauerstoff-induzierte Entspannung raten.
Hinweis: Die Werte der Sauerstoff-induzierte Entspannung Preise waren 0,49 mG/MmHg sowohl für A und B Formen der Hoffnung Sonde gemessen bei 37 ° C8. - Erwerben Sie für die Kalibrierung der Sonde [PI] EPR Spektren des Prüfpunkts Hoffnung bei verschiedenen Phosphat-Konzentrationen. Verwenden Sie die Hoffnung radikale Lösung mit einem pH-Wert in der Nähe von pKein (pKein = 6,9 bei 37 ° C)18 und mit verschiedenen Phosphat-Konzentrationen titrieren. Pflegen Sie die Temperatur- und Zusammensetzung, wie in oben genannten Schritte.
- Simulieren Sie die EPR-Spektren und passen sie die experimentelle, wie in Schritt 1.4.6 zur Bestimmung der Werte des Pi-induzierte Wechselkurses beschrieben.
Hinweis: Die Abhängigkeit des Pi-induzierte Wechselkurses [Pi] dient als Kalibrierung in weiteren Studien.
(2) Maus-Modellen von Brustkrebs
- MMTV-PyMT spontane Tumor Modell
- Verwenden Sie 4-8 Wochen-alte weibliche Freund Virus Typ B Anfälligkeit/NIH (FVB/N) Maus Milch-Tumor Virus Promotor (MMTV) Polyoma Mitte-T Antigen (PyMT +) Mäuse mit spontan gebildeten Mamma-Tumoren in Vivo EPR-Studien.
- Verwenden Sie für den Vergleich von Gewebe Mikroumgebungen normalen Milchdrüsen und Tumoren Alter abgestimmt stellt Frauen einen Mangel an PyMT Onkogen (PyMT−, "Wildtyp")20.
- Die Mäuse L-Band EPR-Spektroskopie einmal pro Woche für vier Wochen während der Isoflurane Narkose zu unterziehen (siehe Sonde Lieferung unten).
- Betäuben Sie die Maus mit einem Luft-Isofluran-Mischung (3 % Isofluran) zu, und platzieren Sie den Mauszeiger auf ein verstellbarer Tisch rechts, seitliche Lage mit den Tumor (Milchdrüsen) in der Nähe der Oberfläche Spule Resonator.
- Nach der Maus Platzierung die Sonde durch Intratissual (IT) Injektion verabreichen, tune das EPR-Spektrometer und erwerben die EPR-Spektren für 5-10 min.
- Messen Sie 2-3-Mamma-Tumoren (von MMTV-PyMT + Mäuse) oder keinen Tumor Lager Brustdrüsen (aus PyMT− Mäuse) in der gleichen Sitzung EPR.
- Orthotopen MET-1-Tumor-Modell
- FVB/N Hintergrund Met-1 murinen Brustkrebs-Zellen bei 37 ° C, 5 % CO2und 95 % relativer Luftfeuchte in DMEM mit 10 % fetalen bovine Serum (FBS), 10 µg/mL Insulin, 5 ng/mL RhEGF und 1 % wachsen PSA (Penicillin G Natrium, Streptomycin Sulfat und Amphotericin B), ~ 80 % Zusammenfluss in einem T175 Kolben.
- Aspirieren Sie die Medien und spülen Sie die adhärenten Zellen mit 10 mL PBS (1,54 mM KH2PO4, 155 mM NaCl und 2,71 mM Na2HPO4-7 H2O ohne Kalzium-Chlorid oder Magnesium-Chlorid, pH = 7,4).
- Nehmen Sie die Zellen durch Hinzufügen von 5 mL Trypsin-EDTA-Lösung von 0,25 % und rockt den Kolben ab. Wenn die Zellen getrennt sind, fügen Sie 10 mL DMEM mit 10 % FBS in den Kolben und die Zellen zu sammeln.
- Zentrifugieren der Zellsuspension auf 132 X g für 10 min bei 4 ° C. Zählen der Zellen unter Verwendung einer Hemocytometer und 1 x 106 Zellen pro 100 µL Aufschwemmen minimal DMEM.
- Spritzen Sie mit einer Insulin-Spritze (29 1/2-Nadel), langsam 100 µL Zellsuspension Tumor in Mamma Fettpolster Nummer 4 von 8 Wochen alten weiblichen FVB/N Wildtyp-Mäusen.
- Tumorentstehung durch Abtasten zu überwachen (erscheinen nach ca. 2-3 Wochen), Wachstum (visuelle) und Maus Heide (visuell) jeden zweiten Tag.
- Messen Sie Tumor-Dimensionen einmal pro Woche mit Bremssättel zu und festzustellen Sie Tumor Bände unter Verwendung der Gleichung:
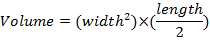
3. Probe Lieferung für In Vivo Funktionsmessungen
- Verwendung Partikel LiNc-Auftrieb Sonde (Protokoll I) für pO2 Messungen im orthotopen Tumormodellen durch Implantation von Tumorzellen mit verinnerlichten LiNc-Auftrieb Mikrokristalle wie zuvor beschrieben14,21 und unten genau geschildert.
- Beim MET-1 Tumor Modell für die Internalisierung der LiNc-Auftrieb Mikrokristalle in MET-1-Zellen die LiNc-Auftrieb Mikrokristalle in DMEM in einer Konzentration von 20 mg/mL und beschallen mit einer Sonde Sonikator bei 20 kHz mit 7 W Leistung in einer 5 mL Rundboden Glasröhre für 5 min auf Eis.
- T75 Kolben fügen Sie 100 µL (2 mg der LiNc-Auftrieb) der Suspension mit 10 mL Nährmedien mit MET-1-Zellen (ca. 30 % Zusammenfluss hinzu). Alle Verfahren statt in einem Biosafety-Schrank und die Medien enthält, Penicillin und Streptomycin, mögliche Infektion zu minimieren.
- Inkubation bei 37 ° C für 72 h oder bis zum Erreichen der Zellen ~ 80 % Konfluenz.
- Aspirieren Sie die Medien. Waschen Sie die Zellen fünfmal mit 10 mL PBS. Lösen Sie die Zellen mit 5 mL Trypsin-EDTA. Sammeln Sie die Zellen. Zentrifuge, wie oben unter Punkt 2.2.4 beschrieben. Färben Sie eine Probe von Zellen mit Ausgrenzung Farbstoff, Zellviabilität und Menge zu bestimmen.
- Aussetzen der Zellen in einer Konzentration von 1 x 106 pro 100 µL minimal DMEM.
- Mit einer Insulin-Spritze, langsam injizieren Sie 100 µL Zellsuspension mit den verinnerlichten LiNc-Auftrieb Mikrokristalle in Mamma Fettpolster Nummer 4 von 8 Wochen alten weiblichen FVB/N Wildtyp-Mäusen wie in Schritt 2.2.5 beschrieben.
- Tumorentstehung und Wachstum zu überwachen, wie in den Schritten 2.2.6 und 2.2.7 beschrieben.
- Verwendung Partikel LiNc-Auftrieb Sonde (Protokoll II) entweder spontan oder orthotopen Modelle. Injizieren Sie LiNc-OBu Mikrokristalle auf der Website von Interesse, z.B.in normalen Milchdrüsen oder Mamma-Tumoren, mit einer Spritze Insulin.
- Lösliche Sonden
- Die Mäuse durch Inhalation eines Luft-Isofluran-Gemisches (1,0 L/min Lieferung und 2-3 % Isofluran) zu betäuben mit einer Anästhesie Maschine und legen Sie sie in den Spalt des EPR-Spektrometers.
- Stimmen Sie das Instrument, dann Spritzen die NR (10-30 µL, 10 mM), Hoffnung Sonde (10−30 µL, 0,5-2 mM) in Kochsalzlösung, pH 7,2 oder RSSR Sonde in DMSO (10 µL, 10 mM) Lösungen (IT).
4. in Vivo Funktionsmessungen
- Betäuben Sie für spektroskopische Messungen EPR die Mäuse durch das Einatmen von Luft-Isofluran-Gemisch mit einem Anästhesiegerät wie unter Punkt 3.3.1 beschrieben.
- Messungen Sie funktionelle mit L-Band (1,2 GHz) EPR-Spektrometer wie folgt.
- Legen Sie die Oberfläche Spule Resonator auf einem normalen Brustdrüse oder ein Milch-Tumor und tune das Spektrometer.
- Die EPR-Spektren von der implantierten Partikel Sonde 5−10 min über mehrere Wochen nach der Implantation zu erwerben. Erwerben Sie bei löslichen Sonden die EPR-Spektren unmittelbar nach Injektion der Sonde für 5-10 min.
- Analysieren Sie die EPR-Spektren der NR-Sonde, die Spaltung, aNund die Signalamplitude, I(t) Hyperfein zu finden. Konvertieren Sie den Wert einerN den pH-Wert mit Hilfe der Kalibrierkurve in Schritt 1.2.4 erhaltenen. Analysieren Sie die Rate des Zerfalls der Signalamplitude I(t) als relative Änderung von der ursprünglichen Amplitude, I(t = 0), in beliebige Einheiten pro Sekunde (s-1) berechnet.
- Passen Sie die Erhöhung der Monoradical Komponente des EPR-Spektrums der GSH-Sensitive RSSR Sonde, die Monoexponents, die Zeitkonstante der exponentiellen Kinetik GSH-Konzentration berechnen zu erhalten.
- Passen Sie die EPR-Spektren der Hochfeld-Komponente des Prüfpunkts multifunktionale Hoffnung zu den experimentellen wie in (Schritt 1.4.5) beschrieben, die Werte von pH, pO2 und Pi führen.
5. statistische Analyse
- Durchführen Sie Datenverarbeitung und statistische Auswertungen. Verwenden Sie eine Pearson R Wechselbeziehung Test (für normalverteilte Datensätze) und Spearmans Rank Order Korrelation (für Datasets mit abgelehnten Normalität der Datenverteilung) Korrelation Analysen.
Ergebnisse
Gewebe p O 2 Bewertung der LiNc-Auftrieb mit Sonden:
Mit dem Verfahren unter Schritt 1.1 beschrieben, haben wir die Kalibrierung von frisch zubereiteten LiNc-Auftrieb Mikrokristalle Aussetzung durchgeführt. Abbildung 2 zeigt die typische Sauerstoff Abhängigkeit die Linienbreite der LiNc-Auftrie...
Diskussion
Die vorgestellten Methoden können für nicht-invasive in Vivo Beurteilung der kritischen Parameter der chemischen TME pO2, pH-Wert, Redox-Status und Konzentrationen von interstitiellen Pi und intrazellulären GSH. Magnet-Resonanz-Techniken, wie MRI und Low-Bereich EPR, sind die Methoden der Wahl für die nicht-invasive in Vivo Profilierung dieser TME-Parameter. MRI anatomische Strukturen visualisiert aber funktionelle Sensitivität fehlen. Im Gegensatz zu MRI bieten EPR-Techniken fu...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde teilweise unterstützt von NIH CA194013, CA192064 und U54GM104942 gewährt. Die WVCTSI ist für Start-up zum VVK, AB und TDE anerkannt. Die Autoren danken Dr. M. Gencheva und K. Steinberger für die Hilfe mit den anschaulichen Experimenten. Der Inhalt ist ausschließlich in der Verantwortung der Autoren und nicht unbedingt die offizielle Meinung des NIH.
Materialien
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Referenzen
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten