Method Article
Einfache Erstellung einer High-Yield-Kultur der induzierten Neuronen aus Menschenhaut Erwachsenen Fibroblasten
In diesem Artikel
Zusammenfassung
Direkte neuronale Umprogrammierung erzeugt Neuronen, die im Alter von der somatischen Startzelle beibehalten. Hier beschreiben wir eine einzelne Vektor-basierte Methode um induzierte Neuronen von dermalen Fibroblasten von Erwachsenen menschlichen Spendern erhalten zu generieren.
Zusammenfassung
Induzierte Neuronen (iNs), das Produkt der somatischen Zellen direkt in Neuronen, konvertiert sind eine Möglichkeit, Patienten abgeleitet Neuronen aus Gewebe zu erhalten, die leicht zugänglich ist. Auf diesem Weg erhalten Sie in einer Angelegenheit von ein paar Wochen Reifen Neuronen. Hier beschreiben wir eine unkomplizierte und schnelle ein-Schritt-Protokoll um iNs von dermalen Fibroblasten durch Biopsie Proben von Erwachsenen menschlichen Spendern erhalten zu erhalten. Wir erklären jeden Schritt des Prozesses, einschließlich der Wartung der dermalen Fibroblasten, das Einfrieren Verfahren, einen Vorrat an der Zell-Linie zu bauen Aussaat für Neuprogrammierung der Zellen sowie die Kulturbedingungen während des Konvertierungsvorgangs. Darüber hinaus beschreiben wir die Vorbereitung der Glasdeckgläser für elektrophysiologische Aufnahmen, langfristige Ansatzbedingungen und Fluoreszenz aktiviert Zelle sortieren (FACS). Wir zeigen auch Beispiele für die Ergebnisse zu erwarten sind. Das hier beschriebene Protokoll ist einfach durchzuführen und können an den menschlichen Fibroblasten aus Menschenhaut Biopsien von Patienten mit verschiedenen unterschiedliche Diagnosen und Alter abgeleitet werden. Dieses Protokoll generiert eine ausreichende Menge an iNs, die für eine breite Palette von biomedizinischen Anwendungen, einschließlich Krankheit Modellierung, Drogen-Screening und Target-Validierung verwendet werden können.
Einleitung
Entwicklung wirksamer Behandlungsmethoden für neurologische Erkrankungen wurde durch den begrenzten Zugang zu lebenden menschlichen Gehirnzellen mechanistische Studien und funktionelle Assays durchführen behindert. Vor über einem Jahrzehnt änderte sich diese Situation radikal mit der Entwicklung von induzierten pluripotenten Stammzellen (iPSCs) Technologie1,2. Dies, kombiniert mit einem besseren Verständnis der neuronalen Differenzierung Mechanismen auftreten während der normalen menschlichen Entwicklung hat für die Erzeugung von definierten und diverse neuronale Subtypen von Patient und Krankheit bestimmtes Material erlaubt. Mit diesem Material ist es jetzt möglich intrazelluläre Mechanismen, neurologischen Erkrankungen und das Potenzial der verschiedenen Verbindungen zur Linderung dieser pathologischen Funktionen3zu studieren.
Während iPSCs revolutionären auf dem Gebiet der Neurowissenschaften wurden, ist ein großer Nachteil dieser Zellen, dass ihre alternden Unterschrift bei der Neuprogrammierung so gelöscht, dass verjüngte Neuron die Sicherheitsanfälligkeit zugeordnet nicht beibehält Aging-4,5,6. Diese Besonderheit der Neuronen, die produziert werden kann Ende wird für viele Aspekte der intrazellulären pathogenen Kaskade, insbesondere bei Krankheiten, bei denen das Alter ein wichtiger Risikofaktor ist, Rekapitulation von entscheidender Bedeutung.
Direkte neuralen Neuprogrammierung ist eine Technologie, wo eine somatische Zelle direkt in umgewandelt wird, ein iN ohne den Umweg über eine pluripotente fortgeschrittene Stadium. Dies ermöglicht eine schnelle Generierung von menschlichen Neuronen in Vitro , die geduldig und spezifische Krankheit sein können. Eine bemerkenswerte Eigenschaft der direkte Reprogrammierung ist, dass die ab Alter der Spender Zelle wird beibehalten, und damit seine Anfälligkeit für Alterungsprozesse wie z. B. Produktion von oxidativem Stress4,7 erhöhte. Infolgedessen iNs von Patienten mit neurologischen Erkrankungen mit Altern verbunden, wie Alzheimer und Parkinson, eignen sich gut für ein breites Spektrum von biomedizinischen Anwendungen, einschließlich Krankheit Modellierung, Drogen-screening-Assays und toxikologischen Untersuchungen .
Die wichtigste Einschränkung, die iNs gehindert hat Patienten mit neurodegenerativen Erkrankungen wird am meisten benutzt ist, dass sie nicht einfach sind zu programmieren, und dies noch schwieriger mit Ausbau der Fibroblasten wird. Infolgedessen wurde Generation der iN den Zellen für diese Arten von Anwendungen benötigten Mengen nicht bis vor kurzem nur8erreicht. Wir haben jetzt eine einfache Methode um Fibroblasten von Spendern jeden Alters sehr effizient programmieren entwickelt. Diese Methode verbindet die erzwungene Ausdruck der neuronalen Transkriptionsfaktoren, Ascl1 und Brn2 mit einem Zuschlag von Repressor-Protein RE1-silencing Transkriptionsfaktors (REST) mit einem einzigen Vektor. Hier beschreiben wir die einzelnen Schritte führt zu der Generation von iNs aus Haut Fibroblasten biopsiert von älteren Spendern umgewandelt.
Protokoll
Erwachsenen dermale Fibroblasten wurden aus den Morbus Parkinson Forschung und Chorea Huntington Kliniken im Zentrum John van Geest für Brain Repair (Cambridge, UK) und unter lokalen ethischen Genehmigung (REC 09/H0311/88) verwendet. Für Details über die Haut Biopsie Stichprobenverfahren siehe Referenz8.
1. Vorbereitung der Haut Fibroblasten Umprogrammierung
- Mit einer automatisierten Zelle System oder einem 37 ° C Wasserbad Auftauen, Auftauen die Erwachsenen menschlichen dermalen Fibroblasten (aHDFs) und 200.000 pro T75 Kolben (Graf mit einem automatisierten Zelle Zähler) in 10 mL Fibroblasten Medium Platte (siehe Tabelle 1) bei 37 ° C in 5 % CO2.
- Führen Sie eine komplette mittlere Änderung mit Fibroblasten Medium am nächsten Tag.
- Ändern der Fibroblasten Medium alle 3 – 4 Tage, bis 95 % Konfluenz der Zellen zu erreichen.
Hinweis: Eine konfluierende Flasche enthält ca. 1.000.000 Zellen. Die aHDFs können eingefroren werden, um ein Lager der Zelllinie (Abschnitt 2) oder direkt neu vergoldet bereit für eine Anpassung (Abschnitt 3) zu bauen.
(2) Einfrieren der Haut Fibroblasten
- Stellen Sie einen kontrollierten Rate Einfrieren Behälter in einer Box mit Eis oder im Kühlschrank bei 4 ° C.
- Die Zellen mit 0,05 % Trypsin (1,5 mL pro Flasche T75) bei 37 ° C für 3 – 5 min zu distanzieren.
- Fügen Sie Fibroblasten Medium (mit fetalen bovine Serum (FBS)) neutralisieren die Trypsin (3 mL pro Spülung pro T75 Kolben) und sammeln die freistehenden Zellen in einem 15 mL Röhrchen durch die Zellen in den Kolben zweimal ausspülen.
- Zählen Sie die Zellen mit der automatisierten Zelle Zähler; (empfohlene) Einfrieren ca. 500.000 aHDFs pro Fläschchen.
- Spin-down der Zellen bei 400 X g für 5 Minuten.
- Aufschwemmen der Zelle Pellet in 1 mL Einfrieren Medium (siehe Tabelle 1) und den Transfer in die Kryo Röhrchen. Legen Sie die Rohre direkt in den kontrollierten Rate Einfrieren Behälter.
- Speichern Sie die kontrolliertere Rate Apparat bei-80 ° C über Nacht einfrieren. Am folgenden Tag, übertragen Sie die Rohre zu einem-140 ° C Gefrierschrank und speichern Sie bis benötigt.
3. Beschichtung für eine Anpassung (Tag −1)
Hinweis: Es empfiehlt sich, verwenden Sie eine Gelatine-Beschichtung für kurzfristige Experimente (bis zu 30 Tage); Alternativ für langfristiges Experimente empfiehlt es sich, auf eine Poly-L-Ornithin, Fibronektin und Laminin (PFL) Beschichtung zu starten.
- 60 min. vor der Beschichtung der aHDFs für eine Anpassung, eine 24-Well-Platte mit 0,1 % Gelatine (250 µL/Well) bestreichen und bei 37 ° c inkubieren
- Aspirieren der Fibroblasten-Medium auf die aHDFs. Einmal waschen Sie mit DPBS. Die Zellen mit 0,05 % Trypsin (1,5 mL pro Flasche T75) bei 37 ° C für 3 – 5 min zu distanzieren.
- Fügen Sie Fibroblasten Medium Trypsin (3 mL pro Spülung pro T75 Kolben) zu neutralisieren und sammeln die freistehenden Zellen in einem 15 mL Röhrchen durch die Zellen in den Kolben zweimal ausspülen.
- Spin-down der Zellen bei 400 X g für 5 min. verwerfen überstand und Aufschwemmen der Zelle Pellet in 1 mL Fibroblasten Medium.
- Zählen Sie die Zellen mit einem automatisierten Zelle Zähler (um eine gute Qualität-Konvertierung-Prüfung, die die Zellviabilität über 90 % mit Trypan blau Färbung ist sicherzustellen).
- Bereiten Sie eine komplette 24-Well-Platte eine Aussetzung der 1.320.000 Zellen in 13,2 mL Fibroblasten Medium, eine Suspension von 100.000 Zellen/mL Medium (oder 55.000 Zellen/Brunnen in 550 µL Fibroblasten Medium multipliziert mit der Anzahl der benötigten Kavitäten) zu erreichen.
- Aspirieren Sie die Gelatine aus der Platte und waschen Sie zweimal mit DPBS. Jedes gut 500 µL Zellsuspension hinzu und Inkubation über Nacht bei 37 ° C in 5 % CO2.
4. virale Transduktion (Tag 0)
Hinweis: Das Arbeiten mit Lentivirale Partikel erfordert Geräte der Kategorie 2 und die Verwendung eines mittels, das Virus zu neutralisieren. Zwei Paar Handschuhe tragen wird auch dringend empfohlen.
- Wärmen Sie 13,2 mL Fibroblasten Mittel-bis 37 ° C.
- Tauen Sie einen Lentivirale Vektor mit den Transkriptionsfaktoren, Ascl1 und Brn2 mit zwei kurzen Haarnadel RNAs (ShRNA) targeting REST bei Raumtemperatur auf.
Hinweis: Beziehen sich aufum 8zu verweisen; Das Konstrukt ist in einem Plasmid-Repository zur Verfügung. Einzelheiten über das Verfahren zur Lentiviren produzieren entnehmen Sie bitte aufum 9zu verweisen. - Das Medium ohne jede Transduktion Enhancer fügen Sie das nötige Volumen des Lentivirus, das aHDFs bei Multiplizität der Infektion (MOI) zu infizieren von 20 hinzu.
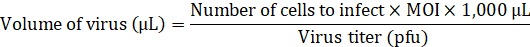
- Ersetzen Sie das Medium in der 24-Well-Platte mit Fibroblasten Medium mit der Lentivirale Vektor (500 µL/Well) und inkubieren Sie über Nacht bei 37 ° C in 5 % CO2.
- Ersetzen Sie am nächsten Tag, das Medium in den Vertiefungen mit frische Fibroblasten Medium ohne Lentivirale Vektor.
Hinweis: Das Medium gilt als ansteckend für 7 Tage und als solche angemessenen Schutz und Handhabung sollte während der ersten Woche nach virale Transduktion verwendet werden.
5. Wartung der Umwandlung von Zellen
Hinweis: Sobald die Konvertierung beginnt Zellen sind anfällig für heben; Achten Sie darauf, Tipp die Platte oben und einer 1.000 µL Pipette zu verwenden, wenn trennen entfernen von Medien zu vermeiden Zellen.
- Am 3. Tag, entfernen die Fibroblasten-Medium und 500 µL des frühen neuronalen Umbau Medium (siehe Tabelle 1).
- Nehmen Sie zwei-bis dreimal in der Woche 225 µL des alten Mediums aus dem Brunnen und Add-in-250 µL frische frühe neuronale Konvertierung Medium.
- Am Tag 18, entfernen Sie alle des Mediums aus jedem Brunnen und mit 500 µL des späten neuronalen Umbau Medium zu ersetzen (siehe Tabelle 1).
- Weiterhin die Hälfte des Mediums als oben mit späten neuronalen Umbau Medium alle 2 – 3 Tage bis Tag 25 oder Experiment Endpunkt (Abbildung 1A) ändern.
Hinweis: Wenn Zellen in jedem gut für das Experiment nicht überzogen sind, füllen Sie leere Brunnen mit PBS oder Wasser, offene Verdunstung des Mediums zu verhindern und zu minimieren Variation zwischen Brunnen.
| Lager Konzentration | Arbeiten Konzentration | |
| Fibroblasten-medium | ||
| Basal medium | N/A | N/A |
| Penicillin/Streptomycin | 10.000 U/mL | 100 mg/mL |
| FBS | N/A | 10 % |
| Einfrieren von medium | ||
| Fibroblasten-medium | N/A | 45 % |
| FBS | N/A | 45 % |
| DMSO | N/A | 10 % |
| Frühe neuronale Konvertierung Medium (ENM) | ||
| Neuronale Differenzierung medium | N/A | N/A |
| Penicillin/Streptomycin | 10.000 U/mL | 100 mg/mL |
| CHIR99021 | 10 mM | 2 ΜM |
| SB-431542 | 20 mM | 10 ΜM |
| Birne | 100 µg/mL | 0,5 µg/mL |
| LDN-1931189 | 10 mM | 0,5 ΜM |
| VPA | 1 M | 1 mM |
| LM-22A4 | 20 mM | 2 ΜM |
| GDNF | 20 µg/mL | 2 ng/mL |
| NT3 | 10 µg/mL | 10 ng/µL |
| DB-cAMP | 50 mM | 0,5 mM |
| Späten neuronalen Umbau Medium (LNM) | ||
| Neuronale Differenzierung medium | N/A | N/A |
| Penicillin/Streptomycin | 10.000 U/mL | 100 mg/mL |
| LM-22A4 | 20 mM | 2 ΜM |
| GDNF | 20 µg/mL | 2 ng/mL |
| NT3 | 10 µg/mL | 10 ng/µL |
| DB-cAMP | 50 mM | 0,5 mM |
| FACS-Puffer | ||
| HBSS 1 X [- Kalzium-Magnesium - Phenol rot] | N/A | N/A |
| BSA | N/A | 1 % |
| DNAase | N/A | 0,05 % |
Tabelle 1: Zusammensetzung der verschiedenen Medien verwendet. Vollständige Beschreibung der Zusammensetzung für alle Medien, die in diesem Protokoll einschließlich der Fibroblasten Medium, Einfrieren, Medium, frühe neuronale Konvertierung Medium, späten neuronalen Umbau Medium und FACS Puffer benötigt.
6. Glasdeckgläser für elektrophysiologische Aufnahmen
Hinweis: Es wird empfohlen, zu tragen einen Laborkittel, Schutzbrille, Handschuhe zu verdoppeln und füllen Sie alle die Arbeit in einer Dampfhaube. Dieses Protokoll wird von 10angepasst.
- Legen Sie Glasdeckgläser am unteren Rand einer Glasschale ohne Überlappung.
- Fügen Sie allgemeine Labor Reinigungsmittel um allen den Deckgläsern ohne riskieren Überlauf Tauchen während schütteln (ca. 30 mL). Setzen Sie auf einem Orbitalschüttler bei langsamer Geschwindigkeit für 2 h.
- Waschen Sie sechs Mal (30 min) autoklaviert deionisiertes Wasser.
- Fügen Sie 95 % igem Ethanol für 2 h.
- Entfernen Sie das Ethanol zu und warten Sie, bis Deckgläsern trocken sind.
- Einmal trocken Sie, übertragen Sie die Deckgläsern in ein Becherglas und 70 % Salpetersäure bis die Deckgläsern untergetaucht sind.
- Legen Sie das Becherglas in einem Sonikator Bad für 60 Minuten.
- Entfernen Sie die Salpetersäure und waschen Sie dreimal mit autoklaviert deionisiertes Wasser.
Achtung: Immer fügen Sie Säure hinzu, Wasser, niemals umgekehrt, da dies zu einer heftigen Reaktion führen kann. - Entfernen Sie so viel Wasser aus den Becher wie möglich und fügen Sie konzentrierten Salzsäure (HCI), bis die Deckgläsern eingetaucht bist; Schwenken Sie den Becher und Deckel mit Paraffin Film.
- 60 min beschallen (50 – 60 Hz, 30 W).
- Entfernen Sie so viel HCI aus Deckgläsern wie möglich und Stelle in einen geeigneten Abfallbehälter. Zweimal mit autoklaviert entionisiertem Wasser spülen.
- Nehmen Sie die Deckgläsern aus der Haube und spülen Sie 20-Mal (oder mehr) mit autoklaviert deionisiertes Wasser ab, bis alle auf die HCI entfernt.
- Einmal trocken, Deckgläsern in sterilen 24-Well-Platten zu platzieren.
- Legen Sie die Platten unter Ultraviolett (UV) Licht über Nacht. Am nächsten Tag sind die Deckgläsern gebrauchsfertig.
Hinweis: Wenn Glasdeckgläser verwendet werden, empfiehlt es sich die PFL-Beschichtung verwenden. Einfach ein Deckglas in jede Vertiefung einer 24-Well-Platte (mit sterilen Pinzette) und folgen Sie das Protokoll wie folgt.
7. PFL Beschichtung für langfristige Kultur
- Bestreichen Sie die 24-Well-Platte mit Poly-L-Ornithin (500 µL/Well) und lassen Sie über Nacht bei 37 ° C in 5 % CO2.
- Aspirieren Sie Poly-L-Ornithin und warten Sie, bis es trocken genug, um Form Tropfen an der Spitze ist.
- Machen Sie einen Tropfen (ca. 60 µL) Laminin in der Mitte jeder gut und verbreiten, um die gesamte Oberfläche des das Deckglas abdecken. Lassen Sie für 2 h 45 min bei 37 ° C in 5 % CO2.
- Waschen Sie dreimal mit DPBS.
- Fügen Sie Fibronektin (500 µL/Well) und lassen Sie über Nacht bei 37 ° C in 5 % CO2.
- Einmal waschen Sie mit DPBS vor dem Hinzufügen von Zellen.
Hinweis: Die PFL-Beschichtung kann für lange Laufzeit Kulturen ins (über 100 Tage), verwendet werden, obwohl progressive Zelltod von 30 Tage zu erwarten ist.
(8) FACS
Hinweis: Um die Zellen nach FACS Platte neu sortieren eine PFL-beschichtete Platte 48 h im Voraus vorbereitet. Zellen können mit einem neuronalen Zelle Adhäsion Molekül (NCAM) Antikörper von Tag 20 ab nach Transduktion sortiert werden.
- Entfernen Sie das Medium mit einer 1.000 µL Pipette (Waschen Sie nicht zur Vermeidung von Zellen trennen).
- Fügen Sie Zelle abkoppelt Agent (250 µL/Well), lassen Sie für 10 – 20 Minuten bis zu den Zellen heben und schweben als Einzelzellen.
- Während dieser Zeit bereiten Sie die FACS-Puffer.
- Genannte sanft mit einer 1.000 µL Pipette. Wenn einige Klumpen bleiben, ein bisschen mehr inkubieren.
- Sobald eine einzelne Zelle Suspension vorliegt, entfernen Sie es aus dem Brunnen und legen Sie in einem 1,5 mL-Tube.
- Bündig die gut zweimal mit späten neuronalen Umbau Medium und Ort in der gleichen 1,5 mL Tube.
- Spin-down bei 400 X g für 5 min und den Überstand verwerfen.
- Die Zelle Pellet in 200 µL Puffer FACS aufzuwirbeln.
- Spin-down der Zellen bei 400 X g für 5 min und den Überstand verwerfen.
- Wiederholen Sie die Schritte 8,8 und 8,9 zweimal.
- Aufschwemmen der Zelle Pellet in 50 µL FACS-Puffer mit menschlichen CD56 (NCAM) Antikörper in einer Konzentration von 01:50 für 15 min auf Eis. Vor Licht schützen.
- Spin-down der Zellen bei 400 X g für 5 Minuten.
- In 200 µL FACS Puffer zu waschen und spin-down der Zellen bei 400 X g für 5 min aufzuwirbeln.
- Wiederholen Sie Schritt 8.13.
- Aufschwemmen Sie in 200 µL des FACS-Puffer mit Propidium Jodid (PI; 10 µg/mL). Sortieren der NCAM positive (iNs) und PI negative (live) Zellen mittels FACS von gating, basierend auf der Fluoreszenz-Intensität der Kontrollproben, die nicht mit dem NCAM Antikörper oder PI gefärbt waren.
- Die NCAM positive Zellen in ein Röhrchen mit späten neuronalen Umbau Medium zu sammeln.
- Zählen Sie die Zellen mit einem automatisierten Zelle Zähler und neu Platte die Zellen bei einer hohen Dichte (50.000 Zellen/cm2) in späten neuronalen Umbau Medium in einer Petrischale PFL beschichtet.
- Weiter, die Hälfte des Mediums 2 – 3 Mal pro Woche mit späten neuronalen Umbau Medium zu ändern, bis der Experiment-Endpunkt (Abbildung 1A).
Ergebnisse
Eine deutliche Änderung der Zellmorphologie sollte von Tag 5 ab (Abbildung 1 b) sichtbar sein. Einige Zelltod ist nach virale Transduktion zu erwarten, obwohl nicht offen. Aus jedem Brunnen in einer 24-Well-Platte sollte eine Ergebniszelle Ausbeute von 20.000-40.000 Zellen tagsüber 25, erwartet werden, von denen etwa die Hälfte Neuronen geworden sein dürfte. Es ist wichtig zu beachten, dass die Ausbeute und Reinheit über Zell-Linie, sowie mit Krankheit Staat und Virus Chargen variieren können.
Zellen werden die meisten standard neuronalen Marker einschließlich MAP2 und TAU (Abbildung 1) am Tag 25 neben den ausstellenden einer Reife neuronalen Morphologie zum Ausdruck bringen. Es ist möglich, ein reines iN Bevölkerung dadurch FACS anhand der Marker NCAM (siehe Referenzen8,11). Zellen können danach werden entweder neu vergoldet auf PFL dreifache Beschichtung (siehe Referenz10) oder direkt für molekularbiologische Analysen eingefroren.
Wenn die Zellen nicht sortiert sind, sollte Immunfluoreszenz Kennzeichnung mit MAP2 oder TAU durchgeführt, um die erfolgreich umgewandelten Zellen identifizieren und Co mit gekennzeichnet werden das Protein des Interesses.

Abbildung 1: Entwicklung der iN Umwandlung im Laufe der Zeit. (A) Chronik des Experiments und Karte des Konstrukts verpackt in einen Lentivirus reprogram die Erwachsenen menschlichen dermalen Fibroblasten verwendet. Jeder schwarze Pfeil stellt eine mittlere Änderung. (B) repräsentative Phase kontrastreiche Bilder Darstellung der Änderungen in der Morphologie der Zellen während der Konvertierung zwischen Tag 0, Tag 22 (wie auf der oberen rechten Ecke jedes Panel angegeben). Bilder wurden auf einem Phase-Kontrast-Mikroskop mit 10 X-Objektiv aufgenommen. (C) Immunfluoreszenz Bild ein TAU und MAP2 doppelte Verfärbungen am Tag 35 Post-Transduktion. Zellen wurden in 4 % Paraformaldehyd fixiert und permeabilized mit 0,1 % Triton in DPBS für 10 min. Zellen für 30 min in einer 5 % Serum-Lösung in DPBS blockiert wurden. Die Antikörper wurden in blocking-Lösung verdünnt und über Nacht bei 4 ° c angewendet Fluorophor-konjugierten Sekundärantikörper waren in blocking-Lösung verdünnt und für 2 h. Zellen mit DAPI für 15 min, gefolgt von 3 Wäschen mit DPBS counterstained wurden aufgetragen. Bilder wurden auf eine invertierte Fluoreszenzmikroskop mit 20 X Objektiv. Skalieren von Balken = 100 µm (B, C). Abkürzungen: ENM: frühe neuronale Medium; LNM: späte neuronalen Medium. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Diese one-step/One-Vektor Umprogrammierung Methode bietet eine effiziente Möglichkeit, iNs von menschlichen Erwachsenen Fibroblasten zu erhalten. Menschliche Erwachsenen Fibroblasten sind normalerweise sehr viel schwieriger zum Versteck als fetaler Fibroblasten, mit begrenzten Studien zuvor Berichterstattung Wirkungsgrade von ca. 5-10 %12,13. Mit dieses neue Protokoll ist es jedoch möglich, eine neuronale Ausbeute (gemessen als MAP2 +-Zellen) von ca. 50 %8zu erreichen. Darüber hinaus kann unser Protokoll auf dermalen Fibroblasten verwendet werden, die mehrere Male passagiert wurden, ohne die Effizienz der Umwandlung. Bisher haben wir Zellen passagiert bis zu 14-Mal ohne Erkennung Abnahme der Wirkungsgrad verwendet. Darüber hinaus gibt es keinen Unterschied in der Umprogrammierung Effizienz in unseren Händen mit Fibroblasten von Spendern im Alter zwischen 52 und 87. Für weitere Informationen über das Alter und Krankheit von anderen Zelllinien getestet mit diesem Konstrukt siehe Referenz8. Andere Studien haben auch keinen Unterschied im Wirkungsgrad mit einem Lentivirale-basierte und kleine Molekül-erweiterte Protokoll mit Gebern zwischen 0 und 89 Jahren4berichtet. Darüber hinaus hat einheitliche Anwendbarkeit mit MiRNA-basierte neuronalen Umprogrammierung in Fibroblasten aller Altersgruppen, mit Gebern zwischen 0 und 86 Jahren7gemeldet. Auf diesem Weg erhalten Sie in ca. 12-15 Wochen in Vitro oder ca. 8 Wochen nach der Transplantation in Vivo8Reifen Neuronen. Dies ist vorteilhaft, weil es Zugang zu Krankheit und Patient gibt einzelne menschliche iNs aus Gewebe, das leicht zugänglich ist. Obwohl dieses Protokoll effizient ist, es wird keinen 100 % neuronalen Ertrag produzieren, und als solche ein Reinigungsschritt, zum Beispiel mit FACS ist erforderlich.
Die wichtigste Schritt im Rahmen dieses Protokolls wird virale Transduktion (Protokoll Abschnitt 4). Es ist entscheidend, dass der Virustiter präzise, zusätzlich eine genaue Anzahl von aHDFs für die Konvertierung überzogen haben. Die empfohlene Titer für die Verwendung mit diesem Protokoll ist zwischen 4 x 10-8 und 4 x 10-9. Mit einem Titer von etwas unter 1 x 108 würde nicht empfohlen werden, wie das hinzufügen, dass große Mengen des Virus in die Zellen giftig sein werden. Darüber hinaus werden beginnen die Fibroblasten zu konvertieren iNs sie zerbrechlich und anfällig für anheben. Es ist wichtig, sanft sein, wenn die Medien nicht zu stören die Zellen zu viel verändert. Dies kann durch das Entfernen der Flüssigkeit langsam mit einer 1.000 µL Pipette. Beschichtung für eine Anpassung (Protokoll Abschnitt 3) ist es schließlich wichtig, eine gesunde Fibroblasten Bevölkerung vor Beginn ein Experiment zu gewährleisten; Dies wird durch eine Zellviabilität von über 90 % mit Trypan blau zu färben. Der aHDFs sollte immer vor erreichen 95 % Konfluenz passagiert werden.
Gibt es spürbare Zelltod vor virale Transduktion, Konvertierung nicht beginnen: Überprüfen Sie, dass die Zellviabilität über 90 % liegt, gab es keine Probleme mit der Beschichtung der Platte. Es wird erwartet, eine kleine Menge von Zelltod nach virale Transduktion, dies sollte jedoch nicht erheblich sein. In diesem Fall bestätigen Sie präzise Aussaat von 50.000 aHDFs/gut und überprüfen Sie der Virustiter zu. Wenn es spürbar Inkonsistenz zwischen Brunnen während der Konvertierung, prüfen Sie zunächst, dass jeder Brunnen einer gleichen Menge von Medien enthält und offene Verdunstung sich nicht an den Rändern vollzieht (wenn die Kante Brunnen erforderliche zusätzliche Medien hinzugefügt werden können). Alternativ überprüfen Sie Schritt 4.4 und sicherstellen Sie, geeignet für eine homogene Suspension mischen, wenn transducing. Es ist entscheidend für die Lentivirus zunächst auf das Medium hinzufügen, bevor man diese in die Vertiefungen. Hinzufügen von Lentivirus direkt in die Vertiefungen steigen Variabilität von Brunnen zu Brunnen und dürfte auch für die Zellen toxisch sein. Zu guter Letzt überprüfen Sie immer, dass das Medium auf 37 ° C erwärmt wird, bevor Sie Zellen hinzufügen.
Dieses Protokoll enthält optionale Abschnitte für Ansatzbedingungen für lange Begriff Kultur iNs und FACS sortieren um neuronale Reinheit zu erhöhen. Für Experimente, die funktionelle Charakterisierung von iNs untersuchen möchten wurde ein Protokoll für die Vorbereitung der Glasdeckgläser für Elektrophysiologie auch aufgenommen. Die Umwandlung Protokoll hier wird für die Verwendung mit einer 24-Well-Platte eingerichtet; Falls gewünscht, dies kann geändert werden, um eine 6-, 12-, 48-, 96-Well-Platte oder Flaschen. In diesem Fall passen Sie alle Volumes auf die Oberfläche der Platte oder Kolben genutzt.
Dieses Protokoll verwendet der erzwungene Expression von Ascl1 und Brn2 in Kombination mit einer REST-Knockdown alle verpackt in einem einzigen Vektor8 iNs von Pan-neuronalen Phänotyp erzeugen. Die Generation der alle glialen Untertypen mit dieser Methode ist jedoch nicht bewertet worden. Somit muss diese Methode für die Verwendung mit anderem Neuprogrammierung Subtyp spezifische Neuronen zu erhalten geändert werden. Direkte Reprogrammierung hat zuvor die Möglichkeit zu motorischen Neuronen, sensorischen Neuronen, Photorezeptoren, mittelgroßen bedornten striatalen Neuronen und dopaminergen Neuronen10,14gezeigt. Dies ist vorteilhaft bei der Untersuchung von neurologischer Erkrankungen, welche spezifischen neuronalen Subtyp sind bevorzugt betroffen, für Beispiel Parkinson und dopaminergen Neuronen.
Bis vor kurzem direkten neuralen Neuprogrammierung Technologie war es nicht möglich für die Herstellung von iNs in eine einheitliche und effiziente Weise – auf einem Niveau, das für Toxikologie und Drogen-screening-Tests in großem Maßstab erforderlich ist. Diese neue Methode ist sehr effizient und kann auf Fibroblasten, die viele Male passagiert wurden haben, so dass es jetzt diese Einschränkungen entfernt und eröffnet eine Vielzahl von Studien, nicht nur im menschlichen Nervensystem, sondern auch in ein System, das bestimmte Patienten kann verwendet werden. Die Einfachheit dieses Ansatzes rendert die iN Technologie zugänglich für alle Gruppen, die ähnliche Studien Inhouse durchführen wollen und kann leicht verwendet werden nicht nur für große biomedizinischen Anwendungen, wie Drogen-Screening und Toxikologie-Tests, sondern auch zur Unterstützung Daten aus Tiermodellen und menschliche post-mortem Gewebeproben abgeleitet.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken Marie Persson Vejgården für technische Hilfe. Die Forschung führt zu diesen Ergebnissen wird finanziell unterstützt von der New York Stem Cell Foundation, der Europäische Forschungsrat siebten Rahmenprogramms der Europäischen Union: FP/2007-2013 Neuro Stem Cell Repair (Nr. 602278) und ERC-Grant Agreement keine. 30971, der schwedischen Forschungsrat (Finanzhilfevereinbarung 521-2012-5624, 2016-00873 und 70862601 / Bagadilico), schwedische Parkinson Foundation (Parkinsonfonden) und Bereich strategische Forschung an der Lund Universität Multipark (multidisziplinäre Forschung im Parkinson Erkrankung). Janelle Drouin-Ouellet wird unterstützt durch ein Stipendium der kanadischen Institute der Gesundheit Forschung (CIHR) (#358492), und Roger Barker wird unterstützt durch ein Stipendium NIHR Biomedical Research Centre an der Universität von Cambridge/Addenbrooke Krankenhaus. Malin Parmar ist ein New York Stem Cell Stiftung Robertson Ermittler. Shelby Shrigley wird vom Programm Europäischen Union Horizont 2020 (H2020-MSCA-ITN-2015) unter dem Marie Skłodowska-Curie Innovative Training Network und Grant Agreement Nr. 676408 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Cell Lines | |||
| Adult human dermal fibroblasts | [C2 passage #7] Donor was a 67 year old female. Cells obtained from the Parkinson’s Disease Research and Huntington’s disease clinics at the John van Geest Centre for Brain Repair (Cambridge, UK). | ||
| Reagents for Fibroblast Culture, Transduction and Conversion | |||
| Dulbecco's phosphate-buffered saline (DPBS) [-CaCl2, -MgCl2] | Gibco | 14190094 | |
| Trypsin-EDTA [0.5%] | Gibco | 15400-054 | Dilute to 0.05% in DPBS. |
| Virkon (agent used to neutralize virus) | Viroderm | 7511 | Dilute to 1% solution with warm water. |
| Milli-Q Water | Millipore | ||
| Basal medium - Dulbecco’s Modified Eagle Medium (DMEM) + GlutaMax | Gibco | 61965059 | |
| Penicillin/Streptomycin [10,000 U/mL] | Gibco | 15140-122 | |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | |
| CryoMACS® dimethyl sulfoxide (DMSO) 10 | Miltenyi | 170-076-303 | |
| Neural differentiation medium - NDiff 227 | Takara-Clontech | Y40002 | |
| LM-22A4 | Tocris | 4607 | Dilute 10 mg in 1450 µL DMSO. Stock concentration: 20 mM. |
| Glial cell line-derived neurotrophic factor (GDNF) [recombinant human] | R&D systems | 212-GD-010 | Dilute 10 ug in 500 µL 0,1% BSA in DPBS. Stock concentration: 20 µg/mL. |
| NT3 [recombinant human] | R&D systems | 267-N3-025 | Dilute 25 µg in 2,5 mL 0,1% BSA in DPBS. Stock concentration: 10 µg/mL. |
| db-cAMP | Sigma Aldrich | D0627 | Dilute 1 g in 40,7 mL Milli-Q water. Filter and make 500 µL aliquots or stock tubes of 10 mL. Stock concentration: 50 mM. |
| CHIR99021 | Axon | 1386 | Dilute 2 µg in 429,8 µL DMSO. Stock concentration: 10 mM. |
| SB-431542 | Axon | 1661 | Dilute 5 mg in 595 µL DMSO. Stock concentration: 20 mM. |
| Noggin [recombinant human] | Miltenyi | 130-103-456 | Dilute 100 µg in 100 µL of Milli-Q water + 900 µL 0,1% BSA in DPBS. Stock concentration: 100 µg/mL. |
| LDN-193189 | Axon | 1509 | Dilute 2 mg in 360 µL DMSO. Stock concentration: 10 mM. |
| Valproic acid sodium salt (VPA) | Merck Millipore | 676380 | Dilute 5 g in Milli-Q water to acheive a stock concentration of 1 M. CAUTION: Avoid ingestion, contact with skin, and breathing dust formation. |
| Reagents for Coatings | |||
| Gelatin | Sigma Aldrich | G2500 | Dilute to 0.1% in Milli-Q water. |
| Poly-L-ornithine | Sigma Aldrich | P3655 | Dissolve in Milli-Q water. Use at 15µg/mL. |
| Fibronectin | ThermoFisher Scientific | 33010-018 | 2 mL of Milli-Q water + 70 µL 0,25 M NaOH. Use at 5 µg/mL. |
| Laminin | ThermoFisher Scientific | 23017-015 | Store at -80°C. Thaw on ice, keep cool and aliquot 30 µL. Use at 5 µg/mL. |
| Reagents for Fluorescence Activated Cell Sorting | |||
| Cell dissociation agent - Accutase (Stem Pro) | ThermoFisher Scientific | A1110501 | |
| Hanks' Balanced Salt Solution (HBSS) 1X [-calcium, -magnesium, - phenol red] | ThermoFisher Scientific | 14175-046 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153 | Use at 1% concentration for Anti-Human CD56 (NCAM). |
| DNAase | Sigma Aldrich | DN-25 | Use at 0.05% concentration. |
| Anti-Human CD56 (NCAM) Antibody [Mouse] | BD Pharmingen | 555518 | Use at 1 : 50. |
| Propidium iodide | Sigma Aldrich | P4170 | Dilute to 1mg/mL in PBS and keep sterile. Use at 1:1000 to achieve a concentration of 10µg/mL. |
| Reagents for Glass Coverslips | |||
| Autoclaved deionized water | |||
| Alconox detergent | Sigma Aldrich | Z273228 | |
| Ethanol 95% | |||
| Nitric Acid | Sigma Aldrich | 438073-M | CAUTION: Concentrated nitric acid is highly corrosive, and its vapours are potentially harmful. |
| Concentrated hydrochloric acid (HCI) | CAUTION: Concentrated hydrochloric acid is highly corrosive, and its vapours are potentially harmful. | ||
| Reagents for Immunocytochemistry | |||
| Paraformaldehyde (PFA) | Merck Millipore | 1040051000 | Use at a concentration of 4%. CAUTION: PFA is a potent fixative. Avoid ingestion and contact with skin |
| Triton X-100 | Fisher Scientific | 10254640 | Use at a concentration of 0.1%. |
| Serum [Donkey] | Merck Millipore | S30-100ML | |
| Anti-MAP2 Antibody [Chicken] | Abcam | ab5392 | Use at a concentration of 1 : 5,000. |
| Tau HT7 Monoclonal Antibody [Mouse] | ThermoFisher Scientific | MN1000 | Use at a concentration of 1 : 500. |
| Cy3 Anti-Chicken Antibody [Donkey] | Jackson ImmunoResearch | 703-165-155 | Use at a concentration of 1 : 400. |
| Alexa Fluor488 Anti-Mouse Antibody [Donkey] | Jackson ImmunoResearch | 715-545-150 | Use at a concentration of 1 : 400. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Sigma Aldrich | D9542 | Reconstitute the powder in Milli-Q water to 1 mg/mL. Aliquot and store at -20°C, light sensitive. Use at a concentration of 1 : 500. |
| Equipment | |||
| T75 flask [Nunclon Delta Surface] | ThermoFisher Scientific | 156499 | |
| 24-well plate [Nunc] | ThermoFisher Scientific | 142485 | |
| 1.5 mL polypropylene tube | Sigma Aldrich | Z336769 | |
| 15 mL falcon tube | Sarstedt | 62.554.502 | |
| 50 mL falcon tube | Sarstedt | 62.547.254 | |
| CryoPure tube 1.6 mL | Sarstedt | 72.380 | |
| Pippette controller | For pipetting volumes 1-25 mL. | ||
| Sterile serological pipettes: 5, 10 and 25 mL | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Adjustable volume pipettors: 5, 20, 200, and 1,000 µL | |||
| Sterile pipette tips | For pipetting volumes of 0.5 - 1,000 µL. | ||
| Glass coverslips | NeuVitro | GG-12-1.5-oz | #1.5 thickness, 12mm diameter, 0.5oz, CE certified, fit 24 well plates. |
| Glass dish | Approximately 150mm diameter. | ||
| Glass beaker | Make sure to have an appropriate size beaker for the sonicator bath available. Water from the sonicator bath should not overflow into the glass beaker. | ||
| Parafilm M | VWR | ||
| ThawSTAR Automated Cell Thawing System | BioCision | BCS-601 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | |
| Cell counting chambers [50 slides] and trypan blue [0.4%] | ThermoFisher Scientific | C10228 | For use with Countess II Automated Cell Counter. |
| CoolCell Cell LX Controlled-rate Freezing Container | Biocision | BCS-405 | |
| Laminar flow hood | |||
| Humidified 5% CO2 37 °C incubator | |||
| Centrifuge | Suitable for 1,5, 15 and 50 mL tubes. | ||
| Orbital shaker | |||
| Sonicator - Bransonic Model B200 cleaner | Sigma Aldrich | Z305359 | Frequency = 50-60Hz, Amplitude = 30 Watts |
| FACS Aria III cell sorter | BD Pharmingen | ||
| Phase contrast microscope | Olympus | CKX31 | |
| Inverted fluorescence microscope | Leica | DMI6000 B |
Referenzen
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nat Rev Mol Cell Biol. 17, 170-182 (2016).
- Mertens, J., et al. Directly Reprogrammed Human Neurons Retain Aging-Associated Transcriptomic Signatures and Reveal Age-Related Nucleocytoplasmic Defects. Cell Stem Cell. 17, 705-718 (2015).
- Hashizume, O., et al. Epigenetic regulation of the nuclear-coded GCAT and SHMT2 genes confers human age-associated mitochondrial respiration defects. Sci Rep. 5, 10434 (2015).
- Lapasset, L., et al. Rejuvenating senescent and centenarian human cells by reprogramming through the pluripotent state. Genes Dev. 25, 2248-2253 (2011).
- Huh, C. J., et al. Maintenance of age in human neurons generated by microRNA-based neuronal conversion of fibroblasts. Elife. 5, (2016).
- Drouin-Ouellet, J., et al. REST suppression mediates neural conversion of adult human fibroblasts via microRNA-dependent and -independent pathways. EMBO Mol Med. , (2017).
- Tiscornia, G., Singer, O., Verma, I. M. Production and purification of lentiviral vectors. Nat Protoc. 1, 241-245 (2006).
- Richner, M., Victor, M. B., Liu, Y., Abernathy, D., Yoo, A. S. MicroRNA-based conversion of human fibroblasts into striatal medium spiny neurons. Nat Protoc. 10, 1543-1555 (2015).
- Lau, S., Rylander Ottosson, D., Jakobsson, J., Parmar, M. Direct neural conversion from human fibroblasts using self-regulating and nonintegrating viral vectors. Cell Rep. 9, 1673-1680 (2014).
- Pfisterer, U., Wood, J., Nihlberg, K., Hallgren, O., Bjermer, L., Westergren -Thorsson, G., Lindvall, O., Parmar, M. Efficient induction of functional neurons from adult human fibroblasts. Cell Cycle. 10, 3311-3316 (2011).
- Caiazzo, M., Dell'Anno, M. T., Dvoretskova, E., Lazarevic, D., Taverna, S., Leo, D., Sotnikova, T. D., Menegon, A., Roncaglia, P., Colciago, G., Russo, G., Carninci, P., Pezzoli, G., Gainetdinov, R. R., Gustincich, S., Dityatev, A., Broccoli, V. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 476, 224-227 (2011).
- Masserdotti, G., Gascón, S., Götz, M. Direct neuronal reprogramming: learning from and for development. Development. 143, 2494-2510 (2016).
- Pereira, M., Pfisterer, U., Rylander, D., Torper, O., Lau, S., Lundblad, M., Grealish, S., Parmar, M. Highly efficient generation of induced neurons from human fibroblasts that transplantation into the adult rat brain. Sci Rep. 4, 6330 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten