Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In Vitro und In Vivo Ansätze Darm Epithelzelle Durchlässigkeit zu bestimmen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Zwei Methoden werden hier vorgestellt, um intestinale Barrierefunktion zu bestimmen. Eine epitheliale Meter (Volt/Ohm) dient zur Messung des elektrischen Widerstands berührt der kultivierten Epithelien direkt in Gewebekultur Brunnen. Bei Mäusen ist die FITC-Dextran-Magensonde-Methode zur Ermittlung der intestinalen Permeabilität in Vivo.
Zusammenfassung
Die Darmbarriere schützt vor pathogenen Mikroorganismus und mikrobielle Toxin. Seine Funktion unterliegt engen Kreuzung Durchlässigkeit und Epithelzelle Integrität, und Störungen der intestinalen Barrierefunktion trägt zur Weiterentwicklung des Magen-Darm- und systemische Erkrankung. Zwei einfache Methoden werden hier beschrieben, um die Durchlässigkeit des Darmepithels zu messen. In Vitro, Caco-2BBe Zellen sind in Gewebekultur Brunnen als einem monomolekularen Film beschichtet und ttransepitelialen elektrischen Widerstand (TER) kann von einem epithelialen (Volt /) Ohmmeter gemessen werden. Diese Methode überzeugt durch seine einfache Bedienung und Wiederholbarkeit. In-vivo -Mäuse sind gavaged mit 4 kDa Fluorescein erfolgt (FITC)-Dextran und die FITC-Dextran-Konzentrationen werden in gesammelten Serumproben von Mäusen zu bestimmen, die epitheliale Durchlässigkeit gemessen. Orale Magensonde bietet eine genaue Dosierung, und daher die bevorzugte Methode zur Messung der intestinalen Permeabilität in Vivo. Zusammen genommen, diese beiden Methoden können die Durchlässigkeit des Darmepithels in Vitro und in Vivozu messen und daher verwendet werden, um die Verbindung zwischen Krankheiten und Barrierefunktion zu studieren.
Einleitung
Intestinale Epithelzellen sind nicht nur verantwortlich für die Absorption von Nährstoffen, sondern auch eine wichtige Barriere zur Abwehr von pathogenen Mikroorganismen und mikrobielle Toxine bilden. Diese Funktion der Darmbarriere unterliegt engen Kreuzung Durchlässigkeit und Epithelzelle Integrität1,2,3, und Dysfunktion der epitheliale Barrierefunktion ist verbunden mit entzündlichen Darmerkrankungen Krankheit (IBD). Perijunctional Actomyosin Ring (PAMR) liegt innerhalb der Zelle, die auf die tight Junctions eng zusammenhängend ist. Die Kontraktion der PAMR, die durch die Myosin-Leichtketten (MLC) geregelt wird, ist entscheidend für die Regulierung der engen Kreuzung Durchlässigkeit4,5,6,7,8, 9,10. Tumor-Nekrose-Faktor (TNF) ist zentral für die Darmbarriere Verlust durch heraufregulierende intestinale epitheliale MLC-Kinase (MLCK) Ausdruck und induzieren occludin Internalisierung11,12,13.
Ionen wie Na+ und Cl– können parazellulär Raum durchqueren, durch die Pore oder Leck Weg14. In einem "undichten" Epithel Änderungen in TER in erster Linie veränderte engen Kreuzung Durchlässigkeit. TER-Messung ist ein häufig verwendete elektrophysiologische Ansatz, engen Kreuzung Durchlässigkeit, in erster Linie für Na+ und Cl-, basierend auf die Impedanz der Zelle Monolagen zu quantifizieren. Verschiedene Zelltypen, einschließlich intestinale Epithelzellen, pulmonaler Epithelzellen und vaskulären endothelialen Zellen wurden für TER Messungen berichtet. Vorteile dieser Methode sind, dass TER Messungen nicht-invasiv sind und verwendet werden, können um lebende Zellen in Echtzeit zu überwachen. Darüber hinaus eignet sich die TER-Messtechnik für Drogen Toxizität Studien15.
Caco-2BBe menschlichen epithelialen kolorektalen Adenokarzinom Zellen mit einer Struktur und Funktion ähnlich wie die differenzierte kleinen intestinalen Epithelzellen sind: zum Beispiel haben diese Zellen Mikrovilli und Enzyme, die verbunden sind mit kleinen Darm Pinsel Grenze. Daher sind kultivierte Caco-2BBe Monolagen als in-vitro- Modell Barrierefunktion zu Testzwecken genutzt.
Bei Mäusen ist Einweg, intestinale parazellulär Durchlässigkeit zu studieren durch die Messung der Fähigkeit der FITC-Dextran aus dem Lumen ins Blut zu überqueren. Somit kann die intestinale Permeabilität von Gavaging FITC-Dextran direkt in Mäusen und Messung der Fluoreszenz im Blut beurteilt werden. Das folgende Protokoll beschreibt zwei einfache Methoden zur Beurteilung des Darmepithels Durchlässigkeit in Vitro und in Vivo.
Protokoll
Diese Studie wurde von der Animal Care und Nutzung Protokoll der Cambridge-Suda genomische Resource Center (CAM-SU), Soochow University zugelassen.
1. Beschichtung und Pflege von Caco-2bbe auf porösen Polycarbonat Membranen
- Zellen in einem T75 Kolben mit Medien wachsen (DMEM mit 10 % FBS). Flaschen sollten regelmäßig, je nach der Zelldichte gefüttert werden.
Hinweis: Für optimale Beschichtung sollte Zellen teilen sich schnell und haben eine flache "gebraten-Ei"-Form, was darauf hindeutet, dass Zellen in der Wachstumsphase sind. - Sobald Zellen 80 % konfluierende, nehmen Sie die Flasche aus dem Inkubator sind und entfernen Sie das Medium. Spülen Sie alle restlichen Medien mit 1-2 mL sterile PBS (ohne Ca2 +). Pipettieren 1,5 mL Trypsin-EDTA in den Kolben und sanft rocken die Flasche; Legen Sie dann die Flasche in den Inkubator 37 ° C für 20 min ohne Schaukeln.
- Während die Zellen trypsinizing sind, fügt Ort mit porösen Polycarbonat Membranen (Porengröße 0,4 µm; Fläche, 0,33 cm2; siehe Tabelle of Materials) in 24-Well Platten. 1,0 mL Nährmedien in der basalen Kammer (untere Bereich der Membran) hinzugeben.
- Pipettieren 5 mL der Medien in die Flasche und kräftig pipettieren der Zellen gegen die Seite des Kolbens 5-10mal Klumpen, lose, einzelne Zellen oder 2-3 Zelle zu erreichen.
-
Platte 0,166 mL Zellen (Erreichung ein Verdünnungsverhältnis von 1:8) in die apikale Kammer (der obere Raum der Membran). Bis zu 3 Wochen bei 37 ° C inkubieren.
- Füttern Sie Zellen dreimal wöchentlich durch sorgfältig Absaugen der Medien aus dem basalen Fach jeder gut mit einer Druckpumpe. Sanft tropft 1 mL der Medien in der apikalen Handelskammer jedes einfügen.
2. Nutzung der epithelialen Meter (Volt/Ohm) zur Messung der TER
Hinweis: Nach ca. 3 Wochen der Kultur auf Polycarbonat-Membranen sind Caco-2BBe Zellen TER messbereit.
- Ersetzen Sie für Zytokin Studien einen Tag vor der Messung die basalen Medien mit Medium mit 10 ng/mL IFNγ. Am Tag des Experiments ersetzen Sie die Medien mit HBSS mit 2,5 oder 7,5 ng/mL TNF.
Hinweis: IFNγ Behandlung erhöht die Expression von TNF-Rezeptor 2 (TNFR2)16. - Um das Messgerät zu beheben, legen Sie die Korrektur-Elektrode in die Input-Port, und wählen Sie "Ohm"-Modus. Verstellen Sie die R Adj-Schraube mit einem Schraubenzieher, bis das Messgerät eine Lesung von 1.000 Ω zeigt.
- Sterilisieren Sie die Elektroden zu, indem man sie in 70 % igem Ethanol für 15-30 min, und dann trocknen sie an der Luft für 15 S. Spülen der Elektrode in die experimentelle Zellkulturmedien.
- Schalten Sie das Gerät, und wählen Sie den Modus "Ohm". Legen Sie vorsichtig die langen Enden der Elektrode Brücken in die basale Kammer und die kurzen enden in die apikale Kammer. Sicherstellen Sie, dass die längeren Elektroden den Boden der Schale, berühren unter Beibehaltung der kürzeren Elektroden unterhalb der Oberfläche der Medien, sondern vor der Gewebekultur-Einsätze. Halten Sie die Elektroden senkrecht.
- Messen Sie den Widerstand der Probe Einsätze und leere Einsätze (d. h. , die die Kultur ohne Zellen aber mit HBSS fügt) auf 0, 1, 2, 3, 4 h nach der Zytokin-Behandlung. Notieren Sie den Widerstand.
- Um Konsistenz zu erreichen über verschiedene Plattenformate, berechnet das Produkt aus den Widerstand und die effektive Membranfläche:
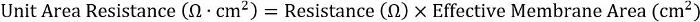
Für 24-Well-Einsätze ist die effektive Membranfläche 0,33 cm2.
(3) Mausmodell Dextran Sulfat Natrium (DSS)-induzierte Kolitis
- Hinzu kommt DSS autoklaviert Wasser, eine Endkonzentration von 3,5 % (wt/Vol).
- Verwalten von 3,5 % DSS 8 Wochen alten männlichen C57BL/6 Mäusen für insgesamt 7 Tage. Kontroll-Mäusen verleihen Sie regelmäßig Trinkwasser ohne DSS.
- Wechseln Sie das DSS-haltigen Wasser nach Tag 7 zu regelmäßigen Trinkwasser.
- Mäuse wiegen und klinische Resultate von jedem Mausklick täglich zu bewerten. Körpergewicht von jeder Maus zu seiner ursprünglichen Körpergewichts zu normalisieren. Noten werden entsprechend der Schwere der Erkrankung durch vier Parameter definiert: rektale Prolaps (0-2), Stuhlkonsistenz (0-2), Blutungen (0-2) und Aktivität (0-2)5. Addieren Sie die Ergebnisse aus diesen Parametern für eine klinische Endstand.
- Um den histopathologischen Zustand der Doppelpunkt Gewebe zu analysieren, einschläfern Sie Mäuse durch Injektion intraperitoneal (i.p.) mit 1,2 % (Vol/Vol) Avertin (0,6 mL/10 g Körpergewicht) 7 Tage Post-DSS Behandlung. Um einen Bestand von 100 % avertin vorzubereiten, mischen Sie 10 g 2,2,2-Tribromoethanol mit 10 ml Tert-Amyl Alkohol. Speichern Sie im Dunkeln bei 4° C. Verdünnen Sie um zu verwenden, bestand von 100 % bis 2 % in Wasser.
- Isolieren Sie den Dickdarm und Blinddarm zu, und Messen Sie die Länge des Dickdarms5.
- Schneiden Sie 0,5 cm Segmente aus dem distalen Kolon und Fix in einem 15 mL Falcon-Röhrchen mit 10 mL 10 % Formalin über Nacht. Waschen Sie das feste Gewebe mit abgestufter Ethanol (75, 95 und 100 %) und Xylol. Betten Sie des Gewebes in Paraffin ein und schneiden Sie 6 mm Abschnitte für die Hämatoxylin und Eosin Färbung8.
4. messen die epitheliale Barriere Permeabilität in DSS-induzierte Kolitis Mäuse
- Messen Sie die Durchlässigkeit Barriere 7 Tage nach dem Beginn der DSS-Verwaltung.
- Am Tag des Tests schnelle Mäuse für 3 h.
- Autoklaven eine Magensonde Nadel um Sterilität, dann Magensonde Mäuse mit 150 µL 80 mg/mL 4 kDa FITC-Dextran in sterilem Wasser sicherzustellen und halten Sie die ungenutzten FITC-Dextran um die Standardkurve nach Serum Collection messen. Wiegen Sie die Mäuse für die Berechnung der Durchlässigkeit.
Hinweis: Die FITC-Dextran-Lösung sollte in Wasser erfolgen. - Mit einer Schere, clip ein 1 cm Stück der Rute, und sammeln Sie 100 µL Blut vom Heck in Serum Röhrchen. Drehen Sie das gesammelte Blut bei 10.000 x g für 10 min bei Raumtemperatur.
- Verdünnen Sie das Serum 1:4 in Wasser. Zu einem Standard Kurve, verdünnen Sie ungenutzte FITC-Dextran mit Wasser bei 1: 300 000, 1:3, 1:1 000, 01:10, 000, 01:30, 000, 1: 100, 000, 1: 300, 000, 1:1 000 000 und 1:3, 000, 000. Fügen Sie 100 µL/Well das Serum und die Standardkurve Proben in 96-Well Platten.
- Lesen Sie die Fluoreszenz in einem Teller-Reader mit 485 Erregung/528-Emission. Berechnen Sie die Durchlässigkeit Werte anhand der Standardkurve und Multipliziere mit 4 für die Verdünnung zu korrigieren.
- Teilen Sie die Konzentration der FITC-Dextran durch das Gewicht, die Werte zu normalisieren (Dadurch wird den Unterschied in der FITC-Dextran-Lieferung zu normalisieren, wenn Mäuse krank sind und habe Gewicht verloren).
Ergebnisse
In Kultur Caco-2BBe Zellen als eine Monolage wachsen und langsam in Reife absorptive Enterozyten, die Bürste Grenzen unterscheiden. In diesem Protokoll Caco-2BBe Zellen wurden mit einer hohen Dichte an Polycarbonat Membranen vernickelt und Zellen erreicht 100 % Konfluenz eines Tages nach der Aussaat. Zellen sind jedoch in diesem Stadium undifferenzierte: um die Zellen vollständig zu unterscheiden, ist die Medien alle 2-3 Tage für 3 Wochen verändert. Zellen waren voller Flecken, mit Ke...
Diskussion
Es gibt mehrere wichtige Schritte im Protokoll. Caco-2BBe (die Grenze des Pinsel-Ausdruck) Zellen sind immer für TER Messung, ausgewählt von der Caco-2-Zell-Linie für Pinsel-Grenze Proteinexpression verwendet. Caco-2BBe Zellen haben einen Villus absorptive Phänotyp bei differenziert (nach ca. 3 Wochen nach dem Zusammenfluss Kultur)17. Es ist notwendig zur Vermeidung von Kontaminationen während der Messung und die Elektrode zu sterilisieren. Da das Verfahren nicht steril ist, können die Messu...
Offenlegungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Danksagungen
Wir danken Dr. Jerrold R. Turner vom Brigham and Women es Hospital, Harvard Medical School, für seine großzügige Unterstützung bei der Durchführung dieser Studie. Diese Arbeit wird unterstützt von der National Natural Science Foundation von China (Grant-Nummer 81470804, 31401229 und 81200620), der Natural Science Foundation der Provinz Jiangsu (Grant-Nummer BK20180838 und BK20140319), The Innovation Forschungsprogramm für College Absolventen der Provinz Jiangsu (Grant-Nummer KYLX16-0116), Advanced Research Projekte der Soochow University (Grant-Nummer SDY2015_06), Morbus Crohn und Colitis Foundation Research Fellowship Award (Gewährungsnummer 310801).
Materialien
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
Referenzen
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten