Method Article
Charakterisierung von Immunzellen im menschlichen Fettgewebe mittels Durchflusszytometrie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt eine Methode, um Immunzelle Inhalt des Fettgewebes durch Isolierung der Immunzellen aus Fettgewebe und anschließende Analyse mit Durchflusszytometrie zu analysieren.
Zusammenfassung
Infiltration von Immunzellen in das subkutane und viszeralen Fettgewebe (AT) Ablagerungen führt zu einer minderwertigen Entzündung einen Beitrag zur Entwicklung der Adipositas-assoziierten Komplikationen wie Typ-2-Diabetes. Um quantitativ und qualitativ die Immunzelle Teilmengen in menschlichen auf Einlagen zu untersuchen, haben wir einen Flow Cytometry Ansatz entwickelt. Die stromale vaskuläre Fraktion (SVF), mit der Immunzellen ist von subkutanem und viszeralem bei Biopsien von Kollagenase Verdauung isoliert. Fettzellen werden nach der Zentrifugierung entfernt. Die SVF-Zellen sind für mehrere Membrane-springen-Marker zur Unterscheidung zwischen Immunzellen Teilmengen ausgewählt und mittels Durchflusszytometrie analysiert gefärbt. Als Ergebnis dieses Ansatzes pro- und antiinflammatorische Makrophagen Teilmengen, dendritische Zellen (DCs), B-Zellen, CD4+ und CD8+ T-Zellen und NK-Zellen erkannt und quantifiziert werden können. Diese Methode gibt detaillierte Informationen über Immunzellen im AT und die Höhe der jeweils spezifischen Teilmenge. Da gibt es zahlreiche fluoreszierende Antikörper zur Verfügung, kann unser Flow Cytometry Ansatz zur Messung der verschiedenen anderen zellulären und intrazellulären Marker von Interesse eingestellt werden.
Einleitung
Adipositas ist gekennzeichnet mit Low-Grade AT Entzündung1 und Infiltration von Pro-inflammatorischen Immunzellen im viszeralen und subkutanen an (MwSt., saß). Ansammlung von Pro-inflammatorischen Immunzellen in den Bottich führt zu einer Insulinresistenz ist ein primärer Risikofaktor für die Entwicklung von Typ-2-Diabetes-2. Immunzellen der angeborenen und der adaptiven Immunsystems befinden sich in der übergewichtige, wie Makrophagen, Mastzellen, Neutrophile, CD4+ und CD8+ T-Zellen und B-Zellen3,4,5,6 ,7. Diese Immunzellen zusammen mit Endothelzellen, stromale Zellen Adipocyte Stammväter, Fibroblasten und Perizyten, bilden die SVF-8 und sind die wichtigste Quelle von Pro-inflammatorischen Substanzen im AT9.
Der Entzündungsstatus AT wird häufig durch Techniken einschließlich Western-Blot10, qPCR11und Immunohistochemistry11untersucht. Jedoch ist bei der Verwendung dieser Techniken, die gesamte AT, Adipozyten und SVF verwendet. Dies macht es schwierig zu bestimmen, die Menge und Teilmengen von Immunzellen in der AT vorhanden. Immunzellen haben verschiedene Zelle Marker zu definieren und zu kategorisieren, wie z. B. Makrophagen. Makrophagen zeigen erhebliche Heterogenität in Funktion und Zelle Oberfläche Marker Ausdruck12. Daher sind sie oft in zwei Populationen von Makrophagen kategorisiert: M1 und M2. M2-Makrophagen nennt man in der Regel Alternativ aktivierten Makrophagen12,13 und befinden sich in der schlanken, metabolisch normale Menschen14. Tritt jedoch bei Übergewicht, ein phänotypische Schalter von M2-Makrophagen, M1 Makrophagen. Diese aktiviert klassisch M1 Makrophagen express CD11C12 und reichern sich um tote Adipozyten, Krone-artige Strukturen13zu bilden. Es hat sich gezeigt, dass CD11C+ Makrophagen in der Insulinwirkung beeinträchtigen und Insulinresistenz bei adipösen Menschen15zugeordnet sind. Immunohistochemistry ist zur Erkennung von M1 und M2-Makrophagen im AT eine Option. Diese Technik bietet Informationen über den Standort von den Makrophagen im Gewebe. Allerdings schränkt es die Anzahl der Markierungen, die in einer Färbung verwendet werden können. Darüber hinaus ist es auch schwierig zu quantifizieren. Um die verschiedenen Immunzellen Teilmengen in der Mehrwertsteuer und sAT Einlagen zu untersuchen, haben wir daher einen Flow Cytometry Ansatz entwickelt. Dieser Ansatz ermöglicht es uns, mehrere Markierungen pro Zelle mit einem Flow-Zytometrie-Analyse zu Zelle Teilmengen zu definieren und zählen die Anzahl der einzelnen Untergruppen in den AT-Ablagerungen vorhanden.
Protokoll
Themen, die in die Studie genehmigt von der medizinischen Ethik Komitee Jessa Krankenhaus, Hasselt und Universität Hasselt, Belgien in Übereinstimmung mit der Deklaration von Helsinki aufgenommen wurden viszeralen und subkutanen Proben entnommen.
1. Vorbereitung der Reagenzien
- Kollagenase-Lösung
- Lösen Sie 1 g der Kollagenbildung zwischengespeichert ich in 10 mL von Phosphat Kochsalzlösung (PBS, ohne Calcium und Magnesium) um eine 100 mg/mL Stammlösung zu machen. 200 µL-Aliquots Vorbereitung und Lagerung bei-20 ° C.
- Lösen Sie 1 g von Kollagenase XI in 10 mL PBS eine 100 mg/mL Stammlösung zu machen. 200 µL-Aliquots Vorbereitung und Lagerung bei-20 ° C.
- Auflösen von 10 mg der DNase I 10 mL PBS eine 10 mg/mL Stammlösung zu machen. Bereiten Sie 180 µL-Aliquots und Lagerung bei-20 ° C.
- Hinzufügen von 100 µL Collagenase I (100 mg/mL), 100 µL Collagenase XI (100 mg/mL) und 90 µL DNase I (10 mg/mL) bis 10 mL DMEM Schinken F12. Machen Sie Kollagenase-Lösung für jede Isolierung frisch.
- Erythrozyten-Lyse-Puffer
- 0,84 g NH4Cl in 100 mL hochreines Wasser auflösen.
- Den pH auf 7,4 vor Gebrauch festgelegt. In einem Glaskolben bei 4 ° c lagern
- Ort der Erythrozyten Lyse Puffer auf dem Eis vor Gebrauch.
- FACS-Puffer
- Auflösen von 0,5 g Rinderserumalbumin (BSA) in 100 mL PBS, 0,5 % BSA PBS zu erhalten.
- Auflösen von 65 mg NaN3 in 100 mL 0,5 % BSA PBS 10 mM NaN3 0,5 % BSA PBS zu erhalten. Store-Lösung in einem Glaskolben bei 4 ° C.
- Ort FACS-Puffer auf dem Eis vor Gebrauch.
Achtung: NaN3 ist hochgiftig. Arbeiten in einer Dampfhaube und Schutzbrille und Handschuhe zum Schutz beim Umgang mit NaN3.
- Menschliche IgG-block
- Lösen Sie 10 mg von menschlichen IgG in 10 mL PBS, 1 mg/mL zu erhalten. 100 µL-Aliquots Vorbereitung und Lagerung bei-20 ° C.
- Platzieren Sie den menschliche IgG-Block auf dem Eis vor Gebrauch.
2. Isolierung des SVF von AT
- Kleinschneiden Sie 1 g bei Biopsie (± 2 mm2) mit einem Skalpell und Transfer in ein 50 mL Zentrifugenröhrchen (z.B. Falcon-Röhrchen). 10 mL Kollagenase Lösung zu jedem Beispiel zugeben.
Hinweis: Schließen Sie den Deckel des Rohres vollständig und drehen Sie den Deckel ¼ Umdrehung zurück. - Inkubation für 60 min bei 37 ° C in einem Wasserbad unter sanft schütteln (60 Zyklen/Min.).
- Filtern Sie die entstandene Suspension mit einem 200 µM-Filter und sammeln Sie die Probe in eine neue 50 mL Zentrifugenröhrchen. Fügen Sie 7 mL PBS auf den Filter zu spülen den Filter alle Zellen hinzu.
- Zentrifugieren Sie die Probe bei 280 X g für 5 min bei 4 ° C.
- Entfernen Sie die schwimmenden Adipocyte Bruchteil durch pipettieren. Die Zelle-Kugel ist der SVF.
Hinweis: Entfernen Sie den Adipocyte Bruchteil um SVF zu erhalten. Vermeiden Sie die gesamte Spitze der Stichprobe untertauchen, weil dadurch nur der PBS und nicht die schwimmenden Fettzellen entfernt werden. - Aufschwemmen der SVF in 5 mL PBS Kollagenase zu entfernen, die Aufhängung mit einem 70 µM-Filter filtern, spülen den Filter mit 5 mL PBS und Zentrifugieren der Probe bei 280 X g für 5 min bei 4 ° C.
- Entfernen des Überstands und das Pellet in 3 mL Erythrozyten Lyse Puffer Aufschwemmen.
- Inkubieren Sie für 5 min auf Eis. 7 mL PBS nach Inkubation hinzugeben.
- Zentrifugieren Sie die Probe bei 280 X g für 5 min bei 4 ° C.
3. Färbung des SVF für Flow Cytometry Analysis
- Auflösen der Zelle Pellet in 90 µL 4 ° C FACS Puffer und 10 µL 1 mg/mL menschliche IgG-Block hinzufügen. Teilen Sie die Zellsuspension in 2 Brunnen eine V-Form 96-well-Platte. Die Platte auf dem Eis und lassen Sie die menschliche IgG-Block für 15 min inkubieren.
- Jede Probe zu waschen und die Platte für 5 min bei 280 X g bei 4 ° c zentrifugiert fügen Sie 100 µL FACS Puffer hinzu Den Überstand durch Kippen der Plattenrandes auf dem Kopf stehend in einer fließenden Bewegung ohne Tippen auf die Platte zu entfernen.
Hinweis: Stellen Sie sicher, jede restliche Flüssigkeit von der Oberseite der Platte mit einem Taschentuch zu entfernen, während die Platte auf dem Kopf stehend zu halten. - Bereiten Sie Antikörper Cocktails für Makrophagen und DC Teilmengen (FACS-Panel 1) und T - und B-Zell-Subsets (FACS-Panel 2) wie in Tabelle 1 und Tabelle 2beschrieben. Die Bände, die in Tabelle 1 und Tabelle 2 beschrieben werden ausgewählt nach der Optimierung der Antikörper-Konzentrationen und sind ausreichend für eine Mehrwertsteuer oder sAT Probe.
Hinweis: Im Bedienfeld "FACS" 1, verwenden die Marker CD303 und CD141 um zu bestätigen, dass CD11C+ CD11Bniedrigen Zellen sind DCs. Es wird jedoch empfohlen, diese Marker aus dem Panel auf einen lebenden/Toten Färbung auszuschließen. Beide FACS-Panel 1 und 2 sind kombinierbar mit der LIVE/DEAD fixierbar Red Dead Cell Fleck Kit Lebensfähigkeit Färbung wenn ausgenommen CD303 in Panel 1 als PE-Kanal unbenutzt sein wird. Durchführen Sie Lebensfähigkeit Färbung nach den Anweisungen des Herstellers. - Das Pellet in 29,5 µL Antikörper cocktail für FACS Panel 1 und 23 µL Antikörper cocktail für FACS-Panel 2 aufzuwirbeln. Inkubieren Sie für 30 Minuten im Dunkeln auf dem Eis.
- Jedes gut 150 µL FACS Puffer hinzu und Aufschwemmen der Zelle Pellet um einen zweiten Waschschritt durchzuführen. Zentrifugieren Sie die Platte für 5 min bei 280 x g und 4 ° C. Den Überstand durch Kippen der Plattenrandes auf den Kopf zu entfernen.
- Geben Sie 150 µL 1 % Formaldehyd-Lösung in jeder der Zellen zu beheben. Übertragen Sie die Zellsuspension aus jedem Brunnen mit dem entsprechenden FACS-Rohr durch Pipettieren mit einer Pipette P200. FACS-Rohre bei 4 ° C in den dunklen bis zu 7 Tage aufbewahren.
Hinweis: Direkte Messung ist auch möglich. Fügen Sie 150 µL FACS Puffer in jede Vertiefung statt 1 % Formaldehyd hinzu, übertragen Sie die Zellen durch Pipettieren mit einer P200-Pipette auf die entsprechenden FACS-Rohre und analysieren Sie die Zellen zu.
Achtung: Formaldehyd ist sehr giftig. Bereiten Sie Formaldehyd-Lösungen während der Arbeit in einer Dampfhaube nicht einatmen und tragen Sie Handschuhe und Schutzbrille zum Schutz vor.
(4) Flow Cytometry Analysis
- Vor der ersten Messung mithilfe eines ungefärbten Negativkontrolle forward Scatter (FSC) und Side Scatter (SSC) festlegen. Passen Sie die Spannungen der Durchflusszytometer gemäß den Anweisungen des Herstellers, sodass alle Populationen von Interesse im FSC und SSC Diagramm sichtbar sind und eine zwischen Schutt und lebenden Zellen Unterscheidung.
- Durchführen Sie Multi-Color Compensation Analyse mit Antikörper erfassen Perlen nach Protokoll des Herstellers.
- Bereiten Sie Fluoreszenz minus 1 (FMO) Kontrollen durch Herstellung der Antikörper-Mischung aber schließen Sie einen Antikörper aus dem Mix aus. Dies gilt für jeden Antikörper, Schaffung von 8 Antikörper-Mischungen für FACS Panel 1 und 6 Antikörper-Mischungen für FACS-Panel 2. Diese FMO Antikörper Mischungen dienen, SVF, wie zuvor beschrieben in diesem Protokoll zu beflecken.
- Messen Sie alle FMO Steuerelemente und der gating-Strategie basierend auf FMO-Steuerelemente. Verwenden Sie die FMO-Steuerelemente möglich Auto-Fluoreszenz der Zellen zu erkennen.
Hinweis: Entfernen Sie einen Antikörper aus dem Mix, Fluoreszenz-Ebene erkannt in diesem Kanal ist ein Hintergrund/Autofluorescent Signal. Daher, durch den Vergleich der verschiedenen FMO Kontrollergebnisse FACS, Tore auf bestimmte Bevölkerungsgruppen, um sicherzustellen, dass die Gatings auf positive Zellen basieren und nicht auf Auto-Fluoreszenz basiert gezogen werden können. - Wirbel der FACS-Rohre bei 800 u/min vor der Einlagerung in das Durchflusszytometer und die Messung starten.
Hinweis: Mindestens 50.000 Veranstaltungen im live Tor wird empfohlen, um sicherzustellen, dass genügend Zellen von jeder Subpopulation gemessen werden.
Ergebnisse
Die SVF isoliert von der Mehrwertsteuer und saß wurde mittels Durchflusszytometrie gemessen. Flow Cytometry Messungen erzeugen Grundstücke zeigen unterschiedliche Zellpopulationen basierend auf zellulärer Marker (Abbildung 1A und 1 b). Zunächst durch Auftragen der Stürmer streuen Breite (FSC-W) und forward Scatter Bereich (FSC-A), Zelle, die Aggregate von weiteren Analyse ausgeschlossen werden können, durch Anspritzung Einzelzellen als niedrige FSC-W. Nächste, live Zellen ausgewählt sind, und Zelltrümmer ist ausgeschlossen durch Anspritzung der Zellen die richtige Größe und Komplexität mit FSC-A und der Seite streuen Bereich (SSC-A), beziehungsweise. Abgestorbenen Zellen sind klein und daher als eine verschiedene Bevölkerung sichtbar mit einem kleinen FSC-A. Nächste, immune Zellen wurden durch Verwendung von Pan-Leukozyten-Marker CD45 (Panel 1 und 2, Abb. 1A) ausgewählt. Um Makrophagen zu analysieren, andere Immunzellen wie die T-Zellen (CD3), B-Zellen (CD19), Neutrophile (CD66b+ CD11b+), und NK-Zellen (CD56) wurden von der weiteren Analyse ausgeschlossen, über verschiedene Antikörper, die gezielt diese Zellen, sondern mit der gleichen Fluorochrom. Weitere Unterteilung der verbleibenden Zellen basierte auf CD11b, CD11c Ausdruck. Dies führte in den folgenden Populationen: CD11b+ CD11c+ Makrophagen, CD11b+ CD11c– Makrophagen und CD11bniedrig /- CD11c+ DCs (FACS Panel 1, Abbildung 1 b). Messung der mittleren Fluoreszenzintensität (MFI) erlaubt die Quantifizierung des Ausdrucks von CD303 (plasmazytoide DC Markierung) und CD141 (DC-Marker), auf CD11b+ CD11c+ Makrophagen und CD11bniedrig /- CD11c+ DCs. Ausdruck dieser beiden Marker waren höher bei CD11bniedrig /- CD11c+ Zellen bestätigt, dass CD11bniedrig /- CD11c+ Zellen wurden DCs (Abbildung 1).
Das CD45+ Zellen (Abbildung 1A) wurden in T-Zellen und B-Zellen unterteilt mit CD3 und CD19, beziehungsweise. T-Zellen wurden unterteilt in T-Helferzellen (CD4+) und zytotoxischen T-Zellen (CD8+). Zu guter Letzt CD3–CD19–-Zellen, NK-Zellen mit dem Marker CD56 zu quantifizieren gezeichnet wurden (FACS-Panel 2, Abbildung 1). Die Anzahl der Zellen in jedem Tor wird quantifiziert und kann zur Berechnung des Anteils dieser Zellentyp aller lebenden Zellen (Tabelle 3).
Der Anteil der lebenden Zellen kann berechnet werden, für jedes Fach ermöglicht die Berechnung der durchschnittlich alle Themen in einer Gruppe von zum Beispiel mageres oder übergewichtige Männer zeigt die Fülle an eine bestimmte Immunzellen, d. h., der Pro-inflammatorischen CD11b+ CD11c+ Makrophagen in viszeralen AT (Abbildung 2).
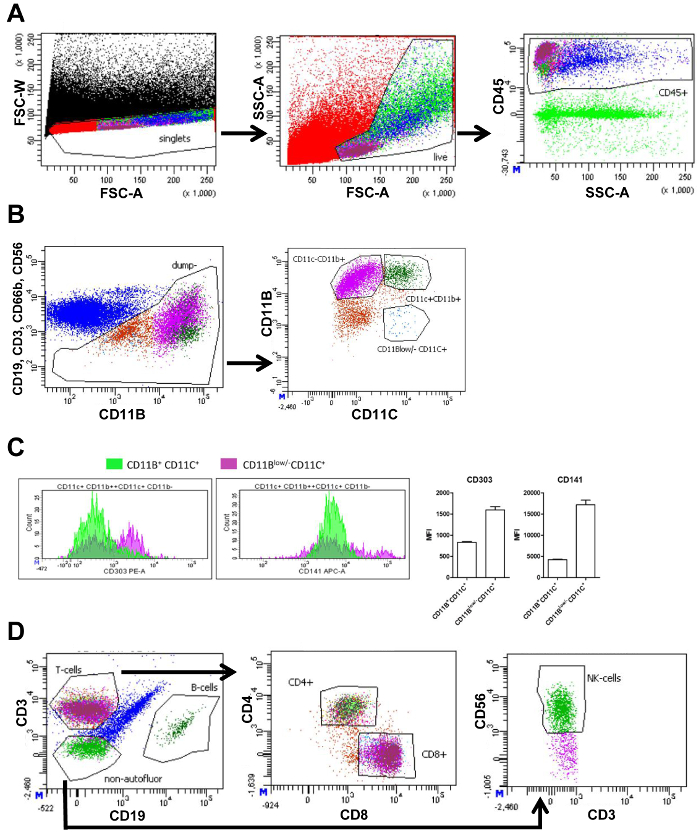
Abbildung 1: FACS Anspritzung Strategie des viszeralen Fettgewebes. (A) FACS Handlung aller Ereignisse (schwarz) mit forward Scatter breite Intensität (FSC-W) und forward Scatter Bereich Intensität (FSC-A) mit einem Tor wählen Sie nur einzelne Zellen (rot), gefolgt von einem FACS-Grundstück basierend auf FSC-A und seitliche Streuung Bereich Intensität (SSC-A) enthält eine Auswahl von lebenden Zellen (hellgrün) Tor. Als nächstes Grundstück mit SSC-A und CD45 Fluoreszenzintensität enthält eine Auswahl aller CD45 Tor+ (immun-) Zellen (blau). (B) FACS Grundstück CD19, CD3, CD66b und CD56 Fluoreszenzintensität versus CD11b Fluoreszenzintensität und ein Tor auswählen alle Zellen, die CD19, CD3, CD66b und CD56 negativ sind (braun) für weitere Unterteilung in Populationen. Weitere Unterteilung in die nächste Handlung basierend auf CD11b und CD11c Fluoreszenz-Intensität. Tore werden angezeigt, enthält CD11b+ CD11c+ Makrophagen (dunkelgrün), CD11b+ CD11c– Makrophagen (lila) und CD11bniedrig /- CD11c+ dendritische Zellen (blau). (C) Menge von CD11b+, CD11c+, oder CD11bniedrig /- CD11c+ Zellen (Y-Achse) ihre Ebenen der Fluoreszenzintensität (X-Achse) für CD303 und CD141 und die entsprechenden Quantifizierung des Mittelwerts anzeigen Fluoreszenzintensität (MFI). (D) FACS Plot zeigt die bisherigen CD45+ Bevölkerung (blau) basierend auf CD3 und CD19 Fluoreszenzintensität mit Toren, die Auswahl von T-Zellen (Magenta), B-Zellen (dunkelgrün) und nicht-Autofluorescent Zellen (grün) negativ für beide CD3 und CD19. Die folgende Handlung basiert auf CD4 und CD8 Fluoreszenz mit Toren Auswahl CD4+ (hellgrün) und CD8+ (Magenta) T-Zellen. Eine identische gating Strategie dient zur subkutanen Fettgewebe. Eine identische gating Strategie dient zur subkutanen Fettgewebe. Diese Zahl wurde von Wouters Et Al. modifiziert 16 Bitte klicken Sie hier für eine größere Version dieser Figur.
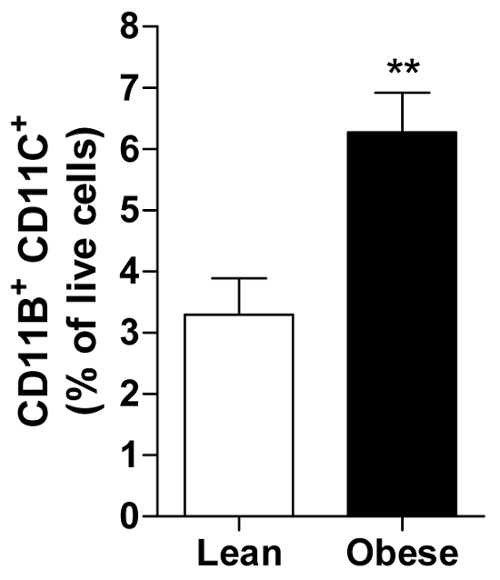
Abbildung 2: Fettleibige MwSt enthält mehr Pro-inflammatorischen Makrophagen. Die Höhe der CD11b+ CD11c+ Makrophagen als Prozentsatz aller lebenden Zellen in Bottich von mageren und fettleibigen Menschen präsentiert. Alle Daten sind Mittel ± SEM; n = 20 für Lean und n = 31 für übergewichtige. p ≤ 0,01 vs. Lean. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Ziel | Definition Ziel | Präsentieren auf | Fluorochrom | Menge | Klon |
| CD11B | myeloische Integrin-marker | Granulozyten, Monozyten/Makrophagen, dendritische Zellengering und natürliche Killerzellen | BV421 | 2.5 ΜL | ICRF44 |
| CD19 | gemeinsame B-Zell-antigen | B-Zell-Entwicklung von Pro-B-Zell bis Blastoid B-Zellen und B Plasmazelle | FITC | 3 ΜL | HIB19 |
| CD3 | gemeinsamen T-Zell-antigen | Thymozyten, T-Lymphozyten und natürlichen Killer T-Zellen | FITC | 3 ΜL | UCHT1 |
| CD66B | Mitglied der carcinoembryonales Antigen (CEA)-wie Glykoprotein-Familie | Granulozyten | FITC | 5 ΜL | G10F5 |
| CD56 | stark glykosylierten Adhäsion protein | natürliche Killerzellen und natürlichen Killer T-Zellen | FITC | 5 ΜL | B159 |
| CD303 | Typ II transmembranen glycoprotein | plasmazytoide dendritische Zellen | PE | 1 ΜL | 201A |
| CD141 | thrombomodulin | Monozyten/Makrophagenniedrig, Subpopulation von dendritischen Zellen | APC | 1 ΜL | M80 |
| CD11C | Typ I transmembranen Glycoprotein; Integrin αx | Monozyten/Makrophagen, dendritischen Zellen, Granulozyten, natürliche Killerzellen, Teilmenge von B und T-Zellen | APC-Cy7 | 0,5 ΜL | Bu15 |
| CD45 | gemeinsamen Leukozyten-antigen | alle menschlichen Leukozyten, Lymphozyten, Monozyten, Granulozyten, Eosinophilen und Thymozyten einschließlich | PE-Cy7 | 1 ΜL | HI30 |
| FACS-Puffer | - | - | - | 7.5 µl | - |
Tabelle 1. Antikörper für cocktail FACS pAnel 1, Teilmengen von Makrophagen und dendritischen Zellen Populationen zu identifizieren. Menge des Antikörpers beschrieben ist für die Analyse einer Probe.
| Ziel | Definition Ziel | Präsentieren auf | Fluorochrom | Menge | Klon |
| CD19 | gemeinsame B-Zell-antigen | B-Zell-Entwicklung von Pro-B-Zell bis Blastoid B-Zellen und B Plasmazelle | BV421 | 1 ΜL | HIB19 |
| CD3 | gemeinsamen T-Zell-antigen | Thymozyten, T-Lymphozyten und natürlichen Killer T-Zellen | V500 | 3 ΜL | UCHT1 |
| CD56 | stark glykosylierten Adhäsion protein | natürliche Killerzellen und natürlichen Killer T-Zellen | APC | 5 ΜL | HCD56 |
| CD4 | IG-Superfamilie, Typ I transmembranen Glycoprotein | T-Helfer-Zell, Thymozyten, Monozyten/Makrophagen, Typ II natürlichen Killer T-Zellen | PerCP-Cy5.5 | 1 ΜL | RPA-T4 |
| CD8 | Α-Untereinheit eines Disulfid-linked bimolekulare komplexes | zytotoxischen T-Zellen, Thymozyten, Teilmenge der natürlichen Killerzellen | APC-H7 | 2 ΜL | SK1 |
| CD45 | gemeinsamen Leukozyten-antigen | alle menschlichen Leukozyten, Lymphozyten, Monozyten, Granulozyten, Eosinophilen und Thymozyten einschließlich | PE-Cy7 | 1 ΜL | HI30 |
| FACS-Puffer | - | - | - | 10 µl | - |
Tabelle 2: Antikörper für cocktail FACS Panel 2, T und B-Zell-Populationen zu identifizieren. Menge des Antikörpers beschrieben ist für die Analyse einer Probe.
| Makrophagen-panel | ||
| Angussbezeichnung | # Zellen | % der live |
| Einzelne Zellen | 183054 | |
| Leben | 10477 | 100 |
| CD45 | 4100 | 39.13 |
| Dump– | 771 | 7.36 |
| CD11C– CD11B+ | 430 | 4.1 |
| CD11C+ CD11B+ | 104 | 0.99 |
| CD11C+ CD11Bniedrig /- | 15 | 0,14 |
| T-Zellen, B-Zellen, NK-Zell-panel | ||
| Angussbezeichnung | #Cells | % der live |
| Einzelne Zellen | 34616 | |
| Leben | 3728 | 100 |
| CD45+ | 1589 | 42.62 |
| NK-Zellen | 29 | 0.78 |
| CD3+ | 953 | 25,56 |
| CD4+ | 601 | 16.12 |
| CD8+ | 328 | 8.8 |
| CD19+ | 20 | 0,54 |
Tabelle 3. Immunzelle Fülle verschiedener Zelltypen der Mehrwertsteuer. Anzahl der Zellen in jedem Tor und der Prozentsatz der verschiedenen Zelltypen bezogen auf die Gesamtmenge von lebenden Zellen.
Diskussion
Diese Methoden beschreiben, wie die SVF von der Mehrwertsteuer zu isolieren und saß und die relativen Mengen von Immunzellen in diesen Geweben zu quantifizieren. Darüber hinaus geben die Methoden wie die Expression von Markern auf bestimmte Zelltypen zu bestimmen.
Durchflusszytometrie von Immunzellen Gewebe ist eine leistungsfähige Technik für Phänotyp der immunologischen Zustand der Gewebe. Die Quantifizierung der Gewebe Immunzellen kann viele Anwendungen haben. Wie in den Ergebnissen beschrieben, ist es möglich, das Vorhandensein von bestimmten Immunzellen zwischen Gruppen von Patienten (z.B.mageres vs. fettleibig) zu vergleichen. Darüber hinaus können indem auch die Durchflusszytometrie auf Blut von den gleichen Patienten, Assoziationen zwischen zirkulierenden Zellen und Gewebe untersucht werden. Mit dieser Anwendung konnten wir feststellen, dass eine bestimmte Teilmenge der zirkulierenden Monozyten mit Pro-inflammatorischen CD11C verbunden ist+ Fettgewebe Makrophagen16.
Anpassungen des beschriebenen Protokolls werden ihre Anwendungen erweitern, wie zahlreiche verfügbare fluoreszierende Antikörper Durchflusszytometrie sehr vielseitig machen. Mit verschiedenen Antikörpern lassen sich fast alle Zelltypen unterscheiden und der Ausdruck der vielen Marker detektiert werden. Darüber hinaus ist es möglich, Marker intrazellulär zu beflecken, durch permeabilizing der Zellmembran intrazelluläre Bindung von fluoreszierenden Antikörpern zu ermöglichen. Diese Eigenschaften erlauben Unterscheidung der unterschiedlichsten Makrophagen Bevölkerungen über die übermäßig vereinfachten M1 und M2-Makrophagen-Subtypen. Neben der Messung der Oberfläche Marker Ausdruck können Proteine (z.B. Zytokine) intrazellulär mit Informationen über Makrophagen Funktionalität befleckt werden. Darüber hinaus werden Proliferationsmarker wie Ki67 zur Verbreitung Preise zu quantifizieren. Wie beschrieben, basierte Unterscheidung zwischen Makrophagen und DCs auf MFI Ebenen der DC-Marker. Ein allgemeine Makrophagen Marker, wie CD68 kann die Makrophagen-Panel (FACS-Panel 1) integriert werden. CD68 muss jedoch intrazellulär erfordern Permeabilisierung der Zellmembran befleckt werden, das ist nicht besser und das Protokoll erweitern würde. Weitere Makrophagen-Marker sind Teilmenge Markierungen wie CD163 und CD206 oder CD11c, letztere in der hier vorgestellten Makrophagen-Panel integriert.
In unseren FACS-Panels, ein Marker, lebende und tote Zellen zu unterscheiden wurde nicht aufgenommen, was wäre vorzuziehen, weil es einen genauere Ausschluss von abgestorbenen Zellen als die Verwendung von FSC und SSC ermöglicht. Häufig sind die DNA Färbung, Lebensfähigkeit Farbstoffe Propidium Jodid (PI) oder 4', 6-Diamidino-2-Phenylindole (DAPI) sowie freie Amin reagiert Farbstoffe wie die LIVE/DEAD fixierbar tote Zelle färben Kit, die in verschiedenen Dye Farben erhältlich. Jedoch kann nicht PI und DAPI verwendet werden, wenn die Zellen zu fixieren. Wie im Protokoll beschrieben, die LIVE/DEAD fixierbar Red Dead Cell Lebensfähigkeit Färbung in beide Platten integrierbar ohne Auswirkungen auf die gesamte FACS Anspritzung Strategie.
Darüber hinaus werden die Daten ausgedrückt als Prozentsatz der lebenden Zellen, was bedeutet, dass alle Daten sind relativ. Nur durch Eingabe einer genauen, wäre bekannt, Anzahl der Zellen in das Durchflusszytometer es möglich die genauen Zahlen der einzelnen Zelle bestimmen. Eine ungefähre Anzahl von Zellen konnte nach dem zählen der Zellen in der SVF-Fraktion mithilfe einer Zählkammer berechnet werden. Diese Zahl müsste für die Höhe der Biopsie Gewebe verwendet, um die SVF isolieren angepasst werden, aber dies hat Einschränkungen beim lehnen zu fettleibig zu vergleichen. Eine ähnliche Masse von adipösen AT besteht aus weniger Fettzellen, wie sie mit Lipiden gefüllt sind und stark erweitert haben. Dies führe zu einer Unterschätzung der Immunzelle Zahl wenn als Anzahl der Immunzellen pro Gramm bei oder Adipocyte dargestellt.
In Humanstudien erfolgt Einbeziehung von Patienten in der Regel über einen längeren Zeitraum hinweg machen Standardisierung von experimentellen Verfahren von großer Bedeutung. Für den Vergleich von Flow Cytometry Daten zwischen Patienten gibt es mehrere Möglichkeiten. Wie in diesem Protokoll beschrieben, können Zellen vor der Messung erlaubt die Analyse von mehreren Proben am gleichen Tag behoben werden. Dies kann auch erreicht werden, durch das Einfrieren der SVF, bevor sie beflecken, wodurch das Färbeverfahren zwischen allen Proben gleich sein, aber die Lebensfähigkeit der Zellen beeinträchtigt werden könnte. Zu guter Letzt auch in dieser Studie beschäftigt, fluoreszierende Perlen Vergütungsstufen zu installieren sind und Cytometer Tracking Perlen wurden zweimal wöchentlich verwendet, um tägliche Messungen der Cytometer standardisieren. Diese letzte Option ist die effizienteste beim Ausmessen von Proben aus einer Studie, die über einen langen Zeitraum hinweg.
Ein limitierender Faktor für Durchflusszytometrie ist im Allgemeinen die Verwendung der Fluoreszenz. Die Anzahl der Fluoreszenzmarkierungen, die gleichzeitig erkannt werden können ist begrenzt durch Überlappung in Emissionsspektren. Jedoch kann mit smart FACS-Panel-Entwicklung und den Einsatz von mehrere Antikörper Cocktails pro MwSt oder sAT Probe, dieses Problem überwinden, wie in diesem Protokoll beschrieben. Ein wichtiger Aspekt der FACS-Panel-Entwicklung ist FMO Kontrollen. Mithilfe des Fensters mit einer Ausnahme alle Antikörper können potenzielle Autofluoreszenz Ebenen beim Vergleich der FMO mit Vollelement geschätzt werden. Dies ermöglicht genaue Anspritzung von Populationen und diese Verfahren durchgeführt werden, wenn Sie ein neues FACS-Panel einrichten. Darüber hinaus können neue Generationen von FACS-Geräte bis zu 50 Parameter ermöglicht simultane Detektion von vielen Merkmalen pro Zelle erkennen. Ein weiteres Problem im Zusammenhang mit der Fluoreszenz-Aspekt ist die Autofluoreszenz der Zellen, insbesondere Makrophagen. Nach Anregung der Zellen mit dem FACS-Laser (vor allem mit 488 nm Wellenlänge Anregung), diese Zellen emittieren ein Fluoreszenzsignal (hauptsächlich < 640 nm), dass können Überschneidungen mit den Emissions-Spektren des Antikörpers Etiketten17,18. Um dies zu berücksichtigen, sollte ungefärbte Zellen gemessen werden, um festzustellen, die Autofluoreszenz in jedem Kanal. Mit diesem wissen sollten Fluorochromes ausgewählt werden, in denen eine Signalstärke angezeigt, die das Autofluorescent Signal. Diese Autofluorescent Hintergrundsignal sollte bei der Festlegung die gating-Strategie der Bevölkerung berücksichtigt werden. Durch Anwendung dieses Protokolls und intelligente FACS-Panel-Design ist es deshalb möglich, in Tiefe Phänotyp Makrophagen Subtypen. Neue eindeutige AT Makrophagen und deren Funktion charakterisiert werden können.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Wir möchten danken J. van de Steuervermeidung und M. Vroomen (Universität Maastricht, Niederlande), für die technische Unterstützung. Darüber hinaus möchten wir K. Verboven, D. Hansen, J. Jocken, danken und E. Blaak für die Bereitstellung von Blut und Gewebe-Biopsien zum Einrichten dieses Protokolls und der nachfolgenden Experimente verwendet.
Materialien
| Name | Company | Catalog Number | Comments |
| Centrifuge | Hettich Rotanta 460R | 5660 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)-Ham’s F12 | Gibco ThermoFisher | 31330-095 | |
| Collagenase XI from Clostridium histolyticum | Sigma Aldrich | C7657-1g | |
| Collagenase I from Clostridium histolyticum | Sigma Aldrich | C0130-1g | |
| DNAse I from bovine pancreas | Sigma Aldrich | DN25 | |
| NH4Cl | Merck | 1.01145.0500 | |
| Bovine Serum Albumine | Sigma Aldrich | A4503-100 | |
| NaN3 | Merck | 1.06688.0100 | |
| 200 µM syringe Filcons | BD Biosciences | 340613 | |
| 70 µM filter | Greiner Bio-one | 542070 | |
| Fc block / human IgG | Sigma Aldrich | 14506 | |
| Formaldehyde | Merck | 1.04003.2500 | |
| CD11b-BV421 | Biolegend | 301324 | |
| CD19-Fitc | BD Biosciences | 555412 | |
| CD3-Fitc | BD Biosciences | 561807 | |
| CD66b-Fitc | BD Biosciences | 555724 | |
| CD56-Fitc | BD Biosciences | 562794 | |
| CD11c-APC-Cy7 | Biolegend | 337218 | |
| CD45-PE-Cy7 | BD Biosciences | 557748 | |
| CD19-BV421 | Biolegend | 302234 | |
| CD3-V500 | BD Biosciences | 561416 | |
| CD56-APC | Biolegend | 318310 | |
| CD4-PerCP-Cy5.5 | Biolegend | 300528 | |
| CD8-APC-H7 | BD Biosciences | 641400 | |
| CD303-PE | Biolegend | 354204 | |
| CD141-APC | Biolegend | 344106 | |
| FACS-Canto II | BD Biosciences | ||
| 96 v-shape well plate | Greiner Bio-one | 651101 | |
| PBS PH 7.4 | Gibco ThermoFisher | 10010023 | |
| FACS tube 5 mL polystyrene round-bottom tube | Corning | 352052 | |
| IgG from human serum | Sigma Aldrich | I4506 | |
| Anti-Rat Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552844 | |
| Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552843 | |
| LIVE/DEAD Fixable Red Dead Cell Stain Kit | ThermoFisher | L23102 | |
| IKA MS 3 basic shaker | Sigma Aldrich | Z645028-1EA |
Referenzen
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Makki, K., Froguel, P., Wolowczuk, I. Adipose tissue in obesity-related inflammation and insulin resistance: cells, cytokines, and chemokines. ISRN Inflamm. 2013, 139239 (2013).
- DeFuria, J., et al. B cells promote inflammation in obesity and type 2 diabetes through regulation of T-cell function and an inflammatory cytokine profile. Proc Natl Acad Sci U S A. 110 (13), 5133-5138 (2013).
- Elgazar-Carmon, V., Rudich, A., Hadad, N., Levy, R. Neutrophils transiently infiltrate intra-abdominal fat early in the course of high-fat feeding. J Lipid Res. 49 (9), 1894-1903 (2008).
- Han, J. M., Levings, M. K. Immune regulation in obesity-associated adipose inflammation. J Immunol. 191 (2), 527-532 (2013).
- Liu, J., et al. Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice. Nat Med. 15 (8), 940-945 (2009).
- Nishimura, S., et al. CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity. Nat Med. 15 (8), 914-920 (2009).
- Koh, Y. J., et al. Stromal vascular fraction from adipose tissue forms profound vascular network through the dynamic reassembly of blood endothelial cells. Arterioscler Thromb Vasc Biol. 31 (5), 1141-1150 (2011).
- Peinado, J. R., et al. The stromal-vascular fraction of adipose tissue contributes to major differences between subcutaneous and visceral fat depots. Proteomics. 10 (18), 3356-3366 (2010).
- Leggate, M., et al. Determination of inflammatory and prominent proteomic changes in plasma and adipose tissue after high-intensity intermittent training in overweight and obese males. Journal of Applied Physiology. 112 (8), 1353-1360 (2012).
- Divoux, A., et al. Mast cells in human adipose tissue: link with morbid obesity, inflammatory status, and diabetes. J Clin Endocrinol Metab. 97 (9), E1677-E1685 (2012).
- Harford, K. A., Reynolds, C. M., McGillicuddy, F. C., Roche, H. M. Fats, inflammation and insulin resistance: insights to the role of macrophage and T-cell accumulation in adipose tissue. Proc Nutr Soc. 70 (4), 408-417 (2011).
- Lumeng, C. N., Bodzin, J. L., Saltiel, A. R. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J Clin Invest. 117 (1), 175-184 (2007).
- Morris, D. L., Singer, K., Lumeng, C. N. Adipose tissue macrophages: phenotypic plasticity and diversity in lean and obese states. Curr Opin Clin Nutr Metab Care. 14 (4), 341-346 (2011).
- Wentworth, J. M., et al. Pro-inflammatory CD11c+CD206+ adipose tissue macrophages are associated with insulin resistance in human obesity. Diabetes. 59 (7), 1648-1656 (2010).
- Wouters, K., et al. Circulating classical monocytes are associated with CD11c+ macrophages in human visceral adipose tissue. Sci Rep. 7, 42665 (2017).
- Duan, M., et al. Distinct macrophage subpopulations characterize acute infection and chronic inflammatory lung disease. J Immunol. 189 (2), 946-955 (2012).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. J Immunol Methods. 386 (1-2), 101-107 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten