Method Article
Vorbereitung, Reinigung und Anwendung von Fettsäure-haltigen Liposomen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Liposomen mit Single-Kette amphiphilen, weisen insbesondere Fettsäuren unterschiedliche Eigenschaften im Vergleich zu den enthaltenden Diacylphospholipids aufgrund der einzigartigen chemischen Eigenschaften der einzelne Kette amphiphilen. Hier beschreiben wir Techniken für die Vorbereitung, die Reinigung und die Verwendung von Liposomen bestehen teilweise oder ganz von diesen amphiphilen.
Zusammenfassung
Liposomen mit Single-Kette amphiphilen, weisen insbesondere Fettsäuren unterschiedliche Eigenschaften im Vergleich zu denen mit Diacylphospholipids aufgrund der einzigartigen chemischen Eigenschaften dieser amphiphilen. Fettsäure-Liposomen verbessern insbesondere dynamischen Charakter, aufgrund der relativ hohen Löslichkeit des Single-Kette amphiphilen. Ebenso sind Liposomen, die freien Fettsäuren enthält mehr empfindlich auf Salz und zweiwertigen kationen, aufgrund der starken Wechselwirkungen zwischen der Carbonsäure Kopfgruppen und Metall-Ionen. Hier zeigen wir Techniken für die Vorbereitung, Reinigung und die Verwendung von Liposomen bestehen teilweise oder ganz einzelne Kette amphiphilen (z.B. Ölsäure Säuren).
Einleitung
Liposomen oder Vesikel – Fächer begrenzt durch Bilayer Membranen aus amphiphilen Lipiden besteht - fanden Einsatz zahlreiche biomedizinische Anwendungen als Lieferfahrzeuge für pharmazeutische Produkte, Modelle der Zellmembranen, und für die Entwicklung von synthetischen in Zellen. Wir und andere haben auch Liposomen als Modelle der primitive Zelle Membranen in den ersten Lebensjahren beschäftigt. 1 , 2 , 3 , 4 in der Regel in solchen Systemen beschäftigen wir Single-Kette amphiphilen enthält nur ein Lipid-Kohlenwasserstoff-Tail (z.B. Ölsäure), da diese Moleküle einfacher sind, ohne den Vorteil der codierte Protein-Enzyme zu synthetisieren, die moderne Zellen einsetzen.
Liposomen bestehend aus Single-Kette Lipide sind ähnlich denen von Diacylphospholipids gebildet (z. B.1-Palmitoyl-2-Oleoyl -sn- Glycero-3-Phosphocholin oder POPC), dass die Grenze der Bilayer Membranen zusammengesetzt ist. Liposomen gebildet aus entweder Klasse der Lipide können können beibehalten eine gelöste Nutzlast und verkleinert und durch verschiedene Techniken gereinigt werden. Einige wichtige Unterschiede ergeben sich aus der einzigartigen chemischen Eigenschaften des Single-Kette Lipide. Vesikel gebildet durch Phospholipide sind stabil über einen weiten pH-Bereich, während Fettsäure Vesikel nur stabil bei pH-neutral, mild grundlegende (ca. 7-9), die bestimmte pH-Puffer für die Vesikel Vorbereitung erfordert. Die meiste Zeit, enthalten dieser Puffer auch bestimmte lösliche Moleküle für die Kapselung, Vesikel, die entweder funktionelle Materialien (z. B.RNA) sein können für unterteilte biochemische Reaktionen oder einfache fluoreszierende Farbstoffe (z.B., calcein ) für die Vesikel Charakterisierung.
Das Vorhandensein von nur einer einzigen Kohlenwasserstoff-Kette erzeugt eine Membran, die sowohl durchlässiger an gelösten Stoffen, sowie dynamischer ist. Darüber hinaus die Carbonsäure Kopfgruppe in Fettsäuren Ergebnissen in Vesikeln, die empfindlicher auf die Anwesenheit von Salz und zweiwertigen kationen (z.B. Mg2 +) sind vorhanden. Magnesium ist eines der wichtigsten zweiwertigen kationen für katalysieren biochemische Reaktionen im Protozellen für Origin of Life-Studien. In den ersten Lebensjahren vor der Entwicklung von anspruchsvollen Protein-Enzyme kann RNA gewesen sein das dominierende Polymer, aufgrund seiner doppelten Fähigkeit selbst replizieren und Katalyse. Ein repräsentatives Beispiel für eine Magnesium-erfordern RNA bezogene Reaktion nicht-enzymatische RNS kopieren, erstmals in den 1960er Jahren nachgewiesen ist. 5 als chemisch aktivierte RNA-Nukleotide (d.h. 2-Methylimidazolide Nukleotide) an eine bereits vorhandene Grundierung-Vorlage-Komplex gebunden werden, greift die 3'-Hydroxylgruppe des Primers 5'-Phosphat von einem benachbarten aktivierten Monomer zu verdrängen der verlassen-Gruppe (d.h. 2-Methylimidazol) und Formen eine neue Phosphodiester Bindung. Diese RNA-kopieren-Chemie erfordert eine hohe Konzentration von Mg2 +, bei dem chelated sein, um mit Fettsäure Protozellen kompatibel sein soll. 6 weitere Mg2 +-abhängigen Reaktion ist, dass durch den Hammerhead-Ribozym, das ist vielleicht die am besten charakterisierten katalytische RNA katalysiert. Diese Ribozym, das aus zwei kurzen Oligonukleotide wiederhergestellt werden kann, führt eine selbst-Spaltung-Reaktion, die bequem durch eine Gel-Schicht zu überwachen ist. Als solche wird es häufig als ein Modell Ribozym in Origin of Life-Studien eingesetzt. 7 durch eine Anforderung durch diese Ribozym für Unliganded Magnesium, Liposomen in der Regel entstehen durch eine Mischung aus Fettsäuren und Glycerin Fettsäureester, die Magnesium stabiler sind. 8 , 9 in diesem Protokoll präsentieren wir Techniken, die haben wir entwickelt für die Vorbereitung, Manipulation, Charakterisierung von diesen Vesikeln und demonstrieren die Anwendung diese Bläschen als Protozellen auf Host nicht-enzymatische RNA kopieren und Hammerhai ribozyme Katalyse.
Protokoll
(1) Vesikel Vorbereitung
-
Herstellung von Dünnschichten
- Verwenden Sie Gas enge Spritzen, gewisse Lipide übertragen, wie in Tabelle 1.1 , in eine Glasflasche chloroform beschrieben.
- Die resultierende Lösung unter dem Strahl des Stickstoff oder Argon in der Dunstabzugshaube zu verdampfen.
- Vorbehaltlich der daraus resultierenden Dünnschicht Haus Vakuum für mindestens 2 h, Chloroform Rückstände zu entfernen. Die Lipid kann unter Vakuum über Nacht an dieser Stelle belassen werden.
-
Rehydrierung von Vesikeln
- Bereiten Sie 10 mL 5 mM Calcein 250 mM Tris-HCl pH 8.0 Hydratation Puffer durch Auflösung 31 mg Calcein Pulver in 2,5 mL 1 M Tris-HCl pH 8.0 Puffer und Hinzufügen von einem anderen 7,5 mL entionisiertem Wasser (DI vor).
- Pipette 250 µL über Hydratation Puffer in einem Leerrohr und 1,875 µL 10 M NaOH für eine endgültige 75 mM Basis (½ entspricht der gesamten Fettsäuren) hinzufügen. Übertragen Sie die Lösung auf die Dünnschicht des trockenen Lipid, Form Vesikel mit einer gesamten Lipidkonzentration von 0,15 M.
- High-Speed-Einsatz (> 3000 u/min) Vortexer Vortex die resultierende Mischung für 4-5 s.
- Lassen Sie die Lipid-Puffer-Mischung auf eine niedrige Drehzahl (ca. 30 u/min) rotierenden Shaker rehydrieren, mindestens über Nacht.
-
Dimensionierung von Vesikeln (optional)
- Mit einer Pinzette, ein Filter Unterstützung gelten Sie für jede innere Oberfläche der Spritze Häfen des Extruders.
- Nass jeder Filter Unterstützung mit 250 mM Tris-HCl, pH 8.
- Mit einer Pinzette, anwenden einer Track-etched 100 nm Polycarbonat Membran eines Extruders O-Ringe und filter unterstützt. Kümmert sich um nicht reißen oder Punktion der Membran, schieben vorsichtig die Membran in der o-Ring um guten Kontakt zwischen den beiden Flächen zu machen.
- Montieren Sie den Extruder, kümmert sich nicht um die Membran zu verdrängen und Filter unterstützt.
- Füllen Sie eine Extruder-Spritze mit ca. 0,5 mL 250 mM Tris-HCl, pH 8. Legen Sie diese Spritze in eine Seite des Extruders.
- Legen Sie eine leere Spritze in die andere Seite des Extruders.
- Drücken Sie von Hand den Kolben der Spritze mit Puffer langsam (≤ 50 µL/s) und überprüfen Sie, ob Widerstand spürbar ist, darauf hinweist, dass die Track-etched Membran vorhanden und intakt ist. Es empfiehlt sich, diesen Schritt ohne eine Membran im Ort zu üben, um das erwartete Maß an Widerstand zu messen.
- Entfernen Sie und leeren Sie die zwei Spritzen. Es ist nicht notwendig, die beiden Spritzen in diesem Stadium zu reinigen, da sie Puffer mit identischer Zusammensetzung der Liposomen-Vorbereitung enthalten.
- Laden Sie die Liposomen-Vorbereitung in eines der zwei Spritzen.
- Montieren Sie den Extruder mit Spritze mit Vesikel Probe auf der linken Seite und die leere Spritze auf der rechten Seite.
- Drücken Sie von Hand den Kolben der Spritze mit Vesikel Probe sehr langsam (10-25 µL/s).
- Beobachten Sie aufmerksam die Spritze auf der rechten Seite des Extruders; klar Puffer gelangen Sie zunächst in der rechten Seite des Extruders (ca. 50 µL, Dies liegt an der inneren Totvolumen des Extruders), gefolgt von einer kleinen Wolke aus extrudierten Liposomen. Sofort stoppen Sie, an dieser Stelle drücken, ziehen Sie die Spritze auf der rechten Seite des Extruders und entsorgen Sie diese Lösung.
- Ersetzen Sie die Spritze auf der rechten Seite des Extruders und extrudieren Sie bis die linke Spritze leer ist.
- Kehren Sie die Ausrichtung des Extruders und wiederholen Sie Schritt 13. Fahren Sie für die gewünschte Anzahl von Zyklen (in der Regel 7, 9 oder 11); eine ungerade Zahl wird immer verwendet, um sicherzustellen, dass UN-extrudierte Liposomen nicht von der Spritze zunächst mit der Pre-Downsizing Liposomen Vorbereitung gesammelt werden.
- Vorsichtig verzichten Sie den Inhalt der rechten Spritze in ein Eppendorf-Röhrchen zu und legen Sie das Rohr auf eine niedrige Drehzahl (ca. 30 u/min) rotierenden Shaker für ca. 0,5 h.
- Mit Vesikel Reinigung, wie in Abschnitt 2 beschrieben vorgehen. Extrudierte Vesikel sollte innerhalb von 24 h oder wieder vor dem nächsten Mal Gebrauch extrudiert.
(2) Vesikel Reinigung
-
Vorbereitung der Vesikel Reinigung mobile phase
- Bereiten Sie 5 mL 250 mM Tris-HCl pH 8 Hydratation Puffer durch Zugabe von 1,25 mL 1 M Tris-HCl pH 8 Puffer, 3,75 mL VE-Wasser eine 15 ml Falcon-Röhrchen. Fügen Sie dann 37,5 µL 10 M NaOH (½ entspricht der Basis relativ unesterified Fettsäure) in den Puffer Hydratation. Pipette 235 µL reine Ölsäure direkt in der Falcon-Röhrchen, wodurch eine Vesikel-Lösung mit 0,15 M total Lipiden.
- High-Speed-Einsatz (> 3000 u/min) Vortexer Vortex die Mischung für 4-5 s, dann bei niedriger Geschwindigkeit rotierende Shaker für mindestens 2 h im Trockner. Die Lipid-Vorbereitung kann an dieser Stelle über Nacht auf den rotierenden Shaker gelassen werden. Filtern Sie die mobile Phase durch 0,22-μm-Spritze-Filter-Einheit vor Gebrauch, jede mögliche Aggregate zu entfernen.
-
Reinigung von Vesikeln auf Sepharose
- Ca. 5 mL ethanolische Sepharose 4 b Gülle aus der Flasche mit einer Pipette entfernen. Anzuwenden Sie bei einer Chromatographiesäule Einweg-10 mL.
- Lassen Sie die Gülle zu begleichen und Ethanol durchströmten bis Ethanol oben auf das Harzbett nähert.
- Gelten 5 mL entionisiertem Wasser an die Spitze des Harzes und lassen Sie durchströmten Ethanol Rückstände abzuwaschen.
- Anwenden von 250 mM Tris-HCl, pH 8 in 1-2 mL Portionen an die Spitze des Harzes, Anwendung einen neuen Teil jedes Mal, wenn der Flüssigkeitsstand nähert sich der Spitze das Harzbett. Wiederholung für 3 - 5 Mal.
- Klemmen Sie die Spalte auf dem Stativ, dann verbinden Sie die Spitze der Säule mit Absperrhahn Stecker und Schläuche für die Fraktionssammler. Fügen Sie einen anderen Teil des Puffers zu spülen Sie den Schlauch, der Absperrhahn schließen, wenn der Flüssigkeitsstand in Spalte nähert sich der Spitze des Harzes.
- Auftragen Sie die extrudierten Vesikel aus Abschnitt 1 an die Spitze des Harzes mit einem 200 µL Pipette, kümmert sich um die Vesikel Vorbereitung so gleichmäßig wie möglich auf das Harz anwenden, ohne Berührung der Harz Bett oder Spalte Wand
- Öffnen Sie den Absperrhahn zu beginnen, den Fluss und sammeln Sie Brüche in einer 96-Well-Platte. Gelten Pustelbildungsphase Reinigung mobile an die Spitze des Harzbettes in 0,5-1 mL Portionen, da der Puffer kümmert sich nicht um das Harzbett verbraucht austrocknen lassen,. Sammeln Sie in fünf Tropfen Brüche, sammeln von mindestens 36 Brunnen (drei Reihen von einer 96-Well-Platte).
-
Fluoreszenz-Charakterisierung der Reinigung Brüche
- Die 96-Well-Platte aus dem vorherigen Abschnitt zu nehmen und auf einem Teller-Reader zu lesen (λex= 485 nm, λEm= 515 nm).
- Darstellen Sie die Ergebnisdaten Fluoreszenz als Fluoreszenz vs. Bruchteil Zahl. Vesikel eluieren zuerst, gefolgt von den unvergossene Bruch (Abbildung 1).
-
Repurification von Vesikeln, Vesikel Leckage zu überwachen
- Wiederholen Sie die Aufreinigung und Charakterisierung in Abschnitte 2.2 und 2.3. Vesikel, die ihren Inhalt bewahrt haben zeigen keine Spitze unvergossene gelösten (oder einer sehr kleinen von ca. 5-10 % der Intensität des Vesikels Peak).
3. Nutzung der Vesikel in Anwesenheit von Magnesium
-
Verwendung von Unliganded magnesium
- Bereiten Sie und reinigen Sie Vesikeln zu, wie in den Abschnitten 1, 2.1 und 2.2 beschrieben.
- Bereiten Sie 1 mL 50 mM MgCl2 Lösung in 250 mM Tris-HCl pH 8.0 Puffer indem 250 µL 1 M Tris-HCl pH 8.0 Puffer und 50 µL 1 M MgCl2 an 700 µL DI Wasser. Wirbel um gut zu mischen.
- Um die gewünschte Magnesiumkonzentration von 5 mM zu geben, 0,9 mL gereinigtes Vesikel und 100 µL der Magnesium-Lösung verrühren Sie und schnell um die Vesikel Störungen durch vorübergehende Aussetzung von Vesikeln zu hohe lokale Konzentration von Magnesium zu minimieren.
Hinweis: Schnelle Vermischung von Magnesium Lösung ist entscheidend für die Stabilität der Vesikel. Wenn Magnesium und Vesikel nicht schnell durch sofortige vortexen gemischt, werden höhere Konzentrationen von Magnesium, was zu inkonsistenten Ergebnissen von Probe zu Probe einige Vesikel ausgesetzt werden. - Lassen Sie die Vesikel Probe auf ein Becher für mindestens 30 min vor Repurification wie unter 2.4 Inhalt Dichtheit zu überprüfen. Die Repurification mobile Phase die gleiche Konzentration an Magnesium wie Vesikel Beispiel hinzufügen.
-
Verwendung von liganded magnesium
- Bereiten Sie und reinigen Sie Vesikeln zu, wie in den Abschnitten 1, 2.1 und 2.2 beschrieben.
Hinweis: Verwenden Sie ½ gleichwertige KOH statt NaOH zu Deprotonate Fettsäuren; Es wurde festgestellt, dass diese stabilere Liposomen in Chelat MgCl2 Systeme produziert. - Vorbereitung 2M Kalium-Citrat-Lösung und Anpassung pH bis 8.0 mit KOH.
- Premix MgCl2 und Kalium Citrat im angegebenen Verhältnis (ca. 1:4 für stabile Ölsäure Vesikel) in 250 mM Tris-HCl pH 8.0 Puffer.
- Die Vesikel Probe, kurz Wirbel vorgemischten Magnesium-Citrat-Lösung hinzufügen.
Hinweis: Immer premix Magnesium und Liganden Lösung. Setzen Sie niemals Vesikel, unchelated Magnesium Lösung allein. - Lassen Sie die Vesikel Probe auf ein Becher für mindestens 30 Minuten vor Repurification, wie in 2.4 beschrieben. Die Repurification mobile Phase die gleiche Konzentration an Magnesium und Citrat wie die Vesikel-Beispiel hinzufügen.
- Bereiten Sie und reinigen Sie Vesikeln zu, wie in den Abschnitten 1, 2.1 und 2.2 beschrieben.
(4) nicht-enzymatische RNA in Vesikeln kopieren
-
Vorbereitung der Monodisperse RNA gekapselt Vesikel
- Bereiten Sie einen trockenen Ölsäure-Film, wie in Abschnitt 1.1 beschrieben.
- Bereiten Sie Vesikel Rehydratation Puffer mit 50 µM Leuchtstoff beschrifteten RNA-Primer, 150 µM RNA-Vorlage und 250 mM Tris-HCl pH 8.0 mit ½ gleichwertige KOH relativ Ölsäure.
- Lipid-Film 250 µL Rehydratation Puffer hinzu, und folgen Sie den Schritten 1.2.2 und 1.2.3 Vesikel mit insgesamt 0,15 M Lipidkonzentration zu machen.
- Um kleine Unilamellar Monodisperse Bläschen bilden, folgen Sie Abschnitt 1.3 für die Vesikel Extrusion.
-
Magnesium-Citrat Zusatz und telson Reinigung
- Premix Magnesium und Citrat Bestände und mischen Sie dies mit der Vesikel Probe zu einer endgültigen Lipidkonzentration von 0,1 M.
- Bläschen auf Sepharose 4 b Spalte "Größe Ausgrenzung", mit 250 mM Tris-HCl pH 8.0, 0,1 M Lipide und Magnesium und Citrat als mobile Phase zu reinigen.
- Sammeln Sie Vesikel Brüche durch folgenden Abschnitt 2.3.
-
Primer-Extension-Reaktion
- 200 mM 2-MeImpG (Guanosin 5'-Monophosphate 2-Methylimidazolide)-Stammlösung mit 250 mM Tris-HCl pH 8.0 vorbereiten. (Anmerkung: folgen früheren veröffentlichten Protokoll10 für die Synthese von 2-MeImpG.)
- Primer-Extension-Reaktion zu initiieren, übertragen Sie 150 µL der Stammlösung 2-MeImpG auf 450 µL Vesikel Probe, eine Endkonzentration von Lipid 75 mM und 50 mM aktiviert Monomer zu erreichen. Start des Timers und halten die Reaktion probieren Sie taumeln aller Zeiten.
- (Optional) Übertragen Sie für kontinuierliche frische Monomer Fütterung 300 µL der Reaktionslösung zu einer Kammer von einem Labor konstruiert kleinvolumigen Liposomen Dialysator11 und Put 300 µL Fütterung Lösung in die andere Kammer. Die Fütterung Lösung sollte alle Zutaten in der gleichen Konzentration wie in der Reaktionslösung, mit Ausnahme der RNA mit Vesikeln mit leeren Vesikeln zu ersetzen. Jeder Runde der Dialyse dauert 1-24 h, je nach Analyt und Membran verwendet.
- Für kinetische Untersuchungen nehmen 100 µL aliquoten zu jedem Zeitpunkt, und repurify den Aliquoten durch eine Sepharose 4 b Größe Ausgrenzung Spalte mit 250 mM Tris-HCl pH 8.0 als mobile Phase.
- Sammeln Sie die Vesikel Fraktionen in einem 1,5 mL Eppendorf-Röhrchen.
- Pipette Triton Vesikel Fraktionen auf eine endgültige rund 0,1 % V/V.
- Das Rohr 0,5 mL kaltem Ethanol hinzu und Inkubation bei-20 ° C für mindestens 2 h.
- Zentrifugieren Sie die Proben bei 16,1 × 1000 Rcf (16,1 × g) für 10 min und sanft Pipette, die Flüssigkeiten. Waschen die RNA mit kaltem Ethanol 70 % und Zentrifuge pellets wieder für 5 min. verwerfen Sie die Flüssigkeit und habe das Rohr mit RNA-Pellets auf eine 80 ° C Hitze Block für 2 min residual Äthanol verdunsten. Lösen Sie die Pellets in 50 µL von 8 M Harnstoff mit 1xTBE laden Puffer.
-
Seitenanalyse
- Bereiten Sie 20 % Seite Gel durch das Mischen von 200 mL des UreaGel Systems-Konzentrat, 25 mL des UreaGel Systems Verdünnungsmittel, 25 mL 10xTBE Puffer, 80 µL TEMED und 250 mg Ammonium bleichen. Schnell die Gel Mischung zwischen eingespannten Gel Platten (35 cm × 45 cm) und legen Sie den Kamm. Warten Sie mindestens 30 min bis vollständige Polymerisation.
- Montieren Sie die Gelplatte auf dem Gel-Ständer und füllen Sie die Gel-Boxen mit 1xTBE Gel Puffer ausgeführt. Nehmen Sie den Kamm und spülen Sie die Brunnen mit Spritze. Pre laufen Sie Gel mit 60 W für 30 min.
- Die Proben auf 80 ° C Hitze Block für 2 min erwärmen und 5 µL jeder Probe pro Bohrloch zu laden.
- Gel-Power-Box schalten Sie und stellen Sie laufen mit konstanter Watt bei 60 W für 2,5 h Gel.
- Zerlegen der Gelplatte vom Gel Stand, wischen Sie das Glas und legen Sie die ganze Platte in Gel-Scanner das Gel Scannen beginnen.
- Das Gel mit ImageQuant TL 1D Analyse zu quantifizieren. Plot der natürlichen Logarithmus des Verhältnisses der Höhe der Grundierung zu einem bestimmten Zeitpunkt auf den ursprünglichen Betrag des Primers vs. Zeit übrig, in eine Zeile passen und berechnen die Pseudo-erste Ordnung Reaktionsgeschwindigkeit (Abbildung 2).
5. Hammerhead RNA selbst Spaltung in Vesikeln
- Vorbereitung und Reinigung von Ribozym gekapselt in Vesikeln
- Bereiten Sie eine Lipid-Dünnschicht (OA: GVO = 9:1) wie in Abschnitt 1.1 mit Komponenten wie in Tabelle 1.2. Hinweis: warme GVO auf mindestens 60 ° C zum vollständigen schmelzen vor der Verwendung.
- Vesikel Rehydratation Puffer mit 5 µM jedes Hammerhead-Ribozym-Strang und 250 mM Tris-HCl pH 8.0 vorbereiten.
- Die Lipid-Film 250 µL Rehydratation Puffer hinzu, und befolgen Sie Schritte 1.2.2 und 1.2.3 zu Vesikeln mit 0,15 M total Lipidkonzentration.
- Um kleine Unilamellar Monodisperse Bläschen bilden, folgen Sie Abschnitt 1.3 für die Vesikel Extrusion.
- Bläschen auf einer Sepharose 4 b Größe Ausgrenzung Spalte mit 250 mM Tris-HCl pH 8.0, 0,15 M gemischt Lipide als mobile Phase zu reinigen.
-
Hammerhai Ribozyme selbst-Spaltung Reaktion
- Magnesium-Lösung zubereiten und mischen mit gereinigtem Vesikel, wie beschrieben in Abschnitt 3.1, die selbst-Spaltung-Reaktion zu initiieren.
- Für kinetische Untersuchungen 100 µL des Gemisches zu jedem Zeitpunkt zu nehmen und direkt repurify dieser aliquoten durch eine Sepharose 4 b Größe Ausgrenzung Spalte mit 250 mM Tris-HCl pH 8.0 als mobile Phase. Die Vesikel Bruchteil zu sammeln.
-
Seitenanalyse
- Führen Sie die Schritte 4.3.6 zu 4.3.8 um RNA laden Probe vorzubereiten.
- Kommerziell gegossen 15 % FSME-Urea Gel in Gel-Box und füllen Sie die Gel-Box mit 1xTBE Gel laufen Puffer zu.
- Die Proben auf 80 ° C Hitze Block für 1 min erwärmen und 5 µL jeder Probe pro Bohrloch zu laden.
- Führen Sie das Gel mit konstant 200 V für ca. 1 h.
- Scannen Sie das Gel.
- Das Gel mit einer Analysesoftware, wie ImageQuant TL 1D zu quantifizieren, um das Ausmaß der Spaltung zu messen, durch den Vergleich der Intensität der verbleibende Substrat RNA Band und gespalten RNA fragment Band (Abbildung 3).
(6) riesige Fettsäure Vesikel für die Mikroskopie
-
Vorbereitung von riesigen Fettsäure Vesikeln
- Folgen Sie Abschnitt 1.1 und Tabelle 1.3 vorzubereiten einem Ölsäure Dünnschicht mit 0,2 Mol% Eindringmittel beschrifteten Lipid für bessere Membran Beobachtung.
- Lipid-Film mit 500 µL 250 mM Tris-HCl pH 8.0 die Vesikel Probe 10 mM Lipide in insgesamt zu rehydrieren. Der Puffer kann Fluoreszenzfarbstoffen oder RNA-Moleküle enthalten, falls gewünscht. Verlassen Sie Vesikel Probe taumeln über Nacht.
- Bereiten Sie 150 mL reinen Fettsäure-Dialyse-Puffer mit 10 mM insgesamt Lipide durch Mischen von 470 µL Ölsäure und 150 mL 250 mM Tris-HCl pH 8.0 mit ½ gleichwertige NaOH.
- Extrudieren Sie die Vesikel Probe durch eine 10 µm Polycarbonat Membran, große Aggregaten zu entfernen.
- Übertragen Sie die Vesikel Probe in 1 µm große Pore Dialyse Kassette, wie zuvor beschrieben. 12
- Legen Sie die Dialyse-Kassette in einen 100-mL-Becherglas mit 30 mL-Dialyse-Puffer. Schütteln Sie den Becher sanft auf eine Tischplatte Shaker bei 80-100 u/min.
- Ändern des Dialyse-Puffers alle 30 min. 5 Mal kostenlos Farbstoffe oder RNA und kleine Bläschen zu entfernen.
- Entfernen Sie vorsichtig die Vesikel-Probe aus der Dialyse-Kassette mit einer Spritze und Transfer in ein Eppendorf-Röhrchen.
-
Mikroskopie-Beobachtung
- Pipette 10 µL von Vesikeln auf einen sauberen standard Objektträger und Deckglas ein Glas über die Probe legen. Versiegeln Sie Deckglas mit transparenten Nagellack.
- Beobachten Sie die Vesikel mit einem 60 X Öl-Dispersion oder ähnlicher Zielsetzung durch konfokale Mikroskopie mit der geeignete Laserquelle für Gewebekulturen beschriftet Membran, RNA oder gekapselte Farbstoff (Abbildung 4).
Ergebnisse
Wir führen in der Regel Liposomen Reinigungen auf Größe-Ausschluss Spalten. Typische Liposomen Präparate enthalten einen Fluorophor irgendeiner Art. Wenn Liposomen erzeugt und extrudiert werden, sind die Arten verkapselt werden vorhanden, sowohl innerhalb als auch außerhalb der Liposomen. Durch die Reinigung Liposomen auf eine Größe-Ausschluss-Harz (Sepharose 4 b), werden unvergossene solute innerhalb der Poren des Harzes, beibehalten, während die größeren Liposomen nicht sind und zuerst (Abbildung 1A eluieren). Sammeln von Brüchen und Plotten Fluoreszenz vs. Bruchteil Nummer (Abbildung 1 b) in der Regel ergibt sich eine zwei-Spitze-Spur, mit den frühen freisetzende Fraktionen entsprechend der Liposomen, die dann gesammelt und in folgenden Anwendungen eingesetzt.
Wir untersuchen häufig nichtenzymatische Grundierung Erweiterung Reaktionen, die wahrscheinlich Mittel RNA-Replikation vor der Entstehung von Ribozym und Protein-basierten RNA-Polymerasen waren. Diese Reaktionen beschäftigen normalerweise Eindringmittel beschriftete Primer (Abbildung 2A), die von aktivierten Monomeren erweitert wird. Diese Reaktionen können durch Gelelektrophorese (Abb. 2 b) überwacht werden und die sich daraus ergebenden Electropherograms integriert Geschwindigkeitskonstanten für eine bestimmte Reaktion Bedingung (Abbildung 2) zu erhalten.
Um zu demonstrieren, dass RNA im Inneren Protozellen funktionieren könnte, beschäftigen wir Hammerhai Ribozyme selbst-Spaltung (Abbildung 3A) als Modell RNA katalytische Reaktion. Diese Reaktion erfordert freie Mg2 + Katalyse zu erleichtern und somit wir OA/GVO Vesikel zugrunde gelegt, da sie in Anwesenheit von 5 mM Mg2 +stabil sind. Ähnlich wie bei der Grundierung Erweiterung Reaktionen, Hammerhai Ribozyme selbst-Spaltung kann das Verhalten auch durch Gelelektrophorese (Abb. 3 b) überwacht und später analysiert werden, um die Rate konstant unter bestimmten Bedingungen (Abbildung 3) erwerben.
Wir Bild Liposomen beschäftigen beide Fluoreszenz und Durchlicht. Liposomen können beschriftet werden, mit fluoreszierenden Lipide, die eine Membran-Label (Abb. 4A) zu geben, oder mit einem fluoreszierenden gelösten innerhalb ihrer Lumen (Abbildung 4 b). Durchlicht kann auch verwendet werden, um Bläschen (siehe auch Abbildung 4 b) zu beobachten.
| Tabelle 1.1 reine Ölsäure in chloroform | |||
| Komponente | Lager | Betrag | |
| Ölsäure | > 99 % | 11.7 ΜL | |
| Chloroform | 1 mL | ||
| Tabelle 1.2 Ölsäure und Glycerin Monooleate (9:1) in chloroform | |||
| Komponente | Lager | Betrag | |
| Ölsäure | > 99 % | 10.5 ΜL | |
| Glycerin-monooleate | > 99 % | 1,4 ΜL | |
| Chloroform | 1 mL | ||
| Tabelle 1.3 Ölsäure mit Rhodamin-PE 0.2mol% in chloroform | |||
| Komponente | Lager | Betrag | |
| Ölsäure | > 99 % | 1.6 ΜL | |
| Rhodamin-PE in chloroform | 10 mM | 20 ΜL | |
| Chloroform | 1 mL | ||
Tabelle 1. Fettsäure Chloroform Lösungen.
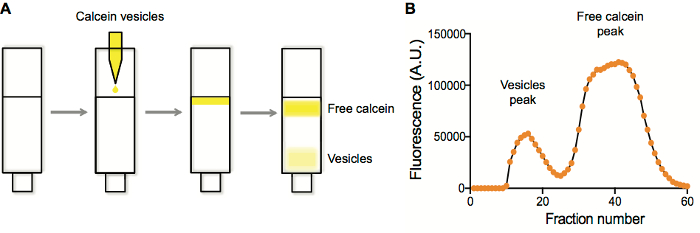
Abbildung 1: Vesikel Reinigung und Fluoreszenz Charakterisierung der Reinigung Bruchteil. A. Trennung von Vesikeln mit Calcein aus freien Calcein auf einer Sepharose-4 b-Säule. B. Vesikel und kostenlose Calcein Peak Erkennung durch die Fluoreszenz in jede Vertiefung vs. gut Anzahl nach Fraktionssammlung Plotten. Bitte klicken Sie hier für eine größere Version dieser Figur.
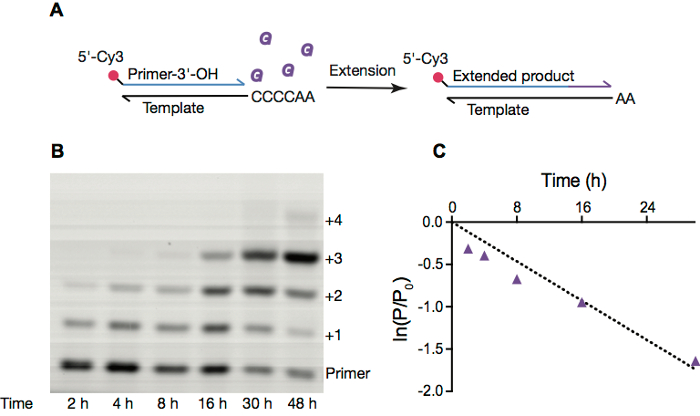
Abbildung 2: Nicht-enzymatische RNA-Replikation in OA Vesikel. A. Schema der nicht-enzymatische RNA-Primer-Extension. B. Seitenbild einer Grundierung Erweiterung Reaktion im Inneren reine Ölsäure Vesikel, mit Bedingungen wie in Abschnitt 4. C. Linear des natürlichen Logarithmus des Verhältnisses der Grundierung verbleibende zu gegebenen Zeitpunkt auf den ursprünglichen Betrag des Primers vs. Zeit über 30 h. Reaktionsgeschwindigkeit passen, aus dem Hang des ln (P/P0) Vs Zeit berechnet, 0,058 h-1ist. Bitte klicken Sie hier für eine größere Version dieser Figur.
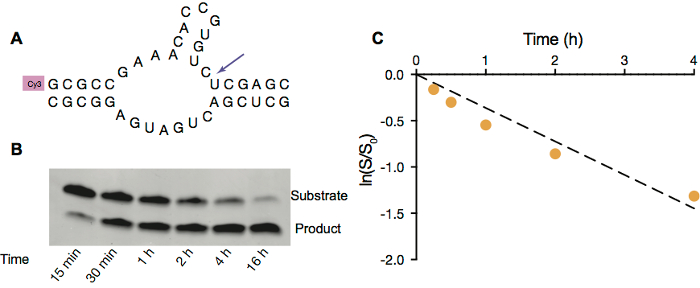
Abbildung 3. Hammerhai Ribozyme Spaltung in OA/GVO Vesikel. A. Schema der Hammerhai Ribozyme Spaltung von Eindringmittel beschrifteten Substrat Strang (oben). B. Seitenbild Hammerhai Ribozyme Spaltung innerhalb OA/GVO Vesikel mit 5 mM Mg2 +. C. Ribozym Aktivität im Inneren der Bläschen. Lineare Anpassung des natürlichen Logarithmus des Verhältnisses der Substratmenge, die übrigen an gegebenen Zeitpunkt auf den ursprünglichen Betrag des Substrats vs. Zeit in den ersten 4 Std. Reaktion, berechnet von der Piste von ln (s/s0) Vs Zeit beträgt 0,36 h-1. Bitte klicken Sie hier für eine größere Version dieser Figur.
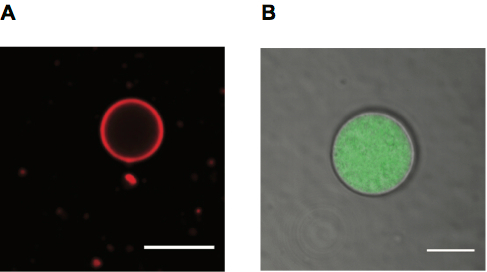
Abbildung 4. Riesige Fettsäure Vesikel für die Mikroskopie. A. konfokalen Mikroskopie Bild von einem Rhodamine PE bezeichnet Ölsäure Bläschen, Skala bar 10 μm. B. konfokalen Mikroskopie Bild Ölsäure Vesikels mit Alexa488 beschriftet RNA mit Membran im übertragenen Detektor (TD) Kanal, Skala bar 5 μm angezeigt.
Diskussion
Liposomen aus Fettsäuren gebildet wurden von vielen als mögliche Modelle für primitive Zellen aufgrund ihrer hohen Durchlässigkeit und dynamischen Eigenschaften vorgeschlagen. Carboxylic Kopfgruppe der einzelnen Fettsäuren ermöglicht nur Selbstmontage in Membranen in einem eingeschränkten pH-Bereich, und die daraus resultierende Membranen sind sehr empfindlich auf die Anwesenheit von Salzen. Infolgedessen benötigen Fettsäure Vesikel verschiedene Vorbereitung und Handhabung Methoden verglichen mit Phospholipid Vesicles.
In diesem Protokoll, obwohl wir Ölsäure als Beispiel für die Bildung von Liposomen, verwenden andere lange Kette ungesättigten Fettsäuren (C14) und deren Derivate (ca. Myristoleic Säure, Palmitolein Säure und die entsprechenden Alkohole und Glycerin-Ester) auch Bläschen bilden nach der Dünnschicht Rehydratation Methode, solange die gesamte Lipidkonzentration oberhalb der Cmc und der Hydratation Puffer pH-Wert liegt in der Nähe der PKA-Wert der Fettsäure in der Membran. Anders als Tris-HCl-Puffer in diesem Protokoll verwendet, wurden andere Puffersysteme (ca. Bicine, Phosphat, Borat) Fettsäure Vesikel Bildung, Unterstützung berichtet, obwohl Vesikel gebildet Phosphat oder Borat Puffer in der Regel sehr undichten13 sind. Die daraus resultierenden Fettsäure-Vesikel nach Rehydratation sind Polydisperse und multilamellar, aber sind leicht umgewandelt in kleinen Monodisperse Unilamellar Vesikel durch Extrusion wie beschrieben. Verglichen mit Beschallung als alternative Methode zur Erzeugung von kleinen Bläschen, bietet Extrusion mehr Optionen für die Kontrolle der Vesikelgröße durch die Anwendung verschiedener Pore Größe Membranen. Vesikeln nach Extrusion sind in der Regel etwas größer als die Porengröße der Membran, sondern durch die Erhöhung der Anzahl der Zyklen der Extrusion, Vesikel mit einem schmaleren Größenverteilung und einer durchschnittlichen Größe in der Nähe der Porengröße der Membran erzielt werden.
Fettsäure-Vesikel müssen um funktionale Protozellen synthetisieren, Host spezifische biochemische Reaktionen durch die Kapselung der RNA oder andere Bausteine. Die Dünnschicht-Rehydration-Methode bietet eine einfache Möglichkeit zur Form Vesikel, die gewünschte gekapselte Materialien enthalten. Jedoch die Kapselung Effizienz ist relativ gering und ein großer Teil der wertvollen Materialien wie RNA sind in der Regel verloren während des Reinigungsprozesses. In einigen Fällen kann die Kapselung Effizienz bescheiden durch wiederholte Frost-Tau-Zyklen vor der Extrusion verbessert werden. Mikrofluidische Methoden für die high-Yield-Vorbereitung der Phospholipid-Liposomen ermöglichen fast 100 % Kapselung Effizienz jedoch analoge Methoden für Fettsäure Vesikel noch nicht entwickelt worden.
Wenn durchgesickert Handhabung Protozellen mit Chelat oder freien Mg2 +, Reinigung nach Magnesium Lösung Additions- und Repurification vor jeden Zeitpunkt sorgt für die Entfernung von Material, das die Genauigkeit der Reaktionsgeschwindigkeit beeinträchtigen könnten gekapselt Messungen in Vesikeln. Da jede Reinigung mindestens 10 min dauert, gute Trennung zu erreichen und Vesikel Brüche zu sammeln, die Analyse der schnelle Reaktionen ist schwierig, und die Reaktion muss vor der Spalte Repurification gestoppt werden.
Das Protokoll, das wir hier vorstellen ist gut geeignet für den Bau von Fettsäure-Liposomen, die als host Reaktionen imitiert diejenigen, die in primitiven Zellen auftreten können. Unsere Protokolle ermöglichen auch Anwendungsmöglichkeiten bei der Entwicklung der biomedizinischen Trägersysteme und Bioreaktoren für andere biochemischen Reaktionen.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
J.W.S. ist ein Ermittler des Howard Hughes Medical Institute. Diese Arbeit wurde zum Teil durch einen Zuschuss (290363) der Simons-Stiftung an J.W.S. unterstützt A.E.E. und K.P.A. bestätigen Unterstützung aus Mitteln der University of Minnesota Start.
Materialien
| Name | Company | Catalog Number | Comments |
| sephorose 4B | SIGMA-ALDRICH INC | 4B200 | |
| calcein | SIGMA-ALDRICH INC | C0875-10G | |
| tris-HCl pH8.0 1M | LIFE TECHNOLOGIES CORP | AM9851 | |
| citric acid | SIGMA-ALDRICH INC | 251275-500G | |
| sodium hydroxide | SIGMA-ALDRICH INC | 71690-250G | |
| potassium hydroxide | Sigma | 30614 | |
| oleic acid | Nu-Chek | U-46-A | |
| glycerol monooleate | Nu-Chek | M-239 | |
| Liss Rhodamine-PE | LIFE TECHNOLOGIES CORP | L1392 | |
| magnesium chloride | Fisher/Thermo Fisher Scientific | AM9530G | |
| sequagel concentrate | National Diagnostics | EC-830 | |
| sequagel DILUENT | National Diagnostics | EC-840 | |
| 15% TBE-UREA GEL | Thermo Fisher Scientific | EC68852BOX | |
| urea | Sigma Aldrich | U6504-500G | |
| titon-100x | SIGMA-ALDRICH INC | T9284-100ML | |
| RNA primer | IDT | 5'Cy3-GCG UAG ACU GAC UGG | |
| RNA template | IDT | 5'-AAC CCC CCA GUC AGU CUA CGC | |
| hammerhead substrate strand | IDT | 5'Cy3-GCG CCG AAA CAC CGU GUC UCG AGC | |
| hammerhead ribozyme strand | IDT | 5'GGC UCG ACU GAU GAG GCG CG | |
| vesicle extruder set | AVANTI POLAR LIPIDS | 610000 | |
| fraction collector | Gilson, Inc. | 171041 | |
| 96-well plates | Fisher | NC9995941/675 | |
| plate reader | Molecular Devices | SpectraMax i3 | |
| confocal microscope | Nikon | Nikon A1R MP Confocal | |
| gel scanner | GE Healthcare Life Sciences | Typhoon 9410 scanner |
Referenzen
- Hanczyc, M. M., Fujikawa, S. M., Szostak, J. W. Experimental Models of Primitive Cellular Compartments: Encapsulation, Growth, and Division. Science. 302, 618-622 (2003).
- Mansy, S. S., Schrum, J. P., Krishnamurthy, M., Tobé, S., Da Treco, ., Szostak, J. W. Template-directed synthesis of a genetic polymer in a model protocell. Nature. 454 (7200), 122-125 (2008).
- Apel, C. L., Deamer, D. W., Mautner, M. N. Self-assembled vesicles of monocarboxylic acids and alcohols: conditions for stability and for the encapsulation of biopolymers. Biochim. Biophys. Acta. 1559 (1), 1-9 (2002).
- Walde, P., Wick, R., Fresta, M., Mangone, A., Luisi, P. L. Autopoietic Self-Reproduction of Fatty Acid Vesicles. J. Am. Chem. Soc. 116 (26), 11649-11654 (1994).
- Sulston, J., Lohrmann, R., Orgel, L. E., Todd Miles, H. Nonenzymatic Synthesis of Oligoadenylates on a Polyuridylic Acid Template. Proc. Natl. Acad. Sci. U. S. A. 59 (3), 726-733 (1967).
- Adamala, K., Szostak, J. W. Nonenzymatic template-directed RNA synthesis inside model protocells. Science. 342 (6162), 1098-1100 (2013).
- Uhlenbeck, O. C. A small catalytic oligoribonucleotide. Nature. 328 (6131), 596-600 (1987).
- Chen, I. A., Salehi-Ashtiani, K., Szostak, J. W. RNA catalysis in model protocell vesicles. J. Am. Chem. Soc. 127 (38), 13213-13219 (2005).
- Adamala, K. P., Engelhart, A. E., Szostak, J. W. Collaboration between primitive cell membranes and soluble catalysts. Nat. Commun. 7, 1-7 (2016).
- Joyce, G. F., Inoue, T., Orgel, L. E. RNA Template-directed Synthesis on Random Copolymers. J. Mol. Biol. 176, 279-306 (1984).
- Adamala, K., Engelhart, A. E., Kamat, N. P., Jin, L., Szostak, J. W. Construction of a liposome dialyzer for the preparation of high-value, small-volume liposome formulations. Nat. Protoc. 10 (6), 927-938 (2015).
- Zhu, T. F., Szostak, J. W. Preparation of large monodisperse vesicles. PloS one. 4 (4), e5009 (2009).
- Zhu, T. F., Budin, I., Szostak, J. W. Vesicle extrusion through polycarbonate track-etched membranes using a hand-held mini-extruder. Methods Enzym. 533, (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten