Method Article
Anpassung der Mikroelektrode-Array-Technologie für das Studium der Anästhesie-induzierte Neurotoxizität im Gehirn intakt Ferkel
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Studie untersucht die neuartige Verwendung von Enzymbasis Mikroelektrode Array (MEA) Technologie zur Überwachung der in Vivo Aktivität der Neurotransmitter bei Ferkeln. Die Hypothese war, dass Glutamat Dysregulation der Mechanismus der Narkose Neurotoxizität beiträgt. Hier präsentieren wir Ihnen ein Protokoll zur MEA-Technologie, um den Mechanismus des Anästhesie-induzierte Neurotoxizität studieren anzupassen.
Zusammenfassung
Jedes Jahr werden Millionen von Kindern Narkose für eine Vielzahl von Verfahren unterzogen. Jedoch haben Studien an Tieren und Menschen die Sicherheit der Narkose bei Kindern, Verwicklung Anästhetika als potenziell giftig für das Gehirn in der Entwicklung in Frage gestellt. Bislang keine Studien haben erfolgreich die Mechanismen aufgeklärt durch die Narkose neurotoxischen sein kann. Tierexperimentellen Studien erlauben Untersuchung solcher Mechanismen und Neugeborenen Ferkel stellen ein hervorragendes Modell, diese Effekte aufgrund ihrer entwicklungspolitischen auffallenden Ähnlichkeiten zum menschlichen Gehirn zu studieren.
Dieses Protokoll passt sich den Einsatz von Enzym-basierte Mikroelektrode (MEA)-Array-Technologie als ein neuartiger Weg, um die Mechanismen der Anästhesie-induzierte Neurotoxizität (AIN) zu studieren. MEAs ermöglichen Echtzeit-Überwachung von in Vivo Aktivität der Neurotransmitter und bieten außergewöhnliche zeitlicher und räumlicher Auflösung. Es wird vermutet, dass die Narkose Neurotoxizität wird teilweise durch Glutamat Dysregulation verursacht und MEAs bieten eine Methode zur Messung der Glutamat. Die neuartige Umsetzung der MEA-Technologie in einem Ferkel-Modell stellt eine einzigartige Gelegenheit für das Studium der AIN.
Einleitung
Jedes Jahr werden Millionen von Kindern Narkose für invasive und nicht-invasive Verfahren in die Vereinigten Staaten1unterzogen. Jahrelang haben die Anästhesie Anbieter Eltern der Sicherheit von Anästhetika, auch bei Kleinkindern und Neugeborenen versichert. Jedoch im Jahr 1999 festgestellt wurde, dass vorübergehende Blockierung des N-Methyl-D-Aspartat-(NMDA)-Untertyp von Glutamat-Rezeptoren im frühen Leben könnten weit verbreitete neuronale Apoptose in Ratten2verursachen. Vor kurzem veröffentlicht die FDA eine Medikament Sicherheit Kommunikation, die die Etiketten von Anästhetika, enthält eine Warnung über allgemeine Anästhesie und ihre potenzielle negative Auswirkungen auf die entwickelnden Gehirn von Kindern, die jünger als 3 Jahre alt werden muss (US Food und Drug Administration, 2017). Allerdings gibt es immer noch notwendig, mögliche Mechanismen und mögliche neuroprotektive Maßnahmen aufzuklären.
Normale Aktivität der Neurotransmitter wie Glutamat und Gamma-Aminobuttersäure (GABA) sind entscheidend für die normale Neurodevelopment auftreten. Obwohl die meisten der Beteiligten in AIN Bahnen immer noch schwer, dürften Neurotransmitter-Systeme sehr beteiligt sein, da Betäubungsmittel bekannt sind, zu modulieren, diese Wege zu Bewusstlosigkeit zu produzieren. Die exzitatorische Neurotransmitter Glutamat verursacht insbesondere Excitotoxizität, wenn seine Tätigkeit Dysregulated ist. Dieser Neurotransmitter ist normalerweise an Neurogenese, neuronale Plastizität, synaptische und neuronale Wachstum und eine Reihe von anderen kritisch wichtige Gehirnfunktionen beteiligt. Jedoch verursachen längere Aktivierung der GLUTAMATREZEPTOREN Excitotoxizität und neuronale Apoptose, besonders unter Stressbedingungen wie Chirurgie, Sauerstoffmangel und Einsparung von Energie-Verfügbarkeit-3. Bindung von Glutamat an den NMDA Rezeptors nachweislich Na+ und Cl− Zustrom verursachen. Die nachfolgenden Depolarisation wird gedacht, um zu Ca2 + Kanal Öffnung führen und Freisetzung von intrazellulären Ca2 + 4speichert. Diese Dysfunktion wahrscheinlich führt zu einer Kaskade von metabolischen Störungen die schließlich verringern neuronale Verbreitung, Entzündung zu erhöhen und zu neuronalen Tod führen. Trotz dieser Hypothesen bleiben die wahren Mechanismen von AIN unklar5. Wegen seiner Rolle bei der Apoptose stellt Glutamat Dysregulation einen neuartigen Weg, der auf den Mechanismus der bisher dokumentierten neuronale Apoptose, ein Merkmal der AIN beitragen können.
Eines der Hindernisse auf die Untersuchung der neuronalen Prozessen ist ihre hohe Komplexität, vor allem in der Umgebung der neuronalen Entwicklung. Die ersten Monaten des Lebens sind die Zeit der maximalen Anfälligkeit für Verletzungen, während die meisten der wichtigen Schritte der neuronalen Entwicklung wie physiologische Apoptose (neuronale Rebschnitt), Synaptogenese, Gliogenesis und Myelinisierung nehmen Platz6 . Angesichts der komplexen Natur der neuronale Kommunikation und die Schwierigkeit, diese Prozesse zu studieren, ohne Störung der normalen Funktion der CNS, wurden neue Technologien entwickelt, die darauf abzielen, die in Vivo -Erkennung und Quantifizierung von wichtige Elemente der neuronale Kommunikation.
Enzym-linked MEA Technologie diente in dieser Studie als ein neuartiger Weg, um die Mechanismen von AIN in einem klinisch relevanten Ferkel-Modell zu studieren. Diese Technik kann verwendet werden, um komplexe in Vivo elektrochemische Vorgänge im Gehirn, einschließlich Glutamat Dysregulation zu studieren. Der eingebaute 4-Kanal platinenaufnahme Sites von MEAs (2 Glutamat-Sensitive-Sites und 2 Sentinel Sites) ermöglichen verweisen auf sich selbst, was dazu beiträgt, Erkennungsgenauigkeit. Darüber hinaus eine Ausgrenzung ist für jede Elektrode aufgetragen, Verleihung Selektivität durch verhindern, dass andere störende Moleküle erkannt7. Darüber hinaus ermöglicht die niedrige Bauform der MEA minimal Gewebetrauma im Vergleich zu älteren Technologien. Diese gleiche Funktion verleiht MEAs eine höhere räumliche Auflösung, die die Studie der mikroskopischen Regionen im Gehirn erleichtert. Beispielsweise können einzelne Regionen des Hippocampus (dentate Gyrus, CA1, CA2) speziell studierte8sein. Einzelheiten auf der Funktionalität von MEAs wurden zuvor beschriebenen9.
Im Vergleich zu MEA Elektrochemie Mikrodialyse enthält eine Membran zwischen der Lösung von Interesse und eine Lösung ähnlicher Zusammensetzung, was die Erkennung der extrazellulären Flüssigkeit ändert10. Obwohl Mikrodialyse eine tragende Säule der Neurochemie ist und ist seit langem für die Erkennung von Neurotransmittern verwendet, hat es den Nachteil der geringen zeitlichen Auflösung, verzögerte Erkennung der Glutamat-Änderung und wesentliche Gewebe Trauma11.
MEAs erkennt indirekt Neurotransmitter wie Glutamat, Acetylcholin und Cholin, mithilfe von entsprechenden Oxidase-Enzyme, die produzieren Elektroaktive Reporter Moleküle wie H2O2 oder O212,13 .
MEA-Technologie hat bei Ratten und Primaten für das Studium der Neurotoxizität im Zusammenhang mit der pathophysiologischen Prozesse als AIN7,14verbreitet. Bei einigen dieser pathophysiologischen Prozesse wurde MEA Technologie verwendet für die Erforschung der Alzheimer-Krankheit, Epilepsie, Schädel-Hirn-Verletzungen und die Wirkung von pharmakologischen Substanzen auf synaptische Kommunikation8,15 , 16 , 17. Obwohl MEAs verwendet wurden, um diese Krankheiten bei Ratten und Primaten zu studieren, die hohe Entwicklungs Ähnlichkeit zwischen Mensch und Ferkel Gehirn Macht der Anpassung der MEA-Technologie bei Ferkeln eine sehr geeignete Technik für das Studium AIN Mechanismen18.
Protokoll
Ferkel (Sus Scrofa) erhalten Sie durch eine lokale Farm von der Ohio State University (OSU) institutionelle Animal Care und Nutzung Committee (IACUC) freigeschaltet. Nach der Genehmigung des Protokolls sind tierische Experimente im Einklang mit IACUC Politik getan.
(1) Ferkel und Ferkel-Handling
- Nutzen Sie männliche und weibliche Ferkel in einer systematischen und zufälligen Weise, jede möglichen geschlechtsspezifische Störfaktoren nach Ankunft Richtlinien19zu beseitigen.
Hinweis: Da die Zeit der maximalen Hirnwachstum innerhalb von 3-5 Tagen nach der Geburt der Ferkel ist, erfolgt Experimente ausschließlich mit Ferkeln 3-5 Tage alt. - Sicherstellen Sie, dass die Ferkel kommen in das Vivarium mindestens 24 h vor Experimenten zur Akklimatisierung für die Umwelt zu ermöglichen.
Hinweis: Ausgebildeten Tierärzten bietet regelmäßige Pflege der Tiere. Die Ferkel sind in einzeln Temperatur gehalten, kontinuierlich überwachten Käfigen gehalten und erhalten eine ernährungsmäßig komplette Milch Milchaustauscher Ad Libitum um Hypoglykämie zu vermeiden. Die Ferkel sind sind auch ohne Milch-Ersatz (null pro os) für mindestens 3 Stunden vor der Narkose gehalten und mit Decken und Spielzeug auf normales Niveau der Stimulation zu gewährleisten. Halten Sie wenn möglich mehrere Ferkel im gleichen Käfig Sozialisation zu ermöglichen.
2. Entwicklung und Anpassung von MEAs für AIN Studien in einem Ferkel-Modell
Hinweis: Diese Technologie nutzt Enzymbasis MEAs, die vorbeschichtet mit Enzym und galvanisiert mit m-Phenylendiamin Dihydrochloride (mPD). Die Elektroden wurden speziell mit 40 mm starre Welle entworfen und hergestellt für den Einsatz bei Ferkeln (Abbildung 1).
- Um Redundanz zu vermeiden, finden Sie, dass die detaillierte Beschreibung der MEA Vorbereitung und Kalibrierung15 (Abbildung 2) wie oben beschrieben.
3. Anästhesie und Verwendung der benutzerdefinierten stereotaktischen Vorrichtung für die Ferkel
- Tiere mit einem Anästhesie-Arbeitsplatz mit einer geeigneten Ventilator und Überwachungsgeräte zu betäuben, und überwachen Sie physiologische Parameter wie Pulsoximetrie, nicht-invasive Blutdruckmessung, Elektrokardiographie und Temperatur während der Gesamtheit des Experiments beschrieben wie bisher19. Intubation und lüften Sie die Ferkel und verwalten Sevofluran Anästhesie bei 1 minimale alveoläre Konzentration (MAC) (ca. 2,5-3 %) für 3,5 h. Achten Sie darauf, die ausgebildete Labormitarbeiter, die Mitglieder sind für diese Experimente präsentieren. Fell über den OP-Bereich ist mit elektrischen Haarschneider vor der Vorbereitung der Haut entfernt.
Hinweis: Die Konzentration und Dauer der Betäubung verwendet ermöglicht das Experiment, die Dauer der eigentlichen Narkose Exposition während eines chirurgischen Eingriffs zu simulieren. Darüber hinaus ist Sevofluran am meisten häufig Vollnarkose in der pädiatrischen Population, so dass die Untersuchung rund um die Sicherheit von größter Bedeutung genutzt. - Vor der Platzierung in der stereotaktischen Rahmen, starten eine Rocuronium laden Dosis von 2,5 mg/kg und eine Infusion von 1,5 mg/kg/h, Tierbewegung während im Rahmen gesichert zu verhindern.
- Platzieren Sie die Ferkel im Ferkel-spezifische stereotaktischen Rahmen, wenn eine ausreichende Tiefe der Narkose von Zehe-Prise bestätigt wurde.
- Bieten Sie angemessene Polsterung im stereotaktischen Rahmen indem die Ferkel auf einem gezwungen Luft Erwärmung Pad mit zusätzlicher Polsterung (z.B. fluidisierte Positioner), Dekubitus zu verhindern.
- Legen Sie die Zähne des oberen Unterkiefers über den Zahn (Abbildung 3).
Hinweis: Die Zahn-Bar sollte ein ausreichendes Maß an den Schädel sehr fest in Position zu halten. - Beheben Sie und ziehen Sie den durchdringenden Ohr-Bars in den Ohren, kümmert sich um sicherzustellen, dass die Ferkel in der Mittellinie Position befindet. Position der Spitzen der seitlichen hält in den Gehörgang und legen Sie das Ohr fest genug bars, um verbunden mit dem Eindringen der Trommelfell "pop"-Sound zu hören. Fest legen Sie die Ohr-Bars auf den Schädel und setzen Sie in gleicher Tiefe auf jeder Seite um Bewegungen des Schädels während des Experiments (Abbildung 4zentrale A) zu vermeiden.
Hinweis: Es ist von entscheidender Bedeutung, um die Ferkel warm zu halten (~ 37,8-38,6 ° C) und überwachen kontinuierlich die Temperatur während des gesamten Verfahrens für die Wartung der normothermie. Dies kann erreicht über eine Decke und/oder eine Wärmelampe sein. Achten Sie darauf, die Wärmelampe in einem angemessenen Abstand zu vermeiden, Brennen der Haut des Tieres zu legen.
- Erstellen Sie einen 4-6 cm Mittellinie Schnitt entlang der Schädel mit Vorsicht um zu vermeiden, erzielte den Schädel mit dem Skalpell. Sobald der Schnitt gemacht wird, sanftes einfahren und stumpfe Dissektion verwenden, um die Kopfhaut vom Schädel zu verbessern. Schrubben Sie vorsichtig den Schädel mit einem Tupfer, entfernen alle Bindegewebe und setzen die Nahtlinien (Abbildung 4Gruppe B).
Hinweis: Es ist nicht notwendig, Sterilität während der Experimente nicht überleben beizubehalten. Sterilität ist jedoch bei überleben versuchen einzuhalten. - Weitere Überlegungen der Kopfhaut, wenn erforderlich, setzen Sie den gewünschten Bereich und die vorgesehene Stelle für die Kraniotomie (Abbildung 5zentrale A) zu bestimmen. Chirurgische Bohrer verwenden, erstellen Sie ein Kraniotomie Fenster ca. 0,25 cm2 (möglicherweise größer oder kleiner je nach experimentellen Ziele) über die Struktur von Interesse, mit Vorsicht, nicht zu verletzen die Dura oder der zugrunde liegende Gehirn (Abbildung 5 , Zentrale B). Verwenden Sie feine Chirurgische Schere, um die Dura über das Hirngewebe (Abbildung 5Panel C) Verbrauchsteuern.
- Positionieren Sie die Elektrode so vertikal wie möglich über die Bregma durch die Sicherung der Metallarm des Headstage auf dem Mikromanipulator Ferkel Stereotax. Senken Sie die Elektrode so weit wie möglich ohne Berührung der Oberfläche des Schädels. Notieren Sie die Koordinaten des Bregma (Abbildung 6zentrale A).
- Bestimmen der anterior-posterioren und Medial-laterale koordiniert sowie die Tiefe der Struktur von Interesse, da sie auf die Bregma beziehen. Bestimmen der stereotaktischen Koordinaten mit einer Spezies und altersgerechte stereotaktischen Atlas. In diesem Fall verwenden eines stereotaktischen Atlas speziell für Ferkel20entwickelt.
- Positionieren Sie die Elektrode, so hat es die richtige anterior-posterioren und Medial-laterale Position, um sicherzustellen, dass der Mikroelektrode und das Gerät senkrecht zur Oberfläche sind. Legen Sie die Pseudo-Bezugselektrode unter der Kopfhaut, Kontakt mit dem Tier (Abbildung 6Panel B) zu gewährleisten.
- Senken Sie langsam und sanft, die Elektrode auf die entsprechende Tiefe in das Gehirn mit Hilfe der stereotaktischen Arms. Verwenden Sie für die letzten 2 mm eine hydraulische Microdrive zu weiteren Antrieb der Elektrode, um den genauen Standort (Abbildung 6Gruppe C).
Hinweis: Die elektrodenposition sollten Fenster Kraniotomie überlagern. Die Elektrode Tiefe variiert je nach der Gehirnstruktur von Interesse. Es ist nicht notwendig, den Schnitt nach Abschluss der Datenerhebung nicht überleben Experimente zu schließen.
4. Messung von extrazellulärem Glutamat unter Sevofluran Anästhesie
- Sicherstellen Sie, dass die Ferkel unter physiologischen Dauerüberwachung während der Ganzheit dieses Verfahrens. Ferkel werden in Vorbereitung auf die Prozedur inhalationally (über Gesicht Kegel) betäubt.
- Warten Sie nach der Implantation der MEA 30 min erlauben die Elektrode zu Grundlinie um sicherzustellen, dass die korrekte Messung für 3 h (Abbildung 7) gewonnen wird.
- Bupivacain 0,25 % (1 mL/kg) ist am Ort des Eingriffs für die postoperative Schmerztherapie subkutan verabreicht. Darüber hinaus wird Buprenorphin retard-q72h nach Bedarf subkutan gegeben.
(5) Perfusion und Opfer
- Führen Sie die Durchblutung und Gehirn Gewebe Sammlung Verfahren wie oben beschrieben21. Für nicht-überleben Operationen sind Tiere sofort nach Experimenten noch unter Vollnarkose euthanasiert.
- Grobe Querschnitte des Gehirns festen Ferkel und Lichtmikroskopie, um die Spur der Elektrode als zuvor beschriebenen22 zur Überprüfung der MEA-Platzierung, gewährleisten die richtige Platzierung im Bereich des Interesses zu visualisieren.
Ergebnisse
Diese Proof-of-Concept-Studie mit Enzymbasis MEA Keramiktechnologie in einem Ferkel-Modell bieten außergewöhnliche Einblicke in die zugrunde liegenden AIN Glutamat-Dynamik. Diese Studie zeigt, dass Enzymbasis MEA Technologie erfolgreich in das Ferkel-Modell, physiologische und Anästhesie-assoziierten Veränderungen in Neurotransmitter Aktivität mit hoher Empfindlichkeit und hoher räumlicher und zeitlicher Messen angepasst werden kann Auflösung. Physiologischen Homöostase wurde beibehalten, während unsere Experimente mit klinisch relevanten Methoden und Standards, und keine Ferkel zeigte Anzeichen einer physiologischen Störungen.
Die gewonnenen Daten bezeichnet die Fähigkeit von MEAs, genau und räumlich Neurotransmitter Messungen in kortikalen und Sub kortikalen Hirnstrukturen zu lösen. Die Verwendung eines stereotaktischen Apparats ermöglicht eindeutige eine Referenz Oberflächenstruktur (Bregma) um die Region von Interesse, konsequent zu finden ohne Rücksicht auf individuelle Unterschiede in der Ferkel Größe und Anatomie. Klare Visualisierung der Nähte ermöglicht konsequente regionale Platzierung der MEA mit Präzision im Mikrometerbereich (Abbildung 4). Erlangung des Zugangs zu den kortikalen Oberfläche des Gehirns ist minimal traumatische mit vernachlässigbar Blutungen, sicherzustellen, dass in-Vivo Glutamat Dynamik nicht durch unbeabsichtigte systemische oder lokale Beleidigung (Abbildung 5). Die benutzerdefinierten, starre MEA orientiert sich dann senkrecht auf der Frontalebene Ferkel (Abbildung 6). Richtig ausrichten der MEA vor dem einsetzen die Nichtbeachtung kann genaue räumliche Aufnahme der gezielten Region, vor allem für subkortikale Regionen verhindern.
In Echtzeit in Vivo Glutamat wurden Messungen in hippokampi von 3-4-Tage alten Ferkeln (n = 4) unter 2,5-3 % Sevofluran Anästhesie (ca. 1 MAC). Strommesstechnik Messungen wurden bei 4 Hz aufgezeichnet und Konzentration über eine lineare Regression basierend auf kalibrierparameter (Abbildung 8zentrale A) umgewandelt. Für jeden Zeitpunkt wurden die Signale aus den beiden Standorten der Glutamat-Sensitive gemittelt, vor Abzug der gemittelten Sentinel-Signal eine korrigierte Glutamat-Signal liefern. Diese kontinuierliche Messungen wurden geglättet, durch die Anwendung eines gleitenden Durchschnitts um den allgemeinen Trend im Laufe der Zeit (Abbildung 8Panel B) besser zu visualisieren. Die mittlere basale Glutamat-Konzentration war 4,61 ± 0,02 µM werden berechnet und im Laufe der Narkose Exposition relativ stabil geblieben. Transiente glutamatergen Aktivität wurde durch die Analyse von Gipfeln im Signal, die nicht mit Sentinel Signal abgeglichen wurden in einem Tier identifiziert (R2 < 0,5) und ein Signal-Rausch-Verhältnis von 3 (Abbildung 9zentrale A) überschritten. Insgesamt 116 Pegelspitzen wurden über einen Zeitraum von 3,5 h (Abbildung 10zentrale A) nachgewiesen. Die Amplitude der resultierenden Pegelspitzen wurde in der Regel innerhalb von 1 µM-Bereich (Abbildung 10Panel B) beobachtet. Um die Dauer der einzelnen Transient zu quantifizieren, wurde die Zeit (t-80) für jedes maximale Peak-Wert 80 % Verfall (Abbildung 9Panel B) erhalten. Die mittlere t80 alle Glutamat Transienten Zeitraum 3,5 h Aufnahme war 4,68 ± 0,82 s (Abbildung 10Gruppe C). Diese Daten zeigen, dass es möglich ist, beide verlängerte und transiente Neurotransmitter-Aktivität in einer subkortikale Region des Gehirns narkotisierten Ferkel genau zu messen.

Abbildung 1: visueller Vergleich der SG-2 Mikroelektrode Arraytypen. SG-2 Arrays enthalten zwei Glutamat-Sensitive-Sites und zwei Glutamat-unempfindliche Sentinel Sites (150 µm X 20 µm pro Standort). ()A) eine biegsame Welle Mikroelektrode Array wird auf der linken Seite angezeigt. Das starre Welle Mikroelektrode Array wurde speziell für den Einsatz bei Ferkeln und Genehmigungen tiefer Implantation bei großen Tieren. Bitte klicken Sie hier für eine größere Version dieser Figur.
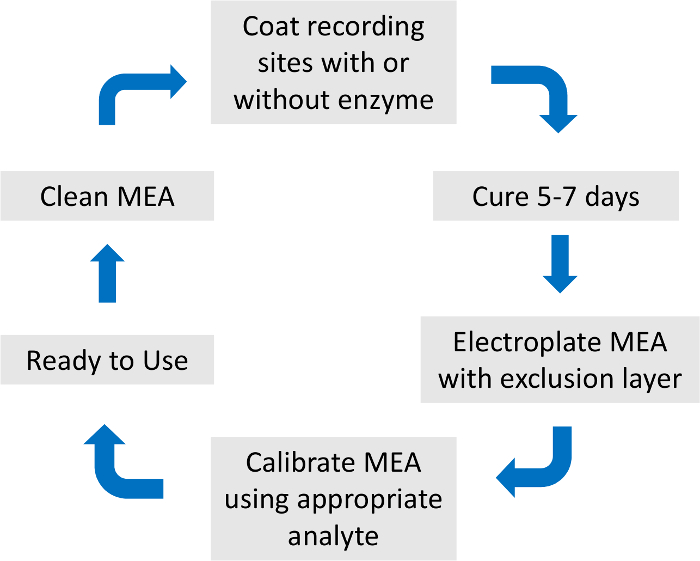
Abbildung 2: Übersicht über Mikroelektrode Array Vorbereitung und Kalibrierung Prozess. Die insgesamt MEA Vorbereitung und Kalibrierung dauern etwa eine Woche. Die Beschichtung Enzym, Ausgrenzung Schicht und Kalibrierung Analyten sind spezifisch für die Neurotransmitter von Interesse. Bitte klicken Sie hier für eine größere Version dieser Figur.
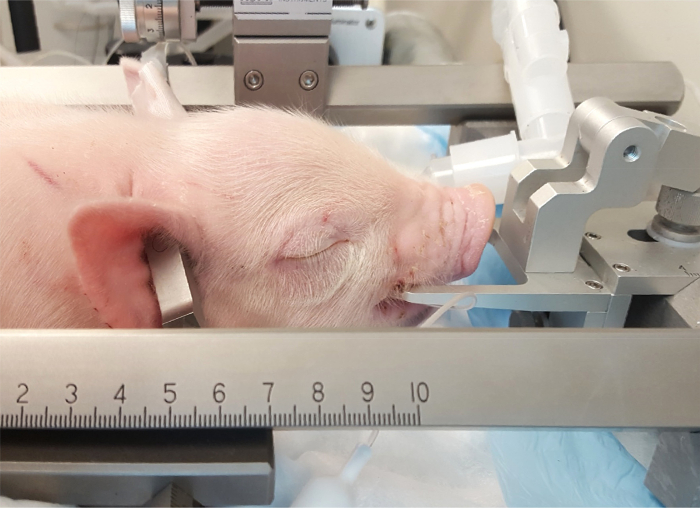
Abbildung 3: Platzierung der Ferkel in der stereotaktischen Apparat. Die Ferkel Mund Mund Bar direkt posterior, die Eckzähne im Vordergrund. Die durchdringenden Ohr-Bars sind in die Gehörgänge, das hintere Ende des Schädels zu sichern eingefügt. Bitte klicken Sie hier für eine größere Version dieser Figur.
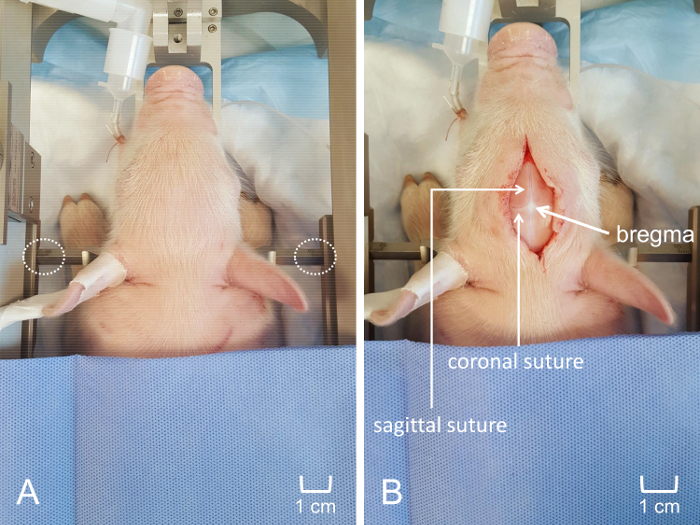
Abbildung 4: Platzierung der Ferkel in der stereotaktischen Vorrichtung zur Kraniotomie. (A) die Ferkel der Kopf ist fest im benutzerdefinierten stereotaktischen Rahmen, gewährleisten konsistente Platzierung der MEA gesichert. Äquidistanten Platzierung der durchdringenden Ohr Balken ist sichtbar. (B) Mittellinie anterior-posterioren Schnitt entlang der Kopfhaut. Bewertung des Schädels wurde vermieden, um sagittale und koronale Nähte zu visualisieren und Visualisierung von Bregma zu optimieren. Die Maßstabsleiste wird angezeigt, um die relative Größe des Schnittes und die Lage der Kraniotomie Fenster anzuzeigen. Bitte klicken Sie hier für eine größere Version dieser Figur.
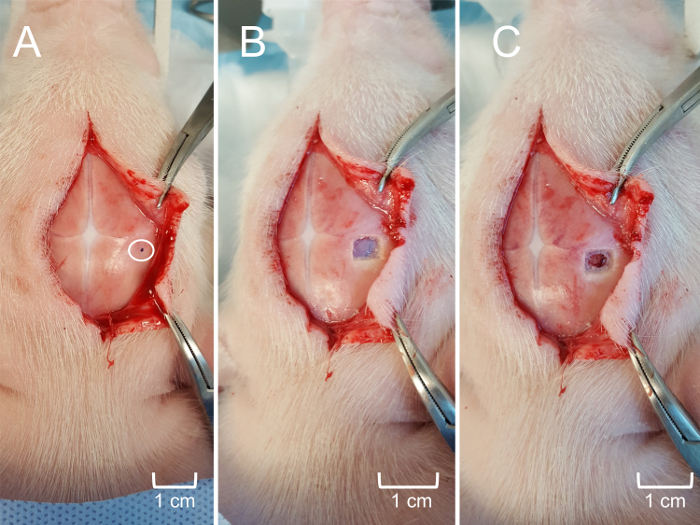
Abbildung 5: Craniotomy für den Zugang zum Hippocampus. (A) der Kopfhaut weiter reflektiert, um die ungefähre Position der MEA-Einfügung nach stereotaktischen Koordinaten verfügbar zu machen. Die Eingekreiste Bereich ist (schwarzen Punkt) gekennzeichnet, um die Kraniotomie führen. (B) die Kraniotomie Fenster (0,25 cm2) mit Totenkopf Klappe entfernt, um die zugrunde liegenden Dura Mater aussetzen. (C) die Hirnhaut vorsichtig entfernt um oberflächliche Großhirnrinde ohne Gewebetrauma verfügbar zu machen. Bitte klicken Sie hier für eine größere Version dieser Figur.
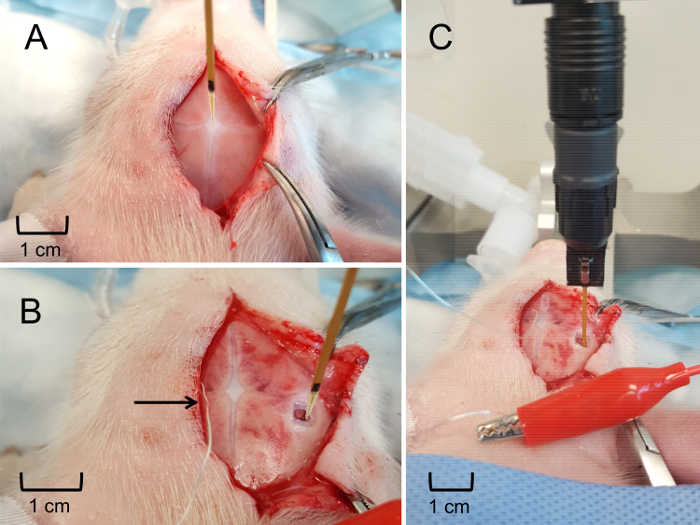
Abbildung 6: MEA Positionierung und Eingliederung in den Hippocampus. (A) Platzierung der MEA an die Bregma, eine relative stereotaktischen Standort des Hippocampus zu ermitteln. (B) stereotaktischen Platzierung der MEA an der Oberfläche des Gehirns die Einstecktiefe des Hippocampus zu bestimmen. Silber Pseudo-Bezugselektrode unterstellt sicher Kopfhaut (durch Pfeil gekennzeichnet). (C) die MEA eingefügt in der entsprechenden Tiefe, in Echtzeit zu erhalten in Vivo extrazellulärem Glutamat Messungen im Hippocampus. Bitte klicken Sie hier für eine größere Version dieser Figur.
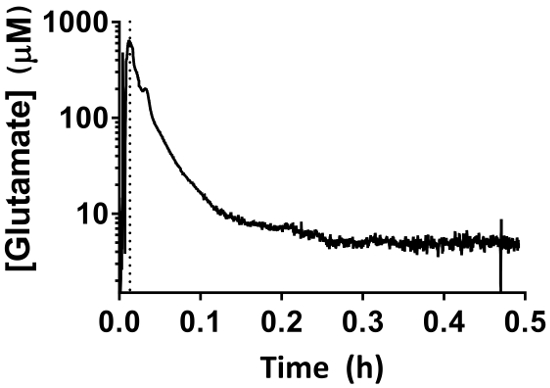
Abbildung 7: MEA Verhalten während der Periode 30-min Baselining. Der erste Anstieg entspricht den Abstieg der MEA in den Hippocampus mit dem Mikromanipulator. Der Basisperiode beginnt, sobald die MEA die entsprechende Tiefe (gepunktete Linie) erreicht hat. Extrazelluläre Glutamat Messungen verringert sich über einen Zeitraum von 30 min und sollte nicht als physiologische Messwerte interpretiert werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
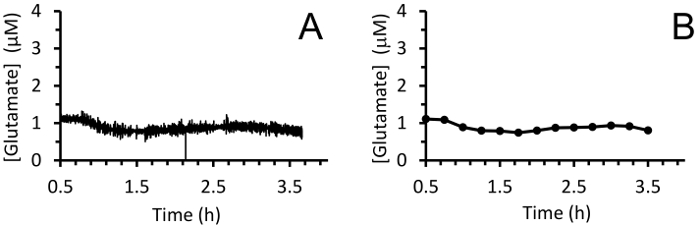
Abbildung 8: Echtzeit extrazellulärem Glutamat Messungen im Hippocampus eines Neugeborenen Schweines Narkose Sevofluran. (A) den gleitenden Durchschnitt der Glutamat-Konzentration im Hippocampus von einem Neugeborenen Schwein unter Sevofluran Anästhesie (mit 10 Datenpunkte). Messungen wurden bei 4 Hz für 3 h nach einer kurzen 30 min Baselining. (B) Glättung von Glutamat Messungen mit einem gleitenden Durchschnitt von 100 Punkten alle 15 min den Trend besser zu visualisieren. Bitte klicken Sie hier für eine größere Version dieser Figur.
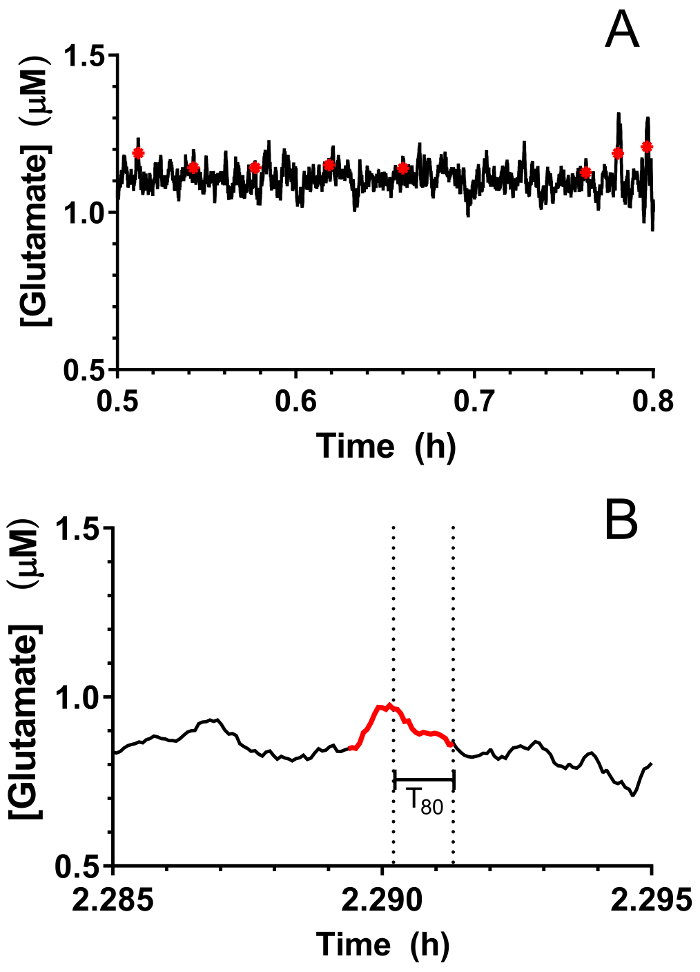
Abbildung 9: Identifizierung von Transienten Glutamat-Aktivität im Hippocampus eines Neugeborenen Schweines Narkose Sevofluran. (A) vorübergehende Glutamat Gipfel (in rot) sind die Echtzeit-Glutamat-Ablaufverfolgung angezeigt. Spitzen wurden erhebliche betrachtet, wenn das Signal-Rausch-Verhältnis 3 überschritten und ihr Signal nicht mit Sentinel-Signal korrelierte (R2 < 0,5). (B) ein repräsentative vorübergehenden Höhepunkt in Abbildung 9zentrale Aidentifiziert. Gestrichelte Linien zeigen die Gesamtdauer für die Spitze zu 80 % verfallen erforderlich. Bitte klicken Sie hier für eine größere Version dieser Figur.
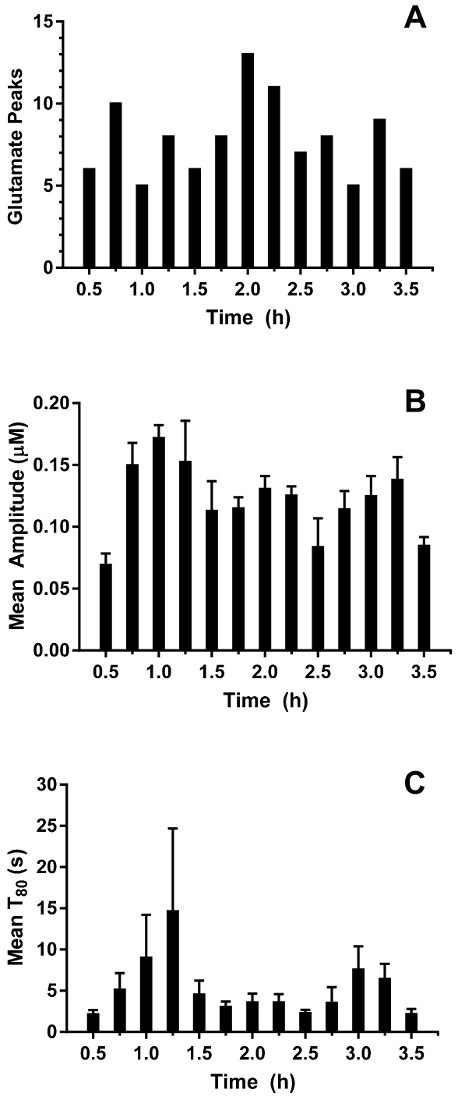
Abbildung 10: Charakterisierung von Glutamat Transienten im Hippocampus eines Neugeborenen Schweines Narkose Sevofluran. (A) A Anzahl der transienten Glutamat Spitzen in 15 min Lagerplätze. Spitzen wurden erhebliche betrachtet, wenn das Signal-Rausch-Verhältnis 3 überschritten und ihr Signal nicht mit Sentinel-Signal korrelierte (R2 < 0,5). (B) die Amplitude der transienten Glutamat Gipfeln. Fehlerbalken zeigen den Standardfehler des Mittelwerts. (C) bedeuten T80 vorübergehende Glutamat-Gipfel. Fehlerbalken zeigen den Standardfehler des Mittelwerts. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Von Beginn des Experiments werden das Ferkel physiologischen Homöostase eingehalten wie in dieser Übungseinheit Vorveröffentlichung21beschrieben. Minimale Überwachung gehören Pulsoximetrie, Elektrokardiographie, capnographie, nichtinvasive Blutdruck und Temperatur. Ausgebildete Ermittler sind erforderlich, damit physiologische Störungen (z.B., Hypo-/Hyperthermie, Hypoxie, Hypotonie, Herzrhythmusstörungen) entsprechend korrigiert werden können.
Vor Induktion in-vitro- MEA Kalibrierungen werden durchgeführt, um Funktionalität und Selektivität der MEA unter bekannten Bedingungen zu schaffen. Die Kalibrierung und Beschichtung von MEAs ist entscheidend für die effektive Nutzung der Technologie. Es gibt viele mögliche Fehler, die während der Kalibrierung auftreten können. Kalibrierung erkennen diese Probleme sowie unsachgemäße Beschichtung, die falsche interferent Antwort führt. Eine detailliertere tabellarische Darstellung der MEA Reaktion auftretende Fehler kompiliert wurde, entlang mit bemerkenswerten Ursachen und Lösungsvorschläge, welche erweisen sollte ein nützliches Instrument zur wahrscheinlich Fehlersuche (Tabelle 1). Es ist wichtig zu beachten, dass vor der Kalibrierung und Beschichtung, der Glaselektrode Verweis auf das Vorhandensein von Luftblasen oder weiße Verfärbungen geprüft werden soll, da entweder MEA Funktion und Genauigkeit Aufnahme negativ beeinflussen.
| Symptom | Ursache | Korrekturmaßnahmen |
| Kein Signal | Nicht angeschlossene Elektrode | Elektrode an Headstage und Headstage zum schnellen strommesstechnik System richtig anschließen. |
| Keine Stromversorgung des Systems schnell strommesstechnik | Power-Schalter auf der Rückseite schnelles System einschalten | |
| Signal-Rausch | Elektrode mit Blut kontaminiert | Bewässern Sie kontinuierlich die Gehirn-Oberfläche beim Einsetzen der Elektrode |
| Spülen Sie die Elektrode in dH2O | ||
| Enzym-Beschichtung ist locker | Reinigen und die Elektrode überstreichbar | |
| Referenzelektrode wurde nicht eingefügt oder beschichtet | Beschichten Sie und legen Sie die Bezugselektrode weiter unter der Kopfhaut | |
| Elektrode ist Bewegung des Gehirns Oberfläche erkennen. | Dies tritt normalerweise in oberflächliche Strukturen. Legen Sie wenn möglich die Elektrode tiefer (1 mm zu einem Zeitpunkt) | |
| Tierbewegung | Tier ist unzureichend gesichert | Bewegen Sie das Tier in posterior, besser zu schützen Earbars auf dem Schädel. Falls erforderlich, erhöhen Sie den Torso, um bessere Körperhaltung zu ermöglichen. |
| Tier ist unzureichend betäubt | Überprüfen Sie die Integrität der Narkose Ausrüstung. Titrieren Sie die Narkose auf eine wirksame Dosis und verwalten Sie eine intramuskuläre Rocuronium Dosis (5 mg/kg) | |
| Platzierung der ungenauen Elektrode | Elektrode ist nicht korrekt ausgerichtet. | Passen Sie die Elektrode unter Beibehaltung der richtigen Anschluss an die Headstage. |
| Stereotaktischen Koordinaten sind ungenau | Sicherstellen Sie, dass die Ferkel Atlas referenzierten nicht ein weiterer Bezugspunkt oder Flugzeug der Ausrichtung verwenden. | |
| Achten Sie darauf, dass Sie nicht die Nahtstellen zu verschleiern, erzielte er den Schädel. |
Tabelle 1: Anleitung zur Problembehandlung MEA verwenden bei Ferkeln. Mögliche Ursachen und Abhilfemaßnahmen bei Optimierung und Fehlerbehebung helfen.
Stereotaktischen Atlas für die Ferkel dient zur Bestimmung der stereotaktischen Koordinaten des Bereichs des Interesses in Bezug auf einen bekannten wie Bregma18. Ohr Bars sollten ordnungsgemäß gesichert werden, um sicherzustellen, dass der Schädel eben und komplett bewegungsunfähig ist. Vorsicht während der Mittellinie Schnitt der Kopfhaut zu vermeiden, erzielte des Schädels, da diese Visualisierung der Nahtlinien beeinflussen kann. Die Kraniotomie Fenster sollte groß genug für die MEA.
Dieses Protokoll stellt eine Reihe von technischen Herausforderungen, die eine gut ausgestattete op-Abteilung und ein Ermittler/Team geschickt in die OP und Narkose Aspekte des Protokolls erfordern. Das Modell stellt zusätzlich finanzielle Einschränkungen, dass die Ferkel-Modell teurer als das Nagetier-Modell ist; Es ist jedoch wesentlich kostengünstiger als der Einsatz von nicht-humanen Primaten, die Tausende von Dollar Kosten können. Die Verwendung von MEA Technologie stellt ihre eigenen Herausforderungen, wie das Verfahren der Beschichtung und Beschichtung der Elektroden manuell erfordern einen qualifizierten Prüfer oder Assistenten um ausreichende Selektivität und zuverlässige Funktion zu gewährleisten. Die Mikroelektroden selbst sind zerbrechlich, wie sie sind aus Keramik gefertigt und somit leicht beschädigt, wenn angemessene Vorsicht nicht beachtet wird. Mikroelektroden sind Interferenzen von anderen elektrischen Geräten, die Rauschen in Aufnahmen erstellen können, und vom Blut an die Operationsstelle, die Aufnahme Seiten verdecken kann. Die Notwendigkeit für spezielle Ausrüstung stellt eine zusätzliche Belastung wie ein chirurgische stereotaktischen Rahmen gebaut, um die Ferkel Schädel während der Implantation zu immobilisieren benutzerdefinierte sein muss. Der stereotaktischen Rahmen, Glutamat-Oxidase und die Elektroden selbst sind alle teuer. Darüber hinaus stellt das Fehlen eines Ferkels stereotaktischen Atlas von innerhalb der letzten Dekade technische Einschränkungen, die eine besonderen Expertise zu bestimmen, die besondere Lage von tiefen Strukturen im Gehirn Ferkel erfordern. Entwicklung eines neuen stereotaktischen Atlas, vielleicht mit Magnet-Resonanz-Tomographie, würde die Fähigkeit, diese Technologie bei Ferkeln erheblich verbessern.
Das Ferkel ist eine klinisch relevante Modell für die Untersuchung von AIN weitgehend durch die parallelen, die zwischen dieser Spezies und das menschliche Neugeborene bestehen beide ähnliche Gehirnstruktur und Entwicklung besitzen. Im Gegensatz zu häufig verwendeten Modelle wie Mäusen oder Ratten hat die Ferkel eine größere CNS Ähnlichkeit mit Menschen, das für die Übersetzbarkeit der Modellergebnisse eignet. Das Ferkel-Modell ist außerdem billiger und unkomplizierter Handhabung als ein nicht-menschlichen Primaten-Modell beinhaltet. Das Ferkel-Modell soll den Prozess untersuchen, durch welche Narkose könnte induzieren Entwicklungsstörungen Neurotoxizität, messen ihren Beitrag zu neurologische Schäden und bekämpfen das Problem der Schäden, die durch Störfaktoren Variablen. Zum Beispiel kann Hypoxie missverstanden werden, für Schäden, die durch Anästhetika wie es globale Auswirkungen auf das Gehirn hat. Das Ferkel wird genutzt, mit der gleichen op und Narkose Bedingungen wie in der Humanmedizin verwendet, um die Genauigkeit der Ergebnisse zu gewährleisten.
Die Verwendung von Keramik-MEA Technologie beseitigt einige der Nachteile der modernen Technik der Mikrodialyse zugeordnet. Mikrodialyse hat eine begrenzte zeitliche und räumliche Auflösung im Vergleich zu amperometrischen Methoden wie die MEA, die kontinuierlich in mehreren Glutamat Ereignisse aufzeichnen kann, mikroskopischen Regionen um bis zu 10 Hz23. Diese schnelle Abtastrate beseitigt die verwirrende Faktor der lokalisierten Neurotransmitter Diffusion, die langsam-Sampling Methoden wie Mikrodialyse24innewohnt. Darüber hinaus ist die MEA eine weniger invasive Methode als eine Sonde, Mikrodialyse, die kann dazu führen, dass erhebliche Gliosis während des Einfügens und Neurotransmitter Aktivität bei der Einfügung Seite22verändern kann.
Frühere Studien nutzen eine Reihe von Säugetieren Modelle, Messtechnik und Regionen des Gehirns, zeigten basale Glutamat Ebenen vergleichbar sind mit dieser Technik zu finden. Dies deutet darauf hin, dass MEA Technologie, wenn das Ferkel-Modell angepasst gültige Aufnahmen der in Vivo Glutamat-Konzentration (Tabelle 2 bietet).
| Autor (Jahr) | Aufnahmetechnik | Tiermodell | Alter | Gehirn Region(en) | Meine basale Glutamat-Konzentration (µM) |
| Hascup Et Al. (2008)23 | MEA (Enzym-basiert) | Nagetier | 20 - 24 Wochen | Präfrontalen Kortex, Striatum | 3.3 ± 1,0; 5,0 ± 1,2 |
| Hascup Et Al. (2010)25 | MEA (Enzym-basiert) | Nagetier | 3 - 6 Monate | Hippocampus | 4.7-10,4 |
| Rutherford Et Al. (2007)9 | MEA (Enzym-basiert) | Nagetier | 3 - 6 Monate | Präfrontalen Kortex, Striatum | 44,9 ± 4,7; 7.3 ± 0,9 |
| Miele Et Al. (1996)26 | Mikrodialyse (Enzym-basiert) | Nagetier | - | Striatum | 3.6 ± 0,5 |
| Day Et Al. (2006)27 | MEA (Enzym-basiert) | Nagetier | 3 - 6 Monate | Frontalen Kortex, Striatum | 1,6 ± 0,3; 1,4 ± 0,2 |
| Quintero Et Al. (2007)28 | MEA (Enzym-basiert) | Nicht - Primaten | 5,3-5,5 Jahre | Prämotorischen Kortex, motorischen Kortex | 3.8 ± 1,7; 3,7 ± 0,9 |
| Stephens Et Al. (2010) 29 | MEA [Spencer-Gerhardt-2 (SG-2)] | Nicht - Primaten | 11 - 21 Jahre | Putamen | 8,53 |
| Kodama Et Al. (2002)30 | Mikrodialyse (Enzym-basiert) | Nicht - Primaten | - | Präfrontalen Kortex | 1.29-2.21 |
| Galvan Et Al. (2003)31 | Mikrodialyse (Enzym-basiert) | Nicht - Primaten | Juvenile | Striatum | 28.74 ± 2.73 |
| Während und Spencer (1993)32 | Mikrodialyse (Enzym-basiert) | Menschlichen | 18 - 35 Jahre | Hippocampus | 20,3 ± 6,6 |
| Reinstrup Et Al. (2000)33 | Mikrodialyse (Enzym-basiert) | Menschlichen | - | Frontalen Kortex | 16 ± 16 |
| Cavus Et Al. (2005)34 | Mikrodialyse (Enzym-basiert) | Menschlichen | 15 - 52 Jahre | Neokortex | 2.6 ± 0,3 |
Tabelle 2: Vergleich der basalen extrazellulärem Glutamat Levelsacross verschiedenen Tiermodellen. Einer ausgewählten Überprüfung der Studien, die normale extrazelluläre Glutamat Ebenen in gesunden wach und narkotisierten Tieren mittels Mikrodialyse oder Mikroelektroden etablieren.
Die Verwendung von MEA Technologie zur Überwachung der in Vivo Glutamat Konzentrationen im Ferkel Modell kann für die zukünftige Bewertung der Ferkel neurologischen Outcomes nach Narkose ermöglichen. Überleben Experimente geplant, die ein Verständnis der langfristigen Auswirkungen der Narkose auf die neurokognitiven Wohlbefinden des menschlichen Neugeborenen. Überleben-Experimente ermöglicht es für Verhaltens-Prüfung und Überwachung von Glutamat ändert sich lange nach der Narkose Exposition. Es ist auch üblich für Kinder unterziehen Anästhesie unter Bedingungen, wo können sie physiologische Belastung in Form eines chirurgischen Eingriffs auftreten. Zukünftige Studien den Einfluss der Chirurgie in Bezug auf neurologische Verletzungen und Erhöhung in Neurotoxizität würde eine genauere Modellierung einer gemeinsamen klinischen Einstellung für Kinder ermöglichen. Die Verwendung von alternativen Tiermodellen ist auch möglich, wie die Studie diese verschiedenen Modelle durch chronische Implantation, ermöglicht es uns, Verhaltensänderungen, die Neurotoxizität zugeordnet zu verfolgen. MEA-Technologie selbst ist vielseitig, so dass Zukunftsstudie nicht auf Analyse von Glutamat Ebenen beschränkt werden muss (z.B.GABA, Cholin, Lysin, etc. konnten analysiert werden).
Offenlegungen
Greg Gerhardt ist Haupteigentümer von Quanteon LLC. Jorge Quintero und Jason Burmeister dienten als Berater für Quanteon LLC.
Danksagungen
Die Autoren möchte die Beiträge von der University of Kentucky Center for Mikroelektrode Technology (CenMeT) und der Ohio State University Labor Tier Resource Center (ULAR) anerkennen.
Materialien
| Name | Company | Catalog Number | Comments |
| Advance Liqui-Wean Pig Milk Replacer | PBS Animal Health | 292-13 | |
| Piglet Anesthesia Face-Cone Mask | VetEquip | 921428 | |
| Integra SL Anesthesia Workstation | DRE Veterinary | 2350 | This anesthesia workstation is chosen to best mimic the clinical monitoring experienced by pediatric patients in the operating room. Any anesthesia machine can be used as long as it allows for sufficient physiologic monitoring and intervention. |
| Sevoflurane | Ultane | 0074-4456-04 | |
| Rocuronium Bromide Injection | Hospira | 0409-9558-05 | |
| Medfusion 4000 IV Infusion | Smiths Medical | ||
| Model 1530 Heavy-Duty Research Model Stereotax | Kopf | custom made | |
| Model 1541 Piglet Adaptor | Kopf | custom made | |
| Infrared Spot Lamp | Amazon | B000HHQ94C | |
| Bair Hugger Torso Blanket | 3M | 540 | |
| Bair Hugger | 3M | 750 | |
| Sterile Alcohol Prep Pad | Fisherbrand | 22-363-750 | |
| Carbon Steel Rib-Back Surgical Blade | Bard-Parker | #10 | |
| Scalpel Handel | Havel's | HAN-G4 | |
| Surgical Scissors | World Precision Instruments | 504615 | |
| Mosquito Forceps | Sklar Surgical Instruments | 17-1225 | |
| Gauze Pads | Fisherbrand | 22-246-069 | |
| Adson Tissue Forceps | Teleflex | 181223 | |
| Dremel 111 Engraving Cutter | Amazon | Dremel 111 | |
| Microelectrode Array | Center for Microelectrdoe Technology, University of Kentucky | S2 4Ch MEA; custom made | |
| Headstage | Quanteon | 2pA/mV | |
| Wire, silver, PFA, .008" Bare, .0110" coated | A-M Systems | 786500 | |
| Fine Micromanipulator | Narishige Scientific Instrument Lab | MO-8 |
Referenzen
- Hall, M. J., DeFrances, C. J., Williams, S. N., Golosinskiy, A., Schwartzman, A. National hospital discharge Survey: 2007 summary. Natl Health Stat Report. (29), 1-24 (2010).
- Ikonomidou, C., et al. Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain. Science. 283 (5398), 70-74 (1999).
- Mattson, M. P. Glutamate and neurotrophic factors in neuronal plasticity and disease. Ann N Y Acad Sci. 1144 (1), 97-112 (2008).
- Atlante, A., et al. Glutamate neurotoxicity, oxidative stress and mitochondria. FEBS Lett. 497 (1), 1-5 (2001).
- Kavitha, J., Durga, P., Ramachandran, G. Inhalational agents in anesthesia induced developmental neurotoxicity - Recent advances. Trends in Anaesthesia and Critical Care. 11 (1), 14-18 (2016).
- Zanghi, C. N., Jevtovic-Todorovic, V. A holistic approach to anesthesia-induced neurotoxicity and its implications for future mechanistic studies. Neurotoxicol Teratol. 60 (2), 24-32 (2017).
- Fan, X., et al. In situ real-time monitoring of glutamate and electrophysiology from cortex to hippocampus in mice based on a microelectrode array. Sensors (Basel). 17 (1), 1-8 (2016).
- Hinzman, J. M., et al. Diffuse brain injury elevates tonic glutamate levels and potassium-evoked glutamate release in discrete brain regions at two days post-injury: an enzyme-based microelectrode array study. J Neurotrauma. 27 (5), 889-899 (2010).
- Rutherford, E. C., Pomerleau, F., Huettl, P., Strömberg, I., Gerhardt, G. A. Chronic second-by-second measures of L-glutamate in the central nervous system of freely moving rats. J Neurochem. 102 (3), 712-722 (2007).
- Benveniste, H. Brain microdialysis. J Neurochem. 52 (6), 1667-1679 (1989).
- Kohno, T., et al. An improved method for the detection of changes in brain extracellular glutamate levels. J Neurosci Methods. 81 (1-2), 199-205 (1998).
- Hascup, K. N., Hascup, E. R. Electrochemical techniques for subsecond neurotransmitter detection in live rodents. Comp Med. 64 (4), 249-255 (2014).
- Rooij, N. F., Koudelka-Hep, M., Frey, O. Biosensor microprobe array for in vivo monitoring of neurotransmitters. EPFL. , (2010).
- Fan, X. T., et al. Cortical glutamate levels decrease in a non-human primate model of dopamine deficiency. Brain Res. 1552, 34-40 (2014).
- Hunsberger, H. C., et al. Using enzyme-based biosensors to measure tonic and phasic glutamate in Alzheimer's mouse models. J Vis Exp. (123), (2017).
- Hill, A. J., Jones, N. A., Williams, C. M., Stephens, G. J., Whalley, B. J. Development of multi-electrode array screening for anticonvulsants in acute rat brain slices. J Neurosci Methods. 185 (2), 246-256 (2010).
- Defranchi, E., et al. Feasibility assessment of micro-electrode chip assay as a method of detecting neurotoxicity in vitro. Front Neuroeng. 4 (6), (2011).
- Whitaker, E. E., et al. Use of a piglet model for the study of anesthetic-induced developmental neurotoxicity (AIDN): A translational neuroscience approach. J Vis Exp. (124), (2017).
- Kilkenny, C., et al. Animal research: reporting in vivo experiments: the ARRIVE guidelines. Br J Pharmacol. 160 (7), 1577-1579 (2010).
- Salinas-Zeballos, M., Ceballos, G., Gootman, P. . A stereotaxic atlas of the developing swine (Sus scrofa) forebrain. , 887-906 (1986).
- Whitaker, E. E., et al. A novel, clinically relevant use of a piglet model to study the effects of anesthetics on the developing brain. Clin Transl Med. 5 (1), (2016).
- Hascup, E. R., et al. Histological studies of the effects of chronic implantation of ceramic-based microelectrode arrays and microdialysis probes in rat prefrontal cortex. Brain Res. , 12-20 (2009).
- Hascup, K. N., Hascup, E. R., Pomerleau, F., Huettl, P., Gerhardt, G. A. Second-by-second measures of L-Glutamate and other neurotransmitters using enzyme-based microelectrode arrays. The Journal of pharmacology and experimental therapeutics. 324 (2), 725-731 (2008).
- Rice, M. E., Cragg, S. J. Dopamine spillover after quantal release: rethinking dopamine transmission in the nigrostriatal pathway. Brain Res Rev. 58 (2), 303-313 (2008).
- Hascup, E. R., et al. Rapid microelectrode measurements and the origin and regulation of extracellular glutamate in rat prefrontal cortex. Journal of Neurochemistry. 115 (6), 1608-1620 (2010).
- Miele, M., Boutelle, M. G., Fillenz, M. The source of physiologically stimulated glutamate efflux from the striatum of conscious rats. J Physiol. 497 (Pt 3), 745-751 (1996).
- Day, B. K., Pomerleau, F., Burmeister, J. J., Huettl, P., Gerhardt, G. A. Microelectrode array studies of basal and potassium-evoked release of L-glutamate in the anesthetized rat brain. J Neurochem. 96 (6), 1626-1635 (2006).
- Quintero, J. E., et al. Amperometric measures of age-related changes in glutamate regulation in the cortex of rhesus monkeys. Exp Neurol. 208 (2), 238-246 (2007).
- Stephens, M. L., Pomerleau, F., Huettl, P., Gerhardt, G. A., Zhang, Z. Real-time glutamate measurements in the putamen of awake rhesus monkeys using an enzyme-based human microelectrode array prototype. J Neurosci Methods. 185 (2), 264-272 (2010).
- Kodama, T., Hikosaka, K., Watanabe, M. Differential changes in glutamate concentration in the primate prefrontal cortex during spatial delayed alternation and sensory-guided tasks. Exp Brain Res. 145 (2), 133-141 (2002).
- Galvan, A., Smith, Y., Wichmann, T. Continuous monitoring of intracerebral glutamate levels in awake monkeys using microdialysis and enzyme fluorometric detection. J Neurosci Methods. 126 (2), 175-185 (2003).
- During, M. J., Spencer, D. D. Extracellular hippocampal glutamate and spontaneous seizure in the conscious human brain. Lancet. 341 (8861), 1607-1610 (1993).
- Reinstrup, P., et al. Intracerebral microdialysis in clinical practice: baseline values for chemical markers during wakefulness, anesthesia, and neurosurgery. Neurosurgery. 47 (3), 701-710 (2000).
- Cavus, I., et al. Extracellular metabolites in the cortex and hippocampus of epileptic patients. Ann Neurol. 57 (2), 226-235 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten