Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Räumliche Quantifizierung von Drogen in der Lungentuberkulose Läsionen durch Laser Capture Microdissection Flüssigkeit Gaschromatographie-Massenspektrometrie (LCM-LC/MS)
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Protokoll mit Laser Capture Microdissection gepaart mit LC/MS-Analyse, um räumlich-Droge-Verteilungen innerhalb von Lungentuberkulose Granulome zu quantifizieren. Dieser Ansatz hat breite Anwendbarkeit auf Droge-Konzentrationen in den Geweben an hohe räumliche Details zu quantifizieren.
Zusammenfassung
Tuberkulose ist nach wie vor eine der Hauptursachen für Morbidität und Mortalität weltweit. Verbesserungen an vorhandenen Drogen-Therapien und die Entwicklung neuer Therapeutika werden dringend gebraucht. Die Fähigkeit der dosierten TB-Medikamente zu erreichen und Sterilisieren Bakterien innerhalb schlecht durchblutet nekrotische Regionen (Caseum) der pulmonale Granulome ist entscheidend für eine erfolgreiche therapeutische Intervention. Effektive therapeutische Therapien müssen daher Medikamente mit günstigen Caseum Eindringvermögen enthalten. Aktuelle LC/MS-Methoden zur Quantifizierung der Droge Ebenen in biologischen Geweben haben begrenzte räumliche Auflösung Fähigkeiten, macht es schwierig, genau festzustellen, absolute Droge Konzentrationen innerhalb kleiner Gewebe Fächer wie die gefunden in nekrotische Granulome. Hier präsentieren wir ein Protokoll mit LC/MS Quantifizierung Laser Capture Microdissection (LCM) pathologisch unterschiedliche Gewebe Regionen kombinieren. Diese Technik bietet absolute Quantifizierung von Medikamenten innerhalb von Granulomen Caseum, um zelluläre Läsion und unbeteiligte Lungengewebe und daher genau bestimmt, ob bakterizide Konzentrationen erreicht werden. Neben der Tuberkuloseforschung hat die Technik viele Anwendungsmöglichkeiten für räumlich aufgelöst Quantifizierung von Drogen im erkrankten Gewebe.
Einleitung
Die Fähigkeit, räumlich zu lösen und zu quantifizieren Droge Ebenen ist eine wesentliche Voraussetzung für die Feststellung, ob Anti-Tuberkulose-Medikamente bakterielle Subpopulationen innerhalb pulmonale Läsionen bei Sterilisation Konzentrationen1erreichen. Von besonderer Bedeutung ist Medikament Eindringen in die nekrotischen Kern der Läsion (genannt Caseum), bestimmen, welche in der Regel enthält die höchste Anzahl von Bazillen und möglicherweise schlecht zugänglichen Drogen wegen fehlender Vaskularisierung.
Traditionelle Methoden zur Läsion eindringen, bewerten die Homogenisierung der ausgeschnittenen pulmonale Läsionen gefolgt von solvent-Extraktion und Analyse der Flüssigchromatographie-Massenspektrometrie (LC/MS) betreffen, sind sehr empfindlich und selektiv für die Medikamente der Interesse. Diese Methoden bieten jedoch schlechte räumliche Informationen, auf die Größe des ursprünglichen homogenisierte Gewebe beschränkt. Massenspektrometrie-basierte Bildgebung Ansätze, wie Matrix-assisted Laser Desorption ionisation (MALDI)2,3, desorption Electrospray Ionisierung (DESI)4 oder Flüssigkeit-Erweiterte Oberfläche Extraktion5, 6 bieten sehr räumlich aufgelöst imaging-Funktionen, direkte Quantifizierung kann jedoch extrem schwierig oder unmöglich aufgrund der heterogenen Ion Unterdrückung Effekte und unterschiedliche Extraktion Wirkungsgrade von Analyten aus der einzelnen Zelle oder Gewebe7. Darüber hinaus sind direkteste Gewebe MS bildgebenden Ansätze von Natur aus weniger empfindlich als LC/MS aufgrund fehlender chromatographische Trennung von endogenen Arten konkurrieren für Ionisierung und die geringeren Wirkungsgrad der solvent-Extraktion der Droge aus Gewebe.
Laser Capture Microdissection (LCM) in Kombination mit LC/MS-Analyse wurde routinemäßig angewendet zu isolieren und zu charakterisieren verschiedene Gewebe Regionen für Proteomik8,9 Studien und vor kurzem verwendet für die Droge Quantifizierung dosiert tierisches Gewebe10. Hier präsentieren wir Ihnen eine optimierte Protokoll Anwendung LCM kombiniert mit LC/MS (LCM-LC/MS)-Analyse, um Anti-TB-Medikamente in unterschiedlichen Granulom Fächer zu quantifizieren. Laser Capture Microdissection dabei konzentriert sich ein UV-Laser durch das Mikroskopobjektiv auf Gewebe, die schneidet und isoliert die gewünschte Gewebebereich ein Pfad durch den Benutzer definiert. Schwerkraft-unterstützte LCM (die Technik für diese Forschung verwendet), Abschnitt Gewebe wird auf einer dünnen Polymer-Membran-Folie (PET oder Stift) montiert und das Gewebe wird in einer Sammlung Rohr Kappe gelegen unterhalb der Folie erfasst. Die Medikamente werden aus dem ausgeschnittenen Gewebe extrahiert und quantifiziert mit LC/MS Standardansätze. Die Menge des Gewebes zu erhebenden erforderlich wird letztlich von der erwarteten Konzentration des Medikaments im Gewebe vorhanden und die Empfindlichkeit der LC/MS-Methode bestimmt. Für die meisten Analysen von Drogen auf therapeutische Ebenen dosiert und analysiert mit Hilfe einer routinemäßigen triple Quadrupol-Massenspektrometer, 3 Millionen µm2 (3 mm2) des Gewebes ist die Fläche ausreichend.
Dieses Protokoll beschreibt die kraftvolle Kombination von räumlichen Profilierung und vollständigen Quantifizierung von LCM-LC/MS, bietet absolute Droge Konzentrationen in allen Abteilen der TB Granulome angeboten. Die Technik kann auch angewendet werden, zu bestimmen, Droge-Konzentrationen in vielen verschiedenen erkrankten Geweben lebenswichtige Medikament Entdeckung und Entwicklung informieren.
Protokoll
Alle Tierversuche erfolgten gemäß dem Leitfaden für die Pflege und Verwendung von Labortieren der National Institutes of Health mit Genehmigung aus dem institutionellen Animal Care und Use Committee der NIAID (NIH), Bethesda, MD.
(1) Tierversuche und Gewebe-Sammlung
Dieser Abschnitt des Protokolls beschreibt Tier Verfahren und Probenentnahme Biosafety Level 3 (BSL3) Bedingungen. Ausführliche Protokolle der Mycobacterium Tuberculosis Aerosol Infektion Verfahren and Drug Administration, die Protokolle bei Kaninchen wurden beschriebenen zuvor11,12.
- New Zealand White Kaninchen (männlich und weiblich, ca. 4-5 Monate alt) mit M. Tuberculosis HN878 infizieren mit einem nur-Nase-Aerosol-System, wie oben beschrieben11.
- Verwalten Sie die gewählten Medikamente (Ethambutol im hier vorgestellten Beispiel) über die bevorzugte Route und einschläfern Sie die Tiere auf 2, 6 und 24 h nach Verabreichung. Erstens zu betäuben die Kaninchen durch intramuskuläre Injektion von Ketamin bei 35 mg/kg und Xylazin bei 5 mg/kg. Für zehn Minuten warten Sie, und bestätigen Sie richtige Anesthetization durch Kneifen die Rute und das Auge berühren. Wenn es keine Reaktion, einschläfern Sie durch intravenöse Gabe von Pentobarbital und Phenytoin (siehe Tabelle of Materials) in 1 mL/4,5 kg in 2 mL steriler Kochsalzlösung.
Hinweis: Diese Zeitpunkte sind optimal um das pharmakokinetische Profil Ethambutol abzudecken und Anpassung/Optimierung für andere Studie Medikamente erfordern. - Mit Pinzette, Schere und/oder Skalpell, entfernen Sie die Lungen aus der Brusthöhle, resezieren Sie Lunge Biopsien mit großen nekrotische Granulome in umliegenden unbeteiligte Lungengewebe (wie zuvor beschrieben3) eingebettet. Nekrotische Granulome erscheinen in Beige Farbe und in der Regel ragen leicht aus der umliegenden rot/Rosé-farbene Lunge. Um einfache Kryoschneiden zu erleichtern, damit Biopsien sind nicht größer als 2 x 1,5 x 1,5 cm.
- Mit Pinzette, Ort der Biopsie auf ein bereits beschriftete Cryomold Tablett mit den gewünschten Schnittfläche in direktem Kontakt mit der Basis des Fachs. Nach dem Einfrieren, wird dies eine flache Oberfläche bieten, aus der Cryosections geschnitten werden.
- Fixieren Sie die Biopsie in flüssigem Stickstoff Dampf. Füllen Sie einen Styropor-Behälter bis zu einer Tiefe von 2 Zoll mit flüssigem Stickstoff und einem Metalldraht Rohr Gestell. Das Rack sollte ragen über der Oberfläche des flüssigen Stickstoffes, die Bereitstellung einer flachen Oberfläche, auf der die Gewebe-Trays platziert werden. Setzen Sie den Deckel wieder auf die Styropor-Behälter und lassen Sie Gewebe für 10 Minuten vollständig einfrieren.
- Entfernen Sie die Gewebe-Fächer, wickeln Sie schnell in Aluminiumfolie ein und in individuell beschriftet, wiederverschließbaren Plastiktüten und Dichtung. Übertragen Sie auf-80 ° C Gefrierschrank für die Lagerung.
Hinweis: Schritte 1.1-1.6 sind in BSL3-Bedingungen (einschließlich alle tierische Arbeit und Umgang mit infizierten Organen und Geweben) durchgeführt. Gamma bestrahlen die Lunge Biopsien bei 3 Megarads Handhabung außerhalb BSL3 Containment zu ermöglichen. Laser Capture Microdissection auf sterilisierte Gewebe kann durchgeführt werden, innerhalb der BLS3 Anlage wenn Sicherheitsprotokolle zugelassen sind vorhanden. Allerdings beschreibt der Rest dieses Protokolls Weiterverarbeitung in einem BSL-2-Anlage.
(2) Gewebe schneiden
- Die gewünschte Arbeitstemperatur des Kryostaten gesetzt. Die Gamma-Bestrahlung Lungenbiopsie von-80 ° C Lagerung auf den Kryostaten übertragen und für 30 Minuten bis die Gewebetemperatur equilibrate lassen. Hinweis:-20 bis-22 ° C ist optimal für TB Läsion Biopsien.
- Mit einer Pinzette, beheben Sie die Biopsie an der Kryostat-Futter mit einem kleinen Betrag der optimale Temperatur Klebstoff (OCT) auf um die Basis des Gewebes an das Futter zu halten. Das Gewebe zu orientieren, so dass die flache Oberfläche (das war in Kontakt mit der Basis der Cryomold) die freiliegende Oberfläche zum Schneiden ist. Gewährleisten Sie, dass das Office-Anpassungstool die Gewebeoberfläche nicht verschmutzt, da dies die anschließende Massenspektrometrie Analyse beeinträchtigen.
- Schneiden Sie drei Gewebeschnitte bei 25 µm Dicke und montieren Sie auf PET-Membran-Folien. Sanft berühren Sie die Membran zum Abschnitt Gewebe und entfernen. Wenn zu viel Druck ausgeübt wird, kann die dünne Membran reißen.
- Vermeiden Sie übermäßige Handhabung der Dias vor der Montage, da dies in der PET-Membran immer aufgeladen und schlechte Adhäsion von der Gewebeschnitte zur Folge. Sicherstellen Sie, dass die Membran Folie ist bei Raumtemperatur Tauwetter-Montage und erfolgreiche Verklebung des Gewebes an der Membran zu ermöglichen.
- Entfernen Sie die Folie aus der Kryostat und 3 Minuten an der Luft trocknen lassen. LCM-LC/MS/MS nicht sofort durchgeführt werden, verschließen Sie die Folie in einem luftdicht verschließbaren Beutel und Transfer zum-80 ° C Lagerung bis zur Präparation erforderlich.
- Schneiden Sie einen angrenzenden Abschnitt 10-12 µm und Tauwetter-Mount auf einem standard Objektträger für Hämatoxylin und Eosin (H & E) Färbung und Referenz. Weitere Querschnitte können in dieser Zeit für andere gewünschte Histochemie Flecken (z. B. Ziehl-Niellsen zur Visualisierung von Mycobacterium Tuberculosis (MTB)).
(3) Mikrodissektion
- Versiegelten Beutel mit der Folie von-80 ° C Lagerung und um Raumtemperatur für 5 Minuten zu erreichen.
Hinweis: Wenn die kalte Folie sofort die Labor-Atmosphäre ausgesetzt ist, wird das Gewebe mit Kondensation beschichtet werden, und die räumliche Integrität des Arzneimittels beeinträchtigt werden. - Schalten Sie das Mikroskop und Laser (Laser benötigt ca. 5-10 Minuten warm up, bevor schneiden begonnen werden kann). Flat-Cap 0,20 mL PCR-Röhrchen in den Halter zu laden.
- Objektträger aus dem Beutel nehmen und nehmen ein optisches Bild des Abschnitts Gewebe auf der PET-Folie mit einem Flachbettscanner.
- Legen Sie die Folie in den Diahalter (Gewebeseite nach unten) und bestimmte Granulom Regionen von Interesse, die mit dem Mikroskop Software weisen Sie separate primärgefäßen zu. In der Regel werden diese "unbeteiligte Lunge", "zelluläre Granulom," und "Caseum" (nekrotische Mitte), kann aber variieren je nach der spezifischen Pathologie der Granulom/Biopsie.
- Konzentrieren Sie sich auf das Gewebe mit den 5 X Mikroskopobjektiv. Diese Vergrößerung sollte einen guten Überblick über das Gewebe mit beiden zellulären und nekrotischen Granulom Bereichen bieten. Wählen Sie in der Software das Rohr bezeichnet "Caseum" in Position unter dem Gewebe verschieben.
- Geben Sie die gewünschte Dissektion-Parameter. Typische Einstellungen für eine 25 µm dicken Lunge Abschnitt sind Laserleistung 30, 15, und Blende 35 (willkürliche Einheiten). Jedoch werden diese unterscheiden sich je nach Mikroskop verwendet und Potenzial rückläufiger macht aufgrund des Alters des Lasers.
- Wählen Sie das Werkzeug "frei-ziehen" und mit Maus oder Touchscreen Stift, umreißen Sie die gewünschte Region für Dissektion. Die Fläche der Region werden in der Software angezeigt. Halten Sie die ausgewählte Regionen unter 500.000 µm2 (0,5 mm2) einfacher Dissektion zu erleichtern. Wiederholen Sie die Dissektion bis 3 Millionen µm2 (3 mm2) insgesamt in der Röhre Kappe gesammelt worden.
- Gelegentlich kann die zergliederten Region bleiben stecken an die umgebenden Membran (z.B. durch statische Anziehung) und fallen nicht in die Sammlung-Kappe. Entfernen Sie diese Regionen aus die kumulierte Fläche insgesamt durch Auswahl und innerhalb der Software manuell zu entfernen.
- Wählen Sie die Kappe für "zelluläre Läsion" und sammle 3 Millionen µm2 des Gewebes, die nach dem gleichen Verfahren wie in Schritt 3.7 beschrieben.
- Wählen Sie die Kappe für "unbeteiligte Lunge" und sammle 3 Millionen µm2 des Gewebes, die nach dem gleichen Verfahren wie in Schritt 3.7 beschrieben. Beachten Sie, dass unbeteiligte Lungengewebe vielen Bronchiolen und alveoläre Räume enthält. Achten Sie besonders auf diese von den definierten Gewebe Regionen für Dissektion auszuschließen.
- Entfernen Sie den Deckel sorgfältig ausclipsen Sie, verschließen Sie und beschriften Sie jedes Rohr. Schützen Sie die seziert Gewebe aus den umliegenden Luft Störungen (z. B. Air Flow Störungen durch eine sich öffnende Tür). Analysieren die seziert Gewebe sofort, oder bei-80 ° C aufbewahren und Auftauen vor der Verarbeitung und Analyse der LCMS.
(4) Extraktion und Analyse der LCMS
- Bereiten Sie Extraktionslösung von 1:1 Acetonitril/Methanol mit Ethambutol d-10 interne Standard vor. Bei der Auswahl eines internen Standards verwenden eine stabile bezeichnete Form des Analyten Medikaments mit ausreichend Masse Verschiebung Isotop zu vermeiden (z. B. Deuterium-mit der Bezeichnung EMB in dieser Demo verwendet) cross sprechen zwischen den Analyten Droge und Standard (in der Regel mindestens 4 Daltons) .
Hinweis: Schaffung von Standards im Homogenat von jedem jeweiligen Gewebetyp ist schwierig, denn es gibt nur eine sehr begrenzte kontrollgewebe mit dem Homogenat Normen erstellt werden soll. Als Alternative zu Standards von einer stacheligen Homogenat Probe zu machen kann ein Standard erstellt werden, indem leere Gewebe und Testverbindung zusammen und extrahieren. Ein Volumen von kontrollgewebe in eine homogenisierte, die das Ziel-Volume von der Studie Probe Gewebeschnitte entspricht wird direkt mit einer Menge an die Testverbindung kombiniert, die in einer bestimmten Konzentration vorhanden sein würde. - Berechnen Sie das Zielgewebe Volumen anhand der Fläche und Dicke des Abschnitts Gewebe und bestimmen Sie den erforderlichen Verdünnungsfaktor für das Homogenat über das Volumen der Homogenat, die von der Norm und QC Proben hinzugefügt werden. Berechnungen sind unten für 3 Millionen µm2 (3 mm2) seziert Zielgebiet mit 25 µm Dicke und 2 µL Volumen von Homogenat dargestellt.
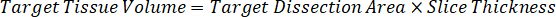
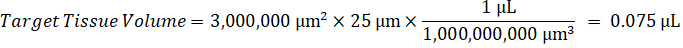
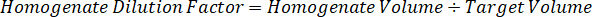

- Unter der Annahme einer Gewebe-Dichte von 1 g/mL, Homogenat Lager vorbereiten, indem mit einem Gewicht von 50 mg kontrollgewebe und Hinzufügen von PBS-Puffer zu verdünnen (mit Hilfe den 26.67 Homogenat Verdünnungsfaktor errechnet im Schritt 4.2, das Verdünnungsmittel 1,283 mL). Homogenisieren von Perle gegen Lungengewebe und PBS-Puffer für 5 Minuten bei 1750 u/min auf einem Wulst-Homogenisator.
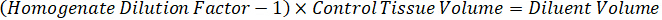
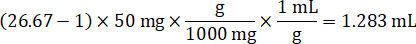
- Verdünnen Sie 1 mg/mL Wirkstoffkonzentration Bestände im 1:1 Acetonitril/Wasser Standardkurve Spick Lösungen zu erstellen. Spick standard Konzentrationen auf der Grundlage der Spike-Volumen und das Zielvolume Gewebe zu bestimmen. Dargestellte Beispiel ist für eine 100 ng/mL standard mit einer 10 µL Spike Volumen.
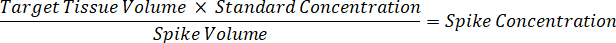
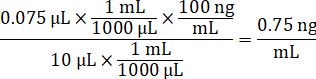
- Entfernen Sie die Röhrchen mit Microdissected Gewebe von-80 ° C Lagerung und erlauben Sie, um Raumtemperatur für 5 Minuten zu erreichen.
- Die Röhrchen mit Microdissected Gewebe fügen Sie 10 µL 1:1 Acetonitril/Wasser-Lösung und 2 µL PBS-Puffer hinzu.
- Fügen Sie für Standardkurve und Qualitätskontrolle Röhren 10 µL Lösung 2 µL Kontrolle Lunge Homogenat Spick.
- Jedes Rohr 50 µL der Extraktionslösung hinzufügen.
- Vortex jede Röhre für 5 Minuten, 5 Minuten lang beschallen und Zentrifugieren bei 5000 u/min für 5 Minuten einen Pellet Film- und Gewebe in jedem Röhrchen zu bilden.
- 50 µL überstand auf eine 96-Well Deep-Well-Platte übertragen und mit einer zusätzlichen 50 µL deionisiertes Wasser in jede Vertiefung verdünnen.
- Durchführen Sie LC/MS/MS-Analyse mit optimierten Geräteparameter für Ethambutol und Ethambutol-d10 interner Standard (wie oben beschrieben im Detail12).
- Verwenden Sie ein Verdünnungsfaktor, um für die genaue Menge des Gewebes seziert für jede Probe zu korrigieren.
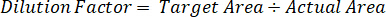
5. die Methodenvalidierung
- Erstellen Sie eine Homogenat im Lungengewebe Kontrolle durch die Kombination von 1 Teil Lunge, 2 Teile PBS und 3-4 stahlkügelchen. Schlagen Sie Lungengewebe und PBS-Puffer für 5 Minuten bei 1750 u/min mit einer Wulst-Homogenisator.
- Spike der Homogenat durch Zugabe von 10 µL von 1 mg/mL Ethambutol DMSO Lager in 990 µL Homogenat erstelle ich eine Endkonzentration von 10.000 ng/mL (10 mg/mL) und Vortex für 1 Minute.
- Erstellen Sie einen gefrorenen Homogenat Block durch das Homogenat in eine Cryomold Gießen und schnell Einfrieren auf Trockeneis für 5 Minuten.
- Bereiten Sie 25 µm Dicke Abschnitte aus dem Homogenat Block wie in 2.1-2.5 beschrieben vor.
- Das Zielgebiet Gewebe wie angegeben in Schritten 3.2-3.10 zu sezieren.
- Die Röhrchen mit Microdissected Gewebe fügen Sie 10 µL 1:1 Acetonitril/Wasser und 2 µL PBS-Puffer hinzu.
- Jedes Rohr 50 µL der Extraktionslösung hinzufügen. Schritte zum Erstellen einer Standardkurve und bestimmen die Wirkstoffkonzentration im Gewebe Homogenat Block 4,9-4.12.
- Berechnen Sie Extraktionseffizienz mit Hilfe der folgenden Formel:
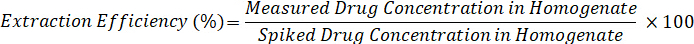
Ergebnisse
Ein Überblick über die LCM-LC/MS-Ansatz ist in Abbildung 1dargestellt. Nach der Sterilisierung des Gewebes durch Gamma-Bestrahlung, statt alle weiteren Schritte (von Gewebe schneiden ab) außerhalb BSL3-Bedingungen. Abbildung 2 zeigt die Läsion Biopsie Abschnitte vor und nach dem Gewebe isoliert von LCM. Nekrotische und zelluläre Bereiche des TB Läsionen können leicht identifiziert und isoliert durch visuelle Inspektion der...
Diskussion
Räumlich aufgelöst Quantifizierung von Medikamenten innerhalb pulmonale TB Läsionen ist erforderlich, um festzustellen, ob Arzneimittelexposition sterilisieren Konzentrationen an Bakterienpopulationen mit Wohnsitz innerhalb der verschiedenen Läsion Fächer erreicht. Die hier beschriebene LCM-LC/MS-Methode ermöglicht absolute Quantifizierung von Anti-TB-Medikamente in alle Fächer der Läsion, einschließlich der Bakterien-reiche Caseum, mit nur 1-3 Gewebeschnitte insgesamt. Traditionelle Gewebe Homogenisierung und L...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken Paul O'Brien, Marizel Mina und Isabella Freedman für Tierversuche, Jacquie Gonzalez und Danielle Weiner von NIH/NIAID für Hilfe mit Gammastrahlung von Kaninchen Gewebe vor dem Laser Capture Microdissection und Jansy Sarathy für Manuskript Gedanken und Ratschläge. Diese Arbeit wurde unterstützt durch Mittel aus der Bill und Melinda Gates Foundation (OPP1174780) und NIH geteilt Instrumentierung gewähren 1S10OD018072. Wir danken Eliseo A. Eugenin für den Zugang zu den Leica LMD 6500 Mikroskop und Austausch von Wissen und Beratung. Der Kauf und die laufende Unterstützung, der LMD-6500 wurde finanziert durch das National Institute of Mental Health Grant, MH096625, National Institute of Neurological Disorders und Schlaganfall, NS105584, PHRI Mittel (für E.A.E) und GSK Beiträge (zur E.A.E).
Materialien
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
Referenzen
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten