Method Article
Antimikrobielle Charakterisierung der Hochleistungswerkstoffe für Bioengineering-Anwendungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir präsentieren Ihnen ein Protokoll für die antimikrobielle Charakterisierung von Materialien. Hier wird die antimikrobielle Wirkung auf Materialoberflächen gemessen durch zwei Methoden, die einander ergänzen: eine basiert auf dem Agar Festplatte Diffusion Test, und der andere ist ein Standardverfahren, basierend auf der ISO-Norm 22196:2007.
Zusammenfassung
Die Entwicklung von neuen fortschrittlichen Materialien mit verbesserten Eigenschaften gewinnt immer mehr Bedeutung in ein breit gefächertes Anwendungsspektrum Bioengineering. So sind viele neue Biomaterialien entworfen, um bestimmte Umgebungen erforderlich für biomedizinische Anwendungen wie Gewebetechnik und kontrollierte Medikamentenabgabe zu imitieren. Die Entwicklung von Materialien mit verbesserten Eigenschaften für die Immobilisierung von Zellen oder Enzyme ist auch ein Aktuelles Forschungsthema in Bioverfahrenstechnik. Allerdings ist eine der begehrtesten Eigenschaften eines Materials in diesen Anwendungen die antimikrobielle Kapazität keine unerwünschten Infektionen zu vermeiden. Hierzu stellen wir Ihnen einfach zu befolgende Protokolle für die antimikrobielle Charakterisierung von Materialien auf Basis von (i) der Agar Festplatte Diffusion Test (Diffusion-Methode) und (Ii) die Norm ISO 22196:2007, die antimikrobielle Wirkung auf Oberflächen (Kontakt zu messen -Methode). Dieses Protokoll muss mit grampositive und Gramnegative Bakterien und Hefen decken ein breites Spektrum von Mikroorganismen durchgeführt werden. Als Beispiel werden 4 Materialien mit unterschiedlicher chemischer Natur getestet nach diesem Protokoll gegen Staphylococcus Aureus, Escherichia coliund Candida Albicans. Die Ergebnisse dieser Tests zeigen nicht-antimikrobielle Aktivität für das erste Material und antibakteriellen Aktivität gegen grampositive und Gramnegative Bakterien für die anderen 3 Materialien erhöhen. Keines der 4 Materialien sind jedoch in der Lage, das Wachstum von Candida Albicanshemmen.
Einleitung
Implantatversagen ist oft eine Folge von mikrobiellen Infektionen, die trotz antimikrobielle Prophylaxe und aseptische Arbeitsbedingungen auftreten. Dieses Problem wird verursacht sehr hohe Kosten im Gesundheitswesen und ist schmerzlich unter Patienten1. Wichtige Bakterien wie Staphylococcus Aureus gelten derzeit als sehr gefährliche Erreger nosokomialer Infektionen mit Kathetern und anderen medizinischen Implantaten verbunden und sind die wichtigsten Schadstoffe von medizinischen Instrumenten2. Daher ist die Entwicklung von neuartigen antimikrobiellen Strategien für Tages- und medizinische Zwecke dringend erforderlich.
Antimikrobielle Wirkstoffe gehören Antibiotika3, Quaternäre Ammoniumverbindungen4, Ionen/Metalloxide5und antimikrobielle Peptide (AMPs)6. Antibiotika sind weniger effizient durch bakterielle Resistenz7, allmählich die spendenbedarf Antibiotika Übernutzung8ist. Quaternäre Ammoniumverbindungen sind nur wegen Antibiotikaresistenz9sehr effizient für den kurzfristigen Einsatz. Ionen/Metalloxide haben lange als sehr effektive antimikrobielle Wirkstoffe verwendet worden und dienen in vielen gemeinsamen kommerziellen Produkten wie Bandagen, Wasserfilter, Farben, etc.10,11,12. Jedoch wurde nachgewiesen, dass diese Arten von Verbindungen zu einigen Arten von Säugerzellen13giftig sein können.
Ampere zeigen ausgezeichnete antimikrobielle und immunmodulatorische Eigenschaften14,15, und Bakterien scheinen16finden es sehr schwierig, eine Resistenz gegen sie zu entwickeln. Allerdings ist der Prozess um reine Ampere produzieren teuer; Daher ist eine groß angelegte Produktion nicht lebensfähig. So entwickelte Strategien zu begegnen, die die Probleme in der Herstellung von AMPs wurden (z.B., kleine Molekulare antibakterielle Peptoid Mimik17, Peptoids18, α-Peptide19 und β-Peptide20). Methacrylat-ended Polypeptide und Polypeptoids wurden für antimikrobielle und Antifouling-Beschichtungen-21synthetisiert.
Die Entwicklung neuer antimikrobieller Wirkstoffe wie fortschrittliche Materialien in reiner oder Mischform, in der Lage, Vorbeugung und Behandlung von multiresistenten Infektionen ist immer notwendig. Zahlreiche neue Hochleistungswerkstoffe für viele Bioengineering-Felder wie Gewebe und Bioverfahrenstechnik wurden mit verbesserten chemischen und physikalischen Eigenschaften in den letzten Jahrzehnten durch verschiedene Methoden entwickelt: Plasmapolymerisation Pfropfen auf eine hydrophobe Substrat22,23,24, Anpassung der Vernetzungsgrad Dichte25,26, Polymerisation in Lösung27,28,29 , 30, Porogen Auflösung31,32, und durch den Einbau von Nanomaterialien wie Graphene oxid (GO)33,34,35,36 und Kohlenstoff Nanofasern (CNFs)37.
Die Studie der antimikrobiellen Kapazität dieser neuen Materialien könnten exponentiell ihre potenziellen Bioengineering Anwendbarkeit und, daher unverzichtbar geworden. Wir präsentieren ein easy-to-Follow-Protokoll um die antimikrobielle Wirksamkeit solcher neuen fortschrittlichen Materialien zu quantifizieren. Hier, nach der Probenvorbereitung zwei komplementäre Methoden gefolgt sind: die erste basiert auf dem Agar Festplatte Diffusion Test38 (Diffusion-Methode) und die zweite basiert auf der ISO 22196:2007 Norm39 , die antimikrobielle Wirkung auf Messen Oberflächen (Kontakt-Methode).
Protokoll
1. die Probenvorbereitung
- Schneiden Sie die Materialproben zylindrischen Stempel in 10 mm Durchmesser Scheiben mit einem Durchmesser von 10 mm.
Hinweis: Spröde Materialien können in geeigneten sterilen Lösungsmitteln für 1 h erweicht und dann in Scheiben schneiden. Z. B. hydrophile Materialien wie Zink Alginat wurden nach diesem Protokoll getestet und waren im Autoklaven Wasser angefeuchtet, bevor sie zu schneiden, um Probe brechen zu vermeiden. Anderen hydrophoben Materialien wie poly(3-hydroxybutyrate-co-3-hydroxyvalerate) brauchen jedoch keine Art von vorherigen Schwellung um richtig geschnitten werden. - Trocknen Sie die Beispiel-Material-Disketten bei 60 ° C in einem Vakuumofen (< 10-2 Torr) für 24 h.
Hinweis: Einige Materialien können eine hohe Trocknungstemperatur erforderlich. Es ist jedoch wichtig, nicht um eine Temperatur zu erreichen, die das Material thermisch beeinträchtigen könnte. - Die Material Schichtdicken mit einem digitalen Bremssattel zu messen.
Hinweis: Dieses Protokoll empfiehlt die Nutzung von Material Filme mit konstanter und ähnliche dicken beim Vergleich der antimikrobiellen Wirkung von verschiedenen Materialien. - Jede Probe durch Eintauchen in Ethanol 70 % für 10 min und anschließende Ultraviolett (UV) Strahlung für 1 h pro jeder Seite zu sterilisieren.
Hinweis: UV-Bestrahlung kann erfolgen indem jede Probe in eine sterile Petrischale in einem Laminar-Flow-Kapuze mit 12,0 W Lampe UV-C Strahlung.
Achtung: Forscher sollten nicht setzen sich auf UV-Strahlung, denn es ist mutagen. - Führen Sie Schritte 1.1, 1.2, 1.3 und 1.4. mit der materiellen Steuerscheiben.
Hinweis: Polyethylenterephthalat (PET) oder alternative nicht-antimikrobielle Materialien könnten als Steuerscheiben in der Diffusion und Kontakt-Methode verwendet werden. Darüber hinaus sollten Nanokomposite oder behandelten Materialien charakterisieren, das Grundmaterial als Kontrollmaterial genutzt werden.
2. Empfohlene Mikroorganismen
Hinweis: Wir empfehlen die Verwendung von 3 verschiedenen Mikroorganismen, die antimikrobielle Kapazität des geprüften Materials gegen ein breites Spektrum von Mikroorganismen zu studieren.
- Reinkulturen von 3 Mikroorganismen zu verwenden: die gram-positiven Bakterien Staphylococcus Aureus, gramnegativen Bakterien Escherichia coliund die Hefe Candida Albicans.
Hinweis: Andere Mikroorganismen-Arten können auch mit diesem Protokoll getestet werden durch den Inkubationsbedingungen bei Bedarf ändern.
Achtung: Die erforderliche Biosafety-Messungen sind nach der Art der Mikroorganismen, die in diesem Protokoll eingesetzt einzuhalten. - Arbeiten mit Pre-steril oder autoklaviert Material und mit dem Bunsenbrenner während des gesamten Prozesses der mikrobiellen Manipulation oder einem biologischen Sicherheitsschrank (falls erforderlich) aseptische Bedingungen zu gewährleisten.
Hinweis: Empfohlene Autoklaven Bedingungen sind 121 ° C während 15 min für Nährböden und 121 ° C während 20 min für Arbeitsmaterial und biologische Rückstände.
(3) Agar Festplatte Diffusion Test (Diffusion-Methode)
Hinweis: Wenn eine flüssige Diffusion von antimikrobiellen Substanzen der antimikrobiellen Hauptmechanismus advanced Materials sein könnte, kann die Diffusion-Methode sehr nützliche Informationen über die antimikrobielle Kapazität dieser Materialien bieten. Der materiellen Datenträger befindet sich in der Mitte der Agar-Platte kann bilden eine transparente Ring Zone (Halo) wo eine Wachstumshemmung von Mikroorganismen nach 24 h Kultur erfolgt (siehe Abbildung 1).
-
Diffusion-Testverfahren
- Vorbereiten und Autoklaven tryptic Soy Agar (TSA) nach den Anweisungen des Herstellers.
- Gießen Sie die TSA in sterile Petrischalen unter aseptischen Bedingungen mit dem Bunsenbrenner oder einem Laminar-Flow-Haube.
Hinweis: Die TSA Platten müssen 4 – 6 mm dick sein. - Kultur der verschiedenen Mikroorganismen auf aerob 18 – 24 h in den Petrischalen mit TSA im Brutschrank bei 37 ° c getestet werden
- Vorbereiten und Autoklaven tryptic Soy Bouillon (TSB) nach den Anweisungen des Herstellers.
- Gießen Sie die TSB in ein 50 mL vorsterilisierten Zentrifugenröhrchen mit einer vorsterilisierten serologische Pipette unter aseptischen Bedingungen mit dem Bunsenbrenner oder einem Laminar-Flow-Haube.
- Erneut ein paar Kolonien aus Schritt 3.1.3 in 25 mL TSB enthalten in einem sterilen Zentrifugenröhrchen mit einem sterilen Wattetupfer und Wirbel für 1 min um eine gleichmäßige Durchmischung zu erreichen.
- Passen Sie die Extinktion (bei 540 nm) der Kultur mit einem Spektralphotometer für die passende Anzahl der koloniebildenden Einheiten (KBE) pro mL: ca. 1,5 x 108 KBE/mL für Bakterien und von 1 x 106 , 5 x 106 KBE/mL für die Hefe.
Hinweis: Die Kultur und Küvette Volumes, die Absorption messen müssen nach der Art der Spektralphotometer genutzt ausgewählt werden. - Wirbel der mikrobiellen Brühe für 5 Sekunden zur Verbesserung der Mikroorganismus Dispersion und kurz Eintauchen einer sterilen Wattetupfer in dieser mikrobiellen Suspension. Entfernen Sie das überschüssige Flüssigkeit aus den Tupfer drücken sie gegen die Rohrwandung mit der Kultur.
- Durchziehen Sie gleichmäßig die mikrobielle Brühe Aussetzung mit der sterilen Wattetupfer auf die Oberfläche der TSA Platten in 3 Ebenen zur Deckung ihrer ganzen Oberfläche mit der Mikroorganismus und 5 min nach der Inokulation trocknen lassen.
Hinweis: Um Feuchtigkeit zu entfernen, müssen die TSA Platten offen hängend bei 37 ° C für 10-15 min vor der Impfung platziert werden. - Ein paar Pinzette durch Eintauchen in ein Becherglas mit Ethanol 96 % und dann brennen sie mit einem Bunsenbrenner oder Alkohol Brenner zu sterilisieren.
- Legen Sie die Beispiel-Disketten zur getestet werden und Kontrolle der Scheibe in der Mitte der TSA Platten mit der sterilen Pinzette.
- Aerob inkubieren Sie die TSA Platten hängend bei 37 ° C für 24 h.
Hinweis: Um Kontaminationen zu vermeiden, empfiehlt es die TSA Platten hängend zu inkubieren. Jedoch wenn die probenscheibe von den TSA Platten löst, führen Sie diesen Schritt hängend. In diesem Fall empfiehlt es sich, die Platten in der Laminar-Flow-Haube zu trocknen. Diese antimikrobiellen Test muss mindestens an verschiedenen Tagen an Reproduzierbarkeit zu gewährleisten in Quadriplicate durchgeführt werden.
-
Überprüfung der mikrobiellen Aussetzung Konzentration und Reinheit
Hinweis: Die folgenden Schritte sind notwendig, um zu überprüfen, dass die mikrobielle Konzentration bestimmt mit dem Spektralphotometer im Schritt 3.1.7 korrekt ist und sicherstellen, dass gab es keine mikrobielle Kontamination der Umwelt. Eine mikrobielle Kontamination der Umwelt kann leicht durch das Auftreten von verschiedenen Arten von mikrobiellen Kolonien nach 24 h Kultur erkannt. Darüber hinaus muss keine Verkeimung des Mediums TSB während ihrer Manipulation in Dezimal Verdünnungsreihen mit einer negativen TSB Steuerplatte sichergestellt werden.- Die sterile TSB (vorbereitet in Schritt 3.1.4) in sterilen Mikrozentrifugenröhrchen mit einer Mikropipette mit passenden autoklaviert Tipps unter aseptischen Bedingungen zu verzichten. Einer von ihnen wird als Negativkontrolle TSB genutzt werden.
- Führen Sie Dezimal Verdünnungsreihen mit der mikrobiellen Brühe Suspension in Schritt 3.1.9 in der sterilen Mikrozentrifugenröhrchen mit TSB genutzt.
- 100 µL jeder Verdünnung auf TSA Platten mit einem vorsterilisierten Drigalski-Spatel oder ein alternatives Instrument zu verbreiten. Auch verbreitete 100 μL der TSB Medium ohne Mikroorganismus (vorbereitet in Schritt 3.2.1) auf einem TSA-Teller als eine negative TSB Steuerungsplatine.
- Aerob inkubieren Sie die TSA Platten aerob bei 37 ° C für 24 h.
- Die Anzahl der Kolonien zu prüfen, ob die KBE/mL sind ähnlich wie in Schritt 3.1.7 bestimmt.
- Überprüfen Sie, ob keine mikrobielle Umweltverschmutzung auf die TSA Platten mit nur einer Art von Kolonien.
- Überprüfen Sie, ob keine mikrobielle Kontamination auf der TSB Negativkontrolle Platte zeigt keine Kolonien
4. Messung der antimikrobiellen Aktivität auf Oberflächen (Kontakt-Methode)
Hinweis: Wenn Flächenkontakt antimikrobielle Hauptmechanismus einige advanced Materials sein könnte, kann die Kontaktmethode sehr nützliche Informationen über die antimikrobielle Kapazität dieser Materialien bereitstellen. Bei dieser Methode die Mikroorganismen befinden sich direkt auf die Materialoberfläche und ihrer Wachstumshemmung kann nach einer gewissen Zeit bestimmt werden.
-
Ursprüngliche Verfahren
- Vorbereiten und Autoklaven TSB nach den Anweisungen des Herstellers.
- Gießen Sie die TSB in ein 50 mL vorsterilisierten Zentrifugenröhrchen mit einer vorsterilisierten serologische Pipette unter aseptischen Bedingungen mit dem Bunsenbrenner oder einem Laminar-Flow-Haube.
- Kultur, die die verschiedenen Mikroorganismen aerob getestet werden in der Röhre mit TSB in einem Orbitalschüttler (140 u/min) bei 37 ° c über Nacht
- Verdünnen Sie die Übernachtung Kultur in 20 mL TSB in ein 50 mL vorsterilisierten Zentrifugenröhrchen zu einer Konzentration von etwa 106 KBE/mL (ermittelt mit einem Spektrophotometer bei 540 nm).
Hinweis: Die Kultur und Küvette Volumes, die Absorption messen müssen nach der Art der Spektralphotometer genutzt ausgewählt werden. - Führen Sie Dezimal Verdünnungsreihen dieser Kultur in sterilen Mikrozentrifugenröhrchen mit TSB. 100 µL der Kultur auf TSA Platten verteilt und inkubieren sie aerob bei 37 ° C für 24 h.
- Die Anzahl der Kolonien zu einer anfänglichen Zellkonzentration von ca. 1 x 106 KBE/mL zu gewährleisten
- Platz 4 Steuerscheiben für mikrobielle zählen nach 24 h und 4 Beispiel-Disketten jeder Art von den getesteten Materialien zum mikrobiellen zählen nach 24 h im Brunnen eine sterile 48-Well-Platte trennt.
- Pipette 150 µL der mikrobiellen Suspension auf jeder Oberfläche.
-
Mikrobielle zählen zur Kontrolle und geprüften Materialien (nach 24 h)
- Nach Schritt 4.1.6 aerob inkubieren der 4 Beispiel-Disketten, die noch in der 48-Well-Platte bei 37 ° C für 24 h.
Hinweis: Diese 24 h Inkubationszeit kann geändert werden, um die Wachstumshemmung zu kürzeren oder längeren Zeiten zu studieren. - Nach 24 h Inkubation pipette 850 µL steriler PBS auf die Oberfläche der Probe 4 Scheiben und mischen Sie es mit den 150 µL der mikrobiellen Suspension.
- Sammeln Sie die PBS/mikrobielle Aussetzung Mischung und jedes Laufwerk von 48-Well-Platte und übertragen Sie sie auf einem vorsterilisierten 10 mL-Tube.
- Wirbel der PBS/mikrobielle Aussetzung Mischung und jedes Laufwerk für 1 min beschallen es bei 50 Hz für 5 min und Wirbel, die er wieder für 1 min um sicherzustellen, dass keine lebensfähigen Mikroorganismen bleiben die Materialoberfläche eingehalten.
- 100 µL der Kultur auf TSA Platten verteilt und dezimal Verdünnungsreihen jeder beschallten Kultur in sterilen Mikrozentrifugenröhrchen mit TSB durchzuführen und inkubieren sie aerob bei 37 ° C für 24 h.
- Die Anzahl der Kolonien, die die Anzahl der lebensfähigen Mikroorganismen auf jede Probe und Kontrolle Plattenoberfläche sind. Drücken Sie diese Anzahl der lebensfähigen Zellen (KBE/mL).
- Nehmen Sie ein Foto von der letzten mikrobielle Kultur für die Probe und Kontrolle Datenträger.
- Nach Schritt 4.1.6 aerob inkubieren der 4 Beispiel-Disketten, die noch in der 48-Well-Platte bei 37 ° C für 24 h.
5. antimikrobielle Ergebnisermittlung
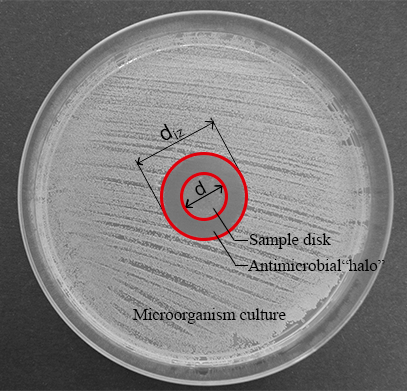
Abbildung 1: Messungen für die normalisierte Breite antimikrobielle "Heiligenschein". Dieses Fenster zeigt den Durchmesser der Hemmung Zone (dIz) und der Disk-Durchmesser (d). Bitte klicken Sie hier für eine größere Version dieser Figur.
-
Diffusion-Methode Ergebnisermittlung
- Messen Sie den Durchmesser der Hemmung Zone (dIz) und der Disk-Durchmesser (d) (siehe Abbildung 1) mit einem digitalen Bremssattel.
Hinweis: Die Hemmung Zone oder antimikrobielle "Halo" entsteht als Folge der mikrobiellen Wachstumshemmung durch die antimikrobielle Material Platte hergestellt (siehe Abbildung 1). Es ist möglich, zu beobachten, dass es eine transparente Ring Zone in der Nähe der Probe im Vergleich zum Rest der Platte wo die Mikroorganismen sind richtig gewachsen (undurchsichtige Zone). - Bestimmen Sie die normalisierten Breite der antimikrobiellen "Halo" (nwHalo) für die einzelnen Datenträger durch die Anwendung von Gleichung (1).
(1)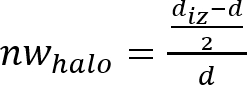
- Der Mittelwert und die Standardabweichung der normalisierten Breite antimikrobielle "Halo" mit den 4 bestimmt nwHalo Werte jeder einzelnen Probe zu bestimmen.
- Nehmen Sie ein Foto von der letzten mikrobielle Kultur mit der materiellen Scheibe.
Hinweis: Der Durchmesser der Hemmung Zone (dIz) und der Disk-Durchmesser (d) können auch von der Fotografie im Schritt 5.1.4 mithilfe einer geeigneten Bildbearbeitungssoftware gemessen werden.
- Messen Sie den Durchmesser der Hemmung Zone (dIz) und der Disk-Durchmesser (d) (siehe Abbildung 1) mit einem digitalen Bremssattel.
-
Kontaktmethode Ergebnisermittlung
- Bestimmen Sie die Anzahl der lebensfähigen Mikroorganismen erholte sich nach Gleichung (2).
(2)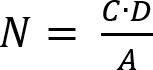
Hinweis: Hier ist N die Anzahl der lebensfähigen Mikroorganismen pro cm2 pro Prüfling wiederhergestellt; C ist die Keimzahl; D ist der Verdünnungsfaktor; A ist die Fläche des Prüfkörpers in cm2 mit der Probe Scheibe Durchmesser bestimmt. - Bestimmen Sie den Verlust der Lebensfähigkeit (LV), die Hemmung des Zellwachstums reflektieren durch die Anwendung von Gleichung (3).
(3)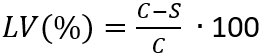
Hinweis: Hier ist C die durchschnittliche Anzahl der lebensfähigen Mikroorganismen (N) in KBE/mL•cm2, erholte sich von der Kontrollproben nach 24 h; S ist die Anzahl der lebensfähigen Mikroorganismen (N) in KBE/mL•cm2, erholte sich von der Probekörper nach 24 h. - Der Mittelwert und die Standardabweichung des Verlustes der Lebensfähigkeit mit 4 ermittelten LV(%) Werte jeder einzelnen Probe zu bestimmen.
- Bestimmen Sie die Anzahl der lebensfähigen Mikroorganismen erholte sich nach Gleichung (2).
Ergebnisse
Dieses Protokoll wurde eingesetzt, als Beispiel, die antimikrobielle Kapazität 4 Materialien mit unterschiedlicher chemischer Natur gegen die 3 testen empfohlen Mikroorganismen: Staphylococcus Aureus, Escherichia coliund Candida Albicans . Die Ergebnisse der Agar Festplatte Diffusion Tests (Diffusion-Methode) ausgestellt nicht antimikrobielle Aktivität für das erste Material (M1), wie es in der Steuerelement-Scheibe (C, Bild nicht gezeigt geschah) und erhöhte antibakterielle Aktivität gegen grampositive und Gramnegative Bakterien für die anderen 3 Materialien, M2, M3 und M4 (siehe Abbildung 2).
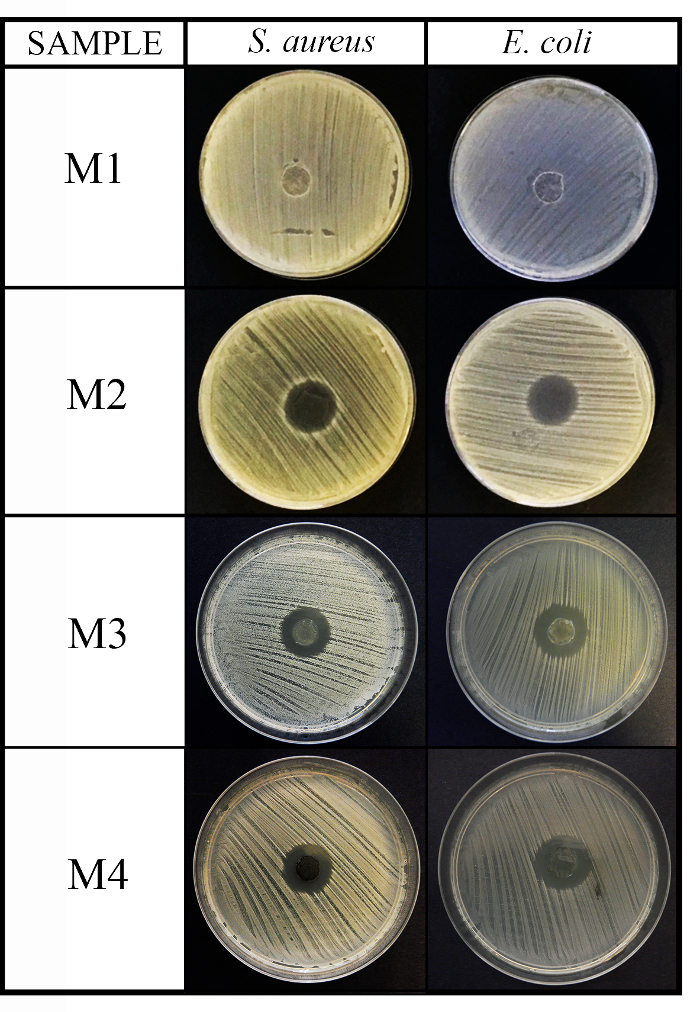
Abbildung 2: antimikrobielle Verbreitung Methodenergebnisse. Dieses Fenster zeigt die antimikrobielle Diffusion-Methode für die 4 Material (M1, M2, M3 und M4) Datenträger (10 mm Durchmesser x 1 mm Dicke) gegen S. Aureus und E. Coli nach 24 h Inkubation. Bitte klicken Sie hier für eine größere Version dieser Figur.
Abbildung 3 zeigt die verschiedenen normalisierten breiten antimikrobiellen "Halo" (nwHalo) für die verschiedenen Beispiel Materialien M1, M2, M3 und M4 gegen grampositive und Gramnegative Bakterien mit Gleichung (1) berechnet. Keines der 4 Materialien konnten jedoch hemmen das Wachstum der Hefe Candida Albicans (Bilder nicht gezeigt).
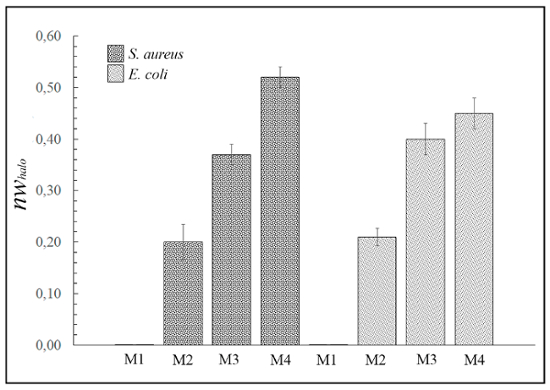
Abbildung 3: antimikrobielle Diffusion "Halo" Ergebnisse. Dieses Panel zeigt die normalisierte "Halo" (nwHalo) für jedes Material (M1, M2, M3 und M4) Laufwerk (Durchmesser 10 mm x 1 mm Dicke) gegen S. Aureus und E. Coli nach 24 h Inkubation. Die Unterschiede sind statistisch signifikant (p < 0,01). Jedoch stellte Probe M1 keine antimikrobielle Aktivität. Bitte klicken Sie hier für eine größere Version dieser Figur.
Die Ergebnisse der Kontaktmethode ausgestellt auch nicht antimikrobielle Aktivität für das erste Material (M1), wie es in den Kontrolle Datenträger (C) und die zunehmende antibakterielle Aktivität gegen Grampositive und Gramnegative Bakterien für die anderen 3 Materialien (siehe ( Abbildung 4).

Abbildung 4: antimikrobielle Kontakt Methodenergebnisse. Dieses Fenster zeigt die jeweiligen 90 mm Platten des 4 Material (M1, M2, M3 und M4) Oberfläche antimikrobielle Aktivität Tests nach ISO 22196:2007 nach 24 h Inkubation für S. Aureus und E. Coli (Verdünnungsfaktor 10-4). C ist die lebensfähigen Bakterien nach 24 h Inkubation von der Kontrolle Festplatte wiederhergestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
Der Verlust der Lebensfähigkeit (%) wurde durch Gleichung (2) und (3) bestimmt, wie in diesem Protokoll angegeben (siehe Abbildung 5).
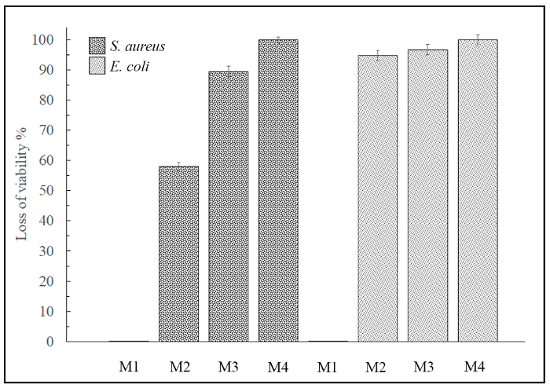
Abbildung 5: Verlust der Lebensfähigkeit von Kontaktmethode. Dieses Fenster zeigt den Verlust der Lebensfähigkeit (%) für M1, M2, M3 und M4 gegen S. Aureus und E. Coli auf den Oberflächen. Probe M1 ausgestellt keine antimikrobielle Aktivität. Bitte klicken Sie hier für eine größere Version dieser Figur.
Keines der 4 Materialien konnten jedoch hemmen das Wachstum der Hefe Candida Albicans durch die Kontaktmethode entweder (Bilder nicht gezeigt). Daher 3 diese 4 advanced Materials zeigte positive antimikrobielle Ergebnisse gegen grampositive und Gramnegative Bakterien und so könnte sehr nützlich sein für viele Bioengineering Anwendungen hohe antibakterielle Aktivität Anforderungen. Keines der 4 Materialien konnten jedoch hemmen das Wachstum der Hefe.
Diskussion
Die antimikrobielle Aktivität des neuen Hochleistungswerkstoffe durch dieses easy-to-Follow-Protokoll, bestehend aus 2 komplementäre Verfahren basierend auf 2 vorhandenen Methoden analysiert werden kann: die Agar-Disk-Diffusion testen38 und die antimikrobielle Aktivität gemessen am Materialoberflächen gemäß ISO 22196:2007 Norm39.
In diesem Forschungsfeld sind viele antimikrobielle Tests in der Literatur beschrieben sehr Assay abhängig. Daher ist es sehr wichtig, detaillierte und einheitliche Protokolle im Ort in Laboratorien. Dieser Artikel ist ein Schritt in diese Richtung. Darüber hinaus könnte es sehr hilfreich für viele Forscher, die weniger Erfahrung auf diesem Gebiet und erfordern detaillierte, Schritt für Schritt Verfahren zu folgen, um genaue Ergebnisse zu erzielen.
Dieses Protokoll kann mit vielen Arten von Materialien geschnitten Scheibe Formen von 10 mm Durchmesser verwendet werden. Spröde Materialien können in einem geeigneten Lösungsmittel für 1 h den Schneidprozess einfacher Rendern geschwollen sein. So können hydrophile Materialien wie Alginate in autoklaviert destilliertem Wasser hydratisiert werden. Anderen Lösungsmitteln wie Ethanol, Keton und Dichlormethan, können eingesetzt werden, um die hydrophobe Materialien für 1 h vor dem Schneiden sie anschwellen. Jedoch einige Materialien wie poly(3-hydroxybutyrate-co-3-hydroxyvalerate) müssen nicht geschwollen sein und sie können direkt geschnitten werden. Danach ist es sehr wichtig die Probe materiellen Datenträger in einem Vakuumofen Trocknen und Sterilisieren Sie jedes Exemplar mit Ethanol und UV-Bestrahlung für 1 h um Kontamination zu vermeiden.
Dieses Protokoll empfiehlt TSA und TSB als Kultur, Medien und die Verwendung von Reinkulturen von 3 Mikroorganismen, ein breites Spektrum von Mikroorganismen zu erreichen: die grampositiven Bakterien Staphylococcus Aureus, Gramnegative Bakterium Escherichia coli, und die Hefe Candida Albicans. Alternative Kultur, Medien und andere Mikroorganismen benötigen unterschiedliche Inkubationsbedingungen könnte jedoch auch mit diesem Protokoll verwendet werden. Manchmal wird nur 1 Mikroorganismus getestet, um eine erste Vorstellung von der antimikrobiellen Wirkung eines neuen Materials haben.
Die Materialien zeigen starke antimikrobielle Aktivität gegen die empfohlenen 3 verschiedene Arten von Mikroorganismen sollte auch geprüft werden, gegen Antibiotika-resistente Krankheitserreger wie Methicillin-resistenten Staphylococcus Epidermidis (MRSE), die wurden erfolgreich mit diesem Protokoll genutzt. Andere wichtigeren resistente Mikroorganismen die viel Sorge sind grampositive Methicillin-resistenten Staphylococcus Aureus (MRSA) und Vancomycin-resistenten Enterokokken (VRE) und Gram-negativen Pseudomonas Aeruginosa40,41.
Biofilm-Hemmung und der antimikrobiellen Wirkung von Materialien gegen andere Arten von Mikroorganismen wie Viren und Parasiten können mit diesem Protokoll getestet werden. Dieses Protokoll bietet jedoch einen sehr guten Ausgangspunkt für eine antimikrobielle Studie eines neuen advanced Materials.
In der antimikrobiellen Agar Festplatte Diffusion Test tritt ein entscheidender Schritt der probenscheibe hat in der Mitte des Tellers platziert werden, da einige Materialien Falten, sobald sie in den Agar Medien Kontakt. In diesem Fall empfiehlt es sich, ein paar sterile Pinzette verwenden, um die Probe sorgfältig zu entfalten. Auf der anderen Seite in der Kontakt-Methode ist es entscheidend, die Kontrolle zu waschen und Beispiel-Disketten sehr gut mit PBS durch pipettieren sie viermal gefolgt von einem kräftig aufschütteln und Beschallung um sicherzustellen, dass keine lebensfähigen Mikroorganismen bleiben auf das Material eingehalten Oberfläche.
Dieses video Protokoll kann genutzt werden, in vielen Bioengineering-Anwendungen, z. B. Bioverfahrenstechnik Gewebetechnik, kontrollierte Medikamentenabgabe, Verpackungsmaterialien, Abwasserbehandlung und Landwirtschaft, die Biomaterialien mit einem hoch wünschenswert antimikrobielle Kapazität.
Die Ergebnisse mit diesem Protokoll sind qualitative (die Bilder) und quantitative (die normalisierten Breite antibakterielle "Halo" und der Verlust der Rentabilität) mit eine gute Analyse ihrer Reproduzierbarkeit (Mittelwert ± Standardabweichung). Beim Vergleich von verschiedener Materials müssen diese Mittelwerte erhalten mit der Diffusion und Kontakt-Methode-Ergebnisse-Analyse analysiert werden, durch einfache ANOVA, gefolgt von der Türkei post Hoc Analyse, um zu studieren, wenn sie, statistisch signifikant sind verschiedene (p < 0,01).
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchte erkennen an der Universidad Católica de Valencia San Vicente Mártir für die finanzielle Unterstützung für diese Arbeit durch die 001UCV-231-2017 und 2018-231-001UCV gewährt.
Materialien
| Name | Company | Catalog Number | Comments |
| Cylindrical punch | 10 mm diameter | ||
| Petri dishes | soria genlab | P101 | 90 mm diameter, sterile |
| Tryptic soy agar (TSA) | Liofilchem | 610052 | Dehydrated medium 500 g (powder) |
| Tryptic soy broth (TSB) | Liofilchem | 610053 | Dehydrated medium 500 g (powder) |
| Sterile cotton swab | EUTOTUBO | 300200 | |
| Centrifuge tubes | VIDRA FOC, SA | 429900 | 50 mL, sterile |
| Ethanol | VWR | 83813360 | Absolute ethanol |
| Sterile 48-wells plate | COSTAR | 3548 | Flat bottom with lid, tissue culture treated, non-pyrogenic, polystyrene |
| A pair of tweezers | BRAUN | 24612036 | Toothless |
| Sterile phosphate buffered saline (PBS). | VWR | E404-100TAPBS | |
| Vaccum oven with a connected vacuum pump | JP Selecta, SA | 5900620 | |
| Laminar flow hood | TELSTAR Technologies, SL | TELSTAR AH-100 | 12.0 W lamp of UV-C radiation |
| Class II Biological safety cabinet | LABOGENE | MARS 1200 | |
| Incubator | ASTEC CO, LTD | SCA-165DR | |
| Vortex mixer | Biosan | V-1 Plus | |
| Spectrophotometer | Macherey-Nagel, Germany | Nanocolor UV/VIS II | |
| Bunsen burner | JP Selecta, SA | 7001539 | |
| Alcohol burner | VIDRA FOC, SA | 1658/20 | In case sterilisation is necessary to be performed inside class II biological safety cabinet |
| Orbital shaker | sartorius stedim | 8864845 | |
| Sonicator | SELECTA | 3000617 | 50/60 Hz |
| Digital calliper | ACHA | 17-260 | 0-150 mm |
| Serological pipette | Fisherbrand | 13-678-11 | 25 mL, sterile |
| Serological pipette | VWR | 612-4950 | 5 mL, sterile |
| Serological pipette | VWR | 612-5541 | 10 mL, sterile |
| Micropipette | GILSON | FA10005P | Pipetman L P200L, plastic 20-200 µL |
| Micropipette | GILSON | F123602 | Pipetman P1000, 200-1000 µL |
| Micropipette | GILSON | FA10016 | Pipetman L P12X300L, 20-300 µL |
| Micropipette tips | LABBOX | TIBP-200-960 | 2-200 µL |
| Micropipette tips | LABBOX | TIBP-1K0-480 | 100-1000 µL |
| Pre-sterilized tube | INSULAB | 301402 | 10 mL |
| Photo camera | Canon EOS 5D | Any camera with high resolution can also be utilized | |
| Gram-positive bacteria Staphylococcus aureus | strain V329 | Cucarella et al. J Bacteriol 183 (9), 2888–2896 (2001) | |
| Gram-negative bacteria Escherichia coli | Colección Española de Cultivos Tipo CECT | CECT 101 | |
| Yeast Candida albicans | Colección Española de Cultivos Tipo CECT | CECT 1394 | |
| Microcentrifuge tubes | DASLAB | 175508 | 1,5 mL |
| Autoclave | JP Selecta, SA | 4002136 | |
| Spectrophotometer-cuvettes | UVAT Bio CB | F-0902-02 | 4,5 mL |
| Drigalski spatula | LABBOX | SPRP-L05-1K0 | Sterile, disposable |
| glass balls (2 mm diameter) | Hecht Karl | 1401/2 | Autoclavable, alternative device to the Drigalski spatula |
| Autoclave bags | DELTALAB | 200318 | To sterilize microbiological residues or contaminated material |
| Electronic pipette filling device | JetPip | JET BIOFIL | |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-100-010 | 100 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-250-010 | 250 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-500-010 | 500 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-1K0-010 | 1000 mL, for autoclaving culture media |
| Latex gloves | DENIA | 2278000000 | |
| Indicator tape for sterilization | LABBOX | STAP-A55-001 | Self-adhesive tape with impregnated paper turning to colour when exposed to sterilization process. |
| Universal test tube rack | LABBOX | MTSP-001-001 | To hold centrifuge tubes |
| Microcentrifuge tube rack | VWR | 211-0210 | To hold microcentrifuge tubes |
| Sterile loop | ACEFE S.A. | 100140055 | 10 µL of capacity for microbial culture |
| Material M1 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 1 | |
| Material M2 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 2 | |
| Material M3 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type3 | |
| Material M4 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 4 | |
| Material C | Universidad Católica de Valencia San Vicente Mártir (UCV) | Control material |
Referenzen
- Sydnor, E. R. M., Perl, T. M. Hospital epidemiology and infection control in acute-care settings. Clin Microbiol Rev. 24 (1), 141-173 (2011).
- Chessa, D., et al. Staphylococcus aureus and Staphylococcus epidermidis Virulence Strains as Causative Agents of Persistent Infections in Breast Implants. PLoS One. 11 (1), e0146668 (2016).
- Pandey, H., Parashar, V., Parashar, R., Prakash, R., Ramteke, P. W., Pandey, A. C. Controlled drug release characteristics and enhanced antibacterial effect of graphene nanosheets containing gentamicin sulfate. Nanoscale. 3 (10), 4104 (2011).
- Jia, Z., Shen, D., Xu, W. Synthesis and antibacterial activities of quaternary ammonium salt of chitosan. Carbohydr Res. 333 (1), 1-6 (2001).
- Liu, Y., Wang, X., Yang, F., Yang, X. Excellent antimicrobial properties of mesoporous anatase TiO2 and Ag/TiO2 composite films. Microporous Mesoporous Mater. 114 (1-3), 431-439 (2008).
- Wang, L., Chen, J., Shi, L., Shi, Z., Ren, L., Wang, Y. The promotion of antimicrobial activity on silicon substrates using a "click" immobilized short peptide. Chem Commun (Camb). 50 (8), 975-977 (2014).
- Kümmerer, K. Resistance in the environment. J Antimicrob Chemother. 54 (2), 311-320 (2004).
- Ng, V. W. L., et al. Antimicrobial hydrogels: A new weapon in the arsenal against multidrug-resistant infections. Adv Drug Deliv Rev. 78, 46-62 (2014).
- Hegstad, K., Langsrud, S., Lunestad, B. T., Scheie, A. A., Sunde, M., Yazdankhah, S. P. Does the Wide Use of Quaternary Ammonium Compounds Enhance the Selection and Spread of Antimicrobial Resistance and Thus Threaten Our Health?. Microb Drug Resist. 16 (2), 91-104 (2010).
- Rana, D., Matsuura, T. Surface modifications for antifouling membranes. Chem Rev. 110 (4), 2448-2471 (2010).
- Lok, C. N., et al. Proteomic analysis of the mode of antibacterial action of silver nanoparticles. J Proteome Res. 5 (4), 916-924 (2006).
- Chen, X., Schluesener, H. J. Nanosilver: A nanoproduct in medical application. Toxicol Lett. 176 (1), 1-12 (2008).
- Ahamed, M., AlSalhi, M. S., Siddiqui, M. K. J. Silver nanoparticle applications and human health. Clin Chim Acta. 411 (23-24), 1841-1848 (2010).
- Yeaman, M. R. Mechanisms of Antimicrobial Peptide Action and Resistance. Pharmacol Rev. 55 (1), 27-55 (2003).
- McLean, D. T. F., Lundy, F. T., Timson, D. J. IQ-motif peptides as novel anti-microbial agents. Biochimie. 95 (4), 875-880 (2013).
- Brogden, K. A. Antimicrobial peptides: Pore formers or metabolic inhibitors in bacteria?. Nat Rev Microbiol. 3 (3), 238-250 (2005).
- Ghosh, C., et al. Small molecular antibacterial peptoid mimics: The simpler the better!. J Med Chem. 57 (4), 1428-1436 (2014).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proc Natl Acad Sci. 105 (8), 2794-2799 (2008).
- Chen, Y., Mant, C. T., Farmer, S. W., Hancock, R. E. W., Vasil, M. L., Hodges, R. S. Rational design of alpha-helical antimicrobial peptides with enhanced activities and specificity/therapeutic index. J Biol Chem. 280 (13), 12316-12329 (2005).
- Porter, E. A., Wang, X., Lee, H. S., Weisblum, B., Gellman, S. H. Non-haemolytic beta-aminoacid oligomers. Nature. 404 (6778), 565 (2000).
- Gao, Q., Li, P., Zhao, H., Chen, Y., Jiang, L., Ma, P. X. Methacrylate-ended Polypeptides and Polypeptoids for Antimicrobial and Antifouling Coatings. Polym Chem. 8 (41), 6386-6397 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Gómez-Ribelles, J. L., Monleón-Pradas, M., Vidaurre-Garayo, A., Suay-Antón, J. Characterisation of macroporous poly(methyl methacrylate) coated with plasma-polymerised poly(2-hydroxyethyl acrylate). Eur Polym J. 43 (10), 4552-4564 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Plasma-induced polymerisation of hydrophilic coatings onto macroporous hydrophobic scaffolds. Polymer (Guildf). 48 (7), 2071-2078 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L., Rault, J. Thermal analysis of water in reinforced plasma-polymerised poly(2-hydroxyethyl acrylate) hydrogels. Eur Polym J. 72, 523-534 (2015).
- Monleón-Pradas, M., Gómez-Ribelles, J. L., Serrano-Aroca, &. #. 1. 9. 3. ;., Gallego-Ferrer, G., SuayAntón, J., Pissis, P. Interaction between water and polymer chains in poly(hydroxyethyl acrylate) hydrogels. Colloid Polym Sci. 279 (4), 323-330 (2001).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Effect of crosslinking on porous poly(methyl methacrylate) produced by phase separation. Colloid Polym Sci. 286 (2), 209-216 (2008).
- Monleón-Pradas, M., Gómez-Ribelles, J. L., Serrano-Aroca, &. #. 1. 9. 3. ;., Gallego Ferrer, G., Suay Antón, J., Pissis, P. Porous poly (2-hydroxyethyl acrylate) hydrogels. Polymer (Guildf). 42 (10), 4667-4674 (2001).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Macroporous poly(methyl methacrylate) produced by phase separation during polymerisation in solution. Colloid Polym Sci. 285 (7), 753-760 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Llorens-Gámez, M. Dynamic mechanical analysis and water vapour sorption of highly porous poly(methyl methacrylate). Polymer (Guildf). 125, 58-65 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Campillo-Fernández, A. J., Gómez-Ribelles, J. L., Monleón-Pradas, M., Gallego-Ferrer, G., Pissis, P. Porous poly(2-hydroxyethyl acrylate) hydrogels prepared by radical polymerisation with methanol as diluent. Polymer (Guildf). 45 (26), 8949-8955 (2004).
- Rodríguez-Hernández, J. C., Serrano-Aroca, &. #. 1. 9. 3. ;., Gómez-Ribelles, J. L., Monleón-Pradas, M. Three-dimensional nanocomposite scaffolds with ordered cylindrical orthogonal pores. J Biomed Mater Res - Part B: Appl Biomater. 84 (2), 541-549 (2008).
- Brígido-Diego, R., et al. Acrylic scaffolds with interconnected spherical pores and controlled hydrophilicity for tissue engineering. J Mater Sci Mater Med. 40 (18), 4881-4887 (2005).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Ruiz-Pividal, J. F., Llorens-Gámez, M. Enhancement of water diffusion and compression performance of crosslinked alginate with a minuscule amount of graphene oxide. Sci Rep. 7, 11684 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Deb, S. Synthesis of irregular graphene oxide tubes using green chemistry and their potential use as reinforcement materials for biomedical applications. PLoS One. 12 (9), e0185235 (2017).
- Sánchez-Correa, F., Vidaurre-Agut, C., Serrano-Aroca, A., Campillo-Fernández, A. J. Poly(2-hydroxyethyl acrylate) hydrogels reinforced with graphene oxide: Remarkable improvement of water diffusion and mechanical properties. J Appl Polym Sci. , (2018).
- Serrano-Aroc, &. #. 1. 9. 3. ;., Iskandar, L., Deb, S. Green synthetic routes to alginate-graphene oxide composite hydrogels with enhanced physical properties for bioengineering applications. Eur Polym J. 103, 198-206 (2018).
- Llorens-Gámez, M., Serrano-Aroca, &. #. 1. 9. 3. ;. Low-Cost Advanced Hydrogels of Calcium Alginate/Carbon Nanofibers with Enhanced Water Diffusion and Compression Properties. Polymers (Basel). 10 (4), 405 (2018).
- Bauer, A. W., Kirby, W. M. M., Sherris, J. C., Turck, A. M. Antibiotic susceptibility testing by a standardized single disk method. A J Clin Pathol. 45, 493-496 (1966).
- . . ISO Specification 22196: measurement of antibacterial activity on plastics surfaces. , 584 (2007).
- Taubes, G. The bacteria fight back. Science. 321 (5887), 356-361 (2008).
- Boucher, H. W., et al. 10 x '20 progress--development of new drugs active against Gram-negative bacilli: an update from the infectious diseases society of America. Clinical Infectious Diseases. 56 (12), 1685-1694 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten