Method Article
Analyse der Beta-Zellfunktion mit einzelligen Auflösung Kalzium Imaging im Zebrafisch Inselchen
In diesem Artikel
Zusammenfassung
Beta-Zell-Funktion ist wichtig für die Blutzucker-Homöostase, die bei einzelligen Auflösung mit einem genetisch codierte Reporter für Kalzium Zustrom ausgewertet wird.
Zusammenfassung
Beta-Zellen der Bauchspeicheldrüse reagieren auf steigende Konzentrationen im Blut Glukose durch Sekretion des Hormons Insulins. Die Dysfunktion der Beta-Zellen führt zu Hyperglykämie und schwere, lebensbedrohliche folgen. Verstehen, wie die Beta-Zellen unter physiologischen Bedingungen funktionieren und welche genetischen und umweltbedingten Faktoren ihrer Dysfunktion verursachen könnten bessere Behandlungsmöglichkeiten für Diabetes-Patienten. Die Fähigkeit zur Messung der Kalziumspiegel im Beta-Zellen dient als ein wichtiger Indikator für Beta-Zellfunktion, als der Zustrom von Kalzium-Ionen löst Insulin-Freisetzung. Hier beschreiben wir ein Protokoll für die Überwachung der Glukose stimuliert Kalzium Zustroms im Zebrafisch Beta-Zellen mithilfe von GCaMP6s, ein genetisch codierte Sensor von Kalzium. Die Methode ermöglicht die Überwachung der intrazellulären Calcium-Dynamik mit einzelligen Auflösung in Ex Vivo montiert Inselchen. Die Glukose-Reaktionsfähigkeit von Beta-Zellen in der gleichen Insel kann gleichzeitig unter verschiedenen Glukosekonzentration erfasst werden, was darauf das Vorhandensein von funktionalen Heterogenität zwischen den Zebrafisch Beta-Zellen hindeutet. Darüber hinaus bietet die Technik hohen zeitlichen und räumlichen Auflösung, der die oszillierende Natur der Kalzium-Zustrom nach Glukose-Stimulation zeigt. Unser Ansatz öffnet die Türen der Zebrafisch als Modell verwenden, um den Beitrag der genetischen und umweltbedingten Faktoren mit Beta-Zell-Funktion und Dysfunktion zu untersuchen.
Einleitung
Unser Blut-Glukose bleibt in einem engen Bereich, im großen Teil wegen der Funktion des endokrinen Pankreas. Die endokrine Rolle der Bauchspeicheldrüse erfolgt durch die Langerhans-Inseln, die Hormon-sezernierenden Zellen enthalten. Die Insulin-sezernierenden Beta-Zellen sind verantwortlich für die Verminderung der Blutzucker nach einer kohlenhydrathaltigen Mahlzeit. Unzureichende Insulin-Sekretion von Beta-Zellen führt zu Diabetes1, charakterisiert durch anhaltend hohe Blutzuckerwerte. Typ 1 und Typ 2 Diabetes, die derzeit weltweit mehr als 400 Millionen Menschen heimsucht, führt zur Morbidität und Mortalität2. Durch die Untersuchung der molekularen und ökologischen Faktoren, die Beta-Zell-Dysfunktion beitragen, werden wir besser verstehen, wie Typ-2-Diabetes beginnt und schreitet voran. Darüber hinaus bieten die Möglichkeit, menschlichen Stammzellen in funktionelle Beta-Zellen in Vitro zu unterscheiden eine Quelle neuer Beta-Zellen für Zelle-Ersatz-Therapien bei Typ 1 Diabetes. Zu diesem Zweck ist es wichtig, Beta-Zellfunktion und Reifung in genetische Modellorganismen zu studieren, um die notwendigen Kenntnisse für die Herstellung von funktionalen Beta-Zellen in einer Schale zu gewinnen.
Beta-Zell-Funktionalität kann durch Quantifizierung des Gesamtbetrags von Insulin abgesondert in Reaktion auf die Glukose-Stimulation auf der ganzen Insel-Ebene überwacht werden. Dieser kumulative Ansatz untersucht die Insel als eine einzelne Gruppe von Zellen ohne Differenzierung einer Zelle Einzelimmobilien. Allerdings ergab die Analyse der Glukose Antworten der einzelnen Beta-Zellen eine Vielfalt in die funktionellen Eigenschaften von Beta-Zellen und das Vorhandensein von Heterogenität3. Um die Funktion der einzelnen Beta-Zellen zu beurteilen, ist es möglich, die intrazellulären Veränderungen zu beobachten, die Insulin-Sekretion4führen. Insulin-Sekretion wird durch einen Eintrag von Glukose in die Beta-Zellen voraus. Die Glukose, die in den Beta-Zellen tritt ist schnell zu ATP verstoffwechselt. Höhere intrazelluläre ATP-Konzentration verringern die offene Wahrscheinlichkeit des ATP-sensitiven Kalium-Ionenkanäle, Beta-Zellen Depolarisation führt. Depolarisation öffnet die Spannung-empfindlichen Calcium-Ionenkanäle und intrazellulären Calcium erhöht. Kalzium löst wiederum Exozytose von Insulin, das in den Blutkreislauf freigesetzt und senkt den Blutzuckerspiegel durch die Förderung der glucoseverwertung5,6,7.
Verschiedene Strategien wurden angewendet, um die Funktion von Beta-Zellen, einschließlich der Überwachung der Membran potenzielle8, direkte Visualisierung der Insulin-Vesikel Exozytose9und Quantifizierung der intrazellulären Ca2 + zu untersuchen Zustrom stellvertretend für Glukose-Reaktionsfähigkeit10. Unter ihnen bietet Bildgebung des intrazellulären Ca2 + den Vorteil von Up-scaling der Analysis auf mehrere einzelne Zellen innerhalb der gleichen Insel11,12, zulassend die Glukose-Reaktionsfähigkeit zwischen im direkten Vergleich einzelnen Beta-Zellen. Intrazelluläre Ca2 + Konzentration kann mit Calcium-Sensitive Fluoreszenzfarbstoffen13 oder genetisch codierte Kalzium Indikatoren (GECIs)14überwacht werden. Während Kalzium-Indikators Farbstoffen fehlen Zelltyp Spezifität, GECIs in einem bestimmten Zelltyp spezifische Promotoren ausgedrückt werden kann. Darüber hinaus bietet die neue Generation von GECIs, z. B. GCaMP6, besseres Signal-Rausch-Verhältnis zusammen mit schneller zeitliche Dynamik15. Hier beschreiben wir das Dienstprogramm der neuen Generation von GECIs in bestimmten GCaMP6s, um Kalzium in Beta-Zellen bei einzelligen Auflösung zu visualisieren. Wir wenden diese Methode auf dem Zebrafisch primäre Inselchen als unser Modell der Wahl. Während der Embryonalentwicklung Beta-Zellen in der primären Insel stammen aus der dorsalen und ventralen Pankreas Knospen16. Die primäre Insel befindet sich an einer Stereotypen anatomische Position innerhalb der Zebrafisch-Bauchspeicheldrüse, ermöglichen die einfache Identifizierung und Isolierung. Beta-Zellen in primären Inselchen sind notwendig für Glukose-Verordnung, da ihre genetische Ablation zu Hyperglykämie17,18führt. Darüber hinaus werden diese Beta-Zellen während des frühen Zebrafisch Entwicklung19Glukose reagieren. Dieses Protokoll kann auch angewendet werden, Imaging der sekundären Inselchen, die während der Post-embryonalen Phase bilden. Das Protokoll ermöglicht Bild Beta-Zellen ex Vivo, in späteren Phasen der Entwicklung und unter definierten Glukosekonzentration.
Protokoll
Alle Verfahren, die unter anderem tierische Themen sind durch das Tierschutzgesetz und mit Genehmigung der Landesdirektion Sachsen, Deutschland (AZ 24-9168.11-1/2013-14, T12/2016) genehmigt worden.
1. Vorbereitung
Hinweis: Dieses Protokoll ist für die ex-Vivo Bildgebung der Zebrafisch primäre Inselchen von doppelten transgenen Tg (Ins:nls-Renilla-mKO2; Cryaa:CFP); TG (Ins:GCaMP6s; Cryaa:mCherry) 19 Zebrafisch. In dieser transgenen Linie fährt der Insulin-Promoter (ins) Beta-Zelle Konkretisierung von zwei transgenen: Nls-Renilla-mKO2, die den Kern der Beta-Zellen mit Monomeren Kusabira Orange 2 (mKO2) kennzeichnet Fluoreszenz; und GCaMP6s15, die grüne Fluoreszenz als Reaktion auf die Zunahme der intrazellulären Kalziumspiegel aussendet. Der Beta-Zelle-spezifischen Ausdruck der GCaMP6s ermöglicht die Glukose-Reaktionsfähigkeit von Beta-Zellen ohne Einmischung von Kalzium Änderungen in Umgebung Zelltypen zu studieren.
- Bereiten Sie frische Fibrinogen Lager (10 mg/mL) durch Auflösen von 10 mg der bovinen Fibrinogen in 1 mL Ca2 +/Mg2 +-Hanks' Balanced Salzlösung (HBSS) in einer 1,5 mL Zentrifugenröhrchen mit. Vortex: kräftig, bis die Fibrinogen-Pulver vollständig auflöst. Halten Sie die Lösung bei Raumtemperatur für mindestens 15 min mehr.
Hinweis: Der Bestand kann bei Raumtemperatur für 2 – 3 h verwerfen die Lager gehalten werden, wenn die Lösung beginnt zu polymerisieren und zähflüssig wird. - Bereiten Sie der Fibrinogen-Arbeitslösung (3,3 mg/mL) durch Verdünnung der Fibrinogen-Lager dreifache in HBSS. Mischen Sie zum Beispiel 300 µL der Fibrinogen-Lager in 600 µL HBSS 900 µL Arbeitslösung Fibrinogen vorzubereiten.
- Vorbereiten von Thrombin-Lösung (10 U/mL) durch Auflösen von 10 Einheiten von Thrombin in 1 mL HBSS oder Phosphat gepufferte Kochsalzlösung (PBS).
Hinweis: Diese Lösung kann im Voraus regelmäñig in 50 µL Teilen vorbereitet, und bei-20 ° c eingefroren - Bereiten Sie 200 mM D-Glukose-Lösung durch 1,8 g D-Glucose in 50 mL Wasser auflösen. Halten Sie bei 4 ° C für die langfristige Lagerung.
- Bereiten Sie 300 mM KCl-Lösung durch 1,1 g KCl in 50 mL Wasser auflösen. Halten Sie bei 4 ° C für die langfristige Lagerung.
- Beschaffen Sie 35 mm Durchmesser Glasboden Gerichte für die Montage der Inseln.
- Für Zerlegung und Montage von dem Inselchen, verwenden Sie ein Stereo-Mikroskop mit Fluoreszenz Lampe und Rotfilter Cube ausgestattet (TRITC: Anregung: 532 – 554 nm, Emission: 570 – 613 nm; oder Texas-rot: Anregung: 540-580 nm, Emission: 592 – 667 nm).
- Für imaging-Kalzium-Zustrom in Beta-Zellen, Verwendung einer invertierten confocal Mikroskop (Zeiss LSM 780 oder ähnliches) mit 20 X (NA 0,8) Luft Ziel und ausgestattet mit einem Kennzeichenhalter für die 35 mm Durchmesser Glasboden Gerichte.
- Bereiten Sie eine 200 mg/L-Lösung von Tricaine Methan Sulfonate (MS222) für euthanizing der Zebrabärbling.
- Beschaffen Sie Petrischalen 90 mm für die Zebrafisch-Dissektion.
(2) Zebrafisch Primary Islet Dissektion und Montage
- Einzuschläfern Sie ein Fisch mit längeren Inkubation in MS222. Dazu sanft entfernen Sie die Fische aus dem Aquarium mit einem Fischernetz und inkubieren Sie es in einer Petrischale mit der MS222-Lösung, bis das Tier keine Kiemendeckel (Kiemen) Bewegung zeigt; in der Regel dauert 5 min. Transfer die Fische in eine Petrischale mit HBSS Lösung mit Ca2 +/Mg2 +.
-
Sezieren Sie unter einem Stereomikroskop mit Fluoreszenz Lampe und Rotfilter Cube ausgestattet die Haut über der rechten Seite des Bauches des Tieres, die Bauchspeicheldrüse zu isolieren.
- Dazu schneiden Sie die Haut von der Zebrabärbling aus Mund, Afterflosse mit scharfen Pinzette. Ziehen Sie die geschnittenen Haut um den Bauch verfügbar zu machen; Diese schnippeln macht die inneren Organe. Die rote Fluoreszenz der mKO2 Ausdruck in Beta-Zellen verwenden, ermitteln Sie die Lage der Inseln durch visuelle Untersuchung unter dem Mikroskop. Bei Bedarf die Lappen der Leber zu entfernen, da sie die kleine Insel decken konnte, so dass es schwer zu finden.
Hinweis: Die primäre Insel liegt in der Nähe der vorderen Region des Bauches, in der Regel auf der rechten Seite.
- Dazu schneiden Sie die Haut von der Zebrabärbling aus Mund, Afterflosse mit scharfen Pinzette. Ziehen Sie die geschnittenen Haut um den Bauch verfügbar zu machen; Diese schnippeln macht die inneren Organe. Die rote Fluoreszenz der mKO2 Ausdruck in Beta-Zellen verwenden, ermitteln Sie die Lage der Inseln durch visuelle Untersuchung unter dem Mikroskop. Bei Bedarf die Lappen der Leber zu entfernen, da sie die kleine Insel decken konnte, so dass es schwer zu finden.
- Reinigen Sie das primären Inselchen, indem Sie sorgfältig umliegendes Gewebe wie Leber und Fettzellen. Treffen Sie Vorkehrungen nicht zu verletzen oder zu stecken das Inselchen; nach dem Löschen des umgebenden Gewebes, werden die einzelnen Zellen auf der kleinen Insel Oberfläche erkennbar.
- Einen Tropfen 30 µL HBSS auf die Mitte eines Tellers Glasboden Pipette. Dieser Rückgang übermitteln Sie sezierte Inselchen.
- Waschen Sie sorgfältig die Insel einmal mit HBSS und einmal mit 30 µL Arbeitslösung der Fibrinogen (3,3 mg/mL). Achten Sie darauf, um zu vermeiden, Trocknen der Insel während der Waschschritte, da andernfalls Zelltod führt.
- Fügen Sie langsam und sanft 10 µL der Thrombin-Lösung (10 U/mL). Lassen Sie die Insel und die Schale für 15 – 20 min. Beachten Sie, dass die Fibrinogen-Thrombin-Drop Viskose und etwas undurchsichtig zu diesem Zeitpunkt werden unberührt.
3. Ex Vivo Live-Imaging GCaMP Fluoreszenz-Intensität im Zebrafisch Primary Inselchen
- Fügen Sie 200 µL HBSS oben auf dem Schimmel und legen Sie die Schale vorsichtig auf den Kennzeichenhalter confocal Mikroskop. Verwenden Sie ein 20 X 0,8 NA, Luft-Ziel für die konfokale Bildgebung. Suchen Sie die Insel mit der Option "Hellfeld".
- Mit Hilfe des Filters für rote Fluoreszenz zu betrachten die nukleare mKO2 Fluoreszenz in den Beta-Zellen, konzentrieren sich auf die Insel. Einzelne Kerne sollte klar erkennbar sein.
- Suchen Sie eine klare Abbildungsebene durch manuelles Ändern der Brennebene des confocal Mikroskop um durch die Dicke der Insel entlang der z-Achse zu bewegen. Stellen Sie sicher, dass die Abbildungsebene eine ausreichende Anzahl (50 – 100) von Beta-Zellen für die Bildgebung enthält und die Helligkeit der nuklearen mKO2 Fluoreszenz einheitlich, vor allem in der Mitte der Insel ist.
- Einrichten einer sequentiellen Erwerb für GCaMP6s und mKO2 Fluoreszenz mit folgenden Einstellungen im Menü"Smart Setup": GCaMP6s, Erregung: 488 nm, Emission: 500 – 555 nm, Falschfarben-: grün (Wählen Sie "GLP"); mKO2, Erregung: 561 nm (mCherry), Emission: 570 – 630 nm, False-Farbe: rot (Wählen Sie "mCherry").
Hinweis: Mit dieser Einstellung wird der rote Kanal Stellung aufnehmen von Beta-Zellkernen, während der grüne Kanal der Fluoreszenzintensität GCaMP aufgezeichnet wird. - In der "Acquisition Mode" legte die Bildauflösung 1.024 x 1.024 Pixel, Geschwindigkeit um 10 und im Durchschnitt bei 1. Einleitung eines kontinuierlichen Aufnahme durch Auswahl der Option für "Zeit-Serie" und die "Dauer" für 500 Zyklen mit ca. 2 s Erfassungszeit pro Frame.
Hinweis: Die ersten 50 Frames der Zeitreihen-entsprechen die Aktivität der Beta-Zellen bei 5 mM Glukosekonzentration. Damit reagiert die Grundlinie. Eine entsprechende Beta-Zelle zeigt zu- und Abnehmen der grünen Fluoreszenz-Intensität mit der Zeit. Wir haben beobachtet, dass ein paar (1 – 5 %) der Beta-Zellen bei 5 mM Glukose oszillieren. -
Halten Sie ein Auge auf die Bildgebung Zyklus. Erhöhen Sie nach den ersten 50 Frames die Glukosekonzentration der umgebenden Lösung bis zu 10 mM ohne die Aufnahme zu unterbrechen.
- Ohne stören die Bildaufnahme, pipette vorsichtig 5 µL 200 mM D-Glukose-Lösung auf das Gel hält die Insel. 150 Frames bei 10 mM Glukose zu erwerben.
Hinweis: Der Anstieg der Glukosekonzentration erhöht die Anzahl der Beta-Zellen durchlaufen GCaMP fluoreszierende Schwingungen in den grünen Kanal. - Stellen Sie sicher, dass die Kerne der Zellen während der Prozess stabil bleiben. Wenn das Inselchen ausgiebig während der Akquisition zittert und Bewegung sind die Kerne aus der Brennebene, verwerfen Sie die Probe (falls erforderlich).
- Warten Sie einen ausreichenden Zeitraum Polymerisation der Fibrinogen-Thrombin Form zu aktivieren, um die Stabilität der nachfolgenden Proben zu gewährleisten.
- Ohne stören die Bildaufnahme, pipette vorsichtig 5 µL 200 mM D-Glukose-Lösung auf das Gel hält die Insel. 150 Frames bei 10 mM Glukose zu erwerben.
- Bei 200 Frames weiter erhöhen Sie die Konzentration der Lösung 20 mM durch sanft pipettieren 10 µL 200 mM D-Glukose-Lösung. Erwerben Sie 150 Frames für die Konzentration von 20 mM.
- Depolarisieren Sie nach 350 Frames die Insel mit 30 mM KCl. Hierzu fügen Sie 20 µL des 300 mM KCl-Stammlösung. Beobachten Sie zu diesem Zeitpunkt, dass die GCaMP6s Fluoreszenz Schwingungen stoppt und mit einer hohen Intensität zu beheben; Beta-Zellen, die nicht auf Glukose reagieren möglicherweise auch eine Erhöhung in grün-Fluoreszenz-Intensität auf KCL Zusatz angezeigt.
(4) Quantifizierung der GCaMP Fluoreszenz Spur für einzelne Beta-Zellen
Hinweis: Um zu verfolgen und die Antworten der einzelnen Beta-Zellen auf unterschiedlichen Niveaus der Glukose zu quantifizieren, quantifizieren der Fluoreszenzintensität GCaMP für den gesamten Zeitraum der Bildgebung. Quantifizierung erfolgt auf zelluläre Auflösung. Verwenden Sie dazu Fidschi20 Bilder (Stufen 4.1 – 4,6) und Tabellenkalkulations-Software oder R21 zu analysieren (Schritte 4,8 – 4,9) die Intensitätswerte der GCaMP Fluoreszenz abzuringen.
- Öffnen Sie die Bilddatei in Fidschi mit der "LSM-Toolbox". Wählen Sie dazu "Plugin | LSM-Toolbox | Zeigen Sie LSM-Toolbox." Klicken Sie in der "LSM-Toolbox" auf "Open LSM" und wählen Sie die Image-Datei.
Hinweis: Für Formate, die von der "LSM-Toolbox" nicht unterstützt, konvertieren sie zuerst zu Analysezwecken tiff. - Extrahieren Sie die Reaktionen der Zellen mit dem Region-of-Interest (ROI) Werkzeug in Fidschi. Öffnen Sie den "ROI-Manager" im Menü "Analyze" unter "Extras". Manuell zeichnen Sie den ROI befindet sich in der Symbolleiste "Polygon-Auswahlwerkzeug" verwenden.
- Ziehen Sie den ROI im roten Kanal in dem Beta-Zellkerne sichtbar sind. Wählen Sie den ROI, so dass es eine Fläche, die größer ist als ein Zellkern umfasst um Beispiele für die Zelle Zytoplasma. Sicherzustellen, dass die ROI-Position zwischen den Frames entspricht und ggf. die Position.
- Die ausgewählten ROIs hinzufügen durch Klicken auf die Schaltfläche "Hinzufügen [t]" der "ROI-Manager". Wählen Sie und den ROI für den Erhalt der Daten auf mehrere Zellen fügen Sie mehrere ROIs hinzu.
- Wählen Sie anschließend im Menü "Analyze" "Set Messungen". Wählen Sie "Integrierte Dichte" für Gewinnung von insgesamt Fluoreszenzintensität innerhalb des Bereichs angeben.
- Verschiebung zu den grün-Kanal mit der GCaMP-Fluoreszenz und wählen Sie "Multi Measure" im "ROI-Manager".
Hinweis: Dies wird die Intensität-Messungen für die Zellen im Laufe der Zeit-Serie bieten. - Für den Fall, dass die ROI-Position durch die Bewegung der Insel angepasst werden muss, manuell kompilieren Sie die Intensität Messungen in verschiedenen Frames. Kopieren Sie und fügen Sie die Werte in eine separate Tabelle.
- Erhalten Sie die Zeitstempel der Bildrahmen aus "LSM-Toolbox". Verwendung "gelten Briefmarken | T-Briefmarken gelten | Dateiname | Dump Textfile"um den Zeitstempel zu erhalten. Speichern Sie Zeitstempel mit der Option "Speichern unter" oder kopieren Sie sie in der Tabelle.
- Führen Sie beim Kompilieren die Intensitätswerte für alle Zellen, die Analyse einer Zelle zu einem Zeitpunkt oder automatisch (z.B.mit Excel-Formeln oder R).
-
Einzelne Zellen in zwei Schritten zu analysieren.
- Im ersten Schritt berechnen der Fluoreszenzintensität oberhalb der Grundlinie. Berechnen Sie zu diesem Zweck die Grundlinie Fluoreszenz Intensität (F0) als Durchschnitt der Fluoreszenz-Intensität für die ersten 50 Frames (5 mM Glukose). Subtrahieren Sie die Grundlinie (F0) aus der gesamten Zeitreihe (F-F0).
Hinweis: einige Zellen zeigen klare GCaMP Schwingungen unter basalen Glukose, die in der Regel weiter nach Stimulation mit höheren Konzentrationen. Für solche Zellen ist es nur möglich, indem man die mittlere Intensität der erste Rahmen in dem die Zellen einen Tropfen Fluoreszenz zeigte F0 zu schätzen. - Erhalten Sie im zweiten Schritt der Analyse die endgültige GCaMP Fluoreszenz-Intensität durch die Normalisierung der Fluoreszenzintensität.
Hinweis: Dies wird durchgeführt, um die Unterschiede zwischen den Inselchen von verschiedenen Tieren zu entfernen. Einzelne Inseln zeigen unterschiedliche Ebenen der Fluoreszenzemission nach Glukose-Stimulation. - Normalisieren Sie die Fluoreszenzintensität, indem man sie mit dem höchsten Intensitätswert. Dafür berechnen die Peak-Intensität (Fmax – F0), und Teilen der Ausgangswerte subtrahiert von Peak-Intensität um die endgültige GCaMP Fluoreszenz-Intensität zu erzielen (F-F0) / (Fmax – F0).
- Im ersten Schritt berechnen der Fluoreszenzintensität oberhalb der Grundlinie. Berechnen Sie zu diesem Zweck die Grundlinie Fluoreszenz Intensität (F0) als Durchschnitt der Fluoreszenz-Intensität für die ersten 50 Frames (5 mM Glukose). Subtrahieren Sie die Grundlinie (F0) aus der gesamten Zeitreihe (F-F0).
- Entsorgen Sie die Zellen, die keine Änderung in der Intensität nach KCl Stimulation, ausstellen, da sie möglicherweise fehlerhaft oder beschädigt.
- Verwenden Sie für die Durchführung der Analyse (Schritte 4,9 – 4.10) in R, R-Skript (Plotcelltrace. (R) versehen mit dieser Handschrift.
Ergebnisse
Mit der oben beschriebenen Protokoll, wurden die Glukose Antworten von Beta-Zellen in einer kleinen Insel eine 45 Tage nach Befruchtung (Dpf) Zebrafisch analysiert. Dafür war das primäre Inselchen von euthanasierten Tiere seziert und montiert in der Fibrinogen-Thrombin-Form in einem Glasboden Teller. Die Insel war in HBSS mit 5 mM Glukose vertieft. Die Glukosekonzentration wurde in gewissem Sinne schrittweise bis 10 mM und 20 mM erhöht. Die Antworten der Beta-Zellen auf der steigenden Glukose-Konzentrationen wurden aufgezeichnet. Zu guter Letzt wurden Beta-Zellen depolarisiert mit 30 mM KCl (Abbildung 1). Die Depolarisation mit KCl induziert Kalzium Eintrag in gesunden Betazellen.
Mit Fidschi und ein Daten-Analyse-Software, die GCaMP6s Fluoreszenzintensität der einzelnen Beta-Zellen wird extrahiert und normalisiert (Abbildung 2). Wie aus der Spur der Fluoreszenzintensität gesehen, anzeigen Beta-Zellen der einzelnen Schwingungen in GCaMP6s Fluoreszenz auf Glukose Stimulation, die nach KCl Stimulation stoppt. Die Technik bietet eine zelluläre Auflösung von den Beta-Zellen Glukose-Reaktionsfähigkeit und ein Fenster in ihrer Funktionalität.
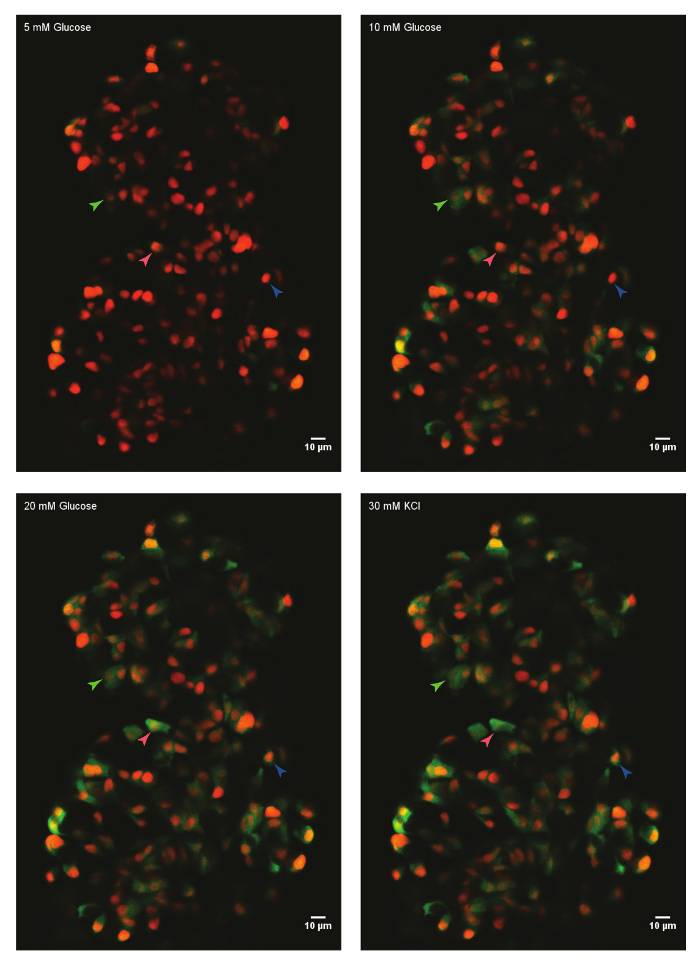
Abbildung 1: Ex Vivo live-Imaging von Kalzium Zustrom mit GCaMP6s im Zebrafisch Betazellen. Eine primäre Inselchen von Tg(ins:nls-Renilla-mKO2); TG(ins:GCaMP6s) Zebrafisch (45 Dpf) wurde in Form von Fibrinogen-Thrombin montiert und mit 5 mM (basal) Glukose inkubiert. Beta-Zellen wurden mit einem roten nuklearen Marker bezeichnet, während die GCaMP6s Fluoreszenz in den grün-Kanal vorhanden ist. Die Insel wurde angeregt mit einer Glukose-Rampe bestehend aus sequenziellen Inkubation mit 10 mM und 20 mM D-Glukose und erschüttert über die Zugabe von 30 mM KCl. Pfeilspitzen einzelne Beta-Zellen markieren deren Aktivität analysiert wurde. Bitte klicken Sie hier für eine größere Version dieser Figur.
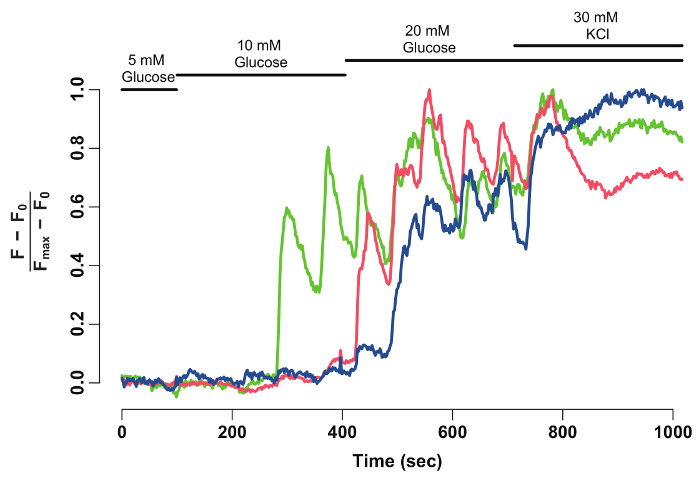
Abbildung 2: normalisiert GCaMP6s Fluoreszenz-Intensität-Ablaufverfolgung für einzelne Betazellen. Normalisierte GCaMP6s Fluoreszenz Intensität-Ablaufverfolgung für die Beta-Zellen markiert mit Pfeilspitzen in Abbildung 1. Die X-Achse gibt die Zeit in Sekunden. An der Spitze zeigen Balken die Konzentration von Glukose und KCl Mittel-und HBSS. Die Y-Achse bezeichnet die normierte Fluoreszenzintensität während der Zeitreihe. Hierzu wird Grundlinie Intensität (F0) als die mittlere Intensität während der Inkubation in 5 mM Glucose berechnet. Dies ist die gesamte Zeitreihendaten abgezogen (F - F0). Die Intensität über Baseline ist durch die maximale Intensität von der Zelle angezeigt normiert (F - F0) / (Fmax- F0). Die normalisierte Ablaufverfolgung zeigt eine Oszillierende Reaktion von Beta-Zellen auf Glucose, die stabilisiert, wenn die Zellen mit 30 mM KCl. depolarisiert werden Klicken Sie bitte hier, um eine größere Version dieser Figur.
Diskussion
Hier zeigen wir eine Technik für die Quantifizierung von Beta-Zellen Glukose Reaktionsfähigkeit bei einzelligen Auflösung. Dies wird durch die Überwachung der intrazellulären Calcium-Konzentration mit genetisch codierte Kalzium Kennzeichen, GCaMP6s ermöglicht. Beta-Zell-Aktivität ist durch die Montage der Insel in einer Fibrinogen-Thrombin-Form aufgenommenen ex Vivo . Ein wichtiger Schritt des Protokolls ist die Stabilität des Werkzeugs. Ausreichend Zeit muss für die Fibrinogen aufzulösen in die HBSS Lösung gegeben werden. Ohne diese wird die Form nicht ausreichend polymerisieren, um Stabilität während der Bildgebung Sitzung zu geben. Eine kleine Insel in Form von Fibrinogen-Thrombin montiert und eingetaucht in Zellkulturmedien kann für mindestens eine Woche (Daten nicht gezeigt) lebensfähig bleiben. Alternativen zu der Fibrinogen-Thrombin-Form, wie Low-Melt Agarose, können genutzt werden, um die kleine Insel22montieren. Ein weiterer kritischer Parameter ist die Zerlegung der Insel. Während dieses Schrittes muss das die Insel umgebende Gewebe entfernt werden, ohne zu verletzen oder stossen der Insel. Eine geschickte Dissektion kommt mit der Praxis.
Eine Einschränkung des imaging-Protokolls ist die Beschränkung auf einer konfokalen Ebene der Insel. Dies geschieht, um die Dynamik der Kalzium-Zustrom in einzelnen Beta-Zellen zu erfassen. Ein Z-Stack durch die gesamte Dicke der Insel führt um zu bildgebenden Geschwindigkeiten und oszillierenden Signalverlust von Einzelzellen zu niedrig. Diese Einschränkung könnte verbessert werden, mit Hilfe schneller wie Spinning-Disk-Mikroskopie, konfokale-Bildgebung um zu ermöglichen, die Kalzium-Dynamik in 3 Dimensionen zu erfassen. Eine weitere Grenze wäre in Vivo Calcium imaging12. Die transparente Art der Zebrafish Embryos oder die Verwendung von Pigment-weniger Stämme von Zebrafish Erwachsenen23 konnte die Möglichkeit für in-Vivo imaging in der Zukunft öffnen.
Die Darstellung der Beta-Zell-Aktivität mit hoher räumlicher und zeitlicher Auflösung ermöglicht es, um die funktionelle Heterogenität zwischen den einzelnen Beta-Zellen zu untersuchen. Dieser Ansatz kann helfen, Licht auf die Existenz von Beta-Zellen Sub-Populationen. Mehrere Studien haben vor kurzem die Existenz von Sub-Populationen in der Beta-Zellen der nominell homogene24,25,26gezeigt. Ex-Vivo Bildgebung kombinierbar mit genetischen Reporter von der Sub-Bevölkerung als Reaktion auf Glukose zu charakterisieren. Darüber hinaus kann die Kombination von bildgebenden Setup mit pharmakologischen Stimulation für das Screening von Verbindungen ermöglichen, die Beta-Zellen Funktionalität verbessern könnte.
Zusammenfassend lässt sich sagen kann die hier vorgestellten Technik Quantifizierung und Vergleich der Glukose Reaktionsfähigkeit für individuelle Betazellen. Es bietet einen direkten Einblick in Beta-Zellen Funktionalität, ein wichtiger Parameter in der Entwicklung von Diabetes.
Offenlegungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Danksagungen
Wir danken Mitglieder des Melua Lab für Kommentare auf das Manuskript, Mitglieder des Zentrums für Regenerative Therapien Dresden (CRTD) Fisch und Mikroskopie-Fazilität für technische Hilfe. N.N. wird unterstützt durch Mittel aus dem DFG-CRTD, Cluster of Excellence an der TU-Dresden, Deutsche Forschungsgemeinschaft (DFG) und dem Deutschen Zentrum für Diabetes-Forschung (DZD).
Materialien
| Name | Company | Catalog Number | Comments |
| Transgenic Zebrafish line: Tg(ins:nls-Renilla-mKO2; cryaa:CFP); Tg(ins:GCaMP6s; cryaa:mCherry) | By request from authors | ||
| Stereo microscope | ZEISS | 495015-0001-000 | SteREO Discovery.V8 |
| Fluorescence lamp | ZEISS | 423013-9010-000 | Illuminator HXP 120 V |
| Red Filter Cube | ZEISS | 000000-1114-462 | Filter set 45 HQ TexasRed |
| Confocal Microscope | ZEISS | LSM 780 | |
| Bovine fibrinogen | Sigma | F8630 | |
| HBSS (Hanks' Balanced Salt solution) | ThermoFisher | 14025092 | |
| Thrombin | Sigma | T4648 | |
| D-Glucose | Sigma | G8270 | |
| KCl | Sigma | P9333 | |
| 35 mm diameter glass-bottom dishes | ThermoFisher | 150680 | |
| tricaine methane sulfonate | Sigma | E10521 | |
| Fine Forceps | Fine Science Tools | 11445-12 | |
| FIJI, using ImageJ Version: 2.0.0-rc-43/1.50e | https://fiji.sc/ | ||
| R, version 3.2.4 | https://www.r-project.org/ | ||
| RStudio | https://www.rstudio.com/ | ||
| plotcelltrace.R | A custom script provided with the manuscript |
Referenzen
- Kahn, S. E. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia. 46 (1), 3-19 (2003).
- Ogurtsova, K., et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 128, 40-50 (2017).
- Pipeleers, D. G. Heterogeneity in pancreatic beta-cell population. Diabetes. 41 (7), 777-781 (1992).
- MacDonald, P. E., Joseph, J. W., Rorsman, P. Glucose-sensing mechanisms in pancreatic beta-cells. Philos Trans R Soc Lond B Biol Sci. 360 (1464), 2211-2225 (2005).
- Hellman, B., et al. Glucose induces oscillatory Ca2+ signalling and insulin release in human pancreatic beta cells. Diabetologia. 37, S11-S20 (1994).
- Bergsten, P., Grapengiesser, E., Gylfe, E., Tengholm, A., Hellman, B. Synchronous oscillations of cytoplasmic Ca2+ and insulin release in glucose-stimulated pancreatic islets. J Biol Chem. 269 (12), 8749-8753 (1994).
- Wollheim, C. B., Pozzan, T. Correlation between cytosolic free Ca2+ and insulin release in an insulin-secreting cell line. J Biol Chem. 259 (4), 2262-2267 (1984).
- Pace, C. S., Price, S. Electrical responses of pancreatic islet cells to secretory stimuli. Biochem Biophys Res Commun. 46 (4), 1557-1563 (1972).
- Ohara-Imaizumi, M., Nakamichi, Y., Tanaka, T., Ishida, H., Nagamatsu, S. Imaging exocytosis of single insulin secretory granules with evanescent wave microscopy: distinct behavior of granule motion in biphasic insulin release. J Biol Chem. 277 (6), 3805-3808 (2002).
- Soria, B., Martin, F. Cytosolic calcium oscillations and insulin release in pancreatic islets of Langerhans. Diabetes Metab. 24 (1), 37-40 (1998).
- Kenty, J. H. R., Melton, D. A. Testing pancreatic islet function at the single cell level by calcium influx with associated marker expression. PLoS One. 10 (4), e0122044 (2015).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Bootman, M. D., Rietdorf, K., Collins, T., Walker, S., Sanderson, M. Ca2+-sensitive fluorescent dyes and intracellular Ca2+ imaging. Cold Spring Harb Protoc. 2013 (2), 83-99 (2013).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Hesselson, D., Anderson, R. M., Beinat, M., Stainier, D. Y. R. Distinct populations of quiescent and proliferative pancreatic beta-cells identified by HOTcre mediated labeling. Proc Natl Acad Sci U S A. 106 (35), 14896-14901 (2009).
- Pisharath, H., Rhee, J. M., Swanson, M. A., Leach, S. D., Parsons, M. J. Targeted ablation of beta cells in the embryonic zebrafish pancreas using E. coli nitroreductase. Mech Dev. 124 (3), 218-229 (2007).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat Protoc. 3 (6), 948-954 (2008).
- Singh, S. P., et al. Different developmental histories of beta-cells generate functional and proliferative heterogeneity during islet growth. Nat Commun. 8 (1), 664 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676 (2012).
- R Core Team. . R: A Language and Environment for Statistical Computing. , (2016).
- Friedman, R. S., et al. An evolving autoimmune microenvironment regulates the quality of effector T cell restimulation and function. Proc Natl Acad Sci. 111 (25), 9223-9228 (2014).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Bader, E., et al. Identification of proliferative and mature β-cells in the islets of Langerhans. Nature. 535 (7612), 430-434 (2016).
- Dorrell, C., et al. Human islets contain four distinct subtypes of β cells. Nat Commun. 7, 11756 (2016).
- Johnston, N. R., et al. Beta Cell Hubs Dictate Pancreatic Islet Responses to Glucose. Cell Metab. 24 (3), 389-401 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten