Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kultur und Transfektion von Primärzellen Zebrafisch
In diesem Artikel
Zusammenfassung
Wir präsentieren Ihnen eine effiziente und einfach zu bedienende Protokoll für die Zubereitung von primären Zellkulturen von Zebrafisch-Embryonen zu Transfektion und live Cell Imaging sowie ein Protokoll Primärzellen von Erwachsenen Zebrafisch Gehirn vorzubereiten.
Zusammenfassung
Zebrafisch-Embryonen sind durchsichtig und entwickeln sich rasch außerhalb der Mutter, wodurch ausgezeichnete in-Vivo Bildgebung der dynamischen biologischen Prozesse in einer intakten und Entwicklungsländern Wirbeltier. Allerdings ist die detaillierte Darstellung der Morphologien von verschiedenen Zelltypen und subzelluläre Strukturen in ganzen Halterungen begrenzt. Daher gründeten wir eine effiziente und einfach zu bedienende Protokoll zur Kultur live Primärzellen von Zebrafisch-Embryonen und Erwachsenen Gewebe.
In Kürze sind 2 Dpf Zebrafisch-Embryonen Dechorionated, Deyolked, sterilisiert und auf einzelne Zellen mit Kollagenase dissoziiert. Nach einem Filtrationsschritt sind Primärzellen vergoldet auf unteren Glasschalen und für mehrere Tage kultiviert. Neue Kulturen, wie lange Begriff differenziert sind, können für hochauflösende konfokale bildgebenden Studien verwendet werden. Die Kultur enthält verschiedene Zelltypen mit gekerbten Myozyten und Neuronen Prominenten auf Poly-L-Lysin-Beschichtung. Speziell Label subzelluläre Strukturen von fluoreszierenden Marker-Proteine haben wir auch eine Elektroporation-Protokoll ermöglicht die Transfektion von Plasmid DNA in verschiedenen Zelltypen, einschließlich Neuronen. So kann in Gegenwart von Bediener definierte Reize, komplexe Zelle Verhalten und intrazellulären Dynamik der primären Zebrafisch Zellen mit hoher räumlicher und zeitlicher Auflösung beurteilt werden. Darüber hinaus mithilfe von Erwachsenen Zebrafisch Gehirn zeigen wir, dass die beschriebenen Dissoziation-Technik sowie die Kultivierung Rahmenbedingungen auch für Erwachsene Zebrafisch Gewebe.
Einleitung
Der Zebrabärbling (Danio Rerio, D. Rerio) ist ein beliebtes Modell für zahlreiche Anwendungsfelder Grundlagen- und biomedizinischen Forschung1Wirbeltier. Zebrafisch-Embryonen entwickeln sich rasch ex Utero, sind transparent und unter dem Mikroskop, so bietet hervorragende Voraussetzungen für das Studium vertebrate Entwicklung in einem lebenden Organismus Fit. Aufgrund der genetischen Lenkbarkeit der Zebrafisch2wurden viele stabile transgenen Reporter Linien mit Zelle Typ-spezifischen Ausdruck der verschiedenen fluoreszierenden Marker ermöglichen die Beobachtung von bestimmten Zellpopulationen gegründet. Die Zebrafisch-Community bietet eine breite Palette von so genannten Gal4-Fahrer-Linien, die eine Transgene Ausdruck der synthetischen Kal4TA4 (oder KalTA3-Äquivalent GalFF) tragen gen mit Gal4-DNA-bindende Domäne von Hefe verschmolzen zu einer viralen transkriptionelle Aktivierung Domains unter der Kontrolle der Zelle typspezifische Enhancer. Diese Treiber-Linien sind Effektor Linien durchzogen, die transgene bestehend aus einer definierten vorgelagerten aktivierenden Reihenfolge (UAS) verschmolzen zu einem Reportergen tragen. Das Kal4TA4-Protein bindet an die FH-Element, und aktiviert die Zelle Typ-selektiven Ausdruck des Reporter-gen3,4. Dieser Ansatz ermöglicht für unterschiedlichste kombinatorische Studien über fast aller verfügbaren Enhancer und Reporter Elemente bei Doppel-transgenen Tieren.
Allerdings ist eingehende live Bildgebung mit Schwerpunkt auf einzelne Zellen oder deren subzelluläre Inhalt im ganzen und sich ständig verändernden Embryo begrenzt. Um bestimmte Zelle biologische Fragestellungen mit der höchsten Auflösung zu begegnen, ist die Verwendung von Zellkulturen oft vorzuziehen. Einige Zelllinien Zebrafisch vorhanden, aber sie gelten als stark ausgewählten5,6,7 und ihre Vermehrung ist oft zeitaufwendig. Darüber hinaus sind alle verfügbaren Zelllinien Fibroblasten abgeleitet, Experimente mit Zellkultur auf eine Art von Zellen zu begrenzen. Daher gründeten wir eine effiziente und einfach zu bedienende Protokoll um primäre Zellen direkt von Zebrafisch-Embryonen und Erwachsenen Zebrafisch Gehirn zusammen mit Ansätzen, die Langlebigkeit der Kultur zu erhöhen und die Vielfalt der kultivierten erweitern vorzubereiten Zelltypen. Darüber hinaus präsentieren wir ein Verfahren zur embryonalen Primärzellen mit Ausdruck Konstrukte für fluoreszierende Organelle Marker transfizieren. So können Morphologien zellulärer und subzellulärer Strukturen mit hoher räumlicher und zeitlicher Auflösung in verschiedene Zelltypen analysiert werden die ihre Hauptmerkmale zu behalten.
Protokoll
Alle hier beschriebenen Tier arbeiten ist gemäß den gesetzlichen Bestimmungen (EU-Richtlinie 2010/63). Wartung und Handhabung von Fischen genehmigt wurde von lokalen Behörden und der Tierschutz Vertreter von der technischen Universität Braunschweig und das untere Sachsen Stand für Verbraucherschutz und Lebensmittelsicherheit (LAVES, Oldenburg, Deutschland; AZ § 4 (02.05) TSchB TU BS).
1. Vorbereitung von Primärzellen von Zebrafish Embryos
- Vorbereitung von 2 Tagen post Düngung (Dpf) Zebrafisch-Embryonen
- Tag 1: Richten Sie mehrere Kreuzungen der Zebrafisch Belastung der Wahl und nach den Vorgaben von Ihrem Zebrafisch Facility Manager8.
- 2. Tag: Mate Fisch und Eier8 direkt nach dem Laichen in einer 10 cm Petrischale (Kunststoff) zu sammeln. Entfernen Sie tot oder kontaminierte Eier mit einer Pasteurpipette (Kunststoff). Wash Eier 1 X mit Danieau 30 % (5,8 mM Natrium-Chlorid, 0,07 mM Kaliumchlorid, Magnesiumsulfat 0,04 mM, Calciumnitrat 0,06 mM, 5 mM 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic Säure, pH 7,2)8 mit Methylenblau 0,0001 % (w/V). Austausch von Mittel-bis Danieau 30 % ohne Methylenblau, da Methylenblau kann dazu führen, Autofluoreszenz dass und Eier über Nacht bei 28 ° C brüten.
Hinweis: Starten Sie mit einem Minimum von 100 Eier pro Fisch Zeile um eine ausreichende Menge an Zellen zu erhalten. Erhöhen Sie mehr als 150 Embryonen in einer Petrischale nicht. - Tag 3: Entfernen Sie tote oder kontaminierte Embryonen zu und tauschen Sie Mittel-bis Danieau 30 aus %. Bestimmen Sie die Anzahl der Embryonen durch zählen. Embryonen über Nacht bei 28 ° c inkubieren
Hinweis: Bei Verwendung eine transgenen Linie mit dem Ausdruck eines fluoreszierenden Reporters Screening auf 1 Dpf oder 2 Dpf kann erforderlich sein.
Hinweis: Für größere Mengen an Embryonen empfiehlt es ein schwarz-weiß-Bild von der jeweiligen Petrischale (Abbildung 1A) und die Anzahl der Embryonen mit einer Bildbearbeitungssoftware zu quantifizieren. - 4. Tag: Die Embryonen sind jetzt 2 Dpf. Chorions entfernen, fügen Sie 1 mL Pronase mit einer Konzentration von 1 mg/mL bis 10 mL Danieau 30 %8 und Embryonen auf einem Schüttler bei Raumtemperatur inkubieren, bis alle Chorions sind freistehende (20-40 min je nach Umgebungstemperatur). Waschen mit Danieau 30 % zur Beseitigung Pronase und Chorions und Embryonen bei Raumtemperatur bis zur weiteren Verwendung.
- Zubereitung von wiederverwendbaren Poly-L-Lysin beschichtetes Glas unten Speisen
Hinweis: Handelsübliche Glasschalen unten sind zur einmaligen Anwendung bestimmt und sind teuer. Das folgende Verfahren beschreibt, wie wiederverwendbare selbstgebauten Glas unten Zubereitung aus standard-Lab-Materialien eine wichtige Rolle.- Bohren Sie ein Loch mit einem Durchmesser von 10 mm an der Unterseite der Standardzelle Kultur Gerichte (Durchmesser 6 cm, Kunststoff) (Abbildung 1 b). Waschen Sie Gericht Böden gründlich mit Leitungswasser, Bohrstaub zu entfernen.
- Silikonfett um das Loch an der Unterseite der Schüssel Böden zu verbreiten und ein Deckglas mit dem Fett als Kleber befestigen. Stellen Sie sicher, dass das Fett die Lücke zwischen Deckglas und Gericht unten abdichtet.
Hinweis: Stellen Sie sicher, dass die Dicke der verwendeten Deckgläsern für die später imaging-Anwendung geeignet ist. - Selfmade Glasschalen unten gründlich, aber vorsichtig, mit kaltem Leitungswasser und Seife zu waschen. Spülen Sie unten Glasschalen dreimal mit entionisiertem Wasser, Seife zu entfernen. An der Luft trocknen Sie Schale Deckel und Böden und bis zur weiteren Verwendung an einer sauberen Box aufbewahren.
- Am Tag der Kultur Vorbereitung (Tag 4, siehe 1.1.4): Befeuchten Sie das Innere der beiden Deckel Schale und Teller Böden mit 70 % (V/V) Ethanol. Schüssel Deckel und Schüssel Böden nach der Innenseite oben in einer sterilen Werkbank mit Laminar-Flow und UV-Licht. An der Luft trocknen Sie bis das Ethanol verdampft ist, dann gelten Sie UV-Licht für 20 Minuten. Nach dieser Behandlung sind Gerichte zusammengestellt und als so steril.
- Für die Beschichtung, pipette 200 µL der Poly-L-Lysin (0,1 mg/mL) in der Mitte jedes Glasschale unten und die Flüssigkeit auf das Deckglas durch Oberflächenspannung mit einer PIPETTENSPITZE brechen verbreitet. Lassen Sie für 60 min. Trocknen, dann waschen Sie 1 X mit sterilen 1 x Phosphat-gepufferte Kochsalzlösung (PBS). Die Flüssigkeit zu entfernen. Halten Sie die Gerichte unter der Bank bis zur weiteren Verwendung.
Hinweis: Andere Beschichtungen können je nach Ziel des Experiments geprüft werden. Wir fanden Poly-L-Lysin ausreichen, um das Wachstum von Neuronen zu unterstützen, während Kunststoff ohne behandelt keine zusätzliche Beschichtung schien günstig für das Wachstum von Fibroblasten-ähnliche Zellen (Abb. 1E, F).
Hinweis: Self-made Glasschalen unten können viele Male verwendet werden. Um das Deckglas auszutauschen, mit warmem Leitungswasser waschen Sie, sorgfältig trennen Sie das Deckglas und entfernen Sie restlichen Fett mit 70 % (V/V) Ethanol und Seife.
- Vorbereitung und Beschichtung von Primärzellen
- Am Tag der Kultur Vorbereitung (Tag 4, siehe 1.1.4): Transfer von Embryonen in eine sterile Zelle Kulturschale (Durchmesser 6 cm) mit einem frischen Kunststoff Pasteurpipette. Entfernen Sie die Flüssigkeit schrittweise, bis alle Embryonen in einen großen Tropfen mit einem Durchmesser von ca. 2 cm oder weniger versammelt sind.
- Legen Sie die Platte mit den Embryonen in der sterilen Werkbank und fügen CO2-unabhängiges Medium (ergänzt um 10 % (V/V) filtriert Rinderserum, 1 x Glutamin und 1,2 % (V/V) 10.000 U Penicillin-Streptomycin; Medium bei allen Ergänzungen ist im folgenden als "Zellkulturmedium" bezeichnet) bis die Schale halb gefüllt ist.
Hinweis: Alternativen zur CO2-unabhängiges Medium kann je nach Ziel des Experiments, wie zum Beispiel Neurobasal Medium, DMEM Medium oder Leibovitzs L-15 Medium getestet werden. CO2-unabhängige und Leibovitz L-15 Medium haben den Vorteil, dass einen CO2 Inkubator. - Um das Eigelb entfernen, pipette Embryonen nach oben und unten mit einem 200 µL-PIPETTENSPITZE. Erfolgreiche Deyolking kann durch die Trübung des Mediums erkannt werden.
- Füllen Sie eine Zelle Kulturschale mit 70 % (V/V) Ethanol und einer anderen Zelle Kulturschale mit Frischzellen-Nährmedium. Verwenden Sie eine Cut-off-1.000 µL-PIPETTENSPITZE Embryonen übertragen in eine sterile Zelle Sieb mit Griff (40 µm; Abbildung 1). Nehmen Sie das Sieb am Griff und Tauchen sie in die Schüssel mit Ethanol, sodass alle Embryonen für 5 eingetaucht sind s. sofort danach Tauchen Sie das Sieb mit Embryonen in die Schüssel mit frischen Zellkulturmedium.
Hinweis: Zelle Siebe können mehrmals wiederverwendbar. Sauber und mit einer weichen Bürste unter fließendem Leitungswasser, laden Sie in 70 % igem Ethanol und trocken und UV-Behandlung unter Steriles Arbeiten Bank direkt vor der Verwendung (siehe auch 1.2.4). - Transferieren Sie die Embryonen in sterilen 1,5 mL Reaktionsgefäße (ca. 100 Embryonen in einem Rohr). Fügen Sie Kollagenase (Typ2) in Zellkulturmedium, eine Endkonzentration von 4 mg/mL in einem Gesamtvolumen von 1 mL verdünnt. Inkubieren Sie Rohre mit Embryonen über ein vertikales Rohr Rotator mit 30 Umdrehungen pro min für 45 Minuten bei Raumtemperatur.
- Distanzieren Sie restlichen Zelle Klumpen durch die Embryo-Kollagenase-Mischung oben und unten mit einem 1.000 µL-PIPETTENSPITZE pipettieren. Filtern Sie die Zellsuspension durch eine sterile Zelle Sieb mit Entlüftung Slot (40 µm; Abbildung 1) in ein 50 mL konische Röhrchen. Spülen Sie das Sieb mit ca. 10 mL frisches Zellkulturmedium.
- Pellet-Zellen durch Zentrifugation für 3 min bei 180 X g. Die Pellets kann fast unsichtbar sein. Nehmen Sie des Überstands vorsichtig und Aufschwemmen der Zellen in 200 µL Frischzellen-Kulturmedium pro 30 ursprünglich eingesetzten Embryonen.
Hinweis: Um einen sichtbaren Pellet zu erhalten, empfiehlt es mit einem Minimum von 100 Embryonen zu starten. - 200 µL Zellsuspension in Schritt 1.3.7 direkt auf die Glasfläche von einer selbstgemachten Poly-L-Lysin-beschichtete Unterseite Glasschale erhaltenen Pipette (siehe 1.2). 60 min bei Raumtemperatur unter der sterilen Werkbank inkubieren. Geben Sie 6 mL frische Zellkulturmedium hinzu und inkubieren Sie Primärzellen bei 28 ° C.
- Führen Sie die gewünschten imaging-Anwendung mit einem inversen Mikroskop bei 28 ° C. Das Zellkulturmedium täglich austauschen. Kulturen können für die Bildgebung für mehrere Tage nach der Beschichtung (dap) verwendet werden.
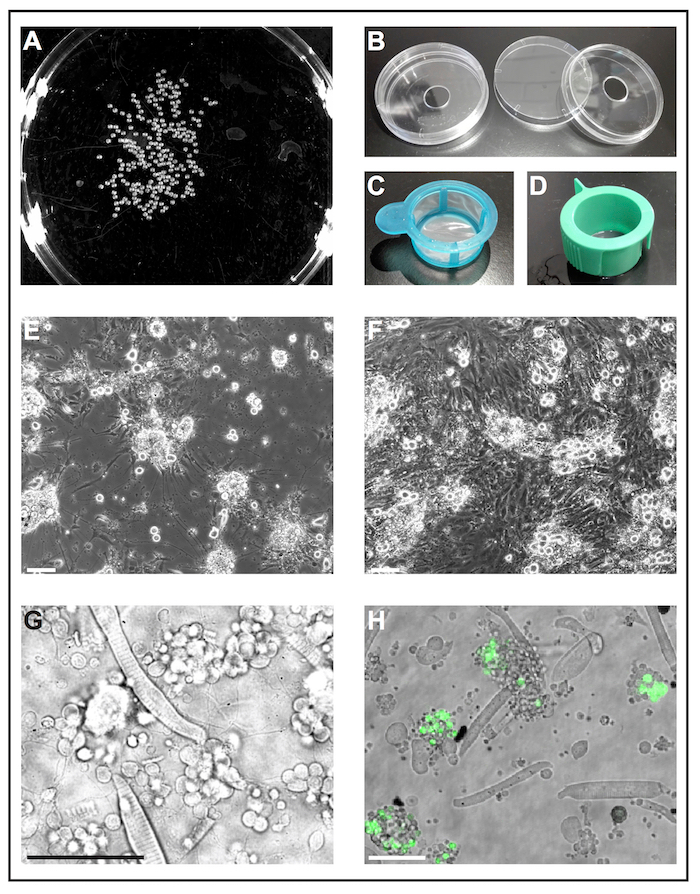
Abbildung 1: primäre Zellkultur von Zebrafisch-Embryonen. (A) schwarz-weiß-Bild 1 dap Embryonen, die durch ein Softwaretool zur Analyse der Anzahl der Embryonen verarbeitet werden können. (B) Handy-Kultur-Gerichte (Durchmesser 6 cm) mit einer Bohrung (Durchmesser 10 mm) werden verwendet, um wiederverwendbare selbstgebauten Glas unteren Gerichte zubereiten. (C) Zelle Siebe (40 µm) mit einem einfachen Griff dienen als "Kescher" Deyolked Embryonen zu Ethanol zu tauchen und sie schnell auf frisches Zellkulturmedium übertragen. (D) Zelle Siebe (40 µm) mit Entlüftung Schlitze verwendet werden, um Zellen nach Kollagenase-vermittelten Dissoziation zu filtern. (E) nach 5 dap, primäre Zellen ausgesät auf Glas beschichtet mit Poly-L-Lysin in erster Linie bilden Neuronen mit ausgeprägten Erweiterungen. Maßstabsleiste = 100 µm. (F) nach 5 auf behandeltem Kunststoff dap, ohne Beschichtung, wie Fibroblasten-Zellen die Kultur überwuchern. Maßstabsleiste = 100 µm. (E) und (F) wurden von einem Epifluorescent Mikroskop erworben. (G) dap übertragbaren Lichtbild von Primärzellen vom Wildtyp Zebrafisch abgeleiteter am 1. Gekerbten Myozyten und Gruppen von Neuronen, die dünnen Prozesse erweitern können leicht beobachtet werden. Maßstabsleiste = 50 µm. (H) kultivierten Zellen von der transgenen Linie Tg (ptf1a: eGFP) jh1, der ausdrückt eGFP in neuronalen Vorläuferzellen meist Gabaergen Neuronen in das Hinterhirn und eine Teilmenge der Netzhaut Zelle Bevölkerungen29, 30 , 31. Maßstabsleiste = 50 µm. (G) und (H) wurden von einer konfokalen Laser-scanning-Mikroskop mit der unteren Glasschalen gemacht wie in (B) erworben. Bitte klicken Sie hier für eine größere Version dieser Figur.
(2) die Transfektion von PV-Zellen mit Plasmid DNA
- Aufschwemmen filtriert und gebeizte Zellen im Schritt 1.3.7 in 1 X PBS statt Zellkulturmedium. Führen Sie ein Aliquot der Zellsuspension mit Trypan blau bestimmen die Anzahl von Zellen in einer Zählung Kammer9zu Flecken.
- Mischen Sie 0,5 Millionen Zellen mit 10 µg hochreine Plasmid DNA in eine 1,5 mL Reaktionsgefäß und passen Sie das Gesamtvolumen zu 100 µL mit 1 X PBS.
Hinweis: Für unsere Experimente benutzten wir hauptsächlich Ausdruck Konstrukte basieren auf dem Plasmid pCS2 +10. Ausdruck von open Reading Frames in die Site mit mehreren Klonen von pCS2 + kloniert wird von der allgegenwärtigen Förderer der menschlichen Cytomegalovirus (CMV-Promotor) angetrieben. Anderen Ausdruck Konstrukte und Förderer können (siehe auch Vertreter Ergebnisse und Abbildung 2 und Abbildung 3) geprüft werden. - Übertragung der Zelle-DNA-Mix sofort eine Elektroporation Küvette (0,4 cm), legen Sie die Küvette in einem Elektroporation Gerät und Electroporate mit den folgenden Einstellungen: einmalige Puls, exponentiellen Zerfall, 280 V, 950 µF.
- Direkt nach der Elektroporation übertragen Sie die Zelle-DNA-Mischung in eine 1,5 mL Reaktionsgefäß mit 300 µL der Frischzellen-Nährmedium.
- Platte 200 µL Zellsuspension wie in 1.3.8 beschrieben und fahren Sie fort wie unter 1.3.9 abhängig von der verwendeten Ausdruck Konstrukt beschrieben, möglicherweise Expression fluoreszierende Proteine nachweisbar, nach ein paar Stunden oder am nächsten Tag.
3. Färbung von festen Primärzellen
Hinweis: Subzelluläre Strukturen können auch durch klassische Immunostaining anstelle von fluoreszierenden Fusion Protein Reporter visualisiert werden. Zebrafisch Primärzellen verwenden wir die folgende standard-Protokoll vorbildlich Fleck Kern, F-Aktin und schimmelpilzschäden Tubulin mit fluoreszierenden Marker.
- Platte Zellen auf Poly-L-Lysin beschichteten Abdeckung rutscht in eine Kultur Gericht oder Multiwell Zellplatte gelegt, wie oben (siehe 1.3.8) beschrieben.
- Zur Befestigung, entfernen Sie das Medium und die Zellen mit 4 % Paraformaldehyd in 1 X PBS. Inkubieren Sie die Zellen für 10 min bei 4 ° C in einen Shaker geben. Wash Zellen 3 X 5 min mit 1 X PBS bei Raumtemperatur. Stellen Sie sicher, dass die 1 X PBS die Zellen vollständig abdeckt und führen Sie die Waschschritte auf einem Boston-Shaker.
- Zu blockieren und zu die festen Zellen, permeabilize decken die Zellen mit 1 X PBS mit 5 % Magermilch und 0,3 % Triton x-100. Legen Sie die Zellen für 10 min bei Raumtemperatur auf einem Boston-Shaker. Waschen Sie Zellen, wie in 3.2 beschrieben.
- Schimmelpilzschäden Tubulin beschriften, ein Marker für die Axone11, verdünnen die primären Antikörper-1:2,000 in 1 X PBS mit 1 % Magermilch. Decken Sie die Zellen mit dieser Lösung und inkubieren sie über Nacht bei 4 ° C in einen Shaker geben. Am nächsten Tag waschen Sie Zellen wie in 3.2 beschrieben.
- Verdünnen Sie die Sekundärantikörpers konjugiert mit den grünen Fluorochrom Fluorescein erfolgt (FITC) 1: 100 in 1 X PBS mit 1 % Magermilch und inkubieren Sie die Zellen mit dieser Lösung für 1 h bei Raumtemperatur im Dunkeln (decken das Gericht z.B. mit einer Box oder Alu-Folie) auf einem Boston-Shaker. Waschen Sie Zellen, wie in 3.2 beschrieben.
- Um gleichzeitig die Aktin-Zytoskelett und Kerne färben, brüten Sie die Zellen in 1 X PBS ergänzt mit Phalloidin12 konjugiert mit einem roten Fluorochrom (01:50) und 4', 6-Diamidino-2-Phenylindole (DAPI)13 (100 ng/mL) für 10 min bei Zimmer Temperatur im Dunkeln auf einem Boston-Shaker. Waschen Sie Zellen, wie in 3.2 beschrieben.
- Um die Zellen für die Abbilderstellung vorbereiten, ein Objekt glasträgers (Objektträger) auf einer sauberen Fläche und auf Tropfen Eindeckmittel drauf. Nehmen Sie ein Deckglas mit festen und gefärbten Zellen aus ein Gericht mit einer Pinzette und legen Sie sie auf das Drop-mit den Zellen, die mit Blick auf die Objekt-Träger. Stellen Sie sicher, dass Eindeckmedium breitet sich über die gesamte Fläche des Deckglases. Im Dunkeln trocknen lassen.
- Store fixiert und montiert Zellen im Dunkeln bei 4 ° C, bis die gewünschte imaging-Anwendung ausgeführt wird.
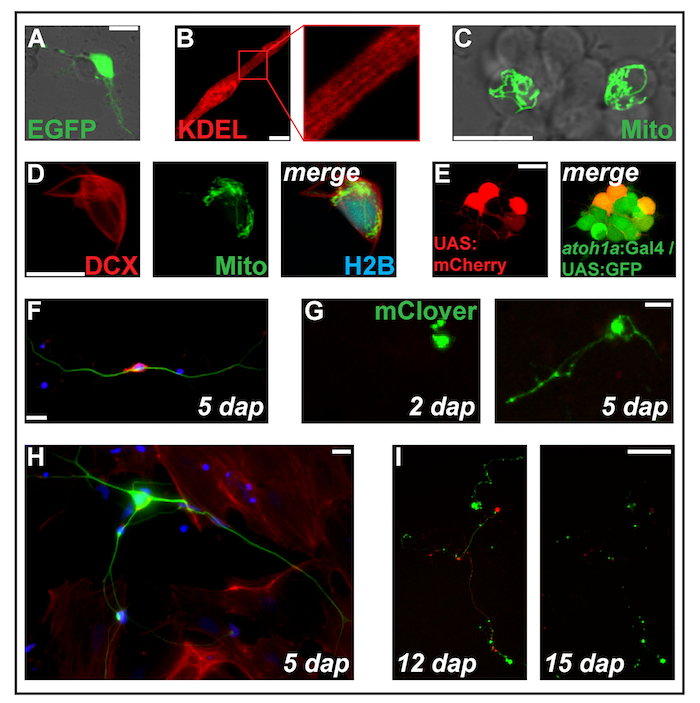
Abbildung 2: Transfektion von Ausdruck konstruiert durch Elektroporation. (A) dap Putative Neuron mit pCS-eGFP 1 transfiziert. (B) gekerbten Myozyten (2 dap) das endoplasmatische Retikulum ausgerichtete Protein ss-RFP-KDEL zum Ausdruck zu bringen. (C) zwei Neuronen in einem neuronalen Cluster 2 mit pCS-MitoTag-YFP transfiziert dap. (D) Zelle (2 dap) dreifach-transfizierten mit pCS-DCX-TdTomato, PC-MitoTag-YFP und pCS-H2B-MseCFP. (E) pSK-UAS:mCherry elektroporiert in Primärzellen (dap 1) abgeleitet aus Doppel-transgenen Embryonen tragen die transgene Tg (atoh1a: Gal4TA4) hzm222 und Tg (4xUAS:KGFPGI) hzm332 was zu GFP Ausdruck in neuronalen Vorläuferzellen von dem Hinterhirn. Skalieren von Balken = 10 µm. (A-E) wurden von einem konfokalen Laser-scanning-Mikroskopie mit den unteren Glasschalen gemacht, wie in Abbildung 1 berworben. (F) fluoreszierende Färbung des festen Zebrafisch primären Neuronen bei 5 dap. Blau: DAPI (Zellkern); Rot: Phalloidin (F-Aktin); Grün: Acetyliert Tubulin (Neuronen). Maßstabsleiste = 10 µm. (G) Neuron-wie Cell mit pCS-mClover transfiziert. Bei 2 dap, keine Verlängerung ist sichtbar. Bei 5 dap, eine Neurit-artige Struktur gebildet hat. Maßstabsleiste = 25 µm. (H) Neuron aus die gleiche Vorbereitung wie die Zelle (F), umgeben von Fibroblasten-wie Zellen. Maßstabsleiste = 10 µm. (ich) Neuron abgeleitet aus einem transgenen Embryo tragen das Transgen Tg (XITubb: DsRed) zf14828 mit pCS-mClover transfiziert. Zwischen 12 und 15 dap, die Neuriten unterziehen massive Degeneration. Maßstabsleiste = 100 µm. Zellen (F-ich) gezeigt wurden ausgesät auf Poly-L-Lysin beschichtetes Glas (F, H) oder Kunststoff (G, ich), angebaut in L-15 Medium in Anwesenheit von 10 % filtriert Rinderserum und die neuronalen Ergänzung B-27 (verdünnte 01:50) und mit einem Mikroskop Epifluorescent abgebildet. Bitte klicken Sie hier für eine größere Version dieser Figur.
4. Vorbereitung von Primärzellen von Erwachsenen Zebrafisch-Gehirn
-
Gehirn-Extraktion
- Wählen Sie einen ausgewachsenen Fischen von mindestens 90 Tagen. Wenn das Arbeiten mit einem bestimmten Zelltyp benötigt wird, wählen Sie eine transgene Linie in der zellspezifische fluoreszierende Reporter Ausdruck erlauben wird, um die gewünschten Zellen zu visualisieren.
- Legen Sie den Fisch in einen Becher gefüllt mit 200 mL der Narkose Tricaine8 (0,2 %) im Danieau 30 %. Warten Sie, bis die Fische nicht bewegt mehr. Tauchen Sie die betäubten Fische in ein Becherglas gefüllt mit 200 mL eiskaltem Wasser für 15 min, es einzuschläfern.
- Füllen Sie eine Petrischale (Durchmesser 6 cm) mit 70 % (V/V) Ethanol. Halten Sie den Fisch am Schwanz mit einer Pinzette und Tauchen sie in das Ethanol. Sicherstellen der Fische ist völlig untergetaucht in Ethanol für 5 s.
- Extrahieren Sie das Gehirn nach dem Protokoll von Gupta und Mullins14 mit folgenden Anpassungen: Verwenden Sie nur autoklaviert oder steril verpackt Tools und den Kopf in sterilen 1 X PBS zu sezieren.
- Direkt nach der Extraktion, platzieren Sie das Gehirn in einer Petrischale (Durchmesser 3 cm) gefüllt mit sterilen 1 X PBS und bewegen Sie das Gericht unter einer sterilen Werkbank für die Zellkultur.
-
Gehirn-Dissoziation und Beschichtung von Primärzellen
- Legen Sie zwei Sätze von sterilen Pinzette (autoklaviert), eine sterile Petrischale (Durchmesser 6 cm) mit 70 % (V/V) Ethanol, eine sterile Petrischale gefüllt (Durchmesser 10 cm) gefüllt mit Leibovitz L-15 Medium ergänzt mit 10 % (V/V) filtriert Rinderserum, B-27 (01:50) und 1,2 % (V / (V) 10.000 U Penicillin-Streptomycin und eine sterile Zelle Sieb mit Griff (40 µm; Abbildung 1) unter den sauberen Werkbank.
- Ort der Zelle Sieb in der Petrischale gefüllt mit Ethanol und sicherzustellen, dass der Flüssigkeitsspiegel mindestens 5 mm höher als die Unterseite des Siebes.
- Mit dem ersten Satz von Pinzette, übertragen Sie das Gehirn in das Sieb, die bereits in das Ethanol platziert und sicherzustellen Sie, dass es vollständig von der Flüssigkeit bedeckt ist. Nach 1 s, Transfer das Sieb mit dem Gehirn in der Petrischale mit Leibovitz L-15 Medium mit den oben beschriebenen Ergänzungen.
- Mit dem zweiten Satz von Pinzette, beschrieben Übertragung, die das Gehirn in einen sterilen 1,5 mL Reaktionsgefäß mit 500 µL Leibovitz L-15 Medium mit den oben genannten gefüllt Ergänzungen. Hinzu kommt eine Endkonzentration von 4 mg/mL in einem Gesamtvolumen von 1 mL Kollagenase (Typ2).
- Inkubieren Sie das Rohr auf einer vertikalen Rohr Rotator mit 30 Umdrehungen pro min für 35 min bei Raumtemperatur. Mechanisch distanzieren Sie die restlichen Gewebe Klumpen von pipettieren nach oben und unten mit einer 1.000 µL PIPETTENSPITZE um die Dissoziation-Prozess zu unterstützen.
- Stoppen Sie die Dissoziation, wenn keine sichtbare Partikel in Lösung bleiben. Filtern Sie die Zellsuspension durch eine sterile Zelle Sieb mit Entlüftung Slot (40 µm; Abbildung 1) in ein 50 mL konische Röhrchen. Spülen Sie das Sieb mit ca. 10 mL frisches Zellkulturmedium.
Hinweis: Wenn einzelne Zellsuspension erreicht wird, entfällt der Filtrationsschritt so wie im Fall von Embryonen Dissoziation. Das Gehirn ist ein weiches Gewebe und als solches ist es anfälliger für homogen in einzelnen Zellsuspension getrennt werden. - Pellet-Zellen durch Zentrifugation für 5 min bei 180 X g und Aufschwemmen der Zelle Pellet in 1 mL frisch Leibovitz L-15 Medium mit den oben beschriebenen Ergänzungen.
- Pipette 500 µL Zellsuspension (50 % der gewonnenen Zellen) auf einem selbstgebauten Poly-L-Lysin beschichtetes Glas unten Teller (siehe 1.2) oder in einem Brunnen von einer 24-Well-Platte. Downscale bei kleineren Flächen (z.B. 125 µL Lösung für einen Brunnen einer 96-Well-Platte). 60 min bei Raumtemperatur unter der sterilen Werkbank inkubieren. Fügen Sie dann den erforderlichen Umfang frisches Medium zu bestimmten Behälter füllen und inkubieren Sie primäre Zellen bei 28 ° C.
- Führen Sie die gewünschten imaging-Anwendung mit einem inversen Mikroskop bei 28 ° C. Kulturen können für die Bildgebung für mehrere Tage nach der Beschichtung verwendet werden. 50 % des Mediums auf einer täglichen Basis zu ersetzen.
Ergebnisse
Abbildung 1 zeigt ein übertragene Licht Bild einer typischen Kultur aus Wildtyp-Embryonen mit gekerbten Myozyten und Trauben von Neuron-ähnliche Zellen werden am häufigsten vorkommende gewonnen. Um bestimmte Zelltypen leichter zu identifizieren, eine transgene Linie mit Zelle Typ-spezifischen Ausdruck eines fluoreszierenden Proteins werden kann (Abbildung 1 H) verwendet.
Diskussion
Hier präsentieren wir Ihnen zwei verschiedene Protokolle zur primären Zellkulturen aus 2 Dpf Zebrafisch-Embryonen oder Erwachsenen Zebrafisch Gehirn.
Die Vorbereitung der primären Zellkulturen aus 2 Dpf Zebrafisch ist relativ einfach für jemanden mit Erfahrung in der Keimzelle Kulturtechniken durchzuführen. Um gute und reproduzierbare Ergebnisse zu erhalten, ist jedoch eine ausreichende Anzahl von Embryonen als Ausgangsmaterial entscheidend (100 ist das Minimum). Während der Anhebung der...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken T. Fritsch, A. Wolf-Asseburg, I. Linde und S.-M. Tokarski für ausgezeichnete Tierpflege und technischen Support. Wir sind dankbar für alle Mitglieder des Köster Lab für intensive und hilfreiche Diskussionen. Wir erkennen dankbar, Finanzierung durch die Deutsche Forschungsgemeinschaft (KO 1949/5-1) und des Bundeslandes Niedersachsen, Niedersächsisches Vorab (VWZN2889).
Materialien
| Name | Company | Catalog Number | Comments |
| Fish lines | |||
| AB (wild-type) | established by Streisinger and colleagues, available from the Zebrafish International Resource Center (ZIRC) | ||
| Tg(ptf1a:eGFP)jh1 | stable transgenic line in which the enhancer of the zebrafish gene ptf1a drives expression of the fluorescent protein EGFP (Parsons et al., 2007) | ||
| Tg(XITubb:DsRed)zf148 | stable transgenic line in which the Xenopus neural-specific beta tubulin promoter drives expression of the fluorescent protein DsRed (Peri and Nüsslein-Volhard, 2008) | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| centrifuge | Eppendorf | model 5804 R | |
| ChemiDoc MP imaging system | BioRad | model XRS+, used to acquire black-and-white images of Petri dishes containing 1 da embryos | |
| confocal laser scanning microscope | Leica microsystems | model SP8, equipped with 28 °C temperature box and a 63X objective | |
| epifluorescent microscope | Leica microsystems | model DM5500B, equipped with 28 °C temperature box and a 40X objective | |
| Gene Pulser Xcell with capacitance extender | BioRad | 1652661 | electroporation device |
| Horizontal shaker | GFL | model 3011 | |
| incubator for cell culture (28 °C) | Memmert | model incubator I | |
| incubator for embryos (28 °C) | Heraeus | type B6120 | |
| light microscope | Zeiss | model TELAVAL 31 | |
| micro pipettes | Gilson | ||
| sterile work bench | Bio Base | with laminar flow and UV light | |
| tweezers | Dumont | Style 5, Inox | |
| vertical tube rotator | Labinco B.V. | model LD-79 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Image Lab Software | BioRad | for the ChemiDoc MP imaging system from BioRad | |
| ImageJ | National Institutes of Health | used for counting 1 dpf embryos by applying the Count particles-tool to the respective black-and-white images; Rasband, W.S., ImageJ, U. S. National Institutes of Health, Bethesda, Maryland, USA, https://imagej.nih.gov/ij/. (1997-2016). | |
| LAS X | Leica Microsystems | for both confocal and epifluorescent microscopes from Leica Microsystems | |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| pCS-DCX-tdTomato | Köster Lab | # 1599 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-eGFP | Köster Lab | # 7 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-H2B-mseCFP | Köster Lab | # 2379 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-mClover | Köster Lab | # 3865 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-MitoTag-YFP | Köster Lab | # 2199 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-ss-RFP-KDEL | Köster Lab | # 4330 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-VAMP1-mCitrine | Köster Lab | # 2291 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pSK-UAS:mCherry | Köster Lab | # 1062 | based on the pBluescript-backbone of Stratagene |
| Plasmid numbers refer to the database entries of the Köster lab. Plasmids are available upon request. | |||
| Name | Company | Catalog Number | Comments |
| Plastic and glass ware | |||
| BD Falcon Cell Strainer (40 µm) | FALCON | REF 352340 | distributed by BD Bioscience, used as “landing net” to dip deyolked embryos into ethanol and to transfer them quickly to fresh cell culture medium |
| 1.5 mL reaction tubes | Sarstedt | 72690550 | |
| 24-well plate | Sarstedt | 83.3922 | |
| 50 mL falconic tube | Sarstedt | 62.547.004 | |
| 96-well plate | Sarstedt | 83.3924.005 | |
| EasyStrainer (40 µm) | Greiner Bio-One | 542 040 | with venting slots; used to filter cells after collagenase-mediated dissociation |
| electroporation cuvette (0.4 cm) | Kisker | 4905022 | |
| glass coverslips | Heinz Herenz Medizinalbedarf GmbH | 1051201 | |
| Microscope slides | Thermo Fisher Scientific (Menzel Gläser) | 631-0845 | |
| Neubauer chamber | Henneberg-Sander GmbH | 9020-01 | |
| Pasteur pipettes (plastic; 3 mL) | A. Hartenstein | PP05 | |
| Petri dishes (plastic; diameter 10 cm) | Sarstedt | 821473 | for zebrafish embryos |
| pipette tips | Sarstedt | Blue (1000 µl): 70762; Yellow (200 µl): 70760002; White (10 µL): 701116 | |
| sterile cell culture dishes (plastic; diameter 3 cm) | TPP Techno Plastic Products AG | 93040 | |
| sterile cell culture dishes (plastic; diameter 6 cm) | Sarstedt | 72690550 | |
| sterile Petri dishes (plastic; diameter 10 cm) | Sarstedt | 83.3902 | for brain dissection |
| Name | Company | Catalog Number | Comments |
| Chemicals and Reagents | |||
| sodium chloride | Roth | 0601.1 | |
| 4 % paraformaldehyde in 1x PBS | Sigma-Aldrich | 16005 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | D1306 | |
| calcium nitrate tetrahydrate | Sigma-Aldrich | C1396 | |
| ethanol p.a. 100% | Sigma-Aldrich | 46139 | |
| goat α-mouse IgG (Fc specific) FITC conjugated | Thermo Fisher Scientific | 31547 | |
| HEPES | Roth | 9105.4 | |
| high vacuum grease | DOW CORNING | 3826-50 | silicon grease used for self-made glass bottom dishes |
| magnesium sulfate heptahydrate | Merck | 105886 | |
| methylene blue | Serva | 29198.01 | |
| Monoclonal Anti-Tubulin, Acetylated antibody | Sigma-Aldrich | T6793 | |
| Aqua-Poly/Mount (mounting medium) | Polyscience | 18606 | |
| poly-L-lysine | Biochrom | L 7240 | |
| potasssion chloride | Merck | 104938 | |
| Skim milk | Roth | 68514-61-4 | |
| Texas Red-X Phalloidin | Thermo Fisher Scientific | T7471 | |
| Tricaine | Sigma-Aldrich | E10521 | Synonym: Ethyl 3-aminobenzoate methanesulfonate |
| Triton X-100 | BioRad | 1610407 | |
| Trypan Blue | Gibco by Life Technologies | 15250061 | |
| Name | Company | Catalog Number | Comments |
| Enzymes | |||
| collagenase (Type 2) | Thermo Fisher Scientific | 17101015 | dissolve powder in cell culture medium (8 mg/mL) and sterile-filter the solution, store aliquots at -20 °C |
| pronase (from Streptomyces griseus) | Roche | 11459643001 | distributed by Sigma-Aldrich, dissolve in 30% Danieau (10 mg/mL) and store aliquots at -20 °C |
| Name | Company | Catalog Number | Comments |
| Medium and solutions for cell culture | |||
| 1x PBS (Dulbecco's Phosphate Buffered Saline) | Gibco by Life Technologies | 14190-169 | distributed by Thermo Fisher Scientific |
| CO2-independent medium | Gibco by Life Technologies | 18045054 | distributed by Thermo Fisher Scientific |
| filtrated bovine serum (FBS) | PAN-Biotech | individual batch | |
| glutamine 100x | Gibco by Life Technologies | 25030081 | distributed by Thermo Fisher Scientific |
| Leibovitz's L-15 medium | Gibco by Life Technologies | 11415049 | distributed by Thermo Fisher Scientific |
| PenStrep (10,000 U/mL) | Gibco by Life Technologies | 15140148 | distributed by Thermo Fisher Scientific |
Referenzen
- Ablain, J., Zon, L. I. Of fish and men: using zebrafish to fight human diseases. Trends in Cell Biology. 23, 584-586 (2013).
- Sassen, W. A., Köster, R. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. , 151 (2015).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80, 153-158 (1999).
- Köster, R. W., Fraser, S. E. Tracing transgene expression in living zebrafish embryos. Developmental Biology. 233, 329-346 (2001).
- Driever, W., Rangini, Z. Characterization of a cell line derived from zebrafish (Brachydanio rerio) embryos. In Vitro Cellular & Developmental Biology - Animal. 29A, 749-754 (1993).
- Badakov, R., Jaźwińska, A. Efficient transfection of primary zebrafish fibroblasts by nucleofection. Cytotechnology. 51, 105-110 (2006).
- Senghaas, N., Köster, R. W. Culturing and transfecting zebrafish PAC2 fibroblast cells. Cold Spring Harbor Protocols. , (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. Journal of Visualized Experiments Available from: https://www.jove.com/science-education/5048/using-a-hemacytometer-to-count-cells (2017)
- Rupp, R. A., Snider, L., Weintraub, H. Xenopus embryos regulate the nuclear localization of XMyoD. Genes & Development. 8, 1311-1323 (1994).
- Piperno, G., Fuller, M. T. Monoclonal antibodies specific for an acetylated form of alpha-tubulin recognize the antigen in cilia and flagella from a variety of organisms. Journal of Cell Biology. 101 (6), 2085-2094 (1985).
- Barden, J. A., Miki, M., Hambly, B. D., Dos Remedios, C. G. Localization of the phalloidin and nucleotide-binding sites on actin. European Journal of Biochemistry. 162 (3), 583-588 (1987).
- Kapuscinski, J. DAPI: a DNA-specific fluorescent probe. Biotechnic & Histochemistry. 70 (5), 220-233 (1995).
- Gupta, T., Mullins, M. C. Dissection of organs from the adult zebrafish. Journal of Visualized Experiments. 37, E1717 (2010).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Stornaiuolo, M. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Molecular Biology of the Cell. 14, 889-902 (2003).
- Lithgow, T. Targeting of proteins to mitochondria. FEBS Letters. 476, 22-26 (2000).
- Nagai, T., Ibata, K., Park, E. S., Kubota, M., Mikoshiba, K., Miyawaki, A. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nature Biotechnology. 20, 87-90 (2002).
- Sassen, W. A., Lehne, F., Russo, G., Wargenau, S., Dübel, S., Köster, R. W. Embryonic zebrafish primary cell culture for transfection and live cellular and subcellular imaging. Developmental Biology. 430, 18-31 (2017).
- Horesh, D., et al. Doublecortin, a stabilizer of microtubules. Human Molecular Genetics. 8, 1599-1610 (1999).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N. G., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22, 1567-1572 (2004).
- Distel, M., Hocking, J. C., Volkmann, K., Köster, R. W. The centrosome neither persistently leads migration nor determines the site of axonogenesis in migrating neurons in vivo. Journal of Cell Biology. 191, 875-890 (2010).
- Matsuda, T., Miyawaki, A., Nagai, T. Direct measurement of protein dynamics inside cells using a rationally designed photoconvertible protein. Nature Methods. 5, 339-345 (2008).
- Archer, B. T., Ozçelik, T., Jahn, R., Francke, U., Südhof, T. C. Structures and chromosomal localizations of two human genes encoding synaptobrevins 1 and 2. Journal of Biological Chemistry. 265, 17267-17273 (1990).
- Griesbeck, O., Baird, G. S., Campbell, R. E., Zacharias, D. A., Tsien, R. Y. Reducing the environmental sensitivity of yellow fluorescent protein. Mechanism and applications. Journal of Biological Chemistry. 276, 29188-29194 (2001).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nature Methods. 10, 407-409 (2013).
- Campbell, R. E., et al. A monomeric red fluorescent protein. Procedings of the National Academy of Sciences of the United States of America. 99, 7877-7882 (2002).
- Peri, F., Nüsslein-Volhard, C. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo. Cell. 133, 916-927 (2008).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132, 5069-5079 (2005).
- Jusuf, P. R., Harris, W. A. Ptf1a is expressed transiently in all types of amacrine cells in the embryonic zebrafish retina. Neural Development. 4, 34 (2009).
- Kani, S., et al. Proneural gene-linked neurogenesis in zebrafish cerebellum. Developmental Biology. 343, 1-17 (2010).
- Distel, M., Wullimann, M. F., Köster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Procedings of the National Academy of Sciences of the United States of America. 106, 13365-13370 (2009).
- Choorapoikayil, S., Overvoorde, J., den Hertog, J. Deriving cell lines from zebrafish embryos and tumors. Zebrafish. 10, 316-332 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten