Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In-vitro- Aufzucht von Solitärbienen: ein Werkzeug für die Beurteilung der Larven Risikofaktoren
In diesem Artikel
Zusammenfassung
Fungizid-Sprays auf Blütenpflanzen können solitäre Bienen gegenüber hohen Konzentrationen von Pollen getragen Fungizid Rückstände aussetzen. Mit Labor-basierten Experimente mit in-Vitro-gezüchteten Bienenlarven, diese Studie untersucht die Wechselwirkungen des Verzehrs von Fungizid behandelt Pollen aus Host und nicht-Host Pflanzen gewonnen.
Zusammenfassung
Obwohl Solitärbienen entscheidend Bestäubung wild und verwalteten Kulturen erbringen, hat dieser artenreichen Gruppe weitgehend in Schädlingsbekämpfungsmitteln Verordnung Studien übersehen worden. Das Risiko einer Exposition gegenüber Fungizid Rückstände ist wahrscheinlich zu hoch sein, insbesondere wenn das Spray auf oder in der Nähe von Wirtspflanzen auftritt, während die Bienen sammeln Pollen ihre Nester bereitstellen. Arten von Osmia , die Pollen von einer ausgewählten Gruppe von Pflanzen (Oligolecty) zu konsumieren, kann die Unfähigkeit zur Nutzung der Pollen von nicht-Wirtspflanzen ihre Risikofaktor für Fungizid-bezogene Toxizität erhöhen. Dieses Manuskript beschreibt Protokolle verwendet, monophyletische Mauerbienen, Osmia Ribifloris Sensu Lato, vom Ei bis zum prepupal Stadium in Kultur Zellplatten unter standardisierten Laborbedingungen erfolgreich aufzuziehen. Die in-Vitro-gezüchteten Bienen werden anschließend verwendet, um Belichtung und Pollen Quelle Fungizid auf Biene Fitness auswirkt. Basierend auf einem 2 × 2 vollständig gekreuzt faktoriellen Design, untersucht das Experiment die Haupt- und interaktive Auswirkungen von Fungizid Exposition und Pollen Quelle an Larven Fitness, durch prepupal Biomasse, Larvale Entwicklungszeit und Survivorship quantifiziert. Ein großer Vorteil dieser Technik ist, die Verwendung von in-Vitro-gezüchteten Bienen natürlichen Hintergrund Variabilität reduziert und ermöglicht die gleichzeitige Manipulation von mehreren experimentellen Parameter. Das beschriebene Protokoll präsentiert ein vielseitiges Werkzeug für Hypothesen Tests, an denen die Suite von Faktoren, die Gesundheit der Bienen. Für Erhaltung Bemühungen mit erheblichen und dauerhaften Erfolg erfüllt werden werden solche Einblicke in das komplexe Zusammenspiel von physiologischen und ökologischen Faktoren, die Biene Rückgänge erweisen sich als kritisch.
Einleitung
Angesichts ihrer Rolle als die dominierende Gruppe von Bestäubern1, stellt der weltweite Rückgang der Bienenvölker eine Bedrohung für Ernährungssicherheit und Ökosystem Stabilität2,3,4,5,6 ,7. Die rückläufigen Trends in beiden verwaltet und wilde Bienenvölker werden mehrere gemeinsame Risikofaktoren einschließlich Habitatfragmentierung, neue Parasiten und Krankheitserreger, Verlust der genetischen Vielfalt und die Einführung invasiver Arten3 zugeschrieben ,4,7,8,9,10,11,12. Insbesondere ist der dramatische Anstieg der Verwendung von Pestiziden, (z. B. Neonicotinoide) direkt zu negativen Auswirkungen bei den Bienen13,14,15verbunden. Mehrere Studien haben gezeigt, dass der Synergismus zwischen Neonicotinoide und Ergosterol-Biosynthese-Hemmung (EBI) Fungizide über mehrere Biene Arten16,17,18 , hohe Mortalität führen kann , 19 , 20 , 21 , 22. dennoch Fungizide, lange Zeit als "Biene-Safe", weiterhin auf-Blüte ernten ohne viel Kontrolle23gesprüht werden. Sammlerbienen sind dokumentiert worden, um routinemäßig wieder Pollen Lasten mit Fungizid Rückstände24,25,26kontaminiert. Der Verzehr von solchen Fungizid-Ladenpollen kann dazu führen, dass hohe Mortalität unter larval Bienen27,28,29,30und eine Palette subletale Effekte unter Erwachsenen Bienen16 , 31 , 32 , 33 , 34. eine aktuelle Studie legt nahe, dass Fungizide Biene Verluste verursachen, durch die Veränderung der mikrobiellen Gemeinschaft im Bienenstock gespeichert Pollen, dabei stören die kritische Symbiosen zwischen Bienen und Pollen-borne Mikroben35.
Obwohl solitäre Bienen für die Bestäubung von mehreren wild und landwirtschaftliche Pflanzen36,37,von entscheidender Bedeutung sind hat38, diese heterogene Gruppe der Bestäuber in Pestizid Überwachung Studien viel weniger Aufmerksamkeit erhalten. Das Nest einer erwachsenfrau einsame enthält ca. 5-10 versiegelte Brut Kammern, jeweils bestückt mit einer endlichen Masse von mütterlich gesammelten Pollen und Nektar und ein einzelnes Ei-39. Nach dem Schlüpfen verlassen die Larven auf die zugewiesenen Pollen-Bereitstellung und die zugeordneten Pollen getragen Mikrobiota, angemessene Ernährung40,41zu erhalten. Weil sie die Vorteile eines sozialen Lebensstils fehlt, möglicherweise solitäre Bienen anfälliger für Pestizid Exposition42. Zum Beispiel während der Defizite im sozialen Bienen nach einem Spray kompensiert werden kann einige verlängern von Arbeitern und neu entstehende Brut, der Tod eines einzigen einsamen erwachsenfrau endet alle Vermehrungstätigkeit43. Solche Unterschiede in der Empfindlichkeit unterstreichen die Notwendigkeit, diverse Biene Taxa in Ökotoxikologische Untersuchungen ausreichend Schutz für verwaltete und wilde Bienen gleichermaßen zu integrieren. Aber abgesehen von einer Handvoll Studien, Untersuchungen über die Auswirkungen der Fungizid-Exposition in erster Linie konzentriert sich auf soziale Bienen18,23,32,44,45 ,46,47,48,49.
Solitäre Bienen gehören zur Gattung Osmia (Abbildung 1) sind weltweit als effiziente Bestäuber mehrere wichtige Obst-und Nuss Pflanzen39,50,51,53, benutzt worden 53. Gruppen mit anderen verwalteten Bestäuber24,54,55,56,57,58, Osmia Bienen sind routinemäßig Fungizide in voller Blüte ernten44aufgesprüht ausgesetzt. Adulte Weibchen auf Nahrungssuche auf vor kurzem gespritzten Pflanzen sammeln und lagern ihre Brut Kammern mit Fungizid-beladenen Pollen, die später die alleinige Ernährung für die entwickelnden Larven bildet. Verzehr von kontaminierten Pollen Bestimmungen kann anschließend die Larven zu Fungizid Rückstände42verfügbar. Das Risiko eines möglicherweise höhere unter monophyletische Arten, die nur auf wenige eng verwandte Host Pflanzen59,60,61Futter. Zum Beispiel scheinen bestimmte Megachilid Bienen, bevorzugt für minderwertige Asteraceae Pollen, als ein Mittel zur Verringerung von Parasitismus62Futter. Jedoch wurde das Ausmaß auf dem Fungizide Larven Fitness unter monophyletische solitäre Bienen auswirken empirisch nicht quantifiziert. Das Ziel dieser Studie ist es, ein Protokoll, um die wichtigsten test entwickeln und interaktive Effekte von Fungizid Exposition und Pollen Quelle auf die Fitness der in-vitro- aufgezogen Solitärbienen. Um zu untersuchen, können Eier von O. Ribifloris Sensu Lato (s.l.) im Handel bezogen werden (Table of Materials). Diese Population eignet sich wegen seiner Bedeutung als eine native Bestäuber und seine starke Vorliebe für die nektarreichen Mahonia Aquifolium (Mahonie) gefunden in der Region53,63,64 (Abbildung 2).

Abbildung 1: Ein hochauflösendes Foto von einem Erwachsenen Osmia Ribifloris. Photo credit Dr. Jim Cane, Forschung Entomologe, USDA-ARS Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 2: Phragmite nisten Schilf von Osmia Ribifloris (s.l.) mit einem brütenden Weibchen im Vordergrund. Kammer-Partitionen und Klemme Stecker für die Stimmzungen sind aus vorgekaute Blättern gefertigt. Bildnachweis: Herr Kimball Clark, NativeBees.com Klicken Sie bitte hier, um eine größere Version dieser Figur.
Das erste Ziel dieser Studie ist die Wirkung des Verzehrs von Fungizid behandelt Pollen auf Larven Fitness (gemessen an der Entwicklungszeit und prepupal Biomasse) bewerten. Während der Exposition gegenüber der allgemein angewandten Fungizid-propiconazolhaltige mit erhöhter Mortalität unter Erwachsenen Bienen über mehrere Arten 23,24,32,44,45, verbunden worden ist 54,55,56,57,58,65,66,67, ihre Auswirkungen auf die larval Bienen ist weniger bekannt. Das zweite Ziel dieser Studie ist die Bewertung der Auswirkungen des Konsums von nicht-Host Pollen auf Larven Fitness. Bisherige Studien zeigen, dass Larven der monophyletische Bienen nicht weiterentwickeln, wenn gezwungen, nicht-Host Pollen68verbrauchen. Solche Ergebnisse können Schwankungen der Biene Physiologie69, Pollen Biochemie70und die wohltuende Microbiome verbunden mit natürlichen Pollen Bestimmungen71zugeschrieben werden. Das dritte Ziel dieser Studie ist es, die interaktiven Effekte der Fungizidbehandlung und diätetische Pollen auf Larven Fitness zu bewerten.
Zahlreiche biologische Merkmale, einschließlich mütterlichen Körpergröße, sind Bereitstellung Rate, Futtersuche Strategie und Pollen Menge72,73,74,75 bekannt, larval Fitness unter solitäre Bienen beeinflussen. Diese Faktoren können erhebliche Variabilität zwischen Schilf, die eine Herausforderung vertretbar experimentellen Designs zu entwickeln, bei der Beurteilung der Larven Gesundheit darstellt einführen. Darüber hinaus da die Larvalentwicklung in versiegelten Verschachtelung Schilf auftritt, sind der Auswirkungen von solchen Variabilität auf die Nachkommen schwierig zu visualisieren und quantifizierte ohne Verwendung von nicht-tödlichen Techniken (Abbildung 3). Um diese Herausforderung zu meistern, sind alle Hypothesen im Rahmen dieser Studie mit Larven aufgezogen außerhalb ihre Verschachtelung Schilf getestet. Das experimentelle Design stellt eine vollständig gekreuzte 2 × 2 Faktorielle Set-ups, mit jeder Faktor bestehend aus 2 Ebenen; Faktor 1: Fungizid Exposition (Fungizid; Kein Fungizid); Faktor 2: Pollen Quelle (Host Pollen, Non-Host Pollen). Bienen werden aus dem Ei in die prepupal Phase im sterilen multiwell Kultur Zellplatten unter kontrollierten Laborbedingungen ausgelöst. Jeder ist gut individuell bestückt mit einer standardisierten Menge Blütenstaub und ein einziges Ei. Nach dem Schlupf der Larve ernährt sich von den zugewiesenen Pollen in den Brunnen, vervollständigt Larvalentwicklung und Verpuppung initiiert. Frühere Studien haben gezeigt, dass unerklärliche Sterblichkeit bei den Bienen innerhalb dieser künstliche Aufzucht Umgebung als in die wilde49,76aufgetretenen geringer ist. Die Verwendung von in-Vitro-gezüchteten Bienen hat mehrere Vorteile gegenüber feldbasierte Untersuchungen: 1) es minimiert die verwirrende Wirkung der natürlichen Variabilität und unkontrollierte Faktoren, die in der Regel mit Feld-Studien; (2) Es kann mehrere Ebenen von Manipulation für jedes Risiko von Interesse über Behandlungsgruppen gleichzeitig getestet werden; (3) die Anzahl der Wiederholungen kann vorgegeben werden, und experimentelle Faktoren für jede replizieren können individuell bearbeitet werden; (4) Larven Antwortvariablen problemlos visualisiert und unabhängig ohne störende neben Larven aufgenommen; (5) das Protokoll kann geändert werden, um komplexere experimentellen Designs mit mehreren Faktoren und Zielgrößen zu berücksichtigen.

Abbildung 3. Inhalte in eine natürliche Nistplätze Schilf von Osmia Ribifloris (s.l.). Nahaufnahme von (A) ein seziert Schilfrohr mit einzelnen Kammern, Pollen Bestimmungen und Partitionen, und (B) frisch Pollen Bestimmungen und die damit verbundenen Eier (gekennzeichnet mit einem schwarzen Kreis) geerntet. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protokoll
1. bereiten Sie Propiconazolhaltige Lösungen für Fungizid Belichtung Experimente
- Bereiten Sie 0,1 x Fungizid-Lösung durch entsprechende Mengen von im Handel erworbenen propiconazolhaltige 14,3 % in sterilem Wasser am Tag des Experiments auflösen. Stellen Sie sicher, dass nur frisch zubereitete Fungizid-Lösung für alle Anwendungen verwendet wird.
- Fügen Sie 23 µL 0.1 x Fungizid-Lösung pro Gramm Pollen Bestimmung, die maximale Konzentration des propiconazolhaltige bereits berichtet von Bienen gesammelte Pollen24 (0,361 PPM oder µg Wirkstoff g-1 von Pollen) zu erhalten.
2. ernten Sie Eier und Host-Pollen-Bestimmungen von Osmia Schilf
- Mit einem sterilen Skalpell, sezieren Sie, frisch angeschlossen nisten Schilf von Osmia, Aufteilung in zwei Teile entlang der Länge des Blattes, die einzelnen Kammern verfügbar zu machen.
Hinweis: Jedes Nest kann zwischen 8 bis 14 Kammern und ein einziges Ei innerhalb einer Kammer enthalten. - Inspizieren Sie Schilf visuell um die Kammern männliche Eier anhand der bisher veröffentlichten Richtlinien77zu identifizieren. Verwendung einer sterilisierten gebogene Nadel entfernen jede Pollen Bestimmung zusammen mit dem zugehörigen Ei aus der Verschachtelung Schilf, und in einem sauberen wiegen Boot.
- Sanft die Bereitstellung mit einem sauberen feinen Pinsel das Ei trennen und das Frischgewicht der Pollen Bestimmung aufzunehmen und Ei mit einer standard-Labor-Waage. Das durchschnittliche Gewicht der männlichen Pollen Bestimmungen zu berechnen.
- Führen Sie die nachfolgenden Schritte mit einer minimalen Verzögerung die Gefahr eines Schadens zum Ei vor Übertemperatur und Austrocknung zu reduzieren.
3. bereiten Sie Host Pflanze Pollen Bestimmungen
- Sichtkontrolle des mütterlich gesammelten Wirtspflanze Pollens aus der Verschachtelung Kammern um sicherzustellen, dass keine Parasiten vorhanden78ausgegraben. Um jede mögliche mütterliche Bias zu reduzieren, kombinieren Sie die Pollen-Bestimmungen zu einer einheitlichen Masse in eine sterile Petrischale und mischen Sie gut mit einer sterilisierten Nadel.
- Teilen Sie die kombinierte Masse in Pollen Neuregelungen, um sicherzustellen, dass das Gewicht jedes rekonstituierte Bestimmung etwa gleich auf das durchschnittliche Gewicht einer natürlich zugewiesenen männlichen Bestimmung ist (meine ± SE, 0,35 ± 0,01 g, N = 42).
Hinweis: Da Osmia sp. weist kleinere Pollen Bestimmungen an die männlichen Nachkommen, dies führt zu geringeren Körpergewicht der männlichen Larven im Vergleich zu Frauen77. Um eine solche Voreingenommenheit durch geschlechtsspezifische Unterschiede zu vermeiden, verwenden Sie nur männliche Eier in den Experimenten.
4. bereiten Sie-Wirtspflanze Pollen Bestimmung vor
- Pulverisieren Sie kommerziell gekauften Honig Bienen gesammelte Pollen zu einem feinen Pulver mit einer standard-Labor-Kugelmühle.
- Basierend auf den Feuchtigkeitsgehalt der mütterlich gesammelt Host Pollen Bestimmungen (~ 20 %), Hydrat der Pollen Pulver mit entsprechenden Volumes von 40 % sterilisiert Zucker Lösung79 und Mischung gründlich um zu eine Teig-Konsistenz zu bilden.
- Teilen Sie in einzelnen Pollen Massen, jeweils mit einem Gewicht von ungefähr das gleiche wie das durchschnittliche Gewicht einer natürlich zugewiesenen männlichen Bestimmung.
Hinweis: Feuchtigkeitsgehalt der mütterlich gesammelten Host Pollen, die Bestimmungen in vor standardisiert werden können, durch den Vergleich der frischen und trockenen Gewichts Pollen Bestimmungen von 30 zufällig ausgewählten männlichen Kammern80. Um das Trockengewicht zu erhalten, sollten Pollen Bestimmungen werden gefriergetrocknet in ein Gefriertrockner (1,5 Pa 72 h).
5. bereiten Sie Multiwell Zellplatten Kultur
- Linie individuelle Vertiefungen der sterilen 48-Well Kultur Teller mit autoklaviert Zinn Tassen (5 × 9 cm). Verwenden sterile Pinzetten, sanft Flair aus dem oberen Rand der Kapsel, so dass es die Pollen Bereitstellung unterbringen kann.
- Legen Sie eine einzelne Masse der Host oder nicht-Host Pollen Bestimmung in die blechtasse mit sterilen Werkzeugen basierend auf der behandelten Gruppe.
Hinweis: Zur Vermeidung von Kreuzkontamination verwenden Sie separate Platten für Behandlungs- und Kontrollgruppen.
6. Fügen Sie Fungizide
- Machen Sie eine zentral platzierte Depression innerhalb der Pollen-Masse mit einem sterilen Holzstab. Verwenden Sie einen neuen Stick für jede Erbringung von Pollen.
- Fügen Sie entsprechende Mengen Fungizid-Lösung (zur Behandlung) oder sterilem Wasser (für Steuerelemente) in die Depression. Klemmen Sie die Eröffnung der Depression mit sterilen Pinzette zur Minimierung der Kontaktfläche zwischen das Fungizid / sterile Wasser und das Ei.
- Sicherzustellen, dass der Faktorielle Aufbau des experimentellen Designs, die ausgerichtet in der schematischen Darstellung (Abb. 4) dargestellt.
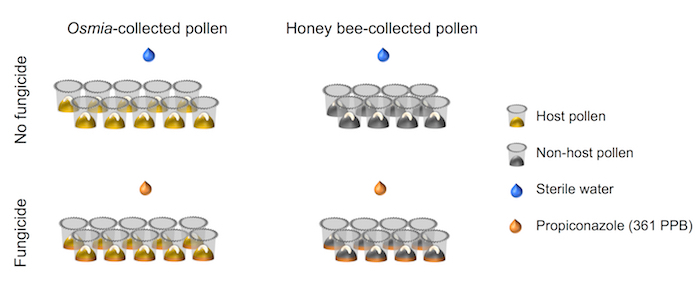
Abbildung 4. Schematische Darstellung des experimentellen Aufbaus. Das Experiment ist ein vollständig gekreuzt 2 × 2 Faktorielle Setups. Faktor 1 stellt Fungizid Exposition und besteht aus 2 Ebenen: (i) kein Fungizid (N = 10), und (Ii) Fungizid (N = 10). Faktor 2 Pollen als Finanzierungsquelle und besteht aus 2 Ebenen: (i) Host Pollen (N = 8), und (Ii) nicht-Host Pollen (N = 8). Bitte klicken Sie hier für eine größere Version dieser Figur.
(7) hinten und Larven zu beobachten
- Legen Sie eine zufällig gewählte männliche Ei auf der Oberseite der Pollen Bestimmung mit einem sauberen feinen Pinsel. Sobald Eier auf alle Bestimmungen gestellt worden sind, setzen Sie den Deckel der Kultur Zellplatte, befestigen Sie es mit Klebeband an den Ecken beschriften.
- Legen Sie die well-Platten auf einem sauberen Tablett und bedecken Sie es mit einem dunklen Tuch, Kontakt mit direktem Licht zu behindern. Platz 6 Brunnen Platte mit 30 mL steriles Wasser in das Fach, um Austrocknung zu verhindern. Lassen Sie Inkubation Tabletts ungestört in einem Inkubator bei Raumtemperatur.
- Beobachten Sie well-Platten täglich unter dem sezierenden Mikroskop ohne Abnehmen des Deckels von der well-Platten. Stellen Sie sicher, dass die Larven lebendig sind, indem für die Bewegung. Wenn keine Bewegung erkannt wird, verwerfen Sie die blechtasse, die Toten Larven und die restlichen Blütenstaub-Bereitstellung enthalten. Lassen Sie alle Überlebende Larven innerhalb der well-Platten ungestört entwickeln, bis sie die prepupal Stadium zu erreichen.
- Entfernen Sie die Larve aus der blechtasse, sobald es die prepupal Stufe41erreicht. Verwendung einer Bürste zu reinigen Stuhldrang aus dem Silk Kokon. Sorgfältig die Silk Cocoon sezierenden Mikroskop durchtrennt und Extrahieren der Prepupa mit Kautschuk-Zangen.
- Behandeln Sie die Prepupa vorsichtig, um sicherzustellen, dass die Tools nicht den weichen Körper durchbohren zu tun. Notieren Sie das Frischgewicht des Prepupa (prepupal Biomasse) und die Entwicklungszeit vom Ei in die prepupal Phase (Larvale Entwicklungszeit).
Hinweis: Jeder Tote Larve sollte sofort verworfen, um unerwünschten mikrobiellen Wachstums auf den Kadaver und übrig gebliebene Pollen zu verhindern. Dies reduziert das Risiko einer Infektion für die verbleibenden gesunden Larven.
Ergebnisse
Larval Fitness wurde mit drei Metriken (i) Larvale Entwicklungszeit, (Ii) prepupal Biomasse und (Iii) Prozent Survivorship quantifiziert. Eine zwei-Wege-ANOVA wurde mit Fungizid Exposition durchgeführt (zwei Ebenen: kein Fungizid, Fungizid) und Pollen Quelle (zwei Ebenen: Host Pollen, Non-Host Pollen) als die unabhängigen Variablen und Larvale Entwicklungszeit als abhängige Variable. Der Haupteffekt für Fungizid Exposition (F1,28 = 1.24, P = 0,28) war nich...
Diskussion
Aufzucht von Bienen außerhalb ihrer natürlichen Verschachtelung Schilf unter Laborbedingungen ermöglicht die Prüfung von mehreren Hypothesen, die im Zusammenhang mit Larven Fitness. In dem Maße, in dem nicht identifizierte Faktoren weiterhin Bienensterben führen, riskieren Studien können in-vitro- Experimente mit Hilfe identifizieren möglicher Bedrohungen und Management-Praktiken zu informieren, für diese artenreichen Gruppe der wilden Bestäuber 12 ,
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren danken Kimball Clark und Tim Krogh für die Bereitstellung von Osmia Verschachtelung Schilf, Meredith Nesbitt und Molly Bidwell für Hilfe im Labor, DRS. Cameron Currie, Christelle Guédot, Terry Griswold, Michael Branstetter und drei anonymen Gutachtern für Ihre nützliche Kommentare, die das Manuskript verbessert. Diese Arbeit wurde von USDA-Agricultural Research Service angeeignet Mittel (aktuelle Research Information System #3655-21220-001), Wisconsin Ministerium für Landwirtschaft, Handel und Verbraucherschutz (#197199), National Science Foundation (unter unterstützt. Grant Nr. DEB-1442148), DOE Great Lakes Bioenergy Research Center (DOE Office of Science BER DE-FC02-07ER64494).
Materialien
| Name | Company | Catalog Number | Comments |
| eggs of O. ribifloris sensu lato (s.l.) | Kaysville, Davis County, Utah, USA | ||
| Osmia reeds | Nativebees.com | NA | Freshly plugged reeds |
| Dissection set | VWR | 89259-964 | Sterilize before use |
| Long Nose Pliers | Husky | 1006 | |
| 6 well culture plates | VWR | 10062-892 | Sterile sealed |
| 48 well culture plates | VWR | 10062-898 | Sterile sealed |
| Petri dishes | VWR | 25373100 | Sterile sealed |
| Square Weighing Boats | VWR | 10770-448 | |
| Camel Hair Brush | Bioquip | 1153A | |
| Tin capsules | EA Consumables | D1021 | Sterilize before use |
| Sucrose | VWR | 470302-808 | |
| Propiconazole 14.3 | Quali-Ppro | 60207-90-1 | Propiconazole 14.3% |
| Honey bee pollen | Bee energised | 897098001244 | Untreated, natural, raw pollen |
| Microbalance | VWR | 10204-990 | |
| Pulverisette | LAB SYNERGY INC. | 30334913 | |
| Wooden sticks | VWR | 470146908 | Sterilize before use |
| Sealing tape | VWR | 89097-912 | |
| Microscope | VWR | 89403-384 | |
| Planting tray | VWR | 470150-632 | |
| Ethanol | VWR | BDH1158-4LP | |
| Centrifuge tube | VWR | 21008936 | |
| Microsyringe | Cole-Palmer | UX-07940-07 | |
| Rubber tweezer | Amazon | B0135HWPN4 | |
| Syringe needles | VWR | 89219-334 | |
| Freeze drier | Labcono | LFZ-1L | |
| Statistical software | SPSS | Version 21.0 |
Referenzen
- Klein, A. -. M., et al. Importance of pollinators in changing landscapes for world crops. P Roy Soc Lond B Bio. 274 (1608), 303-313 (2007).
- Biesmeijer, J. C. J., et al. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C., Neumann, P., Schweiger, O., Kunin, W. E. Global pollinator declines: Trends, impacts and drivers. Trends Ecol Evol. 25 (6), 345-353 (2010).
- Cameron, S. A., et al. Patterns of widespread decline in North American bumble bees. P Natl Acad Sci USA. 108 (2), 662-667 (2011).
- Gallai, N., Salles, J. M., Settele, J., Vaissière, B. E. Economic valuation of the vunerability of world agriculture confronted with pollinator decline. Ecol Econ. 68 (3), 810-821 (2009).
- Fontaine, C., Dajoz, I., Meriguet, J., Loreau, M. Functional diversity of plant-pollinator interaction webs enhances the persistence of plant communities. Plos Biol. 4 (1), 0129-0135 (2006).
- Kluser, S., Peduzzi, P. . Global pollinator decline: a literature review. , (2007).
- Brown, M. J. F., Paxton, R. J. The conservation of bees: a global perspective. Apidologie. 40 (3), (2009).
- Lebuhn, G., et al. Detecting insect pollinator declines on regional and global scales. Conserv Biol. 27 (1), (2013).
- Vanengelsdorp, D., Meixner, M. D. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. J Invertebr Pathol. , S80-S95 (2010).
- Pettis, J. S., Delaplane, K. S. Coordinated responses to honey bee decline in the USA. Apidologie. 41 (3), 256-263 (2010).
- Sandrock, C., Tanadini, L. G., Pettis, J. S., Biesmeijer, J. C., Potts, S. G., Neumann, P. Sublethal neonicotinoid insecticide exposure reduces solitary bee reproductive success. Agr Forest Entomol. 16 (2), (2014).
- Van der Sluijs, J. P., Simon-Delso, N., Goulson, D., Maxim, L., Bonmatin, J. M., Belzunces, L. P. Neonicotinoids, bee disorders and the sustainability of pollinator services. Curr Opin Env Sust. 5 (3), (2013).
- Goulson, D., Nicholls, E., Botías, C., Rotheray, E. L. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science. 347 (6229), (2015).
- Johnson, R. M., Ellis, M. D., Mullin, C. A., Frazier, M. Pesticides and honey bee toxicity - USA. Apidologie. 41 (3), (2010).
- Iwasa, T., Motoyama, N., Ambrose, J. T., Roe, R. M. Mechanism for the differential toxicity of neonicotinoid insecticides in the honey bee, Apis mellifera. Crop Protection. 23 (5), 371-378 (2004).
- Glavan, G., Bozic, J. The synergy of xenobiotics in honey bee Apis mellifera: mechanisms and effects. Acta Biol. Slov. 56, 11-27 (2013).
- Biddinger, D. J., et al. Comparative toxicities and synergism of apple orchard pesticides to Apis mellifera (L.) and Osmia cornifrons (Radoszkowski). PLoS ONE. 8 (9), e72587 (2013).
- Thompson, H. M., Fryday, S. L., Harkin, S., Milner, S. Potential impacts of synergism in honeybees (Apis mellifera) of exposure to neonicotinoids and sprayed fungicides in crops. Apidologie. 45 (5), 545-553 (2014).
- Jansen, J. -. P., Lauvaux, S., Gruntowy, J., Denayer, J. Possible synergistic effects of fungicide-insecticide mixtures on beneficial arthropods. IOBC-WPRS Bulletin. 125, 28-35 (2017).
- Robinson, A., Hesketh, H., et al. Comparing bee species responses to chemical mixtures: Common response patterns?. PLoS ONE. 12 (6), (2017).
- Sgolastra, F., Medrzycki, P., et al. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Ladurner, E., Bosch, J., Kemp, W. P., Maini, S. Assessing delayed and acute toxicity of five formulated fungicides to Osmia lignaria and Apis mellifera. Apidologie. 36 (3), 449-460 (2005).
- Mullin, C. A., et al. High levels of miticides and agrochemicals in North American apiaries: implications for honey bee health. PloS one. 5 (3), e9754 (2010).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R., Vanengelsdorp, D. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS one. 8 (7), e70182 (2013).
- David, A., et al. Widespread contamination of wildflower and bee-collected pollen with complex mixtures of neonicotinoids and fungicides commonly applied to crops. Environ Int. 88, 169-178 (2016).
- Zhu, W., Schmehl, D. R., Mullin, C. A., Frazier, J. L. Four common pesticides, their mixtures and a formulation solvent in the hive environment have high oral toxicity to honey bee larvae. PloS one. 9 (1), e77547 (2014).
- Simon-Delso, N., Martin, G. S., Bruneau, E., Minsart, L. A., Mouret, C., Hautier, L. Honeybee colony disorder in crop areas: The role of pesticides and viruses. PLoS ONE. 9 (7), (2014).
- Park, M. G., Blitzer, E. J., Gibbs, J., Losey, J. E., Danforth, B. N. Negative effects of pesticides on wild bee communities can be buffered by landscape context. P Roy Soc B-Biol Sci. 282 (1809), 20150299-20150299 (2015).
- Bernauer, O. M., Gaines-Day, H. R., Steffan, S. A. Colonies of bumble bees (Bombus impatiens) produce fewer workers, less bee biomass, and have smaller mother queens following fungicide exposure. Insects. 6 (2), 478-488 (2015).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. J Exp Biol. 216 (10), 1799-1807 (2013).
- Artz, D. R., Pitts-Singer, T. L. Effects of fungicide and adjuvant sprays on nesting behavior in two managed solitary bees, Osmia lignaria and Megachile rotundata. PLoS ONE. 10 (8), e0135688 (2015).
- Pilling, E. D., Bromleychallenor, K. A. C., Walker, C. H., Jepson, P. C. Mechanism of synergism between the pyrethroid insecticide lambda-cyhalothrin and the imidazole fungicide prochloraz, in the honeybee (Apis mellifera L). Pestic Biochem Phys. 51 (1), 1-11 (1995).
- Johnson, R. M., Wen, Z., Schuler, M. A., Berenbaum, M. R. Mediation of pyrethroid insecticide toxicity to honey bees (Hymenoptera: Apidae) by cytochrome P450 monooxygenases. J. Econ. Entomol. 99 (4), 1046-1050 (2006).
- Steffan, S. A., Dharampal, P. S., Diaz-Garcia, L. A., Currie, C. R., Zalapa, J. E., Hittinger, C. T. Empirical, metagenomic, and computational techniques illuminate the mechanisms by which fungicides compromise bee health. JoVE. (128), e54631 (2017).
- Batra, S. W. T. Solitary bees. Sci Am. 250 (2), 120-127 (1984).
- Linsley, E. G. The ecology of solitary bees. Hilgardia. 27 (19), 543-599 (1958).
- Garibaldi, L. A., et al. Wild Pollinators Enhance Fruit Set of Crops Regardless of Honey Bee Abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Kemp, W. P. . How to manage the blue orchard bee. , (2001).
- Keller, A., Grimmer, G., Steffan-Dewenter, I. Diverse microbiota identified in whole intact nest chambers of the red mason bee Osmia bicornis (Linnaeus 1758). PLoS ONE. 8 (10), e78296 (2013).
- Bosch, J., Kemp, W. P. Development and Emergence of the Orchard Pollinator Osmia lignaria (Hymenoptera: Megachilidae). Environmental Entomology. 29 (1), 8-13 (2000).
- Brittain, C., Potts, S. G. The potential impacts of insecticides on the life-history traits of bees and the consequences for pollination. Basic and Applied Ecology. 12 (4), 321-331 (2011).
- Arena, M., Sgolastra, F. A meta-analysis comparing the sensitivity of bees to pesticides. Ecotoxicology. 23 (3), 324-334 (2014).
- Ladurner, E., Bosch, J., Kemp, W. P., Maini, S. Foraging and nesting behavior of Osmia lignaria (Hymenoptera: Megachilidae) in the presence of fungicides: cage studies. J Econ Entomol. 101 (3), 647-653 (2008).
- Huntzinger, A. C. I., James, R. R., Bosch, J., Kemp, W. P. Fungicide tests on adult alfalfa leafcutting bees (Hymenoptera: Megachilidae). J Econ Entomol. 101 (4), 1088-1094 (2008).
- Tsvetkov, N., et al. Chronic exposure to neonicotinoids reduces honey bee health near corn crops. Science. 356 (6345), 1395-1397 (2017).
- Mao, W., Schuler, M. A., Berenbaum, M. R. Disruption of quercetin metabolism by fungicide affects energy production in honey bees (Apis mellifera). P Natl Acad Sci. 114 (10), 2538-2543 (2017).
- Blacquière, T., Smagghe, G., Van Gestel, C. A. M., Mommaerts, V. Neonicotinoids in bees: A review on concentrations, side-effects and risk assessment. Ecotoxicology. 21 (4), 973-992 (2012).
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (Hymenoptera: Megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Mader, E., Spivak, M., Evans, E. . Managing Alternative Pollinators. , (2010).
- Bosch, J., Kemp, W. P. Developing and establishing bee species as crop pollinators: the example of Osmia spp.(Hymenoptera: Megachilidae) and fruit trees. B Entomol Res. 92 (1), 3-16 (2002).
- Sampson, B. J., Rinehart, T. A., Kirker, G. T., Stringer, S. J., Werle, C. T. Phenotypic variation in fitness traits of a managed solitary bee, Osmia ribifloris (Hymenoptera: Megachilidae). J Econ Entomol. 108 (6), 2589-2598 (2015).
- Sampson, B. J., Cane, J. H., Kirker, G. T., Stringer, S. J., Spiers, J. M. Biology and management potential for three orchard bee species (Hymenoptera: Megachilidae): Osmia ribifloris Cockerell, O. lignaria (Say) and O.chalybea Smith with emphasis on the former. Acta Hort. 810, 549-555 (2009).
- Hladik, M. L., Vandever, M., Smalling, K. L. Exposure of native bees foraging in an agricultural landscape to current-use pesticides. Sci Total Environ. 542, 469-477 (2016).
- Long, E. Y., Krupke, C. H. Non-cultivated plants present a season-long route of pesticide exposure for honey bees. Nat Commun. 7, (2016).
- Krupke, C. H., Hunt, G. J., Eitzer, B. D., Andino, G., Given, K. Multiple routes of pesticide exposure for honey bees living near agricultural fields. PLoS ONE. 7 (1), e29268 (2012).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS ONE. 8 (10), e77550 (2013).
- Sánchez-Bayo, F., Goulson, D., Pennacchio, F., Nazzi, F., Goka, K., Desneux, N. Are bee diseases linked to pesticides? - A brief review. Environ Int. 89, 7-11 (2016).
- Steffan-Dewenter, I., Klein, A. -. M., Gaebele, V., Alfert, T., Tscharntke, T. Bee diversity and plant-pollinator interactions in fragmented landscapes. Specialization and generalization in plant-pollinator interactions. , 387-410 (2006).
- Kremen, C., Ricketts, T. Global perspectives on pollination disruptions. Conserv Biol. 14 (5), 1226-1228 (2000).
- Memmott, J., Waser, N. M., Price, M. V. Tolerance of pollination networks to species extinctions. P Roy Soc B-Biol Sci. 271 (1557), 2605-2611 (2004).
- Spear, D. M., Silverman, S., Forrest, J. R. K. Asteraceae pollen provisions protect Osmia mason bees (Hymenoptera: Megachilidae) from brood parasitism. The American Naturalist. 187 (6), 797-803 (2016).
- Rust, R. W. Biology of Osmia (Osmia) ribifloris Cockerell (Hymenoptera: Megachilidae). J Kansas Entomol Soc. 59, 89-94 (1986).
- Torchio, P. F. Osmia ribifloris, a native bee species developed as a commercially managed pollinator of highbush blueberry (Hymenoptera: Megachilidae). J Kansas Entomol Soc. 63 (633), 427-436 (1990).
- Sanchez-Bayo, F., Goka, K. Pesticide residues and bees - A risk assessment. PLoS ONE. 9 (4), e94482 (2014).
- Kasiotis, K. M., Anagnostopoulos, C., Anastasiadou, P., Machera, K. Pesticide residues in honeybees, honey and bee pollen by LC-MS/MS screening: Reported death incidents in honeybees. Sci Total Environ. 485 (1), 633-642 (2014).
- Stanley, J., Sah, K., Jain, S. K., Bhatt, J. C., Sushil, S. N. Evaluation of pesticide toxicity at their field recommended doses to honeybees, Apis cerana and A. mellifera through laboratory, semi-field and field studies. Chemosphere. 119, 668-674 (2015).
- Praz, C. J., Müller, A., Dorn, S. Specialized bees fail to develop on non-host pollen: Do plants chemically protect their pollen?. Ecology. 89 (3), 795-804 (2008).
- Sedivy, C., Müller, A., Dorn, S. Closely related pollen generalist bees differ in their ability to develop on the same pollen diet: Evidence for physiological adaptations to digest pollen. Funct Ecol. 25 (3), 718-725 (2011).
- Williams, N. M. Use of novel pollen species by specialist and generalist solitary bees (Hymenoptera: Megachilidae). Oecologia. 134, (2003).
- Graystock, P., Rehan, S. M., McFrederick, Q. S. Hunting for healthy microbiomes: determining the core microbiomes of Ceratina, Megalopta, and Apis bees and how they associate with microbes in bee collected pollen. Conserv Genet. 18 (3), 1-11 (2017).
- Bosch, J., Vicens, N. Relationship between body size, provisioning rate, longevity and reproductive success in females of the solitary bee Osmia cornuta. Behav Ecol Sociobiol. 60 (1), 26-33 (2006).
- Bosch, J., Vicens, N. Body size as an estimator of production costs in a solitary bee. Ecol Entomol. 27 (2), 129-137 (2002).
- Radmacher, S., Strohm, E. Factors affecting offspring body size in the solitary bee Osmia bicornis (Hymenoptera, Megachilidae). Apidologie. 41 (2), 169-177 (2010).
- Seidelmann, K. Open-cell parasitism shapes maternal investment patterns in the Red Mason bee Osmia rufa. Behav Ecol. 17 (5), (2006).
- Becker, M. C., Keller, A. Laboratory rearing of solitary bees and wasps. Insect Science. 23 (6), 918-923 (2016).
- Bosch, J. The nesting behaviour of the mason bee Osmia cornuta (Latr) with special reference to its pollinating potential (Hymenoptera, Megachilidae). Apidologie. 25, 84-93 (1994).
- Krunić, M., Stanisavljević, L., Pinzauti, M., Felicioli, A. The accompanying fauna of Osmia cornuta and Osmia rufa and effective measures of protection. B Insectol. 58 (2), 141-152 (2005).
- Elliott, S. E., Irwin, R. E., Adler, L. S., Williams, N. M. The nectar alkaloid, gelsemine, does not affect offspring performance of a native solitary bee, Osmia lignaria (Megachilidae). Ecol Entomol. 33 (2), 298-304 (2008).
- Hendriksma, H. P., Härtel, S., Steffan-Dewenter, I. Honey bee risk assessment: New approaches for in vitro larvae rearing and data analyses. Methods Ecol and Evol. 2 (5), 509-517 (2011).
- Aupinel, P., et al. Improvement of artificial feeding in a standard in vitro method for rearing Apis mellifera larvae. B Insectol. 58 (2), 107-111 (2005).
- Beekman, M., Ratnieks, F. L. W. Long-range foraging by the honey-bee, Apis mellifera L. Funct Ecol. 14 (4), 490-496 (2000).
- Gathmann, A., Tscharntke, T. Foraging ranges of solitary bees. J Anim Ecol. 71 (5), 757-764 (2002).
- Greenleaf, S. S., Williams, N. M., Winfree, R., Kremen, C. Bee foraging ranges and their relationship to body size. Oecologia. 153 (3), 589-596 (2007).
- . Bee Pollen Supplement - Bee Rescued Available from: https://beerescued.com/product/bee-rescued-bee-pollen-supplement/ (2018)
- Cane, J. H., Griswold, T., Parker, F. D. Substrates and Materials Used for Nesting by North American Osmia Bees (Hymenoptera: Apiformes: Megachilidae). Annals of the Entomological Society of America. 100 (3), 350-358 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten