Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Automatisiert, langfristige Verhaltensstörungen Assay für kognitive Funktionen in mehreren genetischen Modellen der Alzheimer-Krankheit, mit IntelliCage
In diesem Artikel
Zusammenfassung
Dieses Whitepaper beschreibt ein Protokoll für die kognitive Bewertung für genetische Modelle von der Alzheimer-Krankheit mit dem IntelliCage-System, das eine automatisierte Hochdurchsatz Verhaltens-monitoring-System mit operanten Konditionierung ist.
Zusammenfassung
Mehrere Faktoren – wie Altern und Gene – sind häufig verbunden mit kognitiven Fähigkeiten. Gentechnisch veränderte Mausmodelle der kognitiven Fähigkeiten, wie z. B. Alzheimer-Krankheit (AD), sind geworden ein viel versprechendes Instrument, die zugrunde liegenden Mechanismen aufzuklären und die therapeutischen Fortschritte zu fördern. Ein wichtiger Schritt ist die Validierung und Charakterisierung des erwarteten Verhaltens Anomalie in den Modellen, bei AD, kognitiven Fähigkeiten. Verhalten Langzeituntersuchungen von Versuchstieren, die Auswirkungen des Alterns Nachfrage erhebliche Anstrengungen von Forschern zu studieren. Das IntelliCage-System ist eine Hochdurchsatz- und kostengünstige Testbatterie für Mäuse, die beseitigt die Notwendigkeit der täglichen menschlichen Umgang. Hier beschreiben wir, wie das System bei der langfristigen Phänotypisierung eines genetischen Alzheimer-Krankheit-Modells genutzt wird konzentriert sich speziell auf die kognitiven Funktionen. Das Experiment beschäftigt wiederholte Testbatterie, die räumliche Lern- und Führungsaufgaben zu beurteilen. Diese kostengünstige altersabhängigen Phänotypisierung ermöglicht es uns, die vorübergehenden oder dauerhafte Auswirkungen von Genen auf verschiedene kognitive Aspekte zu identifizieren.
Einleitung
Die Entwicklung von Tiermodellen für neuronale Erkrankung in den letzten zehn Jahren hat ein mechanistisches Verständnis von ihrer Basis und Förderung der therapeutischen Fortschritte1,2,3zur Verfügung gestellt. Anwendung einer Hochdurchsatz-Verhaltens Testbatterie in genetischen Tiermodellen ist eine heuristische Recherche-Tool, die zugrunde liegenden Mechanismen menschlicher Krankheiten und Identifizierung von medikamentösen Therapien zu untersuchen. Forschung Testbatterien angepasst zur Dauerbeobachtung des Alterns oder Demenz Modelle mussten traditionell Laboratorien zu verbrauchen große Mengen spezialisiertes Personal und Zeit. Ein Haus-Käfig-monitoring-System wäre eine kostengünstige Strategie, wie es die Verhaltensbeobachtung durch den Menschen senken würde. Einige Forschungsteams haben automatisierte Vision-basierte Tools entwickelt, die Verhaltensstörungen Phänotypisierung von einer einzelnen Person in einem kleinen Haus Käfig4,5,6unterstützen. Solche Methoden schränken jedoch die soziale Interaktion, die Größe der Testumgebungen und die Vielzahl von Verhaltensmaßnahmen, die kognitive Funktionen enthalten. Die IntelliCage ist ein der zweiten Generation Haus-Käfig-monitoring-System entwickelt, um verschiedene kognitive Aufgaben in eine soziale Heimat Käfig. Wichtig ist, diese Methode beseitigen kann täglich Umgang mit diesem ermöglicht uns auszuführenden Verhaltens Langzeitüberwachung mit Beurteilung der kognitiven Funktionen, und es kann zu beseitigen die Anforderungen für spezielle praktische Handhabung und ermöglichen hoch reproduzierbare Daten-Übernahme-7. Hier beschreiben wir die langfristige Phänotypisierung und Validierung in genetischer Mausmodelle der Alzheimer-Krankheit (AD) wurde generiert vor kurzem8,9,10 mit dem automatisierten Haus-Käfig-monitoring System. Eine Testbatterie, die Bewertungen des räumlichen Lernens und Exekutive Funktionen enthalten, wurde wiederholt auf mehrere Punkte (9 – 12 und 14 – 17 Monate alt) durchgeführt. Diese altersabhängige Phänotypisierung konnten wir die vorübergehenden oder dauerhafte Auswirkungen von Genen auf verschiedene kognitive Aspekte zu identifizieren. Wir fanden, dass einige AD-Modelle zeigten vorübergehende und dauerhafte Phänotypen mehrere kognitive Aspekte in die langfristige Analyse mithilfe von automatisierten Haus-Käfig monitoring System10getestet. Somit ist die automatisierte Untersuchung mit Haus-Käfig-monitoring-System vorteilhaft und wirtschaftlich für langfristige Verhaltensstörungen Phänotypisierung und Validierung in verschiedenen Modellen der kognitiven Dysfunktion.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alles, was die Verfahren durch die institutionelle Tier angenommen wurden Pflege Ausschuss und verwenden sie nach dem RIKEN Brain Science Institute Richtlinien für Tierversuche durchgeführt wurden.
1. Einstellung Apparat
Hinweis: Eine Übersicht über das automatisierte Home-Käfig-monitoring-System ist in Abbildung 1dargestellt. Jedes System (39 x 58 cm x 21 cm) enthält einen Mikroprozessor und vier Ecke-Kammern, die jeweils zwei Wasserflaschen und eine Ringantenne zur Erkennung von Radiofrequenz Identifikation der Transponder in den Tieren (Abbildung 1A) implantiert. Die Kenn-Nummern des Mikroprozessors zeichnen sich durch die Drehwähler (Hardwareadressen) (Abbildung 1 b). Die Kenn-Nummern des Mikroprozessors sollten sich nicht überschneiden. Zwei Türen in jeder Ecke sind von Computern gesteuert, die für die operante Konditionierung (Abbildung 1) verwendet werden. Jeder Käfig kann in der Regel bis zu 12 Mäuse beurteilen (siehe Abbildung 2 als Beispiel für Gruppenhaltung). Mit einer größeren Anzahl von Mäusen ist akzeptabel. Allerdings sollte sichergestellt werden, dass die Mäuse nicht übermäßig zu bekämpfen und sie nicht überlaufen sind, wenn sie stark umkämpften Aufgaben ausführen.
- Die Käfige Seriell über CAN-Kabel an einen Computer anschließen.
- Schließen Sie die Batteriekabel an die Stecker in den Mikroprozessor (Power-on). Alle LEDs sollte dann für ein paar Sekunden eingeschaltet werden und alle Türen bewegen sollte. Wenn die LEDs nicht abschalten, oder wenn die Türen nicht bewegen, ziehen Sie den Netzstecker und Netzkabel Umstecken (schlechte elektrische Verbindungen führen nicht ordnungsgemäße Funktionieren).
- Stellen Sie sicher, dass die Schiebetüren öffnen und schließen Sie richtig. Wenn die Türen nicht richtig bewegen, überprüfen Sie die kleine Magnete an den schwarzen Arm befestigt. Wenn dieses Problem häufig auftritt, betrachten Sie den Magneten an den Arm kleben.
- Weiterhin die Bedingungen für die Türen während der Experimente (mindestens einmal pro Tag) zu überprüfen.
- Schalten Sie den PC ein.
2. software
Hinweis: Alle drei Komponenten der Software ("Designer", "Controller" und "Analyzer") für das automatisierte Home-Käfig-monitoring-System wurden als grafische Benutzeroberflächen (Abbildung 3) entwickelt. Benutzer können leicht zu kontrollieren oder verschiedene Funktionen während des Experiments.
- Herstellung-Experiment-Dateien mit dem "Designer"
Hinweis: Der "Designer" dient zum erzeugen und Bearbeiten von experimentellen Dateien (Programme auf dem System) für die Durchführung von verschiedenen experimentelle Protokolle und den Status des Systems (Abbildung 3A) zu Testzwecken. Eine experimentelle Datei bettet die tierischen Liste Hardwareeinstellung und mehrere experimentelle Protokolle. Benutzer erhalten auch veröffentlichten Zeitschrift Protokolle durch Kontaktaufnahme mit den Autoren.- Die tierische Liste erstellen
- Definieren Sie die Bedingungen. Bauen das grand Versuchsdesign, umfasst die folgenden Parameter: (1) die Anzahl der Thema Mäuse, (2) die Zahl der genetischen Linien (oder Behandlungsgruppen), (3) Sex (männliche Tiere, weibliche Tiere oder beides) und (4) die Anzahl der den Käfig verwendet werden.
- Wählen Sie den entsprechenden Transponder (DataMars oder Trovan) im zentralen Tool-Bar.
- Set "Gruppen". Im Bereich "Gruppen" hinzufügen oder Entfernen von den experimentellen Gruppen (zB., Genotypen oder Behandlungen) durch Drücken der "grüne Pluszeichen (+)" oder "Rotes Kreuz (X)" Taste im Fenster "Gruppen" jeweils.
- Setzen Sie "Cluster". Verwenden Sie die "Cluster"-Funktion, um Untergruppen gleichermaßen zu betreiben, durch die Definition richtig, falsch und neutralen Ecken und Seiten.
Hinweis: Der Besuch, Nosepoke und lecken Ereignisse, die wichtigsten Daten für keine Verhaltensstörungen Aufgaben sind die Definition zugeordnet. Diese Einstellung ist erforderlich für räumliche Lernaufgaben. Die definierten Cluster für jedes Tier bleiben unverändert in das Experiment. Zum Beispiel in einem Cluster für Platz Präferenz (PP) Aufgabe oder Ort Präferenz Umkehr (PPR), eine Ecke ist definiert als korrekt (Wasser zugänglich) und drei Ecken sind definiert als falsch (Wasser-unzugänglich). Darüber hinaus können Cluster zu einem anderen mit "Link" Funktion verknüpft werden. - Weisen Sie Variablen wie "Name", "Tag" (Transponder ID), "Sex", "Gruppe" und "Cluster zu".
- Speichern und Einfügen der tierischen Listen wählen Sie "Exportieren"... und "Import Tieren"... in der Menüleiste "Datei", die tierischen Listen für ein weiteres Experiment zu replizieren.
- Richten Sie die Hardware im "Setup" tab. Set up alle Systeme mit den dazugehörigen ID-Nummern (Hardware-Adresse) in die Registerkarte "Setup" und entsprechen der Anzahl der Adressen im Abschnitt "Designer", um die tatsächliche Anzahl der Adressen.
- Bauen Sie die experimentelle Protokolle im Reiter "IntelliCage"
- Die experimentelle Protokolle im Reiter "IntelliCage" mit den folgenden Kopf und minderwertige Registerkarten ("Module" und "Option" Tabs) zu bauen.
- Entwerfen Sie die experimentelle Strukturen in der "Modul Space" durch Klicken auf die Registerkarte "Modul" (Abbildung 3A). Um neue Module hinzuzufügen, drücken Sie die "Add" (Green plus -Schaltfläche im Register "Modul").
Hinweis: Es gibt vier verschiedene Arten von Komponenten, nämlich "Aufgaben", "Utils", "Reporter" und "Veranstaltungen". In der Regel beginnt ein Experiment mit einem Triggerereignis, nämlich "Besuchen", "Nosepoke" oder "Trinken". Wenn das auslösende Ereignis auswählen möchten, ziehen Sie die entsprechende Einheit aus der Rubrik Veranstaltungen, die starten-Zeichen zu definieren. Anschließend, um die Ausgabe für bestimmte Aktoren (z. B. Türöffnung) festzulegen, ziehen Sie die Einheiten aus dem Abschnitt "Aufgaben" (zB., "Tür", "LED" und "Air"). - Ziehen Sie die Einheiten, in "Einheiten" Teil, in dem "Modul Space".
Hinweis: Wieder Nutzer veröffentlichten Protokolle (als experimentelle Dateien) von den Autoren und erhalten die Dateien wiederverwenden, indem Sie neue Tier-Liste importieren. Benutzer müssen nicht alle Module machen. - Ziehen Sie eine Nosepoke Anpassung (NPA) Modul (Abb. 6A), um die "Tür" Einheit aus Abschnitt "Aufgaben", "Tor" und "Timer" Einheiten aus dem Abschnitt "Utils" und die "Besuch" und "Nosepke" Einheiten aus der Rubrik "Veranstaltungen" in "Modul Space".
- Link "Any" auf "ON" Linie des Referats "Nosepoke", "In" in der Tor-Einheit. Link "Out" auf "Schließen" in der "Gate"-Einheit. Link "Out" in das "Tor" zu "Aktivieren" in der "Timer"-Einheit. Link "Out" in das Tor zu öffnen in der "Tür"-Einheit. Link "Out" in der "Timer" auf "Schließen" in der "Tür"-Einheit. Festlegen Sie "Zeit" als 5.000 (ms) im Abschnitt Timer.
Hinweis: Das "Gate"-Gerät dient zur Steuerung von ein- und Ausgang der Sequenz. Im "Offenen" Zustand (Standardzustand) wird die Sequenz am "Ausgang" angeschlossenen betrieben werden. Im Gegensatz dazu wird in den "Schliessen" Staat, die Sequenz mit dem Ausgang verbunden gestoppt werden. Die Wahrscheinlichkeit, dass die Öffnungsrate werden kann (Abbildung 6A, Abbildung 8Aund Abbildung 9A) angegeben. Die "Modul-Selector" wird verwendet, um die Module während der gleichen experimentellen nach dem Zufallsprinzip oder in einer bestimmten Reihenfolge zu ändern. In der seriellen Reaktionszeit (SRT) Aufgabe sind beispielsweise die Module (der Variablen Verzögerung Längen) nach dem Zufallsprinzip an jedem Ende des Besuches mit dem Modul-Selektor (Set "RandomExcludeDefault" Modus) verbunden mit der Zeile "Ende" des Referats "Besuch" (Abbildung 8A geschaltet ). Der "Splitter" Gerät wird ein Eingangssignal auf einen angegebenen Seite der Ecke direkt verwendet werden. Dies ist erforderlich für komplizierter Module wie in der SRT oder Verzögerung Abzinsung (DD) Aufgabe, die Bedienung von einer bestimmten Seite erfordern. Zum Beispiel in der DD-Aufgabe öffnet nur eine Seite (gesüßte Seite) mit einer Verzögerung (Abbildung 9A) sich. - Definieren Sie der anfängliche Zustand der Türen in Käfigen in die Registerkarte "Optionen" und geben Sie alle Türen geschlossen werden, in der nicht-Trinkwasser-Sitzung als den typischen Anfangsstatus für PP oder PPR Aufgaben.
- Legen Sie die Zeitpläne im Reiter "Optionen". Die Module werden zu bestimmten Zeitpunkten geändert, und die im Fenster "Tag Muster" definierte Aktion wird durchgeführt.
Hinweis: Der "Tag-Muster" Teil lässt sich die experimentelle Zeitfenster gesetzt. In der Regel wird nachts, aktive Phase der Mäuse, verwendet, um das Verhalten in den kognitiven Aufgaben zu beurteilen. Es sollte bemerkt werden, das die Dauer des Vorgangs die Höhe der Wasseraufnahme beeinflussen kann. Wenn die Dauer lange in relativ einfachen Aufgaben ist, kann die Leistung am Ende des Zeitfensters durch Zufriedenheit verringern. Somit ist das Zeitfenster erforderlich sorgfältig eingestellt werden.
- Die tierische Liste erstellen
- Laufenden Experiment mit dem "Controller"
- Laden Sie die experimentelle Datei durch Drücken der "Experiment" Schaltfläche im Abschnitt "Einstellung" in der "Steuerung".
- Führen Sie das Experiment durch Drücken der Taste "Start" von der "Controller" (richtige Mittelteil).
- Überwachen Sie und visualisieren Sie den aktuellen Status des Systems und die Mäuse.
Hinweis: Die verhaltensbasierte Ereignisse werden wie folgt erläutert: Besuch, Eintritt in eine Ecke (von thermischer Sensor erkannt); Nosepoke, setzen die Nase, das Loch in der Ecke (von Infrarot-Strahl erkannt, und kann in Linker und rechter Nosepoke unterteilt werden); lecken Sie, leckt, die von Lickometer (als Kontaktzeit und Häufigkeit gezählt) erkannt. - Überprüfen Sie den Status des Systems, die Aufmerksamkeit besonders auf die Hinweise.
Achtung: Fehler durch ein falsches Tier Tag (Transpondernummer) werden gemeldet werden im Protokoll selbst wenn die tatsächliche Tag-Nummer korrekt ist (zB., "unregistrierte Tag ***", "Präsenz Signal ohne Antenne-Registrierung", etc..). Dies ist möglicherweise aufgrund der Nutzung eines Transponders, das in Kürze abläuft. Dieser Fehler ist jedoch kein ernstes Problem. In diesem Fall sollte man überprüfen, dass das Tier in der Nachricht identifiziert erkannt werden kann. Fehler durch längere Zeit ohne einen Besuch oder ein Getränk werden angezeigt, wie z. B. "*** (Tier ID) nicht machen jeden Besuch während der letzten 720 Minuten" (Abb. 3 b). Überprüfen Sie mehrere Möglichkeiten, die zu solchen Fehlern führen können. Der gravierendste Fall ist, dass das Tier bereits tot ist. Die zweitwichtigste Möglichkeit ist, dass es ein Problem mit dem Detektionssystem für das Tier (der Transponder nicht funktioniert oder überworfen hat). Die dritte Möglichkeit ist, dass das Tier einfach nicht aktiv ist. Wenn das Tier keine Besuche eine ganze 24 h lang nicht vornimmt, sollten der Experimentator, entfernen das Tier aus dem Käfig aufgrund seiner gesundheitlichen Zustand. Ein ernstes Problem, das keine Fehleranzeige ist das Scheitern der Tür (fast immer aufgrund der Probleme mit den Magneten an der Tür) zu schließen. Dies führt zur Erstellung einer unangemessenen trinken Ecke. Um dieses Problem zu überprüfen, sollten die Bedingungen für alle Türen während einer Sitzung nicht trinken mindestens einmal täglich überprüft werden. Die Daten, wenn dieses Problem vorhanden ist können nicht für die Analyse von PP, PPR, SRT oder DD Aufgaben verwendet werden. - Ausgang die Verhaltensstörungen Ereignisse mit dem Tag für die Uhrzeit und tierische Informationen durch Drücken der Taste "Stop" auf der "Controller" (Abb. 3 b).
- Umgang mit Daten, die mit der "Analyzer"
- Mit der "Analyzer", Analyse und Visualisierung von Daten.
- Exportieren Sie die Zeit Makulatur Daten als Excel-Dateien (Abbildung 3). Die grafische Ergebnisse im Register "Charts" können das Verständnis der Daten erleichtern. In der Registerkarte "Daten" die Daten sind in mehrere Spalten angeordnet und können sortiert werden und mit jedem Parameter gefiltert.
3. tierische Vorbereitung
- Tiere über 15 g (2 Monate oder älter) zu verwenden.
Hinweis: Wenn die Tiere kleiner als 15 g sind, können mehrere Mäuse eine Ecke gleichzeitig besuchen führt zu dem Fehler bei der Datenerhebung. Im Alter von Tieren sollten sorgfältig überwacht werden, um sicherzustellen, dass sie in der Lage, in die Ecken springen und Klettern die Zuführung. Einige ältere Mäuse oder Mäuse mit Genmutationen ausstellenden motorische Beeinträchtigungen können sterben, weil sie keinen auf das Wasser oder Nahrung Zugriff. - Das potenzielle Risiko von Aggression.
Hinweis: Auch wenn weibliche Mäuse verwenden, ist es besser, vor dem Beginn des Experiments beginnen alle Mäuse zusammen in einem Käfig in einem jungen Alter (d. h., im Alter von 1 Monat) Gehäuse. Ein Profil der mauslinie, insbesondere im Hinblick auf Aggressivität, erhalten Sie bei Verwendung von männlichen Mäusen in den Käfig. -
Implantieren Sie die Radiofrequenz Identifikation Transponder (sterilisiert, Nadel inbegriffen) subkutan in die Mäuse in der dorsal-zervikale Region unter Isofluran Inhalation Anästhesie (Abbildung 4).
- Platzieren Sie den Mauszeiger in der Kammer für die Induktion der Anästhesie.
- Passen Sie die Sauerstoff-Durchflussmesser auf 0,8 bis 1,5 L/min und Isofluran Vaporizer auf 2,0 bis 2,5 %.
- Lassen Sie die Maustaste aus der Induktion Kammer nach der Atemfrequenz werden langsam (ca. 5 % Drop).
- Aufrechterhaltung der Narkose mit einer Gesichtsmaske.
- Gelten Sie ophthalmologischen Salbe für Augen, Auge Austrocknen zu verhindern.
- Kneifen Sie und heben Sie die Haut um den hinteren Teil des Schulterblatts erstelle ich eine Tasche.
- Begießen Sie die Injektionsstelle mit 70 % Ethanol, die Einführung des Haares in den subkutanen Raum zu minimieren. Fügen Sie dann die Injektion Nadel durch die Haut parallel zur Wirbelsäule.
- Werfen Sie den Mikrochip subkutan.
- Kneifen Sie den Mikrochip durch die Haut, es Inter Skapulier Raum zu halten.
- Die Nadel langsam zurückziehen. Weiterhin die Gegend für ein paar Sekunden zu Blutstillung zu kneifen.
- Verwenden Sie Post-Verwaltung Schmerzlinderung, wenn die Nadel nicht richtig eingesetzt ist.
- Lassen Sie die Maustaste aus der Narkose.
- Platzieren Sie die Maus in einen Recovery-Käfig und überwachen Sie, bis sie aufwachen und sich bewegen. Zu vermeiden, dass die Maus unbeaufsichtigt.
- Die Maus zu Hause Käfig zurück, sobald sie vollständig ambulante geworden ist.
- Überprüfen Sie den implantierten Transponder mit einem Transponder-Lesegerät für mindestens 1 Woche.
Achtung: Die Position der implantierten Transponder ist absolut entscheidend für die Identifizierung (siehe Abbildung 2). Einfügen Sie den Transponder nicht vertikal in den Hals; Dies kann dazu führen, Tiere werden Verletzungen des Rückenmarks des Tieres. Transponder fallen manchmal nach einigen Stunden oder Tagen. Überprüfen Sie, ob der Transponder funktioniert mithilfe einer Transponderleser. Im optionalen, Implantat-Transponder wieder fällt es heraus; Das wiederholte Re-Implantat kann jedoch künstliche Verhaltensänderungen führen. Überprüfen Sie das Ablaufdatum. Abgelaufene Transponder werden häufig falsche Signale übertragen, der sich bei fehlenden Daten.
- Führen Sie die Tiere in den Käfig und überprüfen Sie die Transponder implantiert in den Mäusen, die mit den Transponder-Leser. Entfernen Sie die Mäuse, wenn die Transponder nicht erkannt werden.
4. laufen Experimente
Hinweis: Mäuse sind Ad Libitum mit Standardmaus Chow gefüttert und gepflegt mit synthetischer Bettwäsche, die alle 1-2 Wochen je nach den Aufgabenplan geändert wird. Zu vermeiden, ändern Bettwäsche während räumliche lernaufgabe vor allem ersten 1 – 2 Tagen. Lichter sind auf 08:00 bis 20:00. Die experimentelle Module werden nacheinander nach wissenschaftlichen Fragestellungen durchgeführt. Die experimentelle Zeitplan ist in Abbildung 5dargestellt.
- Allgemeine Aktivität
Hinweis: Mäuse sind nacheinander an Ihre Umgebung in den Käfig mit drei experimentellen Bedingungen angepasst: die freie Adaption, wo die Tiere immer die Flaschen mit Wasser in den Ecken großzügig zugreifen können (ein Tag bis 1 Woche der Gewöhnung gilt in der Regel (ausreichend); NPA, wo die Mäuse die Flaschen mit Wasser für 5 gelangen s nach jeder Nosepoke in die Löcher vor den Türen in den Ecken (3 Tage, 1 Woche Gewöhnung ist in der Regel als ausreichend betrachtet); und trinken Session-Anpassung, wo die Mäuse die Wasserflaschen zu einem bestimmten Zeitpunkt des Tages zugreifen können.- Bereiten Sie die Experiment-Dateien für die FA, NPA und DSA Aufgaben.
- Führen Sie den FA-Task in der "Steuerung".
- Messen Sie die Anzahl der Besuche, Nosepokes und/oder lecken Episoden täglich oder zirkadianen Tätigkeit in regelmäßigen Abständen als Index der allgemeinen Aktivität.
- Führen Sie die NPA-Aufgabe in der "Steuerung".
- Führen Sie die DSA-Aufgabe in der "Steuerung".
Hinweis: Viele lernen Paradigmen erfordern Anpassung für die Trinkgelage. Um den Zeitplan für die DSA festzulegen, verwenden Sie zwei verschiedene experimentelle Module: die Standardsitzung (für Wasserentzug) und Trinkgelage. Die Mäuse können die Flaschen mit Wasser zugreifen, da nach einem Nosepoke in der Standard-Modul nichts passiert. Die Trinkgelage ist identisch mit dem NPA-Modul. Der zeitliche Ablauf definiert im Reiter "Optionen" in der "Designer" kann dann nach der nicht-Trinkwasser-Sitzung von einem anderen Modul definiert verschieben.
- Räumliche Lern- und Gedächtnisaufgaben
Hinweis: Die PP-Aufgabe dient zur Bewertung räumliche Lernen (in der Regel 5 – 7 Tage). In der PP-Aufgabe haben die Mäuse eingeschränkten Zugang zu Wasser in drei von vier Ecken (eine richtige Ecke und drei falschen Ecken). Somit müssten die Tiere eine bestimmte Ecke um Wasser zu trinken, während die Trink-Sessions zu besuchen. Die PPR-Aufgabe dient, Flexibilität oder Compulsivity und die Fähigkeit zur Verhaltensänderung fließend (in der Regel 5-7 Tage) zu beurteilen. In der PPR-Aufgabe können die Mäuse nur Wasser in den gegenüberliegenden Ecken verwendet als die richtige Ecke in der PP-Aufgabe zugreifen.- Bereiten Sie die Experiment-Dateien für die PP und PPR Aufgaben. Definieren Sie die richtigen Ecken für die Mäuse durch Festlegen der "Cluster" (in der Regel 1-4 Ecken jedes) im Register "Tier" von der "Designer" (siehe Abbildung 6A, unten). Zur Vermeidung von starkem Verkehr in einer Ecke weisen Sie die vier Ecken gleichmäßig alle Mäuse.
- Führen Sie die PP-Aufgabe in der Steuerung.
- Die räumliche Lernleistung auf den zeitlichen Verlauf, die Zahlen und den Prozentsatz der korrekten Nosepokes zu bewerten.
Hinweis: Die aktuelle Version der PP Aufgabe konzentriert sich mehr auf räumliche anstatt räumliche Gedächtnis, lernen wie die Aufgabe eine zeitliche Lücke zwischen den verschiedenen Studien nicht erforderlich ist. Um stärker auf räumliche Gedächtnis erwägen Sie Ort Vermeidung (PA) Aufgabe oder eine undefinierte neue Version der räumliche Aufgabe, die bestimmte zeitliche Lücken zwischen den Studien nutzt. - Führen Sie die PPR-Aufgabe in der "Steuerung".
- Flexibilität oder Compulsivity basierend auf den zeitlichen Verlauf, die Anzahl und der Anteil der korrekten Nosepokes zu bewerten.
Hinweis: Interpretation der PPR Daten erfordert mehrere sorgfältige Urteile. Anfängliche Leistung der PPR Aufgabe ist stark abhängig von Leistung in der PP-Aufgabe. Und zwar deshalb, weil die PPR-Aufgabe stützt sich auf Störungen oder die Notwendigkeit, das Verhalten zu ändern. Daher kann die Leistung der PPR besonders schlecht sein, wenn die Leistung der PP-Aufgabe in der Nähe von 100 % richtig ist. Flexibilität kann einem der exekutiven Funktionen11,12,13betrachtet werden. - Bewerten Sie räumliche Angst Speicher in PA.
Hinweis: Die PA-Aufgabe besteht aus 4 kontinuierliche Sitzungen: Gewöhnung (Tag 1); Klimaanlage (Luftstoß eingeführt, nach der Nospoke auf alle Seiten einer vordefinierten Ecke [falsche Nosepoke], Tag 2); 24 h Pause außerhalb der Prüfung Käfig (die Mäuse befinden sich wieder in ihren normalen Heim-Käfigen, Tag3); Platzieren Mäuse, zurück in den Tests Käfig ohne Luftstoß (4 – 10 Tage).- PA die Experiment-Dateien vorbereiten
- Gewöhnung (Tag 1) ausgeführt.
- Klimaanlage (Tag 2) ausgeführt.
- Nehmen Sie die Mäuse in normalen home Käfige und halten Sie für 24 h (Tag3).
- Nehmen Sie die Mäuse wieder zum Testen Käfig und führen Sie das Testprotokoll (Tag 4 – 10).
- Aversive räumliche Lernen basierend auf dem Verhältnis von falschen Nosepokes auf die Klimaanlage (Tag 2), aversive räumliche Gedächtnis am Tag der Rückkehr in den Tests Käfig (Tag 3) auf dieser Grundlage zu bewerten, und Aussterben lernen darauf basierend auf 4 – 10 Tage.
- Bewertung der Exekutivfunktion (Impulsivität, Aufmerksamkeit und Compulsivity)
- SRT-Aufgaben
Hinweis: Dieses Verfahren war bisher in mehr Detail10,14beschrieben. In dieser Reihe von Aufgaben werden alle vier Ecken in der gleichen Weise, 24 Stunden pro Tag betrieben. Die SRT besteht aus zwei Trainingseinheiten (SRT-Training 1 und 2) und zwei Testsitzungen (SRT-Test 1 und 2). In der ersten Trainingseinheit (SRT-Training 1) werden die Tiere zu erfahren, dass die Gelbe LED-Licht ein Startsignal für eine Nosepoke ist ausgebildet. LEDs blinken immer sofort nach der ersten Nosepoke (Verzögerung auf 0 gesetzt ist s).
In der zweiten Trainingseinheit (SRT-Training 2) soll die Verzögerung nach dem Zufallsprinzip variieren zwischen den 0.5, 1.0, 2.0 und 4.0 s. In diesem Zeitraum haben vorzeitige Antworten ohne Belang (vor dem Training). Nosepoke während der Verzögerung gilt eine vorzeitige Reaktion während der ersten Nosepoke beim Öffnen der Tür (5 s) gilt als eine richtige Antwort. In der ersten Test-Session (SRT-Test 1, verwendet, um Impulsivität zu bewerten), die erste Nosepoke definiert die richtige Seite und initiiert eine Verzögerungszeit (0,5 – 4,0 s, abhängig von der Aufgabe-Phase), nach dem gelben LEDs sind für einen bestimmten Zeitraum aktiviert (Impuls Dauer = 2,0 s, abhängig von der Aufgabe-Phase). Die Tür wird geöffnet. Die ersten Nosepoke nach die Verzögerungszeit die Tür öffnet (5 s) und wird als eine richtige Nosepoke gezählt, während alle Nosepoke während der Verzögerung vorzeitiger Nosepoke gilt. Es gibt mehrere Änderungen im zweiten Test Training (SRT-Test 2, verwendet, um Aufmerksamkeit zu beurteilen). Nach dem Start eines Stimulus (0,2 – 1,0 s, etwas kürzer als der erste Test), die Mäuse verfügen über einen Zeitraum, während dessen Nosepokes sind erlaubt (die Limited halten in der Regel 2 s). Die Türen öffnen (5 s) erst nach einer richtigen Nosepoke ist die erste Nosepoke während der begrenzten halten. Nosepokes nach der begrenzte Laderaum gelten als Nosepoke weggelassen und führen nicht zu Änderungen in den Ausgang. Die Fehler sind in drei Typen unterteilt: vorzeitige Nosepoke, ausgelassene Nosepoke und Auslassung (nur erste Nosepoke). Die Aufmerksamkeit Test erfordert Fähigkeit, LED-Blitz (definiert durch die Dauer des Reizes Dauer) sowie mäßig schnelle Reaktion (definiert durch die Dauer der begrenzten halten) zu beachten. Der zeitlichen Verlauf der Studie ist in Abbildung 7dargestellt.- Bereiten Sie die Experiment-Dateien für SRT-Aufgaben.
- Laufen Sie die SRT-Training-1 für 3 Tage.
- Führen Sie die SRT-Training 2 für 7 Tage.
- Führen Sie die SRT-Test 1 (Impulsivität) für 7 Tage. Berechnen Sie die Impulsivität, die anhand der folgenden Formel:
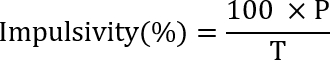
wo P ist die Zahl der vorzeitigen Nosepoke Studien (oder die Anzahl der falsch Nosepoke), und T ist die Anzahl der insgesamt Versuche (die Anzahl der ersten Nosepoke). - Führen Sie die SRT-Test 2 (Attention) für 7 Tage. Berechnen Sie die Genauigkeit (die eine Steuerungsgröße für Aufmerksamkeit gilt) mithilfe der folgenden Formel:
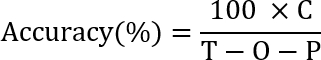
wo C ist die Anzahl der richtigen Nosepoke Studien (Anzahl der richtige zweite Nosepokes), T ist die Anzahl der gesamten Studien (die Anzahl der ersten Nosepokes), O ist die Anzahl der Unterlassung Versuche (Anzahl der Studie fehlt eine zweite Nosepoke) und P ist die Zahl der vorzeitigen Nosepoke Studien (oder die Anzahl der zweite falsche Nosepoke vor den begrenzten Halt).
-
DD-Aufgabe
Hinweis: Dies ist eine einfache Wahl Aufgabe, wo die Tiere wählen, warten, gesüßte Wasser (SW, Saccharin 0,5 % oder 10 % Saccharose) zu trinken, mit einer Verzögerung oder normales Wasser ohne Verzögerung zu trinken. Die Tür auf der gewählten Seite öffnet sich die Tür auf der gegenüberliegenden Seite geschlossen bleiben. Die SW und normales Wasser entfallen im rechten oder linken Seiten aller Ecken identisch. DD-Arbeitsplan beinhaltet die Ausbildung und Prüfung Sitzungen. In der Trainingseinheit können die Mäuse SW und Wasser ohne eine Wartezeit zugreifen. So werden die Mäuse ihre Vorliebe zur SW Seite entwickeln. Im Test-Sessions, die Wartezeit steigt täglich (i.e., 0, 1, 2,..., 8 s). Die Verzögerungen gegenüber dem Vorquartal erhöhen täglich mehrere Module mit unterschiedlicher Verzögerung Länge (0, 1, 2,..., 8 s) und "Link" im Bereich "Modul" und "Options" (Tag-Muster). In dieser Aufgabe arbeiten alle vier Ecken in der gleichen Weise, 24 h pro Tag.- Bereiten Sie die experimentelle Datei für DD-Aufgabe.
- Die Seite der SW (rechts oder Links Seiten an allen Ecken) definieren.
- Ersetzen Sie die Wasserflaschen an den definierten Seiten mit den Flaschen mit SW.
- Führen Sie das Training um die Tiere zum Trinken SW an den definierten Seiten ohne Verzögerung für 5 – 7 Tage zu trainieren.
- Den Präferenz-Index, definiert als das Verhältnis von lecken oder Nosepoking an der Seite von der SW auf die Gesamtzahl der Licks oder Nosepokes zu berechnen. Der Präferenz-Index für die Seite, die, der mit SW so berechnet wird:
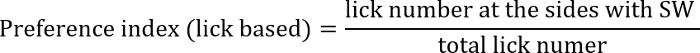
oder
Der ehemalige Index konzentriert sich mehr auf Aktion Ergebnisse, während die letzteren konzentriert sich mehr auf Wahl Verhalten.
Hinweis: Stellen Sie sicher, dass die meisten Mäuse bevorzugt die Seiten mit dem SW wählen (> 90 % für den lecken zahlenbasierte Index > 80 % für die ersten Nosepoke-basierten Index) am Ende des Trainings. - Führen Sie anschließend die Testsitzung DD Aufgabe für 9 Tage (Verzögerung 0, 8 s).
- Bewerten Sie den zeitlichen Verlauf der Änderung in der Präferenz in Richtung der Seite mit SW, die Compulsivity zu bewerten.
- SRT-Aufgaben
- Datenanalyse
- Öffnen Sie die Archive über die "Analyzer" und exportieren Sie alle Daten in Excel-Dateien. Wenn die Datenmenge sehr groß ist, ist es besser zum Filtern der Daten (zB., Trinkgelage für die räumliche Aufgaben zu extrahieren und Extrahieren der ersten und zweiten Nosepokes für SRT-Aufgaben).
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
In unserem vorherigen Studie wurden die altersabhängigen kognitiven Defizite in AD-Modelle durch die Experimente mit der automatisierten Haus-Käfig monitoring System10festgestellt. Ihre Leistung von AD-Modellen in PP war bei jungen Erwachsenen und älteren Probanden intakt; Allerdings war die Leistung in PPR deutlich und schrittweise beeinträchtigt (Abbildung 6). Es ist auch wichtig, das allgemeine Verhalten oder Angst in der Anpass...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieses Whitepaper beschreibt die Methode mit der automatisierten Haus-Käfig-monitoring-System für langfristige kognitive und Verhaltenstherapie Assays in gentechnisch veränderten AD-Modelle. Die wichtigste Schritt ist die Implantation des Transponders in der richtigen Position. Sicherzustellen Sie vor der Durchführung der Implantation, dass das Ablaufdatum des Transponders nicht vergangen ist. Der zweite wichtige Punkt ist, prüfen die Funktion des Systems täglich, vor allem, da ein kleines Problem anschließend ein...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenkonflikte erklärt.
Danksagungen
Wir danken für ihre Hilfe bei der fotografierenden Materialien Reiko Ando. Diese Forschung wurde unterstützt durch Beihilfe für Pionierforschung (JSPS KAKENHI Grant-Nummer 16K 15196).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| IntelliCage | TSE Systems | - | Parchased in 2011 or later |
| PC | Dell | Inspiron 580s | - |
| Display | Dell | SI75T-WL | - |
| ALPHA-dri | Shepherd Specialty Papers | - | Standard bedding |
| Aron Alpha (Krasy Glue) 2 g | Toagosei (Krasy Glue) | #04612 | Cyanoacrylates for gluing magnet and blak arm |
| Handheld Transponder Reader | BTS-ID | R-560 | Transponder reader, which reads both Trovan and DataMars |
| Transponder | DataMars | T-VA, T-VAS, or another series | Basic package of transponders and implanters |
| Diamond Grip Plus | Ansel Microflex | DGP-INT-M | Experimental glove |
| Isoflurane | Pfizer | 1119701G1092 | - |
| Vaporizer for small animals | DS Pharma Biomedical | SF-B01 | Facemask included |
| Neo-Medrol | Pfizer | 006472-001 | Eye ointment |
| Ethanol (70%) | - | - | - |
| Excel | Microsoft | 00202-51382-15524-AA928 | For data analysis |
Referenzen
- Bryan, K. J., Lee, H., Perry, G., Smith, M. A., Casadesus, G. Transgenic Mouse Models of Alzheimer's Disease: Behavioral Testing and Considerations. Methods of Behavior Analysis in Neuroscience. , CRC Press/Taylor & Francis. (2009).
- Nestler, E. J., Hyman, S. E. Animal models of neuropsychiatric disorders. Nature Neuroscience. 13 (10), 1161-1169 (2010).
- Crawley, J. N. Behavioral Phenotyping Strategies for Mutant Mice. Neuron. 57 (6), 809-818 (2008).
- Zarringhalam, K., Ka, M., et al. An open system for automatic home-cage behavioral analysis and its application to male and female mouse models of Huntington's disease. Behavioural Brain Research. 229 (1), 216-225 (2012).
- Prusiner, S. B., Jackson, W. S., King, O. D., Lindquist, S. The power of automated high-resolution behavior analysis revealed by its application to mouse models of Huntington's and prion diseases. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13363-13383 (1998).
- Jhuang, H., Garrote, E., et al. Automated home-cage behavioural phenotyping of mice. Nature Communications. 1 (6), 1-9 (2010).
- Krackow, S., Vannoni, E., et al. Consistent behavioral phenotype differences between inbred mouse strains in the IntelliCage. Genes, brain, and behavior. 9 (7), 722-731 (2010).
- Nilsson, P., Saito, T., Saido, T. C. New mouse model of Alzheimer's. ACS chemical. 5 (7), 499-502 (2014).
- Saito, T., Matsuba, Y., et al. Single App knock-in mouse models of Alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Masuda, A., Kobayashi, Y., Kogo, N., Saito, T., Saido, T. C., Itohara, S. Cognitive deficits in single App knock-in mouse models. Neurobiology of Learning and Memory. , (2016).
- Chan, R. C. K., Shum, D., Toulopoulou, T., Chen, E. Y. H. Assessment of executive functions: Review of instruments and identification of critical issues. Archives of Clinical Neuropsychology. 23 (2), 201-216 (2008).
- Jurado, M. B., Rosselli, M. The Elusive Nature of Executive Functions: A Review of our Current Understanding. Neuropsychology Review. 17 (3), 213-233 (2007).
- Diamond, A. Executive Functions. Annual Review of Psychology. 64 (1), 135-168 (2013).
- Kobayashi, Y., Sano, Y., et al. Genetic dissection of medial habenula-interpeduncular nucleus pathway function in mice. Frontiers in behavioral neuroscience. 7, 17(2013).
- Robinson, O. J., Vytal, K., Cornwell, B. R., Grillon, C. The impact of anxiety upon cognition: perspectives from human threat of shock studies. Frontiers in human neuroscience. 7, 203(2013).
- Robbins, T. The 5-choice serial reaction time task: behavioural pharmacology and functional neurochemistry. Psychopharmacology. (3-4), 362-380 (2002).
- Asinof, S. K., Paine, T. A. The 5-Choice Serial Reaction Time Task: A Task of Attention and Impulse Control for Rodents. Journal of Visualized Experiments. (90), e51574(2014).
- Codita, A., Gumucio, A., et al. Impaired behavior of female tg-ArcSwe APP mice in the IntelliCage: A longitudinal study. Behavioural brain research. 215 (1), 83-94 (2010).
- Blumstein, D. T. Habituation and sensitization: new thoughts about old ideas. Animal Behaviour. 120, 255-262 (2016).
- Endo, T., Maekawa, F., et al. Automated test of behavioral flexibility in mice using a behavioral sequencing task in IntelliCage. Behavioural brain research. 221 (1), 172-181 (2011).
- Voikar, V., Colacicco, G., Gruber, O., Vannoni, E., Lipp, H. -P., Wolfer, D. P. Conditioned response suppression in the IntelliCage: assessment of mouse strain differences and effects of hippocampal and striatal lesions on acquisition and retention of memory. Behavioural brain research. 213 (2), 304-312 (2010).
- Puścian, A., Łęski, S., Górkiewicz, T., Meyza, K., Lipp, H. -P., Knapska, E. A novel automated behavioral test battery assessing cognitive rigidity in two genetic mouse models of autism. Frontiers in Behavioral Neuroscience. 8, 140(2014).
- Voikar, V., Colacicco, G., Gruber, O., Vannoni, E., Lipp, H. -P., Wolfer, D. P. Conditioned response suppression in the IntelliCage: assessment of mouse strain differences and effects of hippocampal and striatal lesions on acquisition and retention of memory. Behavioural brain research. 213 (2), 304-312 (2010).
- Harda, Z., Dzik, J. M., et al. Autophosphorylation of αCaMKII affects social interactions in mice. Genes, Brain and Behavior. , e12457(2018).
- Aarts, E., Maroteaux, G., et al. The light spot test: Measuring anxiety in mice in an automated home-cage environment. Behavioural Brain Research. 294, 123-130 (2015).
- Safi, K., Neuhäusser-Wespy, F., et al. Mouse anxiety models and an example of an experimental setup using unconditioned avoidance in an automated system -IntelliCage. Cognition Brain & Behavior. 10 (4), 475-488 (2006).
- Dzik, J. M., Puścian, A., Mijakowska, Z., Radwanska, K., Łęski, S. PyMICE: APython library for analysis of IntelliCage data. Behavior Research Methods. 50 (2), 804-815 (2018).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten