Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bewertung der synaptischen Schnittstelle der primären menschlichen T-Zellen aus peripherem Blut und Lymphgewebe
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt eine Technik, um die Fähigkeit der primären polyklonale menschlichen T-Zellen synaptische Schnittstellen mit planaren Lipid Bilayer bilden zu studieren. Wir verwenden diese Technik, um die differenzielle Synapse Bildung Fähigkeit der menschlichen primäre T Zellen aus Lymphknoten und peripheren Blut zu zeigen.
Zusammenfassung
Das gegenwärtige Verständnis der Dynamik und strukturellen Merkmale der T-Zellen synaptischen Schnittstellen wurde weitgehend bestimmt durch den Einsatz von Glas-gestützte planar Bilayer und in-Vitro-abgeleiteten T-Zell-Klone oder Linien1,2 ,3,4. Wie diese Erkenntnisse für die primären menschlichen T-Zellen aus Blut isoliert oder lymphatischen gelten Gewebe ist nicht bekannt, teilweise erhebliche Schwierigkeiten, eine ausreichende Anzahl von Zellen für die Analyse5. Hier begegnen wir dies durch die Entwicklung einer Technik, die Nutzung von Folien, Multichannel-Fluss um planare Lipid Bilayer mit Aktivierung und Adhäsion Moleküle bauen. Die geringe Höhe der Fluss Folien fördert schnelle Zelle Sedimentation, um Zelle: Bilayer Anlage, wodurch Forscher studieren die Dynamik der synaptischen Schnittstelle Bildung und die Kinetik der Granulat-Version synchronisieren. Wir wenden diesen Ansatz zur Analyse der synaptischen Schnittstelle von so wenig wie 104 bis 105 primäre kryokonservierten T-Zellen isoliert von Lymphknoten (LN) und peripherem Blut (PB). Die Ergebnisse zeigen, dass die neuartige planar Lipid Bilayer Technik die Studie die biophysikalischen Eigenschaften des primären menschlichen T-Zellen aus Blut und Gewebe im Zusammenhang mit Gesundheit und Krankheit abgeleitet ermöglicht.
Einleitung
Wissenschaftlicher Erkenntnisse über die strukturellen Merkmale des T-Zell-immun-Synapsen und ihre Verknüpfung, die funktionelle Aktivität der T-Zellen erzeugt worden ist, in erster Linie aus der Studie von Zelllinien und Klone von PB abgeleitet. Inwieweit diese Ergebnisse beziehen sich auf primäre T-Zellen entnommen Blut oder lymphatischen Gewebe bleibt unklar, wie die synaptischen Schnittstellen von T-Zellen, die ihren Wohnsitz in den lymphatischen und anderen Geweben bisher nicht analysiert wurden. Wichtig ist, neue Daten deuten darauf hin, dass Gewebe-Resident und lymphatischen Organ abgeleitet T-Zellen möglicherweise erhebliche Unterschiede in ihren Phänotyp und funktionelle Aktivität im Vergleich zu denen in PB6,7. Dies hat die Notwendigkeit, besser zu verstehen, die Funktionen der T-Zell-synaptischen Schnittstelle in primären menschlichen T-Zellen weiter verfestigt.
Zu diesem Zweck entwickelten wir eine neuartige Mini-Ansatzes Ausnutzung Lipid Bilayer eingebaut Multichannel-Fluss Folien ermöglichen die Darstellung der T-Zelle/Bilayer Schnittstellen mit weniger als 105 primäre T-Zellen aus menschlichen PB und LN isoliert ausführen Diese neuartige Technik ermöglicht die Studie die biophysikalischen Eigenschaften des primären menschlichen T-Zellen synaptischen Schnittstellen um besser zu modellieren und in Vivo Zell-Zell-Interaktionen zu verstehen.
Protokoll
Diese Studie wurde in Übereinstimmung mit der Deklaration von Helsinki. Schriftliche Einwilligung wurde von allen Teilnehmern, und Blut-und Lymphknoten wurden mit Zustimmung des Institutional Review Board an der University of Pennsylvania (IRB #809316, IRB # 815056) erworben. Alle Probanden waren Erwachsene. Schnur Blutproben wurden freundlicherweise zur Verfügung gestellt von wehen und der Geburt von der Abteilung für Geburtshilfe und Gynäkologie an der Thomas Jefferson University. Alle Proben wurden anonymisierte.
1. Isolation von CD4+ T-Zellen für eine Bildanalyse
-
Tauen Sie eine 1 mL-aliquoten, 107 eingefroren peripheren mononukleären Blutzellen (PBMCs) oder Lymphknoten mononukleären Zellen (LNMCs) aus gesammelten Proben enthalten. Fügen Sie in einem sterilen Haube die aufgetauten Zellen 9 mL RPMI ergänzt mit Penicillin/Streptomycin und Glutamin hinzu.
- Entmischen der Zellen für 10 min bei 300 X g bei 4 ° C, Aspirieren überstand und Aufschwemmen der Zellen in 5 mL ergänzt mit 10 % RPMI FBS (komplette Medium). Inkubieren Sie die Zellen über Nacht in eine CO2 Inkubator bei 37 ° c
- Am nächsten Tag reinigen CD4+ T-Zellen durch negative Immunomagnetic Sortieren mithilfe eines handelsüblichen Kits nach Anweisungen des Herstellers.
- Um die Anzahl der frisch gereinigten CD4 Messen+ T Zellen, mischen Sie 5 µL Zellsuspension mit ein gleiches Volumen einer Trypan blau-Lösung. Laden Sie eine Hemocytometer mit einer Zelle-Trypan blau Mischung und zählen die lebenden Zellen in den 5 Abschnitten der Hemocytometer.
- Nehmen Sie den Durchschnitt der Zellzahl und bestimmen Sie die Anzahl der Zellen in der ursprünglichen Zellsuspension: die Anzahl der Zellen/1 mL = durchschnittliche Anzahl x 2 x 104. Wenn die Gesamtzahl der isolierten Zellen zu klein ist, verwenden Sie die Zellen ohne zu zählen ist.
- Die Zellen bei 300 X g für 10 min zentrifugieren und Aufschwemmen in einem testpuffer (20 mM HEPES, pH 7,4, 137 mM NaCl, 2 mM Na2HPO4, 5 mM D-Glucose, 5 mM KCl, 1 mM MgCl2, 2 mM CaCl2und 1 % menschliches Serumalbumin) bei 105 < /C13 > Zellen/50 µL oder weniger und halten die Zellen bei 4 ° C (für 1 – 2 h) bis zum Gebrauch in den Experimenten.
- Entsorgen Sie alle biologischen Abfälle gemäß den einschlägigen institutionellen Richtlinien.
- Auf Wunsch als eine Kontrolle Zellpopulation bereiten aktivierte CD8 T-Zellen aus Nabelschnurblut PBMC, 107 platzzellen in 5 mL komplette Medium in einem T25-Kultur-Kolben, bedeckt mit einer Mischung aus Anti-CD3 und Anti-CD28-Antikörper bei 10 µg/mL und 1 µg/mL , beziehungsweise.
- Am nächsten Tag die aktivierten Nabelschnurblutzellen aus der Flasche zu entfernen, waschen Sie sie 1 X mit frischem Medium vervollständigen und erweitern die Zellen in Anwesenheit von rekombinanten IL-2 (100 U/mL) für 2 Wochen.
- Reinigen Sie die Nabelschnurblut CD8+ T-Zellen durch negative Immunomagnetic Sortieren mit dem kommerziell erhältlichen Kit nach Anweisungen des Herstellers. Zählen der Zellen und die Medien in den Assay-Puffer austauschen, wie 1,3-1,6 für LN und PB CD8 beschrieben+ T Zellen.
(2) Komponenten für die Herstellung von planaren Lipid Bilayer
- 3 Arten von Liposomen, wie an anderer Stelle5beschrieben vorbereiten: (a) 0,4 mM DOPC (1,2-Dioleoyl -sn- Glycero-3-phosphocholin) Liposomen, (b) 0,4 mM DOPC Liposomen mit 33 mol-% Hunde-NTA (1,2-Dioleoyl -sn- Glycero - 3-[(N-(5) Amino-1-Carboxypentyl) Iminodiacetic Acid) Succinyl] (Ammoniumsalz)) Lipide, (c) 0,4 mM DOPC Liposomen mit 4 mol% Biotinyl-Cap-PE (1,2-Dioleoyl -sn- Glycero-3-Phosphoethanolamine - N-(GAP Biotinyl) (Natriumsalz)).
-
5 % Kasein-Lösung als zuvor beschriebenen5vorbereiten.
- 5 g Casein Pulver in 100 mL Reinstwasser auflösen und Hinzufügen von 350 µL 10 M Natronlauge. Rühren Sie alles auf eine regelmäßige Magnetrührer mit langsamer Geschwindigkeit anhand der verfügbaren Skala bei Raumtemperatur für 2 h, und dann über Nacht bei 4 ° C. Stellen Sie den pH-Wert auf 7,3 und Ultrazentrifugen Lösung für 2 h bei 100.000 x g bei 4 ° c Filtern Sie den Überstand mit einem sterilen 0,22 µm-Filter und speichern Sie die Lösung in Aliquote bei-80 ° C.
Achtung: Natronlauge kann Verätzungen verursachen und kann dauerhafte Erblindung bei Berührung mit den Augen verursachen. Verwenden Sie Gummihandschuhe, Sicherheitskleidung und Augenschutz beim Umgang mit dieser Chemikalie oder seine Lösungen.
- 5 g Casein Pulver in 100 mL Reinstwasser auflösen und Hinzufügen von 350 µL 10 M Natronlauge. Rühren Sie alles auf eine regelmäßige Magnetrührer mit langsamer Geschwindigkeit anhand der verfügbaren Skala bei Raumtemperatur für 2 h, und dann über Nacht bei 4 ° C. Stellen Sie den pH-Wert auf 7,3 und Ultrazentrifugen Lösung für 2 h bei 100.000 x g bei 4 ° c Filtern Sie den Überstand mit einem sterilen 0,22 µm-Filter und speichern Sie die Lösung in Aliquote bei-80 ° C.
-
Label Anti-CD3-Antikörper mit Biotin, Mono-Bionylated Antikörper-Moleküle mit einem zuvor beschriebene Vorgehensweise8zu produzieren.
- Bereiten Sie eine Lösung von Biotin-PEO4-NHS in Dimethyl Sulfoxid (DMSO) 0,1 mg/ml. 1 mg des Antikörpers in 0,5 mL der Phosphat-gepufferte Kochsalzlösung (PBS) mit 100 mM Sodium Bicarbonat fügen Sie 3,7 µL der Biotin-PEO4-NHS-Lösung hinzu.
- Inkubieren Sie die Mischung für 2 h bei Raumtemperatur. Bereiten Sie eine Lösung von Alexa Fluor-488-NHS Ester bei 10 mg/mL in DMSO. Der Antikörper mit der Bezeichnung Biotin-PEO4-NHS bei einem 10-divisibel molaren Überschuß fügen Sie die Alexa Fluor-488-NHS Ester Lösung hinzu.
- Inkubieren Sie die Mischung für 1 h bei Raumtemperatur unter langsamen rühren auf eine regelmäßige Magnetrührer. Trennen Sie den ungebundenen Farbstoff mit Größe-Ausschluss-Chromatographie.
- Die antikörperkonzentration zu bestimmen, durch Messung der optischen Dichte der Antikörper-Lösung bei 280 nm (ein280). Messung die optische Dichte der beschriftete Antikörper bei 577 nm (ein577).
- Bestimmen Sie die Farbstoff-Antikörper-Verhältnis unter Verwendung der folgenden Gleichung:
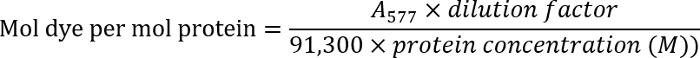
Hinweis: Weitere Details finden Sie im Protokoll des Herstellers.
-
Drücken Sie ein rekombinantes lösliches ICAM-1-Protein in eine Drosophila -Expressionssystem wie zuvor beschrieben,3,4,9,10.
- Klon mit cDNA Kodierung, die ektodomäne von ICAM-1 in Drosophila Ausdruck Vektor pMT/V5-sein mit einem induzierbaren Metallothionein Promoter herstellen ein rekombinantes Protein angehängt mit seiner6 -Tag auf der C-terminalen Ende.
- Co transfizieren Sie S2-Zellen mit der daraus resultierenden ICAM-1 enthaltenden Plasmid und eine G418 Expressionsvektor. Wählen Sie stabile Transfectants mit Schneiders Drosophila Media ergänzt mit 10 % fetalen Kälberserum (FCS) und 0,5 mg/mL G418 für 3 Wochen. Erweitern Sie die Zellen im Insekt serumfreien Medium und induzieren Sie eine Protein-Expression mit 0,5 mM CuSO4 für 3-d.
- Konzentrieren sich die Kultur überstand 10 X und Dialyse gegen PBS über einen tangentialen Fluss Konzentrator als zuvor beschriebenen11.
- Wenden Sie die geballte Kultur überstand auf eine Spalte mit Sepharose mit einem kovalent immobilisierte Anti-ICAM-1 monoklonale Antikörper und eluieren Sie gebundene ICAM-1 mit einem 50 mM Glycin Puffer, pH-Wert 3,0. Sofort neutralisieren der eluierten ICAM-1-Proteins mit einem 2 M Tris-Puffer, pH 8.0.
- Dialyse eluierten Material gegen PBS, pH 8.0 und eine Spalte mit Ni-NTA Agarose dialysierten Material hinzufügen. Eluieren Sie lösliche ICAM-1 mit 200 mM Imidazol, pH 8.0. Dialyse eluierten Material gegen eine PBS-Puffer, pH 8.0.
- Beschriften Sie die gereinigten ICAM-1 mit Cy5 NHS Ester nach Anweisungen des Herstellers.
Hinweis: Das beste Finale Farbstoff-Protein-Verhältnis ist 1:1.
- Fab erzeugen Fragmente aus einem Anti-CD107a-Antikörper durch Papain Verdauung und reinigen die Fab Fragmente durch Ionenaustausch-Chromatographie wie zuvor beschrieben3. Bezeichnung die Fab mit Alexa Fluor 568 NHS Ester nach Anweisungen des Herstellers Fragmente.
3. Zustandekommen des Glas-gestützte Planar Lipid Bilayer
- Bereiten Sie eine frische saure Piranha-Lösung durch das Mischen von 140 mL konzentrierte Schwefelsäure und 60 mL 30 % Wasserstoffperoxid. Waschen Sie die Glasdeckgläser für die Fluss-Folien durch Einweichen in die Säure Piranha-Lösung für 30 min. halten das Glas Deckglas mit Polypropylen Scissor-Art Zange.
Achtung: Piranha Lösung ist ein extrem starkes Oxidationsmittel. Denken Sie daran, Sicherheitsbrille oder Schutzbrille oder einen Integralhelm Schild zusammen mit dicken Gummihandschuhe jederzeit während der Behandlung der Lösung. Arbeiten Sie nur mit Piranha-Lösung unter einer Abzugshaube. Heizung, Transport oder schütteln es jederzeit während des Gebrauchs zu vermeiden, da sie explodieren kann. Sammeln Sie die Piranha-Abfälle in eine Glasflasche mit einem bleihaltigen Loch. Wenden Sie sich an die institutionellen Safety Committee über ordnungsgemäßen Abfallverwertung. -
Spülen Sie die gewaschenen Deckgläsern 7 X mit Reinstwasser indem Sie diese nacheinander in Becher mit frischem Wasser zu übertragen. Stellen Sie den sauberen, trockenen Glases hinterlässt die nassen Deckgläsern beiseite zu lassen, das restliche Wasser abperlen.
- Alternativ verwenden Sie eine PIPETTENSPITZE an eine Vakuumpumpe angeschlossen, um entfernen Sie vorsichtig die restlichen Wassertropfen von den Deckgläsern.
- Führen Sie in der sterilen Haube Verdünnungen von verschiedenen Lipiden, die Liposomen-Mischung zur Herstellung von Bilayer zu produzieren. Zunächst verbinden Sie 37 µL DOPC Liposomen und 3 µL Biotinyl-Cap-PE Liposome. Zweitens: Mischen Sie 14 µL DOPC Liposomen und 15 µL von Hunde-NTA Liposomen. Drittens: Fügen Sie 1 µL des ersten Mix 29 µL des zweiten Mix, die endgültige Liposomen-Mischung zu fabrizieren hinzu.
-
In der sterilen Haube richten Sie einen Arbeitsbereich mit trockenen Deckgläsern in der Nähe. Aliquoten 2 µL der endgültigen Liposomen-Mischung (siehe Punkt 3.3) genau in der Mitte eines Kanals selbstklebende Folie. Richten Sie sofort und sehr präzise eine saubere und trockene Deckglas mit der Folie aus und senken Sie das Deckglas auf der Klebeseite der Folie vorsichtig ab.
- Wenn mehr als eine Folie vorbereiten, arbeiten Sie auf einer Folie zu einem Zeitpunkt, da die Liposomen-Mischung schnell verdunstet. Umdrehen Sie die Folie und verwenden Sie den äußeren Ring des Polypropylen Scissor-Art Zange, um üben Sie sanften Druck auf den peripheren Kontakt das Deckglas mit der Folie, um sicherzustellen, dass der Schlupf der Folie verhindert Leckage fest zugeordnet ist.
Hinweis: Drücken Sie nicht gegen die Kanäle der Folie zu vermeiden, brechen oder reißen das Deckglas. - Drehen Sie die Folie wieder und markieren Sie die Position der gebildeten Bilayer, die aussieht wie ein Tropfen zwischen dem Deckglas und der Kanal-Folie durch Zeichnung 4 Punkte mit einem wasserfesten Filzstift um die Bilayer auf die äußere Folie Seite des Querschnitts.
- Wenn mehr als eine Folie vorbereiten, arbeiten Sie auf einer Folie zu einem Zeitpunkt, da die Liposomen-Mischung schnell verdunstet. Umdrehen Sie die Folie und verwenden Sie den äußeren Ring des Polypropylen Scissor-Art Zange, um üben Sie sanften Druck auf den peripheren Kontakt das Deckglas mit der Folie, um sicherzustellen, dass der Schlupf der Folie verhindert Leckage fest zugeordnet ist.
- Bezeichnen Sie vor der ersten Injektion einer Flüssigkeit in den Kanal ein Port des Kanals als der Anschluss und die andere als die Ausgangsöffnung, und pflegen Sie diese Bezeichnung in das Experiment.
- Um die Bildung von Luftblasen zu vermeiden, stecken Sie das Ende der pipettieren Spitze direkt in den Anschluss des Kanals. Füllen Sie langsam die Kanäle der Folie mit 50 µL Warm (mindestens Raumtemperatur) testpuffer (siehe Schritt 1.5 für die Puffer-Zusammensetzung).
- Bereiten Sie eine 0,5 M Nickel(II)-oxid-chlorid-Lösung. Tauen Sie eine 2 mL-aliquoten Kasein-Lösung in einem Wasserbad bei 37 ° C für 30 min auf und ergänzen Sie es mit einem Nickel-chlorid-Lösung auf eine Endkonzentration von 200 µM.
- Waschen Sie die Bilayer durch Injektion von zunächst 100 µL der Kasein-Lösung in den Anschluss des Kanals und dann sofort entfernen 100 µL aus der Ausfahrt Hafen auf der Folie durch pipettieren. Blockieren der Bilayer mit der gleichen Lösung durch Injektion von 100 µL der Kasein-Lösung in den Anschluss jedes Kanals und Inkubation der Folie für 45 min bei Raumtemperatur.
- Tauen Sie Aliquote Cy5-ICAM-1-HSI6 und Streptavidin Proteine. Kombinieren Sie die Proteine in testpuffer auf die letztendliche Konzentration von 2 µg/mL. Zentrifugieren Sie die Lösung für 30 min bei 20.000 x g und 4 ° C, Aggregate zu entfernen.
- Entfernen Sie den Rest der blockierenden Lösung aus die Ausgangsöffnung des Dia-Kanals durch pipettieren. 100 µL der Lösung mit ICAM-1 und Streptavidin in den Eintrag Port zu injizieren.
- Inkubieren Sie die Folie für 45 Minuten bei Raumtemperatur. Entfernen Sie überschüssiges Öl von der Proteinlösung aus der Ausgangsöffnung. Waschen Sie die Bilayer 2 X durch Injektion von zunächst 100 µL für den Assay-Puffer in den Anschluss des Kanals und dann sofort entfernen 100 µL aus der Ausgangsöffnung.
- Verdünnen Sie einen Alexa-Fluor-488-gekennzeichnete Anti-CD3-Antikörper mit der Assay-Puffer, eine Endkonzentration von 2 µg/mL. 100 µL der Antikörper-Lösung in den Eintrag Port der Folie zu injizieren und 45 min bei Raumtemperatur inkubieren. Entfernen Sie überschüssiges Öl von der Proteinlösung aus der Ausgangsöffnung. Waschen Sie die Bilayer 2 X mit 100 µL testpuffer wie in Schritt 3.11.
4. Bildgebung der T Zellen Interaktion mit planaren Bilayer
-
Heizen Sie die Bühne und das Ziel einer konfokalen oder vollständige interne Reflexion Fluoreszenzmikroskop (TIRF vor), bis die Temperatur bei 37 ° c equilibriert ist Richten Sie die Folie mit der Bilayer(s) auf der beheizten Bühne. Verschieben Sie die Phase an einer geeigneten Stelle nach der Tinte Marken und konzentrieren Sie sich auf die Bilayer Fluoreszenz Cy gekennzeichnet ICAM-1 Moleküle beschäftigt.
- Verwenden Sie eine 61 X Objektiv für das konfokale Mikroskop oder ein 100 X Objektiv für TIRF-Mikroskop, mit entsprechenden Filtereinstellungen.
-
Für Granulat release Bildgebung durch TIRF-Mikroskopie, fügen Sie Alexa-Fluor-568-markierten Anti-CD107a Antikörper Fab-Fragmente, die Zellsuspension auf eine Endkonzentration von 4 µg/mL vor der Injektion der Zellen in der Anschlüsse.
- Aufschwemmen der vorbereiteten CD4+ T Zellen isoliert von LN oder PB oder Schnur Blut und 50 µL Zellsuspension in den Anschluss des Dia-Kanals mit dem Bilayer injizieren.
- Wählen Sie die gewünschte Anzahl der Felder und Aufnahmen der einzelnen Felder 1 x alle 2 min für 30 min nach der Injektion.
- Hellfeld, reflektierte Licht und fluoreszierende Kanäle (Alexa 488 und Cy5) des konfokalen Mikroskops zu erwerben, die Bilder zu nutzen. Verwenden Sie TIRF Modus für Alexa-Fluor-488 und Alexa-Fluor-568 Fluoreszenz und Weitfeld Cy5 Fluoreszenz sowie Hellfeld Bildgebung am TIRF Mikroskop.
(5) Bildanalyse
- Die erworbenen Bilder mittels geeigneter Software zu analysieren. Zellmorphologie im übertragenen Lichtbilder und ausschließen geclustert und sichtbar beschädigt oder Apoptotic Zellen aus der Analyse zu beobachten. Gehören Sie in die Analyse nur jene Zellen, die mit der Bilayer Oberfläche (d.h. Zellen ansammeln Alexa-Fluor-488 Fluoreszenz (Anti-CD3-Antikörper) an der Schnittstelle) produktiv zusammenzuarbeiten.
- Bestimmen Sie die Größe des Bereichs Zelle Adhäsion bei 20 min nach der Einleitung der Zelle-Bilayer Interaktion.
Hinweis: Die Adhäsion Gegend ist der dunkle Bereich an der Zelle-Bilayer-Schnittstelle auf der interferenzbilder Reflexion Mikroskopie (IRM) entwickelt. - Jede Ansammlung von Cy5-ICAM-1 Fluoreszenz und eine Formation von der Ring-Kreuzung durch getrennte Cy-ICAM-1 Moleküle an der Zelle-Bilayer Schnittstelle zu beobachten. Wenn kumulierte ICAM-1 Moleküle eine Adhäsion Ring Kreuzung auf mindestens zwei aufeinander folgende Bilder gebildet, als Zellen entwickeln eine periphere supramolekularen aktivierende Cluster (pSMAC)12festlegen Sie solcher Zellen.
- Bewerten Sie das Granulat-Release durch Messung der Alexa-Fluor-568 Fluoreszenzintensität an der T-Zell-Bilayer-Schnittstelle über die Hintergrundfluoreszenz außerhalb der Kontaktfläche in unmittelbarer Nähe der Zelle. Festlegen Sie Zellen mit einem Verhältnis von Alexa-Fluor-568 Signal-Hintergrund von mindestens 1,3 als degranulating Zellen.
Ergebnisse
Zunächst verglichen wir die Struktur der synaptischen Schnittstelle gebildet von aktivierten CD8 Schnur Blut abgeleitet+ T Zellen, Lipid Bilayer entweder in traditionellen großen Fluss gebaut Zellsysteme (siehe die Tabelle der Materialien für Details)1 ,2,3,4 oder im Multi-Channel-Flow-Folien. Die Bilayer enthalten Leuchtstoff-mar...
Diskussion
Die neuartige Technik, die hier beschriebenen nutzt ähnliche Reagenzien erforderlich, um planare Bilayer in den herkömmlichen Flow Zelle5 bauen und kann erfolgreich eingesetzt werden, um die Darstellung der primären menschlichen T-Zell-Bilayer Schnittstellen3,4 durchführen ,15. Die Technik bietet eine deutliche Reduzierung der fluoreszierende Moleküle Nutzung und erfordert 10 – 20 x weniger T-Zell...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde unterstützt durch die R01AI118694 NIH Grant, Michael R. Betts, worunter Sub Award 566950, Yuri Sykulev. Wir danken der Sidney Kimmel Cancer Center Bioimaging geteilt Ressource für ihre hervorragende Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| CD4 T cell isolation kit, human | Miltenyl Biotec | 130-096-533 | |
| CD8 T cells Isolation Kit, human | Miltenyl Biotec | 130-096-495 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| DOGS NTA | Avanti Polar Lipids | 790528C | |
| Biotinyl Cap PE | Avanti Polar Lipids | 870273C | |
| Human Serum Albumin | Octapharma USA | NDC 68982-643-01 | |
| sticky-Slide VI 0.4 | ibidi | 80608 | |
| Coverslips for sticky-Slides | ibidi | 10812 | |
| Bioptech FCS2 Chamber | Bioptech | 060319-2-03 | |
| anti-CD3 antibody | Thermo Fisher Scientific | 16-0037-81 | OKT3 clone, hybridoma cells are available from ATCC |
| anti- CD28 antibody | Genetex | GTX14664 | 9.3 clone |
| Casein | Sigma | C5890 | |
| Biotin-PEO4-NHS | Thermo Fisher Scientific | 21329 | |
| DMSO | Sigma | D2650-5 | |
| Alexa Fluor 488 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10235 | |
| Alexa Fluor 568 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10238 | |
| Amersham Cy5 NHS Ester | GE Life Science | PA15101 | |
| pMT/V5-His A, B, C Drosophila Expression Vectors | Thermo Fisher Scientific | V412020 | |
| pcopneo, G418 Drosophila expression vector for positive selection | ATCC | 37409 | |
| Serum free Drosophial media Insect-XPRESS | Lonza | 12-730Q | |
| Hybridoma YN1/1.7.4 | ATCC | CRL1878 | The hybridoma secrets antibody against ICAM-1. |
| Cyanogen bromide-activated-Sepharose 4B | Sigma-Aldrich | C9142 | Utilized for preparation of Sepharose with covelently bound anti-ICAM antibody. |
| MasterFlex tangential flow concentrator | Cole-Parmer | 77601-60 7592-40 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Centramate Lab Tangential Flow Systems | Pall Laboratory | FS002K10 OS010T12 FS005K10 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Ni-NTA Agarose | QIAGEN | 30210 | |
| Dialysis tubing | Spectra/Por | 131384 | |
| Papain from papaya latex | Sigma | P3125 | |
| mouse anti-human antibody against CD107a | BD Bioscences | 555798 | Clone H4A3 |
| Ansell Natural Blue Gloves | Fisher Scientific | 19-014-539 | |
| Nalgene Polypropylene Scissor-Type Forceps | Thermo Fisher Scientific | 6320-0010 | |
| Streptavidin | ProZyme | SA10 | |
| Confocal microscope | Nikon | Nikon TiE inverted microscope equipped with PFS for long-term image stability control, 60X oil objectives, 4 lasers with excitation lines at 405, 458, 488, 514, 561, and 640 nm, 2 GaAsP detectors and 2 high sensitivity PMTs, DIC transmitted light, Programmable X,Y,Z stage for multiple positions and stitching of large areas, time lapse functions, Tokai-Hit temperature and CO2-controlled chamber for live imaging, and anti-vibration isolation table | |
| TIRF microscope | Andor | Andor Revolution XD system equipped with Nikon TIRF-E illuminator, Lasers with 405,488,561 and 640 lines, DIC transmitted light, Yokogawa CSU-X1 spinning disk head for confocal imaging, 100/1.49 NA objective, Andor iXon X3 EM-CCD camera, objective heater, and a piezoelectric motorized stage with Perfect Focus System (PFS) | |
| MetaMorph Premier Image Analysis Software | Molecular devices |
Referenzen
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Somersalo, K., et al. Cytotoxic T lymphocytes form an antigen-independent ring junction. Journal of Clinical Investigation. 113, 49-57 (2004).
- Beal, A. M., et al. Protein kinase C theta regulates stability of the peripheral adhesion ring junction and contributes to the sensitivity of target cell lysis by CTL. The Journal of Immunology. 181, 4815-4824 (2008).
- Beal, A. M., et al. Kinetics of early T cell receptor signaling regulate the pathway of lytic granule delivery to the secretory domain. Immunity. 31, 632-642 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Current Protocols in Immunology. , (2007).
- Reuter, M. A., et al. HIV-Specific CD8(+) T Cells Exhibit Reduced and Differentially Regulated Cytolytic Activity in Lymphoid Tissue. Cell Reports. 21, 3458-3470 (2017).
- Buggert, M., et al. Limited immune surveillance in lymphoid tissue by cytolytic CD4+ T cells during health and HIV disease. PLoS Pathogens. 14, e1006973 (2018).
- Carrasco, Y. R., Fleire, S. J., Cameron, T., Dustin, M. L., Batista, F. D. LFA-1/ICAM-1 interaction lowers the threshold of B cell activation by facilitating B cell adhesion and synapse formation. Immunity. 20, 589-599 (2004).
- Anikeeva, N., et al. Distinct role of lymphocyte function-associated antigen-1 in mediating effective cytolytic activity by cytotoxic T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America. 102, 6437-6442 (2005).
- Steblyanko, M., Anikeeva, N., Campbell, K. S., Keen, J. H., Sykulev, Y. Integrins Influence the Size and Dynamics of Signaling Microclusters in a Pyk2-dependent Manner. The Journal of Biological Chemistry. 290, 11833-11842 (2015).
- Anikeeva, N., Lebedeva, T., Sumaroka, M., Kalams, S. A., Sykulev, Y. Soluble HIV-specific T-cell receptor: expression, purification and analysis of the specificity. Journal of Immunological Methods. 277, 75-86 (2003).
- Monks, C., Freiberg, B., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Riddell, S. R., Greenberg, P. D. The use of anti-CD3 and anti-CD28 monoclonal antibodies to clone and expand human antigen-specific T cells. Journal of Immunological Methods. 128, 189-201 (1990).
- Lin, S. J., Yu, J. C., Cheng, P. J., Hsiao, S. S., Kuo, M. L. Effect of interleukin-15 on anti-CD3/anti-CD28 induced apoptosis of umbilical cord blood CD4+ T cells. European Journal of Haematology. 71, 425-432 (2003).
- Anikeeva, N., Sykulev, Y. Mechanisms controlling granule-mediated cytolytic activity of cytotoxic T lymphocytes. Immunologic Research. 51, 183-194 (2011).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten