Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung einer Niere Cortex extrazelluläre Matrix abgeleitet Hydrogel
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll, um eine Niere Kortex extrazelluläre Matrix abgeleitet Hydrogel um die native Niere extrazelluläre Matrix (ECM) strukturelle und biochemische Zusammensetzung behalten zu fabrizieren. Den Fertigungsprozess und ihre Anwendungen werden beschrieben. Schließlich ist eine Perspektive auf die Verwendung dieses Hydrogel zur Niere-spezifische zelluläre und Geweberegeneration und Bioingenieurwissenschaften Unterstützung diskutiert.
Zusammenfassung
Extrazellulärer Matrix (ECM) bietet wichtige biophysikalische und biochemische Hinweise um Gewebe Homöostase. Aktuelle synthetischen Hydrogelen bieten robuste mechanische Unterstützung für in-Vitro Zellkultur aber fehlen die notwendigen Protein und Liganden Zusammensetzung physiologischen Verhalten von Zellen zu entlocken. Dieses Manuskript beschreibt ein Herstellungsverfahren für eine Niere Kortex ECM-abgeleitete Hydrogel mit richtige mechanische Robustheit und unterstützende biochemischen Zusammensetzung. Das Hydrogel ist von mechanisch Homogenisieren und Gefäss-decellularized menschliche Niere Kortex ECM hergestellt. Die Matrix bewahrt native Niere Kortex ECM Protein Verhältnisse Gelierung zu physiologischen mechanische Steifigkeit ermöglicht. Das Hydrogel dient als Substrat auf die Nieren Rinde gewonnenen Zellen unter physiologischen Bedingungen aufrechterhalten werden können. Darüber hinaus kann die Hydrogel-Zusammensetzung manipuliert werden, um eine kranke Umwelt-Modell ermöglicht die Zukunftsstudie von Nierenerkrankungen.
Einleitung
Extrazellulärer Matrix (ECM) bietet wichtige biophysikalische und biochemische Hinweise um Gewebe Homöostase. Die komplexen molekularen Zusammensetzung regelt die strukturelle und funktionelle Eigenschaften des Gewebes. Strukturproteine Zellen mit räumliches Vorstellungsvermögen und Adhäsion und Migration1. Gebundene Liganden interagieren mit Oberfläche Zellrezeptoren, Zelle Verhalten2zu kontrollieren. Niere ECM enthält eine Fülle von Molekülen, deren Zusammensetzung und Struktur variiert je nach anatomischen Lage, Entwicklungsstufe und Krankheit Staat3,4. Rekapitulation der Komplexität von ECM ist ein wichtiger Aspekt bei der Untersuchung der Nieren-abgeleitete Zellen in Vitro.
Frühere Versuche zur Replikation von ECM Mikroumgebungen konzentrierten sich auf einem ganzen Gewebe, Gerüste Recellularization zusammenzustellen. Decellularization mit chemischen Reinigungsmitteln wie Natrium-Dodecyl-Sulfat (SDS) oder nichtionischen Reinigungsmitteln durchgeführt wurde, und es nutzt entweder ganze Organ Perfusion oder Eintauchen und Agitation Methoden5,6,7 ,8,9,10,11,12,13. Die hier vorgestellten Gerüste bewahren die strukturelle und biochemische Signale in nativen Gewebe ECM gefunden; Darüber hinaus Recellularization mit Spender-spezifischen Zellen hat klinischen Relevanz in der rekonstruktiven Chirurgie14,15,16,17,18, 19. allerdings diese Gerüste fehlen strukturelle Flexibilität und sind daher nicht kompatibel mit vielen aktuellen Geräten für in-vitro- Studien verwendet. Um diese Einschränkung zu umgehen, haben viele Gruppen decellularized ECM zu Hydrogele20,21,22,23,24weiterverarbeitet. Diese Hydrogele sind kompatibel mit Spritzguss und Bioink und Mikrometer Skala räumliche Einschränkungen, die Gerüste auf Zellen statt decellularized umgehen. Darüber hinaus sind Molekulare Zusammensetzung und Verhältnisse in native ECM gefunden3,25erhalten. Hier zeigen wir eine Methode, um ein Hydrogel, abgeleitet von Niere Kortex ECM (kECM) herzustellen.
Dieses Protokoll soll ein Hydrogel zu produzieren, die die Mikroumgebung der Niere kortikalen Region repliziert werden. Nierengewebe Kortex ist in einer 1 % SDS-Lösung unter ständiger Bewegung, zelluläre Materie zu entfernen decellularized. SDS ist häufig verwendet, um Gewebe wegen seiner Fähigkeit, schnell zu entfernen, immunologische zellulären Material6,7,9,26decellularize. Dann unterliegt die kECM mechanische Homogenisierung und Lyophilisation5,6,9,11,26. Solubilisierung in einer starken Säure mit Pepsin führt zu einer endgültigen Hydrogel-Stammlösung20,27. Native kECM Proteine, die wichtig sind für strukturelle Unterstützung und signal-Transduktion sind3,25erhalten. Das Hydrogel kann auch in einer Größenordnung von nativen menschlichen Niere Kortex28,29,30, geliert werden. Diese Matrix bietet eine physiologische Umgebung, die verwendet wurde, um die Ruhe der Niere-spezifischen Zellen im Vergleich zu Hydrogele aus anderen matrixproteine pflegen. Darüber hinaus Matrix Zusammensetzung manipuliert werden kann, zum Beispiel durch die Zugabe von Kollagen-I Modell Krankheit Umgebungen für die Studie der renalen Fibrose und andere Niere Krankheiten31,32.
Protokoll
Menschliche Nieren wurden durch LifeCenter Nordwesten nach ethischen Leitlinien durch die Association of Organ Procurement Organizations lokalisiert. Dieses Protokoll folgt Tiere Pflege und Zelle Kultur genannten Richtlinien von der University of Washington.
1. Vorbereitung des menschlichen Nierengewebe
- Vorbereitung der Decellularization Lösung
- Ein 5000 mL-Becherglas und eine 70 x 10 mm Stir Bar zu sterilisieren.
- Mix 1: 1000 (Gewicht: Volumen) Natrium Dodecyl-Sulfat (SDS) in autoklaviert deionisiertes Wasser in den Becher geben. Lassen Sie die Lösung auf einem Teller rühren ca. 200 u/min für 24 h oder bis die SDS vollständig gelöst ist.
Anmerkung: In der Regel reicht 2500 mL 1 % SDS-Lösung zu eine einzige menschlichen Niere decellularize. - Die Lösung auf eine 500 mL sterile Vakuumfilter übertragen und in sterilisierte verschließbaren Behälter zu filtern.
- Verarbeitung von nierengewebe
- Wasch- und Autoklaven ein paar Zangen, zwei Gefäßklemme Klemmen, der allgemeine Service Klasse Schere, Skalpell Klinge Tragegriffen, einen 1000-mL-Becherglas abgedeckt mit Alufolie und 36 x 9 mm Stir Bar.
- Linie eine Gewebekultur Kapuze mit Unterlage. Legen Sie die Becher, ein steriles Gewebe Kulturschale (150 x 25 mm) und die ganze Niere-Orgel in der Haube. Füllen Sie den Becher mit 500 mL 1 % SDS-Lösung.
Hinweis: Die menschliche Nieren gingen am Eis aus LifeCenter Nordwesten. - Legen Sie die Niere in der sterilen Gewebe Kulturschale (Abbildung 1A). Entfernen Sie alle Tubulussystem Fett durch das Rasieren leicht um die renale Kapsel mit einem Skalpell (Abbildung 1 b).
- Machen Sie einen flachen 8-10 cm Schnitt mit dem Skalpell, nur tief genug, um die renale Kapsel aufzubrechen ohne die zugrunde liegenden Kortex Gewebe, über das bessere Ende der Niere. Entfernen Sie die renale Kapsel durch Schälen es weg von der Rinde Gewebe mit zwei Gefäßklemme Klemmen (Abbildung 1).
- Halbieren Sie die Niere entlang der koronalen Ebene mit dem Skalpell entlang der lateralen Seite der Niere (Abbildung 1). Kortex Gewebe aus beiden Hälften durch Ausgliederung der medullären Region mit dem Skalpell (Abbildung 1E) zu isolieren und die Rinde Gewebe in 0,5 cm3 Stücke (Abb. 1F) Würfeln. Entfernen Sie alle sichtbaren Großschiffe.
- Isolierung der extrazellulären matrix
- Füllen Sie in einer Gewebekultur-Haube einen 1000-mL-Becherglas mit 500 mL 1 % SDS-Lösung. Legen Sie die gewürfelte Kortex Gewebe und rühren Bar in das Becherglas mit SDS-Lösung. Decken Sie das Becherglas mit autoklaviert Alufolie ab und legen Sie sie auf einem Teller rühren ca. 400 u/min außerhalb der Gewebekultur-Haube.
- Nach das Kortex Gewebe auf dem Teller rühren für 24 h wurde, bringen Sie das Becherglas in einer Gewebekultur Kapuze und fügen Sie ein 40 µm sterile Zelle Sieb mit Nylon-Mesh gemacht. Füllen Sie einen separaten 1000 mL Becher mit 200 mL Bleichmittel und legen Sie sie in der Gewebekultur-Haube.
- Pipette, die SDS-Lösung durch das Sieb der Zelle in das Becherglas mit Bleichmittel. Pipette, alle SDS-Lösung bis nur decellularized Gewebe und Zelle Sieb im Becherglas bleiben.
Hinweis: Die Zelle Sieb sollte jedem Gewebe verhindern entfernt während Lösung streben. - Lassen Sie die Zelle Sieb in den Becher und füllt mit 500 mL frischem SDS-Lösung. Das Becherglas mit dem gleichen Alu-Folie abdecken und auf einen Teller rühren mit der gleichen Geschwindigkeit wie vor Ort.
- Wiederholen Sie die Schritte 1.3.1-1.3.3 alle 24 Stunden mit frischem SDS-Lösung für insgesamt fünf Tage.
- Spülen Sie decellularized Gewebe mit autoklaviert DI Wasser alle 24 h für 3 Tage insgesamt, nach der Technik beschriebenen in Schritten 1.3.1-1.3.3.
- Spülen decellularized Gewebe mit Zellwasser Kultur Grade alle 24 h für 2 Tage, nach der Technik gemäß Schritte 1.3.1-1.3.3.
- Wiederholen Sie die Schritte 1.3.1-1.3.2. Übertragen Sie das decellularized Gewebe (bezeichnet als kECM ab diesem Zeitpunkt auf) in eine 30 mL Selbststehend konischem Rohr zu und mit Kultur Grade Zellwasser füllen Sie, bis das Gewebe untergetaucht ist.
2. Herstellung von Hydrogel-Lager-Lösung
- Mechanische Bearbeitung von decellularized Gewebe
- In einer Gewebekultur Haube mechanisch Homogenisieren Sie kECM innerhalb der konischen Röhre mit einem Gewebe-Homogenisator für 2 min.
Hinweis: Homogenisierte kECM sollte eine opake Lösung mit keine sichtbaren Stücke von ECM ähneln. - Tauchen Sie das konische Rohr mit kECM in flüssigem Stickstoff bis Kochen rund um das Rohr nicht mehr besteht. Speichern Sie die kECM bei-4 ° c über Nacht.
- In einer Gewebekultur Haube mechanisch Homogenisieren Sie kECM innerhalb der konischen Röhre mit einem Gewebe-Homogenisator für 2 min.
- Gefriertrocknung von gefrorenen decellularized Gewebe
- Lösen Sie leicht konischem Rohr Kappe, damit für Gasaustausch und legen Sie das Rohr in eine Gefriertrocknung-Maschine. Die kECM lyophilize, drei Tage lang oder bis es ein feines, weißes Pulver ähnelt. Bei-4 ° c.
- Chemische Verdauung und Solubilisierung Gel
- Autoklaven ein 20 mL-Fläschchen funkeln und GAP 15,9 x 7,9 mm rühren und eine Bar, ein paar feine Spitze Pinzetten.
- Wiegen die lyophilisierten kECM und berechnen Sie das Volumen von HCl und Pepsin musste solubilisieren kECM zu einer 3 % (30 mg/mL) Lösung mit den folgenden Gleichungen, wo mPepsin ist die Masse von Pepsin Masse, mGewebe ist die Masse des lyophilisierter Gewebe und VHCl ist das Volumen von 0,01 N HCl:
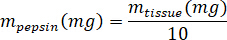
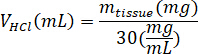
- In einer Gewebekultur-Haube das Funkeln Fläschchen porcinen Magen Pepsin, 0,01 N HCl und Stir Bar hinzu, und lassen Sie es auf einer Platte unter Rühren auf ca. 500 u/min, bis alle Pepsin aufgelöst hat. Transfer der gefriergetrockneten kECM zum Funkeln Fläschchen und lassen Sie die Lösung auf einem Teller rühren bei ca. 500 u/min für drei Tage.
3. Hydrogel Gelierung
- Niere ECM Hydrogel Vorbereitung
- Das Hydrogel durch Mischen der kECM Hydrogel-Stammlösung mit 1 N NaOH, 10 x Medien Ergänzung (M199), Gel und Zell-Kultur, Medien. Halten Sie die Lösungen auf dem Eis.
Hinweis: Letzte Gel Konzentrationen von 7,5 mg/mL waren für die Zellkultur verwendet. 1 mL kECM Gel war ausreichend für Zellexperimente Kultur vorgestellt. - Bestimmen Sie die Lautstärke praktikable kECM Gel produziert und Volumen der Lager kECM Hydrogel benötigt mithilfe der folgenden Gleichung, wo Vfinal ist das Volumen des Gels erstellt, VLager kECM ist das Volumen der Lager kECM Hydrogel benötigt, CLager kECM ist die Konzentration Lager kECM Hydrogel und Cfinal ist die Konzentration des endgültigen Gels:
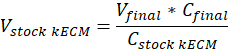
- Bestimmen Sie die Lautstärke mithilfe der folgenden Gleichungen, wo VNaOH ist das Volumen von 1 N NaOH benötigte Reagenzien zu neutralisieren, 10 X V ist das Volumen des M199 10 X Medien ergänzen und V1 X ist die Volumen von Zellkulturmedien:
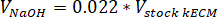
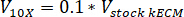
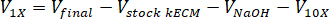
- In einer Gewebekultur-Haube pipette die neutralisierenden Reagenzien (NaOH, M199 und Zellkulturmedien) in eine sterile 30 mL Selbststehend konischem Rohr. Mischen Sie die neutralisierende Reagenzlösung mit einer Microspatula.
- Verwenden Sie eine sterile 1 mL Spritze, um das entsprechende Volumen der Lager kECM Hydrogel zu neutralisierende Reagenzlösung übertragen. Verwenden Sie eine Microspatula, um die Lösung vorsichtig mischen, bis eine homogene Farbe Hydrogel Lösung erreicht ist.
Hinweis: Vermeiden Sie Luftblasen unter Rühren langsam und vorsichtig einführen. - Um Zellen in kECM Hydrogel enthalten, subtrahieren Sie 10 µL Zellkulturmedien (V1 X) aus die neutralisierende Lösung Mengenberechnungen im Schritt 3.1.1.3.
- Suspendieren Sie Zellen in 10 µL Zellkulturmedien. Bestimmen Sie die Anzahl der Zellen ausgesetzt werden mithilfe der folgenden Gleichung, wo #Zellen bedeutet die Anzahl der Zellen, auszusetzen und Vfinal ist das Volumen des Gels erstellt:
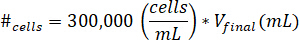
Hinweis: 300.000 Zellen/mL ist die Konzentration der Zellen in der kECM Gel verwendet. - Pipette 10 µL der Zelle gesperrt-Lösung in das endgültige kECM Gel nach kECM-Stammlösung vermischt worden ist, mit Reagenzlösung zu neutralisieren. Rühren Sie die Lösung mit einer Microspatula, bis die Zellen gleichmäßig verteilt sind.
- Suspendieren Sie Zellen in 10 µL Zellkulturmedien. Bestimmen Sie die Anzahl der Zellen ausgesetzt werden mithilfe der folgenden Gleichung, wo #Zellen bedeutet die Anzahl der Zellen, auszusetzen und Vfinal ist das Volumen des Gels erstellt:
- Das Hydrogel durch Mischen der kECM Hydrogel-Stammlösung mit 1 N NaOH, 10 x Medien Ergänzung (M199), Gel und Zell-Kultur, Medien. Halten Sie die Lösungen auf dem Eis.
- Verwenden Sie eine 1 mL Spritze, um eine gewünschte Zelle Kultur Gerät mit kECM Hydrogel auszufüllen.
- Lassen Sie das Gel auf 37 ° c für 1 h vor dem übertragen oder galvanischen Zellen festgelegt.
Ergebnisse
KECM Hydrogel stellt eine Matrix für Niere Zellkultur mit ähnlicher chemischer Zusammensetzung als die native Niere Mikroumgebung. Um das Hydrogel zu fabrizieren, ist Cortex nierengewebe mechanisch isoliert aus eine ganze Niere Orgel und gewürfelte (Abbildung 1). Decellularization mit einem chemischen Reinigungsmittel (Abbildung 2A.1-a. 3), gefolgt von Spülungen mit Wasser Spülmittel Partikel (
Diskussion
Matrizen liefern wichtige mechanische und chemische Signale, die Zelle Verhalten steuern. Synthetische Hydrogele sind in der Lage, komplexe 3-dimensionale Musterung unterstützen, aber nicht die vielfältigen extrazelluläre Signale in physiologischen Matrix Mikroumgebungen gefunden. Hydrogele native ECM abgeleitet sind ideale Materialien für in Vivo und in Vitro Studien. Frühere Studien haben decellularized ECM Hydrogele verwendet, um synthetische Biomaterialien zur Vermeidung Host Immunreaktionen
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchten die Lynn und Mike Garvey Imaging Laboratory am Institut für Stammzellen und Regenerationsmedizin und LifeCenter Nordwesten anzuerkennen. Sie möchten auch die finanzielle Unterstützung der National Institutes of Health Zuschüsse, UH2/UH3 TR000504 (, j.h.) und DP2DK102258 (um Y.Z), NIH T32 Ausbildung Grant DK0007467 (R.J.N.), und ein uneingeschränkter Geschenk aus Nordwesten Niere Zentren zu erkennen an der Niere-Forschungsinstitut.
Materialien
| Name | Company | Catalog Number | Comments |
| Preparation of Kidney Tissue | |||
| 5000 mL Beaker | Sigma-Aldrich | Z740589 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma-Aldrich | 436143 | |
| Sterile H2O | Autoclaved DI H2O | ||
| Stir Bar (70 x 10 mm) | Fisher Science | 14-512-128 | |
| 500 mL Vacuum Filter | VWR | 97066-202 | |
| Stir Plate | Sigma-Aldrich | CLS6795420D | |
| 1000 mL Beaker | Sigma-Aldrich | CLS10031L | |
| Forceps | Sigma-Aldrich | F4642 | Any similar forceps may be used |
| Scissor-Handle Hemostat Clamp | Sigma-Aldrich | Z168866 | |
| Dissecting Scissors | Sigma-Aldrich | Z265977 | |
| Scalpel Handle, No. 4 | VWR | 25859-000 | Any similar scalpel handle may be used |
| Scalpel Blade, No. 20 | VWR | 25860-020 | Any similar scalpel blade may be used |
| Stir Bar (38.1 x 9.5 mm) | Fisher Science | 14-513-52 | |
| Absorbent Underpad | VWR | 82020-845 | |
| Petri Dish (150 x 25 mm) | Corning | 430597 | |
| Autoclavable Biohazard Bag | VWR | 14220-026 | |
| Sterile Cell Strainer (40 um) | Fisher Science | 22-363-547 | |
| Cell Culture Grade Water | HyClone | SH30529.03 | |
| 30 mL Freestanding Tube | VWR | 89012-778 | |
| Fabrication of ECM Gel | |||
| Tissue Homogenizer Machine | Polytron | PCU-20110 | |
| Freeze Dryer | Labconco | 7670520 | |
| 20 mL Glass Scintillation Vials and Cap | Sigma-Aldrich | V7130 | |
| Stir Bar (15.9 x 8 mm) | Fisher Science | 14-513-62 | |
| Pepsin from Porcine Gastric Mucosa | Sigma-Aldrich | P7012 | |
| 0.01 N HCl | Sigma-Aldrich | 320331 | Dilute to 0.01 N HCl with cell culuture water |
| Kidney ECM Gelation | |||
| 1 N NaOH (Sterile) | Sigma-Aldrich | 415413 | Dilute to 1 N in cell culture grade water |
| Medium 199 | Sigma-Aldrich | M4530 | |
| 15 mL Conical Tube | ThermoFisher | 339651 | |
| Cell Culture Media | ThermoFisher | 11330.032 | Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12) |
| Fetal Bovine Serum (FBS) | Gibco | 10082147 | |
| Antibiotic-Antimycotic 100X | Life Technologies | 15240-062 | |
| Insulin, Transferrin, Selenium, Sodium Pyruvate Solution (ITS-A) 100X | Life Technologies | 51300-044 | |
| 1 mL Syringe | Sigma-Aldrich | Z192325 | |
| Microspatula | Sigma-Aldrich | Z193208 |
Referenzen
- Lelongt, B., Ronco, P. Role of extracellular matrix in kidney development and repair. Pediatric Nephrology. 18 (8), 731-742 (2003).
- Yue, B. Biology of the Extracellular Matrix: An Overview. Journal of Glaucoma. 23, S20-S23 (2014).
- Miner, J. H. Renal basement membrane components. Kidney International. 56 (6), 2016-2024 (1999).
- Petrosyan, A., et al. Decellularized Renal Matrix and Regenerative Medicine of the Kidney: A Different Point of View. Tissue Engineering Part B. 22 (3), 183-192 (2016).
- Caralt, M., et al. Optimization and Critical Evaluation of Decellularization Strategies to Develop Renal Extracellular Matrix Scaffolds as Biological Templates for Organ Engineering and Transplantation. American Journal of Transplantation. 15 (1), 64-75 (2015).
- Nakayama, K. H., Batchelder, C. A., Lee, C. I., Tarantal, A. F. Decellularized rhesus monkey kidney as a three-dimensional scaffold for renal tissue engineering. Tissue Engineering Part A. 16 (7), 2207-2216 (2010).
- Nakayama, K. H., Lee, C. C. I., Batchelder, C. A., Tarantal, A. F. Tissue Specificity of Decellularized Rhesus Monkey Kidney and Lung Scaffolds. Public Library of Science ONE. 8 (5), (2013).
- Orlando, G., et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations. Annals of Surgery. 256 (2), 363-370 (2012).
- Sullivan, D. C., et al. Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials. 33 (31), 7756-7764 (2012).
- Choi, S. H., et al. Development of a porcine renal extracellular matrix scaffold as a platform for kidney regeneration. Journal of Biomedical Materials Research Part A. 103 (4), 1391-1403 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
- Nagao, R. J., et al. Decellularized Human Kidney Cortex Hydrogels Enhance Kidney Microvascular Endothelial Cell Maturation and Quiescence. Tissue Engineering Part A. 22 (19-20), 1140-1150 (2016).
- Gupta, S. K., Mishra, N. C., Dhasmana, A. Decellularization Methods for Scaffold Fabrication. Methods in Molecular Biology. , 1-10 (2017).
- Hudson, T., et al. Optimized Acellular Nerve Graft is Immunologically Tolerated and Supports Regeneration. Tissue Engineering. 10 (11), 1641-1651 (2004).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367 (9518), 1241-1246 (2006).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B., et al. Organ reengineering through development of a transplantable recellularied liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Nagao, R. J., et al. Preservation of Capillary-beds in Rat Lung Tissue Using Optimized Chemical Decellularization. Journal of Materials Chemistry B. 1 (37), 4801-4808 (2013).
- Song, J. J., et al. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Medicine. 19 (5), 646-651 (2013).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29 (11), 1630-1637 (2008).
- Wolf, M. T., et al. A hydrogel derived from decellularized dermal extracellular matrix. Biomaterials. 33 (29), 7028-7038 (2012).
- Fisher, M. B., et al. Potential of healing a transected anterior cruciate ligament with genetically modified extracellular matrix bioscaffolds in a goat model. Knee Surgery, Sports Traumatology, Arthroscopy. 20 (7), 1357-1365 (2012).
- Ghuman, H., et al. ECM hydrogel for the treatment of stroke: Characterization of the host cell infiltrate. Biomaterials. 91, 166-181 (2016).
- Rijal, G. The decellularized extracellular matrix in regenerative medicine. Regenerative Medicine. 12 (5), 475-477 (2017).
- Lennon, R., et al. Global Analysis Reveals the Complexity of the Human Glomerular Extracellular Matrix. Journal of the American Society of Nephrology. 25 (5), 939-951 (2014).
- Bonandrini, B., et al. Recellularization of Well-Preserved Acellular Kidney Scaffold Using Embryonic Stem Cells. Tissue Engineering Part A. 20 (9-10), 1486-1498 (2014).
- O'Neill, J. D., Freytes, D. O., Anandappa, A. J., Oliver, J. A., Vunjak-Novakovic, G. V. The regulation of growth and metabolism of kidney stem cells with regional specificity using extracellular matrix derived from kidney. Biomaterials. 34 (38), 9830-9841 (2013).
- Streitberger, K. -. J., et al. High-resolution mechanical imaging of the kidney. Journal of Biomechanics. 47 (3), 639-644 (2014).
- Bensamoun, S. F., et al. Stiffness imaging of the kidney and adjacent abdominal tissues measured simultaneously using magnetic resonance elastography. Clinical Imaging. 35 (4), 284-287 (2011).
- Moon, S. K., et al. Quantification of Kidney Fibrosis Using Ultrasonic Shear Wave Elastography. Journal of Ultrasound in Medicine. 34, 869-877 (2015).
- Genovese, F., Manresa, A. A., Leeming, D. J., Karsdal, M. A., Boor, P. The extracellular matrix in the kidney: a source of novel non-invasive biomarkers of kidney fibrosis?. Fibrogenesis & Tissue Repair. 7 (1), (2014).
- Hewitson, T. D. Fibrosis in the kidney: is a problem shared a problem halved?. Fibrogenes & Tissue Repair. 5 (1), S14 (2012).
- Wolf, M. T., et al. Polypropylene surgical mesh coated with extracellular matrix mitigates the host foreign body response. Journal of Biomedical Materials Research Part A. 102 (1), 234-246 (2014).
- Faulk, D. M., et al. ECM hydrogel coating mitigates the chronic inflammatory response to polypropylene mesh. Biomaterials. 35 (30), 8585-8595 (2014).
- Jeffords, M. E., Wu, J., Shah, M., Hong, Y., Zhang, G. Tailoring Material Properties of Cardiac Matrix Hydrogels To Induce Endothelial Differentiation of Human Mesenchymal Stem Cells. ACS Applied Materials & Interfaces. 7 (20), 11053-11061 (2015).
- Kim, M. -. S., et al. Differential Expression of Extracellular Matrix and Adhesion Molecules in Fetal-Origin Amniotic Epithelial Cells of Preeclamptic Pregnancy. Public Library of Science ONE. 11 (5), e0156038 (2016).
- Paduano, F., Marrelli, M., White, L. J., Shakesheff, K. M., Tatullo, M. Odontogenic Differentiation of Human Dental Pulp Stem Cells on Hydrogel Scaffolds Derived from Decellularized Bone Extracellular Matrix and Collagen Type I. Public Library of Science ONE. 11 (2), e0148225 (2016).
- Viswanath, A., et al. Extracellular matrix-derived hydrogels for dental stem cell delivery. Journal of Biomedical Materials Research Part A. 105 (1), 319-328 (2017).
- Uriel, S., et al. Extraction and Assembly of Tissue-Derived Gels for Cell Culture and Tissue Engineering. Tissue Engineering Part C Methods. 15 (3), 309-321 (2009).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissues: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Faust, A., et al. Urinary bladder extracellular matrix hydrogels and matrix-bound vesicles differentially regulate central nervous system neuron viability and axon growth and branching. Journal of Biomaterials Applications. 31 (9), 1277-1295 (2017).
- Pouliot, R. A., et al. Development and characterization of a naturally derived lung extracellular matrix hydrogel. Journal of Biomedical Materials Research Part A. 104 (8), 1922-1935 (2016).
- Pati, F., et al. Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink. Nature Communications. 5, 3935 (2014).
- Pati, F., et al. Biomimetic 3D tissue printing for soft tissue regeneration. Biomaterials. 62, 164-175 (2015).
- Wang, R. M., Christman, K. L. Decellularized myocardial matrix hydrogels: In basic research and preclinical studies. Advanced Drug Delivery Reviews. 96, 77-82 (2016).
- Jang, J., et al. 3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair. Biomaterials. 112, 264-274 (2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (Pt 24), 4195-4200 (2010).
- Mouw, J. K., Ou, G., Weaver, V. M. Extracellular matrix assembly: a multiscale deconstruction. Nature Reviews Molecular Cell Biology. 15 (12), 771-785 (2014).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Hinderer, S., Layland, S. L., Schenke-Layland, K. ECM and ECM-like materials - Biomaterials for applications in regenerative medicine and cancer therapy. Advanced Drug Delivery Reviews. 97, 260-269 (2016).
- Uriel, S., et al. The role of adipose protein derived hydrogels in adipogenesis. Biomaterials. 29 (27), 3712-3719 (2008).
- Singelyn, J. M., et al. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30 (29), 5409-5416 (2009).
- Medberry, C. J., et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials. 34 (4), 1033-1040 (2013).
- Loneker, A. E., Faulk, D. M., Hussey, G. S., D'Amore, A., Badylak, S. F. Solubilized liver extracellular matrix maintains primary rat hepatocyte phenotype in-vitro. Journal of Biomedical Materials Research Part A. 104 (4), 957-965 (2016).
- Hill, R. C., Calle, E. A., Dzieciatkowska, M., Niklason, L. E., Hansen, K. C. Quantification of extracellular matrix proteins from a rat lung scaffold to provide a molecular readout for tissue engineering. Molecular & Cellular Proteomics. 14 (4), 961-973 (2015).
- Li, Q., et al. Proteomic analysis of naturally-sourced biological scaffolds. Biomaterials. 75, 37-46 (2016).
- Tanaka, T., Yada, R. Y. N-terminal portion acts as an initiator of the inactivation of pepsin at neutral pH. Protein Engineering. 14 (9), 669-674 (2001).
- Ligresti, G., et al. A Novel Three-Dimensional Human Peritubular Microvascular System. Journal of the American Society of Nephrology. 27 (8), 2370-2381 (2016).
- Mozes, M. M., Böttinger, E. P., Jacot, T. A., Kopp, J. B. Renal expression of fibrotic matrix proteins and of transforming growth factor-beta (TGF-beta) isoforms in TGF-beta transgenic mice. Journal of the American Society of Nephrology. 10 (2), 271-280 (1999).
- Romanowicz, L., Galewska, Z. Extracellular matrix remodeling of the umbilical cord in pre-eclampsia as a risk factor for fetal hypertension. Journal of Pregnancy. 2011, 542695 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten