Method Article
Visualisierung der Knoten und Notochordal Platte In Gastrulating Maus-Embryonen mittels Rasterelektronenmikroskopie und ganze Mount Immunfluoreszenz
In diesem Artikel
Zusammenfassung
Die Knoten und notochordal Platte sind vergänglich Signalisierung Organisatoren bei der Entwicklung von Mäuseembryonen, die mit mehreren Techniken visualisiert werden können. Hier beschreiben wir im Detail wie Sie zwei Techniken ihre Struktur und Morphogenese durchführen: 1) Rasterelektronenmikroskopie (SEM); und 2) ganze Berg Immunfluoreszenz (WMIF).
Zusammenfassung
Nach der Implantation Mausembryos erfährt große Formänderungen nach der Einleitung der Gastrulation und Morphogenese. Ein Markenzeichen der Morphogenese ist die Bildung der Transienten-Organisatoren, die Knoten und notochordal Platte aus Zellen, die das primitive Streak durchlaufen haben. Die richtige Bildung dieser Signalisierung Zentren ist essentiell für die Entwicklung des Körpers Plans und Techniken, um sie zu visualisieren sind von großem Interesse für die Maus Entwicklungs Biologen. Die Knoten und notochordal Platte liegen auf der ventralen Oberfläche der gastrulating Mausembryonen um embryonale Tag (E) 7.5 Entwicklung. Der Knoten ist eine schalenförmige Struktur, deren Zellen einen einzigen schlanken Zilie besitzen. Die richtige subzelluläre Lokalisation und die Drehung der Zilien in der Knoten-Grube bestimmt, links-rechts-Asymmetrie. Die notochordal Platte Zellen besitzen auch einzelne Zilien, wenn auch kürzer als die der Knoten Zellen. Die notochordal Platte bildet die Chorda fungiert als wichtige Signalisierung Veranstalter für Somitogenesis und neuronale Musterbildung. Da die Zellen des Knotens und notochordal Platte befinden sich vorübergehend auf der Oberfläche und Cilien besitzen, können sie mit Rasterelektronenmikroskopie (SEM) visualisiert werden. Unter anderen Techniken zur Visualisierung verwendet diese Strukturen auf zellulärer Ebene ist ganze Berg Immunfluoreszenz (WMIF) mit Hilfe der Antikörper gegen die Proteine, die hoch in den Knoten und notochordal Platte zum Ausdruck kommen. In diesem Bericht beschreiben wir unsere optimierte Protokolle um SEM und WMIF des Knotens und notochordal Platte in Entwicklungsländern Mäuseembryonen, helfen bei der Beurteilung der Gewebe Form und zelluläre Organisation in Wildtyp und Gastrulation mutierten Embryonen durchzuführen.
Einleitung
Gastrulation und die begleitenden morphogenetischen Bewegungen sind entscheidend für die Gestaltung der Maus-Embryo-1. Die Veränderungen in der zellulären Form und Organisation während der Morphogenese diktieren Positionsinformationen zu regulieren Zelle Schicksal und erlauben auch die anschließenden Signalwege genau ihre Aufgaben der neu gegründeten Mikrobeschichten1zu diversifizieren. Die Bildung der Transienten Organisation Strukturen und Signalisierung Zentren wie die Knoten und die Chorda ist essentiell für die Ausführung von Entwicklungs Programm2. Entwicklungs Biologen haben eine Vielzahl von Techniken verwendet, um die Morphogenese dieser Strukturen, am bemerkenswertesten ist die Verwendung von zellulären Reporter und live- ex-Vivo imaging, die Dynamik zellulärer und subzellulärer Verhalten2 Folgen zu studieren ,3,4. In diesem Bericht konzentrieren wir uns auf die Details unserer optimierte Protokolle für zwei dieser Techniken zu beschreiben: Scannen von Rasterelektronenmikroskopie (SEM) und ganze Berg Immunfluoreszenz (WMIF), die waren und sind immer noch maßgeblich bei der Untersuchung der Morphogenese des Knotens und die notochordal Platte, die Vorläufer der Chorda.
Der embryonalen Maus-Knoten ist eine tropfenförmige Tasse von Zellen, die auf der ventralen Oberfläche des Mausembryos in den frühen bis späten Kopf Falte Phasen während der Gastrulation und Morphogenese (embryonale Tag, E7.5-E8) befindet2,5, 6,7. Die notochordal Platte entspringt morphologisch anterior Knoten3. Jede Zelle in den Knoten und notochordal Platte zeichnet sich durch einen einzigen Zilie, die nach außen ragt, die länger in Knoten Zellen aber deren Länge variiert mit der Entwicklungsstufe2. Die Rotation der Flimmerhärchen in der Knoten-Grube hat sich gezeigt, wichtig für die Signalisierung, die links-rechts-Asymmetrie4bestimmt. Die notochordal Platte ist der Vorläufer der Chorda, die Signalisierung Zentrum, das für die Strukturierung von der angrenzenden Somiten und die darüberliegenden Neuralrohr3wichtig.
Wegen der Eigenschaften der Lage (Oberfläche), Form (Pokal) und besitzen unterschiedliche äußere Zellstrukturen (Zilien) wurde SEM traditionell verwendet, um Knoten und notochordal Platte zu visualisieren und studieren ihre Entstehung und Struktur2, 7. SEM wird auch verwendet, um die Veränderungen in der Struktur der Knoten selbst oder die Cilien auf seine Zellen in Mutationen, die Gastrulation, Morphogenese sowie Zilien Bildung8,9,10betreffen zu studieren. SEM ist eine Technik, die einen fokussierten Strahl von Elektronen, die topologische Ultrastruktur der äußeren Oberfläche der Materialien wie biologischer Präparate11Verhören nutzt. Die Probe ist in der Regel fest, getrocknet und dann Sputter-beschichtet mit Metallen für die Beobachtung unter dem Rasterelektronenmikroskop wie in Schritt 1 beschrieben.
WMIF ist eine Färbung Technik, Gen-Produkte, wie zum Beispiel Proteine, dreidimensionalen (3D) zu visualisieren. WMIF von Gewebe, Organen oder sogar ganze Organismen bietet räumliche Informationen über die Verteilung des Signals und die Form der daraus resultierenden Struktur in 3D. Die Technik basiert auf die Festsetzung der Probe, die sie dann mit fluoreszierenden Konjugate beflecken. Maus-Embryonen ~ E7.5 sind klein und transparent und daher ideal für WMIF Protokolle, Knoten und notochordal Platte zu visualisieren. Beispielsweise der Transkriptionsfaktor, die Barchyury (T) zum Ausdruck kommt, in den Kernen des Knotens und notochordal Platte und in geringerem Maße in der primitive Streak, um E7.5-E8 der Embryonalentwicklung und gut funktionierende Antikörper gegen T von WMIF sind im Handel zur Verfügung und ermöglichen das Färbeverfahren. Die Zellen des Knotens und notochordal Platte zeichnen sich auch durch verengte apikalen Oberflächen, die außen stehen und somit kann auch gebeizt mit Fluoreszenz-konjugiert Phalloidin, Mark F-Aktin an der apikalen Verengungen. Unter Verwendung dieser Reagenzien als Beispiele, bietet die Kombination aus T und F-Aktin Färbung von WMIF eine Darstellung des Knotens und notochordal Platte in 3D in gastrulating Mäuseembryonen, wie wir in Schritt2 8zeigen. Jedoch können Marker der Zilien, wie ARL13B oder Schimmelpilzschäden Tubulin sowie anderen Markern des Knotens und notochordal Platte, z. B. FOXA2, auch durchführen WMIF auf entwickelnden Maus Embryonen3,4verwendet werden.
Wir haben gezeigt, dass striatin-Interaktion Protein 1 (STRIP1) für normale Gastrulation und Morphogenese in der Maus Embryo8unerlässlich. STRIP1 ist eine Kernkomponente des striatin-Interaktion Phosphatasen und Kinasen-komplexe (STRIPAK), die wir und andere in den Aktin-Zytoskelett Organisation8,12in Verbindung gebracht haben. Ein schwerwiegenden Mangel in Strip1 mutierten Embryonen ist bei der Bildung der axialen Mesoderm (Knoten und notochordal Platte) und Erweiterung der Antero-posterioren Körperachse. Wir haben SEM und WMIF verwendet, um den Knoten und notochordal Platte im Wildtyp (WT) und Strip1 mutierten Embryonen zu analysieren, wie wir in die Vertreter Ergebnisse und Vergleichszahlen zeigen.
Protokoll
Alle Experimente tierexperimentelle stimmten mit den zuständigen Behörden in Nord-Rhein-Westfalen (LANUV-NRW).
(1) Rasterelektronenmikroskopie des Knotens embryonalen Maus
- Opfern die schwangere weiblichen Maus an ~ E7.5 (2-4 Somiten Stufe) durch zervikale Dislokation. Eine ausführliche Erläuterung mit Diagrammen der Schritte 1.1 - 1.7 gibt es in Maus-Embryo-Labor-Handbücher-13.
- Öffnen Sie den Bauch durch die Haut und Mesenterien und Entfernen der Gebärmutter mit Schere und feine Pinzette.
- Spülen Sie die Gebärmutter kurz in destilliertem Wasser und legen Sie sie in einer kleinen sauberen Petrischale (6 cm) mit 1 x Phosphat-gepufferte Kochsalzlösung (PBS).
- Entfernen Sie unter einem Mikroskop sezieren und mit feinen Pinzette die uterinen Muskeln um die einzelnen Deciduae oder Implantation Websites freizugeben.
- Halten Sie jedes Decidua mit ein paar Zangen und das andere Paar eine longitudinale voll dicke Einschnitt zwischen den roten Teil (zukünftige Plazenta) und weißen Teil (wo sich der Embryo befindet). Oberflächliche Perforationen vertikal entlang den weißen Teil der Dezidua zusammenhängend mit der Schnitt zu machen. Auseinanderziehen Sie der Dezidua horizontal in zwei Hälften und der Embryo in den weißen Teil der Dezidua aushöhlen Sie vorsichtig.
- Übertragen Sie den Embryo auf eine neue Petrischale (35 mm) mit frischen steril filtriert PBS. Wiederholen Sie für alle Deciduae/Embryonen.
- Reicherts Membran zu entfernen, eine relativ undurchsichtig Membran Verschlingung des Embryos, von jedem Embryo durch Hänseleien es entfernt wie eine Socke Ectoplacental Kegel (rötliche Implantationsort) ab. Für die Genotypisierung, nehmen Sie ein kleines Stück (~ 0,1 mm2) von dem Dottersack in diesem Stadium.
- Übertragen Sie unter einer chemischen Kapuze und angemessenen Schutz (Handschuhe) tragen die Embryonen auf EM Grade Fixiermittel bestehend aus 2,5 % Glutaraldehyd in steril filtriert PBS in einem Microcentrifuge (1,5 mL) Rohr bei Raumtemperatur. Beheben Sie die Embryonen über Nacht bei 4 ° C.
- Sorgfältig entfernen Sie das Glutaraldehyd Fixiermittel aus der Tube ohne Berührung der Embryonen und in einem richtigen Abfallbehälter entsorgen. Waschen Sie die Embryonen dreimal in steril filtriert PBS für 15 min bei Raumtemperatur.
- Die Embryonen in einem Ethanol-Serie für 5 min zu entwässern: 50 %, 70 % und 85 % dreimal in 100 % oder absoluten Ethanol. Speichern Sie die Embryonen bei −20 ° C in Ethanol oder direkt mit dem nächsten Schritt fortfahren.
- Transferieren Sie die Embryonen in Ethanol, Körbe für den kritischen Punkt (CPD) in einer kritischen Punkt Trockner Maschine trocknen. Füllen Sie die Kammer mit Ethanol auf die Körbe vollständig zu bedecken.
- Tauschen Sie das Ethanol durch sorgfältig spülen mit flüssigem CO2 für zehn Mal bei 10 ° C. Lassen Sie flüssiges CO2 nach dem letzten Schritt ab, bis die Kammer halb voll ist. Erhitzen Sie bis zu 40 ° C, bis der Druck 80 bar (der kritische Punkt erreicht) und das flüssige CO2 auf Gas ändert. 10 min warten und dann langsam das Gas über ca. 45 min Abblasen.
- Als einfachere Alternative zu CPD zum Trocknen hinzufügen der Embryonen in Ethanol für 30 min Hexamethyldisilazane (HMDS) in einem Verhältnis von 1:1. Dann transfer der Embryonen zum reinen HMDS für 30 min. entfernen die Embryonen aus der Flüssigkeit mit einer Pipette und lassen Sie diese für 30 min trocknen.
Hinweis: Beide Trocknungsmethoden arbeitete ebenso gut in unseren Händen. - Verwenden Sie einen feinen Pinsel die getrockneten Embryonen mit der Bauchseite (Knoten), an ein SEM-Stub mit doppelseitigem Klebeband befestigen.
- Legen Sie die Stubs mit den Embryonen in ein Sputter-Beschichtungsanlage für gold Teilchen Beschichtung, die bevorzugt wird, die langen, dünnen Cilien zu berechnen. Tragen Sie eine Schicht von 120-150 Å; die Zeit ist abhängig von der Strom, der mit jeder Probe variieren.
- Legen Sie die beschichteten Stubs mit Embryonen in einem SEM-Mikroskop, Vakuum anzuwenden und beobachten die embryonalen Knoten und notochordal Platte Zellen mit Zilien bei Vergrößerungen von 1000 X bis hin zu 15, 000 X.
2. ganze Mount Immunfluoreszenz der Maus Knoten und Notochordal Platte
- Mit eiskaltem PBS mit 0,05 % Tween 20 (PBSTw), führen Sie die Schritte oben 1,1-1,7 zu entfernen die Embryonen im E7.75 und legen Sie sie in PBSTw in einem 35 mm Petrischale auf Eis.
- Übertragen Sie unter einer chemischen Kapuze und angemessenen Schutz (Handschuhe) tragen die Embryonen auf eine Fixativ Lösung von 4 % Paraformaldehyd mit PBS-Puffer in einem Microcentrifuge Schlauch. Beheben Sie die Embryonen über Nacht bei 4 ° C.
- Sorgfältig entfernen Sie Paraformaldehyd Fixiermittel aus der Tube ohne Berührung der Embryonen und in einem richtigen Abfallbehälter entsorgen. Waschen Sie die Embryonen dreimal mit PBS-Puffer mit 0,2 % Triton x-100 (PBSTr) für 5 min bei Raumtemperatur. Führen Sie die Wasch- und nächsten Inkubationsschritte auf Nutating Shaker.
- Entfernen der letzten Wäsche und blockierende Lösung mit PBSTr mit 10 % Hitze-inaktivierten Serum (aus der Wirtsarten des sekundären Antikörpers). Block von 2 h zu Nacht (oder länger) auf ein Nutator bei 4 ° C.
- Entfernen Sie die Blockierung und fügen ~ 1 mL des primären Antikörpers in blocking-Lösung, zum Beispiel ein Anti-T-Antikörper bei Verdünnung 1: 500 verdünnt. Inkubieren Sie über Nacht (oder mehr) auf einen Nutator bei 4 ° c
- Entfernen Sie den primären Antikörper und durch Zugabe von Natriumazid, eine Endkonzentration von 0,02 % (20 % Aktien zu 1 mL der Antikörperlösung 1 µL) für die spätere Verwendung zu speichern. Der Antikörper kann wiederverwendet werden ~ 10 Mal. Spülen Sie die Embryonen zweimal mit PBSTr und waschen Sie sie dann drei Mal für 30 min auf eine Nutator bei 4 ° C.
- Ersetzen die Wäsche mit einem Fluoreszenz-konjugierten Sekundärantikörper gegen den Primärantikörper Wirtsarten, verdünnt ~ 1: 1000 Nacht (oder länger) auf ein Nutator bei 4 ° C.
- Entfernen Sie den sekundären Antikörper und zweimal mit PBSTr, dann waschen dreimal für 30 min mit PBSTr spülen.
- Ersetzen Sie die letzten Waschen mit PBSTr mit 1: 500 Fluoreszenz konjugiert Phalloidin, F-Aktin und 1: 1000 DAPI, um Kerne für 1 h bei Raumtemperatur Fleck Fleck.
- In PBSTr zweimal spülen Sie und waschen Sie einmal mit PBSTr für 30 min bei Raumtemperatur.
- Ersetzen Sie PBSTr durch PBS und lassen Sie die Embryonen auf Eis. Bereiten Sie sauber positiv geladenen Folien (60 x 24 mm) und Deckgläsern (24 x 24 mm) und wässrigen Glycerin-basierte Montage Medien, z. B. 90 % Glycerin in 1xPBS und ein antifade Reagenz, die Embryonen zu montieren.
- Setzen Sie zwei Stücke von durchsichtigem Klebeband in einer Entfernung von ~ 15 mm voneinander entfernt auf den klaren Teil der Folie. Dadurch wird genügend 3D-Raum (in der Z-Dimension) erstellt, die es ermöglichen würde, Abflachung der Embryonen, aber nicht vollständig zerquetschen sie.
- Unter dem sezierenden Mikroskop bewegen vorsichtig die Embryonen mit einer geschnittenen P200-Pipette (damit genug Platz für den Embryo übertragen und nicht beschädigt werden kann) auf die Folie.
- Mit feinen Pinzette, kürzen Sie zwei voll auf die Seitenflächen der Dottersack, den Embryo zu entfalten. Legen Sie den Embryo mit der Bauchseite (Knoten und notochordal Platte) bis (dorsal des Neuralrohrs unten auf der Folie).
- Fügen Sie 50 µL Medien auf den Embryo zu montieren. Platz 4-5 Embryonen pro Folie. Hinzufügen eines Dab-Montage Medien zum Rand des Deckglases, die zuerst berühren die Folie (obere oder untere Seite), dann legen Sie es zwischen die beiden Teile des Bandes und senken es langsam auf die Embryonen mit einer feinen Pinzette oder einer gebogenen feinen Nadel unter Vermeidung von Luftblasen zu schaffen.
- Mit einem saugfähigen Tuch reinigen Sie die überschüssige Montage-Medien. Achten Sie darauf, dass Sie nicht das Deckglas dabei zu bewegen.
- Verwenden eine großzügige Menge von Nagellack, versiegeln Sie die Seiten des dem Deckglas ohne es zu bewegen.
- Unter einem Scan confocal Mikroskop beobachten.
Ergebnisse
Um zu untersuchen, die Entstehung des Knotens im WT und Strip1 mutierten Embryonen im ~ E7.5, verwendeten wir SEM wie in Schritt 1 beschrieben und in Abbildung 18gezeigt. Die Ultrastrukturforschung Details der externen Topologie mit SEM waren sehr informativ und es war sofort klar, dass im Gegensatz zu der Grube-förmigen Knoten im WT Embryonen, die mutierten Embryonen einen abgeflachten und unregelmäßigen Knoten. Höherer Vergrößerung des Embryos zeigte die charakteristischen Cilien auf Knoten-Zellen, die sie eindeutig identifiziert. Deutliche geringere Dichte von Zilien in das mutierte möglicherweise zum Verlust der Grube Knotenstruktur und Krümmung oder eine geringere Anzahl an Knoten Zellen zurückzuführen. Die notochordal Platte erscheinenden ausgehend vom Knoten war auch unregelmäßig in der mutierten Embryonen. Sie waren mit ihren kürzeren Zilien identifizierbar. SEM war daher wichtig, die Strip1 Mutanten8Knoten Morphogenese Mängel offenbaren. Wir haben auch SEM in früheren Studien verwendet, um das Fehlen der Zilien im embryonalen Knoten von Mutanten zeigen, die Centriolen, fehlte die Cilien9die Vorlage vorsehen.
Um die axiale Mesoderm Bildung Mängel in Strip1 mutierten Embryonen auf zellulärer Ebene zu untersuchen, haben wir WMIF verwendet, wie in Schritt2 beschrieben und in Abbildung 2dargestellt. Mit dieser Technik wurden die Knoten und notochordal Platte leicht an F-Aktin und T Färbung erkennen. WT-Knoten und notochordal Platte Zellen haben apikale Domänen eingeengt, wo F-Aktin wurde bereichert, und nukleare T Färbung war offensichtlich. Die notochordal Platte Rostral erweitert in der WT aber war kurz und unregelmäßig in den Mutanten. Die Daten zeigten, dass F-Aktin-Organisation in den verschiedenen Schichten der Keim der mutierten Embryonen einschließlich der axialen Mesoderm8abnorm ist. So war WMIF maßgeblich, die Mängel im Knoten und notochordal Platte Bildung in Strip1 mutierten Embryonen zu studieren.
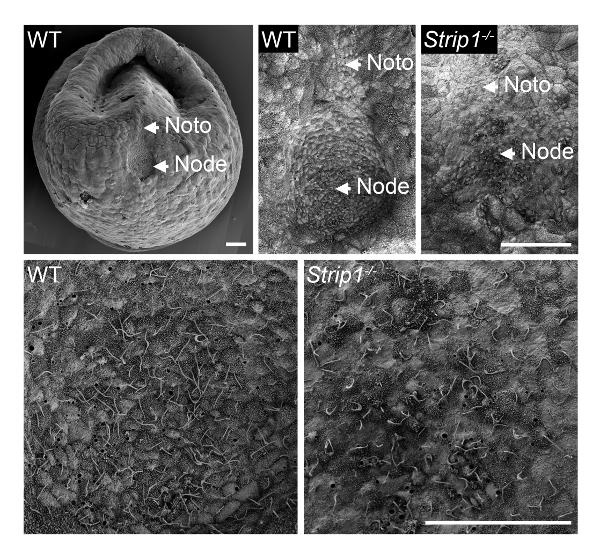
Abbildung 1 . Rasterelektronenmikroskopie zeigt die Mängel im Knoten Morphogenese in Strip1 mutierte Mausembryonen. (Oben) SEM Analysen von WT und Strip1 mutierte ventralen embryonalen Knoten und notochordal Platten (Noto)8. Ein Beispiel für ein geringer Vergrößerung-Bild eines Embryos WT wird auf der linken Seite angezeigt. (Unten) Höheren Vergrößerungen des Zentrums der Knoten gezeigt oben offenbart die langen Verlaufsformen von Knoten Zellen projizieren. Anterior ist in alle Panels. Skalieren Sie Bars: 30 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
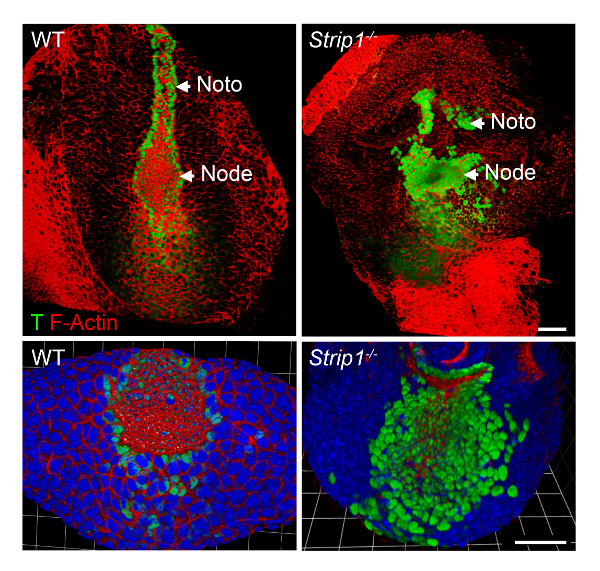
Abbildung 2 . Ganzen Berg Immunfluoreszenz zeigt die abnorme Knoten und notochordal Platte auf zellulärer Ebene in Strip1 mutierten Embryonen. (Oben) Ventralen 3D-Rendering (Volocity Software) WMIF auf WT und Strip1 mutierten Embryonen mit einer Kombination von Fluoreszenz-konjugiert Phalloidin (F-Aktin, rot) und T (grün) Antikörper Färbung. (Unten) Weitere Beispiele für die Färbung oben mit Schwerpunkt auf den Knoten mit höheren Zoom und einschließlich DAPI gezeigt. Anterior ist in alle Panels. Skalieren Sie Bars: 30 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
In dieser Arbeit zeigen wir wie Sie SEM und WMIF um die embryonalen Maus Knoten und notochordal Platte visualisieren durchführen. Die geringe Größe des gastrulating Mausembryonen ~ E7.5 und das Vorhandensein von diesen Strukturen auf der Oberfläche sind sie ideal zu studieren, mit den Techniken beschrieben2,7,8. Die Verfügbarkeit von guten Antikörper, wie T und Zilien Marker gibt ausgezeichnete 3D Informationen über die Struktur, Organisation und Bildung von diesen wesentlichen embryonalen Organisatoren8WMIF.
Weil Maus Embryonalentwicklung in einem sehr schnellen Tempo verläuft und die Knoten und notochordal Platte nur vorübergehend auf der Oberfläche des Embryos vorhanden sind, ist das Timing entscheidend für den Erfolg dieser Experimente2,3. Beispielsweise eignen sich 2-4 Somiten Embryonen für SEM-Analyse einer Reifen Knoten Grube mit langen Cilien. In viel früheren oder späteren Embryonen (z. B. 12 h vor oder nach) kann der Knoten nicht auf der Oberfläche vorliegen. WMIF ist in dieser Hinsicht ein wenig flexibler aber die Strukturen selbst sind auch vorübergehend während der Entwicklung und das Timing hängt in diesem Fall die Forscher Interessen.
Die Reinheit der Reagenzien ist auch entscheidend für den Erfolg dieser Techniken, vor allem in sondieren die Ultrastruktur von SEM Tiny Verunreinigungen, die in der Regel mit den Embryonen bleiben führen Sie riesige Artefakte.
Wir haben zwei verschiedene Methoden der Embryo Fixierung für SEM eines getestet mit halben Karnovsky Fixiermittel (2,5 % Glutaraldehyd, 2 % Paraformaldehyd und 0,1 M Cacodylate-Puffer) und ein einfacher 2,5 % Glutaraldehyd in 1 X PBS. Wir bevorzugen die Glutaraldehyd und PBS Fixiermittel wie in Schritt 1 beschrieben, jedoch wir und andere haben auch die halbe Karnovsky Fixiermittel erfolgreich eingesetzt für SEM
Wir haben auch zwei Methoden der Trocknung der Embryos für SEM verglichen und fanden keinen Unterschied in der Qualität der Probe entweder mithilfe einer kritischen Punkt Trockner oder HMD wie in Schritt 1 beschrieben und berichtet an anderer Stelle14.
Für Schritt2, wir testeten Einbettung der Embryonen nach der endgültigen Waschschritten in 1 % niedrig schmelzende Agarose auf eine 35 mm Glasboden Schüssel montiert und dann Richtfest es mit ~ 10 µL Eindeckmedium. Diese Einbettung Methode funktioniert und bewahrt die ursprüngliche 3D-Struktur des Embryos und zugehörigen Strukturen; multiphoton Mikroskop ist jedoch erforderlich, um die Probe Bild, da eine regelmäßige confocal Mikroskop nicht so tief in die intakten Embryonen erreichen kann (~ 1 mm).
Wir glauben, dass mit diesen beiden Techniken gibt ergänzende Informationen über die Struktur des Knotens und der notochordal Platte während der normalen Entwicklung und Mutanten die Mängel bei der Bildung dieser Strukturen zeigen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
H.B wird unterstützt durch die Start-up Finanzierung von der medizinischen Fakultät und SFB829 von der Universität zu Köln. C.X wird von der DFG unterstützt BA 5810/1-1 zu gewähren. Wir möchte die Imaging-Einrichtungen am CECAD Forschungszentrum und Memorial Sloan Kettering Cancer Center (New York, USA). Wir danken für seine Einsicht bei der Montage der Embryos für WMIF Joaquín Grego-Bessa (Spanisch National Center for Cardiovascular Research, Madrid, Spanien).
Materialien
| Name | Company | Catalog Number | Comments |
| 1,1,1,3,3,3 Hexamethyldisilazane (HMDS) | Carl Roth | 3840 | |
| Anti-T antibody | R&D Systems | AF2058 | |
| Critical Point Dryer | Blazers Union | CPD 020 | |
| DAPI | AppliChem | A4099,0005 | |
| Glutardialdehyde solution 25% | Merck | 1042390250 | |
| Triton X-100 | Sigma Aldrich | X100-100ML | |
| Tween 20 | AppliChem | A4974,0500 | |
| SEM coating unit PS3 | Agar Aids for Electron Microscopy | PS3 | |
| SEM microscope Quantum FEG 250 | ThermoFisher Scientific (FEI) | Quantum FEG 250 |
Referenzen
- Rivera-Pérez, J. A., Hadjantonakis, A. K. The dynamics of morphogenesis in the early mouse embryo. Cold Spring Harbor Perspectives in Biology. , (2015).
- Lee, J. D., Anderson, K. V. Morphogenesis of the node and notochord: The cellular basis for the establishment and maintenance of left-right asymmetry in the mouse. Developmental Dynamics. 237 (12), 3464-3476 (2008).
- Balmer, S., Nowotschin, S., Hadjantonakis, A. K. Notochord morphogenesis in mice: Current understanding and open questions. Developmental Dynamics. 245 (5), 547-557 (2016).
- Yoshiba, S., et al. Cilia at the node of mouse embryos sense fluid flow for left-right determination via Pkd2. Science. , (2012).
- Jurand, A. Some aspects of the development of the notochord in mouse embryos. Journal of Embryology and Experimental Morpholog. 32 (1), 1-33 (1974).
- Poelmann, R. E. The head-process and the formation of the definitive endoderm in the mouse embryo. Anatomy and Embryology (Berl). , 41-49 (1981).
- Sulik, K., et al. Morphogenesis of the murine node and notochordal plate. Developmental Dynamics. 201 (3), 260-278 (1994).
- Bazzi, H., Soroka, E., Alcorn, H. L., Anderson, K. V. STRIP1, a core component of STRIPAK complexes, is essential for normal mesoderm migration in the mouse embryo. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 10928-10936 (2017).
- Bazzi, H., Anderson, K. V. Acentriolar mitosis activates a p53-dependent apoptosis pathway in the mouse embryo. Proceedings of the National Academy of Sciences of the United States of America. 111 (15), 1491-1500 (2014).
- Huangfu, D., Liu, A., Rakeman, A. S., Murcia, N. S., Niswander, L., Anderson, K. V. Hedgehog signalling in the mouse requires intraflagellar transport proteins. Nature. 426 (6962), 83-87 (2003).
- McMullan, D. Scanning electron microscopy 1928-1965. Scanning. 17 (3), 175-185 (2006).
- Bai, S. W., et al. Identification and characterization of a set of conserved and new regulators of cytoskeletal organization, cell morphology and migration. BMC Biology. 9, (2011).
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual, Fourth Edition. Cold Harb Lab Press. , (2014).
- Braet, F., De Zanger, R., Wisse, E. Drying cells for SEM, AFM and TEM by hexamethyldisilazane: a study on hepatic endothelial cells. Journal of Microscopy. 186, 84-87 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten