Method Article
Generation von menschlichen 3D Lungengewebe Kulturen (3D-LTCs) für Krankheit Modellierung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll für die Vorbereitung der Agarose-gefüllte menschlichen präzise geschliffenen Lunge Scheiben aus resezierten Patienten Gewebe, die für die Erzeugung von 3D Lunge Gewebekulturen, Modell menschlichen Lungenerkrankungen in biologischen und biomedizinischen Studien eignen.
Zusammenfassung
Übersetzung der neuartigen Entdeckungen menschlicher Erkrankungen wird durch die Verfügbarkeit von menschlichen Gewebe-basierte Modelle der Krankheit begrenzt. Präzise geschliffenen Lunge Scheiben (PCLS) verwendet, da 3D Lunge Gewebekulturen (3D-LTCs) ein elegantes darstellen und biologisch hochrelevant 3D Kultur Zellmodell, die stark ähneln in-situ Gewebe aufgrund ihrer Komplexität, Biomechanik und molekulare Zusammensetzung. Gewebe zu schneiden ist in verschiedenen Tiermodellen eingesetzt. 3D-LTCs abgeleitet von menschlichen PCLS können verwendet werden, um Antworten auf neue Medikamente, zu analysieren, die weiter, zum besseren Verständnis der Mechanismen und funktionellen Auswirkungen von Drogen im menschlichen Gewebe helfen könnte. Die Vorbereitung des PCLS von chirurgisch reseziertem Lunge Gewebeproben von Patienten, die Lunge Lobektomie erlebt, erhöht die Zugänglichkeit der erkrankten und peritumorale Gewebe. Hier beschreiben wir ein detailliertes Protokoll für die Erzeugung von menschlichen PCLS von chirurgisch reseziertem weich-elastisch Patienten Lungengewebe. Agarose wurde in den alvéolaire Raum der Resectates eingeführt, so Lunge Struktur erhalten und steigern das Gewebe Steifigkeit, die entscheidend für das spätere schneiden. 500 µm dicke Scheiben wurden aus dem Gewebe-Block mit einem Vibratome vorbereitet. Biopsie-Stanzen entnommen PCLS sorgen für vergleichbare Gewebe Stichprobengrößen und weiter erhöhen Sie die Menge von Gewebeproben. Die generierten Lunge Gewebekulturen können in einer Vielzahl von Studien in der menschlichen Lunge Biologie, einschließlich der Pathophysiologie und Mechanismen von verschiedenen Krankheiten, wie z. B. fibrotischen Prozesse am besten bei (Sub-) zellulären Ebene angewendet werden. Der größten Nutzen von 3D-LTC ex Vivo Modell ist seine enge Darstellung der in-situ menschlichen Lunge in Bezug auf 3D Gewebearchitektur, Zelle Typenvielfalt und Lunge Anatomie sowie das Potenzial für die Beurteilung des Gewebes von einzelnen Patienten, die ist relevant für die weitere Entwicklung neuer Strategien für Präzisionsmedizin.
Einleitung
Akuten und chronischen Lungenerkrankungen sind eine der Hauptursachen für Morbidität und Mortalität weltweit1. Für Patienten mit chronischen Lungenerkrankungen wie obstruktiver Lungenerkrankung (COPD)2, schwerem Asthma3, Lunge Krebs4 und diffuse parenchymal Lung Krankheiten5sind kurative Therapien derzeit nicht verfügbar. Obwohl Studien in Tiermodellen für Lungenerkrankungen sich das Verständnis der Krankheit Pathomechanismen6 vertieft haben und zur Identifizierung von potenziellen neue therapeutische Targets7,8,9 führten, Diese Modelle weisen relevanten biologischen und physiologischen Unterschiede im Vergleich zu Menschen10. Um diese Diskrepanzen zwischen den murinen und menschliche Biologie und Anatomie, menschliche ex Vivo 3D Lunge Gewebekultur überwunden werden (3D-LTC) Systeme in verschiedenen Bereichen der biomedizinischen Forschung eingesetzt. Diese 3D-LTC-Kultur-Systeme basieren auf Precision-Cut Lung Slices (PCLS). Die Generation der PCLS ex Vivo ermöglicht die Analyse der eine dritte räumliche Dimensionalität, die für die Untersuchung der räumlichen und funktionalen Beziehungen der Zellen im gesamten Alveolen und Airways11, sowie das Interstitium, Gefäßsystem ermöglicht und Mesothel. Insbesondere sind PCLS ex-Vivo-Modelle mehrzelligen, was bedeutet, dass sie funktionellste Zellen in-situ Lungen enthalten, stellvertretend für die Zellen native biologischen Umgebung eng und damit Überwindung der begrenzten Zell-Zell und der Zellmatrix Interaktion in den meisten 2D Zellkultur nähert. Bis jetzt ex Vivo murinen PCLS dienten, Lungenerkrankungen, wie COPD12, Lungen-Fibrose-13, Lunge Krebs14, Virusinfektion15,16, bronchopulmonale Dysplasie17, zu modellieren und Asthma-18. Jedoch ein erheblicher Teil der neuartige medikamentöse Therapien bei menschlichen Lungenerkrankungen, die in klinischen Studien untersucht wurden nicht übersetzen in die Klinik aufgrund ihrer mangelnden Wirksamkeit oder Sicherheit, assumingly wegen noch erhebliche Unterschiede zwischen Mensch und murine Biologie und Krankheit19,20,21.
Über mehrere Jahre hinweg wurden menschliche PCLS weitgehend zur Lunge Toxizität von Chemikalien und Drogen zu beurteilen. Erst vor kurzem wurde menschliche Lungengewebe von Patienten mit COPD22,23, Asthma24und Lunge Fibrose25, zur pathophysiologische und pharmakologische Studien nachzugehen. Durch Verwendung resezierten Patienten Orgel Materialien und generieren PCLS davon, kann eine schwere Erkrankung Markenzeichen in einem komplexen 3D Gewebe Umwelt22 Vertretung und Wahrung der native zellulären Vielfalt der Orgel zu rekapitulieren. Darüber hinaus zeigte sich erkranktes Gewebe angewendet in einer Vielzahl von Versuchsaufbauten, Krankheit-ähnliche Veränderungen in Leber, Darm und Nieren26,27,28,29zu imitieren.
Verarbeitung von Lungengewebe bleibt jedoch aus mehreren Gründen schwierig. Im Gegensatz zu festen Gewebe native Lungenparenchym tendenziell ohne Lüftung zusammenbrechen und unteren Gewebe Steifigkeit aufweist. Diese Eigenschaften erschweren die Schneiden des Gewebes. So Füllung der Atemwege und der alveoläre Raum mit niedrigschmelzenden Punkt Agarose bewahrt die native Lunge-Struktur und die Steifigkeit für präzise geschliffenen Schneiden von murinen und menschliche Lunge30benötigt. Menschlichen Lunge Resectates für Forschungszwecke gespendet sind von Natur aus anatomisch, genetisch und physiologisch sehr vielfältig, so oft präsentiert eine hohe Variabilität auf Inter Patienten bei der Durchführung von Experimenten25. Im Gegensatz zu den ganzen Lappen oder ganze Lunge Explantaten Lunge Proben mittels Thoraxchirurgie reseziert nicht unbedingt folgen die anatomische Segmente und erfordern daher besondere Vorbereitung. In diesem Artikel stellen wir eine detaillierte und optimierte Protokoll für die Erzeugung von menschlichen PCLS von resezierten Lungengewebe und ihren späteren Anbau und Versuchszwecke zu Modell Lungenerkrankung.
Protokoll
Die Verwendung von menschlichem Gewebe wurde von der Ethik-Kommission der Ludwig-Maximilian-Universität [München (Projekt Nr. 455-12)] genehmigt. Tumor-freien menschlichen Lunge Resektionen lieferten die Asklepios Biobank für Lungenerkrankungen (Gauting, Deutschland, Projektnummer 333-10).
Hinweis: Alle Verfahren der menschlichen PCLS Produktion (Abbildung 1) sind unter einer sterilen Laminar-Flow-Haube durchgeführt.
1. Vorbereitung von Instrumenten und Materialien
-
Bereiten Sie alle Materialien für die Inflation des Lungengewebes mit Agarose wie unten beschrieben.
- Bereiten Sie das Anbau-Medium: Dulbeccos geändert Eagle Medium (DMEM) f-12 ergänzt mit L-Glutamin, HEPES, 10.000 IE Penicillin, 10.000 IE Streptomycin und fötalen Rinderserum 0,1 % (V/V).
Hinweis: Medium dient bei 37 ° C. - Bereiten Sie einen sterilen Metalltablett mit Seidenpapier bedeckt. Legen Sie eine sterile 15 cm Zelle Kulturschale in das Fach.
- Die 15 mL Anbau Medium der Zelle Kulturschale einfüllen.
- Bereiten Sie eine 3 % (w/V) Agarose-Lösung durch die entsprechende Menge an niedrig schmelzende Punkt Agarose in einem Minimum von 30 mL Anbau Medium auflösen.
- Erhitzen Sie die Lösung in einer Mikrowelle zum Kochen bringen. Die Agarose-Lösung auf 42 ° C im Wasserbad abkühlen. Halten Sie die flüssige Agarose-Lösung im Wasserbad gespeichert.
- Bereiten Sie mehrere 50 mL konische Röhrchen gefüllt mit flüssige Agarose.
- Bereiten Sie das Anbau-Medium: Dulbeccos geändert Eagle Medium (DMEM) f-12 ergänzt mit L-Glutamin, HEPES, 10.000 IE Penicillin, 10.000 IE Streptomycin und fötalen Rinderserum 0,1 % (V/V).
(2) resezierten Lungengewebe
- Shop frische freie Lunge Tumorgewebe der Lobektomie Resectates sofort nach der Resektion in DMEM F-12 Medium bei 4 ° C bis zu Schritt 3.
- Überschreiten Sie kalten Ischämie-Zeit von 4-8 h vor der Verarbeitung nicht.
3. Prüfung und Auswahl des resezierten Gewebes vor der Agarose Befüllung
- Heben Sie das Gewebe aus dem Medium mit einer Pinzette. Zur Vermeidung von Schäden an Gewebe, insbesondere um die Pleura behandeln Sie das Gewebe mit einer Pinzette in die Atemwege nur.
- Ergebnis der Gewebe-Qualität durch Kriterien der Lunge Agarose füllen Partitur in Tabelle 1definiert.
- Fahren Sie mit Schritt 4 fort, wenn das Gewebe Qualität über oder gleich 72 erzielt wird. Wenn das Gewebe Qualität unter 60 erzielt wird, nicht weiter mit Agarose füllen.
Hinweis: Wenn das Gewebe Ergebnis zwischen 60 und 68, die Agarose-Füllung und Gewebe schneiden noch vernünftige Ergebnisse produzieren könnte, und eine endgültige Entscheidung für eine Verlängerung des Experiments hat zu Fall zu Fall getroffen werden. Jedoch Lungengewebe, die nicht die oben genannten Anforderungen erfüllt haben meist nicht in Agarose füllen.
(4) Lunge Gewebe Inflation durch Agarose-Füllung
- Heben Sie das Gewebe vom Speichermedium und abtropfen Sie überschüssige Medien aus dem Gewebe. Übertragen Sie das Lungengewebe in der 15 cm Kulturschale in 1.1.2 vorbereitet.
- Füllen Sie eine 30 mL-Spritze mit niedrigschmelzenden Punkt Agarose aus 1.1.3.
- Bereiten Sie einen peripheren Venenkatheter durch Entfernen der Obturator und verbinden Sie es mit einer 30 mL Spritze
- Identifizieren eines Bronchus (0,5-3 mm im Durchmesser) in das Gewebe, das einen intakten Abschnitt des Gewebes zu lüften ist (siehe Abbildung 2).
- Stecken Sie die Kanüle in den ausgewählten Bronchus (0,5-3 mm Durchmesser).
- Schieben Sie die Kanüle leicht nach vorne so weit wie möglich.
- Versiegeln der Bronchus um die Kanüle durch das Komprimieren der Bronchialwand um die Kanüle mit der Pinzette, idealerweise spannen alle angrenzenden Lungenarterie zur gleichen Zeit.
- Verdecken Sie andere zusätzliche Airways mit einer chirurgische Klammer Agarose undicht durch diese Atemwege zu verhindern.
- Heben Sie das Gewebe mit der Zange aus der Kulturschale.
- Gießen Sie manuell die Agarose mit der Spritze nicht schneller als 0,3 mL/s. Die Geschwindigkeit der Agarose Füllung variieren von ca. 0,05 bis 0,3 mL/s aufgrund der heterogenen Widerstand der Atemwege und/oder Atelektase.
-
Wenn hohe Widerstand während der Befüllung oder Agarose Austritt aus dem Gewebe zu beobachten ist, wiederholen Sie das ganze Verfahren mit unterschiedlichen Bronchus aus Schritt 4.4. Problembehandlung, wie unten beschrieben.
Hinweis: Der Grad der Agarose Füllung ist stark abhängig von der Lage des Katheters im Gewebe und tiefes Eindringen der Katheter Ergebnisse in Agarose Füllung der kleine Kegel wie Regionen (*) des Lungengewebes (Abbildung 2).- Versuchen Sie bei hohem Widerstand Positionierung des Katheters führt zu richtigen Füllung aus den meisten Regionen des Gewebes (#) (Bild 2D).
- Als Stecker der frühen erstarrten Agarose in den proximalen Bronchien oder andere Atemwege Hindernisse (Pfeil) können zu einer unvollständigen Füllung des Gewebes (Abbildung 2E) führen, nicht mit Gewalt Agarose zu füllen, da dies zu Defekten in der gefüllten Fläche, aber nicht in einer Füllung aus führen könnte die versperrte Gewebeteile.
- Wenn die Atemwege Baum abgeleitet kanülierte Bronchus während der Resektion und die Agarose Füllung ergibt eine ständige undicht flüssige Agarose (Pfeil in Abbildung 2F) beschädigt ist, legen Sie den Katheter in einen peripheren Teil des Systems der Atemwege Füllen Sie mindestens einen kleineren Teil des Gewebes (*) (Abbildung 2). Darüber hinaus versiegeln Sie die geschädigte peripheren Atemwege mit einer chirurgische Klammer (Pfeil) (Abb. 2 H).
- Gelten Sie Agarose, bis das Lungengewebe vollständig gefüllt ist. Pumpen Sie nicht übermäßig auf das Gewebe da dies irreversible Schäden an der Gewebestruktur und seine Zellen führen kann.
- Klemmen Sie den Bronchus, der für die Füllung verwendet wurde sofort. Entfernen Sie die Kanüle vor dem Spannen.
- Inkubieren Sie das Gewebe in das Kulturmedium bei 4 ° C für 30 min um Agarose erstarren zu gewährleisten.
- Des resezierten Gewebes bronchiale Mehrfacheinträge hat, wiederholen Sie Schritt 4.2 bis 4.13 bis alle Teile des Gewebes mit Agarose gefüllt sind.
- Speichern Sie die Agarose gefüllt Lunge Gewebeschnitte bei 4 ° C kaltes Medium bis zum Schneiden.
(5) präzise geschliffenen Lunge aufschneiden
-
Identifizieren Sie Regionen im Lungengewebe, die fest mit der Agarose gefüllt sind. Solide gefüllte Bereiche werden nicht zusammenbrechen, wenn sie vorsichtig mit einer Pinzette gegen die Unterseite der Zelle Kulturschale gedrückt werden.
- Verbrauchsteuer eine 1-1,5 cm3 Block Regionen beschrieben in 5.1, während einer Seite noch mit Pleura abgedeckt werden sollten.
- Befestigen Sie jeder einzelne Gewebe-Block mit der Pleura Seite Kontakt mit dem Inhaber der Vibratome durch mit einem Cyanacrylat-Klebstoff.
Hinweis: Die Pleura ist leicht elastisch und behindert deshalb das Schneiden mit der Vibratome Klinge. Platziert auf dem Gewebe-Halter, der Pleura beeinträchtigt nicht das Schneiden und, wichtiger ist, bildet eine natürliche Barriere zwischen der Cyanacrylat-Klebstoff und das Gewebe Parenchym ermöglicht minimale Diffusion des Klebers. - Schneiden Sie das Lungengewebe mit der Vibratome mit den folgenden Einstellungen: Stärke: 500 µm, Frequenz: 100 Hz, Amplitude des Messers: 1,2 mm, Vorwärtsgeschwindigkeit der Klinge von 3-12 µm/s, die abhängig von Gewebe Steifigkeit. Reduzieren Sie die Vorwölbung-Geschwindigkeit des Messers, wenn die Scheibe nicht richtig geschnitten wird, oder wenn der Gewebe-Block selbst beginnt zu vibrieren.
- Übertragen Sie die Scheibe vorsichtig anheben mit der Pinzette aus dem Vibratome Fach in einen Brunnen von einem 12-Well-Platte mit Anbau Medium gefüllt Zu guter Letzt inkubieren Sie die Lunge Scheiben in einem Inkubator unter Kulturbedingungen Standardzelle.
- Stop zu schneiden, wenn 2-3 mm Gewebe-Block links Thekenverkauf da der Cyanacrylat-Klebstoff die Gewebe Integrität dieser Region beeinträchtigt.
6. Generation des PCLS Schläge
- Übertragen Sie die Lunge-Scheiben aus einem einzigen Brunnen auf einer leeren 10 cm Schüssel.
- Legen Sie eine 4 mm-Biopsie-Puncher orthogonal auf der Oberseite eine PCLS und beginnen Sie sich zu der Puncher in Drehungen im Uhrzeigersinn und gegen den Uhrzeigersinn bewegen.
- Füllen Sie Zellkulturmedium in die Vertiefungen einer 96-Well-Platte. Heben Sie die Gewebe-Schläge mit der Pinzette und übertragen Sie die Schläge in die Vertiefungen einer 96-Well-Platte zu. Zu guter Letzt inkubieren der Lunge Schläge, eingetaucht in das Medium in 1.1.1 vorbereitet. in einer Zelle Kultur Inkubator unter Standardbedingungen (21 % (V/V) Sauerstoff, Kohlendioxid und 95 % Luftfeuchtigkeit 5 % (V/V), bei 37 ° C).
(7) Gewebekultur und Probe ernten
- Kultur der PCLS und Schläge über Nacht im Brutschrank unter Standardzelle Kulturbedingungen.
- Kultur PCLS und Schläge unter beschriebenen Zustand für bis zu 120 Stunden nach ihrer Generation zellulärer Lebensfähigkeit und Funktion zu gewährleisten.
- Waschen Sie für die Ernte Protein sowie RNA PCLS und Schläge dreimal in Phosphat gepufferte Kochsalzlösung (PBS), in Cryovials überführen Sie und Snap-Einfrieren in flüssigem Stickstoff.
-
Probe mittlere Überstand der kultivierten PCLS schlägt für die Analyse der sekretierten Proteine.
- Histologische Analysen waschen Sie PCLS und Schläge dreimal mit PBS und befestigen Sie sie mit 4 % Paraformaldehyd durch Inkubation für 30 min bei 37 ° C. Schließlich speichern Sie die PCLS mit PBS-Puffer bei 4 ° C für weitere nachgelagerte Färbung.
Ergebnisse
PCLS generation
Die Generation der PCLS kann in vier wesentliche Schritte getrennt werden: chirurgische Lunge Gewebe Resektion, Agarose-Füllung, Vibratome-basierte PCLS Generation und Kultur des PCLS. Die resezierten Lungengewebe ist mit niedrig schmelzende Punkt Agarose, die das Lungengewebe zum schneiden die erforderliche Steifigkeit verleiht und bewahrt die native Lunge Struktur und Architektur gefüllt. Der Hinweis PCLS Generation ist sehr zeitaufwendig, so oft Lagerung über Nacht des gefüllten Lungengewebes in DMEM F-12 Medium lassen sich als einen weiteren Schritt und PCLS Generation ist am nächsten Tag begann. Abhängig von den folgenden Versuchsaufbau können generierte PCLS über Nacht inkubiert werden, im standard Zellkulturmedium mit 0,1 % (w/V) fötalen Rinderserum, bevor die experimentelle Bedingungen angewendet werden. 3D-LTCs wurden praktikable und zelluläre Funktionen (z. B. Surfactant Protein Sekretion) ausgestellt, für bis zu 120 h22 in die Kulturbedingungen in diesem Protokoll (Abbildung 1 skizziert) und möglicherweise auf weitere Verbesserung optimiert werden.
Agarose-Füllung
Für die Agarose Füllung des Gewebes, wurde eine Kanüle einen peripheren Venenkatheter mit 1,3 mm Durchmesser befestigt an der Agarose-gefüllte Spritze in einen Bronchus an der Oberfläche des geschliffenen Gewebes (Abbildung 2A) eingefügt. Bronchien sind oft in der Nähe eine Lungenarterie lokalisiert. Während die Arterien dünnere Wände haben und neigen zu kollabieren, ausgestellt Bronchien eine gut sichtbare Lumen. Abhängig von dem Gewebe Integrität kann der Katheter über mehrere Generationen der Atemwege Baum in die Peripherie der Lunge vorgeschoben werden. Eingedrungene Bronchus wurde rund um die Kanüle mit einer Pinzette (Abb. 2 b) besiegelt. Die Lungenarterie kann gleichzeitig mit der Pinzette geklemmt werden. Danach wird das Gewebe angehoben und flüssige Agarose ist sanft in die Atemwege eingeflößt.
Abhängig von der Position des Katheters kann eine Mehrheit des Gewebes mit flüssige Agarose (Abb. 2D) gefüllt werden. Optional, könnte Kegel wie Teile des Lungengewebes, die Lungenparenchym durch eingedrungene Bronchus belüftet widerspiegeln, mit der Agarose (Abbildung 2) gefüllt werden. In beiden Szenarien ein charakteristisches Muster von fest gefüllten Gewebe Regionen beobachtet werden: Erstens ein Großteil des Gewebes in Keile (Abb. 2D) gefüllt ist, oder Zweitens, kleiner hervorstehende Runde Bereiche gründlich gefüllten Gewebe Regionen erscheinen ( Abbildung 2). Wenn Teile der Atemwege durch Agarose Klumpen oder andere Ursachen behindern, können Teile des Gewebes nicht richtig mit Agarose gefüllt. Somit können nur Teile des Gewebes zum Schneiden anwendbar. Im Falle von Leckagen bei der Agarose füllen Verfahren Teile des Baumes gefüllten Atemwege perforiert bekommen könnte und Füllung des Lungengewebes wird jedoch fast unmöglich, mögliche Problemumgehungen gehören die Füllung über einen peripheren Bronchus, eine tiefere Eindringen der Kanüle in den distalen Atemwegen (Abbildung 2) oder potentielle Klemmung des Bereichs Leckage (Abb. 2 H).
Lung von präzise geschliffenen schneiden
Gewebe Blöcke auf eine Länge und Breite von 1-1,5 cm aus Gewebe Regionen, die erstarrten Agarose ()Abbildung 3Avoll waren herausgeschnitten wurden-3 b). Als nächstes wurden die einzelnen Gewebe Blöcke auf der Gewebe-Inhaber der Vibratome (Abbildung 3) geklebt. 500 µm dicken PCLS generiert wurden, während der Gewebe-Block in der Vibratome nach vorne mit einer Geschwindigkeit zwischen 3 und 12 µm/s. voran war (Abbildung 3D-3F). Schließlich wurden die PCLS untergetaucht im Zellkulturmedium mit 0,1 % (w/V) fötalen Rinderserum und kultiviert bei Standardzelle Kulturbedingungen, skizzierte Schritt 7.
Experimentelle Auslesen des menschlichen 3D-LTC nach 48h der Kultivierung
Abbildung 4A-4 Czeigt eine repräsentative Immunfluoreszenz Färbung, wie oben beschrieben durch Alsafadi Et Al.25. Immunolabeling von Fibronektin (rot) und Zellkerne (DAPI, blau), für die Bildgebung der erhaltenen alveoläre Struktur in der menschlichen 3D-LTC ex Vivo erlaubt. Behandlung des Menschen schlägt PCLS mit einer Profibrotic-Zytokin-cocktail (einschließlich transformierenden Wachstumsfaktor-Beta 1, Thrombozytenzahl abgeleitet Wachstumsfaktor AB, Lipophosphatidyl Säure und Tumor-Nekrose-Faktor Alpha) für 48 h Fibrose-ähnliche Veränderungen im menschlichen geführt 3D-LTCs. Von qPCR war eine deutliche Induktion der Fibrose-relevante extrazelluläre Matrix Komponenten Kollagen Typ 1 und Fibronektin Gene in 3D-LTC Schläge bei der Behandlung mit der Profibrotic cocktail (Abbildung 4) beobachtet. Darüber hinaus wurden Proteingehalte der mesenchymalen Marker Vimentin hochreguliert in 3 von 4 Patienten nach der Behandlung von 3D-LTC Schlägen (Abb. 4E) gefunden.
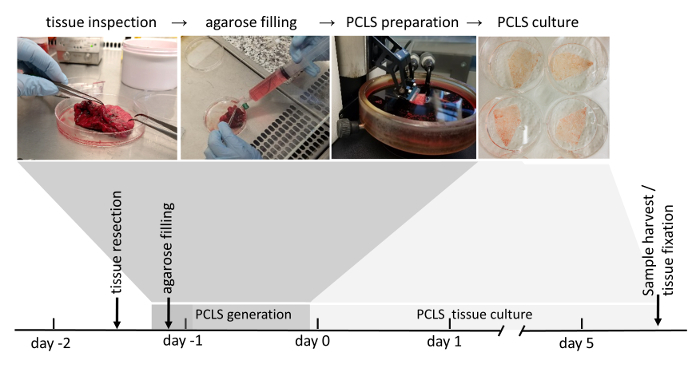
Abbildung 1: Workflow PCLS Generation. Tumor-freie Bereiche der Lunge Resektionen werden aufgrund ihrer Gewebe Integrität gründlich inspiziert. Wenn das Gewebe für den weiteren Gebrauch erzielt wird (scoring wird ausführlich im Abschnitt Material und Methoden), es ist als nächstes mit flüssige Agarose gefüllt. Gewebe-Blöcke mit erstarrten Agarose gefüllt sind anschließend mit einem Vibratome geschnitten. Eingetaucht in Zellkulturmedium, 3D-LTC kultiviert bis zu 120 h nach ihrer Generation. Nachgeschaltete Analysen von 3D-LTCs beinhalten Proteinexpression oder RNA sowie live-Gewebe Fluoreszenz imaging und Immunfluoreszenz-Färbung nach der Fixierung des Gewebes. Bitte klicken Sie hier für eine größere Version dieser Figur.
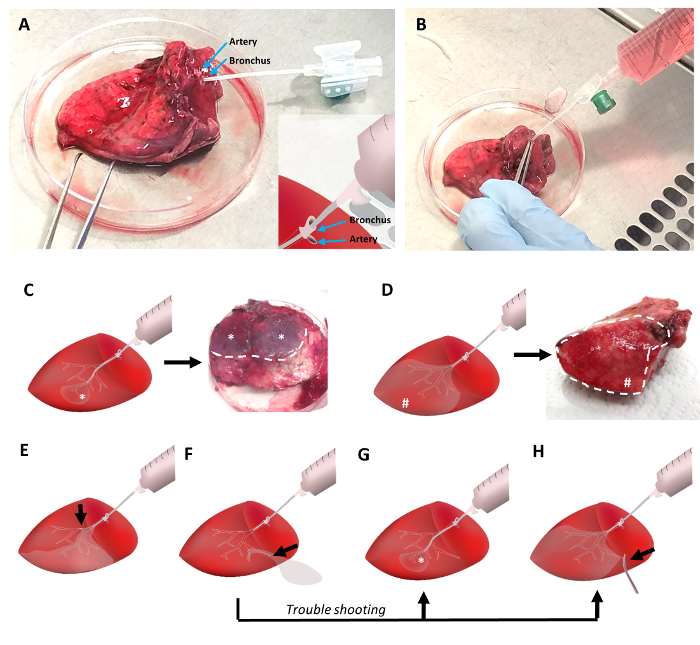
Abbildung 2: Ausfüllen des Lungengewebes mit niedrigschmelzenden Punkt Agarose. Das Lungengewebe ist mit einem peripheren Venenkatheter kanülierte, die in einem Bronchus angrenzend an der Lungenarterie (Abbildung 2A) eingeschoben wird. Pinzetten dienen, die Kanüle in den Bronchus zu beheben und Klemmen Sie die Lungenarterie zur Vermeidung der flüssige Agarose undicht. Flüssige Agarose bei 42 ° C wird in das Lungengewebe mit einer 30 mL Spritze (Abb. 2 b) gegossen. Eine distale Positionierung der Kanüle während des Füllens wird in kleinen Bereichen des gefüllten Gewebes (Abbildung 2), führen, während proximale Positionierung wird die Füllung von einem größeren Gewebevolumens (Abb. 2D) zu gewährleisten. Alle Hindernisse der Atemwege verringert sich die Menge des Gewebes Volumen, die sein können (Abb. 2E) gefüllt. Eine distale Kanüle Positionierung und/oder Spannen von der Leckage-Seite ermöglicht im Falle Agarose undicht, richtige Agarose Füllung des Lungengewebes ()Abbildung 2F-2 H). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: präzise geschliffenen Lunge aufschneiden. Ein erfolgreich Agarose-gefüllte Lungengewebe wird verwendet, um ein Stück eines Gewebes Blocks Verbrauchsteuern (1 x 1,5 cm x 1 cm) mit einem Skalpell (Abb. 3A). Als nächstes der ausgeschnittenen Gewebe-Block ist Inhaber der Gewebe geklebt, Maßstabsleiste zeigt 1 cm (Abb. 3 b). Vorzugsweise wird das Gewebe mit der Pleura Oberfläche an die Oberfläche des Gewebes Inhabers wie in Abbildung 3dargestellt geklebt. 500 µm dicke Scheiben werden durch die Vibratome mit einem Saphir Messer in einem Winkel von 10° - 15 ° bezogen auf das Gewebe (Abbildung 3D und 3E) geschnitten. Der Schneidvorgang führt in ca. 2-3 cm3 große intakte Lunge Scheiben, Skala bar = 5 mm (Abbildung 3F). Darüber hinaus können mithilfe einer Biopsie Puncher kleine reproduzierbare Schläge mit einem Durchmesser von 4 mm generiert werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
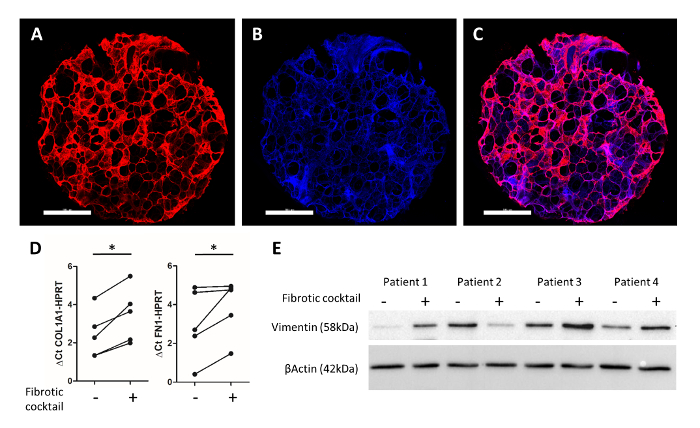
Abbildung 4: experimentelle Auslesen des menschlichen 3D-LTCs nach 48h Kultur. Eine menschliche 3D-LTC-Punch von 4 mm Durchmesser war Immunostained für Fibronektin (in rot) und DAPI (in blau) ()Abbildung 4A-4C). Skalieren von Balken = 1.000 µm. Abbildung 4 zeigt das zusammengefügte Bild. RNA-Analyse der PCLS mittels quantitativer RT-PCR zeigt deutliche Steigerungen der COL1A1 und FN1 Genexpression von den Profibrotic cocktail25. Abbildung 4E zeigt ein Immunoblot ganze Protein Lysates des PCLS, die mit einer fibrotischen cocktail25behandelt wurden. Sondierung für Vimentin und β-Aktin zeigten eine erhöhte Protein-Expression der mesenchymalen Marker (Vimentin) nach Behandlung mit Profibrotic bei Patientenproben 1, 3 und 4 Faktoren. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Kriterium | Punkte |
| Die Gewebeprobe wurde intakt pleural Oberfläche. | 20 |
| Die Gewebeprobe scheint makroskopisch intakt, Einschnitte, Quetschungen, Brüche und Verwerfungen fehlt. | 20 |
| Die Gewebeprobe enthält mindestens einen Bronchus mit einem Durchmesser > 1mm. | 20 |
| Die Gewebeprobe enthält keine oder nur wenig beläuft sich von Blut. | 4 |
| Die Gewebeprobe wurde vollständig in Medium gespeichert und zeigt keine offensichtlichen Anzeichen einer Atelektase. | 4 |
| Die Gewebeprobe wurde innerhalb der letzten vier Stunden reseziert. | 4 |
| Die Gewebeprobe ist größer als 5cm in seinem größten Durchmesser. | 4 |
| Ergebnis in der Summe: |
Tabelle 1: Lunge Agarose füllen Partitur. Die Lunge Agarose füllen Score (LAFS) korreliert mit der Erfolgsquote um eine Gewebe-Resektion mit Agarose für seine spätere Vibratome-basierte PCLS Produktion zu füllen. Das Ergebnis fasst alle Punkte der Kriterien erfüllt durch das Gewebe. Ein LAFS gleich oder über 72 prognostiziert gute Fülleigenschaften Agarose, einem Score unter 60 prognostiziert eine sehr wahrscheinlich Scheitern der Agarose Füllung des Gewebes.
Diskussion
Das Protokoll in diesem Manuskript beschrieben gilt die Generation des PCLS von menschlichen Lunge Gewebe Resectates durch füllen mit flüssige Agarose und anschließende Vibratome schneiden. Generation von Gewebe Scheiben zeigte sich vor für ein paar von Organen, wie Leber und Gehirn, während die Eigensteifigkeit dieser Organe direkt schneiden ohne Änderung des Gewebes erlaubt. Der Hinweis ist der erste richtige Vorbereitung des Lungengewebes der wichtigste Schritt bei der Schaffung von PCLS. Agarose-Füllung der Lunge ist die Methode der Wahl, naturgemäß weich und elastisch zu stabilisieren und zu eine homogenere und reproduzierbare PCLS Generation zu gewährleisten. Großen Fluglinien des resezierten Lungengewebes sind für den Zugriff auf die kleinen Atemwege sowie auf die intakte Lungenparenchym kanülierte. Der Mangel an eine intakte Pleura, der Agarose füllen fast unmöglich macht, ist ein Hauptgrund, warum Lungengewebe meist nicht brauchbar für das Schneiden von Lungenkrebs ist. Prospektiv, konnte eine synthetische Pleura, ursprünglich entworfen, um funktionelle Experimente auf decellularized Gerüsten potenziell angewendet werden, um erfolgreiche Agarose Füllung von Explantaten zu erreichen, die eine intakte Pleura31fehlt. Resektionen, was zu einer menschlichen Lunge Gewebe Stück mit intakten Pleura sind wesentlich für die Erzeugung von Gewebe Blöcke zum Schneiden. Resezierten Gewebes gibt es mehr durch Tumor-freien Gewebe vom Krebs Resektionen als völlig intakt Lappen oder ganze Lunge Explantaten von Patienten, die Lungen-Transplantation unterzogen.
Allgemein, zwei Systeme werden verwendet, um PCLS zu produzieren: Krumdieck Gewebe Allesschneider15 und Vibrations Mikrotome (Vibratomes). Gewebe-Schneidemaschinen generieren Scheiben indem man einen Gewebe-Block durch einen Metallbehälter, welche die PCLS im 90 °-Winkel am Ende dieses Schiff schneidet. Vibratomes generieren PCLS durch Verschieben einer schwingenden Messer waagerecht über eine verankerte Block von Gewebe, das in einem gekühlten mittlere Bad eingetaucht ist, die im Vergleich zu den Krumdieck Allesschneider weniger Querkraft auf das Gewebe ausübt. Dies führt zu weniger harte Behandlung des Gewebes vor Anbau. Auf der anderen Seite ist das Vibratome schneiden mehr Zeit und Arbeit zu konsumieren. In unseren Händen schlägt Vibratome schneiden aktiviert die Produktion von maximal 100 PCLS oder 500 PCLS an einem Tag, ausreichend für die meisten experimentellen Untersuchungen. PCLS kann auf verschiedene Weise gezüchtet werden: (a) befestigt, Trans-Brunnen, wodurch eine flüssige Luftschnittstelle (ALI) System, (b) als dynamisches Organ Kultur (DOC), oder (c) eingetaucht in Zellkulturmedium bei Standardzelle Kulturbedingungen. Der Anbau im Detail des PCLS war zuvor beschriebenen22,23,25; Allerdings fehlt noch ein gemeinsamer Standard Anbaubedingungen zwischen deren Nutzung in verschiedenen Labors auf der ganzen Welt. Insbesondere die Kulturzeit kritisch sein könnte: wie in murinen PCLS wird ein Verlust von SFTPC positive alveolären Typ 2 Zellen beobachtet nach 144 h, aber nicht nach 120 h22. Darüber hinaus scheint die Stoffwechselaktivität in murinen22 und menschlichen PCLS25 für 120 h stabil bleiben.
Es gibt ein paar technische Beschränkungen für die Generation des PCLS: die Anzahl und Größe der Resectates schwankt im Laufe der Zeit; die Effizienz der Agarose füllen, die das Vorhandensein von intakten Pleura innerhalb des gewonnenen Gewebes abhängt, entscheidet über den endgültigen Erfolg der PCLS Generation; und Gewebezerstörung verursacht durch pathologische Veränderungen in der erhaltenen (Kranken) Lungengewebe PCLS Vorbereitung stören könnte. Atemwege Hindernisse und fibrotische Gewebe intakt alveoläre Raum fehlt mit Agarose Füllung behindern und damit Schneiden des fibrotischen Gewebes eine anspruchsvolle Aufgabe. Emphysematöse Gewebe als gefunden bei Erkrankungen wie COPD oder Alpha-1-Anti-Trypsin-Mangel könnte nicht widerstehen dem Druck der Agarose füllen, und zum Bruch der Alveolen und architektonischen Artefakten führt. In diesen Fällen kann die Verwendung von niedrigen Agarose Konzentration, z. B., 1 % (w/V), verringern Druck und Geschwindigkeit während des Füllens der Agarose nützlich sein. Insgesamt kann den Krankheitszustand des Gewebes die Verwendung des Gewebes für PCLS Generation drastisch einschränken. All diese Parameter bestimmen die Höhe des PCLS, die aus Lungengewebe generiert werden können, und auch die Menge an Zeit, die es braucht, um die PCLS zu produzieren. Weitere sind Einschränkungen des PCLS Inkonsistenzen zwischen verschiedenen Lunge Scheiben in Bezug auf Größe oder Gewebe Inhalt, wonach weitere Normalisierung Schritte für Experimente. Um dies zu überwinden, können Biopsie Schläge von vergleichbaren Regionen der gleichen Schicht erzeugt werden. Dieses Verfahren ist geeignet, reduzieren die Gewebe-Variabilität und als Zusatznutzen, erhöhen Sie die Anzahl der PCLS Proben, die für Experimente verwendet werden kann.
Zusammenfassend, menschlichen 3D Lunge Gewebekulturen von Agarose gefüllt PCLS vorsehen, dass ein komplexes Modell der menschlichen Lunge Physiologie und Krankheiten zu studieren. Das Protokoll enthält eine ausführliche Beschreibung der Vorbereitung des PCLS von resezierten Lungengewebe und deren Anbau und darüber hinaus befasst sich mit Herausforderungen in Agarose Füllung der menschlichen Lunge Resektionen und wie man sie überwinden.
Offenlegungen
Alle Autoren erklären keine konkurrierenden finanziellen Interessen.
Danksagungen
Die Autoren sind dankbar, Marisa Neumann für kompetente technische Unterstützung. Alle Lungengewebe wurden uns freundlicherweise zur Verfügung gestellt durch des CPC-M Bio-Archivs. Diese Arbeit wurde vom Deutschen Zentrum der Lunge Forschung (DZL), der Helmholtz-Gemeinschaft und CPC Research School Stipendien unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Vibratome Hyrax V50 | Zeiss | - | |
| Hyrax CU 65 | Zeiss | - | |
| Vasofix Braunüle 18 G | B. Braun Melsungen AG | 4268130B | |
| 30 mL NORM-INJECT | Henke Sass Wolf | 4830001000 | |
| Guarded disposable scalpels, sterile | Swann-Morton | ||
| Loctite 406 | Henkel | LOCTITE 406 | |
| Synthetic Single Crystal Sapphire | Delaware Diamond Knives | - | |
| Dulbecco's Modified Eagle Medium F-12 Nutreient Mixture (Ham) + L-Glutamine + 15mM HEPES | Gibco | 31330-038 | |
| Penicillin Streptomycin | Gibco by Life Technologies | 15070-063 | |
| Special process fetal bovine serum (Sera Plus) | Pan Biotech | P30-3702 | |
| Disposable Biopsy Punch | pfm medical | 48401 | |
| 96 Well, Black/Clear, Tissue Culture Treated Plate, Flat Bottom with Lid, sterile | Falcon / Corning | 353219 | |
| Agarose, low geling temperature | Sigma | A9414-100G |
Referenzen
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study. Lancet. 380 (9859), 2095-2128 (2010).
- Rosenberg, S. R., Kalhan, R., Mannino, D. M. Epidemiology of Chronic Obstructive Pulmonary Disease: Prevalence, Morbidity, Mortality, and Risk Factors. Seminars in Respiratory and Critical Care Medicine Med. 36 (4), 457-469 (2015).
- Hekking, P. P., et al. The prevalence of severe refractory asthma. The Journal of Allergy and Clinical Immunology. 135 (4), 896-902 (2015).
- Woodard, G. A., Jones, K. D., Jablons, D. M. Lung Cancer Staging and Prognosis. Cancer Treatment and Research. 170, 47-75 (2016).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. American Journal of Respiratory and Critical Care Medicine. 183 (4), 431-440 (2011).
- Burgstaller, G., et al. The instructive extracellular matrix of the lung: basic composition and alterations in chronic lung disease. European Respiratory Journal. 50 (1), (2017).
- Degryse, A. L., Lawson, W. E. Progress toward improving animal models for idiopathic pulmonary fibrosis. The American Journal of the Medical Sciences. 341 (6), 444-449 (2011).
- Fricker, M., Deane, A., Hansbro, P. M. Animal models of chronic obstructive pulmonary disease. Expert Opinion on Drug Discovery. 9 (6), 629-645 (2014).
- Sagar, S., Akbarshahi, H., Uller, L. Translational value of animal models of asthma: Challenges and promises. European Journal of Pharmacology. 759, 272-277 (2015).
- Williamson, J. D., Sadofsky, L. R., Hart, S. P. The pathogenesis of bleomycin-induced lung injury in animals and its applicability to human idiopathic pulmonary fibrosis. Experimental Lung Research. 41 (2), 57-73 (2015).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of beta2-adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Skronska-Wasek, W., et al. Reduced Frizzled Receptor 4 Expression Prevents WNT/beta-Catenin-driven Alveolar Lung Repair in Chronic Obstructive Pulmonary Disease. American Journal of Respiratory and Critical Care Medicine. 196 (2), 172-185 (2017).
- Lehmann, M., et al. Senolytic drugs target alveolar epithelial cell function and attenuate experimental lung fibrosis ex vivo. European Respiratory Journal. 50 (2), (2017).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Communication and Signaling. 12, 73 (2014).
- Ebsen, M., et al. Infection of murine precision cut lung slices (PCLS) with respiratory syncytial virus (RSV) and chlamydophila pneumoniae using the Krumdieck technique. Pathology - Research and Practice. 198 (11), 747-753 (2002).
- Kennedy, J. L., et al. Effects of rhinovirus 39 infection on airway hyperresponsiveness to carbachol in human airways precision cut lung slices. The Journal of Allergy and Clinical Immunology. 141 (5), 1887-1890 (2018).
- Royce, S. G., et al. Airway Remodeling and Hyperreactivity in a Model of Bronchopulmonary Dysplasia and Their Modulation by IL-1 Receptor Antagonist. American Journal of Respiratory Cell and Molecular Biology. 55 (6), 858-868 (2016).
- Donovan, C., et al. Rosiglitazone elicits in vitro relaxation in airways and precision cut lung slices from a mouse model of chronic allergic airways disease. American Journal of Physiology-Lung Cellular and Molecular Physiology. 309 (10), L1219-L1228 (2015).
- Zscheppang, K., et al. Human Pulmonary 3D Models For Translational Research. Biotechnology Journal. 13 (1), (2018).
- Fisher, R. L., et al. The use of human lung slices in toxicology. Human & Experimental Toxicology. 13 (7), 466-471 (1994).
- Wang, L., et al. Differences between Mice and Humans in Regulation and the Molecular Network of Collagen, Type III, Alpha-1 at the Gene Expression Level: Obstacles that Translational Research Must Overcome. International Journal of Molecular Sciences. 16 (7), 15031-15056 (2015).
- Uhl, F. E., et al. Preclinical validation and imaging of Wnt-induced repair in human 3D lung tissue cultures. European Respiratory Journal. 46 (4), 1150-1166 (2015).
- Switalla, S., et al. Natural innate cytokine response to immunomodulators and adjuvants in human precision-cut lung slices. Toxicology and Applied Pharmacology. 246 (3), 107-115 (2010).
- Banerjee, A., et al. Trichostatin A abrogates airway constriction, but not inflammation, in murine and human asthma models. American Journal of Respiratory Cell and Molecular Biology. 46 (2), 132-138 (2012).
- Alsafadi, H. N., et al. An ex vivo model to induce early fibrosis-like changes in human precision-cut lung slices. American Journal of Physiology-Lung Cellular and Molecular Physiology. 312 (6), L896-L902 (2017).
- Westra, I. M., Oosterhuis, D., Groothuis, G. M., Olinga, P. Precision-cut liver slices as a model for the early onset of liver fibrosis to test antifibrotic drugs. Toxicology and Applied Pharmacology. 274 (2), 328-338 (2014).
- Vatakuti, S., Schoonen, W. G., Elferink, M. L., Groothuis, G. M., Olinga, P. Acute toxicity of CCl4 but not of paracetamol induces a transcriptomic signature of fibrosis in precision-cut liver slices. Toxicology in Vitro. 29 (5), 1012-1020 (2015).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Disease Models & Mechanisms. 8 (10), 1227-1236 (2015).
- Li, M., de Graaf, I. A., Groothuis, G. M. Precision-cut intestinal slices: alternative model for drug transport, metabolism, and toxicology research. Expert Opinion on Drug Metabolism & Toxicology. 12 (2), 175-190 (2016).
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Wagner, D. E., et al. Design and Synthesis of an Artificial Pulmonary Pleura for High Throughput Studies in Acellular Human Lungs. Cellular and Molecular Bioengineering. 7 (2), 184-195 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten