Method Article
LDL-Cholesterin-Aufnahme-Assay mit Live Cell Imaging-Analyse mit Zelle Systemüberwachung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll bietet einen effizienten Ansatz zur Messung von LDL-Cholesterin-Aufnahme mit Real-Time Zustrom Raten mit einem live Cell imaging-System in verschiedenen Zelltypen. Diese Technik bietet eine Plattform die pharmakologische Aktivität von Verbindungen beeinflussen LDL Zustrom während der Überwachung für Zellmorphologie und damit potenzielle Zytotoxizität auf dem Bildschirm.
Zusammenfassung
Die Verordnung der LDL-Cholesterin-Aufnahme durch LDLR-vermittelte Endozytose ist ein wichtiger Bereich der Studie in verschiedenen wichtigen Krankheiten einschließlich Stoffwechselstörung, kardiovaskulären Erkrankungen und Nierenerkrankungen. Derzeit gibt es keine Methode, LDL-Aufnahme zu bewerten, während gleichzeitig Überwachung für die Gesundheit der Zellen. Die aktuelle Studie zeigt ein Protokoll, mit einer live Cell imaging Analysesystem auf Reihenmessungen LDL Zustrom mit gleichzeitiger Überwachung für Zellgesundheit erwerben. Diese neuartige Technik wird über einen vier-Stunden-Kurs in drei humanen Zelllinien (hepatische, renale tubuläre Epithelzellen und koronaren Arterie Endothelzellen) getestet. Darüber hinaus wird die Empfindlichkeit dieser Technik mit bekannten LDL-Aufnahme-Hemmer, Dynasore und rekombinante Protein PCSK9 sowie durch eine LDL-Aufnahme-Promotor, Simvastatin validiert. Zusammen genommen bietet diese Methode eine mittlere-hohe Durchsatz-Plattform für gleichzeitig screening pharmakologische Aktivität sowie die Überwachung der Zellmorphologie, also Zytotoxizität von Verbindungen, die Regulierung von LDL Zustrom. Die Analyse kann mit verschiedenen bildgebenden Systemen und Analyse-Software verwendet werden.
Einleitung
Die LDL Low Density Lipoprotein Rezeptor LDLR-vermittelte Endozytose ist ein wichtiger Bereich der Studie, da zirkulierende LDL-Cholesterinspiegel das Herzstück des Herz-Kreislauf-Krankheit1, Niere-Krankheit2 , sowie eine Vielzahl von entzündlichen sind transport von Krankheiten3 und genetische Erkrankungen mit Mutationen in Cholesterin Gene4,5,6,7. Studien in LDLR-vermittelten Cholesterin Zustrom führten zur Identifizierung von mehrere Recherche-Tools, wie z. B. Dynamin-Inhibitoren sowie die chemische Dynasore8,9,10, LDL-Regulierung Proteine wie Proprotein Konvertase Subtilisin/Kexin Typ 9 (PCSK9)11,12.
Der LDL-LDLR-Endozytose-Weg beginnt mit den LDL-LDLR-Komplex auf der Zelloberfläche in Clathrin-coated Pits13Sequestrierung. Bläschen werden dann durch Einstülpung der Zellmembran Oberfläche Verinnerlichung des LDL-LDLR-Komplexes in Vakuolen für den Transport innerhalb der Zelle gebildet. Die gebildeten Vesikel in frühe und dann späte Endosomen reift, sinkt der pH-Wert innerhalb der späten Endosom, Distanzierung von der LDL von seinen Rezeptor14verursacht. In der Vergangenheit hing die Methoden zur Quantifizierung von LDL Zustrom von Radio-Label 125-LDL Co Inkubation mit Zellen und anschließende Extraktion des radioaktiv markierten Proteins aus Zellen zur Quantifizierung15. Dies wurde dann durch die Verwendung von Eindringmittel gekennzeichneten LDL-Proteine wie DiI-LDL und anschließende Immunostaining oder Extraktion des Proteins für fluoreszierende Lesungen mit einem Spektralphotometer oder Platte Leser15,16ersetzt. Eindringmittel gekennzeichnet wurde LDL auch in Fluoreszenz-aktivierte Zelle sortieren (FACS) für die Analyse der Internalisierung der LDL und Zelle Oberfläche LDL Bindung17eingesetzt. Während diese Methoden für die Erfassung von Daten nach der Behandlung ermöglichen, ist die Überwachung der Lebensfähigkeit der Zellen während der Behandlung nicht möglich.
Der saure pH-Wert in der späten Endosom ermöglicht den Einsatz einer pH aktiviert fluoreszierende LDL-Sonde wie pHrodo rot-LDL, die nach Internalisierung18,19fluoresziert. Diese Eigenschaft ermöglicht einen kontinuierlichen zeitlichen Verlauf der LDL-Aufnahme-Bewertung in lebenden Zellen. Daher nutzt dieses Protokoll pHrodo rot-LDL-Fluoreszenz-Bildgebung in live Zellanalyse, seriell Maßnahme LDL Aufnahme mit gleichzeitiger Überwachung für die Zellgesundheit. Die Ergebnisse zeigen die Zuverlässigkeit dieser neuartigen Technik wie über einen vier-Stunden-Kurs in drei verschiedenen humanen Zelllinien, menschlichen hepatischen Karzinomzellen (HepG2), menschlichen Nieren (HK2) Epithelzellen und menschlichen koronare arterielle Endothelzellen (HCAEC getestet ). Diese Zelllinien sind klinisch signifikanter LDL Abstand20,21,22,23,24,25,26,27 , Niere Krankheit28,29,30,31, und Herz-Kreislauferkrankungen32,33, beziehungsweise. Dieses Protokoll beinhaltet zusätzlich zur Überwachung des LDL-Zustroms, Behandlung mit zwei bekannten LDL-Aufnahme-Hemmer, Dynasore Hydrat und rekombinanten Proteins PCSK9 sowie ein statin Induktor von LDLR Ausdruck und LDL-Aufnahme, Simvastatin. Dynasore und rekombinante PCSK9 jedes arbeiten über verschiedene Wege zur Verringerung der LDL-Aufnahme.
Dynasore ist ein kleines Molekül-Hemmer von Dynamins10 und senkt LDL-Aufnahme blockieren Clathrin-abhängige Endozytose von LDL-LDLR Komplex10,34. Rekombinante PCSK9 ist auf der anderen Seite Mitglied Peptidase S8-Familie, die LDLR bindet und hemmt das recycling an die Zelloberfläche nach der Veröffentlichung von LDL aus dem verinnerlichten Komplex durch die Blockierung erforderlich Konformationsänderungen35,36 . Verminderte Oberfläche LDLR Zelldichte führt schließlich zum reduzierten LDL-Aufnahme von der Zelle. Statine, sind beim direkt Blocken der 3-hydroxy-3-Methylglutaryl-Coenzym (HMG-CoA)-Reduktase Enzym und damit die Cholesterin-Biosynthese, auch Upregulate den Ausdruck des LDLR25,38 führt zu erhöhte LDL-Aufnahme bekannt. Die Empfindlichkeit dieses Protokolls wird überprüft, indem er erkennt erhebliche Reduzierungen in LDL Zustrom in drei klinisch relevante humanen Zelllinien, HK2, HepG2 und HCAECs, durch Dynasore und/oder rekombinante PCSK9, und eine deutliche Zunahme der LDL-Aufnahme in HepG2-Zellen durch Simvastatin in einem vier-Stunden-Kurs mit Überwachung für Zelle Morphologie/Gesundheit. Zusammen genommen bietet diese Methode eine mittlere-hohe Durchsatz-Plattform für das screening gleichzeitig die pharmakologische Aktivität und Zytotoxizität von Verbindungen, die Regulierung der LDL-Aufnahme in lebenden Zellen.
Protokoll
(1) Aussaat Zellen in einer 24-Well-Platte
- Aspirieren Sie Medien aus den Zellen, waschen Sie die Zellen mit 5 mL Dubelco Phosphat gepufferte Kochsalzlösung (dPBS) und aspirieren Sie des dPBS. Verwenden Sie für HepG2 Zellen in einer Petrischale 100 mm, 1,5 mL von 0,25 % Trypsin/EDTA, und für HK2 Zellen oder HCAECs 1,5 mL 0,05 % Trypsin/EDTA-Lösung, um die Zellen zu lösen.
- Inkubieren Sie die Platte in einem Inkubator 37 ° C, 4 Minuten lang oder bis die Zellen gelöst werden. Nach einer Inkubationszeit von 4 Minuten zu neutralisieren Trypsin durch Zugabe von 3 mL komplette Medien für HepG2 und HK2 oder 3 mL Trypsin neutralisierende Lösung, dPBS plus 5 % fetalen bovine Serum (FBS), für HCAEC Zellen.
- Übertragen Sie die Zellen in 15 mL konische Röhrchen bei 250 X g für 5 min Zentrifugieren, aspirieren Sie die Medien und erneut aussetzen der Zelle Pellet in komplette Medien.
- Filtern Sie die Zellsuspension vorsichtig durch ein Sieb 40 μm zu Zelle Klumpen brechen. Waschen Sie die Zellen nicht durch das Sieb.
- Zählen der Zellen und sie auf eine optimale Dichte Platte. Zum Beispiel führen 5.000 Zellen pro Bohrloch HepG2-Zellen oder 10.000 Zellen pro Bohrloch HK2 Zellen oder HCAECs in einer 24-Well-Platte zu optimalen Ergebnissen.
- Inkubieren Sie die Platte über Nacht bei 37 ° C damit Zellen befestigen.
- Am nächsten Tag ändern Zelle Media Base-Medien für die Zell-Linie (ohne FBS) plus 5 % Lipo-Protein mangelhaft Serum (LPD) oder niedrig (2 %) FBS-Medien je nach Behandlung (siehe 1.7). Dann weiter Inkubation für 24 h die Zellen verhungern. Verwenden Sie 500 μL der gesamten Medien pro Bohrloch in einer 24-Well-Platte.
- Behandeln die Zellen in eine der drei Möglichkeiten: Fügen Sie 10 µg/mL rPCSK9 (oder Fahrzeug) und zurück die Zellen in den Inkubator 37 ° C für 1 Stunde, 40 µM Dynasore-Hydrat (oder Fahrzeug, Dimethyl Sulfoxid) hinzufügen und die Zellen in den Inkubator 37 ° C für 10 Minuten zurück , oder fügen Sie 1 µM Simvastatin (oder Fahrzeug, Dimethyl Sulfoxid) und die Zellen in den Inkubator 37 ° C für 12, 18 oder 24 Stunden zurück. Verwenden Sie Medien mit 5 % LPDS für rPCSK9 oder Dynasore Behandlungen. Verwenden Sie niedrig (2 %) FBS-Medien oder mit 5 % LPDS Simvastatin Behandlungen.
Hinweis: Behandlung der Zellen mit gewünschten Verbindungen kann zum Zeitpunkt der Medienwechsel für Lipoprotein Hunger (Schritt 1.6) für langfristige Experimente oder vor der Analyse für kurzfristige Experimente durchgeführt werden. Alternativ können individuelle Behandlungszeiten basierend auf der Art und der Zweck der Experimente gewählt werden. - Als nächstes fügen Sie 5 µL pHrodo rot-markierten LDL (1 mg/mL Brühe) in jede Vertiefung, eine Endkonzentration von 10 µg/mL zu erhalten. Dann entfernen Sie sorgfältig alle Bläschen aus dem Brunnen.
2. live-Cell-Analyse
- Sofort nach dem Hinzufügen des gekennzeichneten LDL, platzieren Sie die Platte in den live Zelle Analyse System Inkubator (siehe Tabelle der Materialien) und die Platte zu equilibrate für 15 Minuten zu Kondensation in der Platte reduzieren lassen.
- In der Zwischenzeit öffnen Sie die Software und planen Sie den Scan, indem man das Schiff die Halteplatte. Bild 16 Bilder pro Bohrloch in Abständen von 1 Stunde bei 10 X für 4 Stunden über die Kanäle rot und Phase.
- Erstellen Sie eine Platte Karte für Datenverarbeitung zu verwenden.
- Klicken Sie auf die Registerkarte " Eigenschaften " wählen Sie die Platte Karte. Geben Sie den Zelltyp und Behandlungen in der Registerkarte " Verbindungen ".
- Klicken Sie auf die Registerkarte " Regionen ", wählen Sie jeden Satz von Wiederholungen, und speichern Sie als Regionen.
3. richten Sie Analyseparameter
- Sobald eine experimentelle abgeschlossen ist, erstellen Sie ein Bild-Set in der Software des Computers auf jeden Parameter in der Zählung enthalten quantifizieren zu trainieren.
- Öffnen Sie in der Software die Platte Ansicht zu, dann wählen Sie im Feld Analyse Job Dienstprogramme erstellen "oder" Add an Image Collection.
- Wählen Sie Neue Bildsammlung, geben Sie einen Namen für die Bildersammlung, und wählen Sie die Kanäle rot und Phase durch Markieren der Kästchen neben den Kanälen.
- Wählen Sie 5 weitere Bilder aus und Bild-Auflistung fügen Sie hinzu, indem Sie das aktuelle Bild-Sammlung hinzufügen.
- Erstellen Sie eine Verarbeitung Definition für die Zellen. Tabelle 1 enthält die Parameter für die Verarbeitung von Definitionen für dieses LDL Zustrom Protokoll HepG2 HK2 und HCAE Zelle.
- Wählen Sie im Feld Analyse Job Utilities Verarbeitung Neudefinition. Wählen Sie die Bildersammlung benannt im Schritt 2.1.2 aus dem Drop-down-Menü. Geben Sie die Parameter für die Art der Zellen aus der Tabelle 1.
- Im Feld Vorschau Vorschau allewählen Sie mit der Drop-down-Menü.
- Überprüfen Sie im Feld Analyse-Maske der Zusammenfluss Maske und das Rote Objekt Maske Boxen um den Bereich in der Analyse für die Verarbeitung Definition enthalten anzeigen. Siehe Abbildung 1.
- Blättern Sie durch die Bildersammlung um sicherzustellen, dass die Zellen und LDL in der Maske enthalten sind. Wählen Sie Datei und die Definition der Bearbeitung Speichern .
- Analysieren Sie den Satz von Bildern aus dem experimentellen Lauf.
- Öffnen Sie das Experiment in Platte Ansicht. Wählen Sie im Feld Analyse Job Dienstprogramme Starten neue Analyse-Auftrag. Wählen Sie die gespeicherte Definition Verarbeitung.
- Nennen Sie den Analyse-Auftrag zu, wählen Sie den Zeitraum für die Analyse und markieren Sie die experimentelle Brunnen zu analysieren. Klicken Sie auf die Schaltfläche " starten ".
4. Analyse und Verarbeitung von Daten
- Sobald die Analyse-Auftrag abgeschlossen ist, exportieren Sie die Daten:
- Wählen Sie die fertige Analyse und Ansicht. Wählen Sie im Menü " Dienstprogramme " Metrisch/Grafik zu exportieren.
- Im Menü Regionen wählen Sie Alle Brunnen, und die Gruppe um zu erhalten die Mittelwerte für jede Gruppe von Brunnen als Gruppe wählen Sie im Menü repliziert, und für den Export die Einzelwerte für jede Vertiefung wählen Sie keine.
- Wählen Sie im Menü rot Objekt Metrik die Red Objekt integrierten Gesamtintensität (RCU X µm2StraßenrandVerkaufsförderung). Dieser Parameter gibt der Summe der roten Signalzeiten Intensität (in RCU) Bereich das rote Signal (in µm2) in den Bildern über jedes gut, das entspricht insgesamt LDL-Aufnahme durch die Zellen.
- Klicken Sie auf die Schaltfläche " Daten exportieren ". Überprüfen Sie die Daten in Einzelbilder zerlegen. Die Daten werden automatisch in einer Zwischenablage kopiert und können in eine neue Tabellenkalkulationsdatei eingefügt werden.
- Wählen Sie im Menü Phase Objekt Metrik Zusammenfluss (Prozent). Überprüfen Sie die Daten in Einzelbilder zerlegen. Klicken Sie auf die Schaltfläche " Daten exportieren ". Die Daten werden automatisch in einer Zwischenablage kopiert und können auf die Kalkulationstabellendatei mit roten Objekt integrierten Gesamtintensität Daten kopiert werden.
- Die Umwandlung von Prozent Zusammenfluss auf Gesamtfläche mit der folgenden Gleichung anwenden.
Gesamtfläche (µm2StraßenrandVerkaufsförderung) Phase = Zusammenfluss (%) × (Bildhöhe (Pixel) × Auflösung) × (Bildbreite (Pixel) × Auflösung)
Hinweis: der Zusammenfluss (%)-Parameter gibt die Prozent Zusammenfluss des Bereichs Phase pro Bild, das auf den Bereich der Zellen in jedem Bohrloch entspricht. Diese Kennzahl sollte in totale Phase Bereich umgewandelt werden, für jeden einzelnen Bild einmal exportiert. Die Bild-Spezifikationen für Phase-Kanal (Bildhöhe, Breite und Auflösung) mit der obigen Formel für jedes experimentelle Schiff verwendet werden finden Sie unter Verweis auf Schiff Eigenschaften unter Bild-Kanäle. - Normalisieren Sie Total rot Objekt integrierte Intensität auf die Gesamtfläche der Phase berechnet in 4.1.6 mithilfe der folgenden Formel für jedes einzelne Bild, um die Variabilität in der Zelldichte über den Brunnen zu beseitigen.
- Teilen Sie die Total rot Objekt integrierten (RCU X µm2StraßenrandVerkaufsförderung) Intensitätswerte jedes Bild durch seine entsprechende Phase Gesamtfläche (µm2StraßenrandVerkaufsförderung) , LDL-Aufnahme (RCU) Werte pro Bild zu erhalten.
- Dann, durchschnittliche LDL-Aufnahme (RCU) Daten aller Bilder von jedem gut zu erhalten die durchschnittlichen LDL-Aufnahme in jede Vertiefung und dann Durchschnittswerte der LDL Aufnahme der replizieren Brunnen Gruppe Mittel zu erhalten. Diese Daten sind die Endwerte der LDL-Aufnahme und für Illustration und statistische Analyse mit Hilfe der Software der Wahl verwendet werden.
Ergebnisse
Live Cell Imaging ermöglicht zuverlässige Überwachung der Zellgesundheit während Cholesterin Zustrom Studien in drei humanen Zelllinien
Wir validiert unsere Assay in drei humanen Zelllinien, welche Cholesterin Homöostase Verordnung eine wichtige pathophysiologische Rolle spielt, einschließlich der menschlichen Leber (HepG2) Karzinomzellen, menschlichen Nieren (HK2) Epithelzellen und menschlichen koronaren Endothelzellen (HCAECs). Wir haben ein live Cell imaging Systems den LDL-Aufnahme-Test in einem 4 h Zeit Kurs mit Reihenmessungen in 1 h Abständen durchführen. Unsere Ergebnisse deuten darauf hin, dass alle Zelltypen, die getestet mit dieser neuen Technik und Ergebnis in Kurven wurden, die kontinuierliche LDL-Aufnahme für die Dauer der Zustrom Studie mit 4,33 h als den finalen Endpunkt (Abbildung 2) kompatibel. Der Zustrom in Abbildung 2 gezeigt wurden Daten durch die Normalisierung der gesamten pHrodo rot-markierten LDL Fluoreszenz (total rotes Objekt integriert Intensität pro Bild in RCU x µm2/Bild) zum Bereich Ergebniszelle in jedem Bild von jedem Bohrloch (Phase Objektbereich pro Bild in µ m2StraßenrandVerkaufsförderung), die Variabilität in der Zelldichte über den Brunnen zu beseitigen. Darüber hinaus um die Empfindlichkeit des LDL Zustrom Assays für die Zwecke der screening-Verbindungen beeinträchtigen LDL-Cholesterin-Aufnahme zu überprüfen, haben wir zwei Positivkontrollen bekannt, LDL Zustrom, Dynasore und rPCSK9 zu hemmen und eine Positivkontrolle induzieren LDL bekannt Aufnahme, Simvastatin. Durch unsere Ergebnisse nach der Behandlung mit Dynasore und rPCSK9, überprüft getestet alle drei humanen Zelllinien (HepG2, HK2 und HCAEC) zeigten signifikante Reduktion in LDL Zustrom über ein 4 h zeitlicher Verlauf (Abbildung 2A-C). Abbildung 2A zeigt beispielsweise, dass der LDL-Zustrom in HepG2-Zellen mit der Behandlung von Dynasore Laufe der Zeit, im Vergleich zu den Zellen behandelt mit DMSO reduziert wird; während die DMSO als der Fahrzeugsteuerung für Dynasore Kontrolle keinen signifikanten Einfluss auf LDL Zustrom im Vergleich zu den unbehandelten Kontrollgruppe hatte. Darüber hinaus unsere Ergebnisse zeigten einen deutlichen Anstieg in LDL-Aufnahme durch HepG2-Zellen nach der Behandlung mit Simvastatin (Abbildung 3), unterstützen die Empfindlichkeit dieser Methode, wesentliche Veränderungen in der LDL-Zustrom zu erkennen. Am Drehpunkt der 4,5 h Zeit, die eine typische Zeitpunkt in LDL-Aufnahme-Studien, ist der LDL-Zustrom deutlich reduziert mit entweder Dynasore oder rPCSK9 Behandlung, und erhöht durch Simvastatin-Behandlung (Abbildung 4).
Ein großer Vorteil bei der Verwendung von live Cell imaging für LDL-Aufnahme-Studien ist, dass dieses System Echtzeit-Bilder der Zellen in jedem Bohrloch, das verwendet werden könnte bietet, um potenzielle Zytotoxizität der untersuchten Verbindungen überwachen. Abbildungen 5 bis 7 zeigen repräsentative Bilder der drei Zelllinien als visuelle Referenz für den net LDL-Zustrom in die Anfangszeit (0,33 h) und letzten Endpunkt (4,33 h) untersucht. Die Bilder bestätigen die normale Morphologie der Zellen nach Dynasore oder rPCSK9 Behandlungen, Wirksamkeit und Sicherheit dieser Verbindungen anzeigt.
Live Cell Analyse gibt zuverlässige serielle Quantitative Cholesterin Zustrom Messungen mit verschiedenen Behandlungen
Ein großer Vorteil der Verwendung dieses Protokolls mit einem live Cell imaging-System ist die Fähigkeit, Daten im Laufe der Zeit sammeln und LDL Zustrom an mehreren Zeitpunkten anstatt nur ein letztes Mal Punkt so traditionell zu vergleichen. Dieses Protokoll können wir die prozentuale Ausstiegsversuch LDL Zustrom am terminal Zeitpunkt sowie in 1 h Abständen im Laufe der Zeit zu berechnen. Tabelle 2 fasst die Verringerung der LDL-Zustrom in drei getesteten humanen Zelllinien, die nach 10 min vor der Behandlung mit 40 µM Dynasore oder 1 h vor der Behandlung mit 10 µg/mL rPCSK9. Bei 4,33 h als Endpunkt der letzten Studie Behandlung mit Dynasore bei 40 µM deutlich reduziert LDL Zustrom in HepG2-Zellen, HK2 Zellen und HCAECs um 53 %, 68 % bzw. 54 %, bzw. (Tabelle 2A-C) und Behandlung mit rPCSK9 bei 10 µg/mL führte zu 55 % Verringerung der LDL Zustrom in HK2 Zellen (Tabelle 2 b). Neben der Quantifizierung des terminal Zeitpunkt wie bei herkömmlichen Tests, sind wir in der Lage, eine Quantitative Analyse bei der Reduktion von LDL Zustrom durch Behandlung zu jedem Zeitpunkt des Experiments. Tabelle 2 b zeigt beispielsweise, dass die Behandlung mit rPCSK9 in HK2 Zellen eine Verringerung der LDL-Aufnahme von 79 % auf 1,33 h, 67 % bei 2,33 h führte, 59 % bei 3,33 h Behandlung im Vergleich zu unbehandelten Zellen post. Dieses Protokoll bietet eine zuverlässige Methode zur quantitativen Analyse der LDL-Zustrom nach der Behandlung.
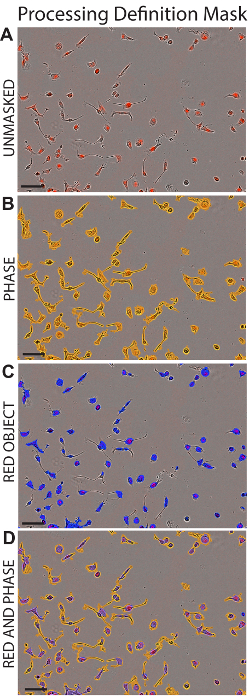
Abbildung 1 : Definition Maske Verarbeitung. Repräsentative Bilder von HK2 Zellen sind nach der Anwendung die entsprechende Verarbeitung-Definition (siehe Tabelle 1) dargestellt. AreHK2 Zellen ohne Maskierung (A), mit Phase Maskapplied (B) gezeigt, mit roten Objekt Maske angewendet (C) oder mit Phase und roten Objekt Masken angewendet (D). Maßstabsleiste = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
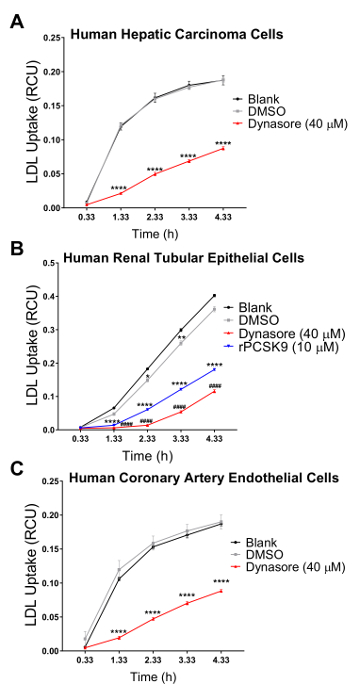
Abbildung 2 : Reduzierung der LDL Aufnahme mit live cell imaging-System über einen zeitlichen Verlauf 4,33 h. Live-Zelle Analyse System verwendet, um LDL Zustrom in menschlichen Leber (HEPG2) Karzinomzellen (A), menschliche renale tubuläre (HK2) Epithelzellen (B) und menschliche Koronararterie (HCAE) Endothelzellen (C) zu messen. Die Zellen wurden mit Dynasore (10 min vor dem Lauf) oder rPCSK9 (1 h vor dem Rennen) als Positivkontrollen behandelt. DMSO diente als Vehikel für Dynasore Behandlungen. Positivkontrollen verringerte sich deutlich die LDL-Zustrom in allen 3 Zelllinien. LDL-Zustrom-Werte wurden durch die Normalisierung der roten Gesamtobjekt integriert Intensität (RCUxµm2StraßenrandVerkaufsförderung) zu den gesamten Phase Objektbereich (µm2StraßenrandVerkaufsförderung) erhalten. Daten sind Mean±SEM. N = 6 Wells/Gruppe. Daten sind repräsentativ für 2 oder 3 unabhängigen Experimenten. p < 0,0001 Vs leer, und ###p < 0,0001 Vs DMSO, mit zwei-Wege-ANOVA. Bitte klicken Sie hier für eine größere Version dieser Figur.
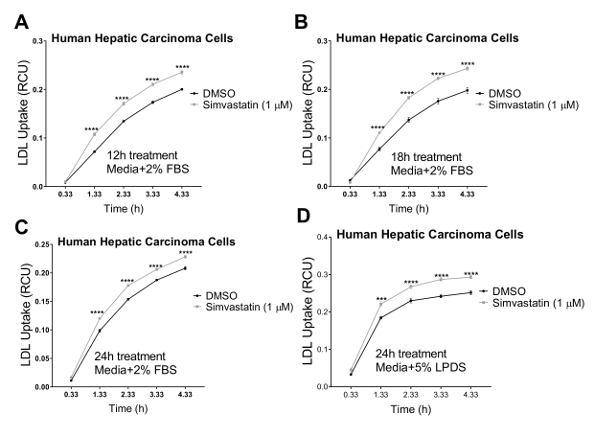
Abbildung 3 . Zunahme der LDL-Aufnahme mit live Cell imaging-System über einen zeitlichen Verlauf 4,33 h. Live-Zelle Analyse System verwendet, um LDL Zustrom in menschlichen hepatischen Karzinomzellen (HEPG2) zu messen. LDL-Aufnahme wird deutlich erhöht, nach der Behandlung mit Simvastatin für 12 h (A), 18 h (B) oder 24 h (C) Verwendung von Medien mit 2 % FBS. Der 24 h-Zeitpunkt erfolgte auch mit Medien, die 5 % LPDS (ohne FBS). DMSO diente als Negativkontrolle. LDL-Zustrom-Werte wurden durch die Normalisierung der roten Gesamtobjekt integriert Intensität (RCU X µm2StraßenrandVerkaufsförderung) zu den gesamten Phase Objektbereich (µm2StraßenrandVerkaufsförderung) erhalten. Daten sind Mean±SEM. N = 6 Wells/Gruppe. Daten sind repräsentativ für eine unabhängige Experiment. p < 0,0001 Vs DMSO, mit der Student t-Test. Bitte klicken Sie hier für eine größere Version dieser Figur.
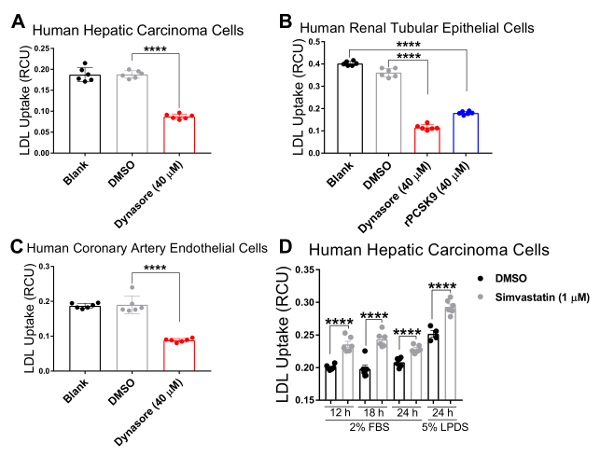
Abbildung 4 . Signifikante Reduktion der LDL-Zustrom von LDL Aufnahme-senkende Mittel Zeitpunkt 4,3 h. LDL-Zustrom ist in menschlichen Leber (HepG2) Karzinomzellen (A), menschliche renale tubuläre (HK2) Epithelzellen (B) und menschliche Koronararterie (HCAE) Endothelzellen (C) nach der Behandlung mit LDL-Aufnahme deutlich reduziert. Dynasore Inhibitoren für 10 min oder rPCSK9 für 1 Stunde. LDL-Zustrom wird Simvastatin in HepG2-Zellen nach 12, 18 oder 24 h Behandlungen (D) deutlich gesteigert. Daten sind Mean±SEM. N = 6 Wells/Gruppe. Daten sind repräsentativ für 2 oder 3 unabhängigen Experimenten. mit zwei-Wege-ANOVA p < 0,0001. Bitte klicken Sie hier für eine größere Version dieser Figur.
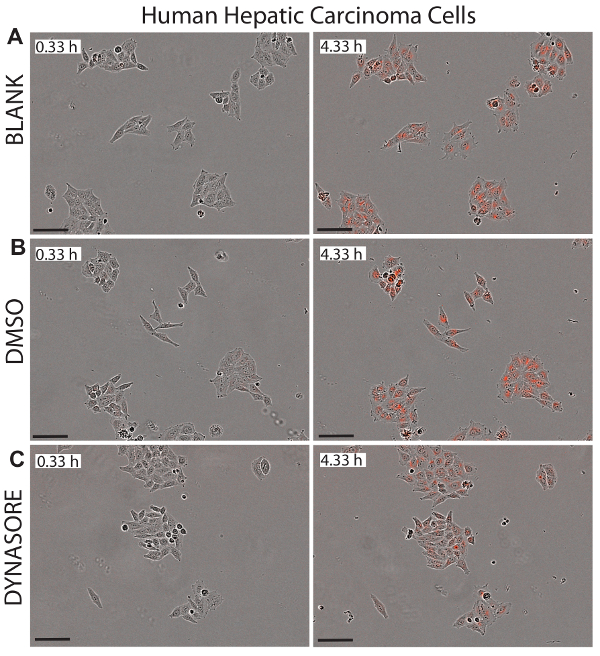
Abbildung 5 . Reduziert LDL Zustrom in hepatozellulären Karzinom (HepG2) Zellen durch LDL Aufnahme-senkende Mittel, Dynasore. Repräsentative Bilder des Phase-Objekts und rotes Objekt für HepG2-Zellen werden bei 0,33 h (linken Panels) dargestellt und der 4,33 h Endpunkt (richtigen Platten) zeigen gesunde Status der Zellen. 40 µM Dynasore, Senkung der LDL-Cholesterin-Aufnahme, bekannt als Positivkontrolle (C) verwendet wurde. Bilder wurden bei 10 X Vergrößerung. Maßstabsleiste = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6 . Reduziert LDL Zustrom in menschlichen renale tubuläre (HK2) Epithelzellen von LDL-Aufnahme-senkende Mittel, Dynasore und rPCSK9. Repräsentative Bilder des Phase-Objekts und rotes Objekt für HK2 Zellen dargestellt bei 0,33 h (linken Panels) und den Endpunkt des 4,33 h (richtigen Platten) zeigen gesunde Status der Zellen. 40 µM (C), Dynasore oder 10 µg/mL rPCSK9 (D), bekannt, LDL-Cholesterin-Aufnahme zu reduzieren wurden als Positivkontrolle verwendet. Bilder werden bei 10facher Vergrößerung aufgenommen. Maßstabsleiste = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
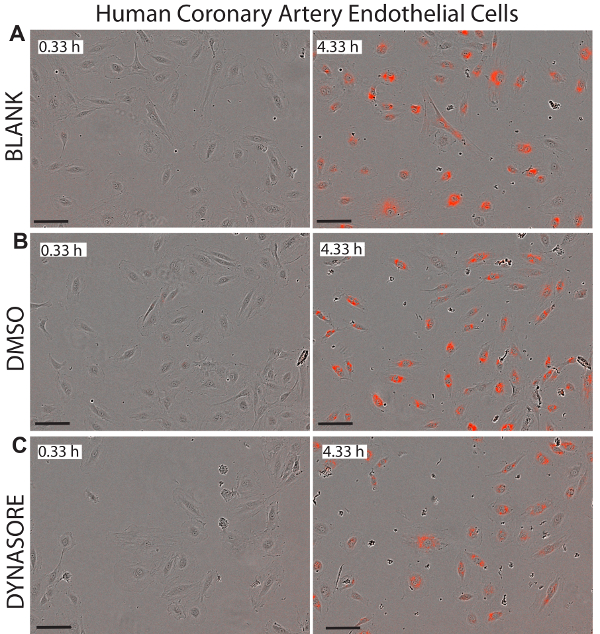
Abbildung 7 . Reduziert LDL Zustrom in menschlichen koronaren Endothelzellen (HCAECs) von LDL Aufnahme-senkende Mittel, Dynasore. Repräsentative Bilder des Phase-Objekts und rotes Objekt für HCAECs dargestellt bei 0,33 h (linken Panels) und den Endpunkt des 4,33 h (richtigen Platten) zeigen gesunde Status der Zellen. 40 µM Dynasore, Senkung der LDL-Cholesterin-Aufnahme, bekannt als Positivkontrolle (C) verwendet wurde. Bilder wurden bei 10 X Vergrößerung. Maßstabsleiste = 100 µm. Daten sind Mean±SEM. N = 6 Wells/Gruppe. Daten sind repräsentativ für 2 oder 3 unabhängigen Experimenten. Bitte klicken Sie hier für eine größere Version dieser Figur.
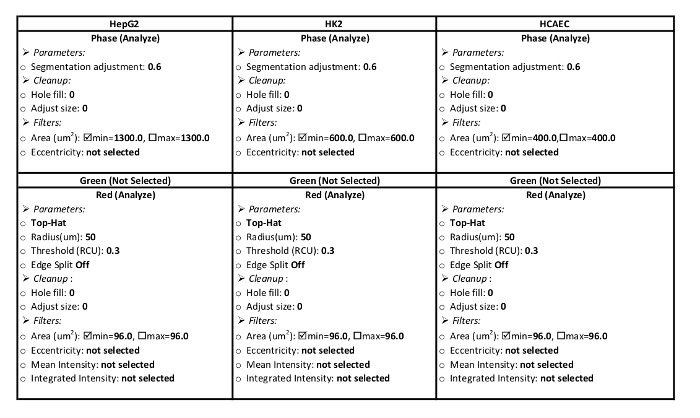
Tabelle 1: Definition Verarbeitungsparameter. Diese Parameter sind spezifisch für das Analysesystem in diesem Protokoll verwendet. Parameter ist rot im roten Kanal und der Bereich der Zelle in den Kanal Phase analysieren aufzustellen. Parametereinstellungen für HepG2, HK2, werden HCAE-Zell-Linien dargestellt.
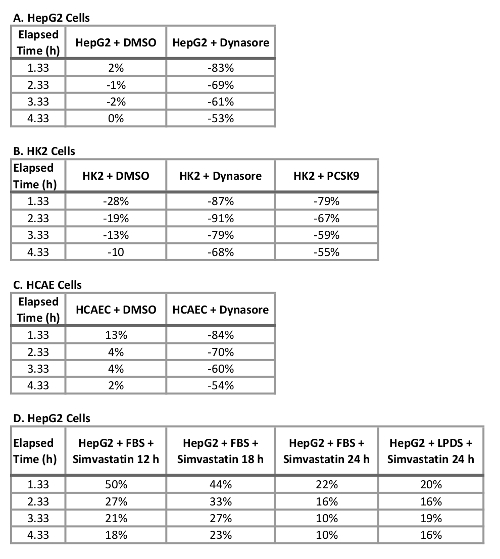
Tabelle 2: prozentuale Veränderung im LDL Zustrom in HepG2, HK2 und HCAE Zellen mit Dynasore, rPCSK9 oder Simvastatin behandelt um 4,3 h (A) HepG2 (D) HepG2-Zellen, Zellen, (B) HK2 Zellen und (C) HCAE Zellen.
Diskussion
In das aktuelle Protokoll zeigen wir Ihnen die Nutzung von live Cell Imaging als eine neue und effektivere Methode zur Messung der Echtzeit LDL-Aufnahme über einen zeitlichen Verlauf in verschiedenen humanen Zelllinien. Menschlichen hepatischen Karzinomzellen (HepG2) werden häufig in Studien screening für Cholesterin-senkende Therapie21,22,23,24,25,26verwendet, 39,40. Daher entschieden wir uns für die Prüfung der Fähigkeit eines live Cell imaging Systems für LDL Zustrom Studien dieser Zellentyp. Unsere Ergebnisse deuten darauf hin, dass HepG2-Zellen mit dieser neuen Technik und führen zu einer sigmoid-ähnliche Kurve, die kontinuierliche LDL-Aufnahme für die Dauer der Zustrom Assay bis 4,33 h als den finalen Endpunkt kompatibel sind (Abbildung 2A und Abbildung 3 ).
Cholesterin-Homöostase spielt eine wichtige Rolle in der Pathophysiologie der verschiedenen Nephropathies. In der Tat, Cholesterin-Ansammlung in renal Gewebe ist ein wesentlicher Faktor für renale Fibrose führt zu chronischer Nierenerkrankung und ist eine große Pathologie in verschiedenen Nephropathies28,29,30,31. Daher haben wir unsere Methode im menschlichen Nieren (HK2) Epithelzellen als eine beliebte und zuverlässige Zelllinie verwendet auf dem Gebiet der Nephrologie untersucht. Unsere Daten unterstützt auch die Machbarkeit des live Cell imaging Systems, LDL Zustrom in HK2 Zellen zu messen. Wie in Abbildung 2Bdargestellt, nahm HK2 Zellen LDL-Cholesterin linear während der gesamten Dauer der Zustrom Studie (4 Stunden).
Aufgrund der Bedeutung der Cholesterin-Stoffwechsel in der Entwicklung und Progression der Atherosklerose32,33,41, die führende Ursache von Herz-und Kreislauferkrankungen, die wiederum die Nummer eins Todesursache weltweit 42, wollten wir unsere Methode in einer Atherosklerose-relevanten Zelltyp zu validieren. Wir haben menschliche koronare arterielle Endothelzellen (HCAECs), sind eines der ersten Zelle Arten eine Beleidigung des Cholesterin in die Koronararterie Lumen eine Arteriosklerose-Patienten ausgesetzt werden. Unsere Daten, dargestellt in Abbildung 2C zeigt, dass diese LDL Zustrom Methode auch mit HCAECs effektiv funktioniert. Das resultierende Diagramm ist eine sigmoid-ähnliche Kurve ähnlich dem von HepG2-Zellen.
Um die Gültigkeit und die Empfindlichkeit des verbesserten LDL Zustrom Assays für das screening von Verbindungen beeinflussen LDL-Cholesterin-Aufnahme zu testen, haben wir drei Steuerelemente, LDL Aufnahme-senkende Mittel Dynasore und rPCSK9 und LDL Zustrom Aktivator Simvastatin. Hier behandelt wir die oben genannten Zelllinien (HepG2, HK2 und HCAECs) mit optimierten Konzentrationen von Dynasore oder rPCSK9 vor dem Zustrom-Assay. Unsere Resultate zeigten, dass alle drei getesteten Zelllinien auf die Behandlungen mit signifikante Reduzierung des LDL Zustrom über einen 4-Stunden-Kurs (Abbildung 2 reagierte). Zum Beispiel bei 4,33 h als der endgültige Zeitpunkt, Behandlung mit Dynasore bei 40 µM deutlich reduziert LDL Zustrom in HepG2-Zellen, HK2 Zellen und HCAECs um 53 %, 68 % bzw. 54 %, bzw. (p < 0,0001; Abbildung 2 A-C und Tabelle 2A-C). Darüber hinaus verursacht rPCSK9 bei 10 µg/mL eine deutliche Reduktion von 55 % im LDL Zustrom in HK2 Zellen (p < 0,0001; Abbildung 2 B und Tabelle 2 b). Darüber hinaus zeigten unsere Ergebnisse, dass die Behandlung von HepG2-Zellen mit Simvastatin führte zu einer deutlichen Zunahme LDL-Aufnahme (Abbildung 3), unterstützen die Empfindlichkeit dieser Methode, wesentliche Veränderungen in der LDL-Zustrom zu erkennen. Studien zur Behandlung mit rPCSK9 in HepG2 und HCAEC Zellen sind in diesem Protokoll nicht berücksichtigt, da rPCSK9 als zusätzliche Kontrollbehandlung mit gut dokumentierten Ergebnissen dient, aber teuer ist, in kleinen Mengen zu kaufen. Deshalb war rPCSK9 nur verwendet, um dieses Protokoll in HK2 Zellen zu validieren.
Live Cell imaging-Analyse, sowie die funktionale und zeitnahe Messung von LDL Zustrom, zugelassen für eine kontinuierliche Überwachung der Gesundheit und der Morphologie der Zellen. Dieser Vorteil kann effizient mögliche Zytotoxizität der angewandten Verbindungen, so dass diese Methode eine ideale Technik für die Überwachung gleichzeitig pharmakologische Aktivität und Zytotoxizität erkennen. Zahlen 5 bis 7 repräsentative Bilder der drei getesteten Zelllinien an den finalen Endpunkt (4,33 h) als visuelle Referenz für den Effekt der Behandlungen auf Netto LDL Zustrom zu veranschaulichen und zeigt auch die gesunde Morphologie der Zellen nach der getesteten Behandlungen. Wir empfehlen Sichtprüfung aller Bilder aus jedem Brunnen um die heathy Morphologie der Zellen für die Dauer der Studie zu gewährleisten. Zum Beispiel in Daten nicht angezeigt, wenn Bilder von HepG2-Zellen mit 80 μM behandelt Dynasore geprüft wurden, beobachteten wir Hinweise auf Zelle ablösen, wie die Zellränder erschien die Platte abheben, was auf Zelle Ablösung bei höheren Konzentrationen von Dynasore. Darüber hinaus induzierte hohe Konzentrationen von Simvastatin (3 – 10 μM) führte auch zu veränderten Morphologie zeigt Apoptose wie für hohe Dosierungen von Statinen45berichtet. Dieses Protokoll wurde verwendet, um eine Titrierung der Dynasore Behandlung bei 20-80 μM und Simvastatin bei 0,5-10 μM Konzentration, woraufhin die Zelle Bilder verwendet wurden, um die Gesundheit der Zellen zu analysieren und ermitteln potenzielle Ctotoxicity der Behandlungen im durchführen verschiedenen Konzentrationen. Ergebnisse vorgeschlagen, die Verwendung von 40 μM für Dyansore und 1 μM für Simvastatin als optimalen Konzentrationen.
Zu guter Letzt empfehlen wir eine Zelle Dichte Titration Studie durchführen, wenn eine andere Zell-Linie mit dieser Methode untersucht werden, Ermittlung der optimalen Zellzahl pro Bohrloch um konsistente Ergebnisse zu erhalten soll. Unsere Zelle Dichte Optimierungsstudie zeigte, dass 10.000 Zellen/Brunnen in einer 24-Well-Platte zu konsequenten LDL Zustrom Ergebnissen für HK2 und HCAE Zellen führen. Es ist wichtig zu beachten, dass für diese LDL Zustrom Assay mit live Cell imaging-System, eine Monolage von nicht-Zusammenfluss Zellen verteilt sich gleichmäßig auf die Brunnen wünschenswert ist, wie Klumpen von Zellen zu Fehlern in der normalisierten LDL Zustrom Endwerte führen können. Der Grund dafür ist, dass für die Normalisierung der Zustrom Daten, der Objektbereich Phase als Maß für die Zelldichte dient und dieser Parameter kann beeinträchtigt werden, wenn Zelle Klumpen gebildet werden. Wir beobachteten, dass HepG2-Zellen eine Tendenz zu Form Klumpen haben wenn bei dichten höher als 5.000 Zellen/Brunnen verursacht inkonsistente Zustrom Ergebnisse ausgesät; Daher haben wir 5.000 Zellen pro Bohrloch in einer 24-Well-Platte als optimale Dichte für HepG2-Zellen.
Gemeinsam, bietet unsere Methode eine mittlere-hohe Durchsatz-Plattform für das screening der pharmakologischen Aktivität und Zytotoxizität von Verbindungen gleichzeitig LDL Zustrom regulieren. Diese Methode kann für die Verwendung mit anderen Fluoreszent-markierten Liganden leicht angepasst werden, die das lysosomale Fach um Liganden Aufnahme in Echtzeit auswerten eingeben. Während dieses Protokoll bietet Spezifikationen für InCucyte live imaging und Analysesystem, das Protokoll für alternative bildgebende Systeme wie Cellomics angepasst werden kann.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Diese Arbeit wurde unterstützt durch die folgenden Zuschüsse an LAS: National Institute of Health (R56HL132209 und 1R01HL140468) und Miami Heart Research Institute. KY ist American Heart Association Predoctoral Fellow (18PRE33960070). HepG2-Zellen wurden freundlicherweise zur Verfügung gestellt von Dr. Emmanuel Thomas, Universität von Miami-Miller-Schule von Medizin46,47,48.
Materialien
| Name | Company | Catalog Number | Comments |
| pHrodo Red-LDL | ThermoFisher Scientific | L34356 | |
| HepG2 cells | E. Thomas Lab, U. Miami | HB-8065 | |
| MEM | Sigma | M0325 | |
| Sodium Pyruvate | Sigma | P5280 | |
| L-Glutamine 200 mM solution | Sigma | G7513 | |
| FBS | Atlas Biologicals | FP-0500-A | |
| HK2 cells | ATCC | CRL-2190 | |
| Keratinocyte SFM media kit | Gibco | 17005-042 | |
| Primary Coronary Artery Endothelial Cells | ATCC | PCS-100-020 | |
| Vascular Cell Basal Medium | ATCC | PCS-100-030 | |
| Endothelial Cell Growth Kit-VEGF | ATCC | PCS-100-041 | |
| Human Lipoprotein Deficient Serum | Millipore | LP4 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Trypsin-EDTA (0.05%) | Gemini Bio-Products | 400-150 | |
| Trypsin Neutralizing Solution | ATCC | PCS-999-004 | |
| 24 well plate | Falcon | 353226 | |
| 40 μM mesh cell strainer | VWR | 10199-654 | |
| 15 mL conical tubes | VWR | 89039-666 | |
| 50 mL conical tubes | VWR | 89039-658 | |
| Trypan Blue Staining (0.4%) | Life Technologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Incucyte Zoom | Sartorius | Zoom | Imaging and analysis platform |
| Dynasore Hydrate | Sigma | D7693 | |
| PCSK9 Recombinant Protein | Cayman Chemicals | 20631 |
Referenzen
- Baigent, C., et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 366 (9493), 1267-1278 (2005).
- Trevisan, R., Dodesini, A. R., Lepore, G. Lipids and renal disease. Journal of the American Society of Nephrology. 17 (4), Suppl 2 145-147 (2006).
- Tall, A. R., Yvan-Charvet, L. Cholesterol, inflammation and innate immunity. Nature Reviews Immunology. 15 (2), 104(2015).
- Dedoussis, G. V., Schmidt, H., Genschel, J. LDL-receptor mutations in Europe. Human Mutation. 24 (6), 443-459 (2004).
- Sasaki, K., et al. ATP-binding cassette transporter A subfamily 8 is a sinusoidal efflux transporter for cholesterol and taurocholate in mouse and human liver. Molecular Pharmaceutics. , (2018).
- Storch, J., Xu, Z. Niemann-Pick C2 (NPC2) and intracellular cholesterol trafficking. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1791 (7), 671-678 (2009).
- Jansen, P. J., et al. Absence of ApoE upregulates murine brain ApoD and ABCA1 levels, but does not affect brain sterol levels, while human ApoE3 and human ApoE4 upregulate brain cholesterol precursor levels. Journal of Alzheimer's Disease. 18 (2), 319-329 (2009).
- Girard, E., et al. The dynamin chemical inhibitor dynasore impairs cholesterol trafficking and sterol-sensitive genes transcription in human HeLa cells and macrophages. PLoS One. 6 (12), 29042(2011).
- Robinet, P., et al. Dynamin is involved in endolysosomal cholesterol delivery to the endoplasmic reticulum: role in cholesterol homeostasis. Traffic. 7 (7), 811-823 (2006).
- Macia, E., et al. Dynasore, a cell-permeable inhibitor of dynamin. Developmental Cell. 10 (6), 839-850 (2006).
- Benjannet, S., et al. NARC-1/PCSK9 and its natural mutants: zymogen cleavage and effects on the LDLR and LDL-cholesterol. Journal of Biological Chemistry. , (2004).
- Qian, Y. -W., et al. Secreted PCSK9 downregulates low density lipoprotein receptor through receptor-mediated endocytosis. Journal of Lipid Research. 48 (7), 1488-1498 (2007).
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Goldstein, J. L., Brown, M. S. History of discovery: the LDL receptor. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (4), 431(2009).
- Stephan, Z. F., Yurachek, E. C. Rapid fluorometric assay of LDL receptor activity by DiI-labeled LDL. Journal of Lipid Research. 34 (2), 325-330 (1993).
- Fisher, T. S., et al. Effects of pH and low density lipoprotein (LDL) on PCSK9-dependent LDL receptor regulation. Journal of Biological Chemistry. 282 (28), 20502-20512 (2007).
- Atrahimovich, D., Khatib, S., Sela, S., Vaya, J., Samson, A. O. Punicalagin induces serum low-density lipoprotein influx to macrophages. Oxidative Medicine and Cellular Longevity. 2016, (2016).
- Xu, M., et al. δ-Tocopherol reduces lipid accumulation in Niemann-Pick type C1 and Wolman cholesterol storage disorders. Journal of Biological Chemistry. 112, (2012).
- Bonilla, D. L., et al. Autophagy regulates phagocytosis by modulating the expression of scavenger receptors. Immunity. 39 (3), 537-547 (2013).
- Guo, M., et al. Apelin-13 Decreases Lipid Storage in Hypertrophic Adipocytes In vitro Through the Upregulation of AQP7 Expression by the PI3K Signaling Pathway. Medical Science Monitor : International Medical Journal of Experimental and Clinical Research. 20, 1345-1352 (2014).
- Guillemot, J., Asselin, M. C., Susan-Resiga, D., Essalmani, R., Seidah, N. G. Deferoxamine stimulates LDLR expression and LDL uptake in HepG2 cells. Molecular Nutrition & Food Research. 60 (3), 600-608 (2016).
- Javitt, N. B. Hep G2 cells as a resource for metabolic studies: lipoprotein, cholesterol, and bile acids. The FASEB Journal. 4 (2), 161-168 (1990).
- Mullen, P. J., Lüscher, B., Scharnagl, H., Krähenbühl, S., Brecht, K. Effect of simvastatin on cholesterol metabolism in C2C12 myotubes and HepG2 cells, and consequences for statin-induced myopathy. Biochemical Pharmacology. 79 (8), 1200-1209 (2010).
- McNutt, M. C., et al. Antagonism of secreted PCSK9 increases low density lipoprotein receptor expression in HepG2 cells. Journal of Biological Chemistry. 284 (16), 10561-10570 (2009).
- Scharnagl, H., et al. Effect of atorvastatin, simvastatin, and lovastatin on the metabolism of cholesterol and triacylglycerides in HepG2 cells. Biochemical Pharmacology. 62 (11), 1545-1555 (2001).
- Scharnagl, H., et al. The effects of lifibrol (K12. 148) on the cholesterol metabolism of cultured cells: evidence for sterol independent stimulation of the LDL receptor pathway. Atherosclerosis. 153 (1), 69-80 (2000).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences. 106 (24), 9820-9825 (2009).
- Ding, W., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Herman-Edelstein, M., Scherzer, P., Tobar, A., Levi, M., Gafter, U. Altered renal lipid metabolism and renal lipid accumulation in human diabetic nephropathy. Journal of Lipid Research. 55 (3), 561-572 (2014).
- Su, H., et al. Lipid Deposition in Kidney Diseases: Interplay Among Redox, Lipid Mediators, and Renal Impairment. Antioxidants & Redox Signaling. 28 (10), 1027-1043 (2018).
- Agrawal, S., Zaritsky, J. J., Fornoni, A., Smoyer, W. E. Dyslipidaemia in nephrotic syndrome: mechanisms and treatment. Nature Reviews Nephrology. 14 (1), 57(2018).
- Babiak, J., Rudel, L. L. Lipoproteins and atherosclerosis. Baillieres Clinical Endocrinology and Metabolism. 1 (3), 515-550 (1987).
- Wang, H. H., Garruti, G., Liu, M., Portincasa, P., Wang, D. Cholesterol and Lipoprotein Metabolism and Atherosclerosis: Recent Advances in Reverse Cholesterol Transport. Annals of Hepatology. 16 (1), 28-42 (2018).
- Preta, G., Cronin, J. G., Sheldon, I. M. Dynasore-not just a dynamin inhibitor. Cell Communication and Signaling. 13 (1), 24(2015).
- Horton, J. D., Cohen, J. C., Hobbs, H. H. Molecular biology of PCSK9: its role in LDL metabolism. Trends in Biochemical Sciences. 32 (2), 71-77 (2007).
- Abifadel, M., et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nature Genetics. 34 (2), 154(2003).
- Goldstein, J. L., Brown, M. S. Regulation of the mevalonate pathway. Nature. 343 (6257), 425(1990).
- Dong, B., Wu, M., Cao, A., Li, H., Liu, J. Suppression of Idol expression is an additional mechanism underlying statin-induced up-regulation of hepatic LDL receptor expression. International Journal of Molecular Medicine. 27 (1), 103-110 (2011).
- Song, K. H., Kim, Y. H., Im, A. -R., Kim, Y. H. Black Raspberry Extract Enhances LDL Uptake in HepG2 Cells by Suppressing PCSK9 Expression to Upregulate LDLR Expression. Journal of Medicinal Food. , (2018).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences of the United States of America. 106 (24), 9820-9825 (2009).
- Tabas, I., Williams, K. J., Borén, J. Subendothelial lipoprotein retention as the initiating process in atherosclerosis: update and therapeutic implications. Circulation. 116 (16), 1832-1844 (2007).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2017 update: a report from the American Heart Association. Circulation. 135 (10), 146-603 (2017).
- Brown, M. S., Goldstein, J. L. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell. 89 (3), 331-340 (1997).
- Horton, J. D., Goldstein, J. L., Brown, M. S. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. The Journal of Clinical Investigation. 109 (9), 1125-1131 (2002).
- Tavintharan, S., et al. Reduced mitochondrial coenzyme Q10 levels in HepG2 cells treated with high-dose simvastatin: A possible role in statin-induced hepatotoxicity. Toxicology and Applied Pharmacology. 223 (2), 173-179 (2007).
- Thomas, E., et al. HCV infection induces a unique hepatic innate immune response associated with robust production of type III interferons. Gastroenterology. 142 (4), 978-988 (2012).
- Thomas, E., Liang, T. J. Experimental models of hepatitis B and C-new insights and progress. Nature Reviews Gastroenterology & Hepatology. 13 (6), 362(2016).
- Yoneda, M., et al. Hepatitis B Virus and DNA Stimulation Trigger a Rapid Innate Immune Response through NF-κB. The Journal of Immunology. , 1502677(2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten