Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Agrobacterium Tumefaciens und Agrobacterium Rhizogenes-vermittelte Umwandlung der Kartoffel und die Promotoraktivität eines Suberin-Gens durch GUS Staining
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen zwei Protokolle, Kartoffelpflanzen zu verwandeln. Die Agrobacterium Tumefaciens Transformation führt zu einer kompletten transgenen Pflanze Agrobacterium Rhizogenes transgenen behaarte Wurzeln in einem Wildtyp-Shooting produziert, die selbst propagiert werden kann. Wir erkennen dann Promotoraktivität von GUS Färbung in den transformierten Wurzeln.
Zusammenfassung
Agrobakterium SP. gehört zu den am häufigsten verwendeten Methoden zu transgene Pflanzen zu erhalten, da es die Fähigkeit hat, zu übertragen und eine eigene T-DNA in das pflanzliche Genom zu integrieren. Hier präsentieren wir Ihnen zwei Transformationssysteme zur (Solanum Tuberosum) Kartoffelpflanzen gentechnisch zu verändern. A. Tumefaciens Transformation Blätter sind infiziert, die transformierten Zellen ausgewählt sind und eine neue komplette transformierte Pflanze regeneriert mit Phytohormonen in 18 Wochen. In A. Rhizogenes Verwandlung Stiele sind durch die Injektion von Bakterien mit einer Nadel infiziert, die neue entstandenen transformierten behaarte Wurzeln werden mit einem roten fluoreszierenden Marker erkannt und die nicht-transformierten Wurzeln entfernt werden. In ca. 5-6 Wochen ist die resultierende Anlage eines Verbundes aus einem Wildtyp-Shooting mit voll entwickelten transformierten behaarte Wurzeln. Um die Biomasse zu erhöhen, können die transformierten behaarte Wurzeln herausgeschnitten und selbst propagiert werden. Wir angewendet beide Agrobakterium -vermittelten Umwandlung Methoden um Wurzeln mit dem Ausdruck der GUS Reportergens angetrieben von einem Suberin biosynthetischen gen Förderer zu erhalten. Die GUS-Färbeverfahren wird zur Verfügung gestellt und ermöglicht es die Zelle Lokalisierung der Projektträger Induktion. Bei beiden Methoden zeigten die transformierten Kartoffel Wurzeln GUS Färbung im suberized Endodermis und Exodermis, und darüber hinaus in A. Rhizogenes verwandelt Wurzeln der GUS-Aktivität auch bei der Entstehung von Seitenwurzeln erkannt wurde. Diese Ergebnisse deuten darauf hin, dass A. Rhizogenes ist ein schnell alternative Werkzeug, um die Gene zu studieren, die in Wurzeln zum Ausdruck kommen.
Einleitung
Abgesehen von wirtschaftlichem Interesse hat die Erzeugung transgener Pflanzen eine eigene Bedeutung in der Forschung, um die ultimative Funktion von Genen zu demonstrieren und Pflanzenphysiologie und Entwicklung besser zu verstehen. Die am weitesten verbreitete Methode, denn Pflanze DNA-Aufnahme Agrobakterium-vermittelten Transformation. Agrobacterium Tumefaciens ist Krone Galls in das infizierte Gewebe viele Pflanzenarten durch die Einwirkung von seiner Tumor-Induktion (Ti) Plasmid zu generieren. Das Plasmid enthält eine T-DNA Region mit einer Reihe von Genen, die in das pflanzliche Genom integriert werden und induzieren Gewebe Entdifferenzierung1,2. Der Austausch dieser Gene innerhalb der T-DNA durch das Transgen ermöglichte die Generation werksbezogen Modifikationen phänotypische Effekte3zu vermeiden. Um das Transgen in die T-DNA Klonen zu erleichtern, hat die T-DNA Region in eine unabhängige Plasmid bezeichnet eine binäre Plasmid, während der Rest der Gene der Ti-Plasmid herausgeschnitten worden gewesen sein (die Virulenz-Gene, die die T-DNA-Transfer und Einfügung Mechanismen erlauben) in einem Plasmid Helfer platziert. Für Pflanzenbiotechnologieforschung, Transformation von A. Tumefaciens hat mehrere Vorteile: es braucht keine teuren Geräte, erzeugen sowohl stabil und transiente Pflanzentransformation und niedrige Zahlen des Gens Kopien integriert sind die Chromosom4. Die Generation der stabile Transformanten erfordert jedoch für die meisten Pflanzen, aber nicht, Arabidopsis Pflanze Regeneration von einem oder wenigen Zellen mit exogenen Phytohormone, macht diesen Prozess mühsam und zeitaufwendig. A. Rhizogenes ist auch in der Lage, das Pflanzengenom ändern Herstellung behaarte Wurzeln oder zufällige Wurzeln an den Standorten der Infektion durch die Expression von Rol (Wurzel Loci) Genen kodiert in den Wurzel-induzierende (Ri) Plasmid5. Obwohl weniger als A. Tumefaciensstudiert, wird A. Rhizogenes auch verwendet, für den Erhalt der transgenen Wurzeln. In diesem Fall enthält die A. Rhizogenes die original T-DNA in das Plasmid Ri und eine binäre Plasmid mit einer zweiten T-DNA tragen das Transgen. Wenn der Infektionsstelle Stängel oder Hypocotyle ist, kann ein zusammengesetztes Werk mit neuen behaarte transgenen Wurzeln aus Wildtyp-Shootings erhalten. Alternativ können behaarte transformierte Wurzeln autonom in Vitro in Medien mit Kohlenstoff Quelle Eingänge wachsen. Die Verwendung von A. Rhizogenes anstelle von A. Tumefaciens , transgene Gewebe zu produzieren ist Relevanz gewinnt, wenn die Wurzel das Zielorgan, ist weil Pflanze Regeneration nicht erforderlich ist und daher es schneller und weniger kostspielig ist. Frühere Studien zeigten diese Methodik für die phänotypische Charakterisierung der Wurzel bestimmter Gene6,7,8,9angeeignet.
Die Kartoffel (Solanum Tuberosum) ist die viertwichtigste Kulturpflanze der Welt laut der Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen (FAO) seit die Knolle ernährungsphysiologische Bedeutung für den menschlichen Verzehr als eine gute Quelle für Vitamine und Mineralien. Aus diesem Grund Kartoffel im Rampenlicht der landwirtschaftlichen Biotechnologie gelegt und gilt auch als ein gutes biologisches Modell für genetische und Entwicklungsbiologie10,11Studien. Kartoffel-Transformation trug wesentlich zum Verständnis der molekularen Mechanismen zugrunde liegenden suberized Gewebe durch die Charakterisierung von Genen beteiligt Suberin und Wachs Biosynthese12,13,14 ,15,16,17, Suberin Monomer Transport18 und Transkription Verordnung19. Das Suberin-Feruloyl-Transferase-gen, FHT, ist eines dieser charakterisiert biosynthetischen Gene; die Herunterregulierung gibt Anlass zu einer starken Beeinträchtigung des Schutzes Periderm, die mit einem starken Rückgang der ferulate Ester von Suberin und Wachse in Kartoffel Knollen14korreliert ist. Begleitend in Wurzeln und Samen von Arabidopsis zeigte der Ko von seiner vermeintlichen orthologs (ASFT/RWP1) auch seine Rolle in der Herstellung von Alkyl Ferulates Suberin20,21. In der Kartoffel zeigte die FHT transkriptionelle Reporter-Linie und der FHT-Antikörper bzw., dass die Promotoraktivität und das Protein in der Exodermis, die Endodermis der Phellogen-Derivate und verletzte Gewebe15befinden.
In dieser Arbeit zeigen wir ein Protokoll mit A. Rhizogenes transgenen behaarte Wurzeln produzieren, die in einem Wild-Typ-Shooting gepflegt sind, generiert composite Kartoffelpflanzen oder herausgeschnitten, um autonom in Vitrowachsen. Wir bieten auch das Protokoll mit A. Tumefaciens , um komplette transgenen Kartoffelpflanzen zu erhalten. Als Fallstudie werden A. Rhizogenes und A. Tumefaciens verwandelt mit der gleichen binären Vektor verwendet, um die Wurzeln mit dem FHT -Promotor fahren GUS -Reporter-gen-Expression zu erhalten. Die Ergebnisse sind gemeldet und verglichen.
Protokoll
A. Rhizogenes Umwandlung Protokoll wurde angepasst und modifiziert von Horn Et Al.7 und der Genotyp getestet wurde S. Tuberosum Ssp. Tuberosum (CV Désirée). A. Tumefaciens Umwandlung Protokoll wurde angepasst und geändert von Banerjee Et Al.22 und die Genotypen getestet wurden S. Tuberosum Ssp. Tuberosum (CV Désirée) und S. Tuberosum SSP. Andigena. Die wichtigsten Schritte der beiden Verfahren sind in Abbildung 1 und Abbildung 2, bzw. zusammengefasst.
Hinweis: In allen Phasen des Verfahrens, die Durchführung von in-vitro- Transfers schnell zu tun, und wenn möglich, beibehalten der Teller oder Töpfe geschlossen, somit minimieren Anlage in die Luft, welken und Kontamination zu vermeiden. Anders angegeben, wurden alle Pflanze Inkubationen in Schränken unter den Bedingungen des 12 h von 24 ° C Licht/12 h 20 ° C dunkel und 67 µmol m-1 s-1durchgeführt. Führen Sie anders angegeben, alle Bakterien Manipulation und in-vitro- Pflanzen Transfers unter aseptischen Bedingungen in einer Laminar-Flow-Haube. Die Medien-Rezepte für Agrobacterium und in-vitro- Pflanzen-Kulturen sind in Tabelle S1vorgesehen.
Vorsicht: Hinterlegen Sie alle gentechnisch veränderten Bakterien und Pflanzen, um die entsprechenden Abfallbehälter.
1. Agrobacterium Kulturen für die Transformation verwendet
Hinweis: Der Stamm für A. Rhizogenes Transformation verwendet wurde die C58C1:Pri15837 (freundlicherweise zur Verfügung gestellt von Dr. Inge Broer) und das für die A. Tumefaciens war die GV2260 (freundlicherweise zur Verfügung gestellt von Dr. Salomé Prat). A. Rhizogenes wandelte sich mit der binären Vektor PK7GWIWG2_II-RedRoot (VIB-Abteilung der Pflanze Systembiologie an der Universiteit Gent; http://gateway.psb.ugent.be), die eine T-DNA tragen einen Transformation Marker zur Überwachung der behaarte Wurzel enthält Bildung. Um die transformierten Wurzeln von A. Rhizogenes und A. Tumefacienserzeugt zu vergleichen, wurden beide mit binären Vektor pKGWFS7 transformiert enthält eine T-DNA tragen der FHT-Promoter fahren das Reportergen β-Glucoronidase (GUS) und Kanamycin-Resistenz-Gen wie eine auswählbare Markierung15.
- Wählen Sie eine Kolonie von Agrobacterium und wachsen sie über Nacht (O/N) in einem 50 mL Zentrifugenröhrchen bei 28 ° C mit Schütteln bei 200 u/min in 5 mL YEB Medium mit Antibiotika (Tabelle S1) ergänzt.
- Für A. Tumefaciens Transformation, Messung die optische Dichte, die OD600 sein muss = 0,6-1,0.
- Wenn die optische Dichte höher ist, machen eine Subkultur auf OD600 senken = 0,3 mit frischen Medien und warten, bis die Kultur OD600 erreicht = 0,6-1.
- Zentrifugieren Sie 1 mL Agrobacterium Kultur bei 3.000 X g in einer Benchtop-Zentrifuge für 10 min bei Raumtemperatur.
- Entfernen des Überstands durch pipettieren und Aufschwemmen Zellen in 1 mL frisches YEB Medium ohne Antibiotika. Wiederholen Sie diesen Schritt, um die vollständige Entfernung von Antibiotika zu gewährleisten.
- A. Tumefaciens Transformation, in der letzten Wiederfreisetzung hinzufügen der entsprechende YEB Volumen um eine endgültige optische Dichte OD600 zu erhalten = 0,8.
- Halten Sie Zellen auf Eis, während der Vorbereitung der Pflanzen infiziert werden.
(2) Pflanzenmaterial für transformation
- Machen Sie ein oder zwei Knoten Stamm Stecklinge entweder mit der apikalen oder die Hilfs Knospen von sterilen in Vitro Kartoffelpflanzen (Spenderpflanzen); für 3 bis 4 Wochen (Abbildung 1A und Abbildung 2A) in festen 2MS Medium in Töpfen wachsen.
3. Pflanzen Sie Transformation mit A. Rhizogenes (Abbildung 1)
Hinweis: Dieses Verfahren ermöglicht die Erlangung der transformierten behaarte Wurzeln. Um die Expression des Transgens zu bewerten, braucht man eine Negativkontrolle. Vorbereiten der Negativkontrolle, folgen den Anweisungen, die mit einer A. Rhizogenes Sorte entweder untransformierten oder mit leerer Vektor transformiert, das Markergen Transformation enthält.
- Verwenden Sie frische Medien Platten; Alternativ können die Platten bei 4 ° C mit dem Deckel nach oben, dicht mit Klarsichtfolie um Medien Dehydrierung zu vermeiden gehalten werden. Um den quadratischen Medien Platten vorzubereiten, neigen sie ~ 15°, füllen sich mit 40 mL von MS, und ließ sie erstarren. Dies minimiert den Kontakt der Luft Teil der Pflanze mit dem Medium.
- Sehr sorgfältig eine Spender-Pflanze aus dem 2MS Medium zum Übertragen einer quadratischen Platte 120 mm x 120 mm
- Zu einem Stamm Internodium 3 μL der A. Rhizogenes Kultur mit einer chirurgischen Nadel injiziert, und wiederholen Sie es zweimal pro Pflanze in verschiedenen Internodien wenn möglich.
Bitte beachten Sie jeder Injektion als unabhängige Transformationsereignis (Abbildung 1 b). - Übertragen Sie sofort die gesamte Anlage auf eine quadratische Platte mit festem MS Medium mit 0,1 mM Acetosyringone ergänzt. Platz für 2 Pflanzen pro Platte.
Hinweis: Die 1 M Acetosyringone Stammlösung wird in DMSO vorbereitet und kann bei-20 ° c gelagert werden - Die Dichtplatte mit chirurgischen Klebeband und ordnen sie vertikal im Inneren ein Wachstum Schrank für 4 Tage.
- Übertragen Sie die Pflanze auf eine neue quadratische Platte mit MS Medium ergänzt mit Cefotaxim Natrium [500 µg/mL], A. Rhizogeneszu töten.
- Nach 10-12 Tagen startet behaarte Wurzeln (Abbildung 1,1D) angezeigt werden. Dann, Verbrauchsteuern Sie die native Wurzeln der Pflanze, und übertragen Sie die Anlage auf eine neue quadratische Platte mit MS Medium ergänzt mit Cefotaxim Natrium [500 µg/mL].
Hinweis: Transformierte behaarte Wurzeln können durch rote Fluoreszenz überprüft werden, wenn Sie einen DsRed Transformation Marker (Abbildung 3D) zu verwenden. - Um ein zusammengesetztes Werk (Abbildung 1E) zu erhalten, lassen Sie die transgenen behaarte Wurzeln wachsen seit ca. 3-4 Wochen in MS Medium ergänzt mit Cefotaxim Natrium [500 μg/mL] (das Medium wechseln jede Woche).
- Je nach Verwendungszweck propagieren Sie die transgenen behaarte Wurzeln und den Negativkontrollen wie folgt.
- Übertragen Sie die ganze zusammengesetzte Pflanze auf eine Hydrokultur (Tabelle S2) oder Boden-Medium für massive Entwicklung ermöglichen.
- Um individuell die transformierten behaarte Wurzeln ausbreiten, mit einem Skalpell schneiden Sie die Wurzeln mit dem Ausdruck des Markers rot fluoreszierende Transformation (DsRed Protein) Wenn sie 4 bis 8 cm lang (Abb. 1E) und übertragen Sie sie in eine Petrischale mit festem Medium Gamborg B5 mit 2 % Saccharose und Cefotaxim Natrium [500 μg/mL] ergänzt. Versiegeln Sie die Platten mit Kunststofflabor Film zu und wachsen sie im Dunkeln bei 20 ° C.
Hinweis: Die Wurzeln können manipuliert werden, unter einem Stereomikroskop ausgestattet, um die Fluoreszenz unter sterilen Bedingungen erkennen (siehe Tabelle der Materialien). - Für die Erzeugung von Biomasse (z.B. gen Expressionsanalyse) eine 5 cm langen behaarten Wurzel schneiden und in einer 150 mL Erlenmeyerkolben mit 20 mL des flüssigen Mediums Gamborg B5 ergänzt mit 2 % Saccharose und Cefotaxim Natrium [500 µg/mL] zu verbreiten. Für 6 Wochen im Dunkeln bei 20 ° C und 60 u/min wachsen.
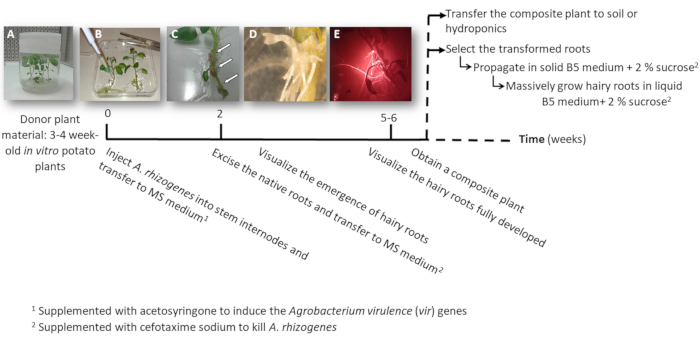
Abbildung 1: Timeline zu Kartoffel transgenen behaarte Wurzeln mit A. Rhizogenes. Die kumulative Wochen zu jeder Phase des Transformationsprozesses und die nachfolgenden Schritte, die haarigen Wurzeln wachsen werden angezeigt. Repräsentative Bilder von verschiedenen Phasen dargestellt: die Einleitung des Prozesses mit 3 Wochen altes Baby in-vitro- Pflanzen (A), dann Infektion der Pflanzen durch die Injektion von A. Rhizogenes (B), die Bildung von der proliferativen Gewebe (C, Pfeile) mit aufstrebenden behaarte Wurzeln (D), und die entwickelten behaarte Wurzeln rot fluoreszierende Transformation Marker DsRed (E) zum Ausdruck zu bringen. Bitte klicken Sie hier für eine größere Version dieser Figur.
4. Pflanzen Sie Transformation mit A. Tumefaciens (Abbildung 2)
Hinweis: Dieses Verfahren ermöglicht die Erlangung der transformierten Pflanzen. Um das Transgen Effekt zu bewerten, braucht man eine Negativkontrolle. Eine Möglichkeit ist, das Verfahren mit einer A. Tumefaciens mit leerer Vektor transformiert zu folgen. Alternativ können die Wildtyp-Pflanzen verwendet werden.
- Schneiden Sie und legen Sie ein Blatt aus den 3-4 Wochen alten Pflanzen (Abbildung 2A) in einer Petrischale. Mit einem Skalpell schließen Sie der Blattstiel aus und kürzen Sie quer (1-3 je nach Blattgröße) von der Mitte des Blattes auf die Kanten vermeiden sie abzuschneiden (Abb. 2 b).
- Sofort legen Sie das Blatt schwimmt auf 10 mL frisches 2MS flüssige Medien in einer Petrischale mit der abaxial Seite oben und schließen Sie die Platte. Wiederholen Sie der Schritt, die Platz für bis zu 15 Blätter für CV Désirée und 25 Blätter für SSP einNdigena (abhängig von der Blattgröße).
- Fügen Sie sofort 80 µL A. Tumefaciens Kultur am OD600 = 0,8 in flüssigen Medien und homogenisieren die Platte manuell für 1 min um die bakterielle Lösung zu verteilen.
- Sorgfältig mit Film Abdichtung dichten Sie ab, mit Alufolie decken Sie ab und inkubieren Sie für 2 Tage in einer Kammer bei 24 ° C, die Transformation auftreten zu lassen.
- Übertragen Sie die Blätter halten abaxial Seite bis zum CIM Medium (Abb. 2 b) und inkubieren sie für eine Woche im Kabinett ein Wachstum.
- Kratzen Sie das CIM-Medium mit der Pinzette, so dass die Blätter auf dem Medium besser untergebracht werden können.
- Übertragen Sie die Blätter halten abaxial Seite bis zum SIM-Medium (Abbildung 2) und inkubieren sie in einem Schrank, erfrischend das Medium alle 7-10 Tage, bis die Triebe sind ca. 2 cm hoch Wachstum.
- Kratzen Sie SIM-Medium mit der Pinzette, so dass die Blätter vollständig von den Medien umgeben sein können. Wenn die entstandenen Triebe den Deckel erreichen, arbeiten mit hohen Petrischalen (100 x 20 mm, Höhe x Durchmesser).
Hinweis: Die Hornhaut wird nach 2-3 Wochen in SIM-Medium (Abb. 2D) und die Triebe nach 6-7 Wochen (Abbildung 2E) bilden. Die Triebe gelten als unabhängige Transformation Ereignisse aus, wenn sie von Kallus gebildet aus unabhängigen Wunden entstehen.
- Kratzen Sie SIM-Medium mit der Pinzette, so dass die Blätter vollständig von den Medien umgeben sein können. Wenn die entstandenen Triebe den Deckel erreichen, arbeiten mit hohen Petrischalen (100 x 20 mm, Höhe x Durchmesser).
- Schnitt drei schießt aus jeder Kallus (als das gleiche Transformationsereignis) entstanden (Abb. 2E), Transfer, Kulturflaschen mit MG Medium ergänzt mit Cefotaxim Natrium [250 mg/L] erlauben, Verwurzelung, beschriften Sie die Teilmenge mit einer Reihe und inkubieren Sie in einen Schrank für 3-4 Wochen oder bis die Triebe kräftig (Abb. 2F) Wachstum.
Hinweis: Wenn die Triebe schneiden, entfernen Sie auch die Hornhaut sonst die Wurzel nicht bilden.- Wiederholen Sie den Schritt so oft wie unabhängige Linien benötigt werden. Bis zu 5 verschiedenen Transformation können Veranstaltungen platziert werden, in einem Kultur-Kolben mit einem Durchmesser von 8 cm, vertrauensvoll zu arbeiten, die die Pflanzen aus verschiedenen Veranstaltungen nicht gemischt werden.
- Wählen Sie die kräftigste Pflanze jedes Ereignisses, schneiden Sie die apikale Segment des Shootings mit 3-4 Internodien und legen Sie sie in eine neue Kultur-Kolben mit 2MS Medium mit Cefotaxim Natrium [250 mg/L] ergänzt.
Hinweis: In 3-6 Wochen wachsen die Pflanzen effizient entwickeln, ein kräftiges Shooting und Wurzeln.- Zurückbringen der Kammer die nicht ausgewählten Triebe bis die ausgewählte Pflanze voll entwickelt hat.
- Geschnitten Sie Stamm Segmente aus der Pflanze mit mindestens einem Internodium oder mit der apikalen Knospe und übertragen Sie sie auf neue 2MS Medium mit Cefotaxim [250 mg/L] ergänzt. Inkubieren sie im Kabinett Wachstum.
- Replizieren Sie alle 3-4 Wochen um die in-vitro- umgewandelt-Linien zu etablieren.
Hinweis: Das Cefotaxim Natrium wird in mindestens drei nachfolgenden Überweisungen auf 2MS Medium um sicher zu sein benötigt, A. Tumefacienszu töten; Danach, wenn A. Tumefaciens Überwucherung zu beobachten ist, übertragen Sie die Pflanzen wieder auf 2MS Medien ergänzt mit Cefotaxim Natrium.
- Replizieren Sie alle 3-4 Wochen um die in-vitro- umgewandelt-Linien zu etablieren.
- Um die Pflanze Phänotyp zu charakterisieren, übertragen Sie Pflanzen in Erde für ihre vollständige Charakterisierung oder Hydrokultur Kultur zur Wurzel Inspektion.
- Halten Sie die Knollen im Boden zu propagieren und behalten die etablierten Linien produziert.

Abbildung 2: Timeline zu Kartoffel verwandelt Pflanzen mit A. Tumefaciens. Die kumulative Wochen, jede Phase des Transformationsprozesses und die nachfolgenden Schritte, die Pflanzen wachsen zu erreichen sind gezeigt. Repräsentative Bilder von verschiedenen Phasen dargestellt: die Einleitung des Prozesses mit Blätter aus 3 - Wochen alten in-vitro- Pflanzen (A), die Übertragung der Verwundeten und infizierten Blätter an die CIM-Medien (B), die Blätter bei der Übertragung auf SIM-Medien (C), die Visualisierung der Kallus um die verwundeten Bereiche nach 2-3 Wochen in SIM-Medien (D), die schießen-Bildung nach 9-11 Wochen in SIM-Medien (E) und die Triebe nach MG Medien (F) übertragen werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
5. Hydrokultur
- Bereiten Sie die Hoagland Lösung um eine halbe Stärke (0,5 X) (Tabelle S2) in einen 10 L Eimer.
- Tauchen Sie eine Aquariumpumpe um Homogenität und ordnungsgemäße Sauerstoffbedingungen beizubehalten.
- Bedecken Sie die Wände des Eimers mit Alu-Folie, Wurzeln im Dunkeln wachsen.
- Übertragen Sie Vermeidung von Wurzelschäden, in-vitro- Pflanzen auf Hydrokultur.
Hinweis: Entfernen Sie alle verbleibenden in-vitro- Medium aus Wurzeln, Mikroorganismus Verbreitung während der Inkubation durch Schütteln sorgfältig die Wurzeln in Wasser getaucht zu vermeiden. - Decken Sie die Pflanzen mit transparenter Folie wie ein Gewächshaus, damit ausreichende Akklimatisierung und in der wachsenden Kammer inkubieren.
- Machen Sie Löcher in die Folie nach 3 Tagen und entfernen Sie es komplett eine Woche nach.
- Ersetzen Sie durch neue Medien alle 10 Tage.
6. GUS histochemische Reporter-gen-Test
Hinweis: In unserem Fall die GUS erfolgte Analyse mit Wurzeln von 2-3 Wochen in Hydrokultur oder in Vitrogewachsen.
- Befestigen Sie die Wurzeln mit 90 % gekühlt Aceton (V/V) und inkubieren Sie es 20 Minuten lang auf Eis.
- Führen Sie zwei Wäschen mit destilliertem Wasser.
- Fügen Sie frische GUS Färbelösung (Tabelle 1) und gelten Vakuum (-70 Pa) für 20 Minuten.
- Inkubation bei 37 ° C im Dunkeln zum Schutz der lichtempfindlichen GUS für 4 h oder bis eine blaue Farbe sichtbar ist.
Hinweis: Das Vorhandensein von Ferri und Ferrocyanid in GUS Lösung minimieren die Diffusion von Reaktionsprodukten und liefern genauere Lokalisierung.
Achtung: Verwenden Sie eine Abzugshaube und Schutzkleidung beim Umgang mit der giftige Zyanid-Derivate in GUS-Lösung (Kalium Ferricyanid und Kaliumferrocyanid). Das GUS-Substrat und die Entsorgung Material sollte sicher entsorgt werden. - GUS Färbelösung zu entfernen und in entsprechenden Behältern entsorgen.
- Führen Sie zwei Wäschen mit Ethanol 70 % (V/V).
- Unter dem Hellfeld-Mikroskop beobachten.
Hinweis: GUS Färbung bleibt für ein paar Wochen relativ stabil. jedoch während der ersten Woche der GUS-Signal ist klar und weniger ins benachbarte Zellen diffundiert. Bei längerer Lagerung das Rohr zu versiegeln und bei 4 ° c lagern
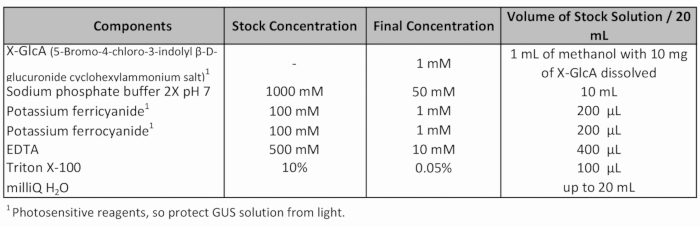
Tabelle 1: GUS Färbung Lösung Rezept.
Ergebnisse
Agrobacterium rhizogenes -vermittelte Umwandlung der Kartoffel
In diesem Manuskript präsentiert das Schritt für Schritt Verfahren eingerichtet, um transformierte Wurzel mit A. Rhizogenes zu erhalten. Abbildung 1 zeigt eine Übersicht über das Verfahren, das insgesamt rund 5 bis 6 Wochen (von Injektion von A. Rhizogenes dauert , ausgerei...
Diskussion
In Kartoffel benutzt die häufigste System stabilere komplette transgene Pflanzen erhalten die Transformation durch Agrobacterium Tumefaciens Stämme, die Organogenese mit exogenen Phytohormone erfordern. Obwohl die Agrobacterium basierte Protokolle hat das Potenzial, T-DNA-Vektor Sequenz25zu integrieren, steht diese Methode immer noch die einfachste und weniger teuer Kartoffelpflanzen zu verwandeln. In letzten Jahren das Interesse an A. Rhizogenes-vermittelten Transform...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenlegen.
Danksagungen
Diese Arbeit wurde von dem Ministerio de Innovación y Ciencia (AGL2009-13745, FPI Grant, PB), Ministerio de Economía y Competitividad und FEDER Mittel (AGL2012-36725, AGL2015-67495-C2-1-R) und der Universität Girona (Promotionsstipendium an SF und Grant unterstützt. SING11/1). Die Autoren sind dankbar, dass Dr. Inge Broer (Institut für Landnutzung, Universität Rostock, Rostock, Deutschland) und Dr. Salomé Prat (Centro Nacional de Biotecnología, Madrid, Spanien) für die Bereitstellung der A. Rhizogenes und A. Tumefaciens Belastung, bzw., und Dr. Marçal Soler und Dr. Anna Plasencia für die Hilfe und Unterstützung bei der Einleitung von A. Rhizogenes Transformation Experimente (Toulouse III Universität Paul Sabatier-CNRS, Plant Research Laboratory (LRSV), Kastagnetten eine (Frankreich). Die Autoren danken Sara Gómez (Departament de Biologia, UdG, Girona) für ihre wertvolle Unterstützung bei der Durchführung der Laborarbeit und die Betreuung der Pflanzen, und Ferran Fontdecaba und Carla Sánchez, die unterstützt mit einige der Experimente, während sie dabei waren Ihre endgültige Diplomarbeiten.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetone | Panreac | 1.310.071.21 | |
| Acetosyringone | Acros | 115540050 | |
| Aquarium pump | Prodac | MP350 | |
| Autoclave | Ragpa Strelimatic | ||
| Bacteriological agar | Lab Conda | 1800 | |
| BAP | Duchefa | B0904 | |
| Beef extract | Lab Conda | 1700 | |
| Plant growing cabinet | Nuaire | ||
| Carbenicillin | Duchefa | C0109 | |
| Cefotaxime sodium | Duchefa | C0111 | |
| DMSO | Merck | 1029310161 | |
| Ecotron infors | HT | 29378 | |
| Ethanol | Merck | 1,009,831,011 | |
| Falcon tube | Control tecnica | CFT011500 | |
| Ferricyanate | Sigma | 101001081 | |
| Ferrocyanate | Sigma | 100979088 | |
| Flask (8.06 cm diameter and 11.3 cm height) and plastic lid for in vitro culture | Apiglass | ref16 | |
| GA3 | Sigma | G7645 | |
| Gamborg B5 media | Duchefa | G0210 | |
| Gelrite | Duchefa | G1101 | |
| Glucosa | Sigma | G5767 | |
| Kanamycin | Sigma | K1377 | |
| Leukopor tape | BSN Leukopor | BDF47467 | |
| Lupe | Wild-Heerbrugg | M420 | |
| Magnetic shaker | Agimatic | 7000243 | |
| MES hydrate | Sigma | M2933-25G | |
MgSO4 | Panreac | 131404 | |
| Microscope | Olympus | ||
| Minufugue centrifugue 5415R | Eppendorf | ||
| Murashige and Skoog media | Duchefa | M0254.0050 | |
Na2HPO4 | Panreac | 131679 | |
| NAA | Duchefa | N0903 | |
| NaCl | Panreac | 131659 | |
NaH2PO4 | Sigma | 58282 | |
| NightSea Stereo | SFA Moonting Adapter | ||
| Parafilm | Anorsa | PRFL-001-001 | |
| Peptone | Lab Conda | 1616 | |
| Petri dishes (90 x 14) | Anorsa | 200200 | |
| pHmetre | Crison | ||
| Phytotron | Inkoa | RFTI-R5485 | |
| Plant Agar | Duchefa | P1001 | |
| Refrigeratot | Liebherr Medline | ||
| Rifampicin | Duchefa | R0146 | |
| Spectinomycin | Sigma | 59007 | |
| Spectrophotometer | Shimadzu | ||
| Square plates (120 x 120) | Deltalab | 200204 | |
| Streptomycin | Sigma | S6501 | |
| Sucrose | Panreac | 131621 | |
| Surgical blades | Swann-Morton | 201 | |
| Surgical needle | NIPRO | 015/0204 | |
| Triptone | Lab Conda | 1612 | |
| Triton | Serva | 37240 | |
| Unimax 1010 shaker | Heidolph | ||
| Vacuum | Dinko | ||
| x-GlcA (5-Bromo-4-chloro-3-indoxyl-beta-D-glucuronic acid, sodium salt anhydrous) | Biosynth | B-7398 | |
| Yeast extract | Lab Conda | 1702.00 | |
| Zeatin riboside | Sigma | 1001042850 |
Referenzen
- Gelvin, S. B. Traversing the Cell: Agrobacterium T-DNA's journey to the host genome. Frontiers in Plant Science. 3, 1-11 (2012).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. The International Journal of Developmental Biology. 57 (6-8), 467-481 (2013).
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Ishida, Y., et al. High efficiency transformation of maize (Zea mays L.) mediated by Agrobacteriumtumefaciens. Nature Biotechnology. 14 (6), 745-750 (1996).
- White, F. F., Taylor, B. H., Huffman, G. A., Gordon, M. P., Nester, E. W. Molecular and genetic analysis of the transferred DNA regions of the root-inducing plasmid of Agrobacterium rhizogenes. Journal of Bacteriology. 164 (1), 33-44 (1985).
- Dinh, P. T. Y., Brown, C. R., Elling, A. A. RNA Interference of effector gene Mc16D10L confers resistance against Meloidogyne chitwoodi in Arabidopsis and Potato. Phytopathology. 104 (10), 1098-1106 (2014).
- Horn, P., et al. Composite potato plants with transgenic roots on non-transgenic shoots: a model system for studying gene silencing in roots. Plant Cell Reports. 33 (12), 1977-1992 (2014).
- Plasencia, A., et al. Eucalyptus hairy roots, a fast, efficient and versatile tool to explore function and expression of genes involved in wood formation. Plant Biotechnology Journal. 14 (6), 1381-1393 (2015).
- Ron, M., et al. Hairy root transformation using Agrobacteriumrhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model. Plant Physiology. 166 (2), 455-469 (2014).
- Zhang, W., et al. Development and application of a universal and simplified multiplex RT-PCR assay to detect five potato viruses. Journal of General Plant Pathology. 83 (1), 33-45 (2017).
- Almasia, N. I., et al. Successful production of the potato antimicrobial peptide Snakin-1 in baculovirus-infected insect cells and development of specific antibodies. BMC Biotechnology. 17 (1), 1-11 (2017).
- Serra, O., et al. Silencing of StKCS6 in potato periderm leads to reduced chain lengths of suberin and wax compounds and increased peridermal transpiration. Journal of Experimental Botany. 60 (2), 697-707 (2009).
- Serra, O., et al. CYP86A33-Targeted gene silencing in potato tuber alters suberin composition, distorts suberin lamellae, and impairs the periderm's water barrier function. Plant Physiology. 149 (2), 1050-1060 (2008).
- Serra, O., et al. A feruloyl transferase involved in the biosynthesis of suberin and suberin-associated wax is required for maturation and sealing properties of potato periderm. The Plant Journal. 62 (2), 277-290 (2010).
- Boher, P., Serra, O., Soler, M., Molinas, M., Figueras, M. The potato suberin feruloyl transferase FHT which accumulates in the phellogen is induced by wounding and regulated by abscisic and salicylic acids. Journal of Experimental Botany. 64 (11), 3225-3236 (2013).
- Serra, O., Chatterjee, S., Figueras, M., Molinas, M., Stark, R. E. Deconstructing a plant macromolecular assembly: chemical architecture, molecular flexibility, and mechanical performance of natural and engineered potato suberins. Biomacromolecules. 15 (3), 799-811 (2014).
- Vulavala, V. K. R., et al. Identification of genes related to skin development in potato. Plant Molecular Biology. 94 (4-5), 481-494 (2017).
- Landgraf, R., et al. The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm. The Plant Cell. 26 (8), 3403-3415 (2014).
- Verdaguer, R., et al. Silencing of the potato StNAC103 gene enhances the accumulation of suberin polyester and associated wax in tuber skin. Journal of Experimental Botany. 67 (18), 5415-5427 (2016).
- Molina, I., Li-Beisson, Y., Beisson, F., Ohlrogge, J. B., Pollard, M. Identification of an Arabidopsis feruloyl-coenzyme A transferase required for suberin synthesis. Plant Physiology. 151 (3), 1317-1328 (2009).
- Gou, J. Y., Yu, X. -. H., Liu, C. J. A hydroxycinnamoyltransferase responsible for synthesizing suberin aromatics in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18855-18860 (2009).
- Banerjee, A. K., Prat, S., Hannapel, D. J. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Science. 170 (4), 732-738 (2006).
- Sunil Kumar, G. B., Ganapathi, T. R., Srinivas, L., Revathi, C. J., Bapat, V. a. Expression of hepatitis B surface antigen in potato hairy roots. Plant Science. 170 (5), 918-925 (2006).
- Schmidt, J. F., Moore, M. D., Pelcher, L. E., Covello, P. S. High efficiency Agrobacteriumrhizogenes-mediated transformation of Saponariavaccaria L. (Caryophyllaceae) using fluorescence selection. Plant Cell Reports. 26 (9), 1547-1554 (2007).
- Petti, C., Wendt, T., Meade, C., Mullins, E. Evidence of genotype dependency within Agrobacteriumtumefaciens in relation to the integration of vector backbone sequence in transgenic Phytophthorainfestans-tolerant potato. Journal of Bioscience and Bioengineering. 107 (3), 301-306 (2009).
- Gaudin, V., Vrain, T., Jouanin, L. Bacterial genes modifying hormonal balances in plants. Plant Physiology and Biochemistry. 32 (1), 11-29 (1994).
- Nemoto, K., et al. Function of the aux and rol genes of the Ri plasmid in plant cell division in vitro. Plant Signaling &. Behavior. 4 (12), 1145-1147 (2009).
- Visser, R. G. F., et al. Expression and inheritance of inserted markers in binary vector carrying Agrobacteriumrhizogenes-transformed potato (Solanumtuberosum L.). Theoretical and Applied Genetics. 78 (5), 705-714 (1989).
- Guillon, S., Trémouillaux-Guiller, J., Pati, P. K., Rideau, M., Gantet, P. Hairy root research: recent scenario and exciting prospects. Current Opinion in Plant Biology. 9 (3), 341-346 (2006).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Ooms, G., Lenton, J. R. T-DNA genes to study plant development: precocious tuberisation and enhanced cytokinins in A. tumefaciens transformed potato. Plant Molecular Biology. 5 (4), 205-212 (1985).
- de Vries-Uijtewaal, E., et al. Fate of introduced genetic markers in transformed root clones and regenerated plants of monohaploid and diploid potato genotypes. TAG. Theoretical and applied genetics. 78 (2), 185-193 (1989).
- Bird, D., et al. Characterization of Arabidopsis ABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal: For Cell and Molecular Biology. 52 (3), 485-498 (2007).
- Luo, B., Xue, X. Y., Hu, W. L., Wang, L. J., Chen, X. Y. An ABC transporter gene of Arabidopsis thaliana, AtWBC11, is involved in cuticle development and prevention of organ fusion. Plant and Cell Physiology. 48 (12), 1780-1802 (2007).
- Panikashvili, D., et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiology. 145 (4), 1345-1360 (2007).
- Panikashvili, D., et al. The Arabidopsis DSO/ABCG11 transporter affects cutin metabolism in reproductive organs and suberin in roots. Molecular Plant. 3 (3), 563-575 (2010).
- Bjelica, A., et al. Fatty acid ω-hydroxylases from Solanum tuberosum. Plant Cell Reports. 35 (12), 2435-2448 (2016).
- Ding, Y., et al. Abscisic acid coordinates nod factor and cytokinin signaling during the regulation of nodulation in Medicago truncatula. The Plant Cell. 20 (10), 2681-2695 (2008).
- Isayenkov, S., Mrosk, C., Stenzel, I., Strack, D., Hause, B. Suppression of allene oxide cyclase in hairy roots of Medicagotruncatula reduces jasmonate levels and the degree of mycorrhization with glomus intraradices 1[w]. Plant Physiology. 139 (3), 1401-1410 (2005).
- Dalton, D. A., et al. Physiological roles of glutathione S-Transferases in soybean root Nodules 1[C][W][OA]. Plant Physiology. 150 (1), 521-530 (2009).
- Limpens, E., et al. RNA interference in Agrobacteriumrhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55 (399), 983-992 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten