Method Article
Ein Positionierungsgerät für die Platzierung von Mäusen während der intranasalen siRNA-Lieferung an das Zentrale Nervensystem
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll mit einem Maus-Positionierungsgerät vor, das die angemessene Platzierung von Mäusen für die intranasale Verabreichung einer hirngezielten Peptid-SiRNA-Formulierung ermöglicht, die eine effektive Gen-Silencing im zentralen Nervensystem ermöglicht.
Zusammenfassung
Intranasale (IN) Medikamentenabgabe an das Gehirn hat sich als vielversprechende Methode zur Umgehung der Blut - Hirn-Schranke (BBB) für die Lieferung von Medikamenten in das zentrale Nervensystem (ZNS) herausgestellt. Jüngste Studien zeigen die Verwendung eines Peptids, RVG9R, mit der minimalen Rezeptor-bindenden Domäne des Tollwutvirus Glykoprotein, bei der Auslösung der Lieferung von siRNA in Neuronen im Gehirn. In diesem Protokoll wird die Peptid-siRNA-Formulierung intranasal mit einer Pipette in der dominanten Hand geliefert, während die anästhesierte Maus durch die Scruff mit der nicht dominanten Hand in einer "Kopf-Nach-und-Vorwärts-Position" zurückgehalten wird, um eine Drainage in die Lunge zu vermeiden. und Magen beim Einatmen. Dieses präzise Greifen von Mäusen kann erlernt werden, ist aber nicht einfach und erfordert Übung und Geschick, um zu einer effektiven ZNS-Aufnahme zu führen. Darüber hinaus ist das Verfahren langgezogen und erfordert ca. 45 min für die Verabreichung eines Gesamtvolumens von 20-30 l lösungsmenge in 1-2 L Tröpfchenvolumen pro Inhalation, mit 3-4 min Ruhezeiten zwischen jeder Inhalation. Ziel dieser Studie ist es, eine Mauspositioniervorrichtung offenzulegen, die eine angemessene Platzierung von Mäusen für eine effiziente IN-Verabreichung der Peptid-SiRNA-Formulierung ermöglicht. In das Design des Geräts sind mehrere Funktionen integriert, wie z. B. vier oder acht Positionierstühle mit einstellbarer Höhe und Neigung, um anästhesierte Mäuse in der Kopf-Down-and-Forward-Position zurückzuhalten, was eine einfache Visualisierung der Mäusen und eine eingebautes Heizkissen, um die Körpertemperaturen der Mäuse während des Verfahrens zu halten. Wichtig ist, dass die Fähigkeit, vier oder acht Mäuse gleichzeitig mit RVG9R-siRNA-Komplexen gleichzeitig zu behandeln, auf diese Weise Studien auf einer viel schnelleren Zeitskala ermöglicht, um einen IN-therapeutischen siRNA-Ansatz zu testen. Zusammenfassend lässt sich sagen, dass dieses Gerät eine angemessene und kontrollierte Mauskopfpositionierung für die IN-Anwendung von RVG9R-siRNA und anderen therapeutischen Molekülen, wie Nanopartikeln oder Antikörpern, für die ZNS-Bereitstellung ermöglicht.
Einleitung
Das BBB verhindert, dass systemisch verabreichte Moleküle von >400-600 Da in das Gehirn gelangen, was eine erhebliche Herausforderung für die Lieferung therapeutischer Biomoleküle für Krankheiten darstellt, die das ZNS und das Gehirn betreffen1. Direkte Medikamentenabgabe an das Gehirn kann durch stereotaktische Injektion erreicht werden; Dies erfordert jedoch chirurgisches Know-how und ist bei der Abgabe auf Bereiche, die an der Injektionsstelle proximal sind, stark eingeschränkt, so dass es für den routinemäßigen klinischen Einsatz ungeeignet ist2. IN Lieferung an das Gehirn kann auch zu einer direkten Hirnabgabe führen, indem sie die BBB umgeht, was eine direkte und schnelle Übertragung einer Vielzahl von Substanzen auf das Gehirnermöglicht 3,4. Diese Übertragung wird angenommen, durch Transportmechanismen über die olfaktorischen und trigeminusten Nerven, die den Nasengang mit dem Gehirn verbinden, die Zerebrospinalflüssigkeit, und die Lymphsysteme5. Da die direkte Nase-Hirn-Route keine peripheren Organe und Gewebe beinhaltet, reduziert es die systemischen Nebenwirkungen erheblich und verbessert die Potenz. IN-Administration ist eine vielversprechende nichtinvasive Alternative zu lokalen und systemischen Wegen für die Hirnabgabe von therapeutischen Wirkstoffen und kann einen leistungsstarken Ansatz zur Bekämpfung von neurologischen Erkrankungen, einschließlich Alzheimer-Krankheit, Parkinson-Krankheit, und Hirntumor und wird in mehreren klinischen Studien6,7,8untersucht.
Mehrere experimentelle Faktoren, wie Volumen und Impfmethode sowie Formulierungs-pH-Wert, beeinflussen die Arzneimittelabgabe zum ZNS stark über den Nasen-Hirn-Signalweg9. In Studien mit Mäusen hängt der Erfolg der IN-Medikamentenabgabe stark von der richtigen Kopfpositionierung ab, die für eine effiziente Abscheidung des Gehirns und die Vermeidung von Medikamentendrainage in die äußere Umgebung oder die Atemwege entscheidend ist. Bemerkenswert ist, dass die meisten Nagetierstudien eine Kopf-Zurück-Position (Supine) mit einer Neigung von 70°-90° für die Medikamentenabgabe an das olfaktorische Epithel verwenden, obwohl die Kopfpositionierung bei 0° die Drainage in die Luftröhre9begünstigen kann. IN der Abgabe von Medikamenten an Mäuse, die wach sind, führt zu einer reduzierten Hirnablagerung im Vergleich zu jeder Anwendung in der Supine-Position, vor allem aufgrund der Unfähigkeit der Wissenschaftler, Mäuse in der gewünschten Position für längere Zeit zu halten. Darüber hinaus führt die umgedrehte Position, die für die für wache Mäuse eingesetzte Hautgriffmethode erforderlich ist, zu einer Wirkstoffabscheidung vorwiegend im Trigeminusnerv und in der Riechbirne sowie peripheren Organen wie Nieren und Lunge innerhalb von 30 min. Nachinokulation10. Die am besten geeignete Körperposition für die Abgabe von Therapeutika durch die riech- oder trigeminusbinalen Nerven bei größeren Tieren wie nichtmenschlichen Primaten in klinischen Studien scheint die Kopf-Nach-und-Vorder-Position zu sein (d.h. das sogenannte "Beten nach Mekka" Position")11. Allerdings wurde diese Position im Mausmodell nicht gut studiert, und die Supine-Position wird in Nagetierstudien weiter verbreitet.
Zuvor haben wir gezeigt, dass das RVG9R, ein Peptid, das auf der minimalen Rezeptorbindungsdomäne des Tollwutvirus basiert, Tropismus an Zellen zeigt, die Nikotin-Acetylcholin-Rezeptor-Untereinheiten wie Neuronen und Makrophagen exezieren und die intrazelluläre Abgabe von siRNA durch einen Mechanismus mit Rezeptoreingriff und temporärer Plasmamembrandelokalisierung an der Stelle der Rezeptoraggregation12,13. Wichtig ist, dass die systemische intravenöse Verabreichung von RVG9R-siRNA-Komplexen die transvaskuläre Abgabe von siRNA in das ZNS14ermöglicht. Der systemische Weg verdünnt jedoch die Menge an siRNA, die dem ZNS zugeführt wird, und jüngste Daten zeigen, dass die IN-Administration von RVG9R:siRNA-Komplexen an Mäuse, die sich in der Kopf-Down-and-Forward-Position befinden, einen weit verbreiteten Zielgen-Knockdown in mehrere Regionen des Gehirns15. Wichtig ist, dass dieses Knockdown-Niveau mit nur 13,5 g siRNA erreicht wurde, die über eine Vier-Dosis-, 2-Tage-Therapie verabreicht wurden, während die IV-Route eine 5-mal höhere Dosis pro Injektion erfordert, um einen vergleichbaren Knockdown zu erreichen. Das einzige Manko des IN-Ansatzes ist, dass es sich um ein mühsames Verfahren handelt, das die Verwendung beider Hände während der Verabreichung der Lösung erfordert, während die Mäuse alternativ im Kopf nach unten und vorwärts und in entspannten Positionen zwischen jede Inhalation über einen beträchtlichen langen Behandlungszeitraum (ein Verfahren von 30-45 min für die effektive Aufnahme eines Volumens von 20-30 l pro Maus). Die Verwendung der hier vorgestellten Mauspositioniervorrichtung ermöglicht die richtige Platzierung von Mäusen mit wenig körperlicher Zwang zu den Tieren und dem Personal, das das Protokoll durchführt, sowie die Behandlung mehrerer Kohorten von Mäusen innerhalb eines angemessenen Zeitraums, ermöglicht eine eingehende Studie über die Verwendung von siRNAs als therapeutische für West-Nil-Enzephalitis bei Mäusen in späten Stadien der Krankheit15.
Protokoll
Alle Experimente wurden in Übereinstimmung mit Richtlinien und Protokollen durchgeführt, die vom Animal Care and Use Committee der Hanyang University genehmigt wurden. In diesem Protokoll wurden 6 Wochen alte Balb/c-Mäuse mit einem Gewicht von 20-25 g verwendet (n = 3 pro Gruppe). Die Tiere wurden in einer pathogenenfreien Anlage mit 12 h Licht/Dunkel-Zyklen bei kontrollierter Temperatur und Luftfeuchtigkeit mit freiem Zugang zu Wasser und Nahrung untergebracht.
1. Gerätebaugruppe
- Montieren Sie die einzelnen Teile der Positioniervorrichtung, wie in Abbildung 1Adargestellt.
HINWEIS: Das Gerät wird in Einzelteilen geliefert, die einfach montiert und demontiert werden können.
2. Materialaufbau
HINWEIS: Die IN-Verabreichung von Verflüssigungsmedikamenten erfordert die folgenden Vorbehandlungsschritte.
- Bereiten Sie die benötigten Materialien vor, einschließlich der Positioniervorrichtung, einer 10-L-Mikropipette, 10 L-Mikropipette-Spitzen, einer Behandlungslösung (z. B. RVG9R-siRNA-Komplex), einer Timeruhr und 70 % Ethanol (siehe Abbildung 2A).
- Schließen Sie den Netzcode an, um das Geräteheizsystem mindestens 15-20 min vor dem Experiment einzuschalten. Die optimale Temperatur für Tierversuche wird automatisch bei 37 °C gehalten.
- Die Anästhesie Ketamin: Xylazin: Phosphat-gepufferte Saline (PBS) im Verhältnis 1:0,5:8,5 vorbereiten und jede Maus mit einer einzigen intraperitonealen (i.p.) Injektion in einem Endvolumen von 200 l pro 20 g Maus anästhesisieren.
HINWEIS: Bitte beachten Sie, dass jedes optimierte Medikament zur Sicherstellung der Anästhesie für einen Zeitraum von 30-45 min verwendet werden kann.
3. Mauspositionierung
- Bewerten Sie den Grad der Anästhesie durch Pedalreflex (feste Zehenklemme), um die chirurgische Ebene zu erhalten.
- Stellen Sie die Positioniervorrichtung in einem angemessenen Abstand und einer angemessenen Höhe auf, um einen bequemen Zugang zu allen erforderlichen Reagenzien zu ermöglichen.
- Sobald die Mäuse richtig anästhesiert sind, heben Sie vorsichtig jede Maus durch den Hals mit Daumen und Zeigefinger und legen Sie sie auf den dafür vorgesehenen Stuhl.
- Die richtige Positionierung der Maus auf dem Stuhl ist in dieser Phase sehr wichtig. Legen Sie den Mausrücken parallel zur Rückenstütze des Stuhls und bei 90° auf den Stuhlsitz. Heben Sie die Hände von der Maus und lassen Sie das Tier natürlich in der Kopf-Nach-und-Vorwärts-Position liegen, ohne zu drücken oder zu drücken, wie in Abbildung 2Bgezeigt. Stellen Sie sicher, dass die Vorderbeine der Maus natürliche Unterstützung bieten, während sich das Tier in dieser entspannten Position befindet, ohne dass die Maus unwohl ist.
- Sobald die Mäuse richtig positioniert sind, schnallen Sie die Mäuse mit dem Stuhlgürtel an und starten Sie sofort die IN-Impfung.
4. Intranasale Lieferung
HINWEIS: Dieses Protokoll beschreibt die IN-Bereitstellung von RVG9R:siRNA-Komplexen mit dem Mauspositioniergerät. Mit diesem Protokoll können pro Maus in 2 L-Tropfen maximal 20-30 l Lösung verabreicht werden. Dieses Volumen ist niedriger als das der Nasenhöhle der Maus, die 0,032 cm3beträgt, so dass das Verfahren nicht zu einer tödlichen Nasenverstopfung oder Erstickung führt. Dieses Protokoll ermöglicht die gleichzeitige Impfung von mindestens vier Mäusen und maximal acht Mäusen pro Gerät, was zu Zeitoptimierung und reduzierter Variabilität führt.
- Nehmen Sie die 10-L-Mikropipette und stellen Sie sie auf 2 l ein.
- Beladen Sie die Mikropipette mit einer komplexen Lösung mit 2 l RVG9R:siRNA (z. B. 5,2 g siCy5, komplexiert mit 104 g RVG9R für das Lieferexperiment, und 13,5 g siSOD1 mit 270 g RVG9R für das Silencing-Experiment in einem Endvolumen von 25 5% Glukose.
- Während Sie die Pipette in der dominanten Hand halten, passen Sie die Position an, indem Sie einen Ellbogen auf die Bankspitze legen. Stützen Sie die Hand, die die Pipette hält, mit der anderen Hand, um unkontrollierte Bewegungen während der Verabreichung zu vermeiden.
- Legen Sie einen Tropfen von 2 L ganz in der Nähe eines Nasenlochs, damit die Maus das Tröpfchen direkt einatmen kann (siehe Abbildung 2B). Wenn ein winziger Tropfen nicht leicht gebildet werden kann, dann ersetzen Sie die Pipettenspitze durch eine neue und wiederholen Sie den Vorgang. Verwenden Sie die Stoppuhr, um das Zeitintervall zwischen Impfungen zu überprüfen.
- Dieses Gerät ermöglicht die Behandlung von mindestens vier Mäusen gleichzeitig. Wenn eine andere Gruppe von Mäusen erforderlich ist, um den Schritt 4.4 zu wiederholen, setzen Sie eine weitere Bar mit vier Stühlen über oder unter der ersten Bar mit vier Stühlen, um bis zu acht Mäuse gleichzeitig auf dem Gerät unterzubringen.
- Wiederholen Sie Schritt 4.4 mit dem anderen Nasenloch nach 3-4 min von der ersten Impfung. Dieses Zeitintervall reicht aus, damit die Maus die Einatmung der ersten Dosis abschließen und die normale Atmung wiederherstellen kann. Wenn ein Tropfen der inhalierten Lösung durch versehentliches Schnarchen aus dem Naris der Maus entfernt wird, reinokulieren Sie eine zusätzliche Lösung von 2 l.
- Wiederholen Sie den gesamten Vorgang mit alternativen Nasenlöchern, bis die Dosis von 20-30 l abgeschlossen ist. Es dauert 30-45 min, um den gesamten Impfvorgang abzuschließen.
- Setzen Sie den Mäusen nasse Salbe auf die Augen, bevor Sie die Mäuse in ihre vorgesehenen Käfige zurückbringen.
HINWEIS: Lassen Sie die Mäuse nicht unbeaufsichtigt, bis sie genügend Bewusstsein wiedererlangt haben, um die Brustbesinnung aufrechtzuerhalten.
5. Datenanalyse
- Um die Ablagerung des Gehirns von Fluor-markiertem RVG9R zu bestätigen, begiften Sie die Mäuse (wie in Schritt 2.3 beschrieben) und isolieren Sie das Gehirn, sowie andere periphere Organe, wie Lunge, Leber, Milz und Niere. Platzieren Sie jedes Organ auf der ImageStation und visualisieren Sie die Fluoreszenz mit ImageStation.
- Um die Fluoreszenz durch das Cy5-Label zu visualisieren, bereiten Sie 20 m dicke Kryosektionen vor, die mit Hoechst 33342 versehen sind, und führen Sie ein Vollhirn-Scannen mit einem konfokalen Mikroskop durch.
- Um die Gen-Silencing zu bewerten, extrahieren Sie RNA aus verschiedenen Hirnregionen, wie der Olfaktor-Lampe, dem Kortex, dem Hippocampus, dem Thalamus, dem Hypothalamus, dem Kleinhirn und dem Hirnstamm, mit einem RNA-Reinigungskit, das mit einer cDNA umgeschrieben wird. Synthese-Kit und führen QPCR mit Primer-Paaren wie zuvor beschrieben15.
Ergebnisse
Die Kopfposition während der IN-Administration ist ein wichtiger Einfluss auf die Effizienz der Medikamentenabgabe an das Gehirn. Hier beschrieben wir die Kopf-Down-and-Forward-Position mit einem Maus-Positionierungsgerät für die IN-Verabreichung einer Hirn-Targeting-Peptid-SiRNA-Formulierung zur Abgabe der Mischung an das CNS der Maus. Um die Lieferung über den IN-Weg zu überprüfen, verwendeten wir das RVG9R-Peptid, das zuvor gezeigt wurde, dass es sowohl in vitro als auch in vivo14,16effizient an neuronale Zellen bindet.
Wir haben zuerst die Nasen-Hirn-Lieferung des rVG9R-Peptids mit Alexa Fluor 488 (RVG9R-A488) mit dem hier beschriebenen Maus-Positionierungsgerät getestet. Bei 48 h Postinokulation wurden verschiedene Organe, einschließlich des Gehirns, der Sinus, der Lunge, der Leber, der Milz und der Nieren, ausgeschnitten, um die gewebeassoziierte A488 Fluoreszenz zu messen. Ein488 allein, oder ein Kontrollpeptid (RVM9R-A488)14, das nAchR nicht bindet, wurden als Negativkontrollen verwendet. Wie erwartet wurden weder A488 noch RVM9R-A488 in einem der Organe bei 48 h Nachträgz nachgewiesen (Abbildung3A, links). Andererseits wurde ein starkes fluoreszierendes A488-Signal ausschließlich in den Gehirnen der RVG9R-inokulaten Gruppe nachgewiesen. Darüber hinaus verglichen wir diese Mausplatzierungsposition mit der zuvor verwendeten Supine-Positionsmethode17sowie der Wachmethode zur Wirksamkeit. Wir haben eine feste Menge an RVG9R-A488 (100 g) und assayed Biodistribution bei 48 h Postinokulation geimpft. Die Ergebnisse zeigten, dass die Positionierung der Mäuse kopfüber nach unten und vorwärts die Penetranz und Ablagerung von RVG9R-A488 im gesamten Hirngewebe verbesserte (Abbildung3A, rechts). Im Gegensatz dazu führten die in einer Supine-Position geimpften Tiere zur Lieferung von RVG9R-A488 an das Gehirn, aber nicht so stark wie bei der Positionierungsvorrichtungsmethode. Um die SiRNA-Abgabe an das Gehirn weiter zu bestätigen, führten wir nach einer einzigen IN-Verabreichung von RVG9R eine Aufarbeitung von 400 pmol (5,2 g) Cy5-markierter siRNA durch. Im Gegensatz zu PBS oder RVM9R führte die Komplexierung mit RVG9R zu einer starken Ansammlung von siRNA in wichtigen Hirnregionen, einschließlich der Olfaktorinde, des Kortex, des Hippocampus, des Thalamus, des Hypothalamus, des Mittelhirns und des Kleinhirns (Abbildung3B ).
Schließlich haben wir die RT-qPCR-Analyse eingesetzt, um die intrazelluläre Abgabe von funktioneller siRNA zu überprüfen, die auf das Superoxid-Dismutase-1-Gen (SOD1) abzielt. Mäuse wurden an aufeinanderfolgenden Tagen 3 Mal intranasal mit RVG9R:siSOD1 (13,2 g siRNA) geimpft, und die SOD1-mRNA-Expression wurde 24 h nach der letzten Impfung analysiert. RVG9R:siSOD1-Verabreichung führte zu einer erheblichen Reduktion der SOD1-Expression in der Riechbirne (63%), dem Kortex (47%), dem Hippocampus (61%), dem Thalamus (53%), dem Hypothalamus (55%), dem Mittelhirn (39%) und dem Kleinhirn (30%) (Abbildung 4). Zusammenfassend lässt sich sagen, dass der Einsatz eines Positioniergeräts eine einfache IN-Inokulation von RVG9R-komplexierter siRNA bei Mäusen ermöglicht, was zu einer hirnspezifischen siRNA-Abgabe führt, die eine funktionelle Silencierung des Zielgens induzieren.
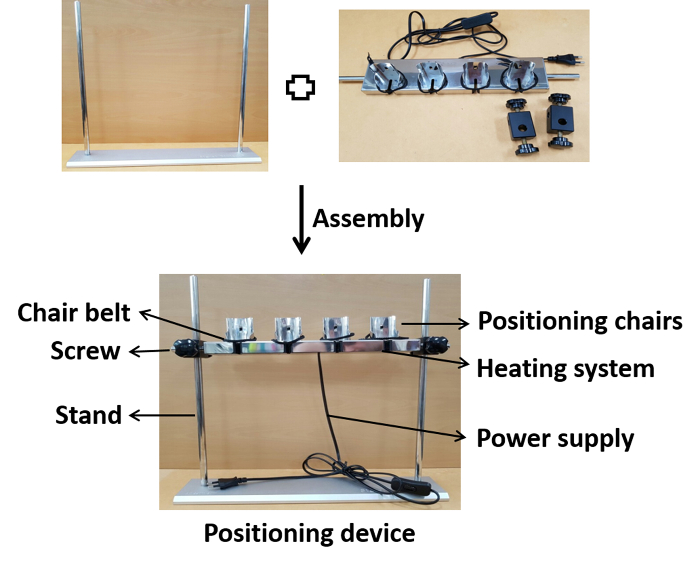
Abbildung 1 : Fotografische Darstellung der Gerätebaugruppe. Die Positionierstühle werden auf dem Ständer in der entsprechenden Höhe mit Schrauben montiert. Nach der Montage wird das Gerät an ein Netzteil zum Erhitzen auf die physiologische Temperatur während der Impfung angeschlossen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2 : Fotografische Darstellung des IN-Impfverfahrens mit dem Positioniergerät. (A) Für die IN-Impfung erforderliche Versuchsausrüstung. (B) Tiere in der Kopf-Nach-und-Vor-Position auf dem Gerät sitzend (links) und die Ablagerung eines 2 L Tröpfchens für DIE Inokulation (rechts). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
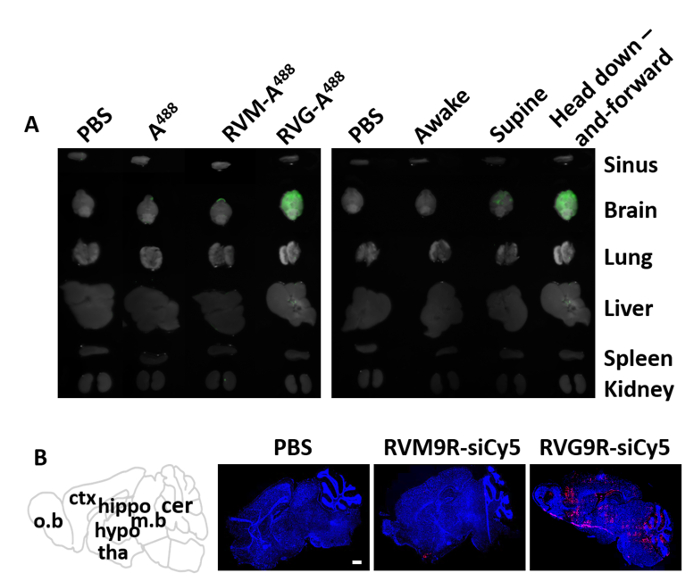
Abbildung 3 : Verteilung von fluoreszierend markiertem Peptid und siRNA nach IN-Verabreichung. (A) Bioverteilung des intranasal geimpften RVG9R-Peptids bei 48 h nach einer einzigen IN-Impfung. Das Gehirn und andere periphere Organe wurden auf das Vorhandensein von Fluoreszenz bei Mäusen untersucht, die mit Salin (PBS), A488, RVM-A488und RVG-A488 (links) geimpft sind. Die Bildgebung der Mäuse, die wie oben erwähnt behandelt werden, während sie wach sind, in der Supine-Position und in der Mauspositionierung in der Kopf-Down-and-Forward-Position (rechts) entwickeln. (B) Bioverteilung des RVG9R:siRNA-Komplexes im Gehirn (n = 3 pro Gruppe). Die Verteilung von Cy5-markierter siRNA wurde in vollständigen Hirnkryosektionen mit einem konfokalen Lasermikroskop bei Tieren visualisiert, die mit Salin (PBS) geimpft, siRNA mit Kontrollpeptid (RVM9R-siCy5) oder dem Hirn-Targeting-Peptid RVG9R (RVG9R-siCy5) komplexiert wurden. Der Maßstabsbalken steht für 1 mm. Abkürzungen: o.b = Olfaktorbirne; ctx = Kortex; Hippo = Hippocampus; Hypo = Hypothalamus; tha = thalamus; m.b = Mittelhirn; cer = Kleinhirn. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
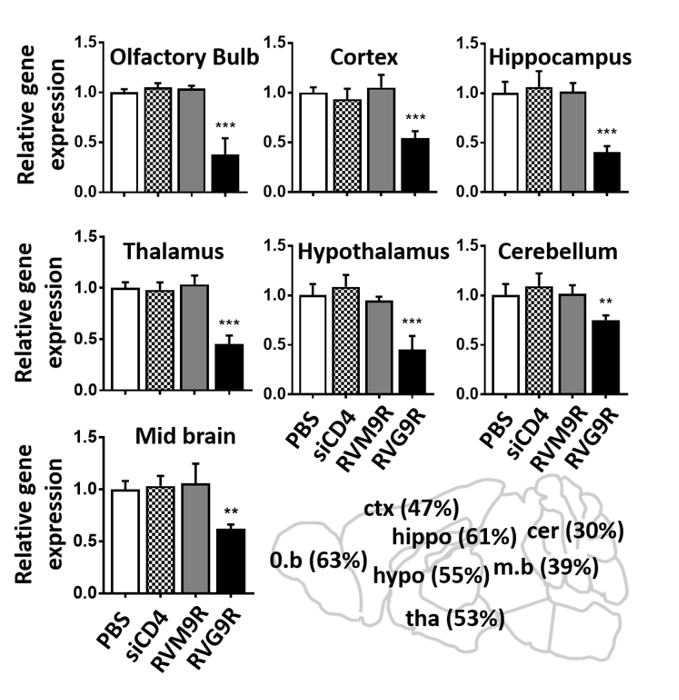
Abbildung 4 : In Anwendung von RVG9R:siSOD1 induziert Zielgen-Silencing in mehreren Regionen des Gehirns. qPCR-Analyse für murine SOD1 mRNA in indizierten Hirnregionen 24 h nach der letzten IN-Impfung von Salin (PBS), RVG9R:siCD4 (siCD4), RVM9R:siSOD1 (RVM9R) und RVG9R:siSOD1 (RVG9R). Die relative SOD1-Silencing in der Olfaktor-Glühbirne, dem Kortex, dem Hippocampus (oben), dem Thalamus, dem Hypothalamus, dem Kleinhirn (Mitte) und dem Mittelhirn (unten) wird gezeigt. Die Daten stellen den Mittelwert sD relativ zu GAPDH nach der Normalisierung mit den entsprechenden Daten von mit Saline behandelten Mäusen (n = 3 pro Gruppe) dar. Die Karikatur, die den Prozentsatz der SOD1 mRNA in der angegebenen Hirnregion nach der IN-Impfung darstellt (unten rechts). **P < 0,01, ***P < 0,001. Abkürzungen: o.b = olfaktorische Glühbirne; ctx = Kortex; Hippo = Hippocampus; Hypo = Hippocampus; tha = thalamus; m.b = Mittelhirn; cer = Kleinhirn. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir haben ein Maus-Positionierungsgerät entwickelt, um Mäuse optimal zu positionieren, um die Nasen-Hirn-Lieferung von Therapeutika zu ermöglichen. Das Gerät ist mit verschiedenen Funktionalitäten ausgestattet, die eine einfache gleichzeitige Handhabung von Tieren gewährleisten. Es ist auch mit Heizkissen für die Aufrechterhaltung der physiologischen Körpertemperaturen der Tiere während des Experimentierens ausgestattet. Die anästhesierten Mäuse können mit speziell gestalteten Stühlen in der Kopf-Down-and-Forward-Position gehalten werden, mit minimalen Beschwerden für die Tiere. Die Höhe der Positionierstühle kann so eingestellt werden, dass es am besten ist, tierische Nasenlöcher während der Verabreichung von Medikamenten zu visualisieren.
DIE In-Hirn-Entbindung hat mehrere intrinsische Einschränkungen, einschließlich der kleinen Oberfläche von Nasenlöchern (die maximale Volumina von 20-30 l pro Verabreichung), Nasenreizung, Epithelschäden und begrenzte Absorption über das Nasenepithel18ermöglicht. Die IN-Verabreichung von Medikamenten an Mäuse, die in die Supine-Position versetzt wurden, wurde für die Hirnabgabe verwendet, indem flüssige Medikamente über Pipetten oder Polyurethanschläuche (24 G x 19 mm), die mit Mikroliterspritzen verbunden sind,in die alternativen Nares der Tiere geworfen wurden. 20. Obwohl die Verwendung von Schlauchsystemen zur Freisetzung von Medikamenten in der Nähe des olfaktorischen Epithels ein potenziell geeigneter Ansatz ist, verursacht es Reizungen oder Nasenentzündungen bei wiederholter Verabreichung. Darüber hinaus begrenzt die geringe Größe der Nasenhöhle diesen Ansatz, insbesondere bei Mäusen, die durch Wiederholung überwunden werden können, sowie durch Arzneimittelformulierungen, die in der Nasenschleimhaut fortbestehen. Eine weitere Möglichkeit ist die IN-Verabreichung von Therapeutika, um Mäuse zu wecken10. Dieser Ansatz erfordert jedoch qualifizierte Verfahren für den Umgang mit Tieren während der IN-Impfung. Darüber hinaus verursacht es tierischen Stress und ist daher nicht ideal für Krankheitsmodelle, insbesondere Infektionskrankheitsmodelle. Darüber hinaus kann eine inkonsistente Verdosung leicht durch die Drainage von Medikamenten in die Lunge oder den Magen aufgrund eines unvollkommenen Tiergreifs resultieren. Der hier vorgestellte Ansatz ermöglicht es Wissenschaftlern, diese technischen Barrieren zu überwinden. Die Kopf-Nach-und-Vor-weg-Position reduziert die Möglichkeit von Medikamentenlecks von der Nase in die Lunge beim Einatmen, wobei eine direkte und selektive siRNA-Abgabe an das Gehirn begünstigt wird. Die Abgabe mit dem Mauspositioniergerät erfordert keine spezielle Technik für den Umgang oder das Greifen der Tiere während der Impfung. Vier Tiere gleichzeitig können für einen Zeitraum von mindestens 30-45 min behandelt werden. Das Verfahren kann durch die Aufnahme einer zusätzlichen Vier-Stuhl-Leiste skaliert werden, was eine einfache Verwaltung von bis zu acht Mäusen in derselben Versuchssitzung ermöglicht. Daher kann ein einzelner Bediener nach dieser Methode über einen längeren Zeitraum die Medikamentenabgabe in das Gehirn großer Tiergruppen induzieren.
Die anatomische Struktur der Nasenhöhle beeinflusst stark die Nasen-Hirn-Versorgung (wie von Merkus et al.11 und Ruigrok und de Lange21) überprüft). Die relative Oberfläche der Nasenhöhle bei Mäusen ist 15-mal größer als die des Menschen und die relative Oberfläche des olfaktorischen Epithels ist 6-mal größer. Obwohl es signifikante Unterschiede in der Anatomie der Nasenhöhle beim Menschen zu Nagetieren gibt, sind etwa 45 klinische Studien im Gange, die den IN-Ansatz zur Behandlung mehrerer Hirnerkrankungen (www.clinicaltrials.gov) verwenden. Die hier vorgestellte Studie zeigt, dass Wissenschaftler bei der Verwendung von IN-Verabreichung von Therapeutika mehrere Faktoren berücksichtigen sollten, wie Z. B. Kopfposition, Schlafen und geeignete Entbindungsmittel.
Wir haben die effiziente und spezifische Ablagerung von fluoreszierend siRNA an das Maushirn gezeigt. Darüber hinaus bestätigte die signifikante Abnahme der SOD1-Genexpression, die nach der IN siRNA-Abgabe beobachtet wurde, funktionelle Effekte. Wir haben zuvor konsequent gezeigt, dass die IN-Verabreichung von RVG9R-siRNA-Komplexen, die auf die Rna des West-Nil-Virus (WNV) abzielen, eine starke therapeutische Wirkung auf wnV-Enzephalitis15ausübt. Insbesondere erforderte die SiRNA-Abgabe von Nase zu Gehirn einen zellvisierenden Liganden (RVG) und ein positiv geladenes Molekül (9R) für komplexe siRNA. In Ermangelung dieser Elemente wurden Moleküle durch den systemischen Kreislauf und Lymphgefäße 48 h Nachbehandlung (Abbildung3A)15gelöscht. Daher haben wir in dem hier beschriebenen Versuchsaufbau die Peptid-/SiRNA-Lokalisierung 48 h nach der Impfung untersucht, um nur die speziell im Gehirn beibehaltenen Werte abzubilden. Dieser Ansatz könnte leicht für die Lieferung anderer Moleküle wie Proteine, Peptide und Nanopartikel oder andere Therapeutika zur Behandlung einer Reihe von Hirnerkrankungen implementiert werden.
Offenlegungen
P.K. und S.K.L. sind Mitbegründer von Signet Biotech. P.K. ist Miterfinder des Patents PCT/US07/12,152, das teilweise Ansprüche im Zusammenhang mit RVG9R enthält. I.U., K.C., P.K. und S.K.L. sind als Miterfinder eines eingereichten Patents (PCT/KR2016/014220) aufgeführt, das Ansprüche im Zusammenhang mit einer Mauspositionierungsvorrichtung enthält.
Danksagungen
Diese Arbeit wurde vom korea Ministry of Health & Welfare (HI17C1046) an S.K.L. unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Comercial assays | |||
| iScript cDNA synthesis kit | BioRad | Cat# 1708891 | |
| RNAiso plus | TaKaRa Bio | Cat# 9108 | |
| SYBR Premix ExTaq | TaKaRa Bio | Cat# RR420A | |
| Dyes | |||
| Alexa fluor 488 | ThermoFisher | Cat# A30052 | |
| Mouse strain | |||
| Balb/c | Orient Bio | N/A | 6-8 week old, 20-30g |
| Oligonucleotides and primers | |||
| Human CD4 | ST Pharm | N/A | Sense: 5’-GAUCAAGAGACUCCUCAGU-3’ |
| siSOD1 | ST Pharm | N/A | Sense: 5’-GGUGGAAAUGAAGAAAGUA-3’ |
| GAPDH primers | ST Pharm | N/A | F: 5’-AACTTTGGCATTGTGGAAGG-3’ R: 5’-GGAGACAACCTGGTCCTCAG-3’ |
| SOD1 primers | ST Pharm | N/A | F: 5’-CCAGTGCAGGACCTCATTTT-3’ R: 5’-CACCTTTGCCCAAGTCATCT-3’ |
| Peptides | |||
| RVG9R | Peptron | N/A | YTIWMPENPRPGTPCDIFTNSR GKRASNGGGGRRRRRRRRR |
| RVM9R | Peptron | N/A | MNLLRKIVKNRRDEDTQKSS PASAPLDGGGGRRRRRRRRR |
| Software, algorithms and devices | |||
| FlowJo software 4.3 | FlowJO, LLC | N/A | http://docs.flowjo.com/vx/ |
| Mouse positioning device | Signet Biotech | N/A | |
| Prism software | Graphpad | N/A | https://www.graphpad.com/scientificsoftware/prism/ |
| Prism software | Graphpad | N/A | https://www.graphpad.com/scientificsoftware/prism/ |
Referenzen
- Pardridge, W. M. The blood-brain barrier: bottleneck in brain drug development. NeuroRx. 2, 3-14 (2005).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (ICV) and intravenous (IV) injection in mice. Journal of Visualized Experiments. (56), e2968(2011).
- Khan, A. R., Liu, M., Khan, M. W., Zhai, G. Progress in brain targeting drug delivery system by nasal route. Journal of Controlled Release. 268, 364-389 (2017).
- Meredith, M. E., Salameh, T. S., Banks, W. A. Intranasal delivery of proteins and peptides in the treatment of neurodegenerative diseases. The AAPS Journal. 17, 780-787 (2015).
- Pardeshi, C. V., Belgamwar, V. S. Direct nose to brain drug delivery via integrated nerve pathways bypassing the blood-brain barrier: an excellent platform for brain targeting. Expert Opinion on Drug Delivery. 10, 957-972 (2013).
- Agrawal, M., et al. Nose-to-brain drug delivery: An update on clinical challenges and progress towards approval of anti-Alzheimer drugs. Journal of Controlled Release. 281, 139-177 (2018).
- Van Woensel, M., et al. Formulations for intranasal delivery of pharmacological agents to combat brain disease: a new opportunity to tackle GBM. Cancers. 5, 1020-1048 (2013).
- Kulkarni, A. D., et al. Nanotechnology-mediated nose to brain drug delivery for Parkinson's disease: a mini review. Journal of Drug Targeting. 23, 775-788 (2015).
- Dhuria, S. V., Hanson, L. R., Frey, W. H. Intranasal delivery to the central nervous system: mechanisms and experimental considerations. Journal of Pharmaceutical Sciences. 99, 1654-1673 (2010).
- Hanson, L. R., Fine, J. M., Svitak, A. L., Faltesek, K. A. Intranasal administration of CNS therapeutics to awake mice. Journal of Visualized Experiments. (74), e4440(2013).
- Merkus, P., Ebbens, F. A., Muller, B., Fokkens, W. J. Influence of anatomy and head position on intranasal drug deposition. European Archives of Oto-Rhino-Laryngology and Head & Neck. 263, 827-832 (2006).
- Zeller, S., et al. Attachment of cell-binding ligands to arginine-rich cell-penetrating peptides enables cytosolic translocation of complexed siRNA. Chemistry & Biology. 22, 50-62 (2015).
- Kim, J., et al. Silencing CCR2 in macrophages alleviates adipose tissue inflammation and the associated metabolic syndrome in dietary obese mice. Molecular Therapy-Nucleic Acids. 5, (2016).
- Kumar, P., et al. Transvascular delivery of small interfering RNA to the central nervous system. Nature. 448, 39(2007).
- Beloor, J., et al. Small interfering RNA-mediated control of virus replication in the CNS is therapeutic and enables natural immunity to West Nile virus. Cell Host & Microbe. 23, 549-556 (2018).
- Ullah, I., et al. Trileucine residues in a ligand-CPP-based siRNA delivery platform improve endosomal escape of siRNA. Journal of Drug Targeting. 25, 320-329 (2017).
- Yu, D., Li, G., Lesniak, M. S., Balyasnikova, I. V. Intranasal delivery of therapeutic stem cells to glioblastoma in a mouse model. Journal of Visualized Experiments. (124), e55845(2017).
- Mittal, D., et al. Insights into direct nose to brain delivery: current status and future perspective. Drug Delivery. 21, 75-86 (2014).
- Renner, D. B., Frey, W. H., Hanson, L. R. Intranasal delivery of siRNA to the olfactory bulbs of mice via the olfactory nerve pathway. Neuroscience Letters. 513, 193-197 (2012).
- Serralheiro, A., Alves, G., Fortuna, A., Falcão, A. Intranasal administration of carbamazepine to mice: a direct delivery pathway for brain targeting. European Journal of Pharmaceutical Sciences. 60, 32-39 (2014).
- Ruigrok, M. J., de Lange, E. C. Emerging insights for translational pharmacokinetic and pharmacokinetic-pharmacodynamic studies: towards prediction of nose-to-brain transport in humans. The AAPS Journal. 17, 493-505 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten