Method Article
Eine Anleitung zu einem stark geneigten bauen fegte Fliese Mikroskop für erweiterte Sichtfeld der Einzelmolekül-Imaging
In diesem Artikel
Zusammenfassung
Eine detaillierte Anleitung ist wie ein stark geneigten bauen beschrieben fegte Kachel (HIST) Mikroskop und dessen Nutzung für die Einzelmolekül-Bildgebung.
Zusammenfassung
Einzelmolekül-Bildgebung hat unser Verständnis der molekularen Mechanismen in biologischen Studien erheblich vorangebracht. Allerdings ist es schwierig, große Field-of-View, kontrastreiche Bilder mit dicken Zellen und Geweben zu erhalten gewesen. Hier stellen wir stark geneigten gefegt Kachel (HIST) Mikroskopie, die dieses Problem überwindet. Ein paar Zylinderlinsen wurde implementiert, um eine längliche Erregung Strahl zu generieren, der großflächig imaging über eine schnelle Galvo-Spiegel gescannt wurde. Eine 4f -Konfiguration wurde verwendet, um optische Komponenten zu positionieren. Eine wissenschaftliche ergänzende Metall-Oxid-Halbleiter-Kamera das Fluoreszenzsignal erkannt und blockiert die Out-of-Focus-Hintergrund mit einem dynamischen konfokale Schlitz mit der Strahl fegen synchronisiert. Wir präsentieren Ihnen eine Schritt für Schritt Anleitung auf den Aufbau der HIST-Mikroskop mit allen Basiskomponenten.
Einleitung
Einzelmolekül-Fluoreszenz-Bildgebung spielt eine wichtige Rolle in vielen biologischen Studien, die zeigen Feinstrukturen, Dynamik und die Menge von Biomolekülen1,2,3. Jedoch hat es eine Herausforderung gewesen, um Single-Molekülen in Zellen oder Gewebe zu studieren. Konfokale Mikroskopie hohe Stationspunkte Fähigkeit4bietet, eignet sie sich nicht für die Einzelmolekül-Bildgebung aufgrund schwerer Immunofluoreszenz durch die hohe Erregung Intensität oder langsame Bildgebung. Weitfeld-Mikroskopie nutzt schwächere Ausleuchtung aber leidet ein schlechtes Signal an Hintergrund-Verhältnis (SBR)5. Licht-Blatt-Mikroskopie, konnte auf der anderen Seite gut schneiden und niedrigen Immunofluoreszenz6zeigen; jedoch ist der verfügbaren numerische Apertur (NA) von dem Erfordernis der Orthogonal platzierte Ziele7stark eingeschränkt. Alternativ erfordert spezielle Beleuchtungen und Probe Kammern8,9.
Aus diesen Gründen hat stark geneigt und laminierte optische Blatt (HILO) Mikroskopie für 3D Einzelmolekül-imaging10verbreitet. Stößt eine schräge Balken eine Schnittstelle von zwei Medien (Glas und Wasser, zum Beispiel), wird der Strahl nach Snell Gesetz gebrochen. Wichtig ist, der gebrochene Strahl wird dünner, und seine Stärke bezeichnet man als Dz = R/tan(θ) wo R ist der Durchmesser des Strahls geneigt und θ ist der Winkel, Brechung des transmittierten Strahl. Diese einfache Implementierung führt eine gute Stationspunkte Fähigkeit. Dennoch zeigt diese Beziehung, dass eine dünne Beleuchtung (d. h. hohe Stationspunkte Fähigkeit) ein kleines R und/oder eine große θ erfordert. Zum Beispiel, wenn R = 20 µm und θ = 72 Grad, man kann erhalten Dz = 6,5 µm. Da gibt es eine praktische Begrenzung zur Steigerung des Brechung Winkels zur image-tief im Inneren der Zellen und zur Vermeidung von Totalreflexion, gibt es eine starke Kopplung von Beleuchtung Durchmesser und die Dicke der Balken. Aus diesem Grund zeigt HILO Bildgebung eine relativ kleine Field-of-View (FOV), die ihre Anwendungen in mehrzelligen Bildgebung erheblich einschränkt.
Vor kurzem haben wir dieses Problem durch stark geneigten gefegt Kachel (HIST) Mikroskopie überwinden, wo die FOV von der Dicke Strahl in eine sehr einfache Art und Weise11entkoppelt ist. Zunächst wird ein Strahl in eine Richtung gestreckt über ein paar Zylinderlinsen generiert. Dieser Strahl, bezeichnet als Kachel, erzeugt eine dünne Beleuchtung mit Dz ~ 4 µm, während seine FOV 130 x 12 µm2ist. Dann ist die Fliese über die Probe mit einem rotierenden Galvo-Spiegel fegte. Unterdessen wird die Fluoreszenzbild auf einem wissenschaftlichen ergänzende Metall-Oxid-Halbleiter (sCMOS) Kamera aufgezeichnet, die filtert effizient unscharfen Hintergrund durch den Betrieb in eine rolling Shutter-Modus dient als durchstimmbare konfokale Schlitz-Erkennung. Auf diese Weise ermöglicht HIST Mikroskopie Einzelmolekül-Bildgebung mit ein größeres Sichtfeld (~ 130 x 130 µm2) und eine dünnere Ausleuchtung als HILO Bildgebung. Wir galt das neue bildgebende Technik um RNA-Transkripte zu erkennen, mit einer einzigen Sonde in Zellen oder mit ein paar Sonden in Maus Hirngewebe, die erhebliches Potenzial für die Untersuchung der Genexpression und Krankheiten hat. Im Gegensatz zu anderen Ansätzen HIST beschäftigt nur einen einzigen hoher numerischer Apertur Ziel ohne eine zusätzliche Beleuchtung oder Fernerkennung Ziele und ist voll kompatibel mit umgekehrten Mikroskopen. Diese Vorteile zusammen mit einem großen FOV und hohem Kontrast machen HIST Mikroskopie eines prominenten Instrument in Biologie und Medizin. Wir präsentieren Ihnen detaillierte Anweisungen bezüglich Instrumentierung des HIST Mikroskop und Gewusst wie: testen und seine Leistung wie folgt zu kalibrieren.
Protokoll
1. einrichten das Mikroskop, Laser und Ausrichtung Werkzeuge
- Vor dem Aufbau des Mikroskops, bereiten Sie alle notwendigen Komponenten inklusive Optik, Optomechanics und Elektronik wie in Tabelle Materialienaufgeführt.
- Bereiten Sie einen Mikroskop Körper vor allem setzt sich aus zwei Teilen: einem Objektivhalter mit einem RMS-Gewinde-Anschluss und ein Piezo-Bühne montiert auf einem Aluminiumblock (Abb. 1A).
Hinweis: Die maßgeschneiderte Mikroskop Körper ist für die Bequemlichkeit und Flexibilität der Instrumentierung12verwendet. Jede handelsübliche Mikroskop Stelle kann für die HIST Mikroskopie verwendet werden. - Kombination von mehreren Laserlinien und verbinden sie mit einer Singlemode-Faser
- Install 405, 561, 638 nm Laser auf die optischen Tisch und Balken durch einen polarisierenden Strahlteiler und einen langen Pass dichroitischen Spiegel zu kombinieren, wie in Abbildung 1Bdargestellt. Stellen Sie sicher, dass alle Laserstrahlen durch Nadelstiche auf das Alignment-Tool übergeben. Fügen Sie eine halbe Welle Platten für Leistungsanpassung.
Hinweis: Tragen Sie für Augenschutz Schutzbrille und verwenden Sie Strahl-Blöcke, um unerwünschte Laser-Strahlen zu absorbieren. - Installieren eine Faser Kupplung Objektiv (f = 4,5 mm) und ein Faser-Adapter in z-Übersetzer mit einem Käfig gehalten.
- Eine multimode-Faser (MMF, Ø 62,5 µm) an der Faser-Adapter anschließen. Passen Sie jedes Paar von der Lenkung Spiegel und der Z-Übersetzer, bis die Kupplung Effizienz jeder Laser über 95 % ist. Der Ausgang Lichtstrahl hat eine in der Nähe von Gauß-Profil mit Speckle-Muster.
- Take away die multimode-Faser und eine Singlemode-Faser (SMF) zu verbinden. Ähnlich wie bei MMF, optimieren und maximieren die Effizienz der Kopplung von drei Lasern.
- Install 405, 561, 638 nm Laser auf die optischen Tisch und Balken durch einen polarisierenden Strahlteiler und einen langen Pass dichroitischen Spiegel zu kombinieren, wie in Abbildung 1Bdargestellt. Stellen Sie sicher, dass alle Laserstrahlen durch Nadelstiche auf das Alignment-Tool übergeben. Fügen Sie eine halbe Welle Platten für Leistungsanpassung.
- Montieren Sie eine kollimierten Lichtquelle, die für breite Ausrichtung in der Erregung und Erkennung Pfade verwendet werden. Dieses Gerät besteht aus einem zeitlich kohärente Lichtquelle (561 nm) verbunden, SMF, Faser-Adapter, achromatische Objektiv (f = 60 mm), Iris und Ø1 "Rohr Abstandhalter in einem Käfig-System (Abbildung 1C). Stellen Sie den Abstand zwischen dem LWL-Adapter und das Objektiv mit einer Schur Interferometer um die Kollimation sicherzustellen.
- Bereiten Sie einen Strahl-Alignment-Tool (Abbildung 1D). Dies ist ein paar von Aluminium Pfosten mit Pinholes auf 2" Höhepunkt von der Oberfläche der optischen Tisch, ermöglicht eine schnelle und präzise Strahl Ausrichtung.
- Montieren Sie eine doppelte Lochkamera-System besteht aus zwei Ø1 "Mattscheibe Ausrichtung Platten an jedem Ende und zwei Ø1" Objektiv Röhren (die untere ist geschlitzt), wie in Abbildung 1Egezeigt.
2. Einrichten des Erkennung-Pfades
- Nehmen Sie das Ziel und installieren Sie die kollimierten Lichtquelle zu. Stellen Sie die Regler des Spiegels (M1) unter dem Objektivhalter, so dass der Ausgang Lichtstrahl vom Mikroskop etwa parallel zum optischen Tisch in der Höhe und ausgerichtet mit Gewindelöchern auf dem Tisch. Detaillierten Positionen der einzelnen optischen Komponenten finden Sie in Abbildung 2 .
- Legen Sie einen multiband dichroitischen Spiegel (DM) und reflektieren Sie den Strahl um 90 Grad zu. Verwenden Sie die maximale Größe der Iris und stellen Sie sicher, dass der Strahl durch die Mitte des dichroitischen Spiegels ohne Clipping geht.
- Verwenden Sie den undichten Strahl durch die dichroitischen Spiegel um die Ausrichtung der Erkennung Pfad führen. Legen Sie eine sCMOS Kamera in den Strahl und stellen Sie sicher, dass der Strahl das Zentrum der Kamerachip trifft mit Hilfe von zwei Spiegeln (M2 und M3).
- Fügen Sie eine Rohr-Objektiv (TL; f = 300 mm) ca. 300 mm von der Kamera entfernt.
- Entfernen Sie kollimierten Lichtquelle und einstellen Sie den relativen Abstand zwischen Rohr-Objektiv und der Kamera, bis eine Muster an der Decke deutlich von der Kamera gelöst ist.
- Legen Sie einen Multi-Band-Pass-Filter (BF) vor der Röhre-Linse für Multi-Color-Fluoreszenz-Bildgebung.
3. Einrichten der Erregung Weg
- Installieren Sie die kollimierten Lichtquelle auf die Objektivhalter. Setzen Sie einen Fach-Spiegel (M4), die Strahl-Ausgabe umleiten vom Mikroskop um 90 Grad. Stellen Sie die Regler des dichroitischen Spiegels und der Falte-Spiegel iterativ, bis der Strahl durch Nadelstiche in der Strahl-Alignment-Tool geht.
- Lösen Sie die kollimierten Lichtquelle zu, und installieren Sie es auf dem Tisch, in dem der Strahl in Richtung der Mikroskop-Körper zeigt. Richten Sie den Strahl mit einem Strahl-Alignment-Tool und eine doppelte Lochkamera-System.
- Legen Sie eine Objektiv L4 (f = 400 mm; Ø = 2") in den optischen Pfad ca. 400 mm entfernt von der Objektivhalter. Installieren Sie das Objektiv und passen Sie die Position der L4 entlang der optischen Achse, bis eine perfekte Airy Scheibe Muster an der Decke gebildet wird.
Hinweis: Wenn das Objektiv einsetzen, sollte die Strahllage durch die Linse unverändert gehalten werden. Das Objektiv L4 hat einen SM2-Thread, der befestigt/losgelöst von 60 mm SM2-Thread Führungsscheibe problemlos ermöglicht. - Schrauben Sie das Ziel, und installieren Sie die kollimierten Lichtquelle mit einer offenen Iris. Verfolgen Sie hinunter die Strahl-Ausgabe vom Mikroskop mit einer Visitenkarte. Montieren Sie einen Spiegel M5 an der Stelle, wo die Größe des Balkens die kleinste ist, und ca. 400 mm entfernt von L4, was eine konjugierte Bildebene (cIP).
- Installieren Sie einen Spiegel M6 und reflektieren Sie den Strahl um 90 Grad. M5 und M6 mit Strahl-Alignment-Tool iterativ einstellen.
- Legen Sie eine L3-Objektiv (f = 150 mm) ca. 150 mm entfernt von M5. Verwenden Sie ein Scheren-Interferometer, um die Kollimation des Strahls Ausgabe sicherzustellen.
- Vorübergehend nehmen Sie L4 und Spur nach unten den Strahl der Fokuslage L3 zu finden Weg. Setzen Sie eine einachsigen Galvo Spiegel an dieser Stelle ist eine konjugierte zurück Brennebene (cBFP). Liefern Sie 0 Volt an den Galvo-Spiegel zu und drehen Sie die Inhaber der Galvo-Spiegel zu, damit es den Strahl um 90 Grad reflektiert.
- Legen Sie eine Falte-Spiegel M7. Richtig Platz L2 (f = 100 mm) genauso wie Schritt 3.6.
- Entfernen Sie kollimierten Lichtquelle aus dem Objekt-Halter. Installieren eine Kollimation Linse L1 (f = 100 mm), Faser-Adapter und Iris. Eine single-Mode-Faser an den Adapter anschließen und den Strahl durch die imaging-System zu senden.
- Setzen Sie L4 und Feinabstimmung des Systems, bis ein perfekter Airy Scheibe Muster zeigt sich an der Decke.
4. Einstellen der Zylinderlinsen
- Legen Sie eine Zylinderlinse (CL1, f = 400 mm) nach L1 und stellen Sie sicher, dass die zylindrische Linse den Strahl entlang der x-Achse fokussiert.
- Fügen Sie ein weiteres Zylinderlinse (CL2, f = 50 mm) in den Strahlengang. Verwenden Sie ein Scheren-Interferometer, um sicherzustellen, dass der Ausgang Lichtstrahl kollimiert ist.
Hinweis: Der Abstand zwischen den beiden zylindrischen Linsen beträgt 450 mm. Der Ausgang Lichtstrahl hat eine Kompressionsrate von 8 und eine länglich Oval geformte luftig Datenträger Muster bildet sich an der Decke.
5. Prüfung der Fliese Bildgebung
- 3D Hydrogel Probe vorbereiten. Mix-20 nm Perlen Crimson mit einem Hydrogel-Lösung, bestehend aus 12 % Acrylamide:bisacrylamide (29,1), 0,2 % (V/V) TEMED und 0,2 % (w/V) Ammonium Bleichen in 0,75 X TAE Puffer. Injizieren Sie 50 µL der gemischten Lösung in ein Strömungsraum wie an anderer Stelle11beschrieben. Nach 10 Minuten ist die 3D Hydrogel-Probe bereit, für die Bildgebung.
- Legen Sie die Probe auf dem Probenhalter. 638 nm Laser einschalten und einstellen die Befugnis, < 1 mW für Probe Erregung.
- Führen Sie die Kamera-Steuerungssoftware. Wählen Sie im Bereich Kamera-Erwerb-Einstellung interne im Trigger-Modus und klicken Sie nehmen video kostenlos Betriebsmodus.
- Leicht passen Sie die Position der Kamera, so dass das Bild befindet sich in der Mitte der Kamera bei 0 Volt auf den Galvo-Spiegel angewendet wird.
- Drehen Sie den horizontalen Knopf des Spiegels M5, eine stark geneigte Ausleuchtung zu erreichen.
Hinweis: Mit der Zunahme von den Beleuchtungswinkel wird das Hydrogel Bild klarer als der des Epi-Bildes, wie der Strahl dünner wird. Allerdings behält das Bild fast die gleiche Position. - Notieren Sie die Kachel-Bild. Die effektive Beleuchtung Breite11zu berechnen. Abbildung 3 zeigt beispielsweise die effektive Beleuchtung Breite von 12 µm.
(6) HIST imaging
- Bereiten Sie eine Daten-Ankaufskommission mit einer Klemmleiste angeschlossen. Verbinden Sie Benutzer 1 BNC-Stecker mit P0.0 durch eine elektrische Draht. Verwenden Sie Benutzer 1 als einen digitalen Ausgang für externe Ansteuerung sCMOS Kamera. Schließen Sie ein analoges AO0 zu einem Galvo-Spiegel-Treiber-Ausgang.
- TTL-Impulsfolgen aus P0.0 mit einem maßgeschneiderten Programm (Abb. 4A) generieren und legen Sie den Zeitraum = 400 ms und T_ON = 2 Ms. die erzeugten Impulse von Benutzer 1 BNC terminal durch ein digitales Oszilloskop überprüfen und schließen Sie die BNC-Kabel an die Kamera externer Trigger-Port.
Hinweis: Die Steuerungssoftware verwendet in diesem Papier ist auf Anfrage erhältlich. Wenn bei anderen Kamera Frameraten imaging, sollte der Zeitraum entsprechend angepasst werden. - Fegt einen Galvo-Spiegel über das maßgeschneiderte Programm zu starten. Passen Sie Vmin bis-500 mV und Vmax 500 mV für volle FOV Bildgebung. Beachten Sie, dass unter diesen Vorgang 3D Hydrogel Proben immer noch hohen Hintergrund ähnlich Epi Beleuchtung zeigen.
- Die Erwerb Kameraeinstellung ändern.
- Wählen Sie externe Trigger-Modus und nach unten (Sequential) in LightScan Plus Drop-Down-Menü wie in Abbildung 4Bdargestellt.
Hinweis: Bei dieser Einstellung die Kamera Bilder dauert nicht, wenn ein Triggersignal eingeschaltet ist. - Klicken Sie auf Scan Speed Control für Fenster Höhe und Linie Zeit Belichtungssteuerung und legen Sie die Werte um 180 Zeilen und 28 msbetragen.
Hinweis: Wenn eine Kachelbreite (WEff) 180 Zeilen (12 µm) und eine Integrationszeit pro Zeile (TInt) 28 ms beträgt, eine Verzögerungszeit zwischen den Zeilen (TD) bestimmt als TD = TInt/wEff = 0.156 Frau für imaging 2.048 x 2.048 Pixel total Erwerb ist 2.048 x TD + TInt = 346 ms, ~2.9 fps entspricht.
- Wählen Sie externe Trigger-Modus und nach unten (Sequential) in LightScan Plus Drop-Down-Menü wie in Abbildung 4Bdargestellt.
- Anzupassen Sie leicht Vmax und Vmin um schärfere Bilder zu erhalten.
- 3D Stapel Bilder indem das maßgeschneiderte Programm 3D Stack ON einschalten und die Anzahl der Stacks und die Schrittgröße angeben zu erhalten.
Ergebnisse
Als Beispiel, einzelsträngigen DNA mit Atto647N beschriftet mit einer Erregung Wellenlänge von 638 abgebildet war nm in einem 3D Hydrogel. DNA wurde mit dem Hydrogel-Netzwerk über eine Acrydite glyko-während Gel Polymerisation verankert. Die Bilder wurden bei 5 µm über der Oberfläche wie in Abbildung 5ein. Die HIST Bild zeigte viel weniger Hintergrund im Vergleich zu den Epi Bild, aus dem die Signal-Hintergrund-Verhältnis berechnet wurde, dass 1,9 ± 0,7 für die HIST Bild, während die meisten der Einzelmolekül-Spots von Epi kaum nachgewiesen werden konnte.
Einzelmolekül-RNA Fluoreszenz in Situ Hybridisierung (SmFISH) erfolgte mit 4 FISH-Sonden. Abbildung 5 b zeigt SmFISH Bilder von EEF2 (eukaryotic Übersetzung Dehnung Faktor 2) beschriftet mit AlexaFluor 647 auf A549 Zellen in einem bildgebenden Puffer (siehe unsere bisherige Arbeit bezüglich der Probe Vorbereitung11). Eine maximale Intensität Projektion wurde auf 20 Z-Stapel entspricht 5 µm Dicke durchgeführt. Die HIST Bild zeigte nicht nur deutlich verbesserte SBR, sondern auch mehr gleichmäßige Ausleuchtung im Vergleich zu Epi-Bild. Für Epi-Bildgebung, die Belichtungszeit war 400 ms für HIST imaging die Integration Zeit pro Zeile 32 ms, beide die gleiche Beleuchtungsstärke von 7,5 hatten mW gemessen vor dem Ziel. Die bildgebenden Geschwindigkeiten von Epi und HIST waren 2,5 fps.

Abbildung 1 . Mikroskop Körper, Laser und Ausrichtung Werkzeuge. (A) Ziel und Probenhalter. (B) Foto von Lasersystemen. LP, lang-Pass dichroitischen Spiegel; Λ/2, Halbwellen-Platten; PBS, polarisierenden Strahlteiler. (C) Collimated Lichtquelle. (D) Strahl Alignment-Tool mit zwei steckbaren Nadelstiche. (E) doppelte Lochkamera System. Bitte klicken Sie hier für eine größere Version dieser Figur.
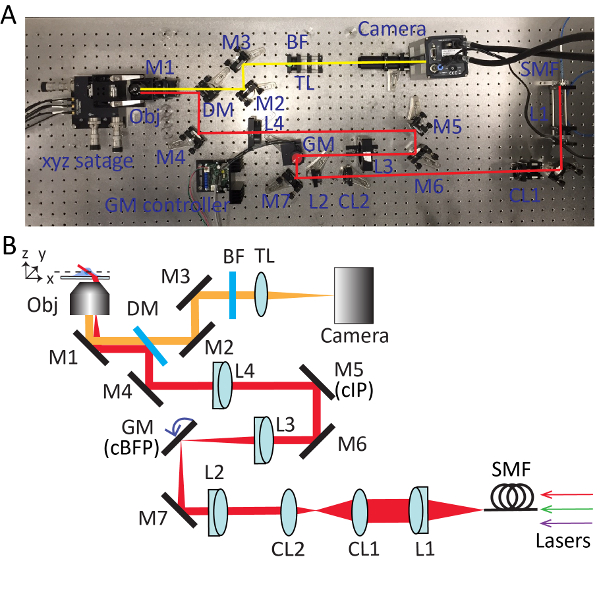
Abbildung 2 . Detaillierte Einstellungen für stark geneigten gefegt Kachel (HIST) Mikroskopie. Foto (A) und (B) schematische Darstellung HIST Mikroskopsystem. BF, Multi-Band-Pass-Filter; CL1-2, zylindrische Linsen; DM, dichroitischen Spiegel; GM, Galvo-Spiegel; BF, Bandpass-Filter; M1-7, Spiegel; L1-4, Linsen; SMF, single-Mode-Faser; TL, Rohr-Objektiv; cIP, konjugierte Bildebene; cBFP, konjugiert zurück Brennebene. Bitte klicken Sie hier für eine größere Version dieser Figur.
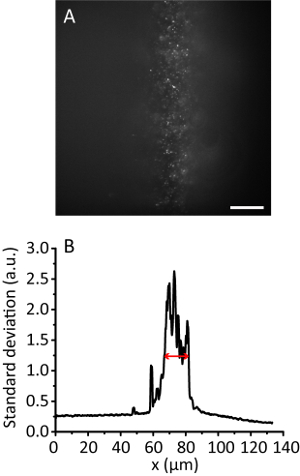
Abbildung 3 . Fliesen-Beleuchtung mit einem Verdichtungsverhältnis von 8. (A) Fluoreszenzbild von 20 nm-Perlen in ein 3D Hydrogel. Maßstabsleiste, 20 µm. (B) Standardabweichung Projektion entlang der y-Richtung von A, durch 10 Datenpunkten geglättet. Der rote Pfeil zeigt eine effektive Beleuchtung Breite von 12 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
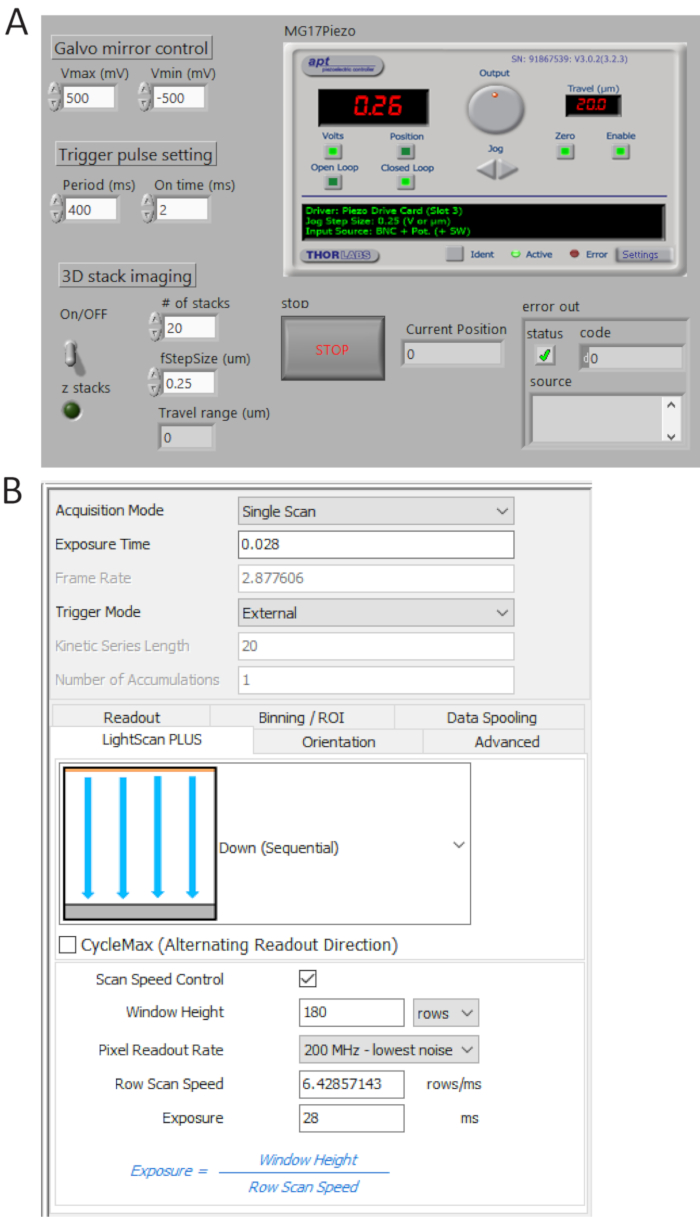
Abbildung 4 . Kontrolle und imaging-Software vorderen Platten. (A) A maßgeschneiderte LabView-Programm synchron steuert das Scannen von Galvo-Spiegel, die ab Erwerb sCMOS Kamera und die Bewegung der Piezo-Bühne. (B) Erwerb Kameraeinstellung Systemsteuerung. Bitte klicken Sie hier für eine größere Version dieser Figur.
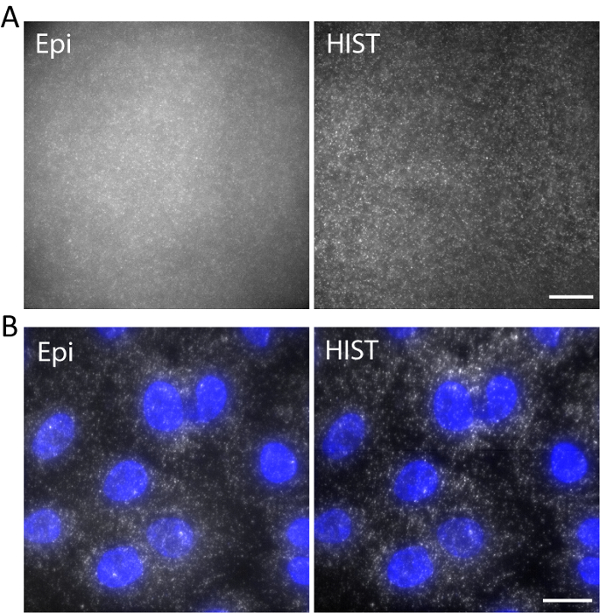
Abbildung 5. (A) mit der Bezeichnung der Bilder von Atto647N DNA in eine 3D Hydrogel mit Epi und HIST Beleuchtung. (B) SmFISH Bilder von EEF2 mit 4 Sonden Fisch auf A549 Zellen durch Epi und HIST Mikroskopie. DAPI Fleck wird blau dargestellt. Skalieren Sie Bars, 20 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Es gibt zwei wichtige Schritte in diesem Protokoll. Die erste ist die richtige Platzierung von L4 im Schritt 3.3, um sicherzustellen, dass der einfallende Strahl durch die Mitte der Linse verläuft und eine perfekte Airy Scheibe Muster an der Decke entsteht. Die Position des L4 bestimmt die Platzierung aller anderen optischen Komponenten, einschließlich der M5, L2, L3 und GM. Der zweite wichtige Schritt ist die Synchronisation. Um die Out of Focus Hintergrund abzulehnen, sollten aktive Pixel, deren effiziente Detektion Breite gleich der Breite der Fliese ist, mit Strahl fegen synchronisiert werden. Daher ist es notwendig, die effektive Beleuchtung Breite eines Balkens Kachel (Schritt 5.6) zu messen und Set Kameraparameter entsprechend Schritt in 6.4.
Wenn mit sehr großen FOV imaging, zeigt die vorgestellte Methode einen erhöhte Hintergrund auf der einen Seite im Vergleich zu der anderen Seite. Dies ist zurückzuführen auf leicht veränderter Winkel der Beleuchtung an verschiedenen bildgebenden Positionen. Umsetzung eines zweiten Galvo-Spiegels anstelle von M5 lindert dieses Problem wie gezeigt durch synchron Verstellen der Position und der Scan Winkel11vor. Statt ab Lager achromatischen Doublets wird eine telezentrischen Scan Objektiv auch hilfreich sein. Jedoch für eine Fläche von imaging < 8.080 µm2, einzelne Galvo Spiegel kehren war ausreichend. HIST-Mikroskopie hat ein Limit von bildgebenden Tiefe, allerdings ist es eine gute SBR erhalten beim bis zu ~ 15 µm mit einem 12 µm Fliese Strahl und ein NA 1,45 Öl eintauchen Objektiv11abbilden können.
In diesem Protokoll haben wir ein Strahl Komprimierungsverhältnis von 8 um einen Kachel-Strahl zu machen. Eine dünnere Beleuchtung lässt sich um höhere SBR zu erreichen, die möglicherweise stark für Einzelmolekül-Gewebe imaging11in der HIST Mikroskopie. Allerdings sollte in diesem Fall Immunofluoreszenz-Effekt durch eine erhöhte Erregung Intensität betrachtet werden während der aktuellen Strahl Verdichtungsverhältnis reduzierte Immunofluoreszenz in 3D Bildgebung im Vergleich zu Epi11zeigte. Im Vergleich zu Licht-Blatt Mikroskope mit zwei Orthogonal platzierte Zielen, ist HIST Mikroskopie einfach zu implementieren und kompatibel mit herkömmlichen Probe Vorbereitungen. Die verbesserte SBR und großen FOV HIST-Mikroskopie ist geeignet für die Untersuchung der Interaktionen und Dynamik der einzelnen Biomoleküle in mehreren Zellen und kann weiter verwendet werden in Höchstauflösung Bildgebung und Einzelmolekül-Tracking.
Offenlegungen
University of Central Florida hat sich über die Arbeit, die in diesem Dokument beschriebenen patent angemeldet.
Danksagungen
Diese Arbeit wurde von der Defense Advanced Research Projekte Agency (DARPA) (HR00111720066) und National Science Foundation (NSF) (1805200) unterstützt. Wir danken Michael Serge in Andor Technology für großzügig die sCMOS Kamera ausleihen.
Materialien
| Name | Company | Catalog Number | Comments |
| 1" Achromatic doublet | Thorlabs | AC254-060-A-ML | Collimator |
| 1" Achromatic doublet | Thorlabs | AC254-100-A-ML | L1,L2 |
| 1" Achromatic doublet | Thorlabs | AC254-300-A-ML | TL |
| 1" Broadband Dielectric Mirrors | Thorlabs | BB1-E02-10 | M1~M7 |
| 1" Cylindrical Lenses | Thorlabs | LJ1363RM-A | CL1 |
| 1" Cylindrical Lenses | Thorlabs | LJ1695RM-A | CL2 |
| 1" square kinematic mount | Edmund Optics | 58-857 | For dichroic mirror mounting |
| 1" Threaded Cage Plate | Thorlabs | CP02 | For holding other lenses |
| 2" Achromatic doublet | Thorlabs | AC508-150-A-ML | L3 |
| 2" Achromatic doublet | Thorlabs | AC508-400-A-ML | L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01 | For holding L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01T | For holding L3 |
| 2% Bis Solution | Bio Rad | 64085292 | hydrogel component |
| 20 nm fluorescent beads | Thermo Fisher | F8782 | For testing imaging |
| 30 mm Cage Right-Angle Kinematic Mirror Mount | Thorlabs | KCB1 | For objective & camera mounting |
| 30mm Cage System Iris | Thorlabs | CP20S | |
| 3-Axis NanoMax Stage | Thorlabs | MAX311D | |
| 40% Acrylamide Solution | Bio Rad | 64148001 | hydrogel component |
| 405 nm laser | Cobolt | Cobolt 06-MLD | |
| 50x TAE buffer | Bio-Rad | 161-0743 | hydrogel component |
| 561 nm laser | Cobolt | Cobolt 06-DPL | |
| 638 nm laser | Cobolt | Cobolt 06-MLD | |
| Ammonium persulfate | Sigma | A3678-25G | hydrogel component |
| Beam alignment tool | custom made | ||
| BNC terminal blocks | Natural Instruments | BNC-2110 | |
| Cage plate with M9 x 0.5 internal threads | Thorlabs | CP1TM09 | For holding aspheric lens |
| Cage System Rods | Thorlabs | SR series | |
| Cell culture & smFISH | See a reference [11] | ||
| Double side tape | Scotch | 515182 | Flow chamber |
| Epoxy | Devcon | 14250 | Flow chamber |
| Galvo mirror | Thorlabs | GVS211 | GM |
| Galvo System Linear Power Supply | Thorlabs | GPS011 | |
| Half wave plate | Thorlabs | WPH10M-405/561/633 | Power adjustment |
| long-pass dichroic mirror | Chroma | T550lpxr | For combining lasers |
| Microscope slides | Fisherbrand | 12549-3 | Flow chamber |
| Mikroskopische Deckglaser | Hecht Assistent | 990/5024 | Flow chamber |
| Mounted Frosted Glass Alignment Disk | Thorlabs | DG10-1500-H1-MD | For double pinhole system |
| Mounted rochester aspheric lens | Thorlabs | A230TM-A | |
| Multi-band dichroic mirror | Semrock | Di03-R405/488/561/635-t3 | DM; 3 mm thickness |
| Multi-band filter | Semrock | FF01-446/523/600/677-25 | BF |
| Multimode fiber | Thorlabs | M31L02 | MMF |
| N,N,N',N'-tetramethyl ethylenediamine | Sigma | T7024-25ML | hydrogel component |
| NI-DAQ board | Natural Instruments | PCI-6733 | |
| Ø1" Kinematic Mirror Mount | Thorlabs | KM100 | For holding mirrors |
| Objective lens | Olympus | PLANAPO N 60X | 60X 1.45NA oil |
| Pedestal Base Clamping Forks | Newport | 9916 | |
| Pedestal Pillar Posts | Thorlabs | RS1P8E | |
| Piezo controller | Thorlabs | BPC303 | |
| Polarized beam splitter | Thorlabs | PBS251 | For combining lasers |
| RMS-SM1 adapter | Thorlabs | SM1A3TS | For objective lens |
| Rod holder | custom made | ||
| Rotation cage mount | Thorlabs | RSP1/CRM1/CRM1P | For HWP & cylindrical lens mounting |
| sCMOS camera | Andor | Zyla-4.2P-CL10 | |
| Shearing interferometer | Thorlabs | SI100 | Beam collimation test |
| Single mode fiber | Thorlabs | P5-405BPM-FC-2 | SMF |
| SM1 Lens Tubes | Thorlabs | SM1S25 | For double pinhole system |
| SM1 Slotted Lens Tube | Thorlabs | SM1L30C | For double pinhole system |
| Stage mount | custom made | ||
| threaded fiber adapter | Thorlabs | SM1FC | |
| Z-Axis Translation Mount | Thorlabs | SM1Z | Fiber coupling |
Referenzen
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361, 880-887 (2018).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Forster resonance energy transfer. Science. 359, (2018).
- Raj, A., van Oudenaarden, A. Single-Molecule Approaches to Stochastic Gene Expression. Annual Review of Biophysics. 38, 255-270 (2009).
- Wilson, T. Resolution and optical sectioning in the confocal microscope. Journal of microscopy. 244, 113-121 (2011).
- Sase, I., Miyata, H., Corrie, J. E., Craik, J. S., Kinosita, K. Real time imaging of single fluorophores on moving actin with an epifluorescence microscope. Biophysical Journal. 69, 323-328 (1995).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305, 1007-1009 (2004).
- Cella Zanacchi, F., et al. Live-cell 3D super-resolution imaging in thick biological samples. Nature Methods. 8, 1047 (2011).
- Galland, R., et al. 3D high- and super-resolution imaging using single-objective SPIM. Nature Methods. 12, 641 (2015).
- Gustavsson, A. K., Petrov, P. N., Lee, M. Y., Shechtman, Y., Moerner, W. E. 3D single-molecule super-resolution microscopy with a tilted light sheet. Nature Communications. 9, 123 (2018).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5, 159-161 (2008).
- Tang, J., Han, K. Y. Extended field-of-view single-molecule imaging by highly inclined swept illumination. Optica. 5, 1063-1069 (2018).
- Han, K. Y., Kim, S. K., Eggeling, C., Hell, S. W. Metastable Dark States Enable Ground State Depletion Microscopy of Nitrogen Vacancy Centers in Diamond with Diffraction-Unlimited Resolution. Nano Letters. 10, 3199-3203 (2010).
- Sinkó, J., Szabó, G., Erdélyi, M. Ray tracing analysis of inclined illumination techniques. Optics Express. 22, 18940-18948 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten