Method Article
Vorhersage In Vivo Nutzlasten Lieferung mit einem Blut-Hirnschranke Tumor in einer Petrischale
In diesem Artikel
Zusammenfassung
Drug targeting zu Tumoren des zentralen Nervensystems ist eine große Herausforderung. Hier beschreiben wir ein Protokoll, um eine in-vitro-Mimik der Blut-Hirn-Tumor-Schranke mit murinen und/oder menschlichen Zellen zu produzieren und ihre Relevanz für die Vorhersagbarkeit des zentralen Nervensystems Tumor targeting in vivo zu diskutieren.
Zusammenfassung
Hochselektiver naturgemäß, die Blut - Hirn-Schranke (BBB) ist essentiell für das Gehirn-Homöostase in physiologischen Bedingungen. Jedoch in Zusammenhang mit Hirntumoren schirmt die molekulare Selektivität der BBB auch der neoplastischen Zellen durch die Blockierung der Lieferung von peripher verabreichten Chemotherapien. Die Entwicklung neuartiger Medikamente (einschließlich Nanopartikel) malignen Hirntumoren im Idealfall Ausrichtung erfordert den Einsatz von präklinischen Tiermodellen, Transcytosis und Antitumor-Wirkung des Medikaments zu studieren. Um das 3R-Prinzip entsprechen (zu verfeinern, zu reduzieren und ersetzen) zu verringern die Zahl der Versuchstiere im Versuchsaufbau und Hochdurchsatz-Screening von eine große Bibliothek von Antitumormittel durchführen, entwickelten wir ein reproduzierbares in-vitro-Mensch und murine Mimik der Blut-Hirn-Tumor-Schranke (BBTB) mit dreischichtigen Kulturen von Endothelzellen Astrozyten und Patienten abgeleitet Glioblastom Sphären. Für höhere Skalierbarkeit und Reproduzierbarkeit wurden kommerzielle Zelllinien oder verewigt Zellen in maßgeschneiderten Bedingungen zur die Bildung einer Barriere, die ähnlich der tatsächlichen BBB ermöglichen. Hier beschreiben wir ein Protokoll, um ein BBTB Mimic durch Kultivierung endotheliale Zellen in Kontakt mit Astrozyten bei bestimmten Zelldichten auf Einsätze zu erhalten. Diese BBTB Mimik kann beispielsweise für die Quantifizierung und konfokale Bildgebung der Nanopartikel Passage durch die Endothelzellen und astrocytic Barrieren, zusätzlich zu der Bewertung der Tumor Zelle Ausrichtung innerhalb des gleiche Tests verwendet werden. Darüber hinaus zeigen wir, dass die gewonnenen Daten verwendet werden können, um das Verhalten von Nanopartikeln in präklinischen Tiermodellen. In einer breiteren Perspektive dieses in-vitro-Modell an anderen neurodegenerativen Erkrankungen für die Bestimmung der Passage von neuen therapeutischen Molekülen durch die BBB angepasst werden konnte und/oder ergänzt werden mit Gehirn Organellen, die Wirksamkeit von direkt zu bewerten Medikamente.
Einleitung
Die neurovaskuläre Einheit besteht aus Neuronen und Astrozyten der BBB, durch komplizierte Verbindungen zwischen Perizyten, Astrozyten und Endothelzellen der zugehörigen Basalmembran bilden das Gehirn Microvasculature1gebildet. Diese engen Zellwand gebildet durch kontinuierliche, nonfenestrated Schiffe fein reguliert die Bewegung von Ionen und Moleküle (einschließlich Hormone, Nährstoffe oder Drogen), sondern auch der zirkulierenden Zellen1. Die besonders niedrige Transcytosis durch die BBB hoch Molekulargewicht Moleküle, wie therapeutische Antikörper, Wirkstoff-Konjugate oder Nanocompounds, schränkt drastisch die Fortschritte in der Arzneimittelforschung für neurologische Krankheiten, einschließlich maligne Gliome2. In der Tat, oral oder intravenös gelieferte Chemotherapien erreichen das Gehirn Parenchym oft bei unzureichend niedrigen Konzentrationen induzieren eine antitumor-Wirkung oder sind einfach nicht in der Lage, überqueren Sie die BBTB um die neoplastischen Zellen3erreichen. Einige präklinische und klinische Studien haben nicht behandelte die Frage der BBTB Penetration aber haben versucht, die BBTB vorübergehend, stören zum Beispiel mit fokussierten Ultraschall4,5, oder um es durch die direkte in Situ zu umgehen Lieferung von Drogen6. Jedoch konnten keine dieser Techniken die unvermeidlichen Tumor Erweiterung entgegenzuwirken oder Rückfall. Daher sollte bei der Entwicklung neuartiger antiglioma Therapien die Diffusion durch die BBTB als einer der kritischen Aspekte für die erfolgreiche Durchführung der Therapeutika7betrachtet werden.
Aufgrund der sehr komplexen Natur der Zelle Interaktionen innerhalb der BBTB scheinen in vivo Studien bei Labortieren die offensichtliche Wahl, wenn im Laufe der Moleküle aus Blut zum Gehirn zu studieren. High-Skala in-vivo-Methoden sind jedoch relativ komplex zu etablieren und erlauben daher, nicht das Hochdurchsatz-Screening von Molekülen in einer angemessenen Zeit zu einem vernünftigen Preis. Noch wichtiger ist, hat Tierversuche zu folgen die 3R ethische Richtlinie definiert als i) verfeinern, Ii) zu reduzieren, und für den aktuellen Kontext relevant, Iii) ersetzen durch alternative Protokolle (z. B. in Vitro/in-Silico-Methoden). Daher neu zu in-vitro-BBTB erscheint als eine interessante und attraktive Möglichkeit, aber sie stellt auch eine komplexe Aufgabe, die von verschiedenen Einschränkungen in Frage gestellt. Viele Versuche, neu dieses komplexeste Fach mit kultivierten Primärzellen oder Zell-Linien von Hunde, Schweine, murine und auch menschlichen Ursprungs (wie Rahman Et Al.8 und Helms Et Al.9überprüft) veröffentlicht worden. Diese Modelle verfügen über dreidimensionale mikrofluidischen Systemen10, BBB-on-a-Chip11,12, und eine Vielzahl von Varianten, basierend auf der klassischen Ko-Kulturen in fügt Systeme. Aktuelle mikrofluidischen und Chip-Systeme sind jedoch entweder nicht geeignet für schnelle, Hochdurchsatz-Droge-Validierung Studien13,14 oder sind derzeit nicht kompatibel mit dem Studium der Drug-Delivery Hirntumoren. Darüber hinaus zeigte die Überprüfung der 155 veröffentlichten Modellen mit Primärzellen, induzierbaren pluripotente Stammzellen (iPSC) oder kommerzielle Zelllinien alle Co kultiviert auf Einsätze einen Trend für interstudy Diskrepanz in ihren Messungen und/oder Schlussfolgerungen8. Dieser Mangel an Korrelationsfaktoren Reproduzierbarkeit konnte mit i) normalisierten Kulturbedingungen, zum Beispiel korreliert werden mit der optionalen Beschichtung mit Basalmembran Matrixproteine in der Zelle Kulturgefäß, (Ii) eine erhöhte Anzahl von Subkultur und Nutzung der Serum-haltigen Medien, beide große Fahrer genetische und phänotypische Modifikationen der Zelle Linien15, oder Iii) die Schwierigkeit, das richtige Gleichgewicht zwischen den Astroglial und endotheliale Komponenten in einer Petrischale reproduzierbar neu zu erstellen. Obwohl die Verwendung von verewigt Zellen oder kommerzielle Zelle Linien um eine in-vitro-Modell der BBB fehlen einige der Eigenschaften im Vergleich zu ähnlichen Modellen, die nur Primärzellen verwenden zu etablieren, in dem beschriebenen Verfahren zeigen wir, dass die richtige Kombination von Exponaten Zellen eine sehr vergleichbarer Leistung zu veröffentlichten Studien in anderen Modellen von Referenz16,17. Schließlich, das Fehlen eines robusten und reproduzierbare Modells, im Laufe der therapeutischen Ausrichtung von Hirntumoren durch die BBTB Verbindungen zu studieren hat uns motiviert, die hier beschriebenen Methoden zu entwickeln.
Denn Ziel war es, das Modell zu nutzen, um die in-vivo Lieferung von Nanopartikeln in präklinischen Tiermodellen vorherzusagen, validiert wir zuerst das BBTB Modell durch die Verwendung von Einsätzen mit murinen endothelial Zellen in Kontakt mit murinen Astrozyten. Darüber hinaus haben wir auch das Modell, um bestimmte menschliche Zelllinien verwenden optimiert. Einmal stabilisiert, sind die Zelle Barrieren Kulturen mit Patienten abgeleitet Glioblastom Kugeln oder kommerzielle Gliom-Zell-Linien übertragen. Danach können die Transcytosis von Nanopartikeln und Tumor Zelle gezielt visualisiert durch konfokale Mikroskopie und quantifiziert durch das Sammeln von Proben im Laufe der Zeit. Wichtig ist, könnte erzielten Ergebnisse mit den BBTB Mimik zuverlässig dem Verhalten der in-vivo, unterstützen die Verwendung des mimischen vor dem BBTB Nanopartikel die präklinische Validierung Vorhersagen.
Protokoll
Die Tierversuche wurden vom Ausschuss für Tierversuche der Bezirk Southern Finnland (ESAVI/6285/04.10.07/2014) genehmigt.
1. Einsetzung der BBTB Mimik
Hinweis: Zellkulturmedium und Ergänzungen sind in der Tabelle der Materialienaufgeführt.
- Vorbereitung der Astrozyten
Hinweis: Die folgenden Bände eignen sich für eine 10 cm Petrischale oder einem T75 Zelle Kultur Kolben.- Waschen Sie unter einer sterilen Zelle Kultur Haube sorgfältig die kultivierten Astrozyten mit 5 mL sterilem Phosphat-gepufferte Kochsalzlösung (PBS). Sanft die PBS mit Hilfe einer Vakuumpumpe zu verwerfen und 2 mL der Zelle Dissoziation Reagenz für 5 min (bei 37 °C, siehe die Tabelle der Materialien), die Zellen zu lösen. Überprüfen Sie die Ablösung der Zelle unter dem Mikroskop. Nicht mehr als 5 min Inkubation, die Belastung der Zellen zu begrenzen.
- Hinzugeben Sie 10 mL sterile komplette Astrozyten Zellkulturmedium (ABM +) zu hemmen die Aktivität der Zelle Dissoziation Reagenz Gefäß. Verwenden Sie eine sterile serologische Pipettieren übertragen die freistehenden Zellen aus dem Gefäß auf einem sterilen 15 mL-Tube. Zentrifugieren die Zellsuspension für 3 min bei 250 Rcf (Beschleunigung: 9 Rcf/s, Verzögerung: 5 Rcf/s) bei Raumtemperatur (RT).
- Unterdessen bereiten die Einsätze (siehe die Tabelle der Materialien): mit sterilen Pinzette, legen Sie die Einsätze mit dem Gehirn nach oben (Abb. 1A) auf dem Deckel einer sterilen 6-Well-Platte (Abbildung 1 b). Überprüfen Sie vorher, ob die Platte auf dem Kopf stehend auf die Einsätze platziert werden kann, ohne zu berühren oder bewegen die Einsätze während des Prozesses.
Hinweis: Die richtige Platzierung der Einsätze ermöglicht die Einklemmung der Astrozyten Suspension zwischen der Membran und der Unterseite des Brunnens. - Einmal zentrifugiert, verwerfen Sie sorgfältig den Überstand von der Zellsuspension; Aufschwemmen der Astrozyten Pellet in 1 mL ABM + durch sanft das Pellet auf dem Rohr'resuspending s Wand bis zu 5 X. Vermeiden Sie übermäßige Pipettieren der Zellen, um die Belastung auf die Zellen beschränken. Zählen der Zellen und passen Sie die Zelldichte Aussetzung bis 1,5 x 105 Zellen in 400 µL ABM + / einfügen.
- Legen Sie die Zellsuspension in der Mitte der Gehirn-Seite des Einsatzes's Membran (Abbildung 1 b) und sehr sorgfältig mit Kapillare Kraft mit einer sterilen Pipettieren Spitze zu verbreiten. Vermeiden Sie direkten Kontakt, da die Membran besonders empfindlich ist.
- Mit der Gehirn-Seite der Einsätze immer noch hoch, 6-Well-Platte wieder auf die Einsätze zu platzieren. Dies sorgt dafür, dass die Zellsuspension zwischen der Membran und der eigentliche Grund des Brunnens (Abbildung 1 gefangen ist). Vermeiden Sie Luftblasen in der Zellsuspension, da es die homogene Ausbreitung der Astrozyten auf der Membran verhindert.
- Legen Sie die Platte und die Einsätze mit der Gehirn-Seite nach oben, im Inkubator (bei 37 °C mit 5 % CO2) erlauben die Zelladhäsion für ein Minimum von 2 h (murine verewigt Astrozyten) und bis zu 6 h (menschliche primäre Astrozyten).
Hinweis: Da die Einsätze auf dem Kopf stehend gepflegt werden, ist die Visualisierung der Zelladhäsion nicht möglich unter dem Mikroskop. Es empfiehlt daher eine separate regelmäßige Zelle Kulturgefäß Saatgut und die Zelladhäsion im Behälter im Laufe der Zeit zu kontrollieren. Sorgfältige Bearbeitung der Membran ist ein muss, da die Ergebnisse unzuverlässig werden, wenn Membranen beschädigt werden. - Am Ende der Inkubationszeit überprüfen Sie fehlender Zelle Aussetzung Lecks außerhalb der Aussaat zu, und verwerfen Sie die Einsätze zu, wenn sie undicht sind. Wiederherstellen Sie die 6-Well-Platte in seine normale Position, mit Einsätzen, die jetzt das Blut nach oben (Abb. 1A). Jedes gut 2,6 mL ABM + hinzufügen. Gießen Sie 2,5 mL komplette Astrozyten Medium in jedem einfügen und platzieren Sie die Platte in den Inkubator (bei 37 °C mit 5 % CO2).
- Vorbereitung von Endothelzellen
Hinweis: Für das murine Gehirn mikrovaskuläre Endothelzellen (bEND3) müssen die Zellen 100 % Zusammenfluss um maximale Zell-Zell Kontakte auslösen die optimale tight Junction-Protein-Expression auf den Tag des Experiments sicherzustellen erreichen. Dies gilt nicht für den menschlichen Nabelader endothelial Zellen (HuAR2T), wie das Vorhandensein von Astrozyten für eine tight Junction-Protein-Expression für diese Zellen erforderlich ist.- Gehen Sie wie oben beschrieben für den Astrozyten (Schritte 1.1.1 und 1.1.2.). Sobald zentrifugiert, sorgfältig entsorgen des Überstands; Aufschwemmen der Endothelzellen Pellet in 1 mL Kulturmedium komplette Endothelzellen (EBM +) durch langsam Pipettieren der Zellsuspension auf dem Rohr's Wand bis zu 5 X. Vermeiden Sie übermäßige Pipettieren der Zellen, um die Belastung auf die Zellen beschränken. Zählen der Zellen und passen Sie die Zelldichte Aussetzung auf 2 x 105 Zellen in 2,5 mL/Einfügen von Endothelzellen Kulturmedium ohne Serum (EBM-) und vaskulären endothelialen Wachstumsfaktor-A (VEGF-A).
- Nehmen Sie die Platte mit den Einsätzen, sorgfältig verwerfen Sie das Medium von der Blut-Seite, und ersetzen Sie es mit 2,5 mL der Suspension Endothelzellen. Die Platte in den Inkubator zurück (bei 37 °C mit 5 % CO2) und lassen Sie es über Nacht für die Endothelzellen zur Einhaltung der Membran.
- Bereiten Sie am nächsten Tag eine sterile 6-Well-Platte durch die Übertragung von 3 mL vorgewärmte Astrozyten serumfreien Medium (ABM-) in jede Vertiefung. Durch den Umgang mit den Einsätzen mit der sterilen Pinzette, sorgfältig verwerfen Sie die endotheliale komplette Medium von der Blut-Seite, legen Sie den Einsatz in der neuen Platte mit ABM-, und 2,5 mL EBM-.
Hinweis: Die Verwendung von EBM - ist entscheidend für den Aufbau der endotheliale Barriere (siehe die Diskussion Abschnitt). - Die Einsätze in den Inkubator zu verlassen (bei 37 °C mit 5 % CO2) mit minimalen körperlichen Störung und Temperaturschwankungen für 5 Tage, so dass die Produktion der endothelialen Basalmembran Astrozyten Kontakte mit Endothelzellen, und schließlich die BBTB mimischen Bildung. Das Medium am Tag des Transfers auf Gliom Zellkulturen zu ersetzen (siehe Abschnitt 1.4).
- Messung der BBTB mimischen Permeabilität (optional)
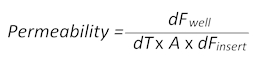
- Passive Diffusion von kleinen Molekulargewicht Fluoreszenzfarbstoff Natrium-Fluorescein (Na-Fl) im Laufe der Zeit aus dem Blut auf die Gehirn-Seite der Einsätze erlaubt die Berechnung der Permeabilität Werte nach folgender Formel:
Hier, dFgutist die Fluoreszenz-Messwert in den Brunnen an einem bestimmten Zeitpunkt abzüglich der Zellwert Kulturmedium Autofluoreszenz, dT ist die Zeit in Sekunden, A ist die Oberfläche der Barriere in Quadratzentimeter und dFEinfügen wird die Fluoreszenz-Wert gemessen im Einsatz zum gleichen Zeitpunkt abzüglich der mittleren Autofluoreszenz-Wert). - Sammle 100 µL des Mediums aus dem Blut und der Gehirn-Seiten des BBTB Mimik und jeder von ihnen auf einer separaten mit flachem Boden, schwarz 96-Well-Platte für nachfolgende Fluoreszenz-Messungen übertragen. Verwenden Sie die Normalpapier als Rohling die Autofluoreszenz zu korrigieren.
- Bereiten Sie 2,5 mL pro Bohrloch des Na-Fl (50 µM) in EBM-. Prewarm die Na-Fl-Lösung auf 37 ° C. Ersetzen Sie die Medien von der Blut-Seite der Einsätze durch das Medium einen Timer mit Na-FL. zu beginnen, sobald das Medium ersetzt wird.
- Sorgfältig sammeln 100 µL der Medien aus dem Blut und der Gehirn-Seite der Einsätze auf 5, 30, 60 und 120 min. übertragen jede Probe, Brunnen von den schwarzen 96-Well-Platte zu trennen.
- Entsprechend, ersetzen Sie die gesammelten Medien aus der Einsätze, das Volumen Gleichgewicht zwischen beiden Seiten. Legen Sie die Einsätze zurück in den Inkubator zwischen jeder Probenentnahme, die Temperaturschwankungen zu minimieren.
- Quantifizieren die Fluoreszenz aus den gesammelten Proben, mit einem Teller-Reader mit dem Filter setzen auf 480/560 nm (Anregung und Emission, beziehungsweise).
Hinweis: Fluoreszenz von der Gehirn -Seite ist fast unsichtbar zum Zeitpunkt 5 min Zeit. Hohe Werte im Vergleich zu den Rohling zeigen ein Leck / Schaden auf den Einsatz's Membran oder die Schranke; Daher schließen Sie diese aus weitere Analysen. Erwartete Na-Fl-Durchlässigkeit-Werte für die BBTB sollte die 10-5 bis 10-6 cm/s-Bereich (Tabelle 1).
- Passive Diffusion von kleinen Molekulargewicht Fluoreszenzfarbstoff Natrium-Fluorescein (Na-Fl) im Laufe der Zeit aus dem Blut auf die Gehirn-Seite der Einsätze erlaubt die Berechnung der Permeabilität Werte nach folgender Formel:
- Vorbereitung von Gliom Zellen
Hinweis: Obwohl Patienten abgeleitet Glioblastom Kugeln hier verwendet werden, kann das folgende Protokoll für Anhänger, im Handel erhältlichen Glioblastom-Zellen wie z. B. U - 87 MG leicht angepasst werden.- Optional für die Immunfluoreszenz Bildgebung legen Sie bis zu vier Runden sterilen Borosilikat Deckgläsern (Ø 0,9 cm) pro Bohrloch in einer 6-Well-Platte mit 2 mL Poly-D-Lysin (0,01 %). Bei Raumtemperatur für 30 min inkubieren.
- Unterdessen übertragen Sie sorgfältig die Tumor-Kugeln aus der Zelle Kulturgefäß auf eine 15 mL steriles Röhrchen mit einer sterilen serologische pipettieren. Zentrifugieren Sie die Tumor-Kugeln für 3 min bei 250 Rcf.
- Den Überstand verwerfen, sanft Aufschwemmen der Kugeln in 1 mL bFGF/EGF-frei (GBM)-Gliom Zelle Medium und zählen der Zellen. Passen Sie die Zelldichte bis ca. 104 Kugeln/mL (105 Zellen/mL) in GBM-.
- Die Poly-D-Lysin aus dem Brunnen zu verwerfen und spülen Sie sie 3 X mit sterilen PBS. Die Platte mit 3 mL/auch der Tumor Sphäroid Suspension Saatgut und die Einsätze durch die BBB-Imitation auf den Tumor Zellsuspension zu übertragen.
- Über Nacht inkubieren (bei 37 °C mit 5 % CO2) Gleichgewicht zwischen Blut und Gehirn Tumor Seiten des Assays ermöglichen. Am nächsten Tag ersetzen Sie die Medien in der Blut-Seite mit EBM-ergänzt durch die Moleküle/Drogen/Nanopartikel von Interesse. Proben werden im Laufe der Zeit für direkte Quantifizierung gesammelt, wie im vorherigen Abschnitt beschrieben. Zellen sind einen genauen Zeitpunkt für die Fluoreszenz-Bildgebung fixiert (siehe Abschnitte 2.1 und 2.2).
(2) hochauflösende konfokale Abbildung von der BBTB
Hinweis: 4 % Paraformaldehyd (PFA, pH 7,4, 6 mL pro BBTB replizieren) ist immer in PBS frisch zubereitet. Halten Sie es auf dem Eis.
Vorsicht: PFA ist krebserregend. Nitril-Handschuhe zu handhaben PFA und bereiten Sie die Lösung unter einem chemischen Abzug zu verwenden.
-
BBTB endotheliale Expression tight Junction-Proteine
- Spülen Sie die beiden Seiten der Membran mit eiskaltem PBS (3 X 5 min, 2,5 ml/einfügen, 3 mL/gut). Verwerfen der PBS und fügen Sie 3 mL und 2,5 mL eiskaltes 4 % PFA in den Brunnen und in der Einlage bzw.. Inkubation auf Eis für 10 min. verwerfen die PFA (entsprechend der Institution's gefährliche Chemikalienentsorgung) und Spülen mit PBS 3 X bei RT (2,5 mL/einfügen "," 3 mL/gut).
Hinweis: Einmal festgelegt, können Proben mit PBS-Puffer (2,5 mL/einfügen "," 3 mL/Brunnen) bei 4 °C für eine Woche gelagert werden. - Verwenden Sie ein Wattestäbchen abwischen der Gehirn-Seite des Einsatzes und der Astrozyten zu entfernen. Mit einem scharfen Skalpell schneiden Sie vorsichtig die Membran in vier gleich große Stücke von zwei senkrechte Schnitte, bilden ein Kreuz. Als nächstes fügen Sie das Skalpell an der Stelle, wo die Membran an der Insert-Wand befestigt ist, und drehen Sie den Einsatz mit der anderen Hand, die vier Proben zu befreien. Übertragen Sie jede Probe feine Pinzette, sorgfältig auf einer 24-Well-Platte mit 200 µL PBS/gut, mit dem Blut Seite nach oben in jeder gut werden.
- Blockieren Sie die Membranen mit 10 % fötalen Rinderserum mit PBS-Puffer (für 30 min bei RT, 200 µL/Well). Vorbereiten der 1° Antikörperlösung Immunostaining der engen Kreuzung Proteine (Abbildung 1) (Zonula Occludens-1, Claudin-5; entnehmen Sie bitte der Tabelle der Materialien) in 200 µL Lösung/gut zu blockieren. Optional ist Endothelzellen Identität überprüft, indem man einen Antikörper gegen die Thrombozyten Endothelzellen Adhäsionsmolekül (PECAM1 oder CD31; entnehmen Sie bitte der Tabelle der Materialien) zu jedem engen Kreuzung Antikörperlösung erhoben. Entsorgen Sie die blockierende Lösung und brüten mit Primärantikörpern' O/N bei 4 °C.
- Am nächsten Tag die primären Antikörper zu verwerfen und spülen Sie sie mit 200 µL PBS (3 X 5 min bei RT). Inkubieren sie mit entsprechenden artspezifische Fluorophor-konjugierten Sekundärantikörper (Verdünnung 1: 500, 200 µL/Well, in blockierende Lösung verdünnt, entnehmen Sie bitte der Tabelle der Materialien) für 2 h bei RT
- Entsorgen Sie die sekundäre Antikörper, spülen Sie mit 200 µL PBS (3 X 5 min bei RT). Die PBS zu entfernen und die Zellkerne mithilfe einer 4', 6-Diamidino-2-Phenylindole (DAPI) Lösung auf eine Endkonzentration von 1 µg/mL reinem destilliertem H2O (dH2O; 200 µL/Well; Tabelle der Materialien siehe counterstain ). 7 min bei RT. Entfernen Sie das DAPI inkubieren und waschen die Membranen 3 X mit dH2O (200 µL/Well).
- Geben Sie einen Tropfen des Mediums Montage (siehe die Tabelle der Materialien) auf einen Glas-Objektträger. Feine Pinzette, sorgfältig nehmen Sie die Membran aus dem Brunnen zu, und entfernen Sie das überschüssige dH2O die Orientierung zu behalten, und legen Sie sie auf das Drop-die Eindeckmedium. Tropfen Sie ein weiterer Eindeckmittel auf der Membran und decken Sie sorgfältig mit einem Borosilikat-Deckglas ab. Sicherstellen Sie, dass keine eingeschlossene Luftblasen vorhanden sind. Bis zur konfokalen Mikroskopie Beobachtungen lagern Sie die Proben bei 4 °C und lichtgeschützt.
Hinweis: Astrozyten Färbung durchgeführt werden kann, indem man die Stücke der Membranen in den 24-Well-Platte mit dem Gehirn Seite nach oben und mit dem Einsatz von ausgewählten Astrozyten-spezifische Antikörper (z.B. gegen die glial fibrillary Acid Protein [GFAP]) (Abbildung 1E ).
- Spülen Sie die beiden Seiten der Membran mit eiskaltem PBS (3 X 5 min, 2,5 ml/einfügen, 3 mL/gut). Verwerfen der PBS und fügen Sie 3 mL und 2,5 mL eiskaltes 4 % PFA in den Brunnen und in der Einlage bzw.. Inkubation auf Eis für 10 min. verwerfen die PFA (entsprechend der Institution's gefährliche Chemikalienentsorgung) und Spülen mit PBS 3 X bei RT (2,5 mL/einfügen "," 3 mL/gut).
-
BBTB Fluoreszenz Färbung um Nanopartikel Transcytosis zu erkennen
- Führen Sie live-Zelle Lysosomen Kennzeichnung (z. B. mit fluoreszierenden Sonden [siehe die Tabelle der Materialien]). Verdünnen Sie den Lysosomen fluoreszierender Farbstoff in einer Arbeitsgruppe-Konzentration von 50 nM in vorgewärmte EBM - (2,5 mL/einfügen) oder 75 mm in vorgewärmte ABM - (3 mL/gut) für den Lysosomen Kennzeichnung von Endothelzellen und Astrozyten, beziehungsweise. Die Zellen für 45 min inkubieren (bei 37 °C mit 5 % CO2); Spülen Sie dann 3 X mit eiskaltem PBS (2,5 mL/einfügen "," 3 mL/gut).
- Verwerfen der PBS und fügen Sie 3 mL und 2,5 mL eiskaltes 4 % PFA zum Brunnen und auf den Einsatz bzw.. Brüten sie auf Eis für 10 min. verwerfen die PFA und spülen Sie die Zellen 3 X mit PBS (bei RT, 2,5 mL/einfügen "," 3 mL/gut).
Hinweis: Einmal festgelegt, können die Proben mit PBS-Puffer (2,5 mL/einfügen "," 3 mL/Brunnen) bei 4 ° C eine Woche aufbewahrt werden. - Entfernen Sie die PBS und counterstain die Zellkerne mithilfe einer DAPI-Lösung auf eine Endkonzentration von 1 µg/mL im dH2O (1 mL/einfügen "," 1 mL/gut). Inkubieren sie 7 min bei RT. Entfernen Sie das DAPI und waschen die Membranen 3 X mit dH2O (2,5 mL/einfügen "," 3 mL/gut).
- Vorsichtig schneiden Sie die Membran, entfernen Sie das überschüssige dH2O und legen Sie es auf einen Tropfen Eindeckmittel (siehe die Tabelle der Materialien) auf einen Glas-Objektträger. Tropfen Sie ein weiterer Eindeckmittel auf der anderen Seite der Membran und decken Sie sorgfältig mit einem Borosilikat-Deckglas ab. Vermeiden Sie eingeschlossene Luftblasen. Die Proben bei 4 °C zu speichern und erst konfokalen Mikroskopie Bildgebung vor Licht geschützt aufbewahren.
-
Fluoreszenz-Färbung von Tumorzellen
- Übertragen Sie die Runde Deckgläsern, enthält die Tumor-Kugeln, um eine 24-Well-Platte mit eiskaltem PBS gefüllt mit feinen Pinzette, sorgfältig werden. Fahren Sie mit live-Zelle Lysosomen Kennzeichnung mit fluoreszierenden Lysosomen Sonden bei 75 nM in vorgewärmte GBM - (200 µL/Well). Inkubieren Sie die Proben für 45 min; Spülen Sie sie dann 3 X mit eiskaltem PBS (200 µL/Well).
- Verwerfen der PBS und fügen Sie 200 µL des eiskalten PFA pro Bohrloch. Brüten auf Eis für 10 min. verwerfen die PFA und spülen Sie die Proben 3 X mit PBS (bei RT).
Hinweis: Einmal festgelegt, können die Proben mit PBS-Puffer gespeichert werden (200 µL) bei 4 ° C für eine Woche. - Die PBS zu entfernen und die Zellkerne mithilfe einer DAPI-Lösung auf eine Endkonzentration von 1 µg/mL im dH2O counterstain (200 µL/Well). Inkubieren sie 7 min bei RT. Entfernen Sie das DAPI und waschen die Deckgläsern 3 X mit dH2O (200 µL/Well).
- Feine Pinzette, nehmen Sie das Deckglas, entfernen Sie das überschüssige dH2O, und legen Sie es auf einen Tropfen Eindeckmittel (siehe die Tabelle der Materialien) auf einen Glas-Objektträger. Vermeiden Sie dabei Luftblasen. Die Proben bei 4 °C zu speichern und erst konfokalen Mikroskopie Beobachtungen vor Licht geschützt aufbewahren.
3. in Vivo vergleichende Studie
- In-situ Aufnahme von Natrium-Fluorescein Diffusion durch die BBB
- 150 µL einer 50 nM-Na-Fl-Lösung in einer physiologischen Lösung vorzubereiten. Halten Sie die Lösung bei 37 °C intravenös im Auslieferungszustand.
- Eine Maus mit einer intraperitonealen Injektion eine Ketamin/Xylazin cocktail (100 mg/kg Ketamin und 10 mg/kg Xylazin mit PBS-Puffer 300 µL) zu betäuben. Einmal tief Anästhesie etabliert ist, legen Sie das Tier auf ein Heizkissen, seine Körpertemperatur aufrechtzuerhalten.
Hinweis: Zehn Wochen alten weiblichen Naval Medical Research Institute (NMRI) nackt immungeschwächte Mäuse wurden verwendet, um die in Abbildung 2dargestellten Daten zu erhalten. Jedoch ist dieses Protokoll an immunkompetenten und immungeschwächte Mäuse angepasst. Die Anästhesie/Analgesie-Methode ist bei der Wissenschaftler'nach Wahl. Inhalation Anästhesie wie Isoflurane wird jedoch nicht empfohlen, da es signifikant die BBB Permeabilität18 erhöht. - Platzieren Sie den Mauszeiger auf einem stereotaktischen Rahmen (siehe die Tabelle der Materialien), und führen Sie einen längs-Schnitt der Kopfhaut mit einer feinen Schere, gefolgt von sanften Dilacerations des Bindegewebes, feine Pinzette, um den Schädel zu offenbaren. Mit kreisenden Bewegungen mit einem feinen Microdrill, entfernen Sie ein ø 0,3 mm rundes Stück des Schädels aus der linken oder rechten parietalen Knochen. Gehen Sie mit äußerster Vorsicht vor, während des Bohrens und beim Entfernen der Schädel Stück um zu vermeiden, die darunter liegenden meningealen Gewebes und der Blutgefäße zu verletzen.
- Geben Sie einen Tropfen der physiologischen Lösung auf das exponierte Gewebe. Zwei Paare von feinen Pinzette verwenden, entfernen Sie vorsichtig meningealen Gewebes um die Hirnrinde zuzugreifen. Das Hirngewebe sollte nie in direktem Kontakt mit Luft.
Hinweis: Kleinere Blutungen von meningealen Verletzung können mit hämatologischen Schwämme gestoppt werden (siehe die Tabelle der Materialien). - Sobald meningealen Gewebes entfernt wird und der Kortex ist unerschütterlich, verleiten Sie einen Tropfen physiologische Lösung zwischen der Rinde und einem ø 0,5 mm Borosilikatglas Deckgläschen. Der Überwachungsbereich mit einem Tropfen Cyanacrylat-Klebstoff zu sichern (siehe die Tabelle der Materialien) mit einer Nadel auf das Deckglas verbreitet. Lassen Sie den Kleber für 1 min trocken.
- Bereiten Sie implantierbaren Katheter für die Rute Vene Injektion (Abbildung 2A). Eine 25 G Nadelspitze mit Rochester-Ochsner Pinzette zu brechen und stecken Sie die Spitze in einem 10 cm langen PE20 Polyurethan-Rohr (siehe die Tabelle der Materialien) (Abbildung 2A).
- Legen Sie den Katheter in die seitlichen Schweif Vene der Maus, mit Bulldog Klemmen für die Katheter Manipulation und einfügen (siehe die Tabelle der Materialien) (Abb. 2 b). Sichern Sie die eingefügte Nadel mit einem Tropfen Cyanacrylat Klebstoff. Lassen Sie den Kleber trocken für 20 s vor dem Entfernen der Bulldog-Klemme. Schließen Sie das andere Ende des Katheters sorgfältig auf eine 25 G Nadel verbunden, eine Spritze mit dem Na-Fl-Lösung (Abb. 2 b).
- Hinweis: Klemmen Sie die Rute nicht mit der Bulldog-Klemme; Es wird nur für präzise Katheter Abwicklung verwendet. Richtigen Katheter Einfügung kann durch Blut Reflux in den transparenten Schlauch bestätigt werden.
- Legen Sie das Tier unter dem Stereomikroskop (siehe die Tabelle der Materialien). Mit der Low-Level-Autofluoreszenz in den Grün-Kanal (480 nm), konzentrieren sich auf eine Region mit relativ großen Blutgefäße (sie erscheinen dunkler aufgrund der Hämoglobin-Absorption des Lichtes bei dieser Wellenlänge) und kleineren Kapillaren (Abbildung 2). Starten Sie die Time-Lapse Übernahme kurz vor der Injektion der Fluoreszenzfarbstoff um eine Messung der Hintergrundfluoreszenz zu erhalten.
Hinweis: Alternativ die Zeitrafferaufnahme durch Snapshot-Bilder von T0 ersetzt werden kann und von allen anderen vorgegebenen Zeitpunkten. - Die Lösung in eine langsame und kontinuierliche Tempo zu injizieren, oder alternativ eine automatisierte Infusion System. Die Na-Fl Fluoreszenz erkannt im Blut sollte stabil bleiben (Halbwertszeit im Blut: 286 min), wodurch eine Aufnahme von der BBB-Diffusion durch die kranialen Fenster für einige Minuten. Sobald der Kauf abgeschlossen ist, vorsichtig den Katheter entfernen und das Tier durch zervikale Dislokation einschläfern.
- In Vivo Bestimmung der BBB Permeabilität
Hinweis: Werte stammen von Bildverarbeitungs-Software, wie z. B. ImageJ, so dass die Messung der Intensität der Fluoreszenz-Signals innerhalb einer benutzerdefinierten Region of Interest (ROI).- Mit dem Anmerkungen-Werkzeug zeichnen Sie einen Rechteck-förmigen ROI außerhalb ein Blutgefäß im Hirngewebe, bei etwa 5 µm Entfernung sichtbaren Blutgefäße gefüllt mit Na-FL. beachten Sie die Dimensionen des ROI und der gemessene Fluoreszenzintensität t0 in diese Rendite, die dient als leer für das Gewebe's Autofluoreszenz. Ohne verschieben den ROI, schneller Vorlauf zu einem postinjection Zeitpunkt (z. B. gegenüber des letzten aufgezeichneten Rahmens wenn die gesamte Lösung für das Tier injiziert hat) und beachten die genaue Zeit und Fluoreszenz Messwerte innerhalb der ROI (Abbildung 2).
- Verschieben Sie den ROI auf eine sichtbare Blutgefäß (Abbildung 2) und notieren Sie den T0 Autofluoreszenz Wert aus dem Blut. Ohne verschieben den ROI, schneller Vorlauf zum gleichen Zeitpunkt wie im Schritt 3.2.1 definiert. und beachten Sie die Fluoreszenz Messwert innerhalb der ROI (Abbildung 2).
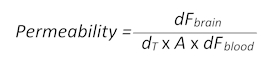
- Verwenden Sie die folgende Formel (adaptiert von Abschnitt 1.3), die BBB Permeabilität bestimmen:
- Hier, dFGehirn ist die Fluoreszenz Intensitätswert minus dem T0 Blindwert im Gehirn, dT ist der Zeitpunkt der Übernahme in Sekunden, A ist die ungefähre Schiff Fläche, als die ROI-Gebiet in Quadratzentimeter und dF Blut ist der Fluoreszenz-Intensität-Wert minus dem T0-leer-Wert im Blut.
Hinweis: Erwartete Permeabilität Werte für die BBB sollte im Bereich 10-6 cm/s (Tabelle 1).
- Verarbeitung für den Nachweis von fluoreszierende Nanopartikel im murine Gehirn Gewebe
- Implantat-Patienten abgeleitet Glioblastom Sphären (5 x 104 Zellen in 5 µL steriler PBS) bei narkotisierten 6 Wochen alten weiblichen NMRI nackten Mäusen im Corpus Callosum. Suchen Sie diese Region des Gehirns an den folgenden stereotaktischen Koordinaten, ausgehend von der Bregma: Anteroposterior + 0,5 mm, links nach rechts + 2,5 mm, dorsoventral + 3 mm. ermöglichen den Gehirntumor, für 2 Wochen zu wachsen.
- Die Nanopartikel intravenös zu injizieren (100 µg in 100 µL steriler physiologischer Lösung) und lassen sie Sie zirkulieren für 8 h. Spritzen die Kontrollmäusen intravenös mit 100 µL steriler physiologischer Lösung.
- Einschläfern Sie die Mäuse durch zervikale Dislokation und sammeln Sie die Köpfe schnell für Snap-frieren im Isopentane auf Trockeneis (1 min bei-50 °C) gepflegt. Speichern Sie die Gehirne bei-80 °C bis zur Verarbeitung von Gewebe.
- Geschnitten Sie koronale Gehirn Abschnitte mit einem Cryomicrotome. Suchen Sie die intrakranielle Implantation durch die Narbe, die es auf der Rinde gebildet und schneiden 9 µm dicke Abschnitte aus diesem Bereich auf die entsprechenden Objektträger (siehe die Tabelle der Materialien).
- Tauchen die Gehirn-Abschnitte, die auf den Folien in eiskaltem PBS immobilisiert sind (2 X 5 min) und befestigen Sie sie dann in eiskalten 4 % PFA (für 5 min). Waschen Sie die Folien mit PBS-Puffer (3 X 5 min bei RT). Legen Sie die Folien horizontal und Pipettieren der blockierende Lösung mit 10 % fötalen Rinderserum mit PBS-Puffer auf das Gewebe Abschnitte auf der gesamten Oberfläche (für 1 h bei RT, 500 µL/Folie). Vorbereiten den CD31 Antikörper (siehe die Tabelle der Materialien) in 250 µL Lösung/Folie zu blockieren. Ersetzen Sie die blockierende Lösung mit dem Antikörper und über Nacht bei 4 °C in eine feuchte Kammer inkubieren.
- Am nächsten Tag tauchen die Folien mit PBS-Puffer (3 X 5 min bei RT) und inkubieren sie mit den entsprechenden Fluorophor-konjugierten Sekundärantikörper (1: 500 in 250 µL PBS für 2 h bei RT). 3 X mit PBS-Puffer (bei RT) spülen und die Zellkerne mithilfe einer DAPI-Lösung auf eine Endkonzentration von 1 µg/mL im dH2O counterstain (250 µL/Folie). Die Proben für 7 min bei RT. Entfernen Sie die DAPI-Lösung brüten und waschen Sie die Folien 3 X mit dH2O.
- Auf jedem Gewebe Abschnitt geben Sie einen Tropfen Eindeckmedium (siehe die Tabelle der Materialien) und die Proben mit einem Deckgläschen zu sichern. Vermeiden Sie dabei Luftblasen. Die Proben bei 4 °C zu speichern und erst konfokalen Mikroskopie Beobachtungen vor Licht geschützt aufbewahren.
Ergebnisse
Konfokale Bildgebung der murinen BBTB Mimik zeigt den Ausdruck und die zellulären Lokalisation der tight Junction Proteinen Zonula Occludens-1 (ZO-1) und Claudin-5 in bEND3. Kontakte zwischen den Endothelzellen und Astrozyten induziert eindeutig die Verlegung des ZO-1 und Claudin-5 auf die endotheliale Zell-Zell-Kontakte im Vergleich zu den bEND3 Monokulturen (Abbildung 1). Mit Immunfluoreszenz-Färbung um die GFAP-mit dem Ausdruck Astrozyten im Gehirn-Seite der Membran sichtbar zu machen, ist es möglich, zu beobachten und studieren der astrocytic Prozesse und Ende-Füße Kontakt mit den endothelialen Zellen durch die Membran (Abbildung 1E ). Die Astrozyten und Endothelzellen Kontakte sind dafür bekannt, zu fördern und zu stabilisieren, die Verschärfung der zellulären Barriere und geringere Permeabilität Werte des BBB19zugeordnet sind. Gemäß jener, beobachten wir einen deutlichen Rückgang der Durchlässigkeit der Maus BBTB Mimik für die Na-Fl von 27,63 (± 3,45) x 10-6 cm/s bei Monokulturen, 6,74 (± 3,01) x 10-6 cm/s wenn Co mit Hypoxie-induzierbaren kultiviert k.o.-Faktor (HIFko) Astrozyten (Tabelle 1). Die verewigt HuAR2T bilden hochpermeablen cellular Barrieren (104.92 ± 27,1 x 10-6 cm/s, Tabelle 1). Ähnlich wie das Mausmodell gemessen wir deutlich geringer Durchlässigkeit der BBTB Na-FL, nämlich (± 14.32PA) 47,4 x 10-6 cm/s, wenn die HuAR2T Zellen zusammen mit den menschlichen primäre Astrozyten (Tabelle 1) kultiviert wurden.
In murinen und menschlichen BBTB Mimik induziert die Anwesenheit der Patienten abgeleitet Glioblastom Sphären eine leichte Erhöhung der Permeabilität Werte im Vergleich zu den endothelialen Zellen-Astrozyten Ko-Kulturen allein (Tabelle 1). Dieses Phänomen wird mit mehreren beobachtet, aber nicht alle Patienten Gliom Kugel Modelle. Dies ist möglicherweise aufgrund der VEGF-A, die von einigen dieser Patienten-abgeleitete Zellen abgesondert wird.
Um die Durchlässigkeit von der in-vitro-BBTB Mimik bei der in-vivo BBB vergleichen, abgebildet wir die Echtzeit-Diffusion des Na-Fl durch ein kranialen Fenster in nackten Mäusen implantiert. Verwenden eine Fluoreszenz Stereomikroskop, verzeichnete Na-Fl Diffusion aus der Blutgefäße Kapillaren aus den wichtigsten pial Blutgefäße vor, während und nach der systemische Injektion der Sonde (Abbildung 2). Messungen der differenziellen Fluoreszenz-Werte aus dem zirkulierenden Blut und Gehirn kortikale Parenchym im Laufe der Zeit konnten wir zur Berechnung der ungefähren Permeabilität Werte der nackte Maus's BBB für Na-Fl (5,57 ± 2.19 x 10-6 cm/s, Tabelle 1).
Um zu veranschaulichen, wie diese BBTB Mimik zur Visualisierung der Passage von Verbindungen aus Blut seitlich auf die Gehirn-Seite verwendet werden kann, verglichen wir die Transcytosis Ø 110 nm (NP110) und Ø 350 nm (NP350) Nanopartikel gezielt Patienten abgeleitet Glioblastom Sphären. In-vitro-Ergebnisse wurden dann im Vergleich zu den in-vivo Transcytosis. Im dargestellten Beispiel Nanopartikel waren mit Tumor-targeting Peptid CooP20 Oberfläche beschichtet und geladen mit dem fluoreszierenden Farbstoff (FITC) um die Visualisierung zu erleichtern. Wir mit der Bezeichnung der Zellen unter Verwendung des lysosomalen Farbstoffs und counterstained mit DAPI 24 h nach der Zusatz der FITC Nanopartikel auf der Blut-Seite von der BBTB imitieren und erwarb konfokale Mikrographen auf verschiedenen Ebenen (z. B. der Blut-Seite, die Membran, die Gehirn-Seite und die Patienten Glioblastom-Sphären) (Abb. 3A). Das NP110-assoziierten Fluoreszenzsignal colocalized mit den Lysosomen in den Endothelzellen Astrozyten und Tumorzellen. Darüber hinaus wurden die NP110s erkannten zwischendurch die Endothelzellen und Astrozyten, durch die Membranporen des Einsatzes (Abb. 3A).
Im Laufe der NP110s wurde durch die Messung der Fluoreszenz von Proben von Blut und Gehirn Seite quantifiziert. Diese Durchlässigkeit Werte wurden im Vergleich zu denen für die Nanopartikel der ermittelten ø 350 nm (NP350). Die Ergebnisse zeigen, dass nur NP110 die BBTB Mimik (Abb. 3 b) überqueren konnte. NP350 blieb auf der Blut-Seite des BBTB Mimik, die geringere Durchlässigkeit Werte für diese Nanopartikel führte.
Um die Relevanz der BBTB Mimik im Vergleich zu den in-vivo Modellen zu markieren, wurden nackt Mäuse mit NP110 oder NP350 Nanopartikeln beschichtet mit Tumor-targeting Peptid CooP und konjugiert mit roten Fluoreszenzfarbstoff (TRITC) für den Nachweis intravenös injiziert. Gewebe zu mehreren Zeitpunkten erhoben ergab, dass nach 8 h, BBB-durchlässigen Nanopartikel in Anwesenheit, während die nonpermeable dies haben diejenigen, die im Umlauf waren vor allem von den Körperkreislauf in-vivo gelöscht wurden. Daher, wir sammelten die Gehirne und beziffert die Zahl der Nanopartikel pro Quadratmillimeter 8 h Steroidtherapie. Im Einklang mit der in-vitro-Ergebnisse, NP110, aber nicht NP350 dies erfolgreich in das Gehirn Parenchym (Abbildung 3). Hohe Vergrößerung Bildgebung des Standortes Nanopartikel im Gehirn zeigten, dass NP110 war homogen in der Anwesenheit von außerhalb der Blutkapillaren verteilt und erfolgreich auf die implantierten Glioblastom-Zellen (Abbildung 3D) verwaltet. Trotz den gleichen Tumor gezielt Abstimmungsunterlagen (CooP) ausstellen, NP350 konnte in der Anwesenheit von Leber und wurde nur innerhalb der luminalen Seite des Gehirns Blutgefäße (Abbildung 3E), ähnlich wie die in-vitro-. erzielten Ergebnisse gefunden
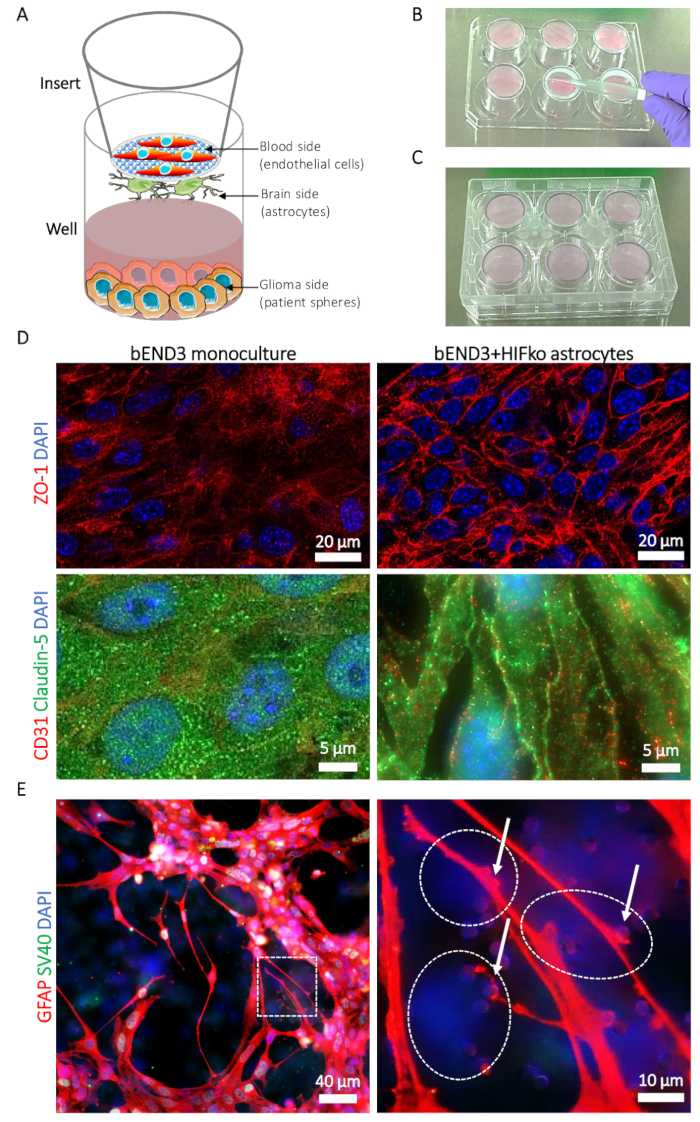
Abbildung 1: Beschreibung der Blut-Hirn-Tumor-Schranke (BBTB) Modell. (A) schematische Darstellung der Standorte der verschiedenen Zelltypen. (B) Darstellung der einfügen-Platzierung auf dem 6-Well-Platte-Cover und die Aussaat Technik für die Astrozyten auf der Gehirn-Seite des Einsatzes's-Membran. (C) Abbildung der 6-Well-Platte Platzierung ermöglicht die Astrozyten Adhäsion. (D) Immunfluoreszenz Mikrographen der tight Junction Proteinen Zonula Occludens-1 (ZO-1, obere Reihe, rot) und Claudin-5 (untere Reihe, grün). Die Proteinexpression ist im Vergleich zu der murine Gehirn mikrovaskuläre Endothelzellen (bEND3) auf der Seite Blut allein BBTB kultiviert, als eine Monokultur (linke Spalte) oder mit murinen verewigt HIFko Astrozyten (rechte Spalte). Zellkerne sind mit DAPI (blau) counterstained. (E) Immunfluoreszenz Schliffbild zeigt die glial fibrillary saure Protein (GFAP, rot) in HIFko Astrozyten Gehirn seitlich der BBTB kultiviert. Die hohe Vergrößerung Bild zeigt Astrozyten Prozesse und Ende-Füße (Pfeile) Kontaktaufnahme mit den endothelialen Zellen durch die Membran Poren (rechte Abbildung). Die Identität des HIFko Astrozyten wurde überprüft, durch Immunfluoreszenz-Färbung des simian Virus 40 große T Antigens (SV40 großen T, grün) für die Verewigung der Zellen verwendet. Endothelzellen express der Astroglia weder das SV40 großen T und daher teilweise durch den transparenten, gegenüberliegenden Seite der Membran als nur DAPI gefärbten Zellen (gestrichelte Linien) beobachtet werden. Zellkerne sind mit DAPI (blau) counterstained. Bitte klicken Sie hier für eine größere Version dieser Figur.
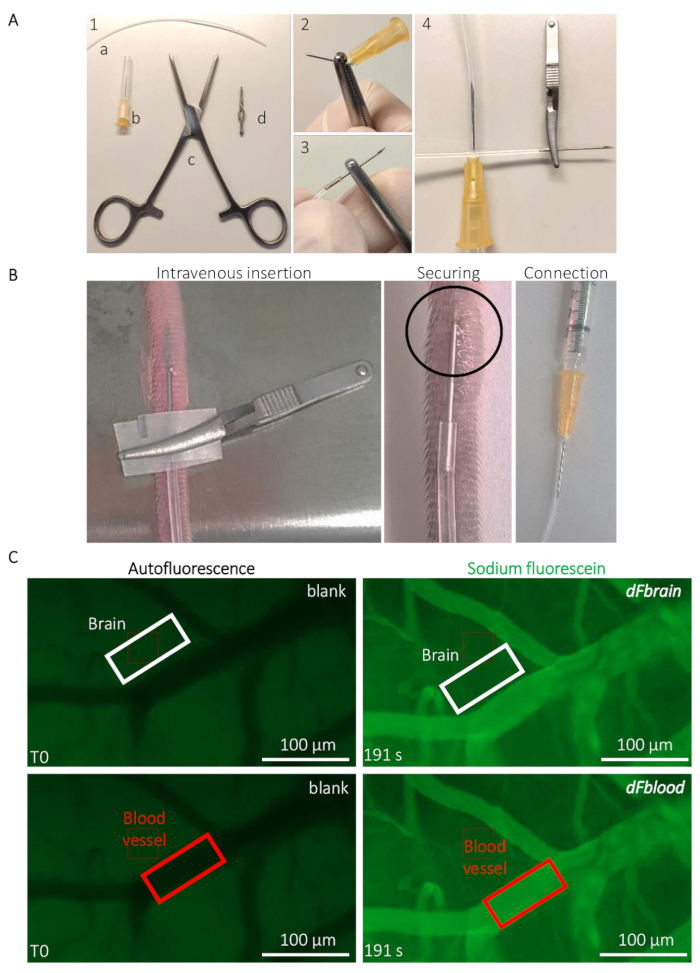
Abbildung 2: Intravitalen live Bestimmung der Maus BBB Permeabilität. (A) Vorbereitung des Katheters implantierbare kaudalen Vene. (1) Werkzeuge und Ausrüstung sind die folgenden: (ein) ein PE20 Polyethylenschlauch (b) zwei 25 G Nadeln (c), Rochester-Ochsner Zange und (d) eine kleine Bulldogge Klemme. (2) A 25 G Nadel wird durch mehrere Torsionen entfernt mit Hilfe der Zange und (3) sorgfältig in das Rohr eingesetzt. (4) die andere Seite des Rohres ist mit einem anderen 25 G Nadel verbunden. (B) Leitlinien für die Katheter-Implantation und Positionierung der Natrium-Fluorescein-Lösung durch die Rute Vene einer Maus ziehen. Die eingekreiste Bereich zeigt den Bereich, wo ein Tropfen Cyanacrylat-Klebstoff platziert wird, um den Katheter zu sichern. Die Bulldog-Klemme wird verwendet, um den Katheter zu behandeln und entfernt, sobald der Katheter befestigt ist. (C) repräsentative Darstellung und Quantifizierung Methode zur Bestimmung der Natrium-Fluorescein Permeabilität Werte. Vor der Natrium-Fluorescein-Infusion (linke Spalte) bemisst sich der Autofluoreszenz/Blank innerhalb einer Region of Interest (ROI) auf das Gehirn (Abdeckung, weißes Rechteck) und Blutgefäß Bereiche (untere Panel, rotes Rechteck) platziert. Während der Natrium-Fluorescein-Infusion (rechte Spalte) wird die Fluoreszenzintensität in beiden ROIs, so dass die Berechnung der BBB Permeabilität gemessen. Bitte klicken Sie hier für eine größere Version dieser Figur.
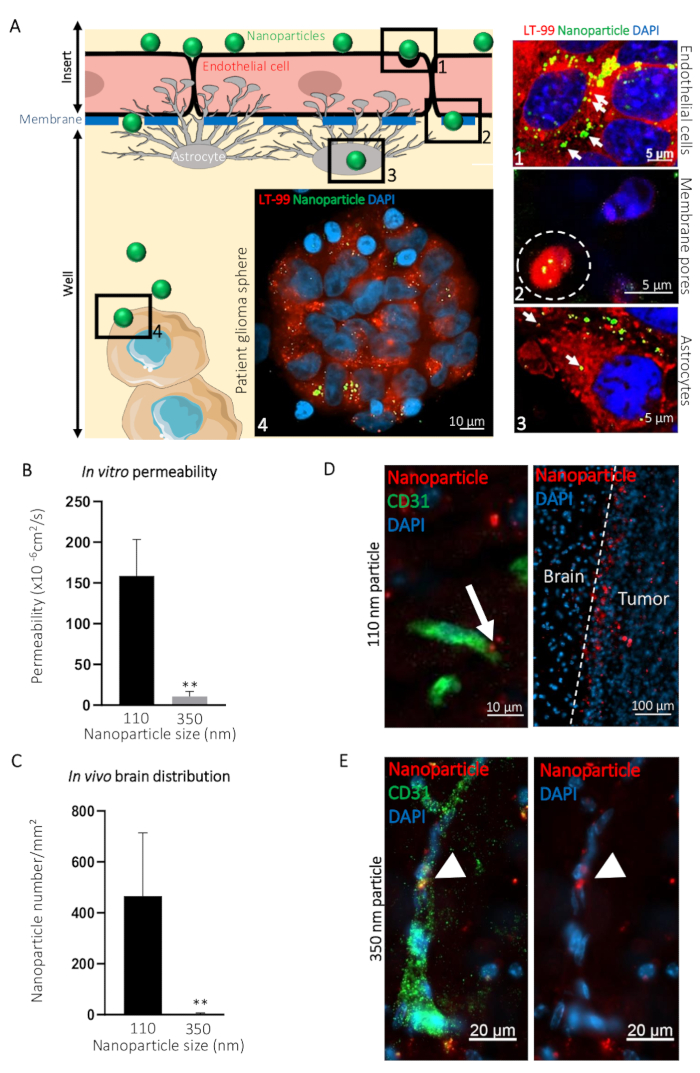
Abbildung 3: Vorhersage von Intrazerebrale Transcytosis von Nanopartikeln durch BBB in-vivo mit dem in-vitro-Modell BBTB. (A) grafische Darstellung des BBTB Assays mit repräsentativen konfokale Bilder auf den angegebenen verschiedenen Ebenen des murinen BBTB Modells erhalten. Nanopartikel von 110 nm im Durchmesser (NP110) und konjugierten, FITC (grün) wurden hinzugefügt, um das Blut Seite der BBTB Zellen wurden mit der lysosomalen Sonde (LT-99, rot) gekennzeichnet. (1) Endothelial Zellen, (2) Endothelial Transcytosis der Nanopartikel durch die Poren der Membran (weiße gestrichelte Linie), (3) Astrozyten, und (4) Patienten Glioblastom Kugeln auf die Grafik identifiziert und entsprechenden konfokale Mikrographen (rechts). Lysosomale Kapselung der Nanopartikel (Pfeile) schlägt aktive Transcytosis durch die Endothelzellen und Astrozyten Schichten der BBTB. (B) Quantifizierung der angegebenen Nanopartikel Durchlässigkeit durch in-vitro-BBTB (n = 6). (C) Quantifizierung der angegebenen Nanopartikel Dichte im Hirngewebe Abschnitte, 8 h nach der kaudalen Vene Infusion der nackte Mäuse (n = 3). (D) konfokale Mikrographen zeigt die Verteilung der Ø 110 nm Nanopartikel (rote NP110) in murine Gehirn Gewebeschnitten beschriftet mit einem Anti-Maus CD31 Antikörper (grün). Der Pfeil markiert die Nanopartikel Transcytosis (linken). Nanopartikel gesammelt um die Gehirn-Tumor-Zellen (Tumor, rechts) aufgrund der CooP-targeting Peptid präsentiert auf ihrer Oberfläche. Keine signifikante Homing wird in das Hirngewebe (Gehirn) beobachtet. (E) konfokale Mikrographen zeigen die Verteilung der ø 350 nm Nanopartikel (rote NP350) in murine Gehirn Gewebe Abschnitte mit der Bezeichnung mit einem Anti-Maus CD31 Antikörper (grün). Pfeilspitzen, die NP350s, die in das Lumen der Blutgefäße beibehalten wurden und waren nicht in der Lage, BBB, wahrscheinlich aufgrund ihrer größeren Durchmesser im Vergleich zu NP110s. Zellkerne zu überqueren sind counterstained mit DAPI (blau). P < 0,01. P-Werte wurden mit einem zweiseitigen, nichtparametrische Mann-Whitney U-Test berechnet. Die Fehlerbalken repräsentieren die Standardabweichung. Bitte klicken Sie hier für eine größere Version dieser Figur.
| murine BBTB Mimik | bEND3 | bEND3 + HIFko als | bEND3 + GB | bEND3 + HIFko als + GB | In-vivo |
| Durchlässigkeit (10-6 cm/s) | 27.63 | 6.74 | 26,8 | 10,83 | 5.57 |
| SD (10-6 cm/s) | 3.45 | 3.01 | 7.99 | 2.65 | 2.19 |
| menschliche BBTB Mimik | HuAR2T | HuAR2T + hIAs | HuAR2T + GB | HuAR2T + hIAs + GB | |
| Durchlässigkeit (10-6 cm/s) | 104.92 | 47,4 | 89.08 | 48.24 | |
| SD (10-6 cm/s) | 27.1 | 14.32PA | 10.21 | 13.07 |
Tabelle 1: Werte der Natrium-Fluorescein (Na-Fl) Durchlässigkeit (in Zentimetern pro Sekunde) ermittelt in-vitro- in den angegebenen Kokultur Systemen und in-vivo in den nude Mäusen NMRI. Daten aus einem repräsentativen Experiment (n = 3 Mäuse).
Diskussion
Der Aufstieg des Begriffs interpatient Tumor Variabilität verjüngt die Forschung über personalisierte Krebs Medizin21. Diese Variabilität ist auch ein Markenzeichen der Tumoren des zentralen Nervensystems. Aufgrund der Unberechenbarkeit des Tumors Ansprechen auf die Chemotherapie ergänzt die schützende Wirkung der BBB für Drug-Delivery und insgesamt stellt große Herausforderungen in Patientenversorgung22. Um eine effektivere Therapien zu entwickeln, ist es oft notwendig, Bildschirm große Bibliotheken mit neuer Moleküle. Um die Antitumor-Wirkung und die Fähigkeit der neuen therapeutischen führt, erreichen die Tumor-Website bewerten, ist die beste Option der präklinischen Studie über Patienten gewonnenen Zellen in Vivo in murinen Avatare Patienten implantiert. Aufgrund der praktischen (, Zeit, Mensch und Anlage Finanzmittel) und ethischen Gründen (3R-Prinzip bei der Verwendung von Versuchstieren) ist die Entwicklung von solch eine große in-vivo Screening-Plattform oft nicht möglich, und daher die zellbasierte assays bleiben Sie ein Modell der Wahl23. Der Hauptgrund für die Auswahl der etablierte Zelllinien und Primärzellen zu vermeiden soll die Reproduzierbarkeit und reduzieren den Einsatz von Versuchstieren, die Hauptquelle für die Isolierung und die Etablierung von murinen Primärkulturen sind. Die Methoden hier präsentieren konnte fest Einhaltung der 3Rs effizient Nanopartikel aus eine weitere präklinische Untersuchungen auf das Kriterium für ihre Unfähigkeit, das Modell BBTB überqueren verwerfen. Hier beschreiben wir als Proof of Principle Erkenntnisse bei der Entwicklung und Validierung von der BBTB. Wir konnten in-vivo, in vitro Befunde bestätigen zum Beispiel bei der Messung der passive Diffusion von einem 376 Da Natrium-Fluorescein.
Das Protokoll in diesem Dokument beschriebenen beschreibt die Vorbereitung von Endothelzellen cocultured mit Astrozyten bilden eine Blut-Hirn-Tumor-Barriere-ähnliche Oberfläche in einer in-vitro-Setup. Sobald ein physischer Kontakt zwischen diesen beiden Zelltypen besteht, weist die endotheliale Zellschicht Ähnlichkeiten mit der BBB (z. B. eine Zelle Oberflächenexpression von tight Junction-Proteinen und relativ geringen Durchlässigkeit). Interessanterweise schien die murine BBTB Mimik besonders ähnlich Na-Fl Permeabilität Werte für denen, die mit der in-vivo Maus BBB Permeabilität Messungen24bereitzustellen. Daher wird die Leistung des BBTB Mimik direkt auf die Wahl der Zellen verwendet, um die Barriere bilden verknüpft werden. Die bEND3 endothelial Zellen stammen aus dem Gehirn und sind dafür bekannt, bei der Bildung von Barrieren bei der Astrozyten25cocultured erfolgreich zu sein. Jedoch verwenden die verewigt HIFko Astrozyten26 wir die BBTB Mimik zu erzeugen. Aufgrund ihrer mangelnden Hypoxie-induzierbare Faktor dieser Astrozyten produzieren keine VEGF-A, ist die Quintessenz in der BBTB Mimik-Stabilisierung, die hier beschrieben. Astrozyten haben als Modulatoren der BBB Permeabilität, zum Beispiel durch die Freisetzung von VEGF-A in Reaktion auf Neuroinflammation27identifiziert. Aktivierung des vaskulären endothelialen Wachstumsfaktor-Rezeptoren (VEGFRs) ist Schlüsselregulator der endothelialen/vaskulären Permeabilität sowohl in Vitro28 und in-vivo-29. Aktivieren Sie deshalb VEGF-A Ergänzungen im Medium der VEGFR2 auf die Endothelzellen, die die Phosphorylierung von Adherens Junction Proteinen wie VE-Cadherin30induziert. Der Verlust der endothelialen Zell-Zell-Kontakte generiert hochpermeablen Blutgefäße. Ebenso entstehen die starken Mitogene Eigenschaft und unbekannter Zusammensetzung des fetalen bovine Sera in die Zelle Kultur Assays verwendet große Probleme in der Barriere Stabilisierung und Assay Reproduzierbarkeit.
Menschlichen Nabelader Endothelzellen (Mediumwechsel) werden manchmal verwendet, um BBB in Vitro31bilden; Sie deutlich unterscheiden sich jedoch von dem Gehirn mikrovaskuläre Endothelzellen, wie z. B. die hCMEC/D3 Zelle Zeile32, in Bezug auf die Genexpression und Barriere-bildenden Eigenschaften. Die relativ höhere Durchlässigkeit, die Werte, die mit den HuAR2T Zellen gewachsen allein im Vergleich zu den bEND3 wurden jedoch durch coculturing sie mit menschlichen primäre Astrozyten stark reduziert. Obwohl die Endothelzellen erforderlich sind, um die Zellwand zu bilden, ist es klar, dass die Astrozyten haben eine ebenso wichtige Rolle für die BBTB Bildung und Stabilisierung zu spielen.
Wenn diese Gleichung Patienten abgeleitet Gliom Kugeln hinzugefügt wurden, rekapitulierte die Maus BBTB Mimik einige der Features der murinen Xenotransplantate, wie die Droge Verbreitung durch das Gehirn Gefäßsystem und den Tumor Zelle targeting. Die hier besprochenen BBTB Mimik gelang, beispielsweise spiegeln das in-vivo Verhalten, wenn wir mehrere Nanopartikel mit unterschiedlichen Durchmessern gezeigt. Um die Parallelität zwischen der in-vitro und in vivo Modellen zu veranschaulichen, verwendet wir die zuvor beschriebenen mesoporösen Silikat Nanopartikel33 mit Zelle durchdringenden Eigenschaften34 konjugiert, das Tumor-targeting Peptid CooP auf ihre surface20. Die CooP-targeting-Peptid Häuser zu invasiven Tumorzellen durch die spezifische Bindung an der Mamma abgeleitet Wachstums-Inhibitor (MDGI). Verschiedene Krebsarten, einschließlich Gliomen, sind im Vergleich zum normalen Gewebe35, wodurch der CooP eine sehr effiziente Tumor-targeting glyko-zu einer Steigerung der Lieferung eines Nutzlast20MDGI überexprimiert. Die Nanopartikel verwendet hier haben bisher gezeigt, dass in der Anwesenheit von (27547955) diffundieren haben, und wenn mit Taxol funktionalisiert, diese Nano-Ladungen erfolgreich bei der Verringerung der Gliom Wachstum in präklinischen Modellen36. Die Zugabe von Polyethylenglykol (PEG) Rückstände an der Oberfläche der Nanopartikel auch beibehalten ihre statischen Aufladung für positive Werte (um + 4 mV), so dass bessere Interaktion mit der neurovaskuläre Einheit37 und erhöht auch ihre Stabilität im Umlauf. In den dargestellten Daten war 3 kDa PEG, NP110s, konjugiert, während NP350s mit 10 kDa PEG beschichtet wurden. Führte jedoch erhöht Molekulargewicht PEG auch eine deutliche Zunahme der Nanopartikel-Durchmesser, damit ihre körperlichen Fähigkeiten, die BBB zu überqueren. Daher haben wir geprüft ob die Abmessungen der Partikel ihrer Passage durch die BBTB verhindert und ob diese Beobachtungen in-vivo gespiegelt werden könnte.
Im Einklang mit den zuvor veröffentlichten Beobachtungen, beobachteten wir, dass NP110s durch in-vitro-BBTB und der BBB von Mäusen mit intrakraniellen Tumoren, während NP350s beibehalten auf der luminalen Seite der BBTB Mimik und in den Blutgefäßen des Bedarfs der Mäuse. Diese ähnliche Ergebnisse empfehlen die BBTB Modell vorhergesagt die in-vivo Fähigkeit von Nanopartikeln zu überqueren die BBB und das Gehirn erreichen.
Die Relevanz von Zellmodellen der BBB wird häufig diskutiert, auch für die zentrale Bereitstellung von Nanopartikeln38. Wir zeigen hier, dass primäre Astrozyten und Endothelzellen, beide als als die wichtigsten in-vitro-Tools durch verewigt und/oder kommerziell erhältlichen Zellen ersetzt werden können größere Skalierbarkeit und Reproduzierbarkeit zu gewährleisten. Die nächste Generation von in-vitro-BBB-Fließbildern könnte durch die Einbeziehung der mikrofluidischen Geräte, so dass schön geformten neurovaskuläre Einheiten, die strukturell den tatsächlichen BBB12,14 ähnelnentwickelt werden. Solche Modelle sind jedoch derzeit nicht geeignet für den Hochdurchsatz-Screening von Molekülen an Gliome, aufgrund technischer Einschränkungen bei der Nachbereitung der Lieferung14geliefert. Es ist in der Tat schwierig, die physiologische Komplexität der BBB in einer Petrischale zu erfassen, und das mögliche Fehlen einiger Rezeptoren/Proteine, bekannt durch die BBB ausgedrückt werden kann die Interpretation der Ergebnisse beeinträchtigen. Ein weiteres Argument betrifft die große Variabilität in der Genexpression zwischen in-vivo und in vitro Bedingungen sowie aus einer Zelllinie zu einem anderen, besonders wenn man bedenkt Endothelzellen. Allerdings könnte auch argumentieren, dass die neurovaskuläre Einheit keine einheitliche Entität in der Gehirn-39 ist. Wissenschaftlicher Forschung in der Biologie hat eine humane Ära erreicht, wo der Tierschutz, ethische Verantwortung und die Kosten der Verwendung von tierischer Lebens gelten stets vor der Gestaltung ein Experiment. Daher, um den Austausch von Tieren zu unterstützen, eine wachsende Zahl von Studien zeigen, dass das Bewusstsein für die Grenzen der Modelle und die sorgfältige Auswahl von Zellmodellen, die Barriere zu etablieren – mit Betonung auf die Astrozyten – garantieren eine Übereinstimmung zwischen den Ergebnissen in einer Schale gewonnen und in der Tier-Modelle40. Mit der hier beschriebenen Methodik bekommen wir einen Schritt näher zur Verringerung der Zahl der Versuchstiere zu screening-Zwecken des BBB Transcytosis für potenzielle Therapeutika verwendet.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Forschung wurde unterstützt durch Zuschüsse aus der finnischen Krebs-Organisationen, Jane & Aatos Erkko Foundation, und Sigrid Juselius Foundation (p.l. und V.L.J.), den Schweizerischen Nationalfonds (Advanced Postdoc.Mobility gewähren keine: P300PB_164732, s. (K.), die Orion Forschungsgemeinschaft (s.k.), der Maud Kuistila Memorial Foundation (s.k.) und der Academy of Finland (TERVA 2017 gewähren keine: 314 498). Biomedicum Bildtrommel (Helsinki) wird für die Bereitstellung der Mikroskopie imaging zentrale Einrichtung anerkannt.
Materialien
| Name | Company | Catalog Number | Comments |
| Cells | |||
| bEND3 | ATCC | CRL-2299 | Cultured in: DMEM (1g/L glucose) supplemented with 10% FBS, 5 mL L-glutamine and 5 mL penicillin/streptomycin |
| HIFko immortalized mouse astrocytes | Isolated in Dr. Gabriele Bergers Lab | https://doi.org/10.1016/S1535-6108(03)00194-6 | Cultured in: BME-1 supplemented with 5% FBS, 5 mL 1 M HEPES, 5 mL 100 mM sodium pyruvate, 3 g D-glucose and 5 mL penicillin/streptomycin |
| HuAR2T | Isolated in Dr. Dagmar Wirth Lab | https://doi.org/10.1089/ten.tea.2009.0184 | Cultured in: EBM-2 with SupplementMix |
| normal human primary astrocytes | Lonza | CC-2565 | Cultured in: ABM with SingleQuots |
| Material and reagents | |||
| 100 mm x17 mm Dish, Nunclon Delta | ThermoFisher Scientific | 150350 | |
| 10 mL serological pipet | ThermoFisher Scientific | 170361 | |
| 15 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339650 | |
| ABM Basal Medium, 500 mL | Lonza | CC-3187 | For primary human astrocytes. ABM+: contains all the additives from the supplement mix. ABM-:all the additives except for rhEGF and FBS |
| Accutase Cell Detachment Solution | Corning | 25-058-CI | |
| AGM SingleQuots Supplements and Growth Factors | Lonza | CC-4123 | |
| B27 supplement | Gibco | 17504-044 | for both GBM + and - medium |
| Basal Medium Eagle | ThermoFisher Scientific | 21010046 | BME-1 |
| Corning Costar TC-Treated 6-Well Plates | Sigma-Aldrich | CLS3506 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3452 | |
| D-glucose | Sigma-Aldrich | G8270 | dissolve in 50 mL of BME-1 and sterile filter before adding to the medium |
| Dulbecco's Modified Eagle's Medium/Nutrient F-12 Ham | Gibco | 21331-020 | Specific to the culture of the patient-derived spheres isolated in our lab, may vary for other glioma cell lines |
| EBM-2 growth Medium SupplementMix | PromoCell | c-39216 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Endothelial Basal Medium 2 (EBM-2) | PromoCell | c-22211 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Fetal Bovine Serum (FBS), qualified, heat inactivated, E.U.-approved, South America Origin | ThermoFisher Scientific | 10500056 | |
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| Greiner CELLSTAR 96 well plates | Sigma-Aldrich | Greiner 655090 | black polystyrene wells flat bottom (with micro-clear bottom) |
| Menzel-Gläser 0.9 cm round borosilicate Cover Slips | Thermo Scientific | 10313573 | |
| PBS tablets | Medicago | 09-9400-100 | one tablet per liter of dH2O, then sterilize the solution by autoclaving |
| Poly-D-lysine hydrobromide | Sigma-Aldrich | P6407 | |
| Recombinant Human EGF | Peprotech | GMP100-15 | for GBM+ medium |
| Recombinant Human FGF-basic (154 a.a.) | Peprotech | 100-18B | for GBM+ medium |
| Immunofluorescence | |||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| 24 mm x 60 mm microscope slide cover glass | ORSAtec | 0224601-D | |
| AlexaFluor 488 and 594 secondary antibodies | ThermoFisher Scientific | dilution: 1/500 | |
| Anti-Claudin-5 antibody | Abcam | ab15106 | dilution: 1/150 |
| Anti-GFAP antibody clone GF5 | Abcam | ab10062 | dilution: 1/150 |
| Anti-Mouse CD31 antibody Clone MEC 13.3 | BD Biosciences | 550274 | dilution 1/800 |
| Anti-SV40 T-antigen antibody | Abcam | ab16879 | dilution: 1/150 |
| Anti-Zonula Occludens-1 | Abcam | ab96587 | dilution: 1/200 |
| DAPI | TOCRIS | 5748 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680 | |
| LysoTracker Red DND-99 | ThermoFisher Scientific | L7528 | |
| Animal procedures | |||
| 10 cm curved dissecting scissors | World Precision Instruments | 14394 | |
| BD Microlance 25 G needles | Becton Dickinson | 300600 | |
| Fine Forceps (12.5 cm) | World Precision Instruments | 503283 | for tissue dissociation |
| Intramedic Polyethylene tubing PE20 | Becton Dickinson | 427406 | |
| Ketaminol vet 50 mg/mL | Intervet | Vnr511485 | Ketamine |
| Mains Powered microdrill | World Precision Instruments | 503599 | |
| Menzel-Gläser 0.5 cm round borosilicate Cover Slips | Thermo Scientific | 11888372 | |
| Micro Bulldog clamp | World Precision Instruments | 14119 | |
| Physiological saline solution | Mustela | Sterile single dose vials 20 x 5 mL / 40 x 5 mL - Medical device class | |
| Rochester-Oschner forceps | World Precision Instruments | 501709 | |
| Rompun vet 20 mg/mL | Intervet | Vnr148999 | Xylazine |
| Stereotaxic adapter | World Precision Instruments | 502063 | |
| Sugi Sponge Points | Kettenbach | 31603 | |
| Equipment | |||
| Axio Zoom.V16 fluorescence stereo zoom microscope | Carl Zeiss | ||
| FLUOstar Omega microplate reader | BMG Labtech | ||
| ORCA-Flash 4.0 digital sCMOS camera | Hamamatsu Photonics | ||
| Universal 320 tabletop centrifuge | Hettich | Cat. No. 1401 | |
| ZEISS LSM 880 with Airyscan confocal microscope | Carl Zeiss |
Referenzen
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), a020412(2015).
- Quail, D. F., Joyce, J. A. The Microenvironmental Landscape of Brain Tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Wang, Z., Sun, H., Yakisich, J. S. Overcoming the blood-brain barrier for chemotherapy: limitations, challenges and rising problems. Anticancer Agents in Medicinal Chemistry. 14 (8), 1085-1093 (2014).
- Alkins, R. D., Brodersen, P. M., Sodhi, R. N., Hynynen, K. Enhancing drug delivery for boron neutron capture therapy of brain tumors with focused ultrasound. Neuro Oncology. 15 (9), 1225-1235 (2013).
- Alli, S., et al. Brainstem blood brain barrier disruption using focused ultrasound: A demonstration of feasibility and enhanced doxorubicin delivery. Journal of Controlled Release. 281, 29-41 (2018).
- Ashby, L. S., Smith, K. A., Stea, B. Gliadel wafer implantation combined with standard radiotherapy and concurrent followed by adjuvant temozolomide for treatment of newly diagnosed high-grade glioma: a systematic literature review. World Journal of Surgical Oncology. 14 (1), 225(2016).
- Guishard, A. F., Yakisich, J. S., Azad, N., Iyer, A. K. V. Translational gap in ongoing clinical trials for glioma. Journal of Clinical Neurosciences. 47, 28-42 (2018).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow & Metabolism. 36 (5), 862-890 (2016).
- Wang, J. D., Khafagy, el-S., Khanafer, K., Takayama, S., ElSayed, M. E. Organization of Endothelial Cells, Pericytes, and Astrocytes into a 3D Microfluidic in Vitro Model of the Blood-Brain Barrier. Molecular Pharmaceutics. 13 (3), 895-906 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Experimental Biology and Medicine (Maywood). 242 (17), 1669-1678 (2017).
- Bang, S., et al. A Low Permeability Microfluidic Blood-Brain Barrier Platform with Direct Contact between Perfusable Vascular Network and Astrocytes. Scientific Reports. 7 (1), 8083(2017).
- Wilhelm, I., Krizbai, I. A. In vitro models of the blood-brain barrier for the study of drug delivery to the brain. Molecular Pharmacology. 11 (7), 1949-1963 (2014).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Pirsko, V., et al. An Effect of Culture Media on Epithelial Differentiation Markers in Breast Cancer Cell Lines MCF7, MDA-MB-436 and SkBr3. Medicina (Kaunas). 54 (2), (2018).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Canfield, S. G., et al. An isogenic blood-brain barrier model comprising brain endothelial cells, astrocytes, and neurons derived from human induced pluripotent stem cells. Journal of Neurochemistry. 140 (6), 874-888 (2017).
- Cao, Y., et al. Hypoxia-inducible factor-1alpha is involved in isoflurane-induced blood-brain barrier disruption in aged rats model of POCD. Behavioural Brain Research. 339, 39-46 (2018).
- Abbott, N. J. Astrocyte-endothelial interactions and blood-brain barrier permeability. Journal of Anatomy. 200 (6), 629-638 (2002).
- Kinnari, P. J., et al. Tumour homing peptide-functionalized porous silicon nanovectors for cancer therapy. Biomaterials. 34 (36), 9134-9141 (2013).
- Levin, V. A. Personalized medicine in neuro-oncology. CNS Oncology. 5 (2), 55-58 (2016).
- Weathers, S. S., Gilbert, M. R. Toward Personalized Targeted Therapeutics: An Overview. Neurotherapeutics. 14 (2), 256-264 (2017).
- O'Duibhir, E., Carragher, N. O., Pollard, S. M. Accelerating glioblastoma drug discovery: Convergence of patient-derived models, genome editing and phenotypic screening. Molecular and Cellular Neuroscience. 80, 198-207 (2017).
- Kaya, M., Ahishali, B. Assessment of permeability in barrier type of endothelium in brain using tracers: Evans blue, sodium fluorescein, and horseradish peroxidase. Methods in Molecular Biology. 763, 369-382 (2011).
- Yang, S., et al. Identification of two immortalized cell lines, ECV304 and bEnd3, for in vitro permeability studies of blood-brain barrier. PLoS One. 12 (10), e0187017(2017).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4 (2), 133-146 (2003).
- Argaw, A. T., et al. Astrocyte-derived VEGF-A drives blood-brain barrier disruption in CNS inflammatory disease. Journal of Clinical Investigation. 122 (7), 2454-2468 (2012).
- Miao, Z., et al. VEGF increases paracellular permeability in brain endothelial cells via upregulation of EphA2. The Anatomical Record (Hoboken). 297 (5), 964-972 (2014).
- Heinolainen, K., et al. VEGFR3 Modulates Vascular Permeability by Controlling VEGF/VEGFR2 Signaling. Circulation Research. 120 (9), 1414-1425 (2017).
- Claesson-Welsh, L. Vascular permeability--the essentials. Upsala Journal of Medical Sciences. 120 (3), 135-143 (2015).
- Adriani, G., Ma, D., Pavesi, A., Goh, E. L., Kamm, R. D. Modeling the Blood-Brain Barrier in a 3D triple co-culture microfluidic system. Conference Proceedings - IEEE Engineering in Medicine and Biology Society. 2015, 338-341 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16(2013).
- Paatero, I., et al. Analyses in zebrafish embryos reveal that nanotoxicity profiles are dependent on surface-functionalization controlled penetrance of biological membranes. Scientific Reports. 7 (1), 8423(2017).
- Prabhakar, N., et al. Stimuli-responsive hybrid nanocarriers developed by controllable integration of hyperbranched PEI with mesoporous silica nanoparticles for sustained intracellular siRNA delivery. International Journal of Nanomedicine. 11, 6591-6608 (2016).
- Hyvonen, M., et al. Novel target for peptide-based imaging and treatment of brain tumors. Molecular Cancer Therapeutics. 13 (4), 996-1007 (2014).
- Feng, X., et al. Mammary-Derived Growth Inhibitor Targeting Peptide-Modified PEG-PLA Nanoparticles for Enhanced Targeted Glioblastoma Therapy. Bioconjugate Chemistry. 26 (8), 1850-1861 (2015).
- Nance, E. A., et al. A dense poly(ethylene glycol) coating improves penetration of large polymeric nanoparticles within brain tissue. Science Translational Medicine. 4 (149), 149rA119(2012).
- Berg, C. Quantitative analysis of nanoparticle transport through in vitro blood-brain barrier models. Tissue Barriers. 4 (1), e1143545(2016).
- Noumbissi, M. E., Galasso, B., Stins, M. F. Brain vascular heterogeneity: implications for disease pathogenesis and design of in vitro blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 12(2018).
- Heymans, M., Sevin, E., Gosselet, F., Lundquist, S., Culot, M. Mimicking brain tissue binding in an in vitro model of the blood-brain barrier illustrates differences between in vitro and in vivo methods for assessing the rate of brain penetration. European Journal of Pharmaceutics and Biopharmaceutics. 127, 453-461 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten