Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Durchführung der Spektroskopie über plasmonische Nanopartikel mit transmissionsbasierten Nomarski-Typ-Differentialinterferenz-Interferenz-Kontrahenten Mikroskopie
In diesem Artikel
Zusammenfassung
Ziel dieses Protokolls ist es, einen bewährten Ansatz für die Herstellung von plasmonischen Nanopartikelproben und für die Durchführung einzelner Partikelspektroskopie auf ihnen mit differenziertem Interferenzkontrast (DIC) Mikroskopie zu beschreiben.
Zusammenfassung
Die Mikroskopie des Differentialinterspannkontrums (DIC) ist ein leistungsfähiges Bildgebungswerkzeug, das am häufigsten für die Bildgebung von Mikromaßstäben mit sichtbarem Bereich eingesetzt wird. Ziel dieses Protokolls ist es, eine bewährte Methode zur Herstellung von plasmonischen Nanopartikelproben und zur Durchführung einzelner Partikelspektroskopie mit DIC-Mikroskopie zu beschreiben. Um wiederholbare Spektroskopie-Experimente durchzuführen, müssen mehrere wichtige Schritte sorgfältig befolgt werden. Zunächst können die Wahrzeichen in das Probensubstrat geätzt werden, was bei der Ortung der Probenoberfläche und bei der Verfolgung des von Interesse interessanten Bereichers bei Experimenten hilft. Als nächstes muss das Substrat von Schmutz und Verunreinigungen, die sonst die Untersuchung der Probe behindern oder verdunkeln, richtig gereinigt werden. Sobald eine Probe richtig vorbereitet ist, muss der optische Pfad des Mikroskops mit Kohler-Beleuchtung ausgerichtet werden. Mit einem Standard-Nomarski-Stil DIC-Mikroskop kann eine Rotation der Probe notwendig sein, insbesondere wenn die plasmonischen Nanopartikel orientierungsabhängige optische Eigenschaften aufweisen. Da die DIC-Mikroskopie zwei inhärente orthogonale Polarisationsfelder hat, zeigt das wellenlängenabhängige DIC-Kontrastmuster die Ausrichtung von stottimmigen plasmonischen Nanopartikeln. Schließlich müssen die Datenerfassung und Datenanalysen sorgfältig durchgeführt werden. Es ist üblich, DIC-basierte Spektroskopie-Daten als Kontrastwert darzustellen, aber es ist auch möglich, sie als Intensitätsdaten darzustellen. Bei dieser Demonstration von DIC für einzelne Teilchenspektroskopie liegt der Fokus auf kugelförmigen und stäbchenförmigen Gold-Nanopartikeln.
Einleitung
Seit den 1980er Jahren wird die DIC Mikroskopie als wichtige bildgebende Methode angesehen, die mikroskalierend für Mikroobjekte innerhalb der biologischen Wissenschaften reserviert ist. Während seiner Entwicklung in den 1950er und 1960er Jahren war es jedoch als Technik für die Materialwissenschaft 1gedacht. Mit den jüngsten Fortschritten in den Materialwissenschaften im Zusammenhang mit plasmonischen Nanopartikeln hat sich ein erhöhtes Interesse an der Charakterisierung von Materialien mit optischer Mikroskopie vollzogen.
Für die Nanomaterialcharakterisierung gibt es sicherlich viele optische Techniken (z.B. Dunkelfeld, Brightfield, polarisiertes Licht, Fluoreszenz, etc.). Dunkles Feld ist in der Nanopartikelforschung weit verbreitet, aber es stützt sich ausschließlich auf die Sammlung von Streuern und liefertbegrenzte Informationen über komplexe Proben 2. Fluoreszenz kann nützlich sein, aber nur mit Proben, die leuchten oder richtig befleckt werden können. Die DIC-Mikroskopie hat mehrere Eigenschaften, die sie zu einem wertvollen Werkzeug für die Analyse von Nanopartikeln machen. Die am häufigsten genannten Vorteile von DIC im Vergleich zu anderen Methoden und in Bezug auf plasmonische Nanopartikel sind: Keine Probenfärbungerforderlich, keine Halo-Effekte, flache Tiefenschärfe und hohe seitliche Auflösung 3. DIC verfügt über zusätzliche Stärken, die für die plasmonische Nanopartikelforschung wertvoll sind. Zunächst einmal sind zwei inhärente und orthogonale Polarisationsfelder vorhanden, die gleichzeitig für Spektroskopie-Zwecke gemessen werden können2. Zweitens wird das depolarisierte Signal von Nanopartikeln im Schlussbild 2 nicht erfasst, was bei Messungen der DunkelfeldspektroskopieAnlasszu ernster Besorgnis geben kann.
Der Zweck dieses Artikels ist es, eine klare Methodik für die Verwendung von übertragbaren Nomarski DIC-Mikroskopie zur Durchführung von Spektroskopie auf plasmonischen Nanopartikeln zu liefern. Obwohl DIC eine leistungsstarke Technik ist, die auf sehr unterschiedliche Materialien angewendet werden kann, ist es auch eine Technik, die großes Geschick und Verständnis erfordert, um sie richtig zu bedienen, wenn Nanopartikel abgebildet werden. Die transmissionsbasierte Nomarski DIC-Mikroskopie hat einen komplexen Lichtweg1 , der hier nur kurz überprüft wird. Der optische Zug von DIC wird in Abbildung1 dargestellt. Das Licht wird durch das Mikroskop übertragen, indem es zuerst durch einen Polarisator und ein strahlspaltendes Nomarski-Prisma geleitet wird, bevor es vom Kondensator auf die Probenebene fokussiert wird. Nach dem Durchleben des Objekts begegnet das Licht einem strahlenden Nomarski-Prisma und einem Analysator, bevor es zum Detektor geht. Die beiden Polarisatoren und Nomarski-Prismen sind für die Bildung des DIC-Bildes von entscheidender Bedeutung und für die Herstellung der beiden orthogonalen Polarisationsfelder 1 verantwortlich. Für den Leser, der mehr über die Arbeitsgrundsätze und den optischen Weg von Nomarski DIC Mikroskopen oder die Unterschiede zwischen Nomarski DIC und anderen Stilen von DIC erfahren möchte, lesen Sie bitte weitere gut geschriebene Berichte zu diesen Themen1, 4 , 5 , 6 , 7. Platz
Ebenso wichtig ist es, die Grundnatur von plasmonischen Nanopartikeln zu verstehen, bevor man versucht, eine Spektroskopie auf ihnen durchzuführen, sei es mit Nomarski DIC, Dunkelfeld oder einer anderen Mikroskopie-Technik. Im Bereich der Plasmonik werden Nanopartikel als Partikel mit Abmessungen im Maßstab 10-100nm8,9definiert. Nanopartikel können viele Formen annehmen (z.B. Kugeln, Stäbe, Sterne, Hanteln, etc.), und die meisten ihrer wichtigen Eigenschaften ergeben sich aus Wechselwirkungen mit Licht im ultraviolett-sichtbaren Infrarotbereich des elektromagnetischen Spektrums. Der Begriff "Plasmonic" beschränkt sich nicht auf Nanopartikel10; Bei der Diskussion über Nanopartikel wird es jedoch in Bezug auf die lokalisierte Oberflächenplasmonresonanz (LSPR) verwendet. LSPR ist ein Phänomen, bei dem die Leitungselektronen in einem Nanopartikel durch eine koulomische Wechselwirkung mit elektromagnetischer Strahlung eines hochspezifischen und relativ engen Frequenzbandes 8 oszillieren. Bei diesen Frequenzen weisen plasmonische Nanopartikel eine erhöhte Absorption und Streuung des Lichts auf, wodurch sie mit der optischen Mikroskopie beobachtet werden können. In vielen Fällen wird es vorgezogen, die Nanopartikel zu beobachten, während Bandpassfilter vor den Kondensator2gestellt werden, um den Bildkontrast zu verbessern und Licht zu eliminieren, das den LSPR-Effekt nicht hervorbringt. Durch den Einsatz von Filtern ist es auch möglich, einzelne Partikelspektroskopie-Experimente durchzuführen.
LSPR-bezogenes optisches Verhalten ist in hohem Maße von der Größe und Form der Nanopartikel abhängig und kann mit vielen optischen Mikroskopie-Techniken untersucht werden. Um die Orientierungsinformationen von plasmonischen Nanopartikeln mit einer anisotropen (d.h. nicht-kugelförmigen) Form zu entschlüsseln, ist es jedoch notwendig, die Polarisierung des Lichtfeldes zu nutzen. Durch das sorgfältige Drehen des Polarisationsfeldes oder des Probensubstrats in kleinen Schritten ist es möglich, die orientierungsabhängigen spektroskopischen Eigenschaften einzelner Nanopartikel zu überwachen. Rotation und Polarisierung können auch dabei helfen, festzustellen, ob ein spektrales Merkmal auf eine dipolare oder höhere Ordnungsschwingung der Oberflächenelektronen des Nanopartikels zurückzuführen ist. Bei isotropen (d.h. kugelförmigen) Nanopartikeln bleibt das Spektralprofil jedoch bei Rotation der Probe unter polarisiertem Licht im Wesentlichen unverändert.
Durch ein DIC-Mikroskop (Abbildung 2) betrachtet, haben Nanopartikel eine luftige Scheibe mit einem schattenspendenden weiß-schwarzen Aussehen vor grauem Hintergrund. Kugelförmige Nanopartikel werden dieses Erscheinungsbild unter Rotation und mit dem Wechsel von Bandpass-Filtern behalten; Die Partikel werden jedoch nach und nach aus dem Blickfeld verblassen, da die zentrale Wellenlänge des Filters weiter von der einzigen dipolaren LSPR-Wellenlänge11 getrennt wird. Das Aussehen von Nanoroden kann sich ziemlich dramatisch verändern, da sie gedreht werden2. Nanorods haben zwei LSPR-Bänder mit dipolarem Verhalten, deren Standort auf den physikalischen Dimensionen der Nanorods basiert. Wenn die Längsachse eines Nanorodes parallel zu einem der DIC-Polarisationsfelder ausgerichtet ist, erscheint die luftige Scheibe ganz weiß oder ganz schwarz, wenn sie mit einem Bandpass-Filter betrachtet wird, der mit dieser LSPR-Wellenlänge verbunden ist. Nach dem Drehen der Probe um 90 ° wird die gegenüberliegende Farbe aufgenommen. Da die Querachse eines Nanorodes senkrecht zur Längsachse ist, nimmt die Stange beim Wechsel zwischen Filtern, die den LSPR-Wellenlängen der beiden Achsen entsprechen, die entgegengesetzte Farbe an. Bei anderen Orientierungen und Filtereinstellungen erscheinen Nanoroden eher wie Kugeln und präsentieren eine Vielzahl von schattenspendenden, luftigen Scheibenmustern. Bei Nanoröhren mit einer Querachse < 25 nm kann es schwierig sein, mit Hilfe der DIC-Mikroskopie das Signal an der Wellenlänge des LSPR zu erkennen.
Für die Durchführung einer einzelnen Partikelspektroskopie ist es wichtig, die richtigen optischen Komponenten zu verwenden und richtig auszurichten. Es muss ein Ziel der DIC-Mikroskopie verwendet werden. Für Einzelpartikelversuche sind 80x oder 100x Ölziele ideal. Nomarski DIC Prismen gibt es in der Regel in drei Varianten: Standard, hoher Kontrast und hohe Auflösung. Der ideale Typ hängt stark vom Zweck des Experiments und der Größe der Nanopartikel ab. Standard-Prismen sind für viele Experimente in Ordnung; Aber bei der Arbeit mit kleineren Nanopartikeln (< 50 nm) können kontrastreiche Prismen von Vorteil sein, da der Partikelkontrast abnimmt, da die Partikel in der Größe11abnehmen. Die Anpassung des DIC-Kontrastes erfolgt entweder durch Drehen eines Polariszers oder durch die Übersetzung einer der DIC-Prismen, je nach Mikroskop-Markeoder Modell 6.
Nach der Einstellung der Kohler-Beleuchtung und der Polarisator-Einstellungen ist es wichtig, diese Einstellungen nicht zu ändern, während Spektroskopie-Daten gesammelt werden. Darüber hinaus muss bei der Datenerfassung jederzeit ein konstantes durchschnittliches Hintergrundsignal beibehalten werden, auch beim Wechsel zwischen Filtern und Winkeleinstellungen. Der eigentlich ideale Hintergrundwert hängt vom dynamischen Bereich der wissenschaftlichen Kamera ab, aber im Allgemeinen sollte der Hintergrund im Bereich von 15% liegen – 40% des maximalen Erkennungsniveaus der Kamera. Dadurch sinkt die Wahrscheinlichkeit, den Kamerasensor zu sättigen und gleichzeitig einen optimalen Partikelkontrast zu ermöglichen. Für das Sammeln von Spektroskopie-Daten ist es notwendig, mit einer wissenschaftlichen Kamera zu arbeiten, die im Gegensatz zu einer Farbkamera Bilder in Schwarz-Weiß erfasst.
Die Probenvorbereitung ist ein weiterer kritischer Aspekt der Bildgebung von Plasmonikarnen. Es ist zwingend erforderlich, dass die Bediener der DIC-Mikroskopie die optischen Eigenschaften der Probe und das Substrat der Probe verstehen. Das "vorgereinigte" Mikroskop-Glas ist für die Abbildung von Nanopartikeln nicht ausreichend vorbereitet und muss vor der Probenablagerung gründlich wiedergereinigt werden, um eine ungehinderte Beobachtung der Probe zu gewährleisten. Viele Reinigungsprotokolle für Mikroskop-Dias wurden zuvor dokumentiert 12,aber es ist kein Schritt, der normalerweise in experimentellen Studien berichtet wird.
Schließlich sind die Methoden der Datenanalyse die letzte Komponente der einzelnen Teilchenspektroskopie. Die Maximal-und Minimalintensitäten für jeden Nanopartikel müssen gemessen werden, ebenso wie der lokale Hintergrunddurchschnitt. Interessenspartikel sollten sich in Gebieten befinden, in denen es keinen Hintergrundschutt, Substratfehler oder eine ungleichmäßige Beleuchtung gibt. Eine Methode zur Bestimmung des Spektralprofils eines Nanopartikels ist die Berechnung des Partikelkontrums auf jeder Wellenlänge,wobeidieGleichung unter 11,13, 14,15verwendetwird:

Alternativ kann das Spektrum eines einzelnen Teilchens in seine individuellen Maximal-und Minimalsignalkomponenten unterteilt werden, die die beiden Polarisationsfelder von DIC darstellen und so die beiden gleichzeitig gesammelten, richtungsabhängigen Spektren anzeigen, Durch die beiden Gleichungen:
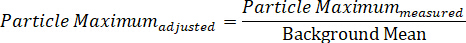
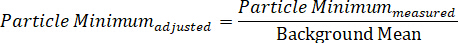
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Probenvorbereitung mit Standard-Glasmikroskopie-Dias
- Bereiten Sie Glasmikroskop-Dias für die Probenablagerung vor.
Hinweis: Unter bestimmten Umständen ist es vielleicht sinnvoller, das Glas in ultrareinem Wasser statt in Ethanol zu lagern. Die Lagerung in Wasser oder Luft macht das Glas jedoch im Laufe der Zeit hydrophobisch.- Für beste Ergebnisse kaufen Sie Glas-oder Quarzmikroskop-Dias und Deckglas.
- Mit einem schreienden Stift, legen Sie eine flache und kurze Kratzmarke auf die Mitte eines jeden Glasabdeckers.
- Reinigen Sie das gesamte Mikroskop-Glas, auch wenn es "vorgereinigt" gekauft wird, um Glasscherben, Staub, Pulver, organische Rückstände und andere Verunreinigungen zu entfernen, die die Bildqualität oder die Probenablagerung beeinflussen.
Hinweis: Diese unten stehende Reinigungsmethode funktioniert gut für die hier beschriebenen Proben und vermeidet den Einsatz von harten Chemikalien. Härtere Chemikalien können das Glas einreißen und erfordern mehr Sorgfalt im Umgang und Entsorgung.- Mikroskop-Glas auf Lagerregale und dann in einen Becher oder in ein Färbegefäß legen. Legen Sie Mikroskop-Glas nicht an den Boden von Bechern und anderen Laborglassgut ohne Regale, da jedes Stück und jede Oberfläche aus Mikroskop-Glas vollständig den Reinigungsmitteln ausgesetzt werden sollte.
- ~ 1 ml flüssiges Reinigungsmittel (Materialtafel) in den Behälter gießen und den Behälter mit Wasser auffüllen. Sonicate für 30 min.
Hinweis: Sobald der Reinigungsprozess beginnt, behandeln Sie das Glas nur noch mit Handschuhen, um Fingerabdruckrückstände auf dem Glas zu vermeiden. - Den flüssigen Gehalt des Reinigungsbehälters in eine Spüle geben. Spülen Sie den Behälter mehrmals mit ultrareinem Wasser, um das gesamte Erscheinungsbild des Reinigungsmittels zu entfernen. Den Behälter mit ultrareinem Wasser auffüllen. Sonicate den Behälter mit Mikroskop-Glas für weitere 30 Minuten.
- Den vorherigen Schritt mindestens noch einmal wiederholen. Führen Sie zusätzliche Klangerunden im Wasser durch, bis offensichtlich alle Spuren des Waschmittels entfernt wurden.
- Den Inhalt des Reinigungsbehälters ausgießen. Den Behälter mit ultrareinem Wasser abspülen. Den Behälter mit Ethanol auffüllen. Sonicate Mikroskop-Glas für 30 min.
- Den Inhalt des Reinigungsbehälters in einen Abfallbehälter geben. Mit Ethanol nachfüllen. Decken Sie den Behälter ab, um den Verlust von Ethanol durch Verdunstung zu verhindern. Bewahren Sie das Mikroskop-Glas in diesem Behälter bis zum Experimentieren auf. Dias bleiben sauber und nutzbar, solange sie in Ethanol in einem überdachten Behälter untergetaucht bleiben.
-
Vorbereitung der Nanopartikellösung
- Mit Hilfe eines Mikropipette einen 100 μL aliquot von 0,05 mg/mL Gold Nanopartikel aus dem ursprünglichen Speicherbehälter entfernen und die Lösung in ein 1,5 mL Zentrifugenrohr werfen.
- Zentrifuge die Probe 10 min bei 6.000 x g.
- Entfernen Sie den Supernatant mit einer Mikropipette, um überschüssiges Tensid zu entfernen.
- Mit Hilfe einer Mikropipette 100 μL ultrareines Wasser in das Zentrifugenrohr legen.
Hinweis: Wenn beim ersten Versuch nicht alle Supernatanten entfernt werden können, wiederholen Sie die Zentrifusions-und Resanimationsschritte. - Kurz wirbeln Sie die Probe, um das Pellet wieder zu verlegen. Sonicate unmittelbar danach für 20 Minuten, um Nanopartikel-Aggregate vollständig wiederzubeleben und aufzubrechen.
Hinweis: Wird die Probe nicht sofort verwendet, sollte sie vor der Ablagerung auf Mikroskop-Glas 20 Minuten lang wieder sonicated werden.
-
Probenablagerung
- Entfernen Sie gereinigte Abdeckschlitze und Mikroskop-Folien aus ihren Lagerbehältern. Das Glas mit Druckstickstoff oder Argon abtropfen lassen.
- Mit Hilfe eines Mikropipette, tropfengedeckte 6 μL Nanopartikel-Lösung von Schritt 1.2.5 auf den Cover-Slip. Um das Tröpfchen gleichmäßig zu verteilen, legen Sie vorsichtig ein zweites, größeres Stück Mikroskop-Glas auf den Deckungsschlitz, wie zum Beispiel einen zweiten Deckungsschlitz oder eine Mikroskop-Rutsche. Vermeiden Sie es, Luftblasen zwischen den beiden Glasstücken zu verfangen.
- Drehen Sie das Probensubstrat um und versiegeln Sie die Kanten des Deckels mit einer schmalen Linie aus Nagellack, um eine Verdunstung der mittleren Lösung zu verhindern.
- Alternativ, um die Probe "trocken" zu machen, lassen Sie die Lösung für 5 – 15 Minuten auf dem Deckel rutschen, bevor Sie das unerwünschte Stück Glas entfernen. Sanft blasen Sie die Abdeckung trocken mit Druckstickstoff oder Argon.
- Wenn möglich, führen die Bildproben sofort nach der Vorbereitung. Wenn das nicht möglich ist, lagern Sie Proben in einem überdachten Behälter, wie zum Beispiel einer Petrischale, bis zur Bildgebung.
2. DIC Bildgebung
- Ziel und Kondensator ausrichten.
- Nachdem Sie die Probe auf das Mikroskop gelegt haben, finden Sie die Brennweite mit der Probe darauf. Zuerst die zuvor erstellte Kratzmarke lokalisieren und fokussieren. Dann den Fokus fein abstimmen, bis Nanopartikel in Sicht kommen.
- Um die exakte Platzierung des Kondensators zu ermitteln, nutzen Sie die Kohler Illumination Methode. 5 Kohler-Beleuchtung bei hoher Vergrößerung (80x, 100x) wird leichter erreicht, indem man die Kohler-Beleuchtung zunächst auf eine niedrigere Vergrößerung setzt, wie 20x.
Hinweis: In der Regel muss die Kohler-Beleuchtung bei der Bildgebung einer einzelnen Probe nicht neu eingestellt werden. Es ist jedoch eine gute Praxis, zu überprüfen, ob die Kohler-Beleuchtung beim Umschalten auf eine neue Mikroskop-Rutsche richtig eingestellt ist.
- Optimieren Sie die Kontrasteinstellungen.
- Wählen Sie eine Region von Interesse innerhalb der Stichprobe für die Bildgebung. Zentrieren Sie die Region im Blickfeld der Kamera und passen Sie den Fokus bei Bedarf an.
- Wenn das Mikroskop das de Senarmont-Design hat, beginnen Sie mit dem Polarizer, der in der Nähe des maximalen Aussterbens des Hintergrunds gesetzt ist, und drehen Sie den Polarisator nach und nach in Richtung abnehmendes Hintergrundaussterben. Die Hintergrundintensität wird allmählich zunehmen.
- Wenn das Mikroskop kein de Senarmont-Design hat, beginnen Sie mit dem optischen Zugset, das bei maximalem Hintergrundaussterben gesetzt wird. In diesem Fall, schrittweise die objektive Prismenposition auf das abnehmende Hintergrundaussterben anpassen.
Hinweis: Die ideale Einstellung wird erreicht, wenn die Nanopartikel ihren größten Intensitätsunterschied (z.B. Kontrast) vom durchschnittlichen lokalen Hintergrundwert erreichen. Bei plasmonischen Nanopartikeln wird ein optimaler Kontrast in der Regel mit relativ dunklem Hintergrund erreicht, also bei Einstellungen in der Nähe des maximalen Hintergrundaussterbens.
- Wählen Sie eine Region von Interesse innerhalb der Stichprobe für die Bildgebung. Zentrieren Sie die Region im Blickfeld der Kamera und passen Sie den Fokus bei Bedarf an.
- Bilden Sie die Probe.
- Schalten Sie die Raumbeleuchtung aus, um eine strapazierfähige Beleuchtung mit dem Prozess zu verhindern.
- Beim Betrachten der Nanopartikel mit einer wissenschaftlichen Bildkamera wird der optimale Hintergrundlevel ermittelt. Mit einer Breite von 10 nm bei halbem Maximum (FWHM) mit der zentralen Wellenlänge, die mit der Hauptwellenlänge von LSPR einhergeht, betrachten Sie die Region, die von Interesse ist. Stellen Sie die Lampenintensität oder Belichtungszeit so lange ein, bis sich der Hintergrundbereich im Bereich von 15% befindet – 40% des maximalen Ausacity der Kamera und keine Objekte im Bereich des Interesses zeigen Signalintensitäten, die 90% des maximalen Intensitätsniveaus der Kamera überschreiten.
Hinweis: Das Ziel des Schrittes 2.3.2 ist es, eine Sättigung des Sensors beim Wechsel zwischen Filtern zu verhindern. Die ideale Hintergrundstufe wird zwischen Proben und Kameras variieren. Sobald dieser Schritt abgeschlossen ist, kann die Belichtungszeit eingestellt werden, nicht aber die Lampenintensität. - Stellen Sie die Probe mit einer Reihe von Bandpass-Filtern, die jeweils einen FWHM von 10 nm haben und die als Ganzes eine Bildgebung über die gesamte Wellenlänge von Interesse ermöglichen. Stellen Sie sicher, dass die Hintergrundintensität von Bild zu Bild (innerhalb von ~ 5% voneinander) konsistent bleibt, indem Sie die Belichtungszeit anpassen. Nach dem Umschalten der Filter, konzentrieren Sie die Probe vor der Bildaufnahme neu.
- Speichern Sie die Bilder als unkomprimierte TIFF-Dateien and/oder im nativen Dateiformat der Software, um alle Informationen zu speichern.
- Drehen Sie die Probe.
- Nach dem Sammeln von Bildern der Probe an ihrer ursprünglichen Position kann die Probe nun gedreht und mit zusätzlichen Orientierungen im Lichtweg abgebildet werden. Führen Sie die Rotation in regelmäßigen Abständen (z.B. 10 ° oder 15 °) im Bereich von 180 ° oder 360 ° durch.
Achtung: Die Rotation erfordert eine drehbare Probenstufe. - Wie in den Abschnitten 2.1-2.3, passen Sie die Kameraeinstellungen an, um eine konsistente Hintergrundebene von Bild zu Bild zu bieten.
NOTE: Es sollte keine Anpassung an Kohler Illumination vorgenommen werden.
- Nach dem Sammeln von Bildern der Probe an ihrer ursprünglichen Position kann die Probe nun gedreht und mit zusätzlichen Orientierungen im Lichtweg abgebildet werden. Führen Sie die Rotation in regelmäßigen Abständen (z.B. 10 ° oder 15 °) im Bereich von 180 ° oder 360 ° durch.
3. Datenanalyse mit ImageJ
Hinweis: Die folgenden Berechnungen können in einer Vielzahl von Softwarepaketen durchgeführt werden, und manchmal in dem nativen Programm, das verwendet wird, um die Bilder zu sammeln. ImageJ ist eine frei verfügbare Software der National Institutes of Health (NIH).
- Berechnen Sie den Partikelkontrast oder die Intensität.
- Öffnen Sie das Bild mit ImageJ.
- Wählen Sie das Rechteck-Werkzeug aus und zeichnen Sie ein Rechteck um den Hauptbereich.
- Wählen Sie in der Werkzeugleiste Bild, dann Zoom, dann zur Auswahl. Das Bildfenster wird auf den ausgewählten Bereich zoomen.
- Wählen Sie in der Werkzeugleiste Bild, dann Adjust,dann Brightness/Kontrast. Ein neues Fenster erscheint. Um eine bessere Betrachtung der Probenregion zu ermöglichen, passen Sie die vier Einstellungen an: Minimum, Maximum, Helligkeit und Kontrast. Diese Anpassungen verändern die wissenschaftlichen Daten nicht, sie ermöglichen lediglich eine bessere Sichtbarkeit der Probenregion.
Hinweis: Schritte 3.1.3 und 3.1.4 können mehrfach und in umgekehrter Reihenfolge durchgeführt werden. - Mit dem Rechteck-Werkzeug noch einmal eine Box um den ersten Nanopartikel ziehen, die gemessen werden soll. Die Box sollte nur geringfügig größer sein als die luftige Scheibe des Nanopartikels.
- Wählen Sie in der Werkzeugleiste Analyse und dann Maß. Es erscheint ein neues Fenster, das die Minimal-, Maximal-und Mittelwerte für die Pixel innerhalb der ausgewählten Box meldet.
- Ziehen Sie die Box, mit der der Nanopartikel gemessen wird, in einen Bereich, der unmittelbar an das Teilchen angrenzt ist, wo der Hintergrundkontrast relativ gleichmäßig ist und keine Partikel oder Verunreinigungen vorhanden sind. Behalten Sie die Originalgröße der Box.
- Verwenden Sie das Messwerkzeug, um die mittlere Intensität für den Hintergrundbereich zu bestimmen.
- Messen Sie die restlichen Partikel und einen angrenzenden Hintergrundbereich für jeden.
- Wiederholen Sie den Vorgang für jedes Teilchen in allen Bildern der Serie.
- Exportieren Sie die Daten in eine Tabelle, um den Kontrast oder die Intensität jedes Teilchens über alle Wellenlängen und Winkel zu berechnen.
- Berechnen Sie den Kontrast jedes Teilchens mit der folgenden Gleichung13,14,15:

Hinweis: Mit dieser Gleichung sollte der Partikelkontrast immer > 0 sein. - Berechnen Sie den rückenbereinigten Maximalwert des Partikels, indem Sie die gemessene Maximalintensität durch den Hintergrundwert teilen:
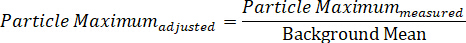
- Ebenso berechnen Sie den rückenbereinigten Mindestwert, indem Sie die gemessene Mindestteilstoffintensität durch den Hintergrund teilen:
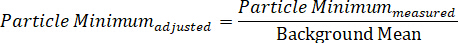
Hinweis: Wie berechnet, sollte das Maximum einen Wert größer als einen haben, während das Minimum kleiner als ein Wert sein wird. Es ist akzeptabel, jeden Wert durch "1" zu subtrahieren, so dass der durchschnittliche Hintergrund im Wesentlichen null ist, das Maximum als positiver Wert dargestellt wird und dem Mindestwert ein negativer Wert16zugeordnet wird. Dieser letztere Ansatz erlaubt es dem Analysten, separat zu überlegen, was entlang der Polarisationsfelder passiert, was bei der Untersuchung anisotropen Teilchen nützlich ist. - Um das Spektralprofil an einer bestimmten Nanopartikel-Position zu zeichnen, werden die Plotdaten mit der Wellenlänge entlang der x-Achse und dem Kontrast oder der Intensität entlang der y-Achse dargestellt.
- Um das Rotationsprofil auf einer bestimmten Wellenlänge zu zeichnen, zeichnen Sie den Drehwinkel entlang der x-Achse und den Kontrast oder die Intensität entlang der y-Achse.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Bei der Arbeit mit Proben, die groß genug sind, um mit bloßem Auge gesehen zu werden, ist es in der Regel nicht erforderlich, Wahrzeichen auf dem Glassubstrat zu platzieren. Bei der Arbeit mit Nanomaterialien oder bei der Rotation der Probe können Wahrzeichen jedoch eine einfache Methode zur Ortung, Unterscheidung und Verfolgung der Probenorientierung bieten. Obwohl ausgeklügeltere Techniken verwendet werden können, um Wahrzeichen auf Glassubstraten 17zu hinte...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Bei der Bildgebung mit der DIC-Mikroskopie ist es entscheidend, die optischen Komponenten vor dem Sammeln von Daten zu optimieren. Schon kleinere Anpassungen des Polariszers in der Mitte eines Experiments können zu erheblichen Auswirkungen auf die Enddaten6führen. Darüber hinaus benötigen unterschiedliche Materialien unterschiedliche Polarisator-Einstellungen. Obwohl hier große Schrittgrößen verwendet wurden, um die Wirkung des Polarisationswinkels zu demonstrieren, ist es in einem eigentli...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Der Autor hat nichts zu offenbaren.
Danksagungen
Dr. Anthony S. Stender möchte die technische Unterstützung durch das Nanoscale and Quantum Phenomena Institute (NQPI) an der Universität Ohio würdigen. Dieser Artikel wurde durch die Inbetriebnahme von Dr. Stender von der Ohio University ermöglicht.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Contrad 70 | Decon Labs, Inc. | 1002 | For cleaning microscope glass, Available through many chemical suppliers |
| Ethanol | Fisher Scientific | A962-4 | For cleaning and storing microscope glass |
| Glass microscope cover slips | Ted Pella | 260148 | |
| Glass microscope slides | Ted Pella | 26007 | |
| Gold nanorods | Nanopartz | DIAM-SPR-25-650 | |
| Gold nanospheres (80 nm) | Sigma Aldrich | 742023-25ML | |
| ImageJ | NIH | N/A | Free Software availabe for data analysis from NIJ |
| Nail polish | Electron Microscopy Sciences | 72180 | |
| Nikon Ti-E microscope | Nikon | N/A | |
| Nitrogen gas | Airgas | N/A | |
| ORCA Flash 4.0 V2+ digital sCMOS camera | Hamamatsu | 77054098 | |
| Scribing pen | Amazon | N/A | Many options available online for under $10. Not necessary to buy an expensive version. |
| Ultrapure water | 18 megaohm |
Referenzen
- Pluta, M. Ch 7: Differential Interference Contrast in. Advanced Light Microscopy. 2, Elsevier. 146-197 (1989).
- Stender, A. S., Wang, G., Sun, W., Fang, N. Influence of Gold Nanorod Geometry on Optical Response. ACS Nano. 4 (12), 7667-7675 (2010).
- Stender, A. S., et al. Single Cell Optical Imaging and Spectroscopy. Chemical Reviews. 113 (4), 2469-2527 (2013).
- Mehta, S. B., Sheppard, C. J. R. Partially coherent image formation in differential interference contrast (DIC) microscope. Optics Express. 16 (24), 19462-19479 (2008).
- Murphy, D. B., Davidson, M. W. Ch 1: Fundamentals of Light Microscopy. Fundamentals of Light Microscopy and Electronic Imaging, Second edition. , Wiley. 1-20 (2012).
- Stender, A. S., Augspurger, A. E., Wang, G., Fang, N. Influence of Polarization Setting on Gold Nanorod Signal at Nonplasmonic Wavelengths Under Differential Interference Contrast Microscopy. Analytical Chemistry. 84 (12), 5210-5215 (2012).
- Wang, G., Sun, W., Luo, Y., Fang, N. Resolving Rotational Motions of Nano-objects in Engineered Environments and Live Cells with Gold Nanorods and Differential Interference Contrast Microscopy. Journal of the American Chemical Society. 132 (46), 16417-16422 (2010).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Mulvaney, P. Not All That's Gold Does Glitter. MRS Bulletin. 26 (12), 1009-1014 (2012).
- Maier, S. A. Plasmonics: Fundamentals and Applications. , Springer US. (2007).
- Sun, W., Wang, G., Fang, N., Yeung, E. S. Wavelength-Dependent Differential Interference Contrast Microscopy: Selectively Imaging Nanoparticle Probes in Live Cells. Analytical Chemistry. 81 (22), 9203-9208 (2009).
- Cras, J. J., Rowe-Taitt, C. A., Nivens, D. A., Ligler, F. S. Comparison of chemical cleaning methods of glass in preparation for silanization. Biosensors and Bioelectronics. 14 (8), 683-688 (1999).
- Augspurger, A. E., Sun, X., Trewyn, B. G., Fang, N., Stender, A. S. Monitoring the Stimulated Uncapping Process of Gold-Capped Mesoporous Silica Nanoparticles. Analytical Chemistry. 90 (5), 3183-3188 (2018).
- Murphy, D. B., Davidson, M. W. Ch 2: Light and Color. Fundamentals of Light Microscopy and Electronic Imaging, Second Edition. , Wiley. 21-33 (2012).
- Wayne, R. Ch 3: The Dependence of Image Formation on the Nature of Light. Light and Video Microscopy (Second Edition). , Academic Press. 43-78 (2014).
- Stender, A. S., Wei, X., Augspurger, A. E., Fang, N. Plasmonic Behavior of Single Gold Dumbbells and Simple Dumbbell Geometries. The Journal of Physical Chemistry C. 117 (31), 16195-16202 (2013).
- Hu, M., et al. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance. Journal of Materials Chemistry. 18 (17), 1949-1960 (2008).
- Choo, P., et al. Wavelength-Dependent Differential Interference Contrast Inversion of Anisotropic Gold Nanoparticles. The Journal of Physical Chemistry C. 122 (47), 27024-27031 (2018).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon Coupling of Gold Nanorods at Short Distances and in Different Geometries. Nano Letters. 9 (4), 1651-1658 (2009).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten