Method Article
Gewinnung von wässrigen Metaboliten aus kultivierten Adherenten Zellen für die metabolomische Analyse durch die kapitänische Spektrometrie Elektrophoresis-Mass
In diesem Artikel
Zusammenfassung
Der Zweck dieses Artikels ist es, ein Protokoll für die Extraktion von wässrigen Metaboliten aus kultivierten, anhaftenden Zellen für die metabolomische Analyse zu beschreiben, insbesondere die kapillare Elektrophoresen-Massenspektrometrie.
Zusammenfassung
Die metabolomische Analyse ist ein vielversprechender Omik-Ansatz, um nicht nur die spezifische Stoffwechselregulation in Krebszellen im Vergleich zu normalen Zellen zu verstehen, sondern auch Biomarker für die Krebserkennung und Vorhersage von Chemotherapie-Reaktionen im Frühstadium zu identifizieren. Krebspatienten. Die Vorbereitung einheitlicher Proben für die metabolomische Analyse ist ein kritisches Thema, das noch angegangen werden muss. Hier stellen wir ein einfaches und zuverlässiges Protokoll zur Gewinnung wässriger Metaboliten aus kultivierten, haftenden Zellen zur metabolomischen Analyse vor, die mittels der kapillaren Elektrophoresen-Massenspektrometrie (CE-MS) verwendet wird. Wässrige Metaboliten aus kultivierten Zellen werden durch Kultivierungs-und Waschzellen analysiert, Zellen mit Methanol behandelt, Metaboliten extrahiert und Proteine und Makromoleküle mit Spinnspalten für die CE-MS-Analyse entfernt. Repräsentative Ergebnisse mit Hilfe von Lungenkrebszelllinien, die mit Diamid behandelt werden, einem oxidativen Reagenz, zeigen die deutlich beobachtbare Stoffwechselverschiebung von Zellen unter oxidativem Stress. Dieser Artikel wäre besonders wertvoll für Studenten und Forscher, die an der Metabolomik-Forschung beteiligt sind, die neu sind, um Metaboliten aus Zelllinien zu ernten, um sie von CE-MS zu analysieren.
Einleitung
Otto Warburg beobachtete, dass Krebszellen die ungewöhnliche Fähigkeit erlangen, Glukose aufzunehmen und sie zu gären, um Laktat in Gegenwart von ausreichend Sauerstoff zu produzieren — ein Phänomen, das als Warburg-Effekt oder Aerobic-Glykolyse1,2bezeichnet wird. Als Grundlage für die aeroben Glykolyse in Krebszellen 3 werden mitochondriale Atemdefekte spekuliert. Tatsächlich ist der Warburg-Effekt die Grundlage für die Tumorabbildung durch Fluorodeoxyglukose (FDG)-Positronen-Emissionstomographie (PET), die in der klinischen Praxis4,5weitverbreitet ist. Eine hohe Aerobic-Glykolysegiltals ein wesentliches Merkmal von Krebs und wurde vor kurzem als eines der bekannten "Kennzeichen von Krebs" angenommen, wie es D. Hanahan und B. Weinberg 6 beschrieben haben. Somatische Mutationen in Onkogenen und Tumorsuppressorgenen — wie HRAS/KRAS/NRAS, EGFR, BRAF, MYC, TP53, Isozitrat-Dydrierase (IDH) und Fumarathydratase (FH — mit spezifischen Stoffwechselveränderungen in Krebszellen in Verbindung gebracht wurden, die als Folge des Warburg-Effekts 7 gelten.
Die metabolomische Analyse ist ein vielversprechender Ansatz, nicht nur die Stoffwechselregulation in Krebszellen zu verstehen, sondern auch, um Biomarker im Frühstadium und die Vorhersage der Chemotherapie zu identifizieren. Nach der Behandlung sensibler oder resistenter Krebszellen mit Krebsmittelverbindungen ermöglicht die Verfolgung ihrer Stoffwechselreaktionen die Identifizierung von Stoffwechselbiomarkern, um die Wirksamkeit bestimmter Krebstherapien bei Krebspatienten vorherzusagen 88 ,9,10,11. In diesem Artikel wurden Krebszelllinien, die von einem Lungenadenokarzinom mit einer EGFR-Mutation abgeleitet sind, die mit Diamid — behandelt wird, die oxidativen Stress verursacht — als Modelle für die metabolomische Analyse verwendet wurden. Der Vorteil dieser analytischen Methode mit kapillarer Elektrophoresis-Massenspektrometrie (CE-MS) ist die umfassende Messung von geladenen Metaboliten mit dem Massenbereich m/50-1000 12,13. Der Zweck dieses Artikels ist es, den Novizen ein detailliertes stufenweises visuelles Protokoll zur Herstellung von wässrigen Metaboliten aus kultivierten Krebszellen und anschließender metabolomischer Analyse, insbesondere durch CE-MS, zu liefern.
Protokoll
1. Zellkultur am 1. Tag
Hinweis: Jede Probe für die Stoffwechselextraktion sollte aus einer einzigen 100-mm-Gewebekulturschale zubereitet werden, die mäßig, aber nicht vollständig verwirrend ist (mit etwa 2 – 5 Millionen Zellen). Berechnen Sie die Anzahl der für den Test benötigten Gerichte und bereiten Sie sie entsprechend vor.
- Kultur HCC827 und PC-9-Zellen in 5% CO 2 bei 37 ° C in RPMI-1640 Medium ergänzt mit 10% fetalen Rinderserum (FBS).
- Aspiration die Zellkulturmedien aus den 100-mm-Kulturgerichten.
- Waschen Sie Zellen auf jeder Schüssel mit 2 ml Phosphat-gepufferten Saline (PBS) Lösung ohne Kalzium und Magnesium. Jedes Gericht sanft rocken, so dass die PBS-Lösung die Oberfläche der Schale vollständig abdeckt.
- Den Waschpuffer aus den Kulturgerichten aufsaugen.
- Warm 0,25% Trypsin-EDTA-Lösung auf 37 ° C und 2 mL Trypsin-EDTA-Lösung mit einer 5 mL serologischen Pipette hinzufügen. Jedes Gericht so sanft felsen, dass die Trypsin die Oberfläche der Schüssel vollständig bedeckt.
- Die Kulturgerichte bei 37 ° C ca. 5 min einverwöhnen.
- Fügen Sie 4 ml vorgewärmtes komplettes Wachstumsmedium pro Schüssel hinzu. Die Zellen in Medium wiederbeleben, indem Sie mehrmals sanft pipettieren.
- Jede Zellaufhängung auf ein separates 15 mL konisches Rohr und Zentrifuge mit 800 × g für 5 min übertragen.
- Resuspend jedes Zellpellet in 2 mL vorgewärmtem Gesamtwachstumsmedium.
- Bestimmen Sie die Gesamtzahl und die prozentuale Lebensfähigkeit der Zellen mit dem automatisierten Zellzähler und 0,4% trypan blauer Lösung.
- Mischen Sie 10 μL Zellaufhängung und 10 μL von 0,4% Trypan Blue-Lösung.
- Laden Sie 10 μL Probe in die Zellzählkammer rutschen durch Kapillarwirkung.
- Legen Sie den Kammerrutsch in den automatisierten Zellzähler. Das übertragene Licht leuchtet automatisch aus und das Instrumentenauto konzentriert sich auf die Zelle.
- Klicken Sie auf die Aufnahmetaste, um das Bild zu erfassen und die Ergebnisse anzuzeigen.
- Wenn nötig, fügen Sie ein weiteres Wachstumsmedium hinzu, um die gewünschte Zellkonzentration zu erhalten.
- Saatgut sind etwa 1 – 2,5 Millionen Zellen pro 100 mm Zellkulturschale.
Hinweis: Die durch die CE-MS-Analyse ermittelten Stoffwechselkonzentrationen werden auf der Grundlage der Anzahl der lebensfähigen Zellen normalisiert. Für die Zellzählung ist es notwendig, für jede Gruppe mindestens ein zusätzliches Saatgut zuzubereiten. - Die Kulturgerichte in 5% CO 2 bei 37 ° Cfür 18 Stunden anfärmen.
2. Zubereitung von Reagenzien
- Verdünnen Sie eine kommerzielle interne Standardlösung mit L-Methion-Sulfon und D-Camphor-10-Sulfonsäure 1000-fach in ultrareinem Wasser.
Hinweis: Für weniger als 80 Proben einfach 50 μL der internen Standardlösung 1 und 45 ml ultrareines Wasser in eine 50 ml volumetrische Flasche mischen, dann die Lösung bis zu 50 ml mit ultrareinem Wasser mitbringen. - Bereiten Sie eine 0,05 g/mL Mannitol-Lösung in ultrareinem Wasser als Waschpuffer vor.
Achtung: Für weniger als 30 Proben einfach 25 g Mannitol in 500 ml ultrareines Wasser auflösen. Pro 100 mm Kulturschale werden ca. 15 ml Waschpuffer benötigt, so dass je nach Anzahl der Proben ein ausreichendes Volumen an Waschpuffer erstellt wird.
3. Vorwasch-Zentrifugalfiltereinheiten
- Pipette 250 μL ultrareines Wasser in die Filterbecher jeder Zentrifugalfiltereinheit (siehe Materialtabelle).
Achtung: Pro Probe werden zwei Filtereinheiten benötigt. - Die Filtereinheiten fest und zentrifuge bei 9,100 × g bei 4 ° C für 5 min fest und zentrifuge.
- Überprüfen Sie das Volumen jedes Filtrats — wenn sich bei der ersten kurzen Drehung signifikantes Filtrat angesammelt hat, kann die Filtereinheit defekt sein. In diesem Fall die Filtereinheit ablegen und stattdessen eine neue Filtereinheit verwenden.
- Schließen Sie die Deckel der Filtereinheiten fest und zentrifuge bei 9,100 × g bei 4 ° C für 30 min wieder.
- Achten Sie darauf, dass in keinem der Filterbecher ultrareines Wasser verbleibt; Entfernen Sie das gefilterte ultrareines Wasser in jedem Sammelrohr mit einer Pipette und werfen Sie ab.
Hinweis: Versuchen Sie nicht, Restwasser in einem Filterbecher mit einer Pipette zu entfernen, da es den Filter beschädigen kann. - Die Filterbecher in ihre Sammelrohre legen.
Hinweis: Verwenden Sie die Zentrifugalfiltereinheiten innerhalb einer Stunde, da die Filter beim Trocknen beschädigt werden können.
4. Zellkultur am 2. Tag
-
Die 100-mm-Kulturgerichte aus dem Inkubator herausnehmen.
Hinweis: Die empfohlene Zellkulturdauer beträgt 18 Uhr. - Aspirieren Sie das Zellkulturmedium aus jedem 100 mm Kulturgericht.
- Fügen Sie jedem Gericht 10 ml Zellkulturmedium hinzu, das die entsprechenden Konzentrationen von Verbindungen oder Medikamenten enthält, wobei darauf geachtet wird, die Zellschicht nicht zu stören.
Hinweis: Für Demonstrationszwecke haben wir in diesem Experiment 10 μL 250 mM-Diamid, die in PBS (Endkonzentration von 250 μM) aufgelöst wurden, hinzugefügt. - Inkubieren Sie die Kulturgerichte bei 37 ° C für 30 min in Anwesenheit von Diamid oder PBS als Kontrolle.
- Aspirieren Sie das Zellkulturmedium aus jedem 100 mm Kulturgericht.
- Waschen Sie Zellen, indem Sie sanft 2 ml von 5% Mannitol-Lösung an den Rand jeder Schüssel legen, wobei darauf geachtet wird, die Zellschicht nicht zu stören, und dann die Schale leicht kippen.
Hinweis: PBS oder Salzlösung stören sich in die CE-MSS-basierte Metabolomische Analyse und wirken sich negativ auf die Messergebnisse aus und sollten daher nicht als Waschpuffer verwendet werden. - Aspirieren Sie den Waschpuffer von jeder Kulturschale, dann waschen Sie die Zellen wieder, indem Sie sanft 10 ml Waschpuffer pro Schüssel hinzufügen und die Schüssel leicht kippen.
- Den Waschpuffer vom Rand jedes Kulturgerichts völlig absaugen.
Hinweis: Aspirieren Sie so viel Wäschepuffer wie möglich, während Sie darauf achten, die Zellen nicht zu saugen. Restmannitol kann die CE-MS-Analyse stören; Das Streben nach Zellen wird die Anzahl der Zellen verringern und so zu einer Quelle von Fehlern bei der Normalisierung der Daten werden.
5. Extraktion von Metaboliten aus kultivierten Zellen
- Pro Kulturgericht 800 μL von 99,7% Methanol hinzufügen. Jede Kulturschale wird sanft hin-und hergestromt, um ihre gesamte Oberfläche zu bedecken. Lassen Sie das Geschirr bei Zimmertemperatur für 30 s.
- Fügen Sie langsam 550 μL der verdünnten internen Standardlösung pro Schüssel hinzu, indem Sie die Spitze der Pipette in das Methanol eintauchen und mehrmals sanft nach oben und unten kippen.
- Jede Kulturschale wird sanft hin-und hergestromt, um ihre gesamte Oberfläche zu bedecken.
- Lassen Sie das Geschirr bei Zimmertemperatur für 30 s.
6. Ultrafiltration von Zellextrakten
- Übertragen Sie die extrahierte Lösung von jedem Kulturgericht auf ein separates 1,5 ml Mikrozentrifugenrohr.
- Zentrifuge die Röhren bei 2.300 × g bei 4 ° C für 5 min.
- Übertragen Sie 350 μL eines jeden Supernatants in zwei Zentrifugalfiltereinheiten pro Probe.
Hinweis: Aus jeder Kulturschale werden insgesamt 700 μL der extrahierten Lösung in zwei Filterrohre (350 μL/tube) übertragen. - Die Filterrohre bei 9,100 × g bei 4 ° C ca. 2 h zentrifugen, bis keine Flüssigkeit in den Filterbechern bleibt.
- Die Filterbecher entfernen und die Deckel der Sammelrohre fest verschließen.
7. Probenverdampfung
- Bereiten Sie einen Zentrifugalverdampfer vor — typischerweise besteht dies aus einem Verdampfer, einer Kaltfalle und einer Vakuumpumpe.
- Die Sammelrohre in den Zentrifugalverdampfer legen.
Achtung: Die Deckel der Rohre offen lassen. - Die extrahierten Probenlösungen unter Vakuumbedingungen bei Raumtemperatur verdampfen.
Hinweis: Typische Konfigurationen für die Anzahl der Rotationen und des Drucks sind 1.500 U/min bzw. 1.000 Pa, und es dauert in der Regel etwa 3 Stunden, um die Proben vollständig zu verdampfen. - Bestätigen Sie, dass keine Flüssigkeit in einem der Sammelrohre verbleibt und schließen Sie die Deckel der Rohre fest.
- Bewahren Sie die Sammelrohre in einem extrem niedrigen Temperaturbereich (− 80 ° C) bis zur metabolomischen Analyse auf.
8. Metabolomische Analyse von CE-MS
- Das Filtrat in 50 μL ultrareines Wasser unmittelbar vor der CE-MS-Analyse wiederverwenden.
- Führen Sie die CE-MS-Analyse mit denbisher beschrieben 12,13mit dem kapillaren Elektrophoresystem und dem Zeitvernahmanag-System Massenspektrometer, das mit einer isokratischen Pumpe, einem CE-MS-Adapter und einem CE-ESI-MS-Sprayer ausgestattet ist.
Hinweis: Beide Systeme lassen sich über die Software der Systemhersteller steuern und sind durch eine geschmolzene Siliziumkapillare (50 μm Innendurchmesser × 80 cm Gesamtlänge) verbunden.- Instrumente und Probenschwingungen aufstellen, die Kapillare mit einer Kapillarkassette aufbereiten, die Hüllenflüssigkeiten und die entsprechenden Elektrophorese-Puffer je nach Anion-oder Kationenanalysemodus auffüllen und dann Spannungen anwenden.
Hinweis: Instrumentierung und analytische Bedingungen werden an anderer Stelle 12,13ausführlich beschrieben. - Öffnen Sie die Software und erstellen Sie eine Werkliste mit Datenerfassungsmethoden und Musterinformationen.
- Starten Sie einen Testlauf und überprüfen Sie die Daten wie die Signalintensität und die Spitzenform interner Standards und die Spitzenauflösung anderer Standardverbindungen.
- Die analytischen Bedingungen gegebenenfalls anpassen.
- Die Musterlösungen mit 50 mbar für 3 s und einer Spannung von 30 kV injizieren.
Hinweis: CE-MS wurde entweder im positiven oder negativen Ionenmodus durchgeführt. Stellen Sie das Spektrometer ein, um den Massenbereich m/50 – 1000 zu scannen. Die Kapillarspannung wurde auf 4 kV eingestellt; Die Durchflussrate des Stickstoffgases (Heizungstemperatur 300°C). Für den positiven Modus wurden die FRFV-Spannung von Fragmentor, Skimmer und OCT auf 75, 50 bzw. 125 V eingestellt. Für den negativen Ionenmodus wurde die FRFV-Spannung des Fragmentors, Skimmer und OCT auf 100, 50 und 200 V festgelegt.
- Instrumente und Probenschwingungen aufstellen, die Kapillare mit einer Kapillarkassette aufbereiten, die Hüllenflüssigkeiten und die entsprechenden Elektrophorese-Puffer je nach Anion-oder Kationenanalysemodus auffüllen und dann Spannungen anwenden.
- Analyse von Spektrumdaten.
- Extrahalbesitzel aus den Massenspektraldaten mit automatischer Integrationssoftware, um Peak-Informationen wie m/z, Peak-Bereich und Migrationszeit (MT) zu erhalten.
Hinweis: Die Methode wird an anderer Stelle 14ausführlichbeschrieben. - Ausschließen Sie Signalspitzen, die Isotopomen, Addukt-Ionen und anderen Produktionen bekannter Metaboliten entsprechen.
- Kommentieren Sie die verbleibenden Spitzen mit Informationen aus der HMT-Metababolitendatenbank nach m/z-Werten und MTs.
- Normalisieren Sie Bereiche der kommentierten Spitzen auf interne Standardwerte und Zellzahlen pro Probe.
- Bewerten Sie die Konzentration jedes Metaboliten in den kultivierten Zellen (pmol/10 6Zellen ) mit Standardkurven, die für jeden Metaboliten vorbereitet werden.
- Nutzen Sie die quantifizierten Stoffwechselkonzentrationen für nachfolgende statistische Analysenund biologische Interpretationen 14.
- Extrahalbesitzel aus den Massenspektraldaten mit automatischer Integrationssoftware, um Peak-Informationen wie m/z, Peak-Bereich und Migrationszeit (MT) zu erhalten.
Ergebnisse
Da die Stoffwechselkonzentrationen in Krebszellen (pmol/10 6 Zellen) auf die Anzahl der lebensfähigen Zellen normalisiert werden, sollten experimentelle Bedingungen mit Vorsicht geschaffen werden, um die Variation der Anzahl der lebensfähigen Zellen zwischen den Bedingungen zu minimieren. So war die Diamidbehandlung relativ hoch (250 μm), aber für kurze Zeit, um alle Zellen so gleichmäßig wie möglich wachsen zu lassen, wodurch die Anzahl der untersuchten Zellen ausgeglichen wurde. Unter diesen Versuchsbedingungen wuchsen die HCC827 und PC-9-Zellen um 3 Stunden gleich pro Stunde (Abbildung 1). Die CE-MS-Analyse von diamid-behandelten Zellen im Vergleich zu PBS-behandelten (Kontroll-) Zellen ergab 175 bzw. 150 Differentialmetabolite in HCC827 bzw. PC-9-Zellen. Darunter waren mehrere Zwischenprodukte im Pentose-Phosphatweg (PPP) und in der oberen Glykolyse in den diamidbehandelten Bedingungen in beiden Zelllinien signifikant höher, während einige wenige Trikarbonsäure (TCA) Zyklusmittler in den behandelten Die Bedingungen (Bild 2 und Bild 3).
Das PPP erzeugt Reduktionsäquivalente in Form von reduziertem Nikotinamid-Adenin-Dinucleotid-Phosphat (NADPH), das zur Versorgung mit Rehox-Homöostasen und Fettsäure zur Biosynthese 15 verwendet wird. Nach der Diamidbehandlung — sich der Gehalt an Gluconsäure — einer oxidierten Glukose in HCC827-Zellen um das 12-fache und in PC-9-Zellen um das Zehnfache erhöht; Ähnlich vermehrt sich nach der Diamidbehandlung der Gehalt an Glukose-6-Phosphat (G6P)—a phosphorylizener Glukose und das erste hexokinase-katalysierte Glykolyse-Produkt — ebenfalls um 6,3-und 3,5-fach in HCC827 bzw. PC-9-Zellen (Abbildung4). Darüber hinaus hat sich nach der Diamidbehandlung der Gehalt an 6-Phosphogluconat (6PG)—the ersten Zwischenprodukt in PPP — in HCC827-Zellen dramatisch um das 89-Fache und in PC-9-Zellen im Vergleich zu den PBS-Steuerungen (Abbildung4) um das 231-fache erhöht. Im Gegensatz dazu änderten sich die Niveaus anderer glykolytischer Zwischenprodukte, wie Fructose 6-Phosphat (F6P) und Fructose 1,6 bisphosphat (F1,6P), im Diamidexperiment-Bedingung nicht (Abbildung4). Der gesamte Nikotinamid-Adenin-Dinucleotid-Phosphatgehalt (NADP+) entsprach fast gleichwertig zwischen der Behandlung von Diamidbehandlungen und den PBS-Kontrollbedingungen (Abbildung4), was darauf hindeutet, dass Glukose hauptsächlich über die PPP katabolisiert wurde.
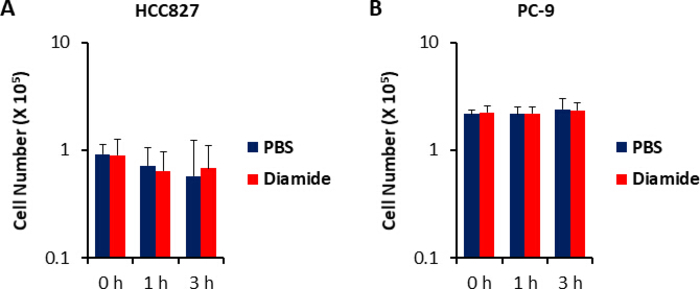
Bild 1. Unveränderte Zellzahlen bei der Diamidbehandlung. Die Reaktion des Zellwachstums auf 250 μm Diamid wurde mit Hilfe der Trypan-Blau-Färbung gemessen. Es werden die Zellzahlen der (A) HCC827 und (B) PC-9-Zellen angezeigt, die mit PBS (blau) oder Diamid (rot; 250 μm) für 1 oder 3 h behandelt werden. Die Daten werden als Mittelwert ± SD (n = 6) angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
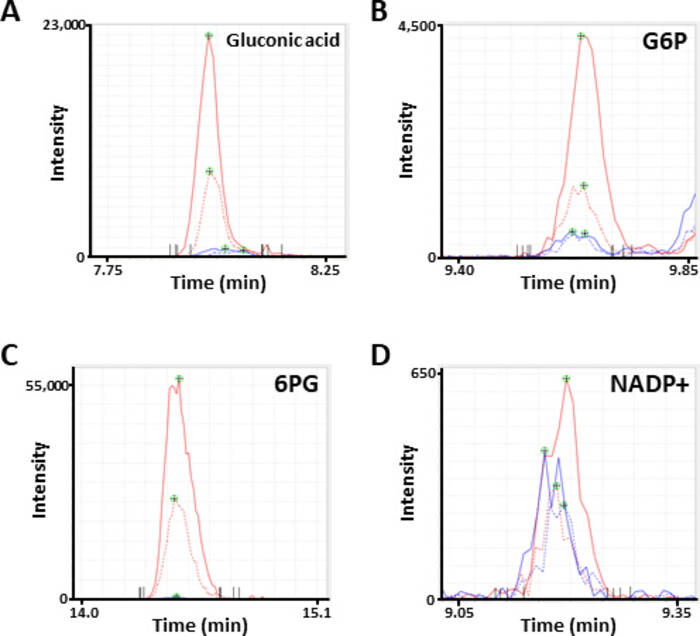
Bild 2. Repräsentative MS-Spitzen von Metaboliten. Elektropherogramme, die als (A) Gluconsäure bezeichnet werden, (B) Glukose 6-Phosphat (G6P), (C) 6-Phosphogluconat (6PG), und (D) Nikotinamid Adenin Dinucleotid-Phosphat (NADP+), die durch CE-MS-Analyse gewonnen werden. Jede Zeile zeigt die verwendete Zelllinie (fest, HCC827; gepunktet, PC-9) und die Behandlung (blau, PBS; rot, diamid) an. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
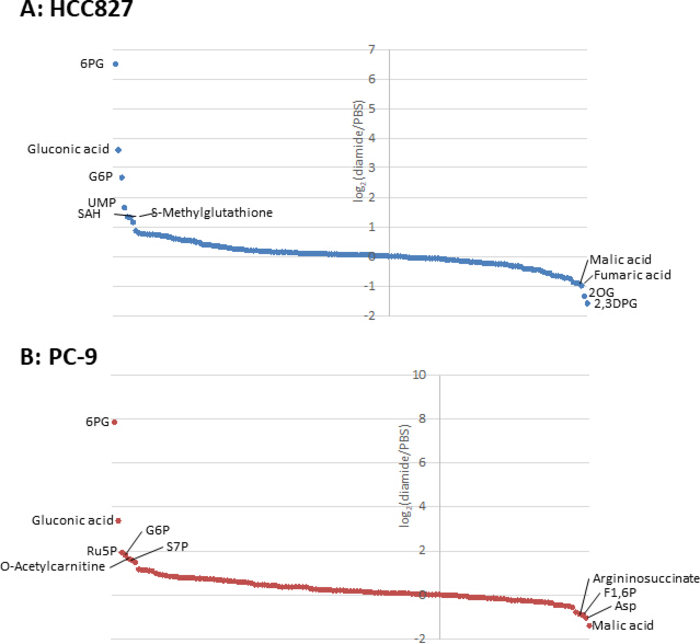
Bild 3. Metabolome Profile von intrazellulären Metaboliten. Falte Veränderungen der Metaboliten in (A) HCC827 und (B) PC-9-Zellen, die mit Diamid behandelt werden, werden als Log 2 (diamide/PBS) angezeigt. Insgesamt wurden 175 und 150 Metaboliten in HCC827 bzw. PC-9-Zellen kommentiert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
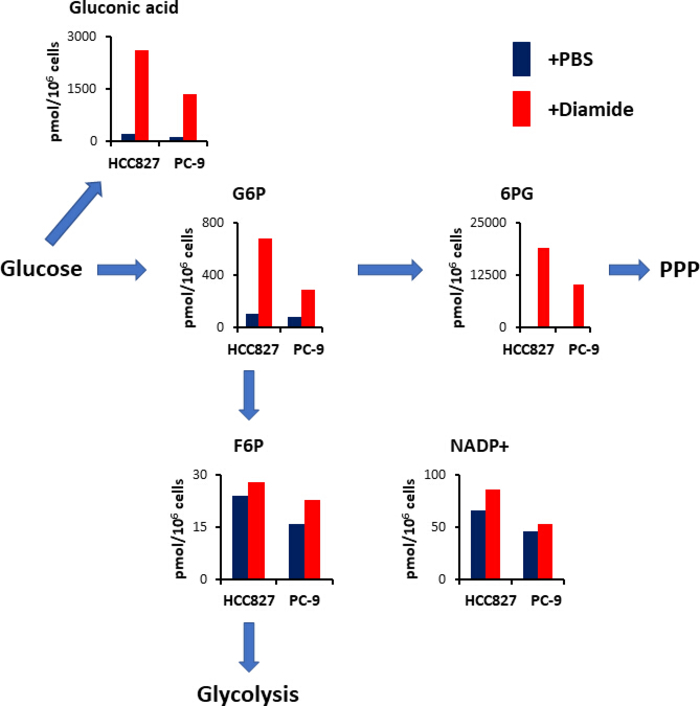
Bild 4. Oberregulierung von PPP nach der Diamidbehandlung. Es werden intrazelluläre Konzentrationen (pmolm/10 6 Zellen) wichtiger Metaboliten gezeigt, die an der Glykolyse und dem Pentose-Phosphatweg (PPP) nach der Behandlung mit Diamid beteiligt sind. Metabolite wurden aus HCC827 und PC-9-Zellen extrahiert, die mit PBS (blau) oder Diamid (rot, 250 μm) für 30 min behandelt wurden. Repräsentative Metaboliten wie Gluconsäure, Glukose-6-Phosphat (G6P), Fructose 6-Phosphat (F6P), 6 Es werden Phosphoglukonat (6PG) und Nikotinamid Adenin Dinucleotid-Phosphat (NADP+) gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Hier beschreiben wir eine allgemein zugängliche Methodik zur Vorbereitung von Metaboliten aus kultivierten Krebszellen auf die auf CE-MS basierende metabolomische Analyse. Einer der kritischsten Punkte in diesem Protokoll ist die richtige Aufbereitung von Krebszellen, da die gemessenen Stoffwechselkonzentrationen auf die Anzahl der lebensfähigen Zellen normalisiert werden. Für die genaue Abschätzung der Zellzahl ist es notwendig, mindestens ein zusätzliches Kulturgericht pro Experimentengruppe vorzubereiten, um die Anzahl der lebensfähigen Zellen parallel zur Extraktion von Metaboliten für die metabolomische Analyse zu zählen. Darüber hinaus sollte in jedem Teller die gleiche Anzahl von Zellen für die Replikate und in der Schüssel für das Zählen gesät werden; In Zukunft würde dies durch ein schnelles und stressfreies (z.B. trypsinfreies) Zellzählprotokoll unterstützt, das es erlaubt, die gleiche Schale sowohl für das Zählen lebensfähiger Zellen als auch für den Abbau von Metaboliten zu verwenden. Bei der Wäsche sollte darauf geachtet werden, dass sich die Zellen nicht von der Oberfläche der Geschirr lösen. Schwere Zytotoxizitätstests und andere Experimente, die die Zellhaftung reduzieren, können für dieses Extraktionsprotokoll aufgrund eines möglichen Verlustes von Zellen während des Waschvorgangs ungeeignet sein.
Es ist wichtig, eine 5-prozentige Mannitol-Lösung als Waschpuffer für die Extraktion von Metaboliten aus kultivierten Zellen für die CE-MS-Basis mabolomische Analyse zu verwenden, da salzbasierte Puffer, wie PBS, die metabolomische Analyse stören und die Messung negativ beeinflussen.
Zwei oder drei Gerichte können als Einzelprobe kombiniert werden, indem man Metaboliten aus jeder Schüssel einzeln extrahiert und dann Proben bündelt; Die Kombination mehrerer Gerichte erhöht jedoch oft das Restmannitol in der extrahierten Metabolitenlösung. Dies kann auch die metabolomische Analyse durch CE-MS stören. Daher wird empfohlen, nicht mehrere Gerichte oder Brunnen als eine Probe zu verwenden.
Diese metabolomische Analysemethode mit CE-MS wurde für die umfassende Messung von geladenen Molekülen mit molekularen Gewichten zwischen 50 und 1000 Da entwickelt; So ist dieses Protokoll für die Extraktion von wässrigen, niedermolekularen Verbindungen optimiert. Daher eignet sich dieses Protokoll nicht für die Gewinnung hydrophobischer Metaboliten wie Lipide oder Makromoleküle wie Proteine und Nukleinsäuren. Da die Nachfrage nach umfassenden Lipidanalysen oder Lipidomics kultivierter Zellproben steigt, ist die Entwicklung eines einfachen und effektiven Protokolls zur gleichzeitigen Gewinnung von hydrophilen und hydrophobischen Metaboliten erforderlich.
Der erste Schritt der Stoffwechselextraktion — Aspirationsmedimine und Waschzellen mit Mannitol — sollte so schnell wie möglich durchgeführt werden, um Veränderungen des Stoffwechselprofils der Zellen zu minimieren. Die Behandlung von Zellen mit Methanol nach dem Waschen mit Mannitol wird angenommen, um Proteine zu dichten und so zu verhindern, dass Enzyme weitere Stoffwechselreaktionen katalysieren. Doch auch nach der Methanolbehandlung können nicht-enzymatische chemische Reaktionen — wie Redoxreaktionen, einige Dekarboxylierungsprozesse und Thiolverbindungen — stattfinden. Daher sollten alle Konzentrationen von Metaboliten, die an diesen Reaktionen beteiligt sind, die durch dieses Protokoll gemessen werden, mit Vorsicht interpretiert werden. Im Gegensatz zum Genom oder Transkriptom besteht das Metabolom aus Molekülen mit einer Vielzahl chemischer Eigenschaften; Daher kann kein einzelnes Protokoll alle Metaboliten ohne Verlust oder Störung extrahieren. Für genauere Messungen solcher hochreaktiven Metaboliten sollte ein speziell entwickeltes Protokoll konsultiert werden, um bestimmte Stoffwechselgruppen zu extrahieren, die Fraktionierungen und Derivate erfordern. Das hier vorgestellte Protokoll beschreibt jedoch eine einfache und schnelle Extraktion wässriger Metaboliten aus kultivierten Zellproben für die metabolomische Analyse von CE-MS. In diesem Beitrag konnten wir nicht beschreiben, wie man CE-MS im Detail aufstellt, weil der Fokus des vorliegenden Manuskripts anders ist, aber die Beschreibung detaillierter Schritte zur Einrichtung von CE-MS kann einen separaten, dedizierten Artikel erfordern.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir bedanken uns bei allen Mitgliedern des Shonai Regional Industry Promotion Centers für ihre Hilfe. Diese Arbeit wurde unter anderem durch Forschungsmittel der Präfektur Yamagata und der Stadt Tsuruoka, durch den Forschungs-und Entwicklungsfonds des National Cancer Center [Grant-Nummer 28-A-9] und durch die Japan Society for the Promotion of Science (JSPS) KAKENHI unterstützt. 17K07189] bis HM.
Materialien
| Name | Company | Catalog Number | Comments |
| Automated cell counter | Thermo Scientific | AMQAX1000 | Countess II automated cell counter |
| Automatic integration software | Agilent Technologies | MassHunter G3335-60041 | version B.02.00 |
| CE system | Agilent Technologies | Agilent 7100 CE system | |
| CE/MS adapter kit | Agilent Technologies | G1603A | |
| CE-ESI-MS Sprayer kit | Agilent Technologies | G1607A | |
| Cell counting chamber slide | Thermo Scientific | C10282 | Countess cell counting chamber slides |
| Centrifugal filter device, 5 kDa | Human Metabolome Technologies | ULTRAFREE MC PLHCC, UFC3LCCNB-HMT | |
| Conical sterile polypropylene tube, 15 ml | Thermo Scientific | N339651 | |
| Conical sterile polypropylene tube, 50 ml | Thermo Scientific | N339653 | |
| Costar stripette, 10 ml | Corning | 4488 | |
| Costar stripette, 5 ml | Corning | 4487 | |
| D(-)-Mannitol | Wako | 133-00845 | 500 g |
| Dulbecco's phosphate buffered saline (DPBS) | Sigma-Aldrich | D8537-500ML | |
| Electrophoresis buffer | Human Metabolome Technologies | H3301-1001 | for cation analysis |
| Electrophoresis buffer | Human Metabolome Technologies | H3302-1021 | for anion analysis |
| Fetal bovine serum | Biowest | S1780 | |
| Filter tip, 1000 μl | Watson | 124P-1000S | |
| Filter tip, 20 μl | Watson | 124P-20S | |
| Filter tip, 200 μl | Watson | 1252-703CS | |
| Fused silica capillary | Polymicro Technologies | TSP050375 | 50 μm i.d. × 80 cm total length |
| HCC827 | American Type Culture Collection | CRL-2868 | |
| Internal standard solution | Human Metabolome Technologies | H3304-1002 | |
| Isocratic pump | Agilent Technologies | Agilent 1100 Series Isocratic Pump | |
| Methanol | Wako | 138-14521 | 1 L, LC/MS grade |
| Microtube, 1.5 ml | Watson | 131-415C | |
| Operating Software | Agilent Technologies | ChemStation G2201AA | version B.03.01 for CE |
| PC-9 | RIKEN Bio Resource Center | RCB4455 | |
| RPMI-1640 | Sigma-Aldrich | R8758-500ML | |
| Sterile tissue culture dish, 100 mm | Corning | 430167 | |
| Time-of-flight mass spectrometer | Agilent Technologies | Agilent G1969A Time-of-Flight LC/MS | |
| Trypan blue solution, 0.4% | Thermo Scientific | T10282 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Ultrapure water | Merck | Milli-Q water | 18.2 MΩ·cm pure water |
| Volumetric flask, 50 ml | Iwaki | 5640FK50E | TE-32 |
Referenzen
- Lunt, S. Y., Vander Heiden, M. G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annual Review Cell and Developmental Biology. 27, 441-464 (2011).
- Soga, T. Cancer metabolism: key players in metabolic reprogramming. Cancer Science. 104 (3), 275-281 (2013).
- Zong, W. X., Rabinowitz, J. D., White, E. Mitochondria and Cancer. Molecular Cell. 61 (5), 667-676 (2016).
- Fukuda, H., et al. Experimental study for cancer diagnosis with positron-labeled fluorinated glucose analogs: [18F]-2-fluoro-2-deoxy-D-mannose: a new tracer for cancer detection. European Journal of Nuclear Meddicine and Molecular Imaging. 7 (7), 294-297 (1982).
- Miles, K. A., Williams, R. E. Warburg revisited: imaging tumour blood flow and metabolism. Cancer Imaging. 8, 81-86 (2008).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Levine, A. J., Puzio-Kuter, A. M. The control of the metabolic switch in cancers by oncogenes and tumor suppressor genes. Science. 330 (6009), 1340-1344 (2010).
- Makinoshima, H., et al. Epidermal growth factor receptor (EGFR) signaling regulates global metabolic pathways in EGFR-mutated lung adenocarcinoma. The Journal of Biological Chemistry. 289 (30), 20813-20823 (2014).
- Makinoshima, H., et al. Signaling through the Phosphatidylinositol 3-Kinase (PI3K)/Mammalian Target of Rapamycin (mTOR) Axis Is Responsible for Aerobic Glycolysis mediated by Glucose Transporter in Epidermal Growth Factor Receptor (EGFR)-mutated Lung Adenocarcinoma. The Journal of Biological Chemistry. 290 (28), 17495-17504 (2015).
- Makinoshima, H., et al. Metabolic Determinants of Sensitivity to Phosphatidylinositol 3-Kinase Pathway Inhibitor in Small-Cell Lung Carcinoma. Cancer Research. 78 (9), 2179-2190 (2018).
- Sato, Y., et al. Metabolic Characterization of Antifolate Responsiveness and Non-responsiveness in Malignant Pleural Mesothelioma Cells. Frontiers in Pharmacology. 9, 1129 (2018).
- Ohashi, Y., et al. Depiction of metabolome changes in histidine-starved Escherichia coli by CE-TOFMS. Molecular BioSystems. 4 (2), 135-147 (2008).
- Ooga, T., et al. Metabolomic anatomy of an animal model revealing homeostatic imbalances in dyslipidaemia. Molecular BioSystems. 7 (4), 1217-1223 (2011).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Patra, K. C., Hay, N. The pentose phosphate pathway and cancer. Trends in Biochemical Sciences. 39 (8), 347-354 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten