Method Article
Transplantation von chemogenetisch hergestellten kortikalen Interneureuren in frühpostnatale Maushirne
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, das entwickelt wurde, um die Aktivität kortikaler Interneureuritoren zu manipulieren, die in den Kortex von frühen postnatalen Mäusen transplantiert wurden.
Zusammenfassung
Die neuronale Entwicklung wird durch eine komplexe Kombination von Umwelt- und genetischen Faktoren reguliert. Die Beurteilung des relativen Beitrags der einzelnen Komponenten ist eine komplizierte Aufgabe, die besonders schwierig ist, wenn es um die Entwicklung von '-Aminobuttersäure (GABA)ergic cortical interneurons (CIs) geht. CIs sind die wichtigsten hemmenden Neuronen in der Großhirnrinde, und sie spielen eine Schlüsselrolle in neuronalen Netzwerken, indem sie sowohl die Aktivität einzelner pyramidaler Neuronen als auch das oszillatole Verhalten neuronaler Ensembles regulieren. Sie entstehen in transienten embryonalen Strukturen (mediale und kaudale ganglionische Eminenzen - MGE und CGE), die sehr schwer effizient mit Hilfe von Utero-Elektroporationsansätzen gezielt werden können. Interneuron-Vorläufer wandern während der normalen embryonalen Entwicklung über weite Strecken, bevor sie sich in den kortikalen Kreislauf integrieren. Diese bemerkenswerte Fähigkeit, sich zu zerstreuen und sich in ein sich entwickelndes Netzwerk zu integrieren, kann durch die Transplantation embryonaler Interneuron-Vorläufer in frühe postnatale Wirtskortika gekapert werden. Hier stellen wir ein Protokoll vor, das eine genetische Veränderung embryonaler Interneureuren-Vorläufer mittels fokaler Ex-vivo-Elektroporation ermöglicht. Diese technisch entwickelten interneuron-Vorläufer werden dann in frühe postnatale Wirtskortika transplantiert, wo sie zu leicht identifizierbaren CIs reifen. Dieses Protokoll ermöglicht die Verwendung mehrerer genetisch kodierter Werkzeuge oder die Möglichkeit, die Expression bestimmter Gene in interneuronen Vorläufern zu regulieren, um die Auswirkungen genetischer oder ökologischer Variablen auf die Reifung und Integration von CIs.
Einleitung
Die Funktion neuronaler Netzwerke beruht auf der Existenz einer ausgewogenen Ergänzung von exzitatorischen Projektionsneuronen und hemmenden Interneuronen. Obwohl kortikale Interneuronen (CIs) nur 20% aller Neuronen in den Säugetierkortika ausmachen, wird angenommen, dass Defizite in ihrer Anzahl oder Funktion eine Schlüsselrolle bei der Pathogenese neuroentwicklungsbedingten Störungen spielen1,2. Die Untersuchung der CI-Entwicklung ist eine Herausforderung, da CIs in vorübergehenden embryonalen Strukturen erzeugt werden, die schwer zugänglich sind, und sie einer langen tangentialen Migration folgen, bevor sie das Pallium erreichen und ihre reifen anatomischen und physiologischen Eigenschaften3. Sowohl genetische als auch Umweltmechanismen sind bekannt, die die CI-Entwicklung regulieren4, aber es hat sich als schwierig erwiesen, den relativen Beitrag mehrerer Faktoren zu untersuchen.
Viele Erkenntnisse in der CI-Entwicklung wurden mit In-vitro-Kultursystemen nach Isolierung von Vorläufern von den ganglionischen Eminenzen5,6gewonnen. Einer der großen Vorteile dieser Methoden ist das Potenzial, die isolierten Vorläufer zu kennzeichnen und genetisch zu modifizieren und deren Differenzierung im Detail zu verfolgen, um zellautonome Veränderungen zu erkennen. Diese Methoden sind jedoch nicht in der Lage, Informationen über die Wechselwirkungen zwischen sich entwickelnden Interneuren und einem aktiven Netzwerk zu bieten. Wir haben diese Protokolle angepasst, indem wir die modifizierten Vorläufer in den frühen postnatalen Kortex transplantiert haben. Interneuron-Vorläufer, die von embryonalen ganglionischen Eminenzen isoliert sind, sind in der Lage zu überleben, zu zerstreuen und sich bei der Transplantation in den Kortex7,8in das Wirtsnetzwerk zu integrieren. Diese Methode wurde verwendet, um die Schwere der epileptischen Anfälle in genetischen Mausmodellen zu reduzieren, und wurde als eine mögliche neue Therapie für verschiedene neuroentwicklungsbedingten Erkrankungenvorgeschlagen 9,10. Ein früheres Protokoll beschreibt ein Verfahren zur Transduce dieser Vorläufer mit viralen Vektoren vor Transplantationen11. Das Protokoll, das wir hier beschreiben, erlaubt auch die genetische Veränderung von Interneuronen, erfordert aber nicht die Erstellung eines viralen Vektors, der nur Plasmid-DNA erfordert, was seine Flexibilität erheblich erhöht. Einige Studien berichteten Erfolg bei der Verwendung in der Utero-Elektroporation, um interneuron-Vorläufer in den kaudalen ganglienEminenzen (CGE)12genetisch zu modifizieren, aber diese Methode hat sich als sehr schwierig erwiesen, sich zu reproduzieren.
Im Abschnitt repräsentative Ergebnisse veranschaulichen wir die Verwendung dieser Methode zur Express-Designerrezeptoren ausschließlich durch Designer-Medikamente aktiviert (DREADDs13) in den transplantierten CIs, eine Methode, die wir in einer kürzlich erschienenen Publikation14verwendet haben. Wir drückten hM3D(Gq), einen technischen Rezeptor auf Basis des humanen cholinergen Rezeptors CHRM3, der die neuronale Funktion nicht beeinflusst, es sei denn, er bindet sein spezifisches Liganand-Clozapin-N-Oxid (CNO). Die CNO-Administration löst selektiv die Aktivierung von hM3D(Gq)-exemitten Zellen aus. Wir verwendeten diese Methode, um zu zeigen, dass die zellautonome und transiente Depolarisation ausreicht, um apoptose von CIs während der Entwicklung zu verhindern14. In Kombination mit verschiedenen genetisch kodierten Werkzeugen hat dieses Protokoll das Potenzial, die Genexpression nach oben oder unten zu regulieren und die Zellaktivität in verschiedenen Stadien der interneuronen Differenzierung zu visualisieren oder zu manipulieren.
Protokoll
Die Tiere wurden gemäß dem United Kingdom Animals (Scientific Procedures) Act (1986) gezüchtet und untergebracht.
HINWEIS: Für die Erzeugung des pCAGGs-hM3D(Gq)-IRES-RFP-Konstrukts wurde ein SalI-StuI-Fragment, das die hM3D(Gq)-Sequenz enthält, aus dem Plasmid 50463 (Addgene) isoliert und in den Expressionsvektor pCAGGs-RFP (Geschenk von F. Guillemot) eingefügt, der mit XhoI-EcoRV.
1. Herstellung von Maus Embryo kortikalen Scheiben
- Sterilisieren Sie Laborgeräte (z.B. Stereomikroskope) und Oberflächen (z.B. Bänke) mit einem geeigneten Waschmittellösungsmittel und 70% Ethanol (EtOH) Lösung in Wasser (H2O).
- Verwenden Sie Sezierwerkzeuge, die autoklaviert wurden, und halten Sie sie die ganze Zeit in 100% EtOH.
- Bereiten Sie drei 20 ml Aliquots mit 4% Niedriggeliertemperatur-Agarose in 1x Phosphatpufferlösung (PBS) in 50 ml-Röhrchen vor und halten Sie sie bei 55 °C.
- Opfern Sie trächtige Mäuse durch Zervixdislokation bei 13,5 oder 14,5 Tagen Der Trächtigkeit (Embryonaltag E13.5-E14.5).
- Mit einer Sezierschere den Bauch der trächtigen Mäuse öffnen, die Gebärmutterhörner (mit den Embryonen) entfernen und in eiskalte Krebslösung (Tabelle 1) in eine 90 mm Petrischale geben.
- Mit einem Paar geraden Student Feine Zange, öffnen Sie die Fruchtwassersäcke, entfernen Sie die Embryonen und übertragen Sie sie in frischen eiskalten Krebs-Lösung, in einer neuen 90 mm Petrischale. Sezieren Sie das Gehirn des Maus-Embryos (Vorhirn, Mittelhirn, Hinterhirn) vom Rest des Embryokörpers.
- Halten Sie die sezierten Gehirne aus dem Hinterhirn, übertragen Sie sie in eiskalter Krebs-Lösung in einer neuen 90 mm Petrischale und halten Sie sie auf Eis.
- Mit einem wasserdichten Stift, zeichnen Sie eine gerade Linie an der Außenfläche, in der Mitte des unteren Teils von sechs 35 mm Petri-Schalen.
- Legen Sie eine 4% niedriggegelende Agarose/PBS 20 ml aliquot bei 37 °C für 5 min. Unmittelbar danach arm 10 ml in zwei 35 mm Petrischalen und betten Sie die sezierten Gehirne ein.
HINWEIS: Die olfaktorischen Glühbirnen sollten nach unten zeigen (unten in der Petrischale). 3-4 Gehirne pro Petrischale einbetten, richten Sie sie in der geraden Linie aus, die zuvor gezeichnet wurde. Lassen Sie 3 x 5 mm Abstand zwischen jedem zwei Gehirne. - Wiederholen Sie die Schritte 1.8 und 1.9, bis alle sezierten Gehirne eingebettet sind.
- Stellen Sie die eingebetteten Gehirne auf 4 °C, damit sich die Agarose verfestigt, und schnitzen Sie die drei Gehirne anschließend in einen einzigen Block mit entsprechender Größe und Ausrichtung.
HINWEIS: Lassen Sie ca. 3 mm an den Rändern der Hirnproben. Ändern Sie die Ausrichtung des Gehirns, mit den olfaktorischen Glühbirnen auf der Oberseite. - Kleben Sie den Block auf der Oberfläche einer Mikrotom-Basis und mit einer chirurgischen Klinge geschnitten den ganzen Boden des Blocks, zwischen jedem zwei Gehirne, um 3 unabhängige Blöcke zu erstellen (jeder Mini-Block enthält ein Gehirn).
- Schneiden Sie die Blöcke in eiskalter Krebslösung in 250 m dicke Scheiben mit einem vibrierenden Klingenmikrotom.
- Mit einem gebogenen flachen Mikrospachtel sammeln nur die Scheiben, die die mediale oder kaudale ganglien Eminenzen (MGE oder CGE; Abbildung 1) und übertragen Sie sie einzeln auf Filtermembranen (13 m Durchmesser, 8,0 m Porengröße), schwebend auf minimalem essentiellen Medium (MEM, Tabelle 1) in Polystyrol-Mittelbrunnen-Orgelkultur-Gerichten (60 mm x 15 mm).
- Die Gerichte in einen CO2-Gewebekultur-Inkubator, bei 37 °C, für 1 h legen und für die fokale Elektroporation vorbereiten.
2. Akute Gehirnscheibe Elektroporation
- Vor Beginn des Elektroporationsverfahrens 50 ml 1% Agarosegel in einer 100 mm Petrischale zubereiten. Lassen Sie das Agarose-Gel bei Raumtemperatur (RT) ca. 30 min erstarren.
- Kleine Agarosesäulen (1 mm Durchmesser und 10 mm Länge), die mit einer Glaspipette (225 mm Länge; 2 ml Fassungsvermögen) gestanzt und in eiskalten Krebs-Lösungen übertragen werden, bereiten.
HINWEIS: An der Pipette wird eine Gummi-Tropfenlampe befestigt, die für 2 ml Pipetten geeignet ist, und durch Drücken kann die Säule von der Glaspipette zur Krebs-Lösung freigegeben werden. - Mit einer chirurgischen Klinge, schneiden Sie kleine Agarose Blöcke von zwei Größen: eine kleine, die auf die Oberfläche der Elektrode passen (siehe unten) und eine größere, die als Basis für die Durchführung der fokalen DNA-Injektionen in die Gehirnscheiben verwendet werden. Übertragen Sie die Agarose-Blöcke auch in eiskalte Krebs-Lösung.
- Bereiten Sie den Aufbau für die Fokalinjektionen und die akute Elektroporation vor (Abbildung 2).
HINWEIS: Für die Injektionen wird folgende Ausrüstung benötigt: 1) ein Hellfeld-Sezier-Stereomikroskop, 2) ein pneumatischer Pico-Pumpen-Injektor, 3) ein Mikromanipulator, 4) ein magnetischer Ständer und 5) eine Stahlgrundplatte. Für die akute Scheibenelektroporation wird folgende Ausrüstung benötigt: 1) eine quadratische Platin 10 mm Petrischalenelektrode, 2) eine quadratische Platin 10 mm Deckelektrode, 3) ein Mikromanipulator und 4) ein Elektroporator. -
Fokale DNA-Injektionen
- Bereiten Sie eine DNA-Mischung von Expressionsvektoren vor: pCAGGs-IRES-GFP (Kontrollvektor) + pCAGGs-hM3D(Gq)-IRES-RFP, bei einer Konzentration von 1 g/l für jeden Vektor und fügen Sie eine schnelle grüne Lösung (Bestand 25 mg/ml) in einer Verdünnung von 1/10 hinzu.
- Füllen Sie eine gezogene Glasmikropipette (0,5 mm Innendurchmesser und 1 mm Außendurchmesser) mit 10 l des DNA-Gemischs und injizieren Sie kleine Mengen (im Bereich 25-50 nL) in den ausgewählten Bereich (MGE/CGE) der Scheibe (Abbildung1 und Abbildung 2).
-
Akute Elektroporation
HINWEIS: Die Elektroporation sollte unmittelbar nach der fokalen DNA-Injektion durchgeführt werden.- Legen Sie den kleinen Agaroseblock auf die Petrischalenelektrode und befestigen Sie die Agarosesäule mit Hilfe einer flachen Mikrospachtel an der mobilen Deckelektrode.
- Übertragen Sie die Scheibe mit ihrer unterstützenden Membran auf den Agaroseblock und legen Sie die obere Elektrode mit der Agarosesäule auf die ausgewählte Region (MGE/CGE) der Scheibe.
HINWEIS: Ladespannungen von 125 V (zwei Impulse von je 5 ms, Intervall 500 ms) ergeben eine erfolgreiche Elektroporation (Abbildung 3).
- Nach der Elektroporation die Scheibe mit ihrer unterstützenden Membran in die Schale geben und die Schale in einem CO2-Gewebekultur-Inkubator bei 37 °C übertragen.
- Nach 1 h, tauschen Sie das MEM-Medium gegen ein grundlegendes Medium, das für primäre neuronale Kulturen geeignet ist (Neuron-Basismedium; Tabelle 1) und inkubieren Sie die Scheiben über Nacht, für ca. 18-24 h.
3. Herstellung von Zelltransplantaten
- Überprüfen Sie die Effizienz der Elektroporation in allen Scheiben. Wählen Sie nur die Slices aus, in denen eine akzeptable Anzahl von Fluoreszenzzellen beobachtet wird (Abbildung 3).
HINWEIS: Elektroporate ca. 30 Scheiben/pro Experiment, um die entsprechende Anzahl von Zellen für die Transplantation zu erhalten (siehe unten). - Sezieren Sie die ausgewählte Region (MGE/CGE) aus jeder Scheibe und schneiden Sie das Gewebe in eiskalte Krebs-Lösung unter einem fluoreszierenden Dissektions-Stereomikroskop in kleine Stücke.
- In der Zwischenzeit legen Sie ein 1,5 ml-Rohr mit 900 l Neuron-Grundmedium in ein Wasserbad bei 37 °C.
- Übertragen Sie die Gewebestücke mit einem P1000 Mikropipettor in ein 1,5 ml-Rohr, das 500 l L15/DNase-Medium enthält, das durch Zugabe von 100 l von 1 mg/ml DNase-Bestand in DMEM/F12-Medium in 900 l L15 Medium hergestellt wird. Waschen Sie die Gewebeteile durch Tippen.
- Fügen Sie 100 l DNase (Lager 1 mg/ml in DMEM/F12 medium) in das 900-L-Neuron-Grundmedium ein.
- Entsorgen Sie das Medium L15/DNase und setzen Sie die in Schritt 3.5 hergestellten Gewebeteile in 200 L Neuron Basic/DNase Medium wieder ab.
- Stellen Sie einen P200-Mikropipettor auf 180 l und distanzieren Sie die Gewebeteile mechanisch, indem Sie 20-30-mal sanft nach oben und unten pfeifen, bis eine glatte und "cremige" Suspension erhalten ist.
- Fügen Sie 200 L Neuron Basic/DNase Medium (Endvolumen 400 l) hinzu und suspendieren.
- Nehmen Sie ein 4 L Aliquot von Zellen, verdünnen Sie richtig und montieren Sie auf einem Hämozytometer.
- Überprüfen Sie unter einem Lichtfeldmikroskop die Effizienz der Dissoziation und zählen Sie die Anzahl der Zellen.
HINWEIS: Wenn die Dissoziation erfolgreich ist, werden helle (lebendige) Einzelzellen und keine Zellaggregate beobachtet. - Zentrifugenzellsuspension ab Schritt 3.8, bei 1.000 U/min, bei RT, für 5 min, und anschließend den Überstand aus dem Rohr entfernen und das entsprechende L15/DNase-Medium (in der Regel 5-7 l) hinzufügen, so dass die Endkonzentration der Zellen 8 x 105-1,2 x 10 6 beträgt. Zellen/L.
HINWEIS: Während der Resuspension ist es extrem wichtig, Luftblasen zu vermeiden. - Legen Sie die Zelle aliquot auf Eis und haben zusätzliche L15/DNase Medium für die Injektionen.
4. Intrakranielle Injektionen
HINWEIS: Die folgenden Verfahren finden in einem Verfahrensraum innerhalb der Tierhauseinrichtung statt. Da die Zellen direkt in das Gehirn von neugeborenen Welpen injiziert werden, ohne das Gehirn freizulegen, werden aseptische Bedingungen gehalten, indem der Arbeitsraum mit 70% EtOH-Lösung sterilisiert und autoklavierte Glasnadeln verwendet werden. Für die intrakraniellen Injektionen wird folgendes benötigt: 1) ein helles Feld-Sezier-Stereomikroskop, 2) ein Mikroinjektor und 3) ein Heizpad für die Mausrückgewinnung.
- Bereiten Sie eine Glasnadel vor, indem Sie Nadeln gemäß den Empfehlungen des Herstellers ziehen. In diesem Protokoll werden Glasnadeln mit einem Außendurchmesser von 80 m, einem Innendurchmesser von 40 m und einer 30°-Abschrägung verwendet.
HINWEIS: Wie oben erwähnt, sollten Nadeln vor der Verwendung autoklaviert werden. - Die Nadel mit einer 30 G, 2 Zoll Nadel und einer Spritze manuell mit biologisch inertem Öl verfüllen.
- Montieren und setzen Sie die Nadel gemäß den Anweisungen des Herstellers an die Injektoreinheit ein.
- Bestimmen Sie die Injektionseinstellungen bei maximalem Volumen (69 nL) und einer relativ langsamen Rate (23 nL/s).
- Entleeren Sie die Nadel, bis der Kolben vollständig verlängert ist.
-
Füllen Sie die Nadel.
- Schneiden Sie ein kleines Stück von einem Pfropfband und legen Sie es unter ein helles Feld-Sezieren Stereo-Mikroskop. Mit einer P10-Mikropipette 5 l von der Probe (Zell-Aliquot) auf das Band übertragen, so dass ein kugelförmiger Tropfen gebildet wird.
- Legen Sie die Spitze der Nadel in die Probe und füllen Sie die Nadel (der Kolben zieht sich zurück und zieht die Probe mit).
HINWEIS: Da die Probe recht zähflüssig sein sollte, füllen Sie die Nadel in kleinen Schritten, damit die Probe ausglich, und mit einer langsamen Rate, die verhindert, dass sich Blasen bilden. Die Probe sollte in der Nadel glatt und homogen sein. Wenn die Probe zu zähflüssig ist und es nicht möglich ist, die Nadel zu füllen, fügen Sie so viel L15/DNase Medium hinzu, wie erforderlich ist, um die richtige Viskosität zu erhalten. Dies wird jedoch die Konzentration der Probe verändern und sollte idealerweise vermieden werden.
- Anästhetisieren Sie neugeborene Welpen (postnataler Tag 0-2 [P0-P2]) auf Eis für 2-5 min.
HINWEIS: Stellen Sie sicher, dass sich der Welpen nicht bewegt. - Platzieren Sie den anästhesierten Welpen unter das helle Feld-Sezier-Stereomikroskop.
- Führen Sie 3-4 Injektionen von je 69 nL in jeder Hemisphäre durch.
HINWEIS: Die Injektionsstellen befinden sich ca. 1 mm seitlich zur Mittellinie und zwischen 1 mm kaudal bis bregma und 1 mm rostral zur interauralen Linie. Die Spitze der Nadel sollte ca. 1 mm tief auf die Pialoberfläche gelegt werden. Nach jeder Injektion wird die Nadel ca. 30 s an Ort und Stelle gelassen und in Zeiträumen zurückgezogen. - Legen Sie den Welpen unmittelbar nach der Einspritzung auf ein Heizkissen mit der Heizung auf der niedrigsten Einstellung (37 °C). Wenn der Welpen sich erholt, überträgt er ihn mit seiner Mutter in den Käfig.
HINWEIS: Lassen Sie die Mutter niemals ohne Welpen im Käfig. Das gesamte Verfahren (vom Entfernen des Welpen aus seinen Wurfmatten, bis es zurückgegeben wird) sollte weniger als 10 min dauern.
5. Clozapin-N-Oxid-Injektionen
- Bereiten Sie die DREADD Ligand, CNO-Lagerlösung durch Verdünnung von 1 mg CNO in 50 l Dimethylsulfoxid (DMSO) vor, bis die Lösung durchscheinend ist. Aufladen auf 10 ml mit Kochsaline, so dass die endendgültige CNO-Konzentration 0,1 mg/ml beträgt.
HINWEIS: DMSO ist giftig. Vermeiden Sie es mit einer Konzentration von mehr als 0,1%. Verwenden Sie als Kontrolle eine Salinelösung, die die gleiche DMSO-Konzentration wie die CNO-haltige Lösung enthält. - Ab dem postnatalen Tag 14 und für 3 konstitutive Tage (P14-P16) führen Sie in jeder Maus zwei intraperitoneale (I.P.) Injektionen von CNO (CNO-Konzentration: 1 mg/kg) oder 0,05% DMSO in der Saline, pro Tag, 12 h auseinander durch.
- Führen Sie am letzten Tag (P17) eine einzelne Injektion durch und opfern Sie Mäuse durch Zervixdislokation innerhalb eines Zeitfensters von 30 min-1 h.
Ergebnisse
Mit dem hier vorgestellten Verfahren haben wir getestet, ob das Überleben kortikaler Interneuroner in frühen postnatalen Stadien durch zellautonome Aktivität reguliert wird. Wir führten 3 Gehirnscheiben-Elektroporationsexperimente (12-16 Embryonen [E14,5-Embryonen] pro Experiment) mit den pCAGGs-IRES-GFP (Steuerung) und pCAGGs-hM3D(Gq)-IRES-RFP-Expressionsvektoren mit einer Konzentration von 1 g/l für jedes Konstrukt durch. In unseren Elektroporationsexperimenten ist nur ein Bruchteil (ca. 50%; Abbildung 3) der GFP+ Neuronen co-expressed hM3D(Gq) (RFP+) und damit die GFP+RFP- Population diente als interne Kontrolle für die Wirkung von DREADD Liganden. Transfizierte kortikale embryonale Interneuronen wurden mechanisch dissoziiert und die resultierende Zellsuspension (8 x 105 Zellen/L) in den Kortex von P0-P1-Wildtypmäusen eingepfropft. Wir hatten 6 Injektionen pro Gehirn durchgeführt. In jedem Experiment wurden mindestens 6 neugeborene Welpen injiziert. Die Verabreichung von CNO erhöhte selektiv die Aktivität transfizierter RFP+ Zellen, wie die Expression des aktivitätsabhängigen Proteins cFos zeigt (Abbildung 4). Die CNO-Behandlung nach dem beschriebenen Protokoll (zweimal täglich P14-P17) führte zu einem Anstieg des GfP+RFP+ im Verhältnis zu GFP+RFP-Zellen im Vergleich zum Fahrzeug (0,5% DMSO in Saline) verabreichte Littermate (Abbildung 5).
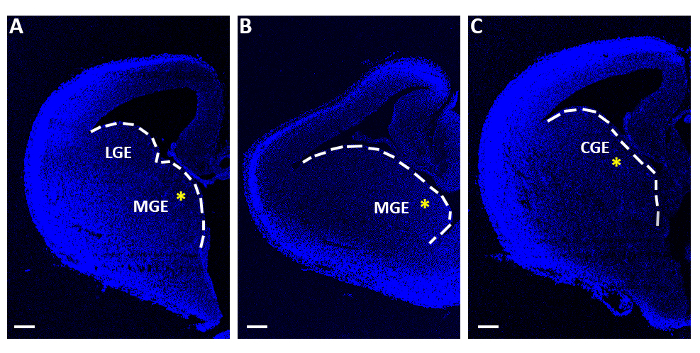
Abbildung 1: Repräsentative telenzephale Scheiben, die für akute Elektroporationsexperimente verwendet werden. (A-C) Telenzephalische Scheiben, die bei drei verschiedenen sequentiellen Rostro-Kaudal-Spiegeln erhalten werden, gefärbt mit 4,6-Diamidino-2-Phenylindole (DAPI). LGE: seitliche ganglionische Eminenz; MGE: mediale ganglionische Eminenz; CGE: kaudale ganglionische Eminenz. Skalenbalken = 200 m. Die gelben Sternchen zeigen die Elektroporationsstelle in jeder Scheibe an. Die weiße Linie markiert den Rand der ganglionischen Eminenz. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
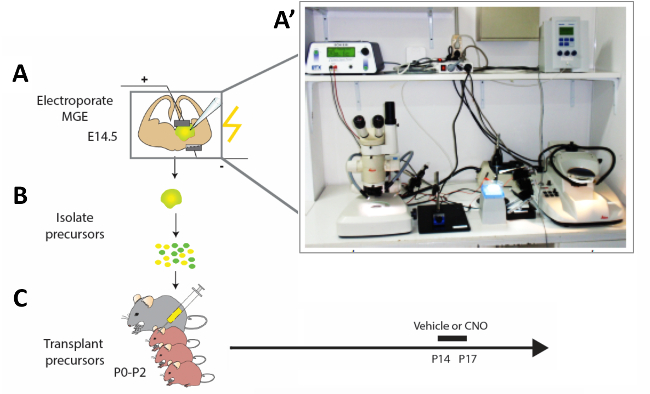
Abbildung 2: Schematische Darstellung des experimentellen Workflows. (A) Maushirnscheiben werden mit geeigneten Konstrukten elektropoiert, und (B) nach 12 h modifizierten kortikalen Interneuron (CI) Vorläuferwerden werden isoliert und (C) im Pallium von neugeborenen Mauswelpen (P0-P2) transplantiert. Um die Aktivität unreifer CIs zu verändern, wurden P14-Welpen, die Zelltransplantationen erhalten hatten, gemäß dem vorgestellten Protokoll vier konstitutive Tage lang mit CNO oder Fahrzeug injiziert. (A') Foto der akuten Maus Gehirn Scheibe Elektroporation Setup. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
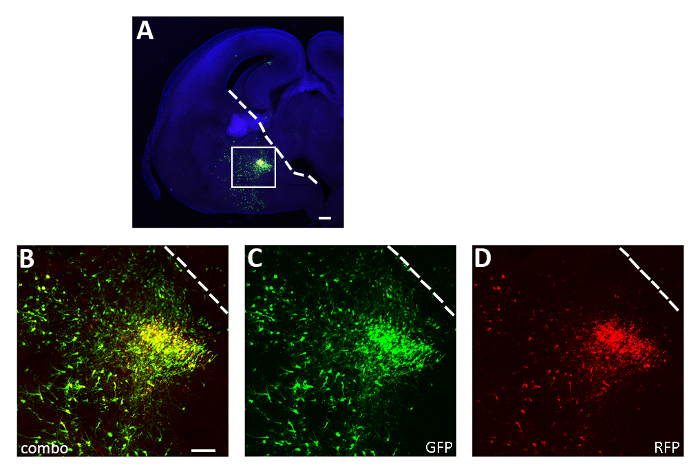
Abbildung 3: Repräsentatives erfolgreiches Experiment zur Elektroporation in akuter Scheibe. (A) Repräsentativer koronaler Abschnitt aus einem E14.5 Embryo-Gehirn, das in der CGE transfiziert wurde, mit beiden pCAGGs-IRES-GFP (GFP) und pCAGGs-hM3D(Gq)-IRES-RFP (RFP) Plasmiden und 12 h kultiviert. Der Abschnitt wurde für GFP (A, B, C) und RFP (A, B, D) immunstainiert. Der Boxbereich in Panel A wird vergrößert, um die Expression der beiden fluoreszierenden Reporter (B), GFP (C) und RFP nur (D) anzuzeigen. Die weiße Linie markiert den Rand der ganglionischen Eminenz. B-D: gleiches Foto, verschiedene Kanäle oder Kombination der beiden verschiedenen Kanäle. Skalenstäbe = 200 m (A), 100 m (B-D). Diese Zahl wurde von Denaxa et al.14geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
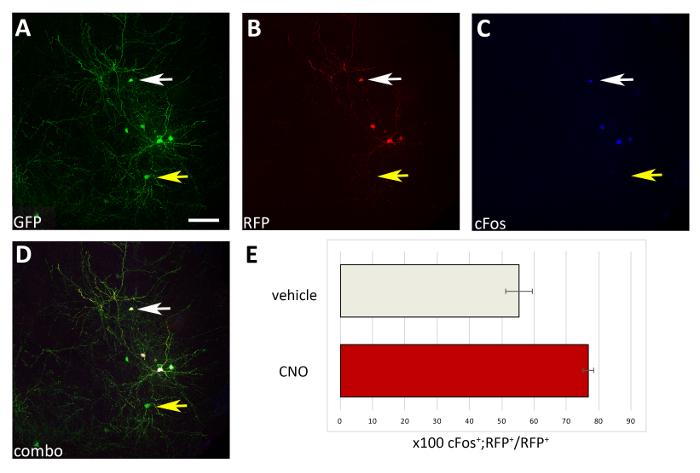
Abbildung 4: Zellautonome Zunahme der Aktivität von M3D(Gq)-exemitten transplantierten CIs nach CNO-Verabreichung. (A-D) Repräsentative konfokale Bilder eines koronalen Abschnitts einer P17-Maus, die bei P1 transplantiert wurde, mit CI-Vorläufern, die sowohl mit pCAGGs-IRES-GFP (GFP) als auch mit pCAGGs-hM3D(Gq)-IRES-RFP (RFP)-Plasmiden transfiziert und mit CNO behandelt wurden. Der Abschnitt wurde für GFP (A), RFP (B) und cFos (C) immunstainiert. (D) Das kombinierte Bild der A-, B- und C-Immunfluoreszenz (Kombination). Beachten Sie, dass nur CIs, die beide Plasmide exmitenken (weiße Pfeile in A-D), auch cFos+ im Vergleich zu CIs sind, die nur das Kontroll-GFP-Plasmid (gelbe Pfeile in A-D) exemiten. (E) Quantifizierung von cFos+RFP+ Zellen, die im Pallium von P17-Mäusen gefunden wurden, die bei P1 transplantiert (normalisiert auf die gesamte RFP+ Population) und mit Fahrzeug oder CNO behandelt wurden (N = 2). A-D: gleiches Foto, verschiedene Kanäle oder Kombination der drei verschiedenen Kanäle. Skalenbalken = 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
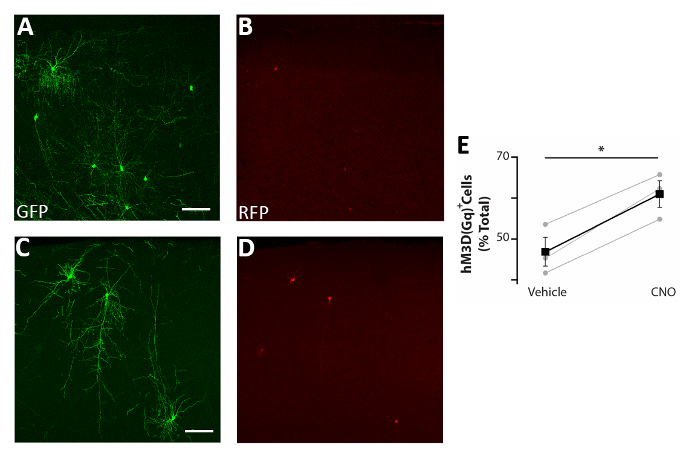
Abbildung 5: Zellautonome Erhöhung der Aktivität von CIs verbessert das Überleben . (A-D) Repräsentative konfokale Bilder von somatosensorischen Kortexkoronscheiben von P17-Mäusen, die bei P0-P2 mit CI-Vorläufern transplantiert wurden, die sowohl mit pCAGGs-IRES-GFP (GFP) als auch mit pCAGGs-hM3D(Gq)-IRES-RFP (RFP)-Plasmiden transfiziert und mit Fahrzeug (A-B) oder CNO behandelt wurden (C-D). (E) Quantifizierung von RFP+ Zellen, die im Vorderhirn von P17-Mäusen gefunden wurden, die bei P0-P2 transplantiert wurden (normalisiert auf die gesamte GFP+ Population). RFP+(Fahrzeug) = 47 % bei 3 %, CNO = 61 % bei 3 %, p = 0,01, Test der gepaarten Probe des Schülers, n = 3 Fahrzeug und 3 CNO, mindestens 150 Zellen pro Gehirn gezählt. A und B: gleiches Foto, verschiedene Kanäle. C und D: gleiches Foto, verschiedene Kanäle. Skalenbalken = 50 m. Diese Zahl wurde von Denaxa et al.14geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
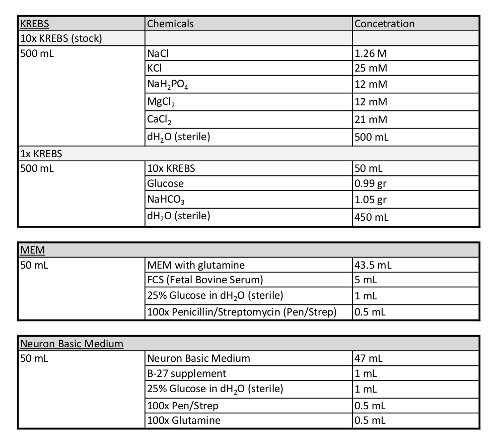
Tabelle 1: Zusätzliche Informationen zu den in diesem Protokoll verwendeten Medien.
Diskussion
Hier beschreiben wir eine allgemein zugängliche Methode zur genetischen Änderung der Aktivität von CI-Vorläufern zur Untersuchung der Auswirkungen der intrinsischen Aktivität auf die CI-Reifung und/oder die Wirkung von aktivitätsmodulierten CIs auf die Montage/Funktion des integrierten kortikalen Schaltungen.
In der Vergangenheit hatten mehrere Labore, darunter auch unsere, in Utero-Elektroporationsexperimenten durchgeführt, um Projektionsneuronen genetisch zu modifizieren6. Jedoch, in utero Elektroporation in ganglionische Eminenzen, die CI-Vorläufer enthalten ist sehr schwierig, aufgrund elektrischer Leitungsweg Probleme. Um dieses Problem zu lösen, führen eine kleine Anzahl von Laboren Ultraschall-geführte Injektionen durch, gefolgt von Elektroporation, eine anspruchsvolle Technik, die teure Geräte erfordert. Dieses Protokoll stellt eine Alternative zu diesen Methoden dar, die für die Mehrheit der wissenschaftlichen Gemeinschaft zugänglich ist.
Einer der schwierigsten Aspekte dieses Protokolls besteht darin, die Anzahl der Zellen, die im Wirtskortex überleben, auf reife Stadien zu maximieren, wenn in der Regel eine phäkotypische Analyse durchgeführt wird (sehr abhängig vom Versuchsdesign, aber in der Regel älter als P17). Es gibt drei wichtige Schritte, die der Prüfer beachten sollte: (1) Die Effizienz der Elektroporation. Dies kann maximiert werden, indem die Reinheit der DNA-Plasmide sichergestellt wird. Für dieses Verfahren sollten nur hochwertige DNA-Plasmide (ein A260/A280 Verhältnis von 1,9-2,0) verwendet werden. Wir erhalten solche hochwertigen DNA-Präparate durch Cäsiumchlorid-DNA-Reinigung. Ein weiterer entscheidender Faktor ist der Promotor, der die Expression des Gens von Interesse antreibt. Wir fanden heraus, dass der pCAGGs-Vektor, der aus dem Hähnchen-B-Actin-Promotor besteht, extrem leistungsstark ist und die Elektroporationseffizienz drastisch steigern kann. (2) Die Anzahl der beginnenden Spenderembryonen. Es ist wichtig sicherzustellen, dass eine große Anzahl (12-16) von Embryonen des gleichen Stadiums elektropoiert sind. Diese Zahl kann erhöht werden, wenn mehr Experimentatoren Embryo-Sektionen durchführen und zusammen schneiden, da es wichtig ist, dass embryonale kortikale Scheiben so schnell wie möglich erhalten, elektropoiert und an den Inkubator übertragen werden. (3) Es ist wichtig sicherzustellen, dass eine große Anzahl von Zellen in jedem Welpen injiziert wird, um eine hohe Wahrscheinlichkeit eines transplantierten Zellüberlebens bis zum Reifestadium zu gewährleisten. Darüber hinaus wird dies die Wahrscheinlichkeit erfolgreicher Transplantationen dramatisch verbessern, da Zellpräparate mit geringer Dichte zu einer ungleichmäßigen Vermischung der Zellen mit dem Medium führen, was zu einer signifikanten Variabilität in den transplantierten Gehirnen führen wird15 .
Das hier beschriebene Protokoll war auf die Untersuchung der Rolle der Aktivität bei der zellautonomen Regulierung des CI-Überlebens zugeschnitten. Das P14-P17-Zeitfenster für die Durchführung der CNO-Injektionen wurde speziell nach veröffentlichten Daten ausgewählt, die zeigen, dass der Höhepunkt des Zelltods transplantierter CI-Vorläufer während dieses Zeitraums16auftritt. Daher gilt dieser Zeitrahmen oder die Häufigkeit von CNO-Injektionen möglicherweise nicht für andere Zelltypen oder Hirnregionen, und der Prüfer sollte diese Parameter entsprechend den spezifischen versuchsspezifischen Zwecken anpassen. Schließlich ist die hier beschriebene Methode für die intrakraniellen Injektionen von CIs nur für P0-P5 Welpen möglich (abhängig auch vom Hintergrund der Mauslinie). Grundsätzlich erfordern Injektionen über P5 eine Ausdünnung oder Entfernung des Schädels15.
Einer der Hauptvorteile dieses Protokolls ist die Möglichkeit, neue genetisch codierte Tools zu verwenden, um die Aktivität von CIs in verschiedenen Phasen der Differenzierung zu visualisieren oder zu manipulieren, während sie sich in ein sich entwickelndes Netzwerk integrieren. Mit dem Tempo der Entdeckung neuer genetisch kodierter Spannungs- und Kalziumsensoren sowie neuer chemogenetischer und optogenetischer Werkzeuge ermöglicht dieses Protokoll Forschern, sie innerhalb von Wochen nach ihrer Freisetzung in Plasmid-Repositorys wie Addgene zu verwenden.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch einen ERC Starter Grant (282047), einen Wellcome Trust Investigator Award (095589/Z/11/Z), ein RP7 EC DESIRE-Stipendium und einen Lister Institute Prize an JB unterstützt. Die Arbeit im Labor von V.P. wird vom BBSRC (BB/L022974/1), dem UK Medical Research Council (MRC) und dem Francis Crick Institute (das vom MRC, Cancer Research UK und dem Wellcome Trust finanziert wird) unterstützt. Die Forschung im M.D. Labor wurde durch das Stipendium der Stavros Niarchos Foundation an die B.S.R.C. "Alexander Fleming" im Rahmen der Initiative der Stiftung zur Unterstützung der griechischen Forschung ermöglicht.
Materialien
| Name | Company | Catalog Number | Comments |
| Medium/Supplements | |||
| B-27 | GIBCO (ThermoFisher Scientific) | 175040-044 | |
| DMEM/F12 | GIBCO (ThermoFisher Scientific) | 21331-020 | |
| DNAse | SIGMA | DN15-100MG | |
| FBS | GIBCO (ThermoFisher Scientific) | 10270-098 | |
| 100x Glutamine | GIBCO (ThermoFisher Scientific) | 35050-061 | |
| L15 | GIBCO (ThermoFisher Scientific) | 11415-049 | |
| MEM alpha, GlutaMAX | GIBCO (ThermoFisher Scientific) | 32561-029 | |
| Neurobasal medium | GIBCO (ThermoFisher Scientific) | 21103-049 | Neuron basic medium |
| 100x P/S | GIBCO (ThermoFisher Scientific) | 15140-122 | |
| Equipment | |||
| Electroporator | BTX | ECM 830 generator | |
| Injector for acute slice electroporation | Eppendorf | FemtoJet Microinjector | |
| Injector for cell transplantation (I) | Visual Sonics | Vevo Injector System | |
| Injector for cell transplantation (II) | WPI | NANOLITER2010 | |
| Magnetic Stand | WPI | M10L Magnetic Stand | |
| Kite Manual Micromanipulator | WPI | KITE-M3-R | |
| Platinum Elecrode (I) | Protech International Inc. | CUY-700-1 | |
| Platinum Elecrode (II) | Protech International Inc. | CUY-700-2 | |
| Steel Base Plate | WPI | 5479 | |
| Vibratome | Leica | VT1200S | |
| Other Material | |||
| Glass capillaries for electroporation | VWR | 1B100-4 | |
| Glass capillaries for cell transplantation | Visual Sonics | provided by Visual Sonics | |
| Nuclepore 8 µm whatman membrane | SLS | 110414 | |
| Organ tissue culture dishes | BD Biosciences (Falcon) | 353037 |
Referenzen
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Review Neuroscience. 13 (2), 107-120 (2012).
- Glausier, J. R., Lewis, D. A. GABA and schizophrenia: Where we stand and where we need to go. Schizophrenia Research. 181, 2-3 (2017).
- Fishell, G., Rudy, B. Mechanisms of inhibition within the telencephalon: "where the wild things are". Annual Review Neuroscience. 34, 535-567 (2011).
- Wamsley, B., Fishell, G. Genetic and activity-dependent mechanisms underlying interneuron diversity. Nature Review Neuroscience. 18 (5), 299-309 (2017).
- Xu, Q., Cobos, I., De La Cruz, E., Rubenstein, J. L., Anderson, S. A. Origins of cortical interneuron subtypes. Journal of Neuroscience. 24 (11), 2612-2622 (2004).
- Denaxa, M., et al. Maturation-promoting activity of SATB1 in MGE-derived cortical interneurons. Cell Reports. 2 (5), 1351-1362 (2012).
- Wichterle, H., Garcia-Verdugo, J. M., Herrera, D. G., Alvarez-Buylla, A. Young neurons from medial ganglionic eminence disperse in adult and embryonic brain. Nature Neuroscience. 2 (5), 461-466 (1999).
- Alvarez-Dolado, M., et al. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. Journal of Neuroscience. 26 (28), 7380-7389 (2006).
- Baraban, S. C., et al. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proccedings of the National Academy of Sciences of the United States of America. 106 (36), 15472-15477 (2009).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Vogt, D., et al. Viral-mediated Labeling and Transplantation of Medial Ganglionic Eminence (MGE) Cells for In Vivo Studies. Journal of Visualized Experiments. (98), e52740 (2015).
- De Marco Garcia, N. V., Karayannis, T., Fishell, G. Neuronal activity is required for the development of specific cortical interneuron subtypes. Nature. 472 (7343), 351-355 (2011).
- Urban, D. J., Roth, B. L. DREADDs (designer receptors exclusively activated by designer drugs): chemogenetic tools with therapeutic utility. Annual Review of Pharmacology and Toxicology. 55, 399-417 (2015).
- Denaxa, M., et al. Modulation of Apoptosis Controls Inhibitory Interneuron Number in the Cortex. Cell Reports. 22 (7), 1710-1721 (2018).
- Quatrocolo, G., et al. Homochronic Transplatation of Interneuron Precursors into Early Postnatal Mouse Brains. Journal of Visualized Experiments. (136), e57723 (2018).
- Southwell, D. G., et al. Intrinsically determined cell death of developning cortical interneurons. Nature. 491 (7422), 103-113 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten