Method Article
A Rabbit Model of Aqueous-Deficient Dry Eye Disease Induced by Concanavalin A Injection into the Lacrimal Dlands: Application to Drug Efficacy Studies
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt die Entwicklung einer Methode, um akute oder chronische trockene Augenerkrankungen bei Kaninchen zu induzieren, indem Concanavalin A in alle Teile des Orbital-Tränendrüsensystems injiziert wird. Diese Methode, die den bereits gemeldeten überlegen ist, erzeugt ein reproduzierbares, stabiles Modell des trockenen Auges, das für die Untersuchung pharmakologischer Wirkstoffe geeignet ist.
Zusammenfassung
Trockene Augenkrankheit (DED), eine multifaktorielle entzündliche Erkrankung der Augenoberfläche, betrifft 1 von 6 Menschen weltweit mit erschütternden Auswirkungen auf die Lebensqualität und die Gesundheitskosten. Der Mangel an informativen Tiermodellen, die seine Hauptmerkmale rekapitulieren, behindert die Suche nach neuen therapeutischen Wirkstoffen für DED. Verfügbare DED-Tiermodelle weisen eine begrenzte Reproduzierbarkeit und Wirksamkeit auf. Hier wird ein Modell vorgestellt, in dem DED induziert wird, indem das Mitogen Concanavalin A (Con A) in die orbitalen Tränendrüsen von Kaninchen injiziert wird. Innovative Aspekte dieses Modells sind die Verwendung von Ultraschall (US) Anleitung, um eine optimale und reproduzierbare Injektion von Con A in die minderwertige Tränendrüse zu gewährleisten; Injektion von Con A in alle orbitalen Tränendrüsen, die die kompensatorische Produktion von Tränen einschränkt; und Verwendung von regelmäßigen Wiederholungsinjektionen von Con A, die den Zustand von DED nach Belieben verlängern. DED und seine Reaktion auf Testmittel werden mit einem Panel von Parametern überwacht, die die Tränenproduktion, die Stabilität des Tränenfilms und den Status der Hornhaut- und Bindehautschleimhaut bewerten. Dazu gehören Tränenosmolarität, Tränenbruchzeit, Schirmers Tränentest, Rosenbengalenfärbung und Tränenlactoferrin-Spiegel. Die Induktion von DED und die Überwachung seiner Parameter werden ausführlich beschrieben. Dieses Modell ist einfach, robust, reproduzierbar und informativ. Dieses Tiermodell eignet sich zur Untersuchung der Tränenphysiologie und der Pathophysiologie von DED sowie zur Beurteilung der Wirksamkeit und Sicherheit von Kandidatenstoffen für die Behandlung von DED.
Einleitung
Trockene Augenkrankheit (DED) ist eine chronische Erkrankung mit hoher Prävalenz und Morbidität1,2,3,4. Entzündung spielt eine Schlüsselrolle bei der Pathogenese5,6. Die Pathophysiologie von DED wird als Folge von Unterproduktion oder Überverdunstung von Tränen herableitend; Erstere ist auch als wässrig-mangelhafte DED7bekannt. Das Sjögren-Syndrom, eine ausgiebig untersuchte prototypische Ursache von DED, betrifft in erster Linie die Tränendrüsen (LGs) und ist ein eindrucksvolles Beispiel für ihre Bedeutung bei der Pathogenese von DED. DED wird oft mit künstlichen Tränen behandelt, die vorübergehende Linderung bieten, oder mit Cyclosporin oder Lifitegrast, die beide Augenentzündungen unterdrücken. Keine der verfügbaren Behandlungen für DED sind optimal, was die Entwicklung neuer Wirkstoffe erforderlich macht8,9.
Die Suche nach neuen therapeutischen Wirkstoffen für DED wird durch drei große Herausforderungen behindert: das Fehlen eines anerkannten medikamentösen molekularen Targets, das angesichts der pathophysiologischen Komplexität von DED schwer fassbar sein kann; die Geringverdiener vielversprechender Agenten; und das Fehlen von Tiermodellen, die die wichtigsten Merkmale von DED rekapitulieren.
Wie bei den meisten Bemühungen zur Entwicklung von Medikamenten sind informative Tiermodelle von DED ein entscheidendes Untersuchungsinstrument, ungeachtet der axiomatischen Aussage, dass kein Tiermodell eine menschliche Krankheit vollständig rekapituliert. Maus-, Ratten- und Kaninchenmodelle von DED sind die am häufigsten verwendeten, während Hunde und Primaten selten verwendet werden10,11. Die meisten der mehr als 12 Bisher gemeldeten Kaninchen-DED-Modelle versuchen, die Tränenproduktion zu reduzieren, indem sie entweder LGs entfernen oder ihre Funktion behindern12,13,14,15,16. Solche Ansätze umfassen die chirurgische Resektion der ILG; Schließung des Ausscheidungskanals; und Beeinträchtigung der LG-Funktion durch Bestrahlung oder Injektion eines der folgenden Punkte: aktivierte Lymphozyten, Mitogene, Botulinumtoxin, Atropin oder Benzalklonium. Wesentliche Einschränkungen dieser Methoden sind ihre Inkonsistenz und die häufige teilweise Unterdrückung der Tränenproduktion.
Concanavalin A (Con A), ein Lektin pflanzlichen Ursprungs, ist ein potenter Stimulator T-Zell-Subsets und wurde in experimentellen Modellen von Hepatitis17 und DED18verwendet. Das ursprüngliche Con-A-basierte Modell soll erhebliche Vorteile bieten, einschließlich seiner relativen Einfachheit; entzündlicher Zellzufluss in den LGs, die Krankheiten wie Sjogren imitieren; Stimulation der proinflammatorischen Zytokine IL-1, IL-8 und TGF-Nr. 1; reduzierte Tränenfunktion überwacht durch Messung der Rissfluorescein-Freiraum- und Reißunterbrechungszeit (TBUT); und Arzneimittelreaktion für ein entzündungshemmendes Kortikosteroid gezeigt.
Bei der Anwendung dieser vielversprechenden Methode wurden zusätzlich zu ihren Vorteilen Einschränkungen festgestellt, die eine allgemeine Überarbeitung und drastische Verbesserungen erforderten. Drei kritische Mängel der Methode sind dokumentiert. Erstens war das Modell ein akutes; der induzierte DED nach ca. 1 Woche nachgelassen. Zweitens war die Reaktion der Tiere inkonsequent. Wie sich gezeigt hat, wurde Con A bei "blinden" transkutanen Injektionen in das inferiorE LG (ILG) nur zufällig an die Zieldrüse geliefert. Detaillierte Untersuchungen der Anatomie der ILG ergaben, dass ihre Größe bis zu 4-fach19 variieren konnte, was solche Injektionen "Hit-or-Miss"-Bemühungen macht. Schließlich kompensierte das überlegene LG (SLG) auch bei der Injektion der ILG häufig den reduzierten Durchreißfluss, was das Modell problematisch machte.
Diese wesentlichen Einschränkungen wurden durch die Einführung von drei Änderungen an der Methode überwunden, wodurch ein überlegenes Tiermodell von DED generiert wurde. Zunächst wurde die Injektion von Con A in die ILG unter Ultraschall -anleitung durchgeführt, um sicherzustellen, dass Con A in die Drüse gelangte. Der Erfolg der Injektion wurde durch die Erlangung eines US-Bilds nach der Injektion bestätigt, wie in Abbildung 1dargestellt. Zweitens wurden zur Beseitigung des kompensatorischen Tränenbeitrags der SLG sowohl der palpebrale als auch der orbitale Teil dieser Drüse mit Con A injiziert. Schließlich wurde dieses akute Modell von DED durch wiederholte Injektionen von Con A alle 7-10 Tage in ein chronisches umgewandelt. DED von 2 Monaten Dauer ist leicht bei diesen Kaninchen erreicht. Der Erfolg dieses Ansatzes wurde ausführlich dokumentiert19.
Wie bereits erwähnt, besteht eine wichtige Anwendung von Tiermodellen von DED darin, die Wirksamkeit und Sicherheit von Kandidatentherapeutika zu bestimmen. Der Nutzen dieses Modells wurde durch die Studie von Phosphosulindac (OXT-328), einem neuartigen entzündungshemmenden kleinen Molekül20,21 als Augentropfen verabreicht demonstriert. Seine Wirksamkeit wurde anhand eines Panels von Parametern von DED19nachgewiesen. Die relative Einfachheit und informative Natur dieses Modells ermöglichte auch einen Vergleich von Phosphosulindac mit den beiden von der FDA zugelassenen Arzneimitteln für DED, Cyclosporin und Lifitegrast, was seine starke präklinische Überlegenheit demonstrierte.
Protokoll
Alle Tierstudien wurden vom Institutional Review Board der Stony Brook University genehmigt und in Übereinstimmung mit der ARVO-Erklärung zur Verwendung von Tieren in der Augen- und Sehforschung durchgeführt.
1. Tiere und Gehäuse
- Erwerben Sie Neuseeländische Weiße (NZW) Kaninchen mit einem Gewicht von 2-3 kg.
- Die Kaninchen sitzen in Käfigen mit strenger Temperatur (65 x 5 °F) und Luftfeuchtigkeit (45 x 5 %) Steuerung. Die Beleuchtung sollte einen 12-Stunden-Ein-/Aus-Zyklus haben.
- Bieten Sie unbegrenzten Zugang zu Wasser und Standard-Kaninchen-Chow. Beseitigen Sie Nahrungsanreicherungen, da sie Vitamin A enthalten können, das das Auge betrifft.
- Akklimatisieren Sie die Tiere für mindestens 2 Wochen vor den Ausgangsmaßnahmen oder der Induktion des trockenen Auges.
2. Methoden der Anästhesie und Euthanasie
HINWEIS: Alle Verfahren erfordern eine leichte Sedierung mit Ausnahme der Con-A-Injektion, die eine moderate Sedierung erfordert.
- Bei leichter Sedierung Acepromazin (1 mg/kg) subkutan über die Schultern mit einer 26-Spur-Nadel injizieren. Endpunkt für milde Sedierung: Tiere halten eine entspannte Kopfposition mit Ohrläppchen nicht mehr ganz aufrecht.
HINWEIS: Wenn der entsprechende Endpunkt nicht erreicht wird, kann eine zusätzliche Injektion von Acepromazin verabreicht werden. Tiere sollten immer wach bleiben, auf das Berühren ihrer Schnurrhaare reagieren und niemals eine verlangsamte Atmung zeigen. - Für eine moderate Sedierung, geben Sie zuerst die Tiere Acepromazin wie oben. Nachdem der Endpunkt erreicht ist (siehe Anmerkung oben), geben Sie Isofluran e mit einer Gasmaske mitO2-Durchfluss auf 1 L/min und Isofluran-Zulieferung auf 5%(Abbildung 2).
- Verabreichen Sie Isofluran, bis der Körperton des Kaninchens völlig entspannt ist und die Ohren völlig floppy sind.
HINWEIS: Es sollten keine kompensatorischen Muskelbewegungen auftreten, wenn das Tier auf der Seite gedreht wird; Atmung bleibt immer spontan. - Spontane Erholung tritt innerhalb von 2-5 min: Anzeichen sind spontane Kopfbewegungen und erhöhter oder normaler Muskeltonus. Nachdem das experimentelle Verfahren mit mäßiger Sedierung abgeschlossen ist, beobachten Sie die Kaninchen ca. 30 min oder bis sich ihr Verhalten wieder normalisiert.
HINWEIS: Eine ophthalmologische Salbe ist bei keiner der beiden Sedierungsformen erforderlich. 1) Bei leichter Sedierung sind die Tiere immer noch wachsam und halten einen Blinkreflex aufrecht. Bei mäßiger Sedierung ist die Hemmung des Blinkreflexes so kurz, dass die Augenoberfläche nicht gefährdet ist. 2) Die Platzierung der ophthalmologischen Salbe auf der Augenoberfläche schließt die Visualisierung von Strukturen aus, die während der Prüfung beurteilt werden. - Euthanasie: Verwenden Sie eine Überdosierung von intravenösem Pentobarbital (100 mg/kg).
3. Entfernung der nictitierenden Membran
- Führen Sie die Entfernung während der Akklimatisierungsphase (in der Regel die erste Woche) durch, um eine vollständige und genaue Bewertung der Hornhaut zu ermöglichen.
-
Injektion in die richtige nictitating Membran
HINWEIS: Wenn die nictitating Membran beider Augen entfernt werden soll, ist es am einfachsten, dies in einer Sitzung zu tun. Beginnen Sie mit einem Auge und gehen Sie wie beschrieben vor. Zur Besseren Beschreibung beginnt diese Methode mit dem rechten Auge.- Legen Sie das Kaninchen in eine entsprechend große Rückhaltetasche.
- Induzieren Sie eine leichte Sedierung, wie in Schritt 2.1 beschrieben.
- Tragen Sie 25 L konservierungsmittelfreies Lidocain mit einer Mikropipette auf das rechte Auge auf.
- Legen Sie ein flexibles Drahtdeckel-Spekulum zwischen die Augenlider.
- Mit 0,3 Zangen (oder gleichwertig), greifen Sie die nictitating Membran an ihrer Spitze und verlängern Sie sie über die Hornhaut.
- Injizieren Sie Lidocain 1% mit 1:100.000 Adrenalin subkonjunkt in die Basis der nictitierenden Membran mit einer 26-Spur scharfen Nadel (Abbildung 3A). Über der nictitierenden Membran sollte sich eine moderate Blessur bilden.
- Entfernen Sie das Spekulum.
- Führen Sie eine identische Injektion mit der linken nictitierenden Membran durch.
-
Schneiden der nictitating Membran
- Nach ca. 5 min den Deckel wieder ins rechte Auge legen. Greifen und ziehen Sie die nictitating Membran an ihrer Spitze mit 0,3 Zangen (oder ähnlich) zurück.
- Schneiden Sie die nictitating Membran an ihrer Basis mit Westcott Schere oder gleichwertig (Abbildung 3B).
HINWEIS: Blutungen sind minimal und erfordern in der Regel keine Kautery. Dennoch wird eine Hochtemperatur-Batteriekauter immer in der Nähe gehalten, falls zusätzliche Hämostase benötigt wird. - Entfernen Sie das Spekulum.
- Topische Antibiotikasalbe auf das Auge legen (z. B. Neomycin, Polymyxin, Bacitracin und Hydrocortison).
- Lassen Sie die Hardersche Drüse intakt. Die Hardersche Drüse wird manchmal gesehen, wenn die nictitating Membran zurückgezogen wird.
HINWEIS: Wenn eine große weiße Masse oder Gewebehöhe im nasalen oder oberen subkonjunktivalen Bereich nach dem Entfernen der nictitierenden Membran beobachtet wird, wurde die Membran zu nah an ihrer Basis resektiert, so dass die Hardersche Drüse spontan vorzeichnet. Um dies in nachfolgenden Verfahren zu verhindern, lassen Sie mehr von der nictitating Membran an der Basis. - Lassen Sie die Augenoberfläche mindestens 1 Woche heilen, bevor weitere Manipulationen vorgenommen oder Augenoberflächentests durchgeführt werden.
4. Messung der Parameter des trockenen Auges und Entnahme von Reißproben
ANMERKUNG: Messen Sie DED-Parameter basierend auf den Anforderungen des Studienprotokolls (z. B. zu Basisplänen und danach angegebenen Zeitpunkten). Messungen für DED sollten in der folgenden Reihenfolge durchgeführt werden, mit strengem Aufwand, um sie jedes Mal treu zu replizieren. Testen Sie alle Tiere ungefähr zur gleichen Tageszeit (ca. 1 h), um zirkadiane Schwankungen zu minimieren. Diese Messungen erfordern in der Regel ein Team von zwei Ermittlern.
- Legen Sie das Kaninchen in eine Rückhaltetasche. Induzieren Sie eine leichte Sedierung.
- Tränenosmolarität22
- Blinzeln Sie die Augenlider 5-10 Mal, um die Tränenschicht gleichmäßig auf der Augenoberfläche zu verteilen.
- Ziehen Sie den unteren Deckel vorsichtig ein.
- Probenrisse mit dem TearLab Osmometer an der Kreuzung der palpebralen und bulbaren Bindehaut entlang des unteren Fornix, nur hinter der Basis der abgeschnittenen Nictitating-Membran.
- Messen Sie die Osmolarität mit dem TearLab Osmolarity Test gemäß den Anweisungen des Herstellers.
- Tear Break-up-Zeit (TBUT)
- Verdunkeln Sie den Raum für diesen Test.
- Legen Sie einen Drahtdeckel speculum zwischen die Augenlider.
- Mit einer Mikropipette wird ein 50-L-Tropfen von 0,2 % Fluorescein über die Hornhautoberfläche auftragen. Wenn auch die Verteilung des Fluoresceins über die Hornhaut nicht mit dem ersten Tropfen erreicht wird, legen Sie einen zweiten Tropfen.
- Starten Sie sofort einen Timer.
- Beobachten Sie den präkornealen Tränenfilm unter blauem Licht. Die TBUT ist definiert als die Zeit, die für die Entwicklung schwarzer Punkte, Linien oder einer offensichtlichen Störung des Fluoresceinfilms aufgedauert wird (Abbildung 4). Verwenden Sie bei Bedarf chirurgische Lupen, die eine Vergrößerung von +1,50 bieten, um frühe Anzeichen eines Auseinanderbrechens besser zu visualisieren. Monitor für bis zu 1 min; Wenn die hier definierte Aufspaltung nach 1 min erfolgt, nehmen Sie TBUT nur für 60 s auf.
- Schirmers Tränentest (STT)
- Tragen Sie einen 25-L-Tropfen konservierungsmittelfreies Lidocain auf die Augenoberfläche auf.
- Legen Sie einen Weck-Zell-Operationsspeer in den unteren Fornix, um Restlidocain und jede Tränenflüssigkeit zu absorbieren. Verwenden Sie bei Bedarf das untere Augenlid, um das proximale Ende des Schwamms zu bedecken, um ihn an Ort und Stelle zu halten (Abbildung 5A).
- Nach ca. 30 s den Weck-Schwamm entfernen.
- Sofort einen Schirmer-Tränenteststreifen in den Raum zwischen der Hornhaut und der palpebralen Bindehaut in der Mitte des unteren Deckels einlegen.
- Starten Sie sofort einen Timer (Abbildung 5B).
- Nach 5 min, messen Sie die Länge des befeuchteten Teils des Streifens; Dies ist der STT-Wert.
- Führen Sie Measures in dreifacher Ausführung durch und melden Sie den Durchschnitt der 3 Messwerte als STT-Wert.
- Sammlung von Tränenproben
- Um Reißproben für die Aufnahme von Verschiedenen Analyten wie Lactoferrin zu sammeln, nachdem der STT-Wert bei 5 min aufgezeichnet wurde, lassen Sie den Streifen an Ort und Stelle, bis eine Benetzung von mindestens 20 mm erreicht ist.
HINWEIS: Wenn eine ausreichende Benetzung nicht auftritt, nachdem DED induziert wurde, rücken Sie den Streifen tiefer in den unteren Fornix, um diesen Endpunkt in angemessener Zeit zu erreichen. - Schneiden Sie den befeuchteten Streifen und legen Sie sofort in 490 L gekühlten Tear Collection Buffer (4% BSA, 1M NaCl, 0.1% Tween-20 in PBS mit Proteinase-Hemmer-Cocktail).
- Bewahren Sie die Proben auf Eis auf, bis sie bei -80 °C gelagert werden können, wo sie bis zum Test bleiben sollten.
- Um Reißproben für die Aufnahme von Verschiedenen Analyten wie Lactoferrin zu sammeln, nachdem der STT-Wert bei 5 min aufgezeichnet wurde, lassen Sie den Streifen an Ort und Stelle, bis eine Benetzung von mindestens 20 mm erreicht ist.
- Rose Bengal Färbung (RBS)
- Mit einer Mikropipette 50 l 1% konservierungsmittelfreies Lidocain auf die Hornhaut auftragen.
- Nach 30 s, legen Sie 25 l von 1% Rose Bengal auf der Augenoberfläche und manuell blinken das Augenlid, um es gleichmäßig zu verteilen.
- Starten Sie sofort einen Timer.
- Legen Sie bei 3,5 min einen Drahtdeckel spekulum zwischen die Deckel.
- Mit 4,0 min die überlegene Bindehaut- und Hornhautoberfläche fotografieren (Abbildung 6).
HINWEIS: Stellen Sie sich an den verwendeten Kameratyp ein. Typische Einstellungen: digitale Spiegelreflexkamera mit nur einem Objektiv, Öffnungsprioritätsmodus (Blende 13 oder höher), ISO 6000, 100 mm Makroobjektiv mit zwei 12,5-mm-Verlängerungsröhren, manueller Fokusmodus, Objektiv bei maximaler Vergrößerung und Beleuchtung vom Makro-/Ringblitz auf automatisch mit Durchlichtmodus eingestellt. Die Fokuslampe des Ringblitzes wird eingeschaltet, um die Hornhaut zu fokussieren. - Vervollständige alle Fotos für beide Augen innerhalb von 1 min.
- Partitur Okulare Oberflächenfärbung mit der NEI-Methode23 wie folgtmodifiziert. Klasse 6 keine separaten Bindehautzonen. Erzielen Sie die überlegene Bindehaut jedes Auges. Dies ist der Teil der Bindehautoberfläche, der leicht fotografiert werden kann, ohne den Globus zu manipulieren. Manipulation könnte die Färbung der Augenoberfläche artefakt verändern.
- Tränenlactoferrin-Spiegel sind ein Ersatzmaß für die Tränenproduktion aus den Tränendrüsen. Assay-Tränen Lactoferrin in Tränen gesammelt wie oben mit einem Enzym-gebundenen Immunosorbent Assay24 Kit nach den Anweisungen des Herstellers.
5. Induktion und Behandlung von trockenem Auge
HINWEIS: Drei Teile des Orbital-Tränendrüsensystems werden injiziert.
- Die Kaninchen mit Acepromazin 0,2 mg/kg subkutan besontieren.
- Das Fell im periorbitalen und Kopfhautbereich abscheren und alle Restfelle mit Nair vollständig entfernen. Lassen Sie die Haut völlig glatt für eine bessere Visualisierung der anatomischen Kennzeichen und US-geführte Injektion von Concanavalin A (Abbildung 7).
- Induzieren Sie eine moderate Sedierung, wie oben beschrieben.
- Injektion des palpebralen Teils der überlegenen Tränendrüse (PSLG)
HINWEIS: Führen Sie zuerst die Injektion von PSLG durch.- Auf das entsprechende Auge 25 l konservierungsfreies Lidocain 1% mit einer Mikropipette auftragen.
- Immer das obere Augenlid und wenden Sie sanften medialen Druck auf den hinteren Orbitalrand an, bis die Protuberanz, die den palpebralen Teil der Drüse markiert, zu sehen ist. Die PSLG erscheint als kleine bauchige Höhe im hinteren (zeitlichen) Teil des oberen Deckels.
ANMERKUNG: Um das Drüsengewebe während des Lernprozesses anzuzeigen, wenden Sie 5% Fluorescein auf den Bereich an (Abbildung 8A). Tränen können von der bauchigen PSLG gestreamt werden. Die Anwendung von Fluorescein ist für die Verabreichung von Con A nicht erforderlich; es wird nur zu Illustrationszwecken getan, um das Drüsengewebe zu zeigen. - Mit feinverzahnten Zangen und einer 27-Spur-Nadel auf einer Tuberkulinspritze, dringen Sie direkt in die Drüse mit einem transkonjunktivalen Ansatz ein. Fördern Sie die Nadel 2 mm in das Gewebe und injizieren Sie 500 g Con A in einem Volumen von 0,1 ml (Abbildung 8B).
HINWEIS: Diese Injektion kann manchmal schmerzhaft sein. Halten Sie die Tiere bei Bedarf unter Isofluran, bis diese Injektion abgeschlossen ist.
- Injektion der Orbital-Superior-Tränendrüse (OSLG)
HINWEIS: OSLG folgt in rascher Folge.- Wenden Sie medialen Druck auf den Globus an, wodurch die OSLG aus der hinteren Inzisur herausragt (sieheRef. 25 für Anatomie, falls erforderlich). Wenden Sie medialen Druck auf den Globus an (Abbildung 9, roter Pfeil) mit der Protuberance der OSLG von der hinteren Inziversicherung. Die Protuberanz dient als grobe Lokalisierung, um die hintere Inziation zu finden.
- Verwenden Sie gekrümmte Zangen mit Spitzen geschlossen, um den Bereich einzurücken, bis die knöcherne Öffnung im Schädel gefühlt wird. Dies wird schlitzartig mit einer vorderen/hinteren Richtung unter der Protuberanz sein.
- Wenden Sie bescheidenen Druck mit Zangen an, um einen Einzug in der Haut zu hinterlassen, der als Meilenstein für die Nadelplatzierung dienen wird (Abbildung 10A).
- Legen Sie eine Nadel (Tuberkulinspritze mit einer 27-Spur, 5/8-Zoll-Nadel) senkrecht zur Haut über die Einzugsmarke(Abbildung 10B) 1/4 Zoll in die Inzisur, dann umleiten Sie die Nadel nach und nach in Richtung der seitlichen Canthus zielt auf den Mittelpunkt zwischen der Injektionsstelle und knöcherne mareals.
HINWEIS: Wenn die Inziversicherung nicht genau mit der Nadel gezielt ist, blockiert der Schädel seinen Fortschritt. - Sobald die Nabe der Nadel erreicht ist, injizieren Sie langsam 1000 g Con A in ein Volumen von 0,2 ml(Abbildung 10C).
- Schließen Sie die Injektion der PSLG und OSLG innerhalb von 2-3 min ab.
- Entfernen Sie das Tier von der Isofluran-Sedierung (falls noch nicht geschehen). Die Injektion der minderwertigen Tränendrüse (ILG) kann in der Regel ohne weitere Sedierung durchgeführt werden.
- Injektion der minderwertigen Tränendrüse
- Sehen Sie das Tier von der Seite. Die Prominenz der ILG ist entlang des unteren vorderen Teils der Umlaufbahn zu sehen (Abbildung 11A).
- Zeichnen Sie eine vertikale Linie mit einem chirurgischen Markierungsstift oder einem geeigneten permanenten Marker auf der Haut, wo der oberflächliche Teil der ILG-Drüse von seiner oberflächlichen (externeren) Ruhestätte auf dem zygomatischen Knochen zu seiner medialen Position im Orbit übergeht. Dies ist in der Regel schlechter als der vordere Limbus (Abbildung 11A).
- Identifizieren Sie das Ende des zygomatischen Knochens, indem Sie die vertikal gehaltene US-Sonde über diese Linie auf der Haut fegen. Der ILG-Übergang tritt dort auf, wo sich das Bild der Drüse von klar umschrieben (hyperechoische Linie des zygomatischen Knochens ist entlang der unteren Randkante der Drüse im Bild zu sehen) zu einem Bild ohne erkennbare mediale Grenze (das zygomatische Knochenecho ist nicht mehr vorhanden, Abbildung 1).
- Beobachten Sie die relative Position des Handstücks zur auf der Haut gezeichneten Linie, wenn der US-Bildschirm diese Änderung anzeigt. Dies ist die "Injektionsstelle", an der Con A verabreicht werden sollte.
- Kontrollieren Sie die Injektionstiefe, um Con A an einem Punkt, der nur medial zum zygomatischen Bogenknochen ist, in die Drüse zu legen.
- Bestimmen Sie die Injektionstiefe wie folgt: Stellen Sie die gewünschte Injektionstiefe als Tiefe des zygomatischen Knochens (hyperechoisches Signal) plus 1 mm ein. Subtrahieren Sie diesen Wert von der bekannten Nadellänge (in diesem Beispiel 15 mm).
- Setzen Sie die Nadel an der "Injektionsstelle" 12 mm in die Drüse ein und ziehen Sie sie dann langsam zurück, bis die Länge der freiliegenden Nadel außerhalb des Körpers (gemessen mit chirurgischen Sätteln) der differenzierten Differenz entspricht, die in 5.8.6 berechnet wird (Abbildung 12). Injizieren Sie 1000 g Con A in 0,2 ml.
HINWEIS: Um sicherzustellen, dass die Kapsel der Drüse durchbohrt und nicht einfach von der Nadel geschoben wird, sollte die Nadel 12 mm oder fast an die Nabe eingeführt werden, bevor ihre Entnahme beginnt. - Wiederholen Sie die USA, um den Erfolg der Injektion zu bestätigen. Die ILG sollte einen charakteristischen hypoechoischen Raum aufweisen (Abbildung 1).
HINWEIS: Die ILG-Injektion ist diejenige, die von den Tieren am besten vertragen wird26 und wird daher zuletzt durchgeführt.
- Schließen Sie den gesamten Vorgang ab, um alle Drüsen beider Augen innerhalb von 10 min zu injizieren. Dies erfordert die Erzielung einer Kompetenz im Verfahren.
HINWEIS: Ein einziger Satz von Injektionen in die 2 orbitalen Tränendrüsen wird akute DED induzieren, die 1-2 Wochen dauert. - Für DED von längerer Dauer, injizieren Con A genau wie oben alle 7 Tage. Bis zu 6 solcher Injektionen wurden erfolgreich durchgeführt.
6. Betreuung nach dem Eingriff
- Überwachen Sie nach der Injektion von Con A die Tiere in ihren Rückhaltebeuteln mindestens 10-20 min oder bis die anästhetische Wirkung abgenutzt ist.
- Lassen Sie die Tiere nicht unbeaufsichtigt, bis sie genügend Bewusstsein wiedererlangt haben, um die Brustbeschisse aufrechtzuerhalten. Bringen Sie sie nicht in ihre einzelnen Käfige zurück, bis sie vollständig geborgen sind.
- Nach dem Eingriff Schmerzen sind in der Regel mild und dauert weniger als 48 h. Bewerten Sie Schmerzen mit dem Kaninchen Grimassenskala. Geben Sie bei Bedarf eine Einzeldosis subkutanen Ketolac (5 mg/kg). Für schwerere Schmerzen geben Sie subkutanes Buprenorphin 0,1 mg/kg alle 8 h.
Ergebnisse
Con-A-Injektionen induzierten eine starke Entzündungsreaktion in den Tränendrüsen, die durch ein dichtes lymphozytisches Infiltrat gekennzeichnet waren (Abbildung 13), begleitet von einer verringerten Tränenproduktion. Alle Reißparameter wurden deutlich geändert (Tabelle 1 und Tabelle 2). Darüber hinaus wurden Tränenlactoferrin-Spiegel unterdrückt (Kontrolle = 3,1 x 0,45 vs. Injizierte Con A = 2,7-0,02 ng/mg-Protein (Mittelwert SEM); p<0,03). Das Endergebnis war ein kompromittiertes Hornhaut- und Bindehautepithel, das durch erhöhte rosabengalische Färbung belegt wird (Abbildung 6).
Die Injektion der drei Orbital-LG-Gewebe erzeugte einen konsistenten und einheitlichen DED-Zustand im Gegensatz zu den Zuständen, die mit früheren Methoden18,27erreicht wurden. Zu diesem Ergebnis trugen wesentlich die US-geführte Injektion der ILG und die Injektion der OSLG bei. Tabelle 1 fasst die wichtigsten Ergebnisse dieser Methode zusammen. Alle Änderungen stimmen mit dem strengen DED überein.
Ein einziger Satz Con A Injektionen produziert DED von etwa 1 Woche; alle klinischen Parameter normalisieren sich nach Tag 10 (Tabelle 2). Sequenzielle Con-A-Injektionen im Abstand von etwa 1 Woche verlängern die Dauer von DED entsprechend. Zum Beispiel, der zweite Satz von Con A Injektionen an Tag 7 hält DED für 2 Wochen und so weiter. Nach ca. 5 Injektionssätzen wird der DED-Zustand oft dauerhaft, ohne dass weitere Injektionen erforderlich sind.
Als die Kaninchen mit Con A-induziertem DED mit dem neuartigen Wirkstoff Phosphosulindac behandelt wurden, unterdrückte es die Krankheit deutlich. Zum Beispiel hat die TBUT nach einer Woche Behandlung mit diesem Mittel im Vergleich zu fahrzeugbehandelten Tieren deutlich zugenommen (43,6 x 4,0 vs. 12,2,8 s; p<0,001; Mittelwert sem bzw. sem für diese und die folgenden Werte), während die Tränenosmolarität normalisiert wurde (294 x 4,6 vs. 311 x 2,0 mOsm/L, p<0,002). Mechanistisch verringerte Phosphosulindac die Konzentrationen von zwei entscheidenden Interleukins, IL-1, (8,4,1,2 vs. 21,2,6,6 pg/mg-Protein; p<0,03) und IL-8 (4,9-1,7 vs. 13,5,0 pg/mg-Protein; p<0,05)19.
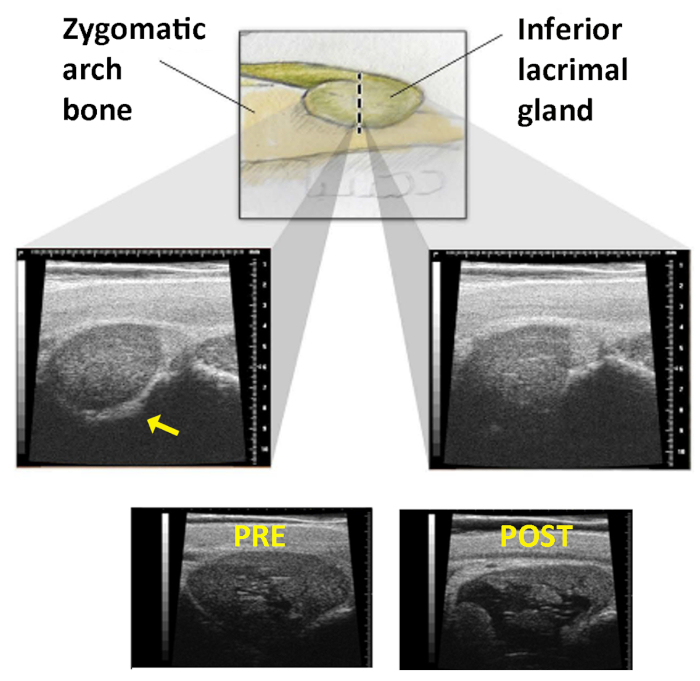
Abbildung 1: Ultraschallbild der minderwertigen Tränendrüse. Oberes Panel: Die ILG, während sie sich tiefer im Orbit bewegt, um unter dem zygomatischen Bogen zu liegen. Die gestrichelte Linie stellt die Linie auf der Haut dar, über die die US-Sonde gefegt wird. Mittlere Panels: Während das Handstück über diese Linie gefegt wird, sucht der Prüfer nach dem Verlust des zygomatischen Knochenechos, das im linken Bild (Pfeil) vorhanden ist und im rechten Bild verschwindet. Untere Panels: Bilder der ILG, die vor(links) und nach(rechts) Injektion von Con A aufgenommen wurden. Die Entwicklung eines großen zystischen Raumes innerhalb der Drüse bestätigt die ordnungsgemäße Lieferung. Nachdruck mit Genehmigung19. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Gasmaskensedation. Dieses Foto zeigt die Gasmaske, die eine kurze moderate Sedierung mit Isoflurane bietet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
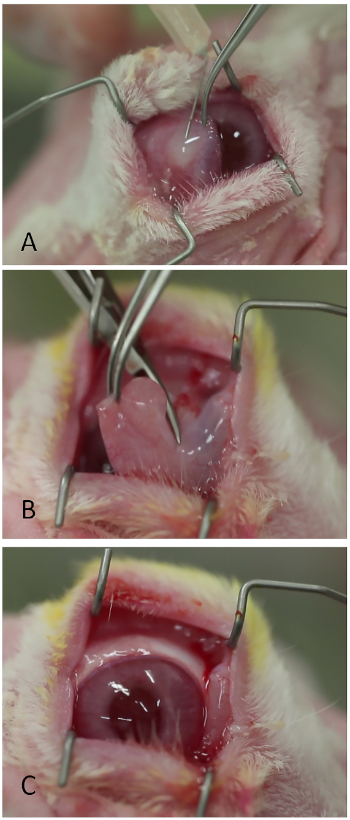
Abbildung 3: Entfernung der nictitierenden Membran. (A) Injektion von Lidocain/Epinephrin. (B) Abschneiden der nictitating Membran an ihrer Basis mit Westcott-Schere. (C) Die Augenoberfläche wird nach entfernung der nictitierenden Membran leichter visualisiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
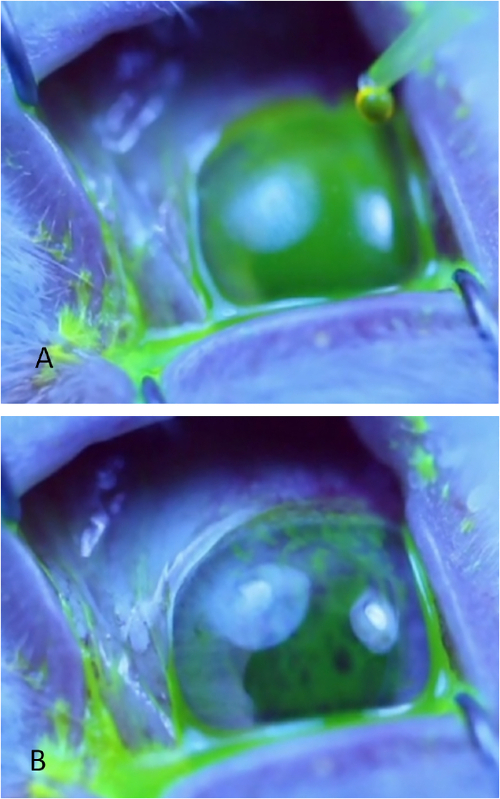
Abbildung 4: Messung der Zerreißzeit. (A) Einheitliches grünes Tränenfilmbild der Hornhautoberfläche unter blauem Licht unmittelbar nach Anwendung von Fluoresceintropfen. (B) Hornhautoberfläche, die bereits durch mehrere dunkle Kreise und lineare Streifen im Fluorescein gekennzeichnet ist. Die Aufspaltungszeit wird aufgezeichnet, sobald sich der erste dunkle Fleck oder die erste Dunkle Linie entwickelt. Die beiden hellblauen Kreise sind Reflexionen der Lichtquelle aus der Hornhaut. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
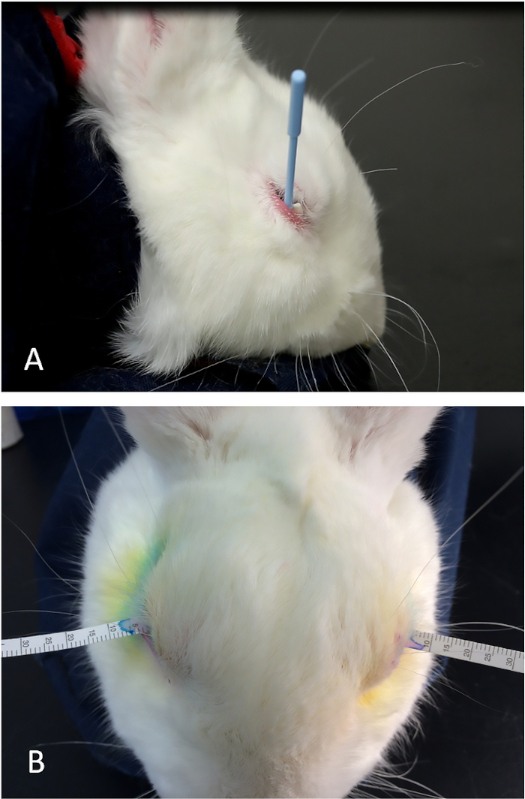
Abbildung 5: Schirmers Reißtest. (A) Die richtige Platzierung des Weck-Cel-Schwamms im unteren Fornix, um alle restliche topische Lidocainlösung und Grundrisse zu entfernen. Indem man den hinteren Rand des dreieckigen Schwamms unter den unteren Deckelrand legt, kann man eine sehr gleichmäßige Technik beibehalten, um die Augenoberfläche vor der Platzierung der Reißstreifen zu trocknen. (B) Ein Reißband, der in der Mittleren Position des unteren Deckels zwischen dem Globus und dem unteren Deckel (palpebrale Bindehaut) angebracht ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Rosenbengalen Färbung. Obere: Fotografien der Hornhautoberfläche. Links: Vor der Behandlung mit Con A ist keine rosabengalische Färbung vorhanden. Rechts: Diffuse Hornhaut- und Bindehautfärbung ist im oberen Nasenquadranten nach der Injektion (oben rechts) zu sehen. Unter: Konjunktive Abformzytologie aus der überlegenen Bulbarkonjunktiva. Links: Vor der Behandlung sind zahlreiche Kelchenzellen vorhanden. Rechts: Epithelzellen sind vorhanden, aber Kelchenzellen fehlen nach der Behandlung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Zubereitung von Kaninchen für Concanavalin-A-Injektionen. (A) Kleine Scheren werden verwendet, um Fell zu entfernen, so dass eine einfachere Visualisierung von Landmarken, um die Orbital überlegene Tränendrüse zu identifizieren. (B) Nair wird verwendet, um Haare zu entfernen, die nach dem Scheren zurückbleiben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
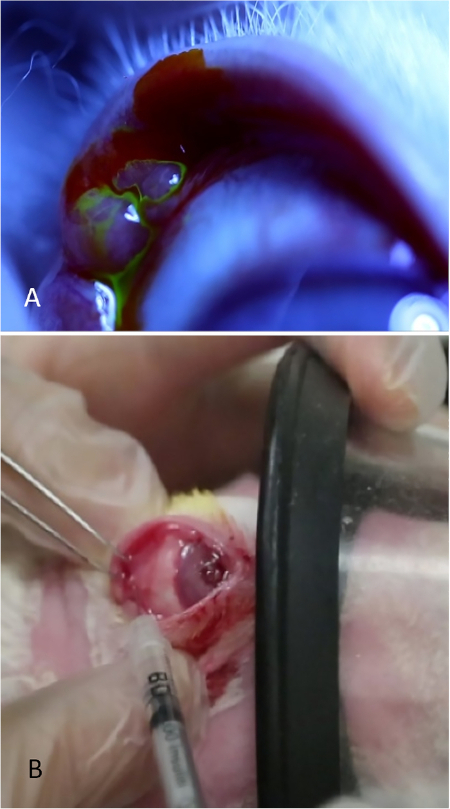
Abbildung 8: Injektion der palpebralen Tränendrüse. (A) Die palpebrale Tränendrüse, die als bauchige Erhebung im hinteren zeitlichen Teil des oberen Deckels erscheint. Tränen werden von der Oberfläche dieser Drüse nach dem Auftragen eines Tropfens von 2% Fluorescein strömen gesehen. (B) Die palpebrale Tränendrüse wird injiziert, während das Kaninchen eine moderate Sedierung erhält. Ein Ermittler zieht das Augenlid zurück, optimiert die Exposition der Drüse und sichert die Maske, während der zweite Prüfer die Drüse injiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 9: Lokalisierung der orbitalen oberen Tränendrüse. Veränderungen der Hautkonturen zeigen die Position der OSLG an, während sie durch die hintere Inziation ragt. Der abwechselnde mediale Druck auf den Globus(großer Pfeil)bewirkt, dass die überlegene Orbitaldrüse verfällt, was als eine kleine Höhe in der Haut angesehen wird. Diese Höhe wird jedes Mal größer, wenn der Druck ausgeübt wird (kleine Pfeile). Die Lage dieser Drüse ist in der Regel im Einklang mit dem hinteren Orbitalrand. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
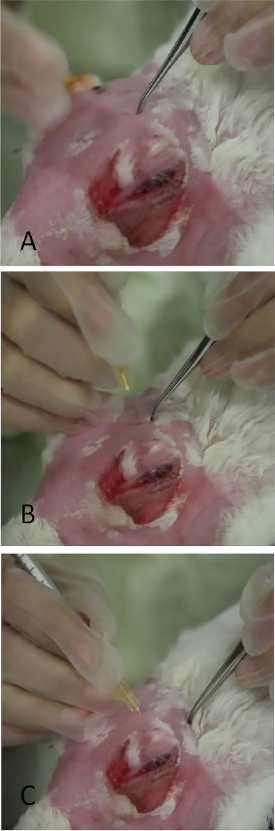
Abbildung 10: Injektion der orbitalen überlegenen Tränendrüse. (A) Anwendung des sanften Drucks auf den Schädel mit feinverzahnten Zangen in dem Bereich, der wie in Abbildung 9vorlief. Eine dünne, schlitzartige Öffnung im Schädel kann palpatiert werden. Das Verlassen einer kleinen Einzugsmarke mit den Zangen trägt erheblich zur Platzierung der Nadel während der Injektion bei. (B) Die Nadel wird senkrecht durch die Inziversicherung eingeführt. Bei falscher Stellung wird sein Durchgang durch den knöchernen Schädel gestoppt. (C) Die Nadel befindet sich in der Endposition zum seitlichen Canthus gewinkelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
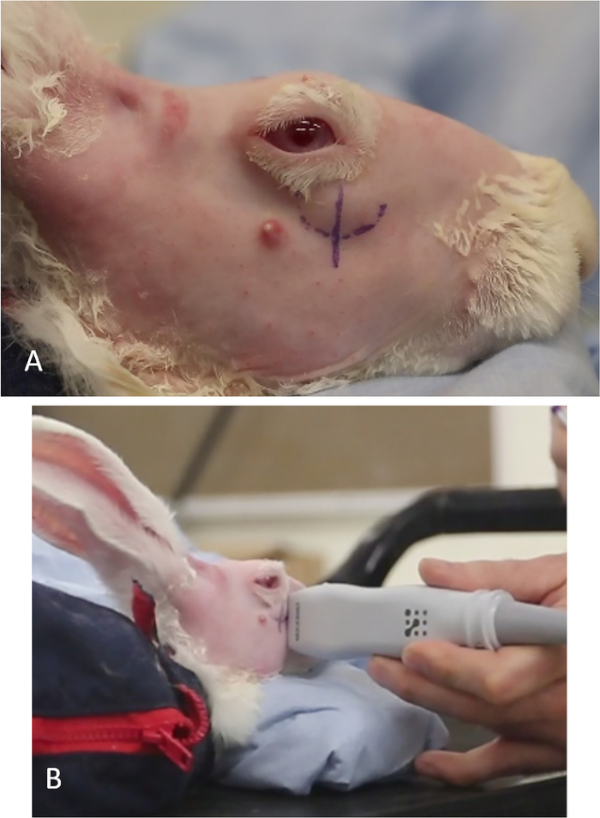
Abbildung 11: Lokalisierung der minderwertigen Tränendrüse. (A) Die Prominenz des oberflächlichen Teils der ILG, der durch den unteren Deckel gesehen wird. Die kurvenlineare Stiftmarke bezeichnet die untere Position der Drüse. Die vertikale Linie unter dem Nasenlimbus bezeichnet die ungefähre Position, an der die ILG in eine tiefere Position innerhalb der Umlaufbahn übergeht und als visuelle Referenz für die USA dient. (B) US-Handstück, das über den Bereich der vertikalen Linie fegt; Der US-Monitor zeigt an, wo der zygomatische Knochen endet, wo die ILG übergeht und wo die Con-A-Injektion verabreicht werden sollte ("Injektionsstelle"). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
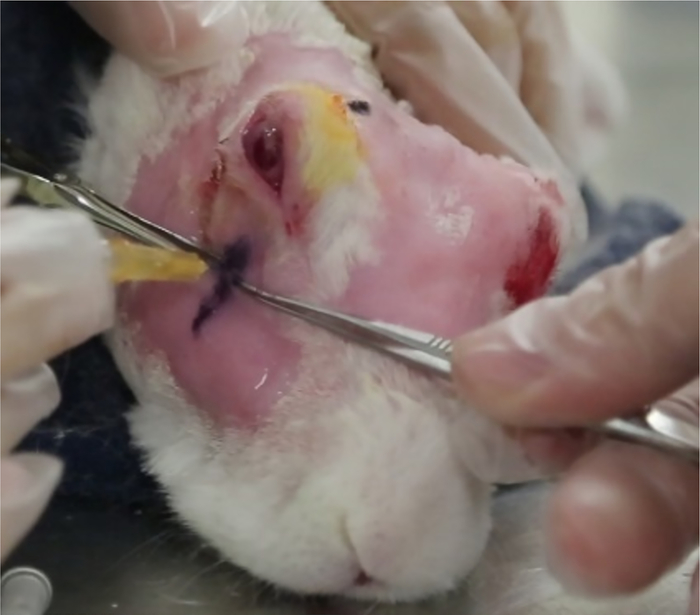
Abbildung 12: Injektion der minderwertigen Tränendrüse. Die Injektion der ILG erfolgt an dem von den USA identifizierten Ort. Die Injektionstiefe wird wie im Text beschrieben berechnet (Schritt 5.8.6). Die Kaliber (gesehen hinter der Nadel) sorgen dafür, dass die Nadel vor der Injektion in die richtige Tiefe gelegt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
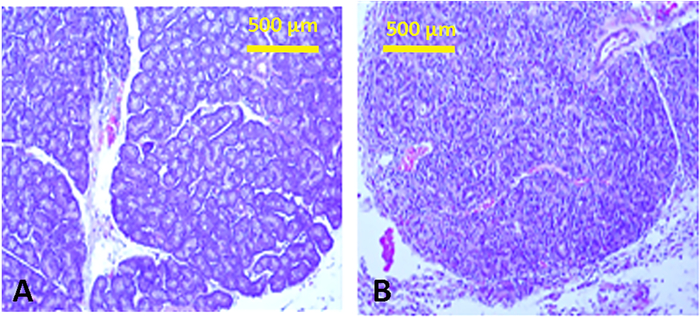
Abbildung 13: Histologie der Tränendrüsen. Gewebeabschnitte einer normalen minderwertigen Tränendrüse mit typischer Tubulo-Alveolar-Struktur (A) und anschließender Injektion von Con A (B), die ein ausgeprägtes lymphozytisches Infiltrat mit Auswirkung der Struktur zeigen. Ähnliche entzündliche Infiltrate sind in den überlegenen Tränendrüsen zu beobachten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Injektionsmethode | TBUT, sek | Tränenosmolalität, Osm/L | STT, mm | |||
| Basislinie | NachderInjektion | Basislinie | NachderInjektion | Basislinie | NachderInjektion | |
| Mittelwert - SEM, Veränderung in % | ||||||
| ILG ohne US-Führung | 58,5 x 1,5 | 44,5 x 7,7 | 297 € 4,9 | 300 x 3,8 | 15,2 x 0,9 | 12,9 € 2,2 |
| %Änderung | -23% | 1% | -15% | |||
| p=0,05 | p=0,36 | p=0,21 | ||||
| US-geführte ILG + PSLG | 59,4 x 0,6 | 11,4 x 4,2 | 296 € 4,7 | 326 bei 3,7 | 15,1 x 1,3 | 10,7 x 1,8 |
| Veränderung in % | -81% | 10% | -29% | |||
| p<0,0001 | p<0,0001 | p<0,03 | ||||
| US-geführte ILG + PSLG + OSLG | 60 x 0,0 | 6,2 x 1,3 | 299 € 2,9 | 309 € 2,8 | 14,6 x 0,9 | 9,9 x 1,3 |
| Veränderung in % | -90% | 3% | -32% | |||
| p<0,0001 | p<0,008 | p<0,002 | ||||
| Alle Werte wurden am 6. Tag nach einer einzigen Injektion von Con A in die aufgeführten Drüsen gemessen. Alle Vergleiche wurden nach Baseline durchgeführt. *ILG, minderwertige Tränendrüse; PSLG, palpebrale Portion der überlegenen Tränendrüse; OSLG, orbitaler Teil der überlegenen Tränendrüse; USA, Ultraschall. | ||||||
Tabelle 1: Wirkung der Injektionstechnik und Anzahl der Injektionsstellen auf die Schwere des trockenen Auges.
| Basislinie | Tag 6 | Tag 13 | Tag 21 | |
| 1 Injektion | 2 Injektionen | 3 Injektionen | ||
| TBUT, sek | 58,5 x 1,5 | 44,5 x 7,7 | 29,2 x 7,8 | 12,8 x 3,9 |
| Veränderung in % | -24% | -50% | -78% | |
| p=0,17 | p=0,001 | p<0,0001 | ||
| TOsm, Osm/L | 297 € 4,9 | 300 x 3,9 | 308 x 4,9 | 313 € 2,7 |
| Veränderung in % | 1% | 4% | 5% | |
| p=0,36 | p=0,04 | p=0,003 | ||
| STT, mm | 15,2 x 0,9 | 9,3 x 1,6 | 12,9 x 1,6 | 7,4 x 1,1 |
| Veränderung in % | -39% | -15% | -51% | |
| p=0,17 | p=0,13 | p=0,008 | ||
| Es wurden Vergleiche mit der Ausgangsbasis angestellt. | ||||
Tabelle 2: Wirkung wiederholter Con-A-Injektionen in ILG auf die Dauer von DED.
Diskussion
Kaninchen sind sehr attraktiv für das Studium von DED. Ihre Hornhaut und Bindehaut haben eine Oberfläche näher an der des Menschen im Vergleich zu Mäusen und Ratten; ihre Ergänzung von medikamentösen metabolisierenden Enzymen wie Esterasen und Histologie ihrer Tränendrüsen ähneln denen des Menschen, und ihre Augen sind groß genug für informative pharmakokinetische Studien. Im Vergleich zu Schweinen und Affen, mit denen sie ähnliche Eigenschaften teilen, kosten sie weniger und ihre experimentelle Manipulation ist einfacher. Wenn mechanistische Studien in Betracht gezogen werden, besteht ein relativer Nachteil des Kaninchens im Vergleich zu Mäusen darin, dass weniger Reagenzien (z. B. monoklonale Antikörper) zur Verfügung stehen. Auf der anderen Seite ist das Kaninchen Mäusen für pharmakokinetische und Bioverteilungsstudien weit überlegen, da einzelne Gewebe leicht seziert werden und von ausreichender Größe für analytische Arbeiten sind, wodurch "Probenpooling" vermieden wird.
Ein kritischer allgemeiner Parameter ist die Akklimatisierungszeit der Kaninchen. Die Tiere werden vom Verkäufer unter Bedingungen verschifft, die oft keine Transportumgebung mit der entsprechenden Temperatur oder Luftfeuchtigkeit gewährleisten. Einige Tiere haben bei der Ankunft möglicherweise bereits ein trockenes Auge entwickelt. Eine zweiwöchige Eingewöhnungszeit wird empfohlen. Ebenso wichtig ist die sorgfältige Aufmerksamkeit auf die Feuchtigkeit und Temperatur des Raumes, in dem die Studienkaninchen im Vivarium untergebracht sind. Abweichungen in beiden Zustand können große Schwankungen in ihrem Augenstatus verursachen. Haben Sie Luftbefeuchter und Luftentfeuchter zur Hand. Wenn das zentralsystem ausfällt, handeln Sie schnell, um die Umgebungsfeuchtigkeit mit dem Back-up-Gerät wiederherzustellen. Denken Sie daran, dass solche unglücklichen Entwicklungen in den Sommermonaten häufiger auftreten. Die drei wichtigsten Schritte zur erfolgreichen Induktion von DED bei Kaninchen sind jedoch: 1) die geschickte Verwendung von US-Bildgebung, um die ILG zu identifizieren und die Injektion von Con A zu lenken und zu bestätigen; 2) Sicherstellung der Injektion sowohl der ILG als auch der beiden Teile der SLG; und 3) zuverlässig und reproduzierbar die Parameter von DED zu bestimmen.
Die Entwicklung der erforderlichen experimentellen Fähigkeiten ist nicht trivial, sollte aber keinen ernsthaften Prüfer abschrecken. Erwarten Sie, dass die Lernkurve innerhalb von fünf Iterationen abgeschlossen wird. Ein US-Bildgebungssystem von angemessener Qualität ist unerlässlich. Die Anerkennung anatomischer Kennzeichen durch die USA ist wichtig, daher sollte der Forscher die Anatomie des Kaninchens überprüfen. Die ausgezeichnete Beschreibung der Kaninchenanatomie von Davis25, einem Klassiker, kann immens hilfreich sein. Beachten Sie auch die Unterschiedliche in der Größe der ILG. Daraus folgt, dass der Erfolg von Con A immer mit Follow-up-Bildgebung bestätigt werden muss. Variationen in der Reaktion auf Con A in einer Gruppe von Kaninchen ist am häufigsten auf die Injektionstechnik (erfolglose oder teilweise erfolgreiche Injektion) oder auf das Ignorieren der Fähigkeit von Rest-Tränendrüsengeweben, durch Überproduktion von Rissen zu kompensieren. Für diejenigen, die die Injektionstechnik beherrschen möchten, kann die Injektion von Methylenblau gefolgt von einer prompten anatomischen Zerlegung hilfreich sein; Visualisierung wird erreicht, wenn sie die Tränendrüse erreicht oder auf benachbarte Gewebe verschüttet wird. Bis heute wurde diese Injektionsmethode über 270 Mal von den Autoren ohne eine einzige Komplikation durchgeführt.
Die oben vorgestellten fünf Parameter von DED zu bestimmen, kann ebenso schwierig sein wie ihre Bestimmung in der klinischen Praxis. Obwohl zirkadiane Variationen noch nicht formal in einer von ihnen dokumentiert wurden, gibt es genügend Hintergrundbeweise für solche Phänomene im Auge28, dass sie zur gleichen Tageszeit untersucht werden sollten (ca. 1 h), vor allem, wenn wiederholte Tests durchgeführt und miteinander verglichen werden sollen. Die Konsistenz bei der Durchführung dieser Assays ist von wesentlicher Bedeutung. Ein zweier Team ist erforderlich. Vier oder mehr Ermittler im selben Raum, die an den Tests teilnehmen, können störend sein, da einige Schritte ein strenges Timing erfordern. Eine angemessene und qualitativ hochwertige fotografische Dokumentation, sofern angegeben, ist wichtig.
Dieses Modell eignet sich ideal für Studien zur Arzneimittelentwicklung. Die Beherrschung des Tiermodells und der Assay-Techniken sorgten für eine hervorragende Reproduzierbarkeit19 von Wirksamkeits- und Sicherheitsstudien.
Dies ist ein leistungsstarker experimenteller Ansatz, weil er die verwirrende Variabilität früherer Modelle eliminiert, das Tiermodell rationalisiert und im Wesentlichen standardisiert die fünf Parameter von DED ermittelt. Die erfolgreiche Anwendung dieses Modells auf die Untersuchung eines kandidaten therapeutischen Wirkstoffs hat seinen praktischen Nutzen als informatives Tiermodell für eine Krankheit bestätigt, die dringend neue Wirkstoffe und ein tieferes Verständnis ihrer Pathogenese braucht.
Offenlegungen
Die Autoren erklären keine konkurrierenden Interessen außer BR, die eine Beteiligung an Medicon Pharmaceuticals, Inc. und Apis Therapeutics, LLC hat; und LH, ein Mitarbeiter von Medicon Pharmaceuticals, Inc. mit einer Beteiligung an Apis Therapeutics, LLC.
Danksagungen
Alle Tierversuche wurden in Übereinstimmung mit allen einschlägigen regulatorischen und institutionellen Richtlinien abgeschlossen. Alle Studien wurden vom Institutional Review Board der Stony Brook University genehmigt und in Übereinstimmung mit der ARVO-Erklärung für den Einsatz von Tieren in der Augen- und Sehforschung durchgeführt.
Diese Studien wurden teilweise durch ein Targeted Research Opportunities Stipendium der Stony Brook University School of Medicine (Grant Number 1149271-1-82502) und ein Forschungsstipendium von Medicon Pharmaceuticals, Inc., Setauket, NY, unterstützt. Die Autoren danken Michele McTernan für die redaktionelle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 mm macro lens | Canon EF 100mm f/2.8L IS USM | 3554B002 | |
| 26 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305115 | Needles for injecting ConA into the lacrimal glands |
| 27 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305921 | Needles for injecting ConA into the lacrimal glands |
| Aceproinj (acepromazine) | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| Anesthesia vaporizer | VetEquip, Pleasanton, CA | Item #911103 | |
| Bishop Harmon Forceps | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Tissue forceps |
| Caliper | Bausch and Lomb (Storz), Bridgewater, NJ | E-2404 | Caliper used to measure length of needle during ConA injection |
| Concanavalin A | Sigma, St. Louis, MO | C2010 | Make 5mg/ml in PBS for injection into rabbit lacrimal glands |
| DSLR camera | Canon EOS 7D DSLR | 3814B004 | Digital single lens reflex camera |
| fluorescein | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT |
| Isoflurane | Henry Schein, Melville, NY | 29405 | |
| Lactoferrin ELISA kit | MyBiosource, San Diego, CA | MBS032049 | Measure tear lactoferrin level |
| lidocaine | Sigma, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent |
| macro/ring flash | Canon Macro Ring Lite MR-14EXII | 9389B002AA | |
| Osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity |
| PBS (phosphate buffered saline) | Mediatech, Inc. Manassas, VA | 21-031-CV | |
| Rabbit, New Zealand White or Dutch Belted (as described in text) | Charles River Labs, Waltham, MA | 2-3 kg | Research animals |
| Rose Bengal | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, stain the ocular surface |
| Schirmer strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production |
| Surgical Loupes +1.50 | Designs for Vision, Bohemia, NY | Specialty item | Provide magnificantion of ocular surface while observing tear break up and performing Concanavalin A injections. |
| TearLab Osmometer | TearLab Corp., San Diego, CA | Model #200000W REV A | Measure tear osmolarity |
| Ultrasound probe | VisualSonics Toronto, Ont | MX 550 S | Untrasonography-guide Con A injection for inferior lacrimal gland |
Referenzen
- Paulsen, A. J., et al. Dry eye in the Beaver Dam Offspring Study: prevalence, risk factors, and health-related quality of life. American Journal of Ophthalmology. 157 (4), 799-806 (2014).
- Vehof, J., Kozareva, D., Hysi, P. G., Hammond, C. J. Prevalence and risk factors of dry eye disease in a British female cohort. British Journal of Ophthalmology. 98 (12), 1712-1717 (2014).
- Tan, L. L., Morgan, P., Cai, Z. Q., Straughan, R. A. Prevalence of and risk factors for symptomatic dry eye disease in Singapore. Clinical and Experimental Optometry. 98 (1), 45-53 (2015).
- Craig, J. P., et al. TFOS DEWS II Report Executive Summary. The Ocular Surface. 15 (4), 802-812 (2017).
- Baudouin, C., et al. Clinical impact of inflammation in dry eye disease: proceedings of the ODISSEY group meeting. Acta Ophthalmologica (Copenhagen). 96 (2), 111-119 (2018).
- Calonge, M., et al. Dry eye disease as an inflammatory disorder. Ocular Immunology and Inflammation. 18 (4), 244-253 (2010).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Buckley, R. J. Assessment and management of dry eye disease. Eye (London, England). 32 (2), 200-203 (2018).
- Clayton, J. A. Dry Eye. New England Journal of Medicine. 378 (23), 2212-2223 (2018).
- Barabino, S. Animal models of dry eye. Archivos de la Sociedad Española de Oftalmología. 80 (12), 695-696 (2005).
- Stern, M. E., Pflugfelder, S. C. What We Have Learned From Animal Models of Dry Eye. International Ophthalmology Clinics. 57 (2), 109-118 (2017).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology & Visual Science. 28 (2), 225-228 (1987).
- Guo, Z., et al. Autologous lacrimal-lymphoid mixed-cell reactions induce dacryoadenitis in rabbits. Experimenal Eye Research. 71 (1), 23-31 (2000).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology & Visual Science. 49 (5), 1850-1856 (2008).
- Heymann, F., Hamesch, K., Weiskirchen, R., Tacke, F. The concanavalin A model of acute hepatitis in mice. Lab Animal. 49 (1 Suppl), 12-20 (2015).
- Nagelhout, T. J., Gamache, D. A., Roberts, L., Brady, M. T., Yanni, J. M. Preservation of tear film integrity and inhibition of corneal injury by dexamethasone in a rabbit model of lacrimal gland inflammation-induced dry eye. Journal of Ocular Pharmacology and Therapeutics. 21 (2), 139-148 (2005).
- Honkanen, R. A., Huang, L., Xie, G., Rigas, B. Phosphosulindac is efficacious in an improved concanavalin A-based rabbit model of chronic dry eye disease. Translational Research. 198, 58-72 (2018).
- Huang, L., et al. The novel phospho-non-steroidal anti-inflammatory drugs, OXT-328, MDC-22 and MDC-917, inhibit adjuvant-induced arthritis in rats. British Journal of Pharmacology. 162 (7), 1521-1533 (2011).
- Mattheolabakis, G., et al. Topically applied phospho-sulindac hydrogel is efficacious and safe in the treatment of experimental arthritis in rats. Pharmaceutical Research. 30 (6), 1471-1482 (2013).
- Osmalek, T., Froelich, A., Tasarek, S. Application of gellan gum in pharmacy and medicine. International Journal of Pharmaceutics. 466 (1-2), 328-340 (2014).
- Lemp, M. A. Report of the National Eye Institute/Industry workshop on Clinical Trials in Dry Eyes. Contact Lens Association of Ophthalmologists Journal. 21 (4), 221-232 (1995).
- Dal Piaz, F., Braca, A., Belisario, M. A., De Tommasi, N. Thioredoxin system modulation by plant and fungal secondary metabolites. Current Medicinal Chemistry. 17 (5), 479-494 (2010).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, 402-441 (1929).
- Lima, L., Lange, R. R., Turner-Giannico, A., Montiani-Ferreira, F. Evaluation of standardized endodontic paper point tear test in New Zealand white rabbits and comparison between corneal sensitivity followed tear tests. Veterinary Ophthalmology. 18 (Suppl 1), 119-124 (2015).
- Zheng, W., et al. Therapeutic efficacy of fibroblast growth factor 10 in a rabbit model of dry eye. Mol Med Report. 12 (5), 7344-7350 (2015).
- Wiechmann, A. F., Summers, J. A. Circadian rhythms in the eye: the physiological significance of melatonin receptors in ocular tissues. Progress in Retinal and Eye Research. 27 (2), 137-160 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten