Method Article
Eine kostengünstige Geruchs-Belohnungs-Assoziationsaufgabe für Lern- und Gedächtnistests
In diesem Artikel
Zusammenfassung
Eine assoziative Geruchs-Belohnungs-Lernaufgabe wurde verwendet, um die unterschiedlichen Auswirkungen physiologischer Manipulation auf das Langzeit- und Kurzzeitgedächtnis zu untersuchen.
Zusammenfassung
Robuste und einfache Verhaltensparadigmen des appetitiven, assoziativen Gedächtnisses sind entscheidend für Forscher, die sich für zelluläre und molekulare Mechanismen des Gedächtnisses interessieren. In dieser Arbeit wird ein effektives und kostengünstiges Mausverhaltensprotokoll beschrieben, um die Auswirkungen physiologischer Manipulation (wie z.B. die Infusion pharmakologischer Wirkstoffe) auf die Lernrate und Dauer des Geruchs-Belohnungs-Gedächtnisses zu untersuchen. Repräsentative Ergebnisse liefert eine Studie, die die unterschiedliche Rolle der Tyrosinkinase-Rezeptoraktivität im Kurzzeit- (STM) und Langzeitgedächtnis (LTM) untersucht. Männliche Mäuse wurden darauf konditioniert, eine Belohnung (Zuckerpellet) mit einem der beiden Gerüche zu assoziieren, und ihr Gedächtnis für die Assoziation wurde 2 oder 48 Stunden später getestet. Unmittelbar vor dem Training wurden ein Tyrosinkinase (Trk)-Rezeptor-Inhibitor oder Vehikelinfusionen in den Riechkolben (OB) verabreicht. Obwohl es keinen Effekt der Infusion auf die Lernrate gab, beeinträchtigte die Blockade der Trk-Rezeptoren im OB selektiv das LTM (48 h) und nicht das Kurzzeitgedächtnis (STM; 2 h). Die LTM-Beeinträchtigung wurde auf die verminderte Geruchsselektivität zurückgeführt, die anhand der Länge der Grabzeit gemessen wurde. Die Ergebnisse dieses Experiments zeigten, dass die Aktivierung des Trk-Rezeptors im OB der Schlüssel zur Konsolidierung des olfaktorischen Gedächtnisses ist.
Einleitung
Die Mechanismen der assoziativen Gedächtnisbildung wurden bisher überwiegend auf der Grundlage von Studien zur Angstkonditionierung in einem Versuch untersucht. Viele alltägliche Aufgaben haben jedoch in der Regel komplexere Akquisitionsmuster und beruhen auf wiederholten Begegnungen. Das Ziel dieses Protokolls ist es, ein kostengünstiges Verhaltensparadigma für Nagetiere bereitzustellen, das zum Verständnis der zellulären und molekularen Mechanismen des appetitiven Lernens und des Gedächtnisses in mehreren Studien verwendet wird.
Das Geruchslernen, das vom Hauptriechkolben (OB) abhängt, bietet mehrere Vorteile für die Untersuchung des appetitiven Gedächtnisses in mehreren Versuchen. Erstens haben OB-abhängige Erinnerungen unterschiedliche Dauern (STM, LTM und Zwischengedächtnis1) und beruhen auf dem gleichen molekularen 2,3 und strukturellen Mechanismus wie anderswo im Gehirn, einschließlich Neuromodulation4, Langzeitpotenzierung5 und adulter Neurogenese 6,7,8. Zweitens ermöglichen OB-abhängige Erinnerungen im Gegensatz zu Regionen höherer Ordnung, wie dem Hippocampus, Beobachtungen einer direkteren Korrespondenz zwischen den Manipulationen der Wahrnehmungsumgebung durch den Experimentator und Veränderungen der neuronalen Schaltkreise, die für das Lernen verantwortlich sind 8,9,10,11 . In dieser Arbeit wird ein OB-abhängiges assoziatives Lern- und Gedächtnisparadigma beschrieben, das zur Untersuchung allgemeiner molekularer und struktureller Mechanismen verwendet werden kann. Es wurde entwickelt, um Forschern den Zugang zu den Vorteilen des olfaktorischen Lernens für die Untersuchung zellulärer und molekularer Mechanismen des Gedächtnisses zu ermöglichen.
In unserer jüngsten Publikation3 wurde das hier beschriebene Protokoll verwendet, um zu zeigen, dass die Konsolidierung des appetitiven Geruchslernens von der Aktivierung des Trk-Rezeptors innerhalb des OB abhängt. Im folgenden Protokoll werden auch Bereiche diskutiert, in denen das Verhaltensparadigma für unterschiedliche experimentelle Bedürfnisse angepasst werden kann.
In dieser Studie wurden insgesamt 27 adulte männliche CD-1-Mäuse verwendet, die zum Zeitpunkt der Kanülierung 8 Wochen alt waren. Für die genauen Gruppenverteilungen und die Verwendung von Geruchssets siehe den Methodenabschnitt unserer vorherigen Veröffentlichung3. Männliche Mäuse wurden verwendet, um große Schwankungen des Östrogenspiegels zu vermeiden, da frühere Forschungen12 zeigten, dass das Geruchsgedächtnis durch erhöhte Östrogenspiegel verbessert wird. Diese Mäuse wurden immer in einem 12:12 h umgekehrten Hell-Dunkel-Zyklus gehalten und hatten Zugang zu Wasser. Während der Verhaltensexperimente wurde die Ernährung der Mäuse so eingeschränkt, dass sie bei ~90% ihres freien Fütterungsgewichts gehalten wurden. Die Diäteinschränkung begann 3 Tage vor Beginn des Verhaltensexperiments. Wie im Folgenden beschrieben wird, wird die gleiche Gruppe von Mäusen mit unterschiedlichen Geruchssets präsentiert, um die angemessene statistische Aussagekraft zu erreichen und gleichzeitig den Tierverbrauch zu minimieren. Der Abschnitt "Statistische Analyse" zeigt, wie die zufällige Varianz, die dadurch eingeführt werden kann, berücksichtigt werden kann.
Protokoll
Das folgende Protokoll entspricht den Tierhaltungsrichtlinien der IACUC am Earlham College.
1. Kanülierung des Riechkolbens
HINWEIS: Diese Operationen erfordern keine sterile Technik, da keine großen Schnitte erforderlich sind. Jede Institution kann jedoch unterschiedlich in ihren Anforderungen sein. Wenn Experimentatoren diese Operation an immungeschwächten Mausstämmen durchführen, können zusätzliche Überlegungen erforderlich sein. Insgesamt werden die Experimentatoren ermutigt, dieses Protokoll vor der Anwendung mit ihrem Tierarzt und ihrem Tierpflegeteam zu besprechen und alle Werkzeuge zwischen den einzelnen Eingriffen zu reinigen und zu desinfizieren.
- Während des Aufbaus Kanülen und Schrauben in einem kleinen Becherglas oder einer Petrischale mit 32 % Chlorhexidin einweichen, um sie desinfiziert zu halten.
- Betäuben Sie Mäuse mit gasförmigem 4%igem Isofluran in reinem Sauerstoff und befestigen Sie sie in einem stereotaktischen Gerät. Stellen Sie während der Operation sicher, dass die Mäuse unter einer 1,5-2%igen Isofluran-Anästhesie gehalten werden, die über einen Nasenkegel verabreicht wird. Überwachen Sie die Atmung während der gesamten Operation. Verwenden Sie Augensalbe, um die Trockenheit der Augen während der Narkose zu verhindern.
- Nachdem die Maus gesichert ist und nicht mehr auf ein festes Einklemmen des Hinterfußes reagiert, reiben Sie mit 32 % Chlorhexidin die Oberseite des Kopfes, um die Schnittfläche zu reinigen.
- Reiben Sie anschließend den Scheitel des Kopfes in rostraler bis kaudaler Richtung mit Lidocain (topische Analgesie).
- Drücken Sie fest nach unten, um mit einer sauberen Skalpellklinge einen einzigen Schnitt in der Mittellinie zu machen.
- Bohren Sie mit einem Bohrer, der an der Stereotaxe befestigt ist, zwei Löcher über die Riechkolben für die Führungskanüle (26 G) mit den Koordinaten AP +5,0 mm, ML +/-0,75 mm in Bezug auf die Bregma.
- Bohren Sie zwei Löcher über die Kleinhirnformation.
HINWEIS: Die Position dieser Schrauben muss nicht genau sein, stellen Sie sicher, dass sie entlang der Mittellinie symmetrisch sind. - Setzen Sie Schrauben in die beiden Löcher über der Kleinhirnformation und befestigen Sie diese Schrauben mit einem Gewebekleber am Schädel.
- Die Führungskanüle (26 G) wird mit dem Stereotaxikum in die Löcher eingeführt, die über den Riechkolben gebohrt wurden (Schritt 1.6). Senken Sie die Kanüle DV um 1,0 mm ab.
- Mischen Sie den Zahnzement in einer Petrischale. Verwende eine kleine Metallschaufel, um den Zahnzement langsam um die Kanüle herum zu stapeln. 5 s trocknen lassen. Entfernen Sie dann die Arme des stereotaktischen Geräts und achten Sie darauf, dass Sie dabei die Führungskanüle nicht herausziehen. Den Zahnzement über den gesamten Schnitt weiter aufschichten, bis sich eine kleine Kappe bildet (siehe Abbildung 1A).
- Setzen Sie an dieser Stelle Blindstopfen in die Führungskanüle ein, um eine Verstopfung zu verhindern.
- Injizieren Sie unmittelbar nach der Operation Ketoprofen (0,2 mg/kg) und Kochsalzlösung (200 μl), um Schmerzen zu lindern und zu rehydrieren. Geben Sie den Mäusen nach der Operation weiches Futter oder Hydrogel. Lassen Sie Mäuse nicht unbeaufsichtigt, bis sie das Bewusstsein wiedererlangt haben, um die Brustbeinlage aufrechtzuerhalten.
HINWEIS: Mäuse werden ab diesem Zeitpunkt auch einzeln untergebracht. - Injizieren Sie Kochsalzlösung (200 μl) und Ketoprofen (0,2 mg/kg) einmal täglich für zwei Tage nach der Operation.
- Wiegen Sie die Mäuse 2 Tage lang und bis zu 5 Tage (je nach Bedarf) nach der Operation und überwachen Sie ihr Gewicht. Wenn das Gewicht nicht innerhalb von zwei oder drei Tagen wieder auf das Niveau vor der Operation zurückkehrt, konsultieren Sie mit dem Tierarzt die geeignete Fütterungsmethode.
- Lassen Sie die Mäuse sich mindestens 7 Tage lang erholen, bevor Sie mit dem Verhaltenstraining beginnen.
2. Assoziative Diskriminierungsaufgabe
- Infusionen
- Verabreichen Sie den Mäusen OB-spezifische Infusionen des Tyrosinkinase-Rezeptor-Inhibitors K252a (50 μM; 5 % DMSO in Kochsalzlösung) oder Vehikel (5 % DMSO in Kochsalzlösung) wie folgt.
- Geben Sie die Infusion bilateral in den OB der Mäuse ab. Injizieren Sie 2,0 μl Endvolumen pro Kolben mit einer Infusionsrate von 0,2 μl/min und einer Gesamtinfusionszeit von 10 min mit einer Doppelinjektorpumpe.
HINWEIS: Der Zeitpunkt der Manipulation kann je nach Art der durchgeführten Verhaltensstudie angepasst werden. Die genauen Infusionsschritte sind für jede Injektorpumpe spezifisch und im Handbuch des Herstellers angegeben. - Achten Sie darauf, die Injektoren nach der Entbindung ca. 5 Minuten in den Kanülen zu belassen, um den Rückfluss zu hemmen und die Diffusion zu fördern. (d. h. planen Sie insgesamt 15 Minuten für jede Infusion ein).
- Geben Sie die Infusion bilateral in den OB der Mäuse ab. Injizieren Sie 2,0 μl Endvolumen pro Kolben mit einer Infusionsrate von 0,2 μl/min und einer Gesamtinfusionszeit von 10 min mit einer Doppelinjektorpumpe.
- Verabreichen Sie den Mäusen OB-spezifische Infusionen des Tyrosinkinase-Rezeptor-Inhibitors K252a (50 μM; 5 % DMSO in Kochsalzlösung) oder Vehikel (5 % DMSO in Kochsalzlösung) wie folgt.
- Geruchsfixierungen.
- Alle Odormittel in leichtem Mineralöl auf einen Partialdruck von 1,0 Pa verdünnen, wobei ein vorher berechnetes Verhältnis auf der Grundlage des Dampfdrucks verwendet wird (Tabelle 1).
- Verwenden Sie die 5 separaten Geruchspaare aus Tabelle 1 (die Zahlen in der Tabelle geben das Volumen in μL an, um 50 mL Mineralöl für 1,0 Pa einzumischen).
- Zur Aufbereitung des Duftsandes, der während der Verhaltensschritte (Abschnitte 2.3 und 3) verwendet werden soll, werden je 100 g Spielsand 400 μl des Geruchsmittels 1,0 Pa aus Schritt 2.2.2 gemischt.
- Bildend
HINWEIS: Mäuse sollten über einen Zeitraum von 10 Tagen wie unten beschrieben geformt werden.- Bringen Sie die Mäuse in den Operationssaal und behandeln Sie sie in den ersten zwei Tagen nach der Genesung von der Operation 10 Minuten pro Tag.
- Legen Sie an Tag 3 eine Petrischale, die mit (+)-Limonen-Duftsand gefüllt ist, in die Heimkäfige der Mäuse und füllen Sie sie mit etwa 10 Saccharosepellets von jeweils 5 mg Masse.
HINWEIS: Verwenden Sie 1,0 Pa (+)-Limonen (mischen Sie 102 μl in 50 mL Mineralöl) als Belohnungsgeruch und reines Mineralöl (das Verdünnungsmittel für die Testgerüche) als unbelohnten Geruch. Die Wahl monomolekularer Odorstoffe wird ebenfalls empfohlen, da diese bei Mäusen höchstwahrscheinlich neu sind. - Füllen Sie sowohl den Sand als auch die Pellets an Tag 4 auf.
- An den Tagen 5 und 6 gewöhnen Sie die Mäuse an den maßgeschneiderten Verhaltensapparat, indem Sie sie in den Apparat setzen und den Raum erkunden lassen (Abbildung 1B,C). Stellen Sie das Gerät aus einem Standardkäfig für zu Hause und Poly (Methylmethacrylat) her, um zwei Deckel und einen schwarzen Mittelteiler zu konstruieren. Stellen Sie sicher, dass sowohl die Deckel als auch die mittlere Trennwand 1-2 cm größer sind als der Heimkäfig.
- Bereiten Sie eine Petrischale mit Limonen-Duftsand und eine weitere mit mineralölhaltigem Sand vor. Nach der Eingewöhnung an Tag 5 und 6 stellen Sie beide Sandschalen in die Testkammer und mischen Sie 10 Saccharosepellets in die nach Limonen duftende Schale, um sie als Belohnung zu servieren. Platzieren Sie jede Maus für 10 Minuten in der Testkammer und lassen Sie sie frei erkunden und die Belohnungspellets verbrauchen.
- Führen Sie die Mäuse an Tag 7 einer verkürzten Version des abschließenden Testverfahrens aus, indem Sie die Schalen mit Limonen- und Mineralöl-Sand in das Verhaltensgerät legen. Diesmal mit einbeziehen Sie die mittlere Trennwand.
- Lege eine einzelne Belohnung auf den nach Limonen duftenden Sand und lege die Maus in die Ruhekammer.
- Sobald die Maus in der Ruhekammer platziert wurde, heben Sie die mittlere Trennwand an, damit die Maus in die Testkammer eindringen kann, um die mit Sand gefüllten Schalen zu untersuchen und zu graben. Bringen Sie die Maus entweder in die Ruhekammer zurück, nachdem sie das Belohnungspellet zurückgeholt hat oder nachdem 5 Minuten abgelaufen sind.
- Wiederholen Sie diesen Vorgang für insgesamt 10 Versuche für jede einzelne Maus. Gleichen Sie die Platzierung des belohnten Gerichts entweder auf der linken oder rechten Seite aus, indem Sie einen Zufallszahlengenerator verwenden. Zwischen den Versuchen gibt es keine Ruhezeiten.
- Wiederholen Sie an Tag 8 die Versuche von Tag 7, vergraben Sie das Pellet aber auch nach und nach immer tiefer im Sand.
HINWEIS: Die meisten Mäuse sollten bis zum 10. Versuch an Tag 8 nach dem unsichtbaren Belohnungspellet graben. - Erhöhen Sie an Tag 9 die Anzahl der Versuche auf 20 Versuche für jede Maus, wobei das Saccharose-Pellet vollständig tief vergraben wird und die Mäuse für 1 Minute pro Versuch in die Testkammer eingeführt werden. Lassen Sie Mäuse in beiden Schalen graben, um die Belohnung zu erhalten.
- Wiederholen Sie an Tag 10 die 20 Versuche für jede Maus, aber wenn sie in der nicht belohnten Schale graben, bevor sie in der belohnten Schale graben, und beginnen Sie dann mit der nächsten Prüfung. Lassen Sie die Mäuse, die zuerst in der Belohnungsschale (nach Limonen duften) gegraben haben, das Belohnungspellet zurückholen, bevor Sie sie zurück in die Ruhekammer schicken.
3. Schulung und Prüfung
HINWEIS: Sobald die Mäuse begonnen haben, zuverlässig nach den unsichtbaren, geruchsgesteuerten Belohnungspellets zu graben, kann das Experiment beginnen.
- Ausbildung
HINWEIS: Die Trainingsphase beginnt zwei Tage nach Abschluss des Shapens und besteht aus 20 Versuchen für jede Maus. Verabreichen Sie vor dem Training sofort die intrabulbären Arzneimittel-/Vehikelinfusionen (siehe Abschnitt 2.1 für Einzelheiten zur Infusion) und beginnen Sie das Training unmittelbar nach den Infusionen.- Lege eine Maus in die Ruhekammer.
- Stellen Sie zwei Schalen mit Sand, der nach einem neuartigen Geruchspaar duftet, in die Testkammer, wo ein Belohnungspellet in einer der Schalen vergraben wird.
- Sobald die Testkammer fertig ist, heben Sie die undurchsichtige Barriere an und führen Sie die Maus in die Testkammer ein. Bringen Sie die Maus sofort in die Ruhekammer zurück, wenn die Maus zuerst in der unbelohnten Schale gräbt (notieren Sie diese Versuche als "0"). Wenn die Maus den belohnenden Geruch zuerst eingräbt, lassen Sie sie das Pellet zurückholen und in die Ruhekammer zurückbringen. Notieren Sie diese Versuche als "1". Wenn der Versuch 1 Minute dauert, ohne dass die Maus die Belohnung zurückholt, schicken Sie die Maus zurück in die Ruhekammer.
- Reinigen und befüllen Sie das Geschirr und beginnen Sie den nächsten Versuch. Wiederholen Sie das Gleiche für 20 Versuche.
- Testen
HINWEIS: Gedächtnistests können zu jeder Zeit durchgeführt werden, die für den Forscher von Interesse ist. In diesem Experiment wurden zwei getrennte Gruppen von Mäusen 2 h (STM) oder 48 h (LTM) nach dem Training getestet, da das Interesse am differentiellen Einfluss von K252a auf STM und LTM bestand.- Führen Sie die Tests mit den gleichen Gerüchen und dem gleichen Verfahren durch, wie für die Schulung beschrieben (Abschnitt 3.1).
HINWEIS: Abhängig von der Forschungsfrage muss der Forscher möglicherweise Kontrollgruppen einbeziehen. In dem zuvor veröffentlichten Experiment wurden beispielsweise die Auswirkungen der Trk-Rezeptorblockade auf die Gedächtniskonsolidierung untersucht3. Daher wurde einer Kontrollgruppe vor dem 48-Stunden-Test K252a infundiert, um zu zeigen, dass die Effekte nicht auf eine Interferenz mit der Entnahme zurückzuführen waren.
- Führen Sie die Tests mit den gleichen Gerüchen und dem gleichen Verfahren durch, wie für die Schulung beschrieben (Abschnitt 3.1).
- Statistische Analyse
HINWEIS: Die SPSS 22.0-Syntax für jeden Schritt wird als Beispiel als ergänzende Datei bereitgestellt.- Führen Sie statistische Analysen mit der linearen Analyse gemischter Effekte durch. Im Gegensatz zu ANOVAs können lineare Modelle mit gemischten Effekten zufällige Effekte und wiederholte Messungen besser berücksichtigen.
- Berechnen Sie das abhängige Maß: "Proportion korrekt". Erinnern Sie sich an 3.1.3, dass Versuchen, bei denen die Maus zuerst den belohnenden Geruch eingrub, eine "1" und eine "0" zugewiesen wurde, wenn die Maus zuerst in den undankbaren Geruch grub. Durchschnittlich alle fünf Studien, um vier Versuchsblöcke zu erstellen (TB; z. B. Studienblock 1 oder TB1 war der Durchschnitt der Studien 1-5, Versuchsblock 2 oder TB 2 war der Durchschnitt der Studien 6-10 und so weiter).
- Legen Sie die unabhängigen Variablen oder festen Effekte als Wirkstoffgruppen fest (K252a oder Vehicle; Abschnitt 2.1.1) und Testblöcke (ab 3.3.1). In den folgenden repräsentativen Ergebnissen sind die Variablen angegeben, die für jede Analyse verwendet werden.
- Einzelne Maus- und Geruchssets, die in der Maus verschachtelt sind, sind als "zufällige Effekte" einzubeziehen, um intrinsische Verhaltensunterschiede bei den Mäusen und alle Auswirkungen der Verwendung mehrerer Geruchssets zu kompensieren.
- Führen Sie eine Logit-Transformation für die Proportionskorrektur durch.
HINWEIS: Der Anteil richtig ist keine stetige, ungebundene abhängige Variable. Damit verstößt es gegen zwei Annahmen für lineare Modelle. Daher wird die Logit-Transformation durchgeführt. - Verwendung geschätzter marginaler Mittelwerte zur Durchführung von Post-hoc-Tests zu signifikanten Wechselwirkungen, die durch das vollständige Modell identifiziert wurden; Mehrfachpaarvergleiche müssen in Post-hoc-Tests korrigiert werden. Typischerweise werden Bonferroni oder Šidák verwendet.
Ergebnisse
Wie beschrieben, ermöglicht dieses Protokoll den Forschern, den Einfluss einiger Manipulationen auf das Lernen, STM und LTM zu bewerten. Beispielergebnisse von Tong et al., 20183 finden Sie hier. Die Ergebnisse stützen die Hypothese, dass die Trk-Rezeptorblockade selektiv die LTM hemmt, nicht aber das Lernen oder die STM.
Abbildung 2A zeigt die Schemata des Trainings, des STM-Tests und des LTM-Tests. Zunächst konnte gezeigt werden, dass K252a-Infusionen die Lernrate einer Geruchs-Belohnungs-Assoziation nicht beeinflussten. Abbildung 2B (Abschnitt 3.1) zeigt die Lernrate sowohl des K252a als auch der Fahrzeuggruppen aus dem Training. Die statistische Analyse unter Verwendung eines linearen gemischten Modells wurde mit zwei festen Effekten durchgeführt, der Wirkstoffgruppe und dem Versuchsblock (TB); Maus und Geruchsset, die in der Maus verschachtelt waren, waren zufällige Effekte. Daten aus den Tests (Abschnitt 3.2) wurden nicht in die Analyse einbezogen. Ein signifikanter Haupteffekt wurde aus dem Versuchsblock (F(3, 183.692) = 43.735, p < 0.001) beobachtet, aber kein Effekt aus der Wirkstoffgruppe (F(1, 85.685) = 0.132, p = 0.717) und keine signifikante Wechselwirkung (F(3, 183.692) = 0.111, p = 0.954). Post-hoc-Tests mit der Šidák-Anpassung bestätigten, dass sich der K252a und die Fahrzeuggruppen in keinem der Versuchsblöcke während des Trainings unterschieden (p > 0,05 für alle Vergleiche). TB2, TB3 und TB4 waren in allen Vergleichen signifikant höher als TB1 (p ≤ 0,001 in allen Fällen), was zeigt, dass beide Gruppen die Geruchs-Belohnungs-Assoziation am Ende von 20 Trainingsversuchen erfolgreich erlernt hatten.
Um die Auswirkungen der Infusion auf STM und LTM zu untersuchen, wurde die gleiche Analyse durchgeführt, die Daten aus dem Test einschloss (Abschnitt 3.2). Es zeigte sich eine signifikante Wechselwirkung zwischen Wirkstoffgruppe und Versuchsblock (F(2, 77.558) = 4.043, p = 0.021), ohne signifikante Haupteffekte der Wirkstoffgruppe (F(1, 55.629) = 1.438, p = 0.236) oder des Versuchsblocks (F(2, 69.979) = 1.360, p = 0.263). Um das Gedächtnis spezifisch untersuchen zu können, wurden in post-hoc-paarweisen Vergleichen mit der Šidák-Korrektur die Unterschiede zwischen dem letzten Versuchsblock des Trainings (Abschnitt 3.1) und dem ersten Versuchsblock des Tests (Abschnitt 3.2) entweder 2 (STM) oder 48 Stunden (LTM) später verglichen. Bei mit Fahrzeugen infundierten Mäusen zeigten die Vergleiche eine Beibehaltung des assoziativen Gedächtnisses sowohl 2 als auch 48 Stunden nach dem Training (p > 0,05 für alle Vergleiche mit der Trainingsleistung). Bei mit K252a infundierten Mäusen unterschied sich der erste Versuchsblock des 2-Stunden-Tests (STM) nicht vom letzten Versuchsblock des Trainings (p > 0,05); Ihre Gedächtnisleistung war jedoch nach 48 h signifikant geringer (p = 0,018). Darüber hinaus war der Speicher beim 48-Stunden-Test im Vergleich zum Speicher beim 2-Stunden-Test (p = 0,009) und zur Leistung der Fahrzeuggruppe beim 48-Stunden-Test (p = 0,006) signifikant reduziert. Es gab keinen Unterschied in der STM zwischen Vehikel- und K252a-infundierten Mäusen (p = 0,356). Zusammengenommen zeigen die Ergebnisse, dass die Hemmung der Trk-Rezeptoren im Riechkolben durch K252a selektiv das langfristige, aber nicht das kurzfristige Geruchsgedächtnis stört (Abbildung 3).
| Geruchs-Set | Geruch 1 | Geruch 2 |
| 1 | Pentansäure | Butansäure |
| 225.1 | 63.6 | |
| 2 | Hexanal | Heptanal |
| 11.1 | 35.3 | |
| 3 | Propylacetat | Butylacetat |
| 3.1 | 10.9 | |
| 4 | 2-Oktanon | 2-Heptanon |
| 87.4 | 28.7 | |
| 5 | Pentanol | Hexanol |
| 37.2 | 127.3 |
Tabelle 1: Mischvolumina für Geruchssets. Jede Zeile zeigt zwei Gerüche, die als Paar für die Verhaltensschritte verwendet werden können. Um zum Beispiel das erste "Geruchsset" zu verwenden, stellen Sie die Mischungen aus Pentansäure und Butansäure her. Die Zahlen in der Tabelle geben das Volumen in μl an, das mit 50 mL Mineralöl für eine Konzentration von 1,0 Pa pro Geruch gemischt werden muss. Während des Trainings und der Tests wurde eine Petrischale mit Pentansäure beduftet, die andere mit Butansäure.

Abbildung 1: Kanülenplatzierung und Verhaltensapparat. (A) Zeigt die relative Position der Kanüle, der Zahnzementkappe und der Schrauben am Kopf der Maus an. Beachten Sie, dass die Nadeln der Kanüle in die beiden Riechkolben reichen, der Sockel selbst ist in die Zahnzementkappe eingelassen. Die Schrauben werden in zwei Löcher gesteckt, die über der Kleinhirnformation in den Schädel gebohrt werden. Die Schrauben berühren nicht das Gehirn selbst, sondern dienen als kaudaler Anker für die Zahnzementkappe. Die Abbildung zeigt die relative Größe für die Herstellung der Zementkappe. (B) Zeigt den zusammengesetzten Verhaltensapparat. Der Körper ist ein typischer Mauskäfig für zu Hause. Die Deckel mit Löchern für die Luft wurden aus Plexiglas hergestellt. Der Mittelteiler ist ebenfalls aus schwarzem Plexiglas gefertigt. Die Deckel sollten aus ausreichend schwerem Plexiglas bestehen, dass sie als Trakt für den Mittelteiler dienen können, der während der Versuche angehoben und abgesetzt werden kann. (C) Zeigt eine Seite des Verhaltensapparates. Beachten Sie, dass der Mittelteiler etwas höher als der Käfig ist, um das Anheben zu erleichtern. Petrischalen aus Sand können entlang des Randes platziert werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
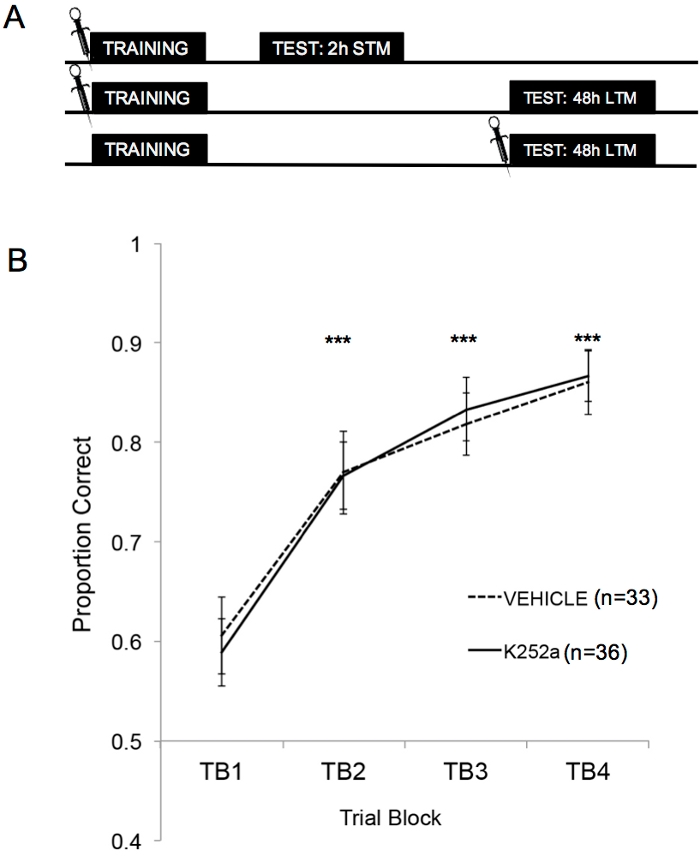
Abbildung 2: Studiendesign und Lernergebnisse. (A) Zeigt das Schema des Studiendesigns. Es ist zu beachten, dass die STM- und LTM-Gruppen unabhängig voneinander waren (d. h. unterschiedliche Gruppen von Mäusen). Die Symbole am Anfang der Blöcke geben den Zeitpunkt an, zu dem die Infusionen verabreicht wurden. (B) Zeigt das Verhältnis an, das für die Versuche 1-20 während des Trainings korrekt ist. Die Ergebnisse deuten darauf hin, dass sich K252a und Fahrzeuggruppen in ihrer Lernrate (Steigung der Linien) nicht unterschieden. Fehlerbalken stellten den Standardfehler des Mittelwerts (SEM) dar. Sternchen zeigen einen signifikanten Anstieg des korrekten Anteils im Vergleich zu TB1 sowohl für Fahrzeug- als auch für K252a-Kohorten (p ≤ 0,001 für alle Vergleiche). Diese Abbildung wurde von Tong et al. 2018 mit Genehmigung3 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
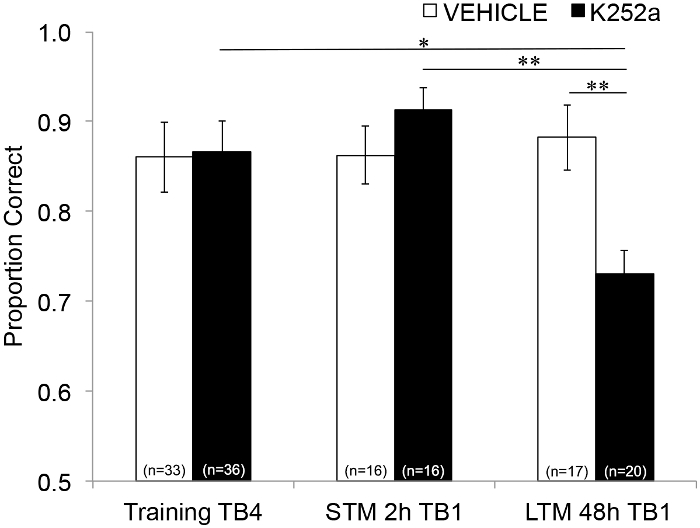
Abbildung 3: Unterschiedliche Effekte der Trk-Rezeptor-Blockade auf STM und LTM. Zeigt das korrekte Verhältnis für Testblock 4 des Trainings und Testblock 1 des STM- und LTM-Tests an. Das heißt, ein lineares gemischtes Modell wird verwendet, um den während des letzten Versuchsblocks der Trainingsphase korrekten Anteils zu vergleichen (Abbildung 2; Training-TB4) zu denen während der ersten Versuchsblöcke (Testing-TB1) des Kurzzeit- (2-Stunden-Test) und Langzeit- (48-Stunden-Test) Gedächtnistests. Das lineare gemischte Modell hatte zwei feste Effekte: Wirkstoffgruppe und Versuchsblock (Training-TB4, STM-TB1, LTM-TB1). Die zufälligen Effekte waren Maus- und Geruchseinstellungen, die in der Maus verschachtelt waren. Post-hoc-Vergleiche ergaben, dass K252a-Mäuse eine signifikant beeinträchtigte LTM aufwiesen (Vergleich mit dem Training TB4; p = 0,018), aber nicht STM (p > 0,05). Die LTM-Leistung von K252a-infundierten Mäusen war ebenfalls signifikant niedriger als die STM von K252a-infundierten Mäusen (p = 0,009) und niedriger als die LTM von Vehikelmäusen (p = 0,006). Fehlerbalken stellten das SEM dar. Diese Abbildung wurde von Tong et al. 2018 mit Genehmigung3 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Datei: Syntax, die für die statistische Analyse verwendet wird. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Angstkonditionierung in einem Versuch ist ein leistungsfähiges Verhaltensprotokoll zur Untersuchung der molekularen und zellulären Dynamik des Gedächtnisses, aber ein Großteil des natürlichen Lernens ist inkrementell und wird am besten durch ein Paradigma wie das oben beschriebene modelliert. Die Hemmung der Trk-Rezeptoren in der OB verhinderte die Konsolidierung des olfaktorischen Gedächtnisses in einem appetitiven Lernparadigma mit mehreren Studien, wie zuvor von unserer Gruppe3 gezeigt wurde. Die Entdeckung eröffnet neue Wege für die Erforschung des differentiellen Timings von molekularen Mechanismen, wie Neurotrophinen, beim appetitiven und aversiven Lernen.
Dieses Experiment bestand aus zwei kritischen Teilen: (1) der Kanülierung und (2) der assoziativen Diskriminierungsaufgabe (unterteilt in Shaping, Training und Testing). Experimentatoren können dieses Protokoll an ihre spezifische Forschungsfrage anpassen. Wir haben uns zum Beispiel in erster Linie für den OB interessiert, und dieses etablierte Protokoll lässt sich leicht auf andere OB-Studien übertragen. Für Experimentatoren mit anderen Regionen von Interesse wird es wichtig sein, die Infusionsstellen in einer Pilotstudie zu validieren. Experimentatoren müssen möglicherweise auch die Diffusionsrate, die räumliche Durchdringung und die Bioaktivitätsdauer dessen, was sie infundieren, berücksichtigen.
Die im Protokoll beschriebenen Formgebungsschritte wurden von den Autoren dieses Protokolls ausgiebig verwendet. Die Einhaltung dieser wie beschrieben scheint wichtig zu sein, damit die Mäuse die Aufgabe rechtzeitig lernen. Unter Verwendung anderer Zeitlinien beobachteten die Autoren eine größere Varianz unter den Mäusen in ihrer Vertrautheit mit der Aufgabe, und dies bedeutete zusätzliches Training, um alle Mäuse auf ein Kriterium für den Test mit experimentellen Gerüchen zu bringen. Bei der Schulung und Erprobung hat der Forscher je nach Forschungsinteresse Flexibilität mit der Anzahl der Versuche, der Konzentration der experimentellen Gerüche und der Ähnlichkeit der Gerüche untereinander. Wir empfehlen, wenn möglich, mehrere Geruchssets zu verwenden, wie wir beschrieben haben, um die Anzahl der für das Experiment verwendeten Tiere zu reduzieren. Im Abschnitt Statistische Analyse finden Sie eine Anleitung, wie die Verwendung mehrerer Ordersätze in der endgültigen Analyse berücksichtigt werden kann. Prinzipiell kann die Ähnlichkeit des Geruchspaares variiert werden, um die Schwierigkeit der Unterscheidung anzupassen. In der zuvor veröffentlichten Studie aus unserer Gruppe3 bestehen die Geruchspaare aus zwei Geruchsstoffen der gleichen Funktionsgruppe, die sich jedoch durch eine Kohlenstofflänge voneinander unterscheiden. Diese Unterscheidungen sind schwieriger als Paare, die sich um zwei oder mehr Kohlenstofflängen unterscheiden, aber einfacher als Enantiomere (z. B. (+)-Limonen und (-)-Limonen). Geruchsstoffe aus verschiedenen Funktionsgruppen sind in der Wahrnehmung sehr unterschiedlich. Cleland et al.13 diskutiert weitere Stimulusvariationen und deren Wirkung auf spezifische Lernparameter.
Eine wesentliche Einschränkung dieses Protokolls besteht darin, dass es im Vergleich zu automatisierten assoziativen Lernaufgaben, bei denen mehrere Tiere parallel getestet werden könnten, viel länger dauert. Für einen bestimmten Test würde ein Forscher mindestens 20 Minuten brauchen, um 20 Versuche mit einer Maus abzuschließen. Es ist jedoch dieser Mangel an Automatisierung, der bedeutet, dass das Protokoll finanziell besser zugänglich ist, was für viele Institutionen eine Priorität ist. Wichtig ist, dass im Fall dieses Experiments festgestellt wurde, dass dieses Protokoll sehr gut handhabbar und effektiv für die Ausbildung von Forschern im Grundstudium ist, die sich für Verhaltensneurowissenschaften interessieren. Insbesondere entwickeln diese Studierenden neben den üblichen Vorteilen der Forschungsteilnahme auch starke Fähigkeiten im Umgang mit Tieren.
Forscher, die an der Übernahme dieses Paradigmas interessiert sind, können mehrere Parameter variieren. Am offensichtlichsten ist, dass pharmakologische Manipulationen von Mechanismen vielfältig sind, und dieses Verhaltensprotokoll kann mit chemogenetischen Techniken oder verschiedenen anderen Methoden zur Manipulation molekularer und zellulärer Signalwege (z. B. Optogenetik) verwendet werden. Das Paradigma selbst kann angepasst werden, um die Art des Lernens und des getesteten Gedächtnisses zu variieren. Zum Beispiel können Forscher die Ähnlichkeit der beiden präsentierten Gerüche anpassen, um die Lerngeschwindigkeit zu steuern. In unserer Studie3 bestehen die Geruchspaare aus zwei Geruchsstoffen der gleichen Funktionsgruppe, die sich jedoch um eine Kohlenstofflänge voneinander unterscheiden. Diese Unterscheidungen sind schwieriger als bei Paaren, die sich um zwei oder mehr Kohlenstofflängen unterscheiden, aber einfacher als Enantiomere (z. B. (+)-Limonen und (-)-Limonen). Geruchsstoffe aus verschiedenen Funktionsgruppen sind in der Wahrnehmung sehr unterschiedlich. Cleland et al.13 diskutieren mehr Stimulusvariationen und ihre Wirkung auf spezifische Lernparameter und kommen zu dem Schluss, dass ähnlichere Gerüche schwieriger zu unterscheiden sind und daher länger zum Erlernen brauchen14. Diese Manipulationen würden sich auch auf die Stärke des Gedächtnisses auswirken. In diesem Sinne könnten Forscher daran interessiert sein, das Gedächtnis zu verschiedenen Zeitpunkten nach dem Lernen zu testen. Zum Beispiel untersuchten zwei Studien15,16 die Rolle von BDNF bei der LTM-Persistenz für eine aversive Lernaufgabe mit einem Versuch. BDNF ist ein Ligand von TrkB. Die Studien zeigten, dass die Anti-BDNF-Antisense-Oligonukleotid-Infusion im Hippocampus 12 Stunden nach dem Lernen die LTM 7 Tage später, aber nicht 2 Tage später blockierte. Diese Studie zeigt, dass die Zeitskala der molekularen Mechanismen nach dem anfänglichen Lernen eine interessante und noch nicht verstandene Rolle bei der LTM spielt. In diesem Artikel wird ein Verhaltensprotokoll beschrieben, das die Untersuchung dieser Zeitskalen ermöglicht. Zu den weiteren Parametern, die für zukünftige Anwendungen von Interesse sind, gehört das verwendete Mausmodell. Zum Beispiel wäre es interessant, männliche Mäuse (die eine deutlich besser untersuchte Neurobiologie)17 durch weibliche Mäuse in zukünftigen Studien zu ersetzen, um Variationen in der Lernrate, STM und LTM zu untersuchen, da weibliche Säugetiere eine höhere Empfindlichkeit und Selektivität gegenüber Gerüchen haben als männliche Säugetiere18. Natürlich können mit diesem Protokoll auch Nagetiermodelle von Krankheiten effektiv eingesetzt werden.
Offenlegungen
Die Autoren dieser Arbeit hatten keine konkurrierenden finanziellen Interessen.
Danksagungen
Das Projekt wurde unterstützt durch das Scantland Summer Collaborative Research Gift und den Stephen and Sylvia Tregidga Burges Endowed Research Fund. Die Autoren möchten sich bei den Kollegen des Department of Psychology und des Neuroscience Program am Earlham College für ihre Unterstützung und Anleitung bedanken.
Materialien
| Name | Company | Catalog Number | Comments |
| Double guide cannula | PlasticsOne | C235GS-5-1.5/SPC | Custom order |
| (-)-limonene | Sigma-Aldrich | 218367-50G | |
| (+)-limonene | Sigma-Aldrich | 183164-100ML | |
| 2-hetanone | Sigma-Aldrich | 537683 | |
| 2-octanone | Sigma-Aldrich | O4709 | |
| 5mg sucrose pellets | Test Diet | 1811560 | Custom size. Used for rewards |
| Butanoic acid | Sigma-Aldrich | B103500 | |
| butyl acetate | Sigma-Aldrich | 402842 | |
| Dental Cement Powder (Coral) | A-M Systems | 525000 | |
| Dental Cement Solvent | A-M Systems | 526000 | |
| Double connector assembly | PlasticsOne | C232C | |
| Double dummy cannula | PlasticsOne | C235DCS-5/SPC dummy dbl | Custom order |
| Double injector | PlasticsOne | C235IS-5/SPC | Custom order |
| Drill | Kopf Instruments | Model 1474 High Speed Stereotaxic Drill | This drill requires an additional "adaptor" piece in order to fit certain drill bits. We get by this problem by wrapping the drill bit with lab tape to increase the circumference of the drill it to fit. This may not be an option for surgeries requiring sterile technique. |
| Eye Ointment | Purchase from local pharmacy | ||
| Figure 1 illustration software | BioRender | ||
| heptanal | Sigma-Aldrich | W254002 | |
| hexanal | Sigma-Aldrich | 115606 | |
| hexanol | Sigma-Aldrich | H13303 | |
| Infusion pump model 11 | Harvard Apparatus | 4169D | Used pumps available via American Instrument Exchange |
| Isoflurane | Santa Cruz Animal Health | sc-363629Rx | Vet prescription needed for order |
| K252a | Sigma-Aldrich | K2015 | Mixed to 50uM in DMSO (5%) |
| Ketoprofen | Allivet | 25920 | Vet prescription needed for order |
| Lidocaine | Aspercreme | Purchased from Amazon | |
| Mounting Screws | PlasticsOne | 00-96 X 3/32 | |
| Mouse Anesthesia Mask | Kopf Instruments | Model 907 Mouse Anesthesia Mask | Used with the stereotaxic to allow oxygen and anesthesia while mouse in stereotax |
| Mouse Nose Adaptor | Kopf Instruments | Model 926 Mouse Adaptor | Used with the stereotaxic to allow for head of mouse to be secured. |
| Novalsan | Jeffers | 41375 | |
| Pentanoic acid | Sigma-Aldrich | 240370 | |
| pentanol | Sigma-Aldrich | 138975 | |
| Petri dish glass bottoms | VWR | 10754-804 | |
| Polycarbonate Café bottoms | Ancare | N10PCSEC | Use normal housing cages and custom fit a track in the middle to act as the track for an opaque plexiglass divider |
| propyl acetate | Sigma-Aldrich | 537438 | |
| Quikrete Premium Play Sand | Purchase from local hardware store | ||
| Saline | Insight Needles | N/A | Sterile saline for drug mixing |
| Stereotaxic apparatus | Kopf Instruments | Model 902 Small Animal Stereotaxic Instrument | |
| Testing chamber | Ancare | N10PCSEC | Our testing chambers are modified using the regular mouse housing cage. The manuscript details what was done. |
| Vetbond Tissue Adhesive | 3M | Purchased from Amazon |
Referenzen
- Grimes, M. T., Smith, M., Li, X., Darby-King, A., Harley, C. W., Mclean, J. H. Mammalian Intermediate-Term Memory: New Findings in Neonate Rat. Neurobiology of Learning and Memory. 95 (3), 385-391 (2011).
- Grimes, M. T., Harley, C. W., Darby-King, A., Mclean, J. H. PKA Increases in the Olfactory Bulb Act as Unconditioned Stimuli and Provide Evidence for Parallel Memory Systems: Pairing Odor with Increased PKA Creates Intermediate- and Long-Term, but not Short-Term, Memories. Learning and Memory. 19 (3), 107-115 (2012).
- Tong, M. T., Kim, T. Y. P., Cleland, T. A. Kinase Activity in the Olfactory Bulb is Required for Odor Memory Consolidation. Learning & Memory. 25 (5), 198-205 (2018).
- Devore, S., Lee, J., Linster, C. Odor Preferences Shape Discrimination Learning in Rats. Behavioral Neuroscience. 127 (4), 498-504 (2013).
- Gao, Y., Strowbridge, B. W. Long-Term Plasticity of Excitatory Inputs to Granule Cells in the Rat Olfactory Bulb. Nature Neuroscience. 12 (6), 731-733 (2009).
- Bath, K. G., Mandairon, N., et al. Variant Brain-Derived Neurotrophic Factor (Val66Met) Alters Adult Olfactory Bulb Neurogenesis and Spontaneous Olfactory Discrimination. Journal of Neuroscience. 28 (10), 2383-2393 (2008).
- Lazarini, F., Lledo, P. M. Is Adult Neurogenesis Essential for Olfaction. Trends in Neurosciences. 34 (1), 20-30 (2011).
- Mandairon, N., Peace, S., Karnow, A., Kim, J., Ennis, M., Linster, C. Noradrenergic Modulation in the Olfactory Bulb Influences Spontaneous and Reward-Motivated Discrimination, but not the Formation of Habituation Memory. European Journal of Neuroscience. 27 (5), 1210-1219 (2008).
- Guérin, D., Peace, S. T., Didier, A., Linster, C., Cleland, T. A. Noradrenergic Neuromodulation in the Olfactory Bulb Modulates Odor Habituation and Spontaneous Discrimination. Behavioral Neuroscience. 122 (4), 816-826 (2008).
- Moreno, M. M., Bath, K., Kuczewski, N., Sacquet, J., Didier, A., Mandairon, N. Action of the Noradrenergic System on Adult-Born Cells Is Required for Olfactory Learning in Mice. Journal of Neuroscience. 32 (11), 3748-3758 (2012).
- Vinera, J., Kermen, F., Sacquet, J., Didier, A., Mandairon, N., Richard, M. Olfactory Perceptual Learning Requires Action of Noradrenaline in the Olfactory Bulb: Comparison with Olfactory Associative Learning. Learning and Memory. 22 (3), 192-196 (2015).
- Dillon, T. S., Fox, L. C., Han, C., Linster, C. 17β-estradiol Enhances Memory Duration in the Main Olfactory Bulb in CD-1 Mice. Behavioral Neuroscience. 127 (6), 923 (2013).
- Cleland, T. A., Narla, V. A., Boudadi, K. Multiple Learning Parameters Differentially Regulate Olfactory Generalization. Behavioral Neuroscience. 123 (1), 26 (2009).
- Cleland, T. A., Morse, A., Yue, E. L., Linster, C. Behavioral Models of Odor Similarity. Behavioral Neuroscience. 116 (2), 222-231 (2002).
- Bekinschtein, P., Cammarota, M., Igaz, L., Bevilaqua, L., Izquierdo, I., Medina, J. Persistence of Long-Term Memory Storage Requires a Late Protein Synthesis- and BDNF- Dependent Phase in the Hippocampus. Neuron. 53 (2), 261-277 (2007).
- Bekinschtein, P., et al. BDNF is Essential to Promote Persistence of Long-Term Memory Storage. Proceedings of the National Academy of Sciences. 105 (7), 2711-2716 (2008).
- Andreano, J., Cahill, L. Sex influences on the neurobiology of learning and memory. Learning and Memory. 16 (2009), 248-266 (2009).
- Kass, M. D., Czarnecki, L. A., Moberly, A. H., Mcgann, J. P. Differences in Peripheral Sensory Input to the Olfactory Bulb Between Male and Female Mice. Scientific Reports. 7 (1), (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten