Method Article
Human iPSC-Derived Cardiomyozyte Networks auf Multiwell Micro-Elektroden-Arrays für recurrent Action Potential Recordings
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel enthält eine Reihe von Protokollen für die Entwicklung von humaninduzierten pluripotenten Stammzell-abgeleiteten Kardiomyozyten (hiPSC-CM) Netzwerken, die auf Multiwell-MEA-Platten kultiviert werden, um die Zellmembran für Aktionspotenzialmessungen reversibel zu elektroporatieren. Hochdurchsatzaufzeichnungen werden von denselben Zellstandorten wiederholt über Tage hinweg abgerufen.
Zusammenfassung
Das Kardiale Sicherheitsscreening ist für die Entdeckung von Arzneimitteln und Therapeutika von größter Bedeutung. Daher ist die Entwicklung neuer elektrophysiologischer Hochdurchsatzansätze für hiPSC-abgeleitete Kardiomyozytenpräparate (hiPSC-CM) für effiziente Arzneimitteltests dringend erforderlich. Obwohl Multielektroden-Arrays (MEAs) häufig für Feldpotenzialmessungen von erregbaren Zellen eingesetzt werden, wurde in einer kürzlich veröffentlichten Veröffentlichung von Joshi-Mukherjee und Kollegen die Anwendung für wiederholte Aktionspotenzialaufnahmen (AP) beschrieben und validiert. aus der gleichen hiPSC-CM-Vorbereitung über Tage. Ziel ist es, detaillierte Schritt-für-Schritt-Methoden zum Säen von CMs und zur Messung von AP-Wellenformen mittels Elektroporation mit hoher Präzision und einer zeitlichen Auflösung von 1 s bereitzustellen. Dieser Ansatz behebt den Mangel an einfach zu bedienenden Methoden, um intrazellulären Zugang für AP-Messungen mit hohem Durchsatz für zuverlässige elektrophysiologische Untersuchungen zu erhalten. Ein detaillierter Arbeitsablauf und Methoden zur Beschichtung von HiPSC-CMs auf Multiwell-MEA-Platten werden diskutiert, wobei kritische Schritte, wo immer relevant, hervorgehoben werden. Darüber hinaus wird ein maßgeschneidertes MATLAB-Skript für die schnelle Datenverarbeitung, -extraktion und -analyse für eine umfassende Untersuchung der Wellenformanalyse gemeldet, um subtile Unterschiede in der Morphologie für verschiedene AP-Dauerparameter zu quantifizieren, die in Arrhythmie und Kardiotoxizität.
Einleitung
Humaninduzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) sind der Goldstandard für eine wachsende Anzahl von Laboratorien1,2,3,4,5,6 ,7,8,9,10. Schlagen embryoide Körper11,12,13 und monolayer3,7,10,11,12, 13,14,15,16,17 Differenzierung sind die bevorzugten Methoden für die Kardiomyozytenproduktion und das Multielektroden-Array (MEA) ist zu einer gemeinsamen Modalität geworden zur Überwachung der Elektrodynamik dieser Netze18,19,20. Während Parameter, die aus Feldpotentialen (FPs) extrahiert werden können, wie Schlaggeschwindigkeit, Amplitude, Dauer und RR-Intervalle, sind elektrophysiologische Ausgangsreaktionen spontan schlagender Monolayer18,21, 22,23, die diesen extrazellulären FP-Signalen zugrunde liegenden Aktionspotentialkomponenten (AP) sind schwer zu extrapolieren24. Unsere kürzlich erschienene Veröffentlichung über die Entdeckung einer Anwendung von MEAs für direkte wiederkehrende AP-Messungen liefert einen Beweis für die Methodik beispielhafter intrazellulärer AP-Auslesungen mit einer umfassenden Wellenformanalyse in verschiedenen Repolarisationsphasen über mehrere Chargen von hiPSC-abgeleiteten Cardiomyozytennetzwerken3. In der Studie haben wir gezeigt, dass die Abgabe von elektroporatingen Impulsen an Netzwerke von hiPSC-abgeleiteten Kardiomyozyten den intrazellulären Zugriff für AP-Aufnahmen ermöglicht. Diese transienten AP-Aufnahmen sind abhängig von transmembranpotenziellen Wiederherstellungen, die durch die Verletzungsstelle3,25,26beobachtet werden. Wellenformen, die in unserer Studie über MEA und Patch-Klemme aufgezeichnet wurden, zeigten ähnliche AP-Morphologien, wodurch die Zuverlässigkeit des Ansatzes3validiert wurde.
Einige Laboratorien haben berichtet, dass APs aus verschiedenen elektrogenen Zellen mit maßgeschneiderten MEAs18,21,26,27,28,29 , 30, aber die Zuverlässigkeit der Verwendung von MEAs für konsistente und wiederkehrende AP-Messungen wurde nicht bewertet. Derzeit ist die Goldstandard-Patch-Clamp-Technik auf Klemmenaufnahmen7,31 beschränkt, während MEA-basierte AP-Messungen transient sind und daher mehrfach an derselben Zelle durchgeführt werden können. Wir zeigen auch, dass man problemlos hochwertige AP-Signale im Millivolt-Bereich aufnehmen kann, die eine minimale Filterung erfordern. Forscher können daher nicht nur akute, sondern auch chronische Arzneimittelstudien in den gleichen Präparaten mit MEAs durchführen. Darüber hinaus ermöglicht diese Technologie die gleichzeitige FP/AP-Messung, die elektrobiome Bibliotheken in kurzer Zeit erzeugt. Angesichts der zunehmenden Betonung der Arrhythmie-Vorhersage und der medikamentösen Kardiotoxizität24,32,33,34,35, Integration von AP-Messung Arzneimittelsicherheits- und Wirksamkeitsbewertungen verbessern.
Hier stellen wir Protokolle für 1) Vorbeschichtung von kryokonservierten hiPSC-CMs zur Reifung, 2) Dissoziierung und Beschichtung von hiPSC-CMs auf Multiwell-MEAs, 3) Aufzeichnung von FPs und APs aus hiPSC-CM-Netzwerken, 4) Segmentierung und Extraktion der Daten für die Analyse und 5) vor. Wiederherstellen der Arrays für die mehrfache Wiederverwendung. Jeder Schritt wurde optimiert und betont kritische Schritte, wo immer relevant. Anforderungen an die Zellanhaftung, um sicherzustellen, dass eine schlagende synzytiale Monoschicht diskutiert und Verfahren für die Multiwell-MEA-Wiederherstellung für sich wiederholende elektrophysiologische Studien erläutert werden. Schließlich wird eine im Labor entwickelte benutzerdefinierte GUI für den AP-Signalextraktions-, Qualitätssicherungs- und Segmentierungsworkflow zur Quantifizierung und Analyse von AP-Parametern vorgestellt.
Protokoll
1. Herstellung von Lösungen und Materialien (siehe Materialtabelle)
-
6-Well-Gewebe-Kultur-Platte Substrat-Beschichtung
- Das Beschichtungssubstrat auf Eis oder bei 4 °C auftauen.
- Bereiten Sie eine 1:100 Beschichtung Substrat Verdünnung in kalten DMEM/F12 Medium. Mischen Sie die Lösung durch langsames Pipettieren.
- Übertragen Sie 2 ml der Beschichtungssubstratlösung (Schritt 1.1.2) pro Bohrung einer 6-Well-Gewebekulturplatte.
- Die beschichtete Gewebekulturplatte sofort bei 37 °C und 5% CO2 für mindestens 7 h im Zellkultur-Inkubator aufstellen und innerhalb von 7 Tagen verwenden.
-
hiPSC-CM Kulturmedium
- Fügen Sie 10 ml CM-Medienergänzung aufgetaut bei 4 °C bis 500 ml CM-Basismedium. Bei 4 °C bis zu 2 Wochen lagern.
- Aliquot benötigte Menge an Medien für den Tag und bringen auf Raumtemperatur vor gebrauchen.
- hiPSC-CM Auftaumedium: Frisch vorbereiten durch Mischen von hiPSC-CM Kulturmedium (Schritt 1.2) mit 10% fetalem Rinderserum (FBS). Bringen Sie das Medium auf Raumtemperatur vor dem Auftauen von CMs für die Suspension.
- Fibronectin 1 mg/ml-Stammlösung: Aliquot 200 l in 1,5 ml sterile Mikrofugenröhrchen und zur späteren Verwendung bei 4 °C gelagert. Bereiten Sie eine Arbeitslösung mit einer Konzentration von 50 g/ml frisch auf Eis vor.
- Multiwell-Reinigungslösung: Kombinieren Sie 0,5 g enzymatisches Reinigungsmittel mit 50 ml sterilem doppeldestilliertem Wasser (ddH2O). Wirbel, um den Inhalt zu mischen. Filtern und lagern Sie bei 4 °C bis zu einer Woche.
2. Vorbeschichtung von kryokonserviertem HiPSC-CM zur Reifung (Abbildung 1)
HINWEIS: Dieser Abschnitt ist zum Auftauen und Kultivieren von HiPSC-CMs gedacht,die mit der feederfreien Monolayer-Methode 3,16 und cryopreserved in flüssigem Stickstoff 10 Tage nach der Differenzierung bei 1-2 Millionen Zellen/Durchstechflasche unterschieden wurden. Zellen aus einer Durchstechflasche werden in zwei substratbeschichtete Brunnen einer 6-Well-Gewebekulturplatte plattiert. Cardiomyozyten neigen dazu, sich an der Unterseite des Rohres zu setzen, so dass sanftes Mischen zum Zeitpunkt der Vorbeschichtung wichtig ist, um eine gleichmäßige Zelldichte über Brunnen hinweg zu erreichen.
- Aliquot 2 ml FBS pro Durchstechflasche hiPSC-CMs, die in ein 15 ml konisches Rohr aufgetaut werden und auf Raumtemperatur bringen.
- Durch das Auftauen von Durchstechflaschen mit kryokonservierten hiPSC-CMs in ein 37 °C-Wasserbad und sanft wirbeln, um nicht mehr als 3 min aufzutauen.
- Den Durchstechflascheinhalt sofort in das FBS-haltige Rohr (siehe Schritt 2.1) übertragen, mit 200 x g 5 min mischen.
- Aspirieren Sie den Überstand und setzen Sie das Zellpellet in 1 ml HiPSC-CM Auftaumedium (siehe Schritt 1.3) pro aufgetauter Durchstechflasche wieder aus. Verwenden Sie eine Transferpipette, um das Pellet durch sanfte Trituration wieder aufzuhängen. Bewerten Sie die Zelllebensfähigkeit.
- Fügen Sie zusätzliche 3 ml Auftaumedium pro Durchstechflasche hiPSC-CM in Schritt 2.4 aufgetaut und mit einer Transferpipette vorsichtig aufhängen, um Zellklumpen weiter zu dissoziieren.
- 2 ml Zellsuspension vorsichtig in jeden Brunnen von substratbeschichteten 6-Well-Platten geben (siehe Schritt 1.1). In Zellkultur-Inkubator bei 37 °Cund 5% CO2 platzieren.
- Ersetzen Sie es nach 24 h und 3 mal wöchentlich für 20 Tage durch frisches hiPSC-CM-Kultivierungsmedium.
HINWEIS: Zellen sollten um 24 h an der Substratbeschichtung haften und spontan bei 48 h Nachplattung schlagen (siehe Video 1 und Video 2).
3. Multiwell MEA Plattensterilisation und Beschichtung (Abbildung 2 und Abbildung 3)
HINWEIS: Das hier beschriebene Protokoll dient zur Vorbereitung von 24-Well-MEA-Platten mit 12 Mikrogold-PEDOT-beschichteten Elektroden auf Glas für die hiPSC-CM-Beschichtung. Vermeiden Sie das Berühren des Bodens der Platte, da dies die Elektroden beschädigen kann.
- Zwei Tage vor der Zellbeschichtung 0,5 ml hiPSC-CM-Kulturmedium (siehe Schritt 1.2) zu jedem Bohrwert hinzufügen und eine Basisaufzeichnung durchführen, um das Signal-Rausch-Verhältnis für die Qualitätsprüfung der MEAs zu überprüfen.
- Die Medien ansaugen, mit sterilem ddH2 O abspülen und unter UV-Licht in einer laminaren Strömungshaube über Nacht sterilisieren.
- Am Tag vor der Zellbeschichtung 0,1 ml FBS zu jedem Brunnen für die hydrophile Behandlung von MEA-Oberflächen hinzufügen. 30 min bei Raumtemperatur inkubieren. Dieser Schritt ist für die Zellanhaftung erforderlich.
- Die FBS ansaugen und mit 0,5 ml sterilem ddH2O pro Brunnen abspülen. Wiederholen Sie dies noch einmal.
- Lassen Sie die Platte über Nacht in der laminaren Strömungshaube trocknen.
- Bereiten Sie eine Arbeitsverdünnung von 50 g/ml Fibronectin in kaltem DMEM/F12 Medium aus dem Bestand vor (siehe Schritt 1.4). Halten Sie die Lösung auf Eis.
- Pipette 5 l der arbeitenden Fibronectin-Verdünnung (siehe 3.6) und geben Sie das Tröpfchen vorsichtig in die Mitte jedes Brunnens, um alle 12 Elektroden abzudecken. Es ist wichtig, schnell über die 24 Brunnen zu arbeiten, um zu verhindern, dass das Tröpfchen trocknet.
- Legen Sie die fibronectinbeschichtete Multiwell-MEA-Platte sofort auf eine erhöhte Oberfläche in eine Befeuchtungskammer, die sterile ddH2O enthält, um die gesamte Telleroberfläche zu bedecken. Legen Sie die Kammer mit der Multiwell-MEA-Platte für 3 h in den Zellkultur-Inkubator.
HINWEIS: Das Platzieren der 24 Well MEA-Platte in einer Befeuchtungskammer ist entscheidend, um zu verhindern, dass Fibronectintröpfchen während der Inkubationszeit austrocknen.
4. hiPSC-CM-Dissoziation und Beschichtung auf Multiwell MEA-Platte (Abbildung 3)
HINWEIS: Starten Sie diesen Schritt etwa 1 h, bevor die MeA-Fibronectin-Inkubation abgeschlossen ist. Stellen Sie sicher, dass die Zelldissoziationslösung bei 37 °C und das iPSC-CM Auftaumedium bei Raumtemperatur liegt. Dissoziationsmethoden wurden für 30 Tage nach der Differenzierung von HiPSC-CMs optimiert, die auf substratbeschichteten 6-Well-Platten kultiviert wurden (siehe Schritt 2), um etwa 90 % lebensfähige CMs für die MEA-Beschichtung zu erhalten. Es sollte darauf geachtet werden, keine Luftblasen während der Trituration einzuführen, um den Zelltod zu verhindern.
- Das Kulturmedium aus jedem Brunnen des 6-Well-Gewebekulturgerichts mit 30 Tagen postdifferenzierter hiPSC-CM-Kultur (siehe Schritt 2.7) ansaugen und mit 2 ml sterilem D-PBS pro Brunnen waschen.
- 1 ml vorgewärmte Zelldissoziationslösung (siehe Materialtabelle)pro Brunnen hinzufügen und 4 min bei 37 °C inkubieren. Verwenden Sie eine Transferpipette, um Zellen zur Dissoziation sanft zu trituieren, um sie zu lockern. Wenn die meisten Zellen noch haften, brüten Sie weitere 3 min bei 37 °C und trituieren Sie erneut. Diese zusätzliche Inkubation sollte zur maximalen Zellwiederherstellung beitragen. Nicht mehr als 7 min inkubieren, da dies zu einer geringen Zelllebensfähigkeit führen könnte.
- Mit einer Transferpipette alle dissoziierten Zellen in einem konischen Rohr mit HiPSC-CM-Auftaumedium (siehe Schritt 1.3) bündeln. Es wird empfohlen, die Zellen mindestens doppelt so viel Medien (2 ml pro Ernte) auszusetzen, um die Aktivität der Zelldissoziationslösung zu blockieren.
- Zentrifuge bei 200 x g für 5 min.
- Die Lösung vorsichtig ansaugen, da das Pellet lose an der Oberfläche befestigt wird, und in 0,1 ml HiPSC-CM-Auftaumedium wieder aufsetzen. Verwenden Sie eine Transferpipette, um das Pellet durch sanfte Trituration ein paar Mal wieder aufzuhängen.
- Aliquot 2 l dissoziierte Zellen und verdünnen mit 18 l Medien in einem 1,5 ml Mikrofuge-Rohr. Fügen Sie 20 L Trypan Blue hinzu und mischen Sie sie für die Zellanzahl und die Durchführbarkeitsbewertung.
- Passen Sie die Zelldichte auf 6.000 Zellen/L an, indem Sie das entsprechende Volumen des HiPSC-CM-Auftaumediums hinzufügen. Das Pellet durch sanftes Flicken ein paar Mal aufhängen. Die hiPSC-CMs lösen sich leicht von Glasoberflächen, besonders wenn sie bei hohen Dichten plattiert werden. Wir haben die Saatdichte und Beschichtungsbedingungen optimiert, um 15 Tage elektrische Aufnahmen zu erreichen.
- Wenn Sie fertig sind, bringen Sie die Multiwell-MEA-Platte zur Zellaussaat in die laminare Durchflusshaube. Es ist wichtig, die folgenden zwei Schritte gut nacheinander durchzuführen, um das Trocknen des Fibronectins zu verhindern.
- Entfernen Sie das Fibronectin-Tröpfchen vorsichtig mit einer P10-Pipette, ohne die Elektroden zu berühren.
- Geben Sie sofort ein 5-L-Zelltröpfchen (30.000 Zellen) in die Mitte des Brunnens der MEA-Platte, die alle 12 Elektroden abdeckt. Wiederholen Sie den Schritt, bis alle 24 Brunnen plattiert sind. Intermittierende Vermischung der Zellsuspension durch Flicken wird empfohlen.
- Legen Sie die Multiwell-MEA-Platte wieder in die lose abgedeckte Befeuchtungskammer und kehren Sie bei 37 °C und 5% CO2 für 3 h für die Zellanhaftung in den Zellkultur-Inkubator zurück.
- Fügen Sie vorsichtig 200 L hiPSC-CM Auftaumedium zu jedem Brunnen hinzu, ohne die Zellen mit einer P200 Pipette zu stören. Fügen Sie das Medium tropfenweise zur Seite des Brunnens hinzu.
- Legen Sie die Multiwell-MEA-Platte wieder in den Zellkultur-Inkubator.
- Ersetzen Sie dies durch ein frisches hiPSC-CM-Kulturmedium bei 24 h-Postplating. Spontanes Schlagen von Kardiomyozyten kann an dieser Stelle beobachtet werden (siehe Video 3).
- Wechseln Sie die Medien alle 2 Tage bis zum Ende der Experimente.
5. hiPSC-CM Elektroporation und Signalerfassung (Abbildungen 4 – 6)
HINWEIS: Dieses Protokoll dient der gleichzeitigen Aufzeichnung von Elektrodensignalen mit hohem Durchsatz (12 Standorte für jeden der 24 Brunnen). Das 24-Well-Multiwell-MEA-System wird mit der Erfassungssoftware verwendet (siehe Tabelle der Materialien). Alle MEA-Aufnahmen werden bei 37 °C durchgeführt.
- Schalten Sie die Schnittstellenplatine ein und initiieren Sie die Erfassungssoftware. Lassen Sie genügend Zeit, damit die Multiwell-MEA-Kopfbühne eine Temperatur von 37 °C erreicht (siehe Pfeil Nr. 1 in Abbildung 4).
- Setzen Sie die Multiwell-MEA-Platte aus Schritt 4 in die Multiwell-MEA-Kopfbühne ein, indem Sie sie über die Aufnahmeplattform gelegt und auf die Schaltfläche Einfügen klicken (siehe Pfeil Nr. 2 in Abbildung 4). Lassen Sie die Temperatur stabilisieren, bevor Sie mit den Aufnahmen beginnen.
-
Anpassen der Erfassungs- und Elektroporationseinstellungen
- Klicken Sie auf das Symbol Experimental Flow definieren (siehe Pfeil Nr. 3 in Abbildung 4) und stellen Sie die Aufnahmezeit auf 2 min oder nach Belieben ein.
- Klicken Sie auf das Symbol Data Acquisition Setup (siehe Pfeil Nr. 4 in Abbildung 4) und stellen Sie die Abtastrate auf 20 kHz, den Hochpassfilter auf 0,1 Hz und den Tiefpassfilter auf 3500 Hz ein.
- Klicken Sie auf das Symbol Stimulator-Einstellungen (siehe Abbildung 5). Definieren Sie unter der Registerkarte Stimulus Definition Stimulation als biphasische symmetrische Spannungsimpulse von 1 mV, 1 ms und 1 Hz. Wählen Sie unter der Registerkarte Stimulationselektroden Elektroporationsstellen aus, indem Sie alle relevanten Elektroden hervorheben.
- Klicken Sie auf die Schaltfläche Erkunden, um Signale in allen Brunnen zu visualisieren. Überprüfen Sie die Signalqualität und die stabilen Zustandsbedingungen. Notieren Sie sich Elektroden mit FP-Signalen im mV-Bereich. Klicken Sie auf dieselbe Schaltfläche, um die Erkundung zu beenden. Bisher wurden keine Daten erfasst.
- Starten Sie die Aufnahme, indem Sie auf die Schaltfläche "Go!"" klicken. Die Elektroden in jedem Brunnen zeigen FP-Signale im Rohdatenfenster an (Abbildung 6). Nach 30 s Aufnahme, klicken Sie auf die Schaltfläche Stimulieren und lassen Sie Elektroporation auf den ausgewählten Standorten für 30 s stattfinden; Klicken Sie dann auf die gleiche Schaltfläche, um die Stimulation zu stoppen und die Aufnahme für die restlichen 60 s fortzusetzen.
HINWEIS: Die aufgezeichnete Datei kann wiedergegeben werden, indem Sie im Dropdown-Menü "Anwendung" in den "Replayer-Modus" wechseln.
6. Multiwell MEA Plattenreinigung zur Wiederverwendung
- Nach abschließenden Experimenten reinigen Sie alle Brunnen in der Multiwell-Platte, indem Sie alle Medieninhalte von jedem Brunnen ansaugen und sorgfältig vermeiden, die Elektrodenoberfläche zu berühren.
- 1 ml steriles ddH2O pro Brunnen hinzufügen. Aspirieren und wiederholen Sie einmal.
- Fügen Sie 0,3 ml Multiwell-Reinigungslösung (siehe Schritt 1.5) pro Brunnen hinzu. Über Nacht bei Raumtemperatur inkubieren, um Zellen und Schutt zu vertreiben.
- Am nächsten Morgen die Lösung aspirieren und mit 1 ml sterilem ddH2O abspülen. 5 - 7 min inkubieren und aspirieren. Wiederholen Sie dies 5 Mal.
- 0,5 ml steriles ddH2O pro Brunnen hinzufügen. Zeichnen Sie die Grundlinie der gereinigten Multiwell-Platte für die Qualitätsprüfung der gereinigten MEAs auf (Abbildung 7).
- Bei 4 °C lagern, bis sie einsatzbereit sind.
7. Datendateikonvertierung und -export
HINWEIS: Für jede Aufzeichnung werden vier Datendateien generiert: MWR-, MWC-, MWD- und MWS-Dateien. Mit der Konverter-Software kann die MWD-Datei zur nachfolgenden Analyse mit einem benutzerdefinierten Skript in eine H5-Datei konvertiert werden (siehe Zusatzdatei 1).
- Initiieren Sie die Konvertersoftware (siehe Tabelle der Materialien).
- Wählen Sie Eingabepfad festlegen im Menü Datei aus. Wählen Sie einen Ordner aus, der Datendateien enthält, die von Interesse sind.
- Wählen Sie Ausgabepfad im Menü Datei festlegen aus. Wählen Sie den Ordner aus, in dem konvertierte Dateien gespeichert werden sollen.
- Markieren Sie die MWD-Datei von Interesse.
- Klicken Sie auf die Schaltfläche EXPORT zu HDF5.
8. Datensegmentierung und -analyse (Abbildungen 8-10)
HINWEIS: Matlab-basierte benutzerdefinierte Software wird verwendet, um verschiedene FP- und AP-Datenparameter zu segmentieren und zu extrahieren. Software ist auf Anfrage verfügbar.
- Führen Sie den Code Wellenformanalyse mit Matlab aus (siehe Abbildung 8 für eine Ansicht des Hauptfensters der GUI).
- Klicken Sie auf Datei und wählen Sie Prozess .h5.
- Suchen und wählen Sie die datei mwd.h5 aus, die gemäß Schritt 7 oben erstellt wurde.
- Klicken Sie auf die Schaltfläche Verzeichnis speichern, um den Speicherort der Ausgabedateien zu ändern.
- Erstellen Sie eine Signalverarbeitungswarteschlange, indem Sie von Interesse sein elektroden-gut-kombinationen auswählen und dann auf die Schaltfläche Warteschlange klicken. Wiederholen Sie diesen Schritt, um weitere Elektroden-/Brunnenkombinationen anzuhängen, die an die Warteschlange verarbeitet werden sollen.
- Bearbeiten Sie die Warteschlange, indem Sie direkt auf Med Name / Med Concentration klicken, wenn Zellen mit Medikamenten behandelt wurden ( Abbildung8).
- Sobald die Warteschlange endgültig ist, klicken Sie auf die Schaltfläche Wellenformen initialisieren. Damit wird die Vorverarbeitung gestartet, bei der Signale identifiziert und zur Segmentierung extrahiert werden.
- Klicken Sie auf die Schaltfläche Zoom In und wählen Sie mit dem Cursor den aktionspotenziellen Interessenbereich aus (Abbildung 9).
- Klicken Sie auf die Schaltfläche Behalten, und überprüfen Sie die Bedienfelder. Für jede Wellenform werden Spitzen (rot 'x') und Tröge (gelbe Kreise) erkannt und die normalisierten Aktionspotentiale überlagert. Klicken Sie auf die Schaltfläche Beibehalten, und fahren Sie mit der nächsten Ablaufverfolgung in der Warteschlange fort (Abbildung 10).
- Wiederholen Sie die Schritte 8.8-8.9 für den Rest der Elektroden-/Well-Kombinationssignale in der Warteschlange.
HINWEIS: Eine CSV-Datei wird mit APD-Parametern generiert, die für jede Wellenform gemessen werden. Eine .mat-Datei für jede .h5-Datei wird ebenfalls gespeichert, um eine zusätzliche Verarbeitung segmentierter Daten zu ermöglichen.
Ergebnisse
Die Lebensfähigkeit und Beschichtungsdichte von post-getobten HiPSC-CMs ist entscheidend für die Multiwell-MEA-Kultur. Die Vorbeschichtung von 1-2 Millionen HiPSC-CMs/Fläschchen in zwei Brunnen einer 6-Well-Gewebekulturplatte mit 50% oder mehr Lebensfähigkeit erzeugt eine gesunde Monolayer-Kultur mit spontanem Schlagen bei 48 h. Schlechte Lebensfähigkeit von CMs führt zu Kulturen mit einem hohen Anteil an Nicht-Myozytenpopulationen. Diese Monolayer, wenn sie für Multiwell-MEA-Beschichtungen dissoziiert werden, führen in der Regel zu inkonsistenten Ergebnissen und schlechten Qualitätssignalen und sollten daher verworfen werden. Abbildung 1 zeigt Beispiele für optimale vs. suboptimale HiPSC-CMs-Kulturen bei 48 h-Postplating. Das Auftauen der CMs auf substratbeschichteten Gewebekulturplatten statt direkt auf Multiwell-MEAs ermöglicht die Zellrückgewinnung und Reifung3. Eine direkte Beschichtung von kryokonservierten CMs auf dem Array wird nicht empfohlen, da sie zu inkonsistenten Ergebnissen führt.
Neben der Qualität der dissoziierten CMs ist die Zellanhaftung auf Multiwell-MEA stark von der Zelldichte und der Fibronectin-Beschichtungstechnik abhängig. Die Größe des Fibronectin-Tröpfchens ist entscheidend, da die CMs den Grenzen des Fibronectin-beschichteten Bereichs entsprechen. Aus diesem Grund werden nur 5 l der Fibronectin-Lösung direkt über den Elektroden-Array-Bereich abgegeben. Damit sich das Tröpfchen nicht verteilt, muss die Brunnenoberfläche zum Zeitpunkt der Beschichtung vollständig trocken sein. Abbildung 2 zeigt das Layout der Multiwell-MEA-Platte mit Schaltplänen der Schritt-für-Schritt-Vorbehandlung für eine optimale Vorbereitung. Um zu verhindern, dass das Fibronectin austrocknet, müssen die Multiwell-MEA-Platten während der Inkubationszeit, die nicht länger als 3 h dauert, in einer Befeuchtungskammer platziert werden (siehe Schritt 3.8). Sobald die Inkubationszeit abgeschlossen ist, ist es wichtig, das Fibronectin Tröpfchen aus jedem Brunnen kurz vor der CM-Beschichtung zu entfernen und erst dann mit der nächsten gut plattieren. Schnelles und sorgfältiges Dosieren der CMs ist der Schlüssel zu einer erfolgreichen Zellanhaftung.
hiPSC-CM-Kulturen nach 30 Tagen nach der Differenzierung werden für die Multiwell-MEA-Beschichtung mit der enzymatischen Zelldissoziationsmethode dissoziiert (siehe Schritt 4). CMs werden um 3 h an den fibronectinbeschichteten MEA-Oberflächen befestigt und eine Monoschicht, die die Arrays bedeckt, wird nach 24 h Nachbeschichtung sichtbar sein (Abbildung 3). Synchrones Schlagen der Monoschicht wird bei 24-48 h beobachtet. Zelltröpfchendispersion wirkt sich auf die Kulturdichte aus oder führt sogar zum Trocknen und Zelltod. Eine präzise Zellplatzierung direkt auf dem Array ist von größter Bedeutung und daher muss die Technik für eine optimale Beschichtung geübt werden. Die Zellhaftung an der Referenzelektrode behindert die elektrische Signalproduktion. Siehe Abbildung 3 für Bilder von optimaler CM-Platzierung und Kultur nach 24 h.
Die CMs, die auf Multiwell-MEAs kultiviert werden, werden einer Qualitätsprüfung für elektrische Aktivität bei 48 h Postplating unterzogen. Typischerweise erhöht sich die FP-Signalamplitude von 'V-Bereich zu mV in ca. 4 Tagen3. Wenn 50 % der Elektroden innerhalb eines Netzes und 70 % der gesamten Netze keine FP-Signale erzeugen, dann sind das Netz oder die Kultur suboptimal und sollten verworfen werden. Für die FP- und AP-Analyse werden nur Kulturen verarbeitet, die die Qualitätsprüfung bestehen. Abbildung 6 zeigt Beispiele für gute und unternormige FP-Signale.
Elektroporationsvermittelte AP-Aufnahmen können mehrfach aus Kulturen 48 h post-MEA-Beschichtung erhalten werden. Mit Elektroporation erhielten wir intrazellulären Zugang zu rekordhochauflösenden APs aus mehreren hiPSC-abgeleiteten Kardiomyozytennetzwerken. Niederspannungsimpulse (1 V, 1 ms, 1 Hz) für 30 s wurden für die transiente, reversible Umwandlung von FP in AP geliefert. Die Elektroporation ermöglicht einen erfolgreichen intrazellulären Zugang zur AP-Messung in ca. 75% der Elektroden. Elektrische Signale werden für 2 min aufgezeichnet, die 30 s Vorelektroporation, 30 s während und 1 min Nachelektroporation umfassen. Ein Zug von 10 s AP-Wellenformen 10 s Post-Elektroporation werden an allen Standorten für Signalqualität und Analyse ausgewertet. Jede Spur, die nicht dem reinen AP-Signal entspricht, wird verworfen. Um zu untersuchen, ob AP-Amplituden mit dem FP-Signal korrelieren, haben wir alle 288 Standorte elektropoiert, um gleichzeitig Wellenformen aufzuzeichnen. Repräsentative FP- und AP-Signale, die von der gleichen Zellstelle von zwei verschiedenen Elektroden aufgezeichnet wurden, sind in Abbildung 11Adargestellt. Wir beobachteten keine Korrelation zwischen FP-Amplituden und AP-Amplituden nach der Elektroporation, die von derselben Zellstelle aufgezeichnet wurden. Darüber hinaus hatten mehrere Elektroporationen derselben Zellstelle bei 0, 24, 48, 72 und 96 h keine signifikanten Auswirkungen auf die AP-Form im Laufe der Zeit (Abbildung11B).
Angesichts des hohen Durchsatzcharakters des Systems ist eine manuelle Technik zur Extraktion und Quantifizierung von Sehenswürdigkeiten wie RR-Intervall, momentaner Frequenz und Differentialwirkungspotenzialdauer ineffizient und zeitaufwändig. Ein maßgeschneidertes MATLAB-Skript, das der Forschungsgemeinschaft auf Anfrage zur Verfügung steht, wird verwendet, um Wellenformmessungen mit einer Auflösung von 1 s durchzuführen. Elektroporationszeitpunkte werden mit dem extrahierten Signal überlagert, um 10 s AP-Nachelektroporation zu identifizieren, um Signalextraktions-, Qualitätssicherungs- und Segmentierungs-Workflows durchzuführen (Abbildung 8, Abbildung 9, Abbildung 10). Die Benutzeroberfläche ermöglicht die Auswahl des gewünschten Segments unter Verwendung der überlagerten Elektroporationsanzeigen als Leitfaden. Die segmentierte Wellenform wird von Unterroutinen verarbeitet, um einzelne AP-Wellenformen weiter zu identifizieren. Dies wird durch Peak-Erkennung abgeschlossen, bei der die höchste und niedrigste Spannung für jeden Zyklus identifiziert wird. Sobald dieser Prozess abgeschlossen ist, werden die Amplituden normalisiert, und die assoziierenden Zeitvektoren werden verschoben, um die Zeit Null bei einem Spitzenwert von 1 zu definieren. Die Interpolation von Schnittpunkten entlang der einzelnen Zyklen wurde verwendet, um APD-Messungen zu bestimmen. So ermöglicht der partielle Automatisierungsworkflow für die AP-Wellenformsegmentierung eine effiziente Datenanalyse für verschiedene APD-Parameter über mehrere Batches von Kulturen in kurzer Zeit hinweg. Weitere Automatisierung der Inklusions- und Ausschlusskriterien für FPs und APs ist für die Echtzeit-Datenanalyse im Gange.
Ein wesentlicher Vorteil der Multiwell-MEA-Platte ist, dass sie mehrfach wiederverwendet werden kann. Diese Wiederherstellung ermöglicht sich wiederholende elektrophysiologische Studien für eine kostengünstige und konsistente Datenerfassung. Aufnahmen von APs aus demselben Array nach 6 Wiederherstellungen sind in Abbildung 12dargestellt. Das Signal-Rausch-Verhältnis ist bei mehreren Wiederverwendungen ähnlich. Um die Zuverlässigkeit des Arrays für sich wiederholende elektrophysiologische Studien zu demonstrieren, werden insgesamt 3815 AP-Wellenformen aus drei Restaurationschargen gepoolt und AP-Dauerdaten extrahiert, um die Wiederholbarkeit der Ergebnisse zu untersuchen. Angezeigt werden Verteilungsdiagramme für die einzelnen Wellenformen APD30, APD80, Triangulation (APD80—APD30) und Fraktionverkürzung ((APD80—APD30)/(APD80)) (Abbildung 13).

Abbildung 1: Vorbeschichtung von kryokonserviertem HiPSC-CM für die Reifung. (A) Zellverarbeitung zur Vorbeschichtung 1 Durchstechflasche von 10 Tagen nach der Differenzierung kryokonservierte hiPSC-CMs. (B) Phasenkontrastbilder erfolgreicher (links) und erfolgloser (rechts) hiPSC Kulturen. Maßstabsleiste: 275 m. Siehe Video 1 und Video 2 für erfolgreiche 14 und 24 Tage Nachdifferenzierungskulturbeispiele. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Multiwell MEA Plattenaufbau und -vorbereitung. (A) Multiwell MEA Plattenschemata: Die Platte besteht aus 24 Bohrungen (A1 bis D6), die jeweils 12 Mikroelektroden-Arrays und 4 periphere Referenzelektroden enthalten. Elektrodendurchmesser: 30 m / Zwischenelektrodenabstand: 300 m. Aufnahmen können gleichzeitig von den 288 Elektroden erhalten werden. (B) Sterilisations- und hydrophile Behandlungsschritte, die vor der HiPSC-CM-Beschichtung durchzuführen sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: hiPSC-CM-Dissoziation und Beschichtung auf Multiwell MEA-Platte. (A) Schemata der hiPSC-CM MEA-Beschichtungsschritte für jeden Brunnen. (B) Mikroskopisches Bild zur Veranschaulichung der korrekten Zelltröpfchenplatzierung, das alle 12 Elektroden abdeckt, ohne sich auf die 4 Referenzelektroden auszubreiten. (C) Phasenkontrast mikroskopische Bilder einer beispielhaften (links) und suboptimalen (rechts) hiPSC-CM-Platte auf MEA bei 24 h Nachplattung. Skala bar= 275 'm. Siehe Video 3 für erfolgreiches MEA-Beschichtungsbeispiel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Multiwell-Screen-Erfassungssoftware. Pfeile zeigen die Position der wichtigsten Features und Funktionen an, auf die im Text verwiesen wird: Temperaturregelung (1) ermöglicht eine Echtzeit-Temperaturüberwachung während des gesamten Experiments. Insert/Eject (2) drücken Sie die Multiwell MEA-Platte ein und lösen Sie sie los. Die Funktion Experimental Flow (3) definieren ermöglicht es dem Benutzer, die Dauer der Aufzeichnung festzulegen. Die Funktion Data Acquisition Setup (4) ermöglicht es dem Benutzer, die Einstellungen für die Abtastrate und den Erfassungsfilter festzulegen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: hiPSC-CM Elektroporation und Signalerfassung . Stimulus Definition Registerkarte ermöglicht es dem Benutzer, die elektroporating Pulsparameter zu definieren. Stimulation Elektroden Registerkarte ermöglicht es dem Benutzer, die Elektroporating-Elektroden zu wählen. Eine beliebige Kombination der 288 Elektroden kann ausgewählt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Qualitätsprüfung von Multiwell-MEAs für elektrische Aktivitäten. Multiwell - Bildschirmerfassungssoftware mit Rohdatenfenstern mit repräsentativen Beispielen für optimale (A) und sub-standard (B) FP-Signale. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: FP- und AP-Signale aus dem neuen und wiederhergestellten Array. Multiwell MEA enzymatische Reinigungsschritte (A). Das Basissignal des neuen Arrays zeigt ein minimales Signal-Rausch-Verhältnis (B) und FP-Signale zeigen die elektrische Aktivität des Netzwerks (C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Datensegmentierung und -analyse. Ansicht des Hauptfensters der GUI für die Wellenformanalyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 9: Datensegmentierung und -analyse. Initialisieren Sie die Schaltfläche Wellenformen, um AP-Wellenformen für die Segmentierung zu identifizieren und zu extrahieren und um die vorläufige Verarbeitung zu starten, indem Sie den Aktionspotenzialbereich vergrößern und auswählen. Rote Kreise sind die Elektroporationsindikatoren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 10: Datensegmentierung und -analyse. Für jede Wellenform werden Peaks (rot 'x') und Tröge (gelbe Kreise) erkannt und die normalisierten APs für eine Qualitätsprüfung der Wellenformen überlagert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 11: AP-Amplitudenabhängigkeit vom FP-Signal für mehrere Aufnahmen von derselben Zellenstelle. DIE FP-Amplitude in den BereichenA, oben links) oder mV -Bereichen (A , oberes rechtes Panel), die von zwei unabhängigen Elektroden aufgezeichnet werden, erzeugen AP-Amplitude im mV-Bereich (A , unten links und rechts), die keine Korrelation zwischen FP-Amplituden und AP-Amplituden nach der Elektroporation. Die normalisierten AP-Wellenformen für jede Aufnahme werden wie für jede Aufnahme gezeigt überlagert. Mehrere Elektroporationen der gleichen Zellstelle bei 0 bis 96 h erzeugten hochwertige AP-Wellenformen, die die Verfolgung der Membranelektrodynamik ermöglichten (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
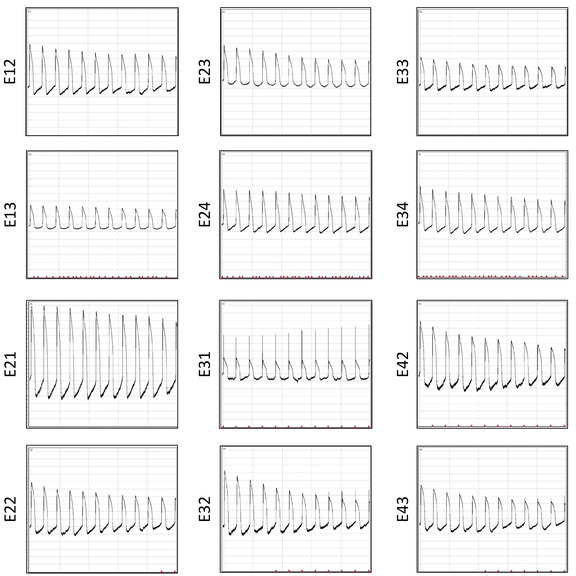
Abbildung 12: AP-Aufnahmen nach sechs Restaurationen. AP-Wellenformen, die gleichzeitig 10 s Nachelektroporation über 12 Elektroden aus dem gleichen Brunnen aufgezeichnet werden, werden angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 13: APD-Parameterhistogramme aus mehreren Restaurationen. Verteilungsdiagramme für die einzelnen Wellenformen APD30 (A), APD80 (B), Triangulation (APD80—APD30) (C) und Fraktionverkürzung ((APD80—APD30)/(APD80)) (D) angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Dateien. Videos 1-3. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Im Laufe der Jahre beschränkte sich die Anwendung von MEAs auf die Durchführung von FP-Messungen von erregbaren Zellen, um ihre elektrophysiologischen Eigenschaften zu untersuchen36,37,38,39. Nur wenige Gruppen haben AP-Spuren von elektrogenen Zellen mit benutzerdefinierter MEA-basierter Technologie18,29,30gemeldet. Diese Ansätze wurden jedoch nicht auf wiederholte Aufnahmen von denselben Präparaten untersucht. Wir haben eine innovative und genaue Methodik entwickelt, um APs von der gleichen Zelle über Tage in mehreren hiPSC-CM-Netzwerken gleichzeitig zu untersuchen3. In unserer veröffentlichten Studie wurde eine multiwell Micro-Gold MEA-Plattform eingesetzt, um AP-Wellenformbibliotheken aus mehreren Chargen von hiPSC-CM-Kulturen mit hoher Präzision und einer zeitlichen Auflösung von 1 s zu generieren. Das hier beschriebene Protokoll erklärt das Seeding von hiPSC-CMs auf dem Array für die effiziente Entwicklung von synzytialen CM-Netzwerken für AP-Aufnahmen mit hohem Durchsatz. Mehrere kritische Schritte im Protokoll sind: 1) Herstellung mehrerer hochreiner Chargen von qualitätskontrollierten CMs für das Kryokonservierungsbanking, 2) hochwertig nach tauende CMs zur Vorbeschichtung und Reifung, 3) Behandlung der Multiwell-MEA-Platte für CM Saat, 4) hiPSC-CM-Kulturdissoziation nach 30 Tagen nach der Differenzierung für die MEA-Beschichtung und 5) Wiederherstellung der MEAs für die mehrfache Wiederverwendung.
Es ist wichtig zu beachten, dass Batch-zu-Batch-Variation in der HiPSC-Differenzierung experimentelle Ergebnisse beeinflussen könnte. Die monolayer Differenzierungsmethode wurde intern für eine hohe Prozent-Kardiomyozytenproduktionoptimiert 3,40. Die FACS-Analyse von MLC2v- und TNNT2-Markern unserer Kulturen zeigt einen 90% ventrikulären Phänotyp3. Diese qualitätskontrollierten Kulturen sind für experimentelle Studien kryokonserviert. Die aktuellen Differenzierungsansätze ergeben eine heterogene Mischung aus Knoten-, Atrial- und Ventrikel-ähnlichen Zellen3,16,17,41. Daher können Strategien zur Anreicherung der CM-Subtyppopulation die Spezifität der Kulturen weiter verbessern. Darüber hinaus können Gewebe-Engineering-Ansätze eingesetzt werden, um ihre Reifung zu verbessern. Die hier vorgeschlagenen Methoden können leicht für andere CM-Quellen implementiert werden.
Die mit MEA aufgezeichneten AP-Wellenformen ähnelten denen, die von Netzwerken von Kardiomyozyten durch optische Kartierung42,43, komplementärmetalloxid-Halbleiter-basierte MEA18,21und simulierte AP aufgezeichnet wurden. mit FP-Aufnahmen20. Um den Mechanismus der AP-Messungen über MEA Hai und Spira25 anzugehen, zeigte sich, dass die Elektroporen-Elektroden-Schnittstelle die etablierte scharfe Glasmikroelektrodentechnik imitiert. Das Ruhende Membranpotential und die wahren Amplitudenwerte in unserer Studie können jedoch nicht nachgewiesen werden, da die Elektroporen-Elektroden-Schnittstelle in MEA-Systemen nicht kalibriert ist und die Amplitude eine Funktion der Empfindlichkeit und Auflösung der technik. Unser Ansatz hat ähnliche Einschränkungen wie das optische Mapping, wenn es um AP-Amplitude geht.
Die hier berichteten FP/AP-Auslesungen auf MEA-Basis eröffnen neue Möglichkeiten für die Beurteilung der Arzneimittelsicherheit. Obwohl spontan, schlagen diese hiPSC-CM-Monolayer mit konstanten Raten. Die Analyse von APD-Parametern über mehrere Netzwerke hinweg liefert Einblicke in die elektrische Heterogenität (Abbildung 13). Umfassende APD-Restitutionsanalysen müssen jedoch vorhergehende diastolische Intervalle umfassen. Darüber hinaus sind hochwertige AP-Wellenformen, die von der gleichen Zellstelle über 96 h aufgezeichnet wurden (Abbildung 11B) der erste Bericht, der die Membranelektrodynamik im Laufe der Zeit verfolgt, die für die Entwicklung und die Krankheit von Wert sein wird.
Das hier beschriebene Protokoll zur Quantifizierung von AP-Parametern kann verwendet werden, um Dosis-Wirkungs-Kurven zu Testverbindungen zu erzeugen. Wie vor kurzem von Edwards et al.3berichtet, Dosis-Reaktion von Noradrenalin, Isoproterenol und E 4031 werden für APD in verschiedenen Repolarisationsphasen geplottet. Die veröffentlichte Studie zeigte die Genauigkeit und Zuverlässigkeit des Ansatzes zur Identifizierung der dosisabhängigen subtilen Veränderungen in den AP-Wellenformen in Echtzeit. Diese Technik könnte leicht für andere Verbindungen oder kleine Molekülbibliotheken erweitert werden, um verschiedene elektrophysiologische Reaktionen zu verstehen.
Der in dieser Studie vorgestellte MEA-basierte Ansatz für AP-Messungen wird nicht nur für Elektrophysiologen, sondern auch für Zellbiologen und In-Silico-Modellierer von Interesse sein. Darüber hinaus werden FP/AP-Aufnahmen von derselben Zellsite auf hiPSC-CMs es Forschern ermöglichen, innerhalb kurzer Zeit bioelektrische Datenbibliotheken mit einer Vielzahl von erregbaren Mobilfunknetzen zu erstellen. Die Verfügbarkeit dieser Ressourcen wird für Die Entdeckung von Arzneimitteln und die Modellierung von Krankheiten von Nutzen sein.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
nichts
Materialien
| Name | Company | Catalog Number | Comments |
| Accutase | Sigma Aldrich | A6964-100ML | cell dissociation solution |
| Acquisition software | Multichannel Systems | Multiwell-Screen v 1.9.2.0 | |
| B27 Supplement | ThermoFisher | 17504-044 | CM media supplement |
| Converter software | Multichannel Systems | MultiChannel DataManager | |
| DMEM/F12 | ThermoFisher | 11330-032 | |
| D-PBS | ThermoFisher | 14190-250 | |
| FBS | Fisher Scientific | SH3007103HI | |
| Fibronectin | Sigma Aldrich | F1141-5MG | |
| Geltrex | ThermoFisher | A1413202 | coating substrate |
| Interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot Interface Board | |
| Multiwell MEA Plate | Multichannel Systems | 24W300/30G-288 | |
| RPMI 1640 | ThermoFisher | 11875-093 | CM base medium |
| Terg-a-zyme | Sigma Aldrich | Z273287-1EA | enzymatic detergent |
| Transfer pipettes, individually wrapped | Fisher Scientific | 1371148 | |
| Trypan Blue | Sigma Aldrich | T8154-100ML | |
| Ultrapure sterile water | ThermoFisher | 10977-023 | |
| 6-well tissue-culture treated plates | Fisher Scientific | 08-772-1B |
Referenzen
- Dambrot, C., Passier, R., Atsma, D., Mummery, C. L. Cardiomyocyte differentiation of pluripotent stem cells and their use as cardiac disease models. Biochemical Journal. 434 (1), 25-35 (2011).
- Dunn, K. K., Palecek, S. P. Engineering Scalable Manufacturing of High-Quality Stem Cell-Derived Cardiomyocytes for Cardiac Tissue Repair. Frontiers in medicine. 5, (2018).
- Edwards, S. L., et al. A Multiwell Cardiac muGMEA Platform for Action Potential Recordings from Human iPSC-Derived Cardiomyocyte Constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Huebsch, N., et al. Miniaturized iPS-Cell-Derived Cardiac Muscles for Physiologically Relevant Drug Response Analyses. Scientific Reports. 6, 24726(2016).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sharma, A., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes to assess drug cardiotoxicity. Nature Protocols. , (2018).
- Zhang, D., et al. Tissue-engineered cardiac patch for advanced functional maturation of human ESC-derived cardiomyocytes. Biomaterials. 34 (23), 5813-5820 (2013).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: the matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically Defined Culture and Cardiomyocyte Differentiation of Human Pluripotent Stem Cells. Current Protocols in Human Genetics. 87, (2015).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Burridge, P. W., Zambidis, E. T. Highly efficient directed differentiation of human induced pluripotent stem cells into cardiomyocytes. Methods in Molecular Biology. , 149-161 (2013).
- Laflamme, M. A., et al. Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts. Nature Biotechnology. 25 (9), 1015-1024 (2007).
- Sharma, A., et al. Derivation of highly purified cardiomyocytes from human induced pluripotent stem cells using small molecule-modulated differentiation and subsequent glucose starvation. Journal of Visualized Experiments. (97), (2015).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), (2014).
- Zhang, J., et al. Functional cardiomyocytes derived from human induced pluripotent stem cells. Circulation Research. 104 (4), e30-e41 (2009).
- Jans, D., et al. Action potential-based MEA platform for in vitro screening of drug-induced cardiotoxicity using human iPSCs and rat neonatal myocytes. Journal of Pharmacological and Toxicological Methods. 87, 48-52 (2017).
- Strauss, D. G., Blinova, K. Clinical Trials in a Dish. Trends in Pharmacological Science. 38 (1), 4-7 (2017).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communications. 497 (4), 1135-1141 (2018).
- Braeken, D., et al. Open-cell recording of action potentials using active electrode arrays. Lab Chip. 12 (21), 4397-4402 (2012).
- Otsuji, T. G., et al. Progressive maturation in contracting cardiomyocytes derived from human embryonic stem cells: Qualitative effects on electrophysiological responses to drugs. Stem Cell Research. 4 (3), 201-213 (2010).
- Shinozawa, T., Imahashi, K., Sawada, H., Furukawa, H., Takami, K. Determination of appropriate stage of human-induced pluripotent stem cell-derived cardiomyocytes for drug screening and pharmacological evaluation in vitro. Journal of Biomolecular Screening. 17 (9), 1192-1203 (2012).
- Raphel, F., et al. Identification of Ion Currents Components Generating Field Potential Recorded in MEA From hiPSC-CM. IEEE Transactions on Biomedical Engineering. 65 (6), 1311-1319 (2018).
- Hai, A., Spira, M. E. On-chip electroporation, membrane repair dynamics and transient in-cell recordings by arrays of gold mushroom-shaped microelectrodes. Lab Chip. 12 (16), 2865-2873 (2012).
- Xie, C., Lin, Z., Hanson, L., Cui, Y., Cui, B. Intracellular recording of action potentials by nanopillar electroporation. Nature Nanotechnology. 7 (3), 185-190 (2012).
- Cohen, A., Shappir, J., Yitzchaik, S., Spira, M. E. Reversible transition of extracellular field potential recordings to intracellular recordings of action potentials generated by neurons grown on transistors. Biosensors and Bioelectronics. 23 (6), 811-819 (2008).
- Ojovan, S. M., et al. A feasibility study of multi-site,intracellular recordings from mammalian neurons by extracellular gold mushroom-shaped microelectrodes. Scientific Reports. 5, 14100(2015).
- Shmoel, N., et al. Multisite electrophysiological recordings by self-assembled loose-patch-like junctions between cultured hippocampal neurons and mushroom-shaped microelectrodes. Scientific Reports. 6, 27110(2016).
- Lin, Z. C., Xie, C., Osakada, Y., Cui, Y., Cui, B. Iridium oxide nanotube electrodes for sensitive and prolonged intracellular measurement of action potentials. Nature Communications. 5, 3206(2014).
- Stett, A., Burkhardt, C., Weber, U., van Stiphout, P., Knott, T. CYTOCENTERING: a novel technique enabling automated cell-by-cell patch clamping with the CYTOPATCH chip. Receptors Channels. 9 (1), 59-66 (2003).
- Kanda, Y., Yamazaki, D., Osada, T., Yoshinaga, T., Sawada, K. Development of torsadogenic risk assessment using human induced pluripotent stem cell-derived cardiomyocytes: Japan iPS Cardiac Safety Assessment (JiCSA) update. Journal of Pharmacological Sciences. 138 (4), 233-239 (2018).
- Yang, X., Papoian, T. Moving beyond the comprehensive in vitro proarrhythmia assay: Use of human-induced pluripotent stem cell-derived cardiomyocytes to assess contractile effects associated with drug-induced structural cardiotoxicity. Journal of Applied Toxicology. 38 (9), 1166-1176 (2018).
- Sala, L., Bellin, M., Mummery, C. L. Integrating cardiomyocytes from human pluripotent stem cells in safety pharmacology: has the time come. British Journal of Pharmacology. 174 (21), 3749-3765 (2017).
- Zlochiver, V., Edwards, S., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Del Alamo, J. C., et al. High throughput physiological screening of iPSC-derived cardiomyocytes for drug development. Biochimica et Biophysica Acta. 1863 (7 Pt B), 1717-1727 (2016).
- Clements, M. Multielectrode Array (MEA) Assay for Profiling Electrophysiological Drug Effects in Human Stem Cell-Derived Cardiomyocytes. Current Protocols in Toxicology. 68, 21-22 (2016).
- Navarrete, E. G., et al. Screening drug-induced arrhythmia [corrected] using human induced pluripotent stem cell-derived cardiomyocytes and low-impedance microelectrode arrays. Circulation. 128 (11 Suppl 1), S3-S13 (2013).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Zlochiver, V., Edwards, S. L., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Waas, M., et al. Are These Cardiomyocytes? Protocol Development Reveals Impact of Sample Preparation on the Accuracy of Identifying Cardiomyocytes by Flow Cytometry. Stem Cell Reports. , (2019).
- Gorospe, G., et al. Automated grouping of action potentials of human embryonic stem cell-derived cardiomyocytes. IEEE Transactions on Biomedical Engineering. 61 (9), 2389-2395 (2014).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics & Molecular Biology. 120 (1-3), 3-17 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten