Method Article
Eine minimalinvasive Läsionstechnik für Muskeln, die dem Odontophore von Aplysia californica innewohnen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll zur minimalinvasiven chirurgischen Läsion von Muskeln vor, die dem Fütterungsapparat der Meeresmolluske Aplysia californica innewohnen, um die Rolle dieser Muskeln während des Fütterungsverhaltens zu verstehen.
Zusammenfassung
Aplysia californica ist ein Modellsystem zur Untersuchung der neuronalen Kontrolle von Lernen und Verhalten. Dieses Tier verfügt über ein halboffenes Kreislaufsystem, das es ermöglicht, auf viele seiner inneren Strukturen zuzugreifen, ohne nennenswerte Schäden zu verursachen. Viele Manipulationen können sowohl in vivo als auch in vitro leicht durchgeführt werden, was es zu einem hochgradig transportablen Modell für die Analyse von Verhalten und neuronalen Schaltkreisen macht. Um die Funktionen der Muskeln innerhalb des Futtergreifers besser zu verstehen, haben wir eine Technik entwickelt, um sie zu läsionen, ohne die Hauptkörperhöhle des Tieres zu öffnen oder die äußeren Schichten des Fütterungsorgans (d.h. die bukkale Masse) zu beschädigen. Bei dieser Technik wird der Greifer teilweise immer wieder verzahnt, was einen direkten Zugang zur Muskulatur ermöglicht. Dieses Verfahren ermöglicht es Tieren, sich schnell und zuverlässig zu erholen. Dies hat es ermöglicht, die I7-Muskeln und subradulären Fasern zu läsion, so dass wir zeigen, dass beide Muskeln wesentlich zur Öffnung in vivo beitragen.
Einleitung
Das Fütterungssystem von Aplysia californica hat eine lange Geschichte der Verwendung als Modellsystem für das Verständnis von Lernen und Gedächtnis1, motivierte Verhaltensweisen2,3, und die Interaktion zwischen Verhalten, Biomechanik und neuronale Steuerung während der Fütterung4. Es hat hoch zugängliche neuronale Schaltungen, mit einer relativ kleinen Anzahl von großen, identifizierbaren Neuronen. Das Tier verfügt über ein halboffenes Kreislaufsystem, das es ermöglicht, auf viele seiner inneren Strukturen zuzugreifen, ohne nennenswerte Schäden zu verursachen. Es ist auch robust für viele Manipulationen sowohl in vivo als auch in vitro, so dass es ein hoch gradlierbares Modell für die Analyse von Verhalten und neuronalen Schaltkreisen.
Um die neuronalen Muster zu verstehen, die zu Fütterungsverhalten führen, ist es wichtig, die zugrunde liegende Mechanik der weichen Struktur zu beschreiben, aus der das Fütterungsorgan besteht, die bukkale Masse4. Während es Arbeit getan wurde, um die äußeren Muskeln zu charakterisieren, die die bukkale Massebilden 5,6, die inneren Muskeln der zugrunde liegenden Struktur innerhalb der bukkalen Masse, die die Oberfläche des Greifers steuert, die Odontophore, wurden für In-vivo-Experimente weitgehend unzugänglich. Obwohl es In-vitro-Studien über die Funktionen einiger dieser Muskeln7,8, der Mangel an direktem Zugang zu diesen Muskeln hat es schwierig gemacht, ihre Rolle bei intakten, verhaltenden Tieren zu studieren.
Die meisten Techniken für Elektrodenimplantation oder Läsionen in Aplysien oder ähnlichen mollusken Arten erfordern, dass die Körperwand geöffnet werden9,10,11,12. Das Öffnen der Körperwand verursacht Epithelverletzungen, und der Schnitt muss sicher versiegelt werden, um eine Hämolymphe zu verhindern. Noch ernstere Schwierigkeiten ergeben sich beim Versuch, die inneren Muskeln des Greifers von Aplysia (Muskeln, die der Radularoberfläche oder innerhalb des Odontophores zugrunde liegen) zu erreichen: Nachdem man durch die Hauptkörperhöhle eingetreten ist, muss man dann durch einige Teil der Muskelwand der bukkalen Masse, um Zugang zu den inneren Strukturen zu erhalten (Abbildung 1A). Diese akkumulierte Verletzung und Zugangsschwierigkeiten haben den Ansatz mit herkömmlichen Mitteln problematisch gemacht, da sich die Tiere nicht gut von diesen Operationen erholen (von Tieren mit vollen Eversionen haben nur 17% eine Fütterungsfähigkeit wiedererlangt, N = 12. Rund 85 % der Tiere ohne Entbehrlichkeit erhielten die Fähigkeit zu füttern, N = 84).
Der I7-Muskel, der als Radularöffner8charakterisiert wurde, befindet sich tief im Odontophore selbst, was den Zugang weiter erschwert. Es erstreckt sich zwischen der Basis des Radularstiels (Abbildung 1C) und der Unterseite der Radularoberfläche, durch ein Lumen im Odontophore (Abbildung 1C). Auf drei Seiten der I7 Muskeln sind Wände von Muskeln, und die vierte Wand besteht aus dem radulären Stiel. Für die Zwecke einer biomechanischen Studie würde eine größere Beeinträchtigung einer dieser Strukturen die normale Funktion des Fütterungsgeräts beeinträchtigen. Wir entwickelten einen neuartigen Ansatz, den Odontophore durch die Kiefer herauszuarbeiten und die Operation durch einen Schnitt auf die dünne, knorpelförmige Radularoberfläche durchzuführen, der es ermöglichte, den I7-Muskel sowie neu beschriebene feine Muskelfasern, die direkt unter der Radularoberfläche verlaufen, die wir als die subradularen Fasern bezeichnen (Abbildung 1C).
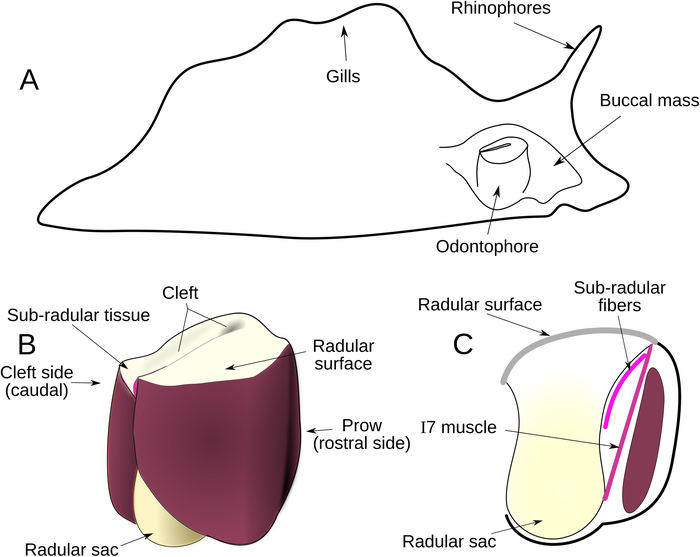
Abbildung 1: Anatomische Übersicht. (A) Lage der bukkalen Masse innerhalb von Aplysia. (B) Externe Anatomie des Odontophores. Die Oberfläche von Radula und Radularsack sind gelb; Muskeln, die das Odontophore komponieren, werden in Rot dargestellt, basierend auf ihren tatsächlichen Farben. (C) SagittalAbschnitt von Odontophore, zeigt die Lage der subradularen Fasern (gekrümmte rosa Linie) und I7 Muskel (gerade rosa Linie). Der Querschnitt des I6-Muskels ist dunkelrot dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Aplysien sind wirbellose Tiere und unterliegen daher keiner IAUC-Zulassung. Um Beschwerden für Tiere zu minimieren, stellen Sie sicher, dass sie vollständig beästhetisiert werden, bevor Sie die unten beschriebenen chirurgischen Techniken anwenden.
1. Tierauswahl und Anästhesisierung
- Wählen Sie ein aktives Tier aus, indem Sie es Algen anbieten und bestätigen, dass die Bissintervalle nicht größer als zwischen 3 und 5 s sind.
-
Anästhesisieren Sie das Tier mit 0,333 moligem Magnesiumchlorid (siehe Tabelle 1), indem Sie in der Nähe des Kopfes mit einer 18 G Nadel auf eine 60 ml Spritze injizieren, so dass die höchste Konzentration von Anästhetikum um die bukkale Masse herum liegt.
- Achten Sie darauf, sowohl das äußere Epithel als auch die innere Gewebeschicht mit der Nadel zu durchdringen. Stellen Sie sicher, dass die Injektion ungefähr unter dem Rhinophore, auf halbem Weg zwischen dem Rhinophore und dem Fuß, und die Nadel sollte schräg eintreten, in Richtung der Kiefer zeigen.
- Nach 10 min versuchen Sie vorsichtig, einen Stift in die Kieme und Rhinophore einzufügen, um zu überprüfen, dass diese sich nicht zurückziehen, um eine ausreichende Anästhesie zu gewährleisten.
- Stellen Sie sicher, dass die Lippen und der Kiefer der Schnecke entspannt sind, damit das Odontophore freigelegt werden kann.
HINWEIS: Die Falten bildung auf den Lippen von Abbildung 2A zeigt an, dass die Lippen und der Kiefer des Tieres nicht entspannt genug sind, um den chirurgischen Eingriff ohne Beschädigung durchzuführen. Die glatten, entspannten Lippen von Abbildung 2B deuten darauf hin, dass die Backen vollständig entspannt sind.
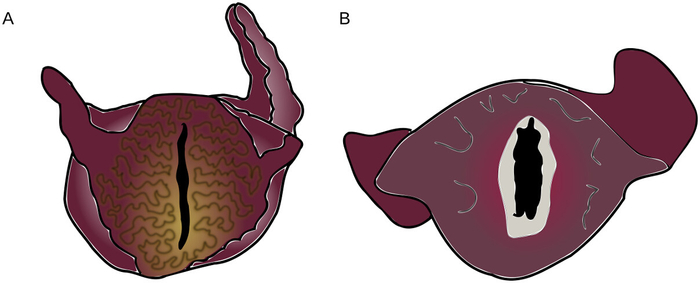
Abbildung 2: Spannung und Entspannung in anästhetisierten Aplysia Mündern. (A) Aplysie zeigt ein hohes Maß an Muskelspannung um die Lippen. Dies korreliert mit Kieferspannung und kontradiziert das Fortschreiten der Operation. (B) Aplysie mit entspannten Lippen, zeigt das Innere der Kiefer (hellgrau). Die Farben entsprechen wiederum denen, die beim Tier beobachtet wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Wenn die Lippen eines Tieres nicht entspannt sind, injizieren Sie weitere 30 ml Magnesiumchlorid und warten Sie weitere 5 min. Wenn dies nicht zu einer Lippenentspannung führt, bringen Sie sie in einen isolierten Behälter mit gutem Wasserfluss zurück, damit sie sich erholen können (siehe Schritt 4) und mit einem anderen Tier fortfahren.
2. Begeben der Radularoberfläche
- Positionieren Sie die Schnecke so, dass der Kopf nach unten hängt, so dass sich die bukkale Masse gegen die Kiefer absetzen kann.
- Drücken Sie mit Daumen und Zeigefinger, um die bukkale Masse in Richtung der Backen zu schieben und die bukkale Masse an Ort und Stelle zu halten.
- Drehen Sie die Backen so, dass sie sichtbar sind. Zur gleichen Zeit, halten Sie den Druck auf die bukkale Masse, so dass der Spannweite der bukkalen Masse durch die Backen sichtbar ist. (Abbildung 3).
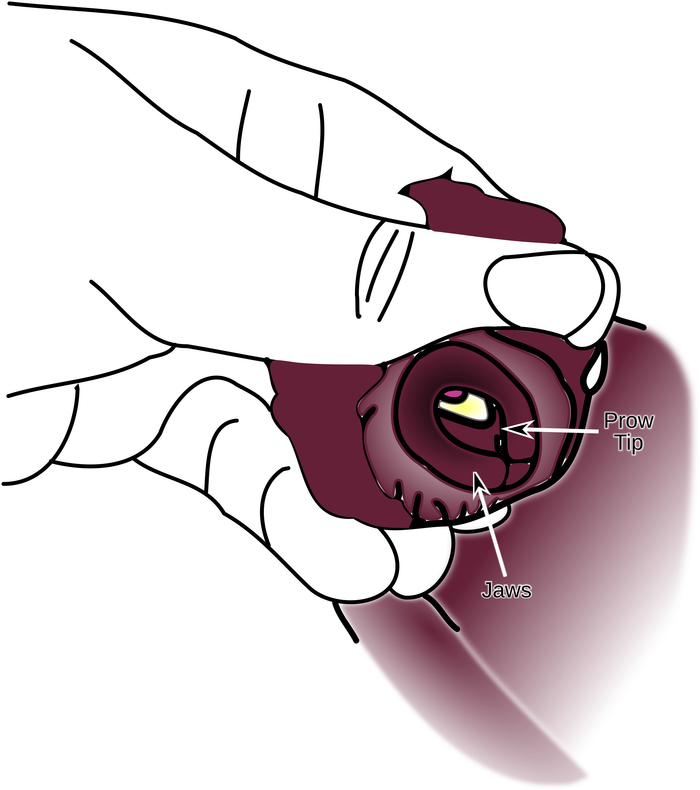
Abbildung 3: Unterstützung der Bukkalmasse gegen das Innere der Kiefer. Finger stützen die bukkale Masse, die gegen den Innenrand der Backen gedrückt wurde, bis die Spitze des Bugs zu sehen ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Arbeiten Sie die Spitzen der stumpfen Zange vorsichtig in den Spalt des Odontophores und hebeln Sie sie, um die radförmige Oberfläche durch die Backen zu hebeln. Wenn die Backen nicht ausreichend entspannt sind, verwenden Sie die Zange, um sanft die Kante der Spalte zu greifen, um diesen Prozess zu unterstützen.
ACHTUNG: Dieser Druck birgt die Gefahr größerer Schäden am Tier. - Sobald die Oberfläche frei ist, arbeiten Sie die Backen frei von dem vorderen Teil der Radularoberfläche den ganzen Weg um den Umfang. Dies macht die Wahrscheinlichkeit, dass sich das Odontophore zurückzieht (Abbildung 4), weniger wahrscheinlich. Stellen Sie sicher, dass nicht mehr als die Hälfte der Wände des Odontophores freigelegt ist.
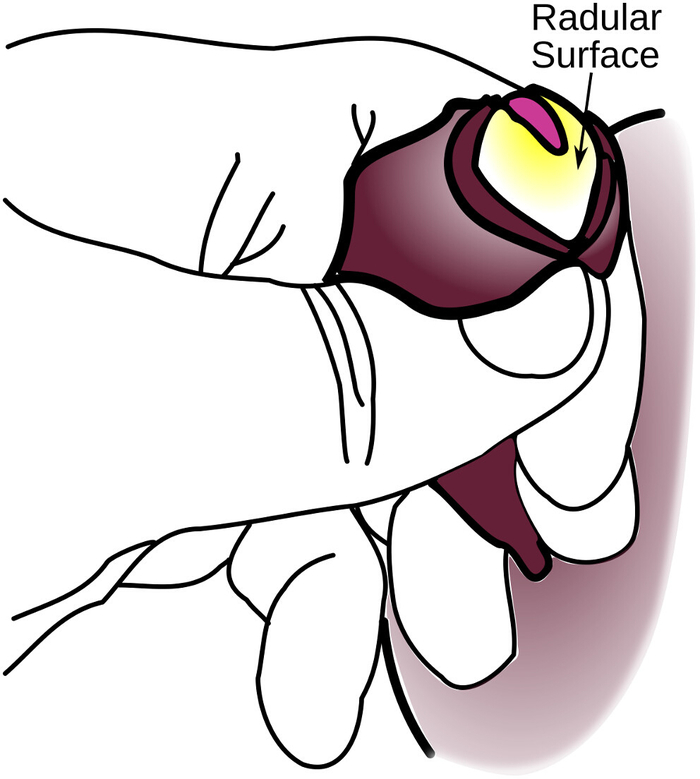
Abbildung 4: Teileversion des Odontophore. Die raduläre Oberfläche ist vollständig freigelegt, aber die Seiten des Odontophores sind nicht freigelegt, was dies nur zu einer partiellen Eversion macht. Eine weitere Eversion wird wahrscheinlich zu Schäden am Tier führen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
HINWEIS: Eine vollständige Eversion des Odontophores wird große Muskelschäden verursachen, von denen sich die Tiere nur sehr langsam erholen.
3. Chirurgische Einschnitte
-
Sobald die Radularoberfläche vollständig freigelegt ist, ordnen Sie die Schnecke unter einem Sezierbereich für die Operation an.
- Alternativ können Sie ein breites Gummiband und eine dritte Hand verwenden, um die Kiefer und die Radularoberfläche für die Operation zu stabilisieren, insbesondere während des Lernens. Dies erhöht jedoch die Zeit und erhöhte Gewebeschäden, was es langfristig weniger ideal macht.
- Platzieren Sie die Radulfläche so, dass die Spaltenseite dem Prüfer zuzeigt.
- Greifen Sie vorsichtig die raduläre Oberfläche in der Nähe der radulären Basis, so dass eine horizontale Falte senkrecht zur anatomischen Falte gebildet wird. Verwenden Sie eine feine Schere, um diese Falte zu durchschneiden, so dass ein Schnitt entlang der anatomischen Falte (Abbildung5).
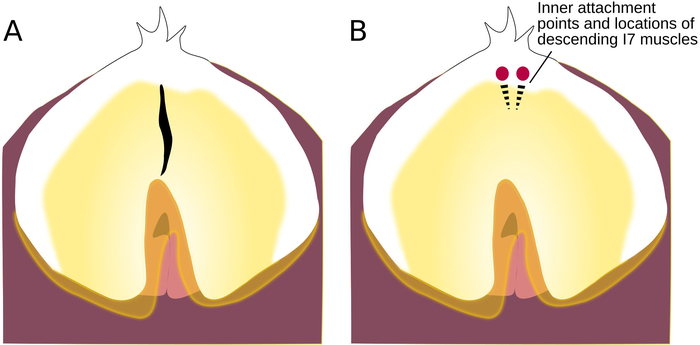
Abbildung 5: Position des Einschnitts zur Radulare Oberfläche. (A) Radulare Oberfläche, mit einem Schnitt. (B) Radulare Oberfläche mit Kreisen, die zeigen, wo die Stränge des bilateralen I7-Muskels befestigen; gepunktete Linien zeigen die Position der absteigenden Muskeln unter der Radularoberfläche an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Erweitern Sie diesen anfänglichen Schnitt auf 3-5 cm, um den Zugang zum Inneren der bukkalen Masse zu ermöglichen.
- Stellen Sie das Licht so ein, dass es durch diesen Schnitt direkt zurück zeigt.
- Teilen Sie die Ränder des Einschnitts so, dass die Rückseite des Lumens des Odontophores und die dünnen vertikalen Stränge des I7-Muskels sichtbar sind. (Abbildung 6)
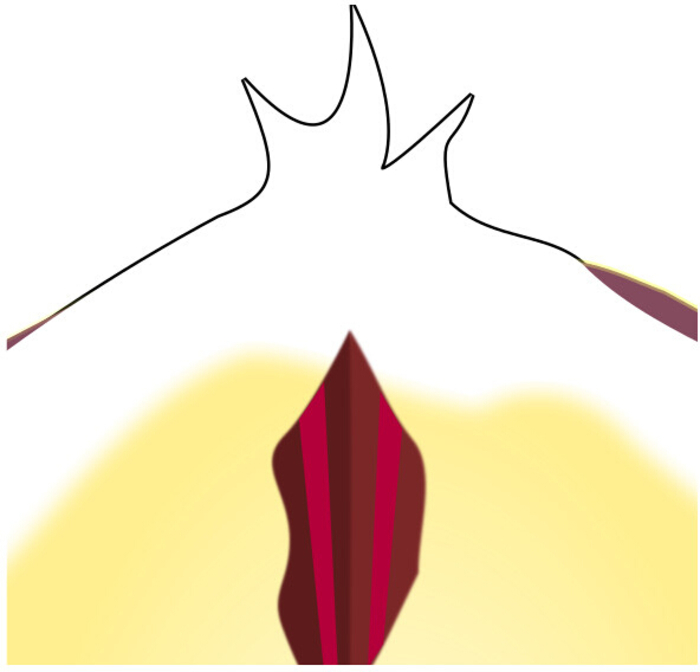
Abbildung 6: Position von I7 durch den Radulare Oberflächenschnitt. Wenn man durch den Schnitt schaut, sind beide Stränge von I7 zwischen den inneren Oberflächen von I4 zu sehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Greifen Sie durch den Schnitt hinein, greifen Sie beide Stränge von I7 und ziehen Sie sie durch den Schnitt nach oben, wo so viel wie der Muskel weggeschnitten werden kann, wie praktisch ist (Abbildung 7).
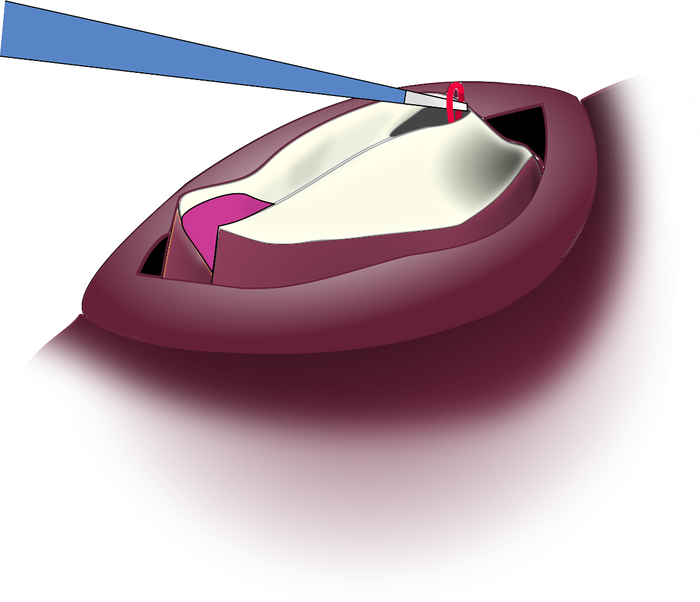
Abbildung 7: Ziehen des I7-Muskelstrangs durch den Schnitt. Der I7-Muskel ist hochelastisch und kann durch den Schnitt zur Entfernung hochgezogen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
HINWEIS: Mit der Praxis ist es in der Regel effektiver, I7 durch Gefühl als durch Sicht zu lokalisieren.
4. Postoperative Pflege
- Nachdem Läsionen durchgeführt wurden, greifen Sie die vorderen Tentakel und drücken Sie auf die raduläre Oberfläche, um die Schnecke wieder in ihre ursprüngliche Konfiguration zu bringen.
- Platzieren Sie postoperative Tiere in einer geschützten Umgebung mit gutem Wasserfluss. Erhöhte Sauerstoffversorgung beschleunigt die Erholung. Stellen Sie sicher, dass die Tiere am Tag nach der Operation wachsam und reaktionsfähig sind. Ist dies nicht der Fall, kann davon ausgegangen werden, dass sie sich nicht erholen werden.
HINWEIS: Die Tiere beginnen in der Regel am ersten oder zweiten Tag nach der Operation zu ernähren. Selbst Tieren, die Probleme beim Beißen haben, sollte Algen angeboten werden, da es unsere anekdotische Beobachtung ist, dass die Erholung eines Tieres durch seine Versuche zu fressen verbessert wird.
5. Für subraduläre Faserverläsion
- Folgen Sie den Schritten von 1.1 bis 3.5
- Legen Sie die Spitze einer kleinen geraden Skalpellklinge (#11 oder ähnliches) durch den Schnitt mit der scharfen Kante nach oben gewinkelt. Kratzen Sie die feinen Muskelfasern vorsichtig von der Unterseite der Radularoberfläche. (Abbildung 8).
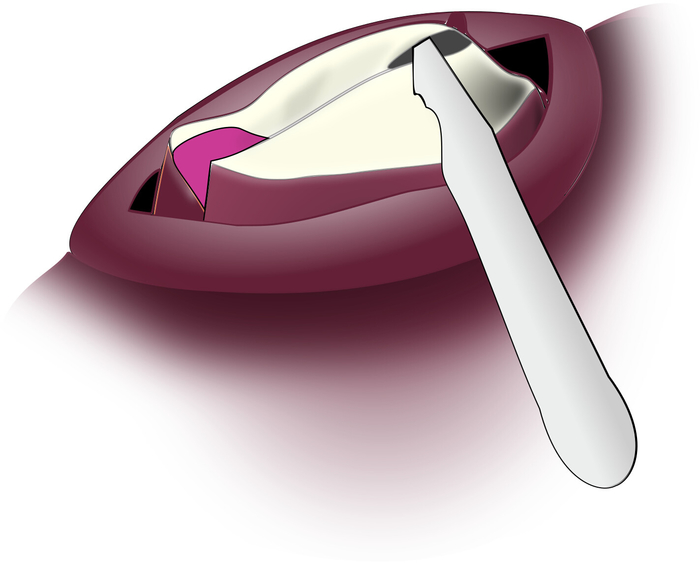
Abbildung 8: Verfestigen der subradularen Fasern. Die Kante der Skalpellklinge wird durch den Schnitt nach oben zur Unterseite der Radularoberfläche gewinkelt, so dass sie die subradularen Fasern sanft wegkratzen kann. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Kehren Sie zu Schritt 4.1 zurück.
Ergebnisse
Frühere Arbeiten hatten vorgeschlagen, dass der I7-Muskel zur Öffnung des Greifers8beitrug. Unsere eigenen anatomischen Studien legten nahe, dass die subradularen Fasern auch zur Greiferöffnung beitragen könnten. Um diese Hypothesen zu testen, wurden Tiere dazu gebracht, Bisse sowohl vor als auch nach einem chirurgischen Eingriff zu erzeugen. Scheintiere wurden allen chirurgischen Schritten unterzogen, einschließlich des Schnittes in der Radularoberfläche, aber es wurden keine inneren Muskeln entfernt. Tiere, die einer I7-Läsion ausgesetzt waren, ließen beide I7-Muskeln entfernen. Tiere, die einer subradulären Faserläsion ausgesetzt waren, hatten direkt unter dem Schnitt 25 % der subradulären Fasern entfernt. Schamläsionen hatten keinen signifikanten Einfluss auf die Breite der Öffnung auf der Spitze des Beißens, während sowohl I7 als auch subraduläre Fasern die Bissbreite deutlich reduzierten (Abbildung9).
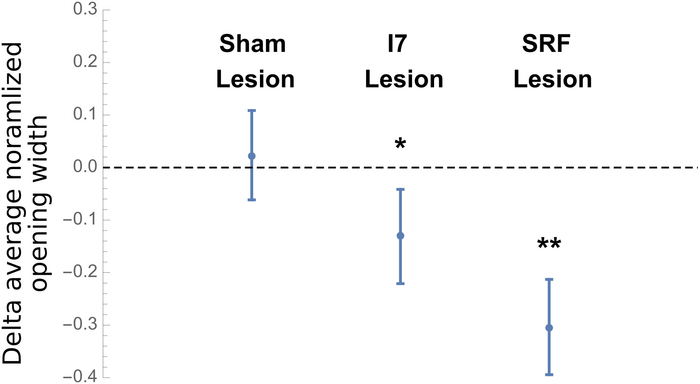
Abbildung 9: Ergebnisse von Läsionen bei Öffnungsbreite während Peak Biting. Die gezeigten Daten sind die Unterschiede zwischen der gemittelten normalisierten Öffnungsbreite der Radula vor und nach dem chirurgischen Eingriff für 5 Tiere in jeder der 3 Gruppen (Schein-, I7-Läsion oder SRF-Läsion), wobei jedes Tier als seine eigene Kontrolle dient. Die Durchschnittswerte wurden von 5 Bissen vor genommen, und 5 Bisse nach dem chirurgischen Eingriff, um den mittleren normalisierten Unterschied zu bestimmen. Öffnungsbreite war der Abstand vom Zentrum der Radulas zur Radularkante an der Spitze der Protraktion, normalisiert durch den Abstand von der inneren Oberfläche der Radularbasis zu den Spaltenkanten der Radularfläche. Die Unterschiede werden als Mittel plus oder minus die Standardabweichung angezeigt. Nach der Feststellung, dass die Differenzdaten normal verteilt waren, wurde die Wahrscheinlichkeit, dass die Läsion keine Wirkung hatte, ermittelt (d. h. die Nullhypothese wurde getestet, dass die Auswirkungen der chirurgischen Eingriffe im Durchschnitt gleich Null wären), indem ein t-Test an jede unabhängige Gruppe. Die Daten zeigen, dass die Scheinläsion keine signifikante Wirkung hatte, während eine Läsion der I7-Muskeln oder eine Läsion der subradularen Fasern einen signifikanten Effekt auf die Radularöffnung hatten (p < 0,031 für die I7-Läsionsgruppe, die mit einem einzigen Sternchen angegeben wurde). , oder p < 0,002 für die SRF-Läsionsgruppe, angezeigt durch ein doppeltes Sternchen). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Körpergewicht | Magnesiumchlorid-Dosis |
| <200 g | 1/2 Körpergewicht |
| 200-350 g | 1/3 Körpergewicht |
| 350-450 g | 1/4 Körpergewicht |
Tabelle 1: Magnesiumchlorid Dosierung nach Körpergewicht.
Diskussion
Die wichtigsten Schritte innerhalb des Protokolls sind die Notwendigkeit, sicherzustellen, dass das Tier vollständig beästhetisiert wird, und dass die Eversion der bukkalen Masse gerade genug ist, um auf die zugrunde liegenden Muskeln zuzugreifen. Es kann einige Praxis erfordern, um diese Schritte zu perfektionieren, aber sobald sie gemeistert sind, ist die Ausbeute aus Operationen wahrscheinlich größer als 85% aller durchgeführten Experimente. Der wichtigste Weg, um das Protokoll richtig zu ändern und zu beheben, ist, Zeit damit zu verbringen, Die bukkalen Massen zu zerlegen, so dass die Positionen der internen Muskeln für den Prüfer vollständig klar sind. Da der vorgeschlagene Schnitt durch die Radularoberfläche unweigerlich einige Schäden an den darunter liegenden subradulären Fasern verursacht, kann es sinnvoll sein, die genaue Position des Einschnitts zu ändern, um bestimmte Bereiche dieser Fasern zu vermeiden.
Eine Einschränkung der chirurgischen Technik ist, dass es unspezifische Auswirkungen auf Fütterungsreaktionen haben kann, wie die Stärke der Protraktion. Eine Möglichkeit, diese Einschränkung zu überwinden, besteht darin, dass Tiere als ihre eigenen Kontrollen dienen. Darüber hinaus ist es wichtig, eine Scheinläsionsgruppe zu haben, die dem gesamten chirurgischen Protokoll unterworfen ist, mit Ausnahme der Entfernung des spezifischen Muskels (d. h. I7 oder der SRFs). Durch die Befolgung dieser Vorschläge wird ein Prüfer die Auswirkungen der Variabilität zwischen Tieren reduzieren und ein intrinsisches Maß für die unspezifischen Auswirkungen einer Operation haben.
Frühere Arbeit hat Ansätze durch die Körperwand verwendet, um Läsion oder Aufzeichnen entweder von Nerven13,14, oder Muskeln15,16,17. In unserem Labor haben wir anekdotisch beobachtet, dass Körperwandschnitte oft mit einem signifikanten Verlust der Hämolymphe und damit des Körpervolumens einhergehen. Tiere benötigen oft mehrere Tage, um sich davon zu erholen, und wenn die Körperwandläsion nicht sorgfältig vernässt ist, können sich die Tiere nicht erholen. Darüber hinaus zeigt die post-mortem Untersuchung der Tiere erhebliche Narben um den Schnitt und eine starke Immunantwort (anekdotische Beobachtungen). Im Gegensatz dazu zeigen Tiere nach der Erholung von dem hier beschriebenen Protokoll (basierend auf Beobachtungen an 96 Tieren) keinen Verlust der Hämolymphe oder Veränderung des Körpervolumens.
Zukünftige Anwendungen der Technik können es auf andere Muskeln innerhalb des Fütterungsapparates von Aplysia und auf andere Tiere ausdehnen. Wir haben uns auf die Entfernung der I7-Muskel- und Subradularfasern konzentriert. Dieselben allgemeinen chirurgischen Techniken ermöglichen auch den Zugang zu den meisten anderen Muskeln des Odontophore. Einige davon, wie der innere Teil des I5-Muskels, sind am besten über die Radularoberfläche zugänglich. Andere, wie die inneren Flugblätter von I4, können besser durch das äußere Epithel des Odontophore erreicht werden. Wir haben Vorversuche gemacht, bei denen ein Schnitt unter der Radularspalte des teilweise immerklichen Odontophores den Zugang für einen geschärften Haken ermöglichte,der dann verwendet werden könnte, um einen anderen Muskel innerhalb des Odontophore, Muskel I8 8, zu läsionen. Da das hier beschriebene Operationsprotokoll die Hauptkörperhöhle nicht öffnet, ist keine Naht erforderlich.
Das Protokoll, das wir beschrieben haben, könnte von allgemeinem Interesse für andere Forscher sein, die an Weichteilstrukturen arbeiten, die sonst schwer zu manipulieren wären, z. B. die Fütterungsvorrichtung anderer Weichtiere. Ganz allgemein könnte dieses Protokoll andere neuartige chirurgische Ansätze zur Analyse weicher Strukturen wie Zungen, Stämme oder Tentakel vorschlagen18.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir möchten die harte Arbeit würdigen, die Sherry Niggel, Sisi Lu und Joey Wu in die Verbesserung und Validierung dieser Protokolle gesteckt haben. Diese Arbeit wurde von NSF Grant IOS 1754869 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Blunt forceps | Fine Science Tools | 11210-10 | 2 pair |
| Scalpel blade (#11) | Fine Science Tools | 10011-00 | |
| Spring scissors | Fine Science Tools | 15024-10 | |
| Webcam | Logitech | c920 | for recording data |
Referenzen
- Pinsker, H., Kupfermann, I., Castellucci, V., Kandel, E. Habituation and Dishabituation of the GM-Withdrawal Reflex in Aplysia. Science. 167, 1740-1742 (1970).
- Kupfermann, I. Feeding Behavior in Aplysia: A Simple System for the Study of Motivation. Behavioral Biology. 10, 1-26 (1974).
- Susswein, A. J., Chiel, H. J. Nitric oxide as a regulator of behavior: New ideas from Aplysia feeding. Progress in Neurobiology. 97, 304-317 (2012).
- Chiel, H. J. Aplysia feeding biomechanics. Scholarpedia. 2, 4165 (2007).
- Neustadter, D. M., Drushel, R. F., Chiel, H. J. Kinematics of the buccal mass during swallowing based on magnetic resonance imaging in intact, behaving Aplysia californica. Journal of Experimental Biology. 205, 939-958 (2002).
- Neustadter, D. M., Herman, R. L., Drushel, R. F., Chestek, D. W., Chiel, H. J. The kinematics of multifunctionality: comparisons of biting and swallowing in Aplysia californica. Journal of Experimental Biology. 210, 238-260 (2007).
- Brezina, V., Evans, C. G., Weiss, K. R. Characterization of the membrane ion currents of a model molluscan muscle, the accessory radula closer muscle of Aplysia california. I. Hyperpolarization-activated currents. Journal of Neurophysiology. 71, 2093-2112 (1994).
- Evans, C. G., Rosen, S., Kupfermann, I., Weiss, K. R., Cropper, E. C. Characterization of a Radula Opener Neuromuscular System in Aplysia. Journal of Neurophysiology. 76 (2), 1267-1281 (1996).
- Cullins, M. J., Chiel, H. J. Electrode Fabrication and Implantation in Aplysia californica for Multi-channel Neural and Muscular Recordings in Intact, Freely Behaving Animals. Journal of Visualized Experiment. (40), 1791 (2010).
- Dudek, F. E., Cobbs, J. S., Pinsker, H. M. Bag cell electrical activity underlying spontaneous egg laying in freely behaving Aplysia brasiliana. Journal of Neurophysiology. 42, 804-817 (1979).
- Hermann, P., Maat, A., Jansen, R. The Neural Control of Egg-Laying Behaviour in the Pond Snail Lymnaea Stagnalis: Motor Control of Shell Turning. Journal of Experimental Biology. 197, 79-99 (1994).
- Jansen, R. F., Pieneman, A. W., Ater Maat, . Pattern Generation in the Buccal System of Freely Behaving Lymnaea stagnalis. Journal of Neurophysiology. 82, 3378-3391 (1999).
- Kupfermann, I. Dissociation of the appetitive and consummatory phases of feeding behavior in Aplysia: a lesion study. Behavioral Biology. 10, 89-97 (1974).
- Scott, M. L., Kirk, M. D. Recovery of consummatory feeding behavior after bilateral lesions of the cerebral-buccal connectives in Aplysia california. Brain Research. 585, 272-274 (1992).
- de Boer, P. A., Jansen, R. F., ter Maat, A., van Straalen, N. M., Koene, J. M. The distinction between retractor and protractor muscles of the freshwater snail’s male organ has no physiological basis. Journal of Experimental Biology. 213, 40-44 (2010).
- Chiel, H. J., Weiss, K. R., Kupfermann, I. An identified histaminergic neuron modulates feeding motor circuitry in Aplysia. Journal of Neuroscience. 6, 2427-2450 (1986).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. Journal of Neurophysiology. 75, 1309-1326 (1996).
- Kier, W. M. The diversity of hydrostatic skeletons. Journal of Experimental Biology. 215, 1247-1257 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten