Method Article
Verwendung von Magnetresonanztomographie- und Biopsiedaten zur Anleitung von Probenahmeverfahren für Prostatakrebs Biobanking
In diesem Artikel
Zusammenfassung
Diese Methode beinhaltet die Nutzung klinischer diagnostischer Daten für Prostatakrebspatienten, um Probenahmeverfahren zu leiten, wenn Biobanking-Gewebe nach radikaler Prostatektomie. Dadurch werden Probleme mit zuvor veröffentlichten Methoden rund um effizienz und Verfügbarkeit von frischem Gewebe für ein breiteres Spektrum nachgelagerter Anwendungen gelöst.
Zusammenfassung
Frühere Methoden für Biobanking Prostatagewebe, nach radikaler Prostatektomie, in der Regel beteiligt Zufällige Probenahme. Um die Effizienz zu steigern und eine größere Bandbreite nachgelagerter Anwendungen zu ermöglichen, wurde eine gezieltere Methode zur Probenahme von Prostatagewebe entwickelt. Hier verwenden wir sowohl Magnetresonanztomographie (MRT) als auch Biopsiedaten, um bestimmte Bereiche des Organs für die Probenahme anzusprechen. Das Verfahren beinhaltet die Verwendung einer zuvor veröffentlichten Prostataschneidvorrichtung, die eine 5 mm Querscheibe aus einem vorgegebenen Bereich der Prostata entfernt, gefolgt von der Entfernung von 6 mm Stanzbiopsien aus vorgegebenen Bereichen dieser Scheibe. Diese Proben können gefroren oder fixiert für Biobanking-Zwecke gelagert werden, oder sofort frisch mit 70% Vertrauen des Tumorgehalts verwendet werden, im Vergleich zu 10% Vertrauen aus dem Zufallsstichprobenansatz. Dies ermöglicht den Einsatz aller nachgelagerten Standardtechniken wie Genomik, Proteomik oder histologische Arbeit, aber auch Arbeiten, die frisches Gewebe erfordern, wie z. B. Live-Gewebe-Bildgebung oder Ex-vivo-Kultur.
Einleitung
Der Zugang zu hochwertigem menschlichem Prostatakrebsgewebe ist eine wichtige Voraussetzung für eine effektive Forschung auf diesem Gebiet. Es gibt eine Reihe von bestehenden Methoden, um Prostatagewebe nach radikaler Prostatektomie für die Forschung zu proben. Typischerweise handelt es sich dabei um die Verwendung von Schlagbiopsien zur Entnahme von Zufallsproben aus einer frischen, gefrorenen oder festen Scheibe Prostatagewebe und nachträglicher Bestätigung, ob in jeder Probe ein Tumor durch Hämatoxylin & Eosin (H&E) vorhanden ist, wie von einem uropathologischer1,2,3,4,5. Eine aktuelle Überprüfung hat einen Überblick über diese bestehendenMethoden6 zusammengestellt. Diese Methoden sind nützlich für bestimmte nachgelagerte Anwendungen, bei denen Gewebe zu einem späteren Zeitpunkt gespeichert und auf Tumorgehalt bewertet werden kann, wie z. B. groß angelegte genomische Analysen wie das International Cancer Genome Consortium (ICGC) und the Cancer Genome Atlas (TCGA) 4,7. Diese Methoden könnten jedoch verbessert werden, wenn wir Magnetresonanztomographie (MRT) und/oder Biopsiedaten verwenden würden, um bestimmte Bereiche der Prostata für die Probenahme anzuvisieren. Dies würde die Methodik auf zwei Arten verbessern; erstens durch verringerung der Anzahl der entnommenen Gewebeproben, Die Steigerung der Effizienz und Verringerung des Drucks auf die Pathologieabteilungen und die Lagerkosten, und zweitens durch die sofortige Verwendung von frischem Gewebe, ohne dass eine sofortige Bestätigung der Tumorgehalt, für neue, nachgelagerte Technologien wie Live-Gewebebildgebung, Organoiderzeugung oder Ex-vivo-Kultur. Dieser Forschungsbedarf hat zur Entwicklung der PEOPLE-Methode (PatiEnt prOstate samPLes for rEsearch) geführt, und die Ergebnisse der ersten 84 Fälle, die mit PEOPLE biobankiert wurden, wurden kürzlich veröffentlicht8. Eine Variante dieser Methode wurde auch mit einem dreidimensionalen (3D) gedruckten Schneideapparat und patientenspezifischer Form veröffentlicht, um ex vivo MRT auf Vor- und Nachfixierungsgewebe9,10zu erleichtern.
Protokoll
Das Protokoll entspricht den lokalen Richtlinien und wird von der UCL/UCLC Biobank Research Ethics Committee (Referenz 15/YH/0311) genehmigt.
HINWEIS: Da diese Methode die Probenahme von menschlichem Gewebe beinhaltet, müssen alle lokalen Verfahren in Bezug auf Ethik und Zustimmung vor Beginn des Protokolls beachtet werden. Radikale Prostatektomiefälle können aufgenommen werden, wenn sowohl MRT- als auch Biopsiedaten vor der Operation vorliegen, mit einem Tumordurchmesser von 5 mm. Fälle sollten ausgeschlossen werden, wenn die Indexläsion nicht genau definiert ist, d.h. nur diffuse Veränderungen sind durch MRT sichtbar.
1. Prostata-Slicing-Apparat
- Kaufen Sie das Prostataschneidegerät (Tabelle der Materialien). Alternativ können Sie ein Blattgriff mit einem 3D-Drucker drucken, wie zuvor veröffentlicht10.
HINWEIS: Das hier verwendete Gerät und die Einwegklingen wurden im Rahmen einer Materialübertragungsvereinbarung vom Institute of Cancer Research, London, UK, erworben.
2. Tumor-Targeting
- Überprüfen Sie klinische Hinweise, um die Indexläsion zu identifizieren, wie sie durch diagnostische Biopsie angegeben wird, z. B. links hinter.
- Überprüfen Sie MRT-Bilder, um die Position des oben genannten Tumors zu messen.
- Finden Sie die Reihenfolge, in der der Tumor in der Axialebene am sichtbarsten ist, z. B. T2-gewichtet.
- Blättern Sie durch axiale Bilder, um das Bild zu finden, in dem der Tumor am größten ist, und drucken Sie das Bild als Referenz.
- Messen Sie in der entsprechenden koronalen Abbildung den Abstand von der Basis der Prostata zur gewählten axialen Position und die gesamte Länge der Prostata von der Spitze zur Basis (mm), und drucken Sie sie als Referenz.
3. Sammlung von pProstate
- Überprüfen Sie die Patientennotizen, um sicherzustellen, dass für dieses Verfahren und alle nachgelagerten Forschungsanwendungen eine angemessene Einwilligung nach Informierter Bildung eingeholt wurde.
- Nach radikaler Prostatektomie, sammeln Sie die Prostata in einem trockenen Topf. Stellen Sie sicher, dass der Prostata kein Formalin oder ein anderes Fixativ hinzugefügt wurde.
- Transfer an einen geeigneten sterilen Ort für die Probenahme, z. B. eine laminare Durchflusshaube in einem Pathologielabor.
- Fahren Sie so schnell wie möglich mit der Probenahme fort, wenn frisches Gewebe benötigt wird.
HINWEIS: Für bestimmte Anwendungen (z. B. DNA-Bewertung, die nicht so schnell abgebaut werden sollte wie RNA), kann es sinnvoll sein, die Probe zu kühlen und am nächsten Tag Proben zu entnehmen.
4. Probenvorbereitung
- Bereiten Sie laminare Fließhaube und Prostata-Schneidevorrichtungen nach lokalen Dekontaminationsverfahren mit steriler Technik vor. Hier 70% Ethanol sprühen und über alle Oberflächen wischen. Verwenden Sie sterile Einwegnadeln und Skalpelle. Slicer-Blades bis zu dreimal verwenden; Nach jeder Anwendung in heißem Seifenwasser waschen, dann sprühen und mit 70% Ethanol abwischen.
- Wiegen Sie die Prostata (g) mit einer Standardwaage.
- Tinte der Prostata. Malen Sie die linke Seite mit blauer Tinte und die rechte Seite mit schwarzer Tinte. Bedecken Sie die volle Kapsel und die Samenbläschen mit Tinte, um später die chirurgischen Ränder zu bezeichnen.
HINWEIS: Die Farbverfahren können lokal variieren und entsprechend geändert werden.
5. Prostata-Slicing
- Montieren Sie das Schneidegerät, indem Sie die Wände senkrecht in die Basis des Ständers einfügen (Abbildung 1A).
- Platzieren Sie die Prostata so, dass die Basis und die Spitze gegenüber den Wänden ausgerichtet sind, mit der hinteren Seite nach unten und vorder nach oben. Legen Sie Goldstifte um die Prostata. Schieben Sie die Prostata bei Bedarf leicht nach innen, um eine enge Passform zu erhalten, die die Prostata beim Schneiden unterstützt.
- Messen Sie die Prostatalänge von der Basis bis zum Scheitelpunkt mit einem Lineal, und vergleichen Sie sie mit der Prostatalänge, gemessen durch MRT. Wenn die Prostata geschrumpft ist, wenden Sie eine Ad-hoc-Korrektur auf den erwarteten Abstand von Basis zu Zielquersegment an. Wenn z. B. die gesamte Länge der Prostata im MRT-Bild 50 mm beträgt, bei der Messung mit einem Lineal an dieser Stelle jedoch auf 45 mm geschrumpft ist, reduzieren Sie die erwartete Schnittposition um 10 %.
- Messen Sie von der Basis bis zur gewünschten Querscheibe. Wählen Sie den Stift aus, der dieser Messung am nächsten liegt, um ihn zu schneiden.
- Tragen Sie Kettenhemdhandschuhe, um Verletzungen zu vermeiden, halten Sie Schneidevorrichtung (Abbildung 1B), legen Sie Klingen auf beiden Seiten des identifizierten Stifts und verwenden Sie den Abstandsmesser, um Klingen 5 mm auseinander zu halten. Nehmen Sie die Klinge langsam und fest nach unten, vorwärts und rückwärts mit langen Strichen(Abbildung 1C). Stellen Sie sicher, dass vor dem Demontagegerät eine vollständige Scheibe getrennt wurde.
- Entfernen Sie Wände und Stifte und nehmen Sie die Scheibe vorsichtig mit Handschuhen auf ein steriles Blatt Korkkarton.
6. Gewebeprobenahme
- Überprüfen Sie die Querscheibe visuell und vergleichen Sie sie mit dem axialen MRT-Bild. In einigen Fällen kann der Tumorbereich blasser erscheinen als das umgebende Gewebe.
- Palpate die Querscheibe sanft. In einigen Fällen kann sich der Tumor fester anfühlen als das umgebende Gewebe.
- Wählen Sie unter Verwendung des axialen MRT-Bildes als Richtschnur einen oder mehrere Bereiche für die Probenahme aus.
-
Nehmen Sie Biopsie Schläge des gewünschten Bereichs des Gewebes.
- Mit einem 6 mm Stempel auf den gewünschten Bereich des Gewebes drücken.
- Drehen Sie den Gewebeschlag an der Stelle und nach unten gegen den Korken, um eine vollständige Trennung zu gewährleisten und verwenden Sie ein scharfes Skalpell, um sich bei Bedarf zu trennen.
- Entfernen Sie den Stempel und legen Sie ihn bei Bedarf in Rohre/Formen, indem Sie mit dem Kolben auswerfen.
- Wiederholen Sie dies bei Bedarf für weitere Tumor- und gutartige Proben mit separaten sterilen Biopsie-Stempeln. Tinte die Löcher, wo Schläge in rot genommen wurden.
- Beachten Sie die Position jedes Schlags zusammen mit dem Gewicht der Prostata und alle Beobachtungen auf Gewebefarbe / Festigkeit.
7. Einreichung von Prostata für die lokale Diagnostik
- Pin die Prostata mit sterilen Einwegnadeln vor der Fixierung zu korken, um Gewebeschrumpfung und Verwarmung zu verhindern, die das Aussehen der chirurgischen Ränder verändern könnte.
- Nach dem Anheften an Kork, reichen Sie die Prostata an die Histopathologie-Abteilung für Standard-klinische Diagnostik.
8. Dekontamination von Geräten
- Entsorgen Sie alle Einweggeräte in biomedizinischen Abfallströmen und/oder scharfen Behältern, wie sie lokal bezeichnet werden.
- Dekontaminieren Sie die laminare Strömungshaube und das Prostataschneidegerät gemäß den für das menschliche Gewebe geeigneten lokalen Risikobewertungen (z. B. durch Sprühen mit 70% EtOH und Wischen).
Ergebnisse
Frisches Prostatagewebe, das mit der PEOPLE-Methode beprobt wird, kann für eine Vielzahl von nachgeschalteten Techniken verwendet werden, einschließlich genomischer Sequenzierung und Ex-vivo-Kultur. Die ersten 59 mit dieser Methode beprobten Fälle wurden zuvor im Vergleich zu einer früheren Version der Methode zusammen mit den ersten nachgelagerten Datenveröffentlicht 8. Die Zeit vom ersten Schneiden der Prostata bis zum Einfrieren/Fixieren der Schlagbiopsien betrug hier ca. 1 min, was auf ein Minimum beschränkt wurde, um einen Abbau der RNA zu vermeiden. Die Zeit von der Entfernung der Prostata bis zum Prostataschneiden sollte ebenfalls auf ein Minimum beschränkt werden, obwohl dies hier etwa 20 min dauerte, da sich unsere Theater- und Pathologielabore an verschiedenen Orten aufhielten.
Je nach nachgeschalteter Anwendung werden in der Regel mindestens zwei Proben entnommen: eine aus einem Bereich des erwarteten Tumorgewebes und eine aus einem Bereich mit erwartetem gutartigem Gewebe. Das wichtigste Erfolgsmaß für die Probenahmemethode selbst ist die Bewertung des Tumorgehalts in einer bestimmten Probe.
Für den Eintritt in das 100.000-Genom-Projekt muss ein H&E-Gefärbtgewebeabschnitt von einem Uropathologen untersucht werden, und die Probe muss mindestens 40% Tumorzellen enthalten. Proben, die weniger als 40 % Tumor enthalten, können weiterhin in das Projekt einbezogen werden, wenn sie erfolgreich makroseziert wurden. Von den ersten 92 auf diese Weise untersuchten Fällen enthielten 64% mindestens 40% Tumor und wurden ohne Makrodissektion dem 100.000 Genomes Project vorgelegt. Die DNA wurde extrahiert und war in allen Fällen von ausreichender Ausbeute und Qualität (Tabelle 1). Eine erste Teilmenge von 59 dieser Stichproben wurde zuvor im Vergleich zu einer früheren Methode8veröffentlicht.
Für die Ex-vivo-Kultur müssen abgestimmte Tumor- und gutartiges Gewebe von ausreichender Qualität sein, um einer 72-h-Kultur ohne signifikanten Abbau standzuhalten. Mehrere Gewebeproben von insgesamt drei Patienten wurden erfolgreichkultiviert 8.
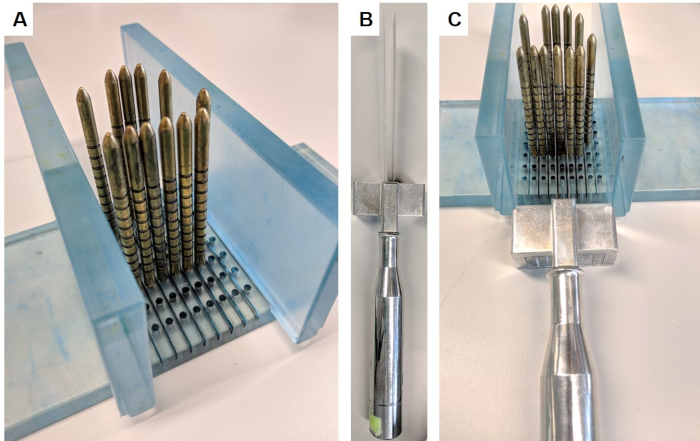
Abbildung 1: Prostataschneidegerät. Dieser Apparat wurde im Rahmen einer Materialübertragungsvereinbarung des Instituts für Krebsforschung erworben. (A) Die Wände werden senkrecht zur Basis eingefügt, und Goldstifte werden in die Basis um die Prostata (Prostata nicht abgebildet) eingesetzt. (B) Die austauschbaren parallelen Klingen werden in den Klingengriff eingesetzt. (C) Die Klingen verlaufen zwischen den Goldstiften, um einen 5 mm Abschnitt der Prostata zu schneiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| n (%) | |
| Hit (>40% Tumor) | 59 (64%) |
| Teilschlag (5-30% Tumor) | 6 (7%) |
| Miss (0% Tumor) | 27 (29%) |
| gesamt | 92 (100%) |
Tabelle 1: Tumortrefferrate. Die Tumortrefferrate wurde von einem auf Prostatakrebs spezialisierten Pathologen nach Überprüfung von H&E-Gefärbtgewebe ermittelt. Der Tumorzellgehalt von >40% wurde gemäß den Genomics England-Richtlinien als für die Aufnahme in das 100.000 Genomes Project geeignet.
Diskussion
Zu den kritischen Schritten innerhalb dieses Protokolls gehören die Identifizierung der Tumorregion für die Probenahme, die Messung der Prostata und die Gewebeentnahme. Erstens ist die Messung der MRT zur Identifizierung des richtigen Bereichs der Probenahme von entscheidender Bedeutung. Wir zeigen diese Methode im begleitenden Video; Wir empfehlen jedoch auch, Messungen zunächst mit einem Radiologen zu bestätigen. Klare klinische Hinweise, die den Forscher auf den Bereich der MRT-Bilder hinweisen, die die Indexläsion enthalten, sind ideal. Zweitens sollte die Messung der Prostata mit Vorsicht durchgeführt werden, um sicherzustellen, dass das Lineal in einem Winkel gehalten wird, um die volle Länge von der Basis bis zum Scheitelpunkt parallel zum vorderen Teil der Prostata zu messen. Drittens sollten Tumorbereiche vor der Probenahme bestätigt werden, indem die Gewebescheibe in Bezug auf das ursprüngliche MRT-Bild visuell untersucht, das Gewebe blass (in einigen Fällen kann sich der Tumorbereich dichter anfühlen) und die Farbe des Gewebes visuell beurteilt werden (in einigen Fällen Wenn der Tumor blasser erscheint als das umgebende gutartige Gewebe).
Dieses Protokoll wurde an der UCL/UCLH von nicht-klinischen Postdoktoranden, einem Pathologie-Stipendiaten, Pathologieberatern und Forschungstechnikern vollständig durchgeführt. Nach unserer Erfahrung können alle Schritte des Protokolls in weniger als zehn Fällen unabhängig vom technischen Hintergrund erlernt werden. Wir empfehlen jedoch eine Schulung eines Radiologen zur MRT-Messung und schulung durch einen Pathologen in erster Linie zum Schneiden. Das Protokoll kann mithilfe eines 3D-gedruckten Schneidegriffs geändert werden, wie zuvor veröffentlicht10.
Mögliche Einschränkungen der Technik sind das Risiko, die Diagnose zu behindern. Das Schneiden der Prostata ist ein wichtiger Schritt, der bei der Einstufung oder positiven Margin-Raten bei falscher Fehlererstellung behindern könnte. Hier gibt es zwei mögliche Probleme. Erstens: Wenn die gesamte Indexläsion entfernt und sofort für Frischgewebeexperimente verwendet wird, wird eine routinemäßige klinische Diagnostik für diese Läsion nicht durchgeführt, und der Patient kann fälschlicherweise als krebskranker unterschläflicher Diagnostiziert werden. Um dies zu vermeiden, sollte der Forscher den Probenahmeplan mit dem beratenden Pathologen besprechen, der den Fall vor der Probenahme routinemäßig überprüft und sich über die Anzahl und den Ort der zu entnehmenden Proben einigen wird. Kleine Tumore können aus diesem Grund lokal ausgeschlossen werden. Zweitens, wenn die Prostatakapsel nicht richtig an Korkbrett vor der Fixierung fixiert ist, könnte dies das innere Gewebe nach außen während der Fixierung wölben, die chirurgischen Ränder verändern. Dies könnte zu einer falsch positiven Marge führen, wo der verbleibende Tumor in der Kapsel rein aufgrund von Gewebeverformung zu wohnen scheint.
Die Bedeutung dieser Technik im Vergleich zu bestehenden Methoden liegt vor allem beim Tumor-Targeting. Bis heute wurde eine Reihe von Methoden zur Probenahme radikaler Prostatektomieproben veröffentlicht; Diese alle basieren jedoch auf einem ganz oder teilweise zufälligen Stichprobenansatz1,2,3,4,5,6,7. Die Verwendung von Biopsie und insbesondere MRT-Daten hier hat die Effizienz verbessert, so dass eine reduzierte Probenahme mit erhöhtem Vertrauen der Gewinnung von Tumorgewebe8ermöglicht.
Zukünftige Anwendungen dieser Methode ermöglichen die Einführung eines breiteren Spektrums nachgelagerter Verfahren als bei früheren Probenahmeverfahren. Zum Beispiel bedeutet die Verfügbarkeit von frischem Gewebe, das eine hohe Wahrscheinlichkeit hat, Tumor zu sein, dass teurere und/oder arbeitsintensive Frischgewebetechniken verwendet werden können, da viele Proben nicht benötigt werden, um das Vorhandensein von Tumoren zu gewährleisten. Dies kann ex vivo Kultur, Ex-vivo-MRT, fortgeschrittene Bildgebung und Transkriptomik umfassen und ist nicht beschränkt.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren möchten Prostate Cancer UK für die Finanzierung von SH im Rahmen des Prostate Cancer UK Centre of Excellence and Travelling Prize Fellowship (TLD-PF16-004) und HP unter INNOVATE (PG14-018-TR2) würdigen. Diese Arbeit wurde von Forschern des National Institute for Health Research University College London Hospitals Biomedical Research Centre unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 6 mm biopsy punch | Fisher Scientific | 13404607 | Disposable biopsy punches for removing 6 mm tissue samples |
| Black Ink | Leica Biosystems | 3801753 | Tissue marking & margin dye |
| Blue Ink | Leica Biosystems | 3801751 | Tissue marking & margin dye |
| Chainmail hand glove | Arco | 1456803 | Chainmail gloves to protect hand during slicing |
| Cork board | Fisher Scientific | 12396447 | Cork board for pinning prostate to following sampling procedure |
| Needles | SLS (Scientific Laboratory supplies) | SYR6112 | Sterile needles to use to pin tissue to cork board following sampling |
| Prostate slicing aparatus | Insitute of Cancer Research, London | NA - must be obtained under MTA | A kit containing the slicer handle, blades, spacer, base, walls and pins |
Referenzen
- Sooriakumaran, P., Henderson, A., Denham, P., Langley, S. E. A novel method of obtaining prostate tissue for gene expression profiling. International Journal of Surgical Pathology. 17 (3), 238-243 (2009).
- Jhavar, S. G., et al. Processing of radical prostatectomy specimens for correlation of data from histopathological, molecular biological, and radiological studies: a new whole organ technique. Journal of Clinical Pathology. 58 (5), 504-508 (2005).
- Wheeler, T. M., Lebovitz, R. M. Fresh tissue harvest for research from prostatectomy specimens. The Prostate. 25 (5), 274-279 (1994).
- Esgueva, R., et al. Next-generation prostate cancer biobanking: toward a processing protocol amenable for the International Cancer Genome Consortium. Diagnostic Molecular Pathology. 21 (2), 61-68 (2012).
- Dev, H., et al. Biobanking after robotic-assisted radical prostatectomy: a quality assessment of providing prostate tissue for RNA studies. Journal of Translational Medicine. 9, 121 (2011).
- Tolkach, Y., et al. Blind Biobanking of the Prostatectomy Specimen: Critical Evaluation of the Existing Techniques and Development of the New 4-Level Tissue Extraction Model With High Sampling Efficacy. The Prostate. 77 (4), 396-405 (2017).
- Warren, A. Y., et al. Method for sampling tissue for research which preserves pathological data in radical prostatectomy. The Prostate. 73 (2), 194-202 (2013).
- Heavey, S., et al. PatiEnt prOstate samPLes for rEsearch, a tissue collection pathway utilizing magnetic resonance imaging data to target tumor and benign tissue in fresh radical prostatectomy specimens. The Prostate. 79 (7), 768-777 (2019).
- Bailey, C., et al. VERDICT MRI validation in fresh and fixed prostate specimens using patient-specific moulds for histological and MR alignment. NMR in Biomedicine. 32 (5), 4073 (2019).
- Bourne, R. M., et al. Apparatus for Histological Validation of In Vivo and Ex Vivo Magnetic Resonance Imaging of the Human Prostate. Frontiers in Oncology. 7, 47 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten