Method Article
Bewertung der Differenzierungskapazität von Mausprostataepithelzellen mithilfe der organoiden Kultur
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Maus-Prostata-Organoide stellen einen vielversprechenden Kontext zur Bewertung von Mechanismen dar, die die Differenzierung regulieren. Dieses Papier beschreibt einen verbesserten Ansatz zur Etablierung von Prostataorganoiden und führt Methoden ein, um (1) Proteinlysat aus Organoiden zu sammeln und (2) Organoide für die konfokale Volltonmikroskopie zu fixieren und zu färben.
Zusammenfassung
Das Prostataepithel besteht überwiegend aus Basal- und Leuchtzellen. In vivo Lineage Tracing wurde verwendet, um die Differenzierungskapazität der Maus Prostata basalen und luminalen Zellen während der Entwicklung, Geweberegeneration und Transformation zu definieren. Die Bewertung zellintrininter und extrinsischer Regulatoren der Prostataepitheldifferenzierungskapazität mithilfe eines Linienverfolgungsansatzes erfordert jedoch häufig eine umfangreiche Züchtung und kann kostenprohibitiv sein. Im Prostataorganoid-Assay erzeugen Basal- und Luminalzellen Prostataepithel ex vivo. Wichtig ist, dass primäre Epithelzellen von Mäusen mit genetischem Hintergrund oder Mäusen isoliert werden können, die mit einer beliebigen Anzahl kleiner Moleküle behandelt werden, bevor oder nach der Beschichtung in eine dreidimensionale (3D) Kultur eingeschichten wird. Nach 7-10 Tagen wird ausreichend Material für die Bewertung der Differenzierungskapazität erzeugt. Die Sammlung von basalabgeleiteten und luminalabgeleiteten Organoiden für (1) Proteinanalysen durch Western Blot und (2) immunhistochemische Analyse intakter Organoide durch vollmontierte konfokale Mikroskopie ermöglicht es Forschern, die ex vivo-Differenzierung zu bewerten Kapazität von Prostataepithelzellen. In Kombination liefern diese beiden Ansätze ergänzende Informationen über die Differenzierungsfähigkeit von Prostatabasal- und Leuchtzellen als Reaktion auf genetische oder pharmakologische Manipulationen.
Einleitung
Basal- und Leuchtzellen bilden die Mehrheit des Prostataepithels1. Lineage-Tracing-Studien haben gezeigt, dass diese Zelltypen überwiegend von unterschiedlichen Vorläufern in der erwachsenen Maus2selbstgetragen werden; jedoch wurde luminale Differenzierung von Basalvorläufern in verschiedenen Kontexten beobachtet, einschließlich Entwicklung3,4, Geweberegeneration5, Entzündung6,7 und Prostatakrebs Initiation2,8. Darüber hinaus unterstützen neu entstehende Daten die Existenz von multipotenten luminalen Vorläufern sowie luminal-gebundenen Vorläufern9. Bei metastasierendem Prostatakrebs stellt die Differenzierung von einer AR-abhängigen luminalen Abstammung zu einer AR-indifferenten Abstammung mit basalen und neuroendokrinen Merkmalen einen zunehmend geschätzten Mechanismus der Resistenz gegen Androgenweghemmer10,11,12dar. Da Differenzierung in die normale Physiologie, Krebsinitiation und Therapieresistenz involviert ist, ist es daher entscheidend, wichtige molekulare Regulatoren der Prostataepithelzelldifferenzierung aufzuklären.
Das Maus-Prostata-Organoid-Modell hat sich als eleganter ex vivo Kontext zur Untersuchung der Prostataepithelzelldifferenzierung9,13,14entwickelt. Bei diesem Test werden einzelne Epithelzellen in eine 3D-Matrix eingegliedert, wo sie drüsenstrukturen erzeugen, die sowohl Basal- als auch Leuchtzellen innerhalb von 1 Woche enthalten. Während bestehende Ansätze zur Beschichtung von Zellen in die organoide Kultur genutzt werden können, um Organoide effizient zu erzeugen, erfordern diese Ansätze eine weitere Optimierung14. Bemerkenswerte Herausforderungen im Zusammenhang mit der Kultivierung von Prostataorganoiden sind (1) ohne zweidimensionale (2D) Kolonien, die sich unterhalb des Matrigels (Matrixgel) aus der Analyse bilden, (2) die Integrität des Matrixgels während Medienveränderungen zu erhalten und (3) Organoide genau zu zählen. Dieses Papier skizziert einen Ansatz zur Erzeugung von Organoiden aus Epithelzellen, die aus der Prostata der Maus isoliert sind. Der beschriebene Ansatz beinhaltet Beschichtungsplatten mit Poly(2-Hydroxyethylmethacrylat) (Poly-HEMA), um das Auftreten von 2D-Kolonien zu verhindern. Darüber hinaus werden Zellen in einen Matrix-Gel-Ring eingezäunt, anstatt in eine Matrix-Gelscheibe, was das Wechseln der Medien und das Zählen von Organoiden weniger schwierig macht. Diese Techniken ermöglichen es Forschern, leichter zu untersuchen, wie genetische Veränderungen oder kleine Moleküle, die vor oder während der Organoidbildung eingeführt wurden, Schlüsselprozesse wie Differenzierung verändern.
Die Ernte von Prostataorganoiden für Western Blot oder immunhistochemische Analysen durch die konfokale Volltonmikroskopie kann wertvolle mechanistische Einblicke in die Differenzierung13liefern, doch es fehlen gut etablierte Protokolle zur Vorbereitung von Organoiden auf solche Techniken. Dieses Manuskript beschreibt Ansätze zur Ernte von Organoiden für (1) die Sammlung von Proteinlysat oder (2) Fixierung und Färbung für die konfokale Mikroskopie. Wichtig ist, dass der beschriebene Ansatz zur Fixierung und Färbung von Prostataorganoiden im Vergleich zu bestehenden Methoden erheblich verbessert wird. Während diese sich auf die Sektionsorganoide15stützen, verwendet die in diesem Manuskript beschriebene Methode intakte Organoide, die bei der Probenvorbereitung vor organoiden Schäden schützen. In Kombination können Western Blot und konfokale Mikroskopie wertvolle Einblicke in die molekularen Regulierer der Differenzierung liefern. Alternativ können diese Ansätze verwendet werden, um andere Prozesse wie Entwicklung und Transformation zu modellieren.
Protokoll
Alle hier beschriebenen Methoden wurden vom Institutional Review Board der University of California, Los Angeles, genehmigt.
HINWEIS: Abbildung 1zeigt einen Schaltplan, der die in dem Papier beschriebenen Ansätze veranschaulicht.
1. Isolieren von Mausbasal- und Luminal-Prostataepithelzellen mit Fluoreszenz-aktivierter Zellsortierung (FACS) — TIMING: 30 Min
HINWEIS: Führen Sie die Schritte 1.3-1.5 im Dunkeln aus.
- Nach der Trennung von Zellen von der gesamten Mausprostata, wie in Lawson et al.16beschrieben, übertragen Sie die Zellen in FACS-Röhren und suspendieren 0,1-5 x 106 Zellen in 100 l Dissoziationsmedien (Tabelle 1).
- Fügen Sie das entsprechende Band der folgenden direkt konjugierten primärantikörper hinzu: CD45, CD31, Ter-119, EpCAM und CD49f.
- Auf Eis, lichtgeschützt, 20 min aufE inkubieren.
HINWEIS: Es wird empfohlen, 10% der gesamten dissoziierten Zellen für ungefärbte und eingefärbte Kontrollen zu verwenden. Diese Steuerungen sind notwendig, um die richtige Kompensation und Spannung für die Sortierung einzustellen. - Quench Antikörper-Cocktail durch Zugabe von 1 ml Dissoziationsmedien zu jeder Probe. Pellet die Zellen durch Zentrifugation bei 800 x g für 5 min bei Raumtemperatur (RT) und entfernen Sie den Überstand durch Angieren.
- Setzen Sie die Zellen in einem entsprechenden Volumen (250 l pro 1 x 106 Zellen) von Dissoziationsmedien mit 1 g/ml 4',6-Diamidino-2-Phenylindole (DAPI) wieder aus. Fahren Sie mit FACS fort. Strömungszytometrie-Plots, die die Isolierung von Mausbasal- und luminalen Prostataepithelzellen demonstrieren, sind in Abbildung 2dargestellt.
2. Beschichtung sortiert ekuratonische Epithelzellen in primäre Maus Organoidkultur — TIMING: 2-3 H (ohne Poly-HEMA-beschichtete Plattenpräparation)
HINWEIS: Die Platten sind mit Poly-HEMA beschichtet, um die Bildung von 2D-Kolonien auf der Oberfläche des Brunnens unter dem Matrixgel zu verhindern. Bereiten Sie poly-HEMA-beschichtete Platten 1 Tag vor der Beschichtung sortierte Basal- oder Luminal-Prostata-Epithelzellen in die Organoidkultur der Maus vor. Tauen 1 ml Aliquots des reduzierten Wachstumsfaktor-Matrixgels, im Folgenden als Matrixgel bezeichnet, auf Eis 2 h vor Schritt 2.1. Y-27632 (ROCK-Hemmer) sollte den Organoidmedien der Maus unmittelbar vor Schritt 2.1 zugesetzt werden. Führen Sie die Schritte 2.1-2.8 auf Eis aus.
- Pellet die Zellen in 5 ml Rundbodenröhrchen durch Zentrifugation bei 800 x g für 5 min bei 4 °C und den Überstand ansaugen.
- Waschen Sie das Zellpellet in 500 l Mausorganoidmedien (Tabelle 2)14.
- Pellet die Zellen durch Zentrifugation bei 800 x g für 5 min bei 4 °C und den Überstand ansaugen.
- Resuspend in Mausorganoid-Medien bei einer Zelldichte von 1.000 Zellen/L.
- Um Master-Mischungen vorzubereiten, mischen Sie Epithelzellen, die in Mausorganoidmedien suspendiert sind, mit Matrixgel, um eine endgültige Mischung zu erzeugen, die 25% Zellen/Medien und 75% Matrixgel enthält. Basalzellen werden in der Regel mit einer Konzentration von 100-2.000 Zellen/80 l plattiert, während Leuchtdichtezellen in der Regel mit einer Konzentration von 2.000-10.000 Zellen/80 l plattiert werden. Die Dichte der plattierten Zellen variiert je nach dem Tag der erwarteten Materialsammlung und der gewünschten nachgeschalteten Anwendung.
HINWEIS: Kühlen Sie die Rohre für das erwartete Master-Mix-Volumen 5 min vor der Master-Mix-Vorbereitung entsprechend dimensioniert. Um sicherzustellen, dass das Matrixgel während der Handhabung nicht aushärtet, ist es wichtig, die Pipettenspitze zu kühlen, indem das Matrixgel 3-4 Mal pipetiert wird, bevor es in ein neues Rohr übertragen wird. - Fügen Sie 80 l der Matrix-Gel/Zell-Mischung pro Bohrung einer 24-Well-Platte hinzu. Es wird empfohlen, ein Tröpfchen auf die untere Hälfte der Wellwand zu pfeifen und gleichzeitig den direkten Kontakt mit der Poly-HEMA-Beschichtung zu vermeiden. Nach zugabe des Matrixgels wirbeln Sie die Platte, damit die Matrix-Gel/Zell-Mischung einen Ring um den Rand des Brunnens bilden kann.
- Legen Sie die 24-Well-Platte 10 min lang in einen 37 °C 5% CO2-Inkubator rechts nach oben, damit das Matrixgel teilweise aushärtet.
HINWEIS: Beginnen Sie mit der Erwärmung der Organoidmedien der Maus bei 37 °C unmittelbar nach dem Platzieren der 24-Well-Platte im Inkubator. - Nach 10 min Inkubation die 24-Well-Platte auf den Kopf stellen und zusätzlich 50 min brüten, damit das Matrixgel vollständig aushärten kann.
- Fügen Sie 350 L vorgewärmte Mausorganoid-Medien tropfenweise in die Mitte jedes Brunnens.
HINWEIS: Um die Integrität des Matrixgels zu erhalten, ist es wichtig, den Matrix-Gel-Ring beim Hinzufügen von Medien zu vermeiden. - Nach Dem Hinzufügen der Medien, geben Sie die 24-Well-Platte auf den 37 °C 5%CO2-Inkubator zurück.
3. Auffüllen Mouse Organoid Media — TIMING: 10-15 Min Pro 24-Well-Platte
HINWEIS: Bestehende Medien sollten alle 48 Stunden durch frische Medien ersetzt werden. Vor jedem Medienwechsel, vorwarme Maus organoide Medien. Es ist nicht notwendig, rock-Hemmer zu den Medien hinzuzufügen, die zum Auffüllen verwendet werden.
- Neigen Sie die 24-Well-Platte in einem 45°-Winkel und entfernen Sie die vorhandenen Medien vorsichtig aus der Mitte jedes Brunnens mit einer p1000 Pipette, während der Matrix-Gel-Ring vermieden wird.
- Fügen Sie 350 l vorgewärmte Mausorganoidmedien wie in Schritt 2.9 hinzu. Es wird empfohlen, Organoiden, die länger als 5 Tage kultiviert werden, ein größeres Medienvolumen (bis zu 1 ml) hinzuzufügen, um eine schnelle Erschöpfung der wichtigsten Nährstoffe und Wachstumsfaktoren zu verhindern.
4. Extraktion von ProteinLysat aus Prostataorganoiden für die Western Blot Analysis — TIMING: 2.5-4 H
HINWEIS: Vor dem Sammeln von Organoiden zur Proteinlysatextraktion, Zubereitung und vorwarme Dispase-haltige Medien (Tabelle 1).
- Entfernen Sie die Medien aus jedem Brunnen sowie in Schritt 3.1.
- Um Organoide zu sammeln, sprengen Sie das Matrixgel wiederholt, indem Sie 1 ml Dispase-haltige Medien direkt auf den Matrix-Gelring pfeifen, bis der gesamte Ring entfernt ist, und übertragen Sie es in ein 1,5 ml Mikrozentrifugenrohr.
HINWEIS: Es ist wichtig, den direkten Kontakt mit den poly-HEMA-beschichteten Brunnen zu vermeiden. Direkter Kontakt kann zu einer Kontamination des gesammelten Materials mit Poly-HEMA führen, was sich negativ auf das Zellüberleben auswirken könnte. - Legen Sie die 1,5 ml Mikrozentrifugenröhrchen(n) in einen 37 °C 5% CO2-Inkubator für 30 min bis 1 h, um eine vollständige Verdauung des Matrixgels durch Dispase zu ermöglichen.
- Pelletorganoide durch Zentrifugation bei 800 x g für 5 min bei RT und entfernen Sie den Überstand mit einer Mikropipette.
- Phosphatgepufferte Saline (PBS) in das Organoidpellet geben und durch sanftes Flicken wieder aufsetzen.
HINWEIS: Wenn das Organoidpellet nicht ausreichend wieder ausgesetzt wird, kann dies zur Kontamination von organoidem Material mit Restdispase oder Matrixgel führen. - Pellet die Organoide durch Zentrifugation bei 800 x g für 5 min bei RT und entfernen Sie den Überstand mit einer Mikropipette.
- Die Organoidpellets schnell einfrieren, indem man jede Röhre in eine Lösung mit Trockeneis und Methanol legt. Bewahren Sie die Rohre bis zur späteren Verwendung bei -80 °C auf. Alternativ kann Proteinlysat unmittelbar nach Schritt 4.6 extrahiert werden.
- Setzen Sie die organoiden Pellets in 100 l Proteinlysepuffer(Tabelle 1) pro 10 l gepacktem Zellvolumen wieder auf. Flick, um erneut zu suspendieren.
HINWEIS: Bei Wiederaufnahme nach dem schnellen Einfrieren stellen Sie sicher, dass der Proteinlysepuffer vor dem Entfernen von Proben von -80 °C aufgetaut wird, da den Proben sofort ein Lysepuffer zugesetzt werden muss, um Phosphatase und Proteaseaktivität zu verhindern. - Inkubieren Sie die Proben in Proteinlysepuffer auf Eis für mindestens 45 min.
HINWEIS: Es wird empfohlen, vor der Inkubation auf Eis zu beschallen, um die Effizienz der Kernproteinrückgewinnung zu erhöhen; Eine Beschallung ist jedoch nicht erforderlich. Wenn keine Beschallung durchgeführt wird, fahren Sie mit Schritt 4.10 fort.- Zum Beschallen, untertauchen Rohre in nasses Eis und tragen Sie die Spitze des Schalldismembrators sanft auf die Außenseite des Mikrozentrifugenrohrs auf. Sonicate für 40 s bei 20 kHz.
- Fahren Sie mit Western Blot nach etablierten Protokollen fort.
5. Fixierung und Färbung von Prostataorganoiden für die immunhistochemische Analyse durch vollwertige Konfokalmikroskopie
-
Sammeln von Prostataorganoiden aus 24-Well-Platten — TIMING: 45-60 min
HINWEIS: Beim Sammeln von Prostataorganoiden für die konfokale Mikroskopie zu verarbeiten, ist es wichtig, sie mit Sorgfalt zu behandeln, um ihre Struktur zu erhalten. Das folgende Entnahmeprotokoll wurde entwickelt, um Störungen der organoiden Struktur während der Isolierung zu reduzieren.- Entfernen Sie die Medien aus jedem Brunnen sowie in Schritt 3.1.
- Verdauen Sie das Matrixgel, indem Sie es mit 500 l dispasehaltigen Medien (Tabelle 1) 30 min in einem 37 °C 5%CO2-Inkubator inkubieren.
- Sammeln Sie verdaut organoide Suspension in einem Mikrozentrifugenrohr und pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT. Entfernen Sie den Überstand.
-
Immunfluoreszenzfärbung von Prostataorganoiden – TIMING: 3-4 Tage (1-5 h/Tag)
- Fügen Sie 500 l 4% Paraformaldehyd in PBS hinzu und brüten für 2 h bei RT mit sanftem Schütteln.
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT, entfernen Sie den Überstand, und waschen Sie das Pellet mit 1 ml PBS für 15 min mit sanftem Schütteln.
- Waschen Sie das Pellet wie in Schritt 5.2.2 für weitere zwei Mal.
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT und entfernen Sie den Überstand. Fügen Sie 1 g/ml DAPI in der Blockierlösung hinzu (Tabelle 1). 2 h bei RT oder alternativ über Nacht bei 4 °C mit sanftem Schütteln inkubieren.
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT und entfernen Sie den Überstand. Primärantikörper (Kaninchen anti-p63, Maus-Anti-Cytokeratin 8) in Blockierlösung hinzufügen und über Nacht bei 4 °C mit sanftem Schütteln inkubieren.
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT und entfernen Sie den Überstand. Waschen Sie das Pellet mit 1 ml PBS für 15 min mit sanftem Schütteln.
- Waschen Sie das Pellet wie in Schritt 5.2.6 für weitere zwei Mal.
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT und entfernen Sie den Überstand. Sekundärantikörper (Ziegenanti-Kaninchen IgG-Alexa Fluor 594, Ziegenanti-Maus IgG-Alexa Fluor 488) in Blockierlösung hinzufügen und über Nacht bei 4 °C mit sanftem Schütteln inkubieren.
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT, entfernen Sie den Überstand, und waschen Sie das Pellet mit 1 ml PBS für 15 min mit sanftem Schütteln.
- Waschen Sie das Pellet wie in Schritt 5.2.9 für weitere zwei Mal.
6. Geweberäumung und Montage der gefleckten Prostata-Organoide für die konfokale Ganztonmikroskopie — TIMING: 7 H
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT und entfernen Sie den Überstand.
- 1 ml 30% Saccharose in PBS mit 1% Triton X-100 hinzufügen und 2 h bei RT mit sanftem Schütteln brüten.
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT und entfernen Sie den Überstand.
- 1 ml 45% Saccharose in PBS mit 1% Triton X-100 hinzufügen und 2 h bei RT mit sanftem Schütteln brüten.
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT und entfernen Sie den Überstand.
- 1 ml 60% Saccharose in PBS mit 1% Triton X-100 hinzufügen und 2 h bei RT mit sanftem Schütteln brüten.
- Pellet die Organoide durch Zentrifugation bei 800 x g für 3 min bei RT und entfernen Sie 95% des Überstandes.
HINWEIS: Das Pellet wird lockerer, wenn die Konzentration von Saccharose höher wird. Es wird empfohlen, die DAPI-gefleckten Organoide unter dem UV-Licht zu beobachten, um zu bestätigen, dass sie bei der Entfernung des Überstandes nicht verloren gegangen sind. - Übertragen Sie ein 10-20-L-Tröpfchen der verbleibenden Suspension auf einen kammerförmigen Deckelschlupf und fahren Sie mit der konfokalen Mikroskopie fort.
HINWEIS: Coverslip-Fragmente können auf beiden Seiten des Tröpfchens platziert werden, um als Abstandshalter verwendet zu werden (Abbildung 4C). Diese verhindern, dass Organoide zusammenbrechen, wenn ein Deckelschlupf über dem Tröpfchen platziert wird.
Ergebnisse
Prostata-Epithelzellen werden in die Organoidkultur der Maus eintellert, wo sie Organoide bilden, die vor der Vorbereitung auf die nachgelagerte Analyse geerntet werden (Abbildung 1).
Basale und luminale Epithelzellen werden mit FACS isoliert. Nach dem Ausschluss von DAPI+ Zellen und erschöpfenden Lin+ Zellen (CD45, CD31, Ter119) werden Basal- und Luminalzellen anhand der differenziellen Expression von EpCAM und CD49f unterschieden (Abbildung 2). Der beschriebene Ansatz, Prostatabasal- und Luminalzellen in die organoide Kultur zu verschichten, beinhaltet: (1) Beschichtung von Zellen in Matrix-Gel-Ringe und (2) Beschichtung von Brunnen mit Poly-HEMA. Plating in Ringe wurde zuvor in Agarwal et al9beschrieben. Mit diesem Ansatz (Abbildung 3A) können Forscher das Matrixgel leichter vermeiden, während sie die Medien auffüllen (Schritt 3), und Organoide leichter zählen, indem sie dem Umfang des Brunnens folgen. Beschichtungsbrunnen mit Poly-HEMA hat gezeigt, dass 2D-Koloniebildung in Netzhautorganoiden zu verhindern17; dieser Ansatz wurde jedoch nicht im Prostataorganoidmodell verwendet. Wichtig ist, dass die Beschichtung von Brunnen mit Poly-HEMA (Tabelle 3) das Auftreten von 2D-Kolonien eliminiert, ohne die Organoidbildung zu stören (Abbildung 3B). Diese Modifikationen erweitern die Fähigkeiten des Prostataorganoid-Assays.
Basale und leuchtdichte Zellen bilden Organoide mit ausgeprägten Morphologien (Abbildung 4A). Während die meisten basalabgeleiteten Organoide nach 7 Tagen in der Kultur ähnlich groß sind (100-300 m Durchmesser), weisen luminale Organoide eine signifikante Heterogenität auf (30-450 m Durchmesser). Darüber hinaus enthalten die meisten basalabgeleiteten Organoide Lumen, die von mehrschichtigem Epithel umgeben sind (Abbildung 4A, oben), während luminale-abgeleitete Organoide in der Morphologie von hohl, mit einschichtigem Epithel bis fest, mit mehrschichtigen Schnüren von Zellen reichen, die nicht kanalisieren ( Abbildung4A, unten). Die oben beschriebenen Ansätze zur Vorbereitung von Organoiden für die nachgelagerte Analyse (Schritte 4, 5) wurden verwendet, um zu untersuchen, ob diese phänotypischen Unterschiede Unterschiede in der Linienmarkerexpression reflektieren. Die Western-Blot-Analyse ergab, dass Basal- und Luminal-abgeleitete Organoide Merkmale beibehalten, die mit basalen und luminalen Primärzellen assoziiert sind. Basalabgeleitete Organoide exprimieren höhere Konzentrationen des Basalmarkers Cytokeratin 5 (K5), während luminale Organoide höhere Konzentrationen des Luminalmarkers Cytokeratin 8 (K8) exprimieren (Abbildung 4B). Sowohl Basal- als auch Luminalmarker wurden in Basal- und Luminal-abgeleiteten Organoiden in der Massenpopulation nachgewiesen, was vielleicht auf eine Differenzierung hindeutet (Abbildung 4B).
Wir versuchten, die Linienmarkerexpression in basalabgeleiteten Organoiden zu charakterisieren und festzustellen, ob morphologisch unterschiedliche luminale-abgeleitete Organoide Unterschiede in der Markerexpression aufweisen, indem wir intakte Organoide färben und konfokale Mikroskopie durchführen (Abbildung 4D). Basalabgeleitete Organoide enthielten mehrschichtiges Epithel mit äußeren Schichten, die hohe Konzentrationen des Basalmarkers p63 und moderate Konzentrationen des Luminalmarkers K8 (p63hi, K8mid) und innere Schichten ohne nachweisbare P63- und hohe K8-Werte (p63lo, K8hi)(Abbildung 4D, oben)ausdrückten. Während alle Zellen in einschichtigen luminalen Organoiden positiv für K8 gefleckt wurden, enthielten nur ausgewählte Zellen Kern p63 (Abbildung 4D, unten). Diese Daten validieren die Ansätze zur Ernte und bereiten Organoide für die Analyse durch Western Blot oder konfokale Mikroskopie vor und erweitern dadurch die Fähigkeit des organoiden Assays, wichtige zelluläre Prozesse, einschließlich Differenzierung, zu untersuchen.
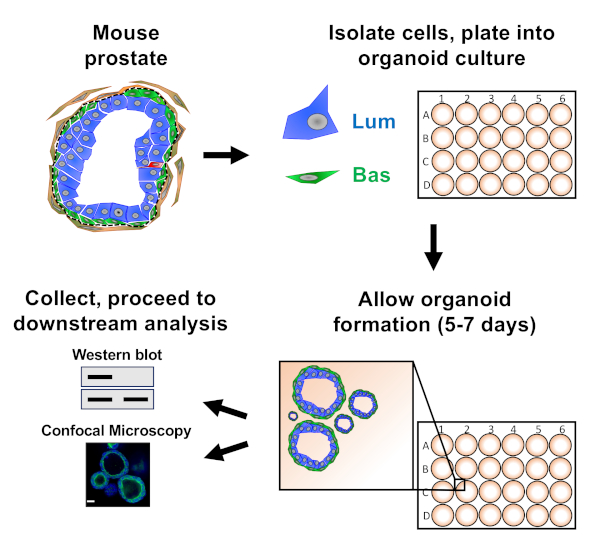
Abbildung 1: Schematische Veranschaulichungsworkflow zur Generierung von Prostataorganoiden für die Sammlung und Analyse. Die gesamte Mausprostata ist dissoziiert und basale und luminale Prostataepithelzellen werden durch fluoreszenzaktivierte Zellsortierung über etablierte Protokolle18,19isoliert. Basale oder luminale Zellen, die in einer Mischung aus Mausorganoidmedien und Matrixgel suspendiert sind, werden in Matrix-Gel-Ringe eintellert. Nach 5 bis 7 Tagen Kultur werden Organoide zur Analyse durch Western Blot oder konfokale Mikroskopie geerntet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
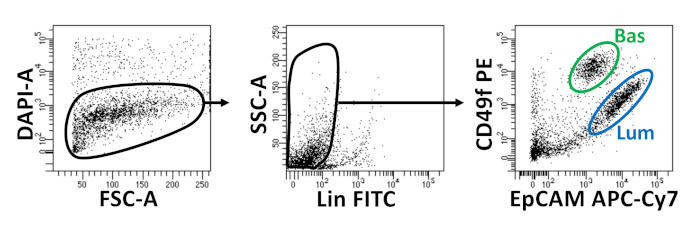
Abbildung 2: Isolierung von Mausbasal- und luminalen Prostataepithelzellen mittels fluoreszenzaktivierter Zellsortierung (FACS). Dissoziierte Zellen von der Mausprostata werden mit DAPI gefärbt, um lebend von abgestorbenen Zellen und Oberflächenantikörpern zu unterscheiden, um Basalzellen von Luminalzellen vor FACS zu unterscheiden. Links = Gated auf DAPI-Zellen. FSC-A = Vorwärtsstreuung. Mitte = Gated auf Lin- Zellen (CD45lo, CD31lo, Ter119lo). SSC-A = Seitenstreuung. Rechts = Basalzellen (Basalzellen) (EpCAMhi, CD49fhi), Luminalzellen (Lum) (EpCAMhi, CD49fmid). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
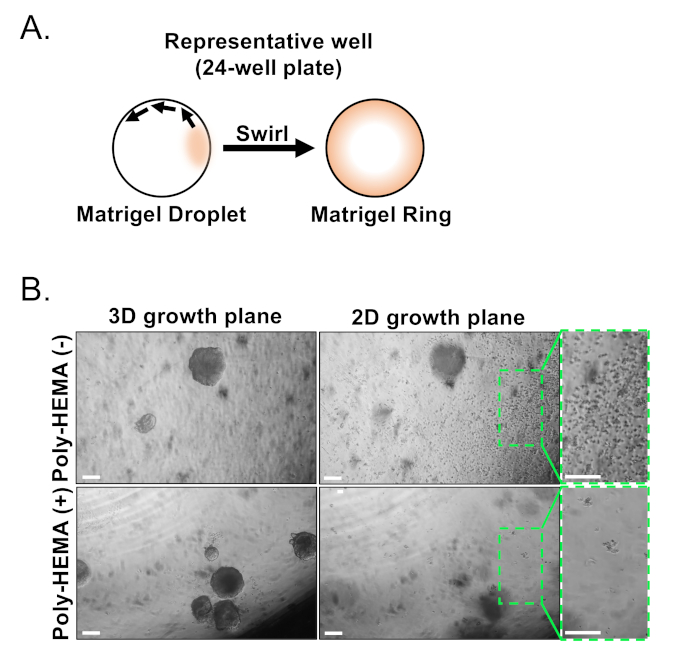
Abbildung 3: Etablierung von Maus-Prostata-Organoiden. (A) Schematische Veranschaulichungsansatz zur Erzeugung eines Matrix-Gelrings in einem Brunnen einer 24-Well-Platte. (B) Repräsentative Phasenkontrastbilder von Organoiden (3D-Wachstumsebene) und zweidimensionalen Kolonien (2D-Wachstumsebene) bildeten sich 7 Tage nach der Beschichtung von Prostataepithelzellen in unbeschichtete (Poly-HEMA (-)) oder beschichtete (Poly-HEMA (+)) 24-Well-Platten. Box-Regionen innerhalb der 2D-Wachstumsebene werden auf der rechten Seite vergrößert. Skalenbalken = 200 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
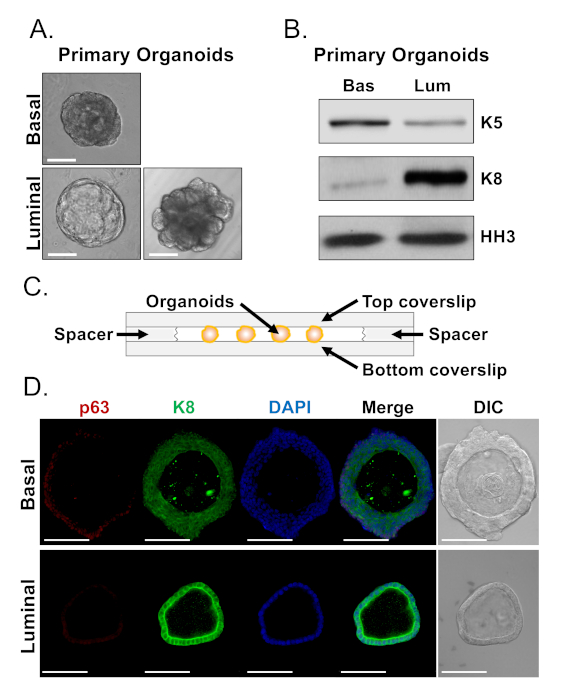
Abbildung 4: Analyse der Linienmarkerexpression in Prostataorganoiden durch Western Blot und vollwertige konfokale Mikroskopie. (A) Repräsentative Phasenkontrastbilder von basal abgeleiteten (oben) und luminalabgeleiteten (unteren) Organoiden nach 7 Tagen Kultur. Skala bar = 100 m. (B) Western Blot Analysis of basal-derived (Bas) and luminal-derived (Lum) organoids after 5 days of culture. Färbung für den Basalmarker, Cytokeratin 5 (K5), und den Luminalmarker, Cytokeratin 8 (K8), und eine Ladekontrolle, Histon H3 (HH3). (C) Schematische Darstellung kammerierter Abdeckungsslip mit Abstandshaltern. (D) Repräsentativer Differentialinterferenzkontrast (DIC) und immunfluoreszierende Bilder von basalabgeleiteten (oben) und luminalabgeleiteten (unteren) Organoiden nach 7 Tagen Kultur. Färbung für p63 (rot), K8 (grün) und DAPI (blau) einzeln und zusammengeführt. Skalenbalken = 100 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Rezepte | |
| Dispasehaltige Medien | 1 mg/ml Dispase + 10 M ROCK-Inhibitor in fortgeschrittenem DMEM F12. Filter sterilisieren mit 0,22 m Filter. |
| Dissoziationsmedien | 10% FBS + 1x Penicillin-Streptomycin in RPMI 1640. Filter sterilisieren mit 0,22 m Filter. |
| Proteinlysepuffer | RIPA-Puffer + Phosphatase-Inhibitoren + Proteasehemmer |
| Blockierlösung | 10% FBS in PBS mit 0,2% Triton X-100 |
Tabelle 1: Anweisungen zur Vorbereitung von Schlüssellösungen.
| Komponente | Konzentration |
| B-27 | 1x (aus 50x Konzentrat verdünnt) |
| GlutaMAX | 1x (aus 100x Konzentrat verdünnt) |
| N-Acetyl-L-Cystein | 1,25 mM |
| Normocin | 50 g/ml |
| Rekombinanter menschlicher EGF, tierfrei | 50 ng/ml |
| Rekombinanter menschlicher Noggin | 100 ng/mL |
| R-Spondin 1-konditionierte Medien | 10% konditionierte Medien |
| A83-01 | 200 nM |
| Dht | 1 nM |
| Y-27632 Dihydrochlorid (ROCK-Hemmer) | 10 m |
| Fortgeschrittene DMEM/F-12 | Basismedien |
| R-Spondin 1-konditionierte Medien werden wie in Drost, et al.13beschrieben, erzeugt. Nach Zugabe aller Komponenten sterilisieren Filter Mausorganoidmedien mit 0,22 m Filter. ROCK-Hemmer wird nur während der Etablierung von Kultur und Passaging von Organoiden hinzugefügt. | |
Tabelle 2: Anleitung zur Herstellung von Mausorganoidmedien.
| Protokoll zur Herstellung poly-HEMA-beschichteter Platten | |
| 1 | 0,25 g Poly-HEMA auf 50 ml 98% EtOH geben. Poly-HEMA bei 37 °C auf einem Shaker auflösen. Dieser Vorgang dauert mindestens 4 h. |
| 2 | Filter sterilisieren Poly-HEMA mit 0,22 m Filter. |
| 3 | Fügen Sie 200 l Poly-HEMA-Lösung pro Bohrung einer 24-Well-Platte(n) hinzu. |
| 4 | Entfernen Sie Deckel von 24-Well-Platten nach Zugabe von Poly-HEMA und lassen Sie die Lösung über Nacht verdampfen. |
| 5 | Waschen Sie jeden Brunnen zweimal mit PBS und stellen Sie sicher, dass die Brunnen vor der Lagerung nach der letzten Wäsche vollständig trocken sind. HINWEIS: Die Unterbrechung der Poly-HEMA-Beschichtung während des Waschens könnte zu einem 2-dimensionalen Wachstum beitragen, wenn Epithelzellen in die Organoidkultur eingeschichten werden. Um Schäden an poly-HEMA-beschichteten Brunnen zu vermeiden, vermeiden Sie den direkten Kontakt mit der Pipettenspitze beim Waschen. Die Integrität der poly-HEMA-beschichteten Bohrungen bleibt erhalten, es sei denn, der Poly-HEMA wird von der Pipettenspitze abgekratzt. |
| 6 | Poly-HEMA-beschichtete Platten können bis zu zwei Wochen bei 4 °C gelagert werden. HINWEIS: Das Umwickeln von Platten in Parafilm vor der Lagerung reduziert das Risiko einer Kontamination. |
Tabelle 3: Protokoll zur Herstellung von poly-HEMA-beschichteten Platten.
Diskussion
Prostataepithelzelldifferenzierung wurde sowohl in der normalen Prostatabiologie2,3,4,5,6,7 und Krankheitsbiologie8,10,11,12; Die Master-Regler dieses Prozesses bleiben jedoch undefiniert. Die Identifizierung wichtiger Regulatoren der Prostataepithelzelldifferenzierung war zum Teil aufgrund des Fehlens gut etablierter Kontexte zur Modellierung schwierig. Während 2D-Monolayer-Kultur verwendet werden kann, um Differenzierung11,12zu modellieren, kann dieser Kontext die komplexe Prostata-Mikroumgebung nicht rekapitulieren. Darüber hinaus eignen sich in vivo-Kontexte zur Modelldifferenzierung nicht für mechanistische Studien, da sie eine Herausforderung zu manipulieren sind. Daher ist die Identifizierung eines leicht zu manipulierenden, aber physiologisch relevanten Kontextes zur Untersuchung der Differenzierung von entscheidender Bedeutung.
Das Prostataorganoidmodell stellt einen eleganten Ex-vivo-Kontext dar, in dem basale bis luminale Differenzierung berichtet wird. Methoden zur Etablierung von Prostataorganoiden sind gut etabliert14; eine weitere Optimierung dieser Methoden ist jedoch erforderlich. Darüber hinaus sind Ansätze zur Ernte und Vorbereitung von Prostataorganoiden für die Analyse nicht klar beschrieben. Dieses Papier beschreibt einen Ansatz zur Platte Prostataepithelzellen isoliert von Maus Prostata in Organoid-Kultur. Dieser Ansatz ermöglicht es Forschern, (1) das Auftreten von 2D-Kolonien während der Organoidbildung zu verhindern, (2) das Risiko einer Störung des Matrixgels während der Medienauffüllung zu reduzieren und (3) Organoide effektiver zu zählen. Darüber hinaus skizziert dieses Manuskript Ansätze zur Ernte von Organoiden zur Vorbereitung auf die Western Blot-Analyse oder zur konfokalen Ganzkörpermikroskopie. Wichtig ist, dass der Ansatz, der zur Vorbereitung von Organoiden für die konfokale Mikroskopie verwendet wird, die intakte Struktur der Organoide während ihrer Dauer aufrechterhält, was Organoidschäden vor der Bildaufnahme reduziert. Insgesamt erweitern die beschriebenen Ansätze die Fähigkeiten des Prostataorganoid-Assays.
Insbesondere kann die organoidbildende Fähigkeit von Basal- und Luminalzellen sowohl durch Methoden zur Isolierung der jeweiligen Populationen als auch durch Kulturbedingungen verändert werden. Die in diesem Test verwendeten organoiden Kulturbedingungen wurden zuerst von Karthaus et al.13beschrieben. Karthaus et al. haben berichtet, dass Basalzellen eine höhere Organoidbildungsfähigkeit haben (15%) als Luminalzellen (1%)13, Chua et al., unter Verwendung unterschiedlicher Isolationsmethoden und Kulturbedingungen, haben berichtet, dass Luminalzellen (0,2-0,3%) organoidbildende Kapazität haben als Basalzellen (0,03%)20. Insgesamt führen die von Karthaus et al. beschriebenen Methoden zu höheren organoiden Bildungsraten sowohl für Basal- als auch für Luminalzellen, was wahrscheinlich Unterschiede im Ansatz widerspiegelt, der zur Isolierung von Basal- und Leuchtlichtzellen13verwendet wird, im Gegensatz zu Kulturbedingungen, die gegen die Organoidbildung aus Leuchtzellen voreingenommen sind. Es bleibt unklar, ob das in diesem Manuskript beschriebene Protokoll die luminale Organoidbildung von multipotenten luminalen Vorläufern oder engagiert-luminalen Vorläufern9begünstigt. Obwohl rechtzeitig und kostenprohibitiv, In-vivo-Lineage-Tracing-Studien können verwendet werden, um Vorläufer-Features im Zusammenhang mit verschiedenen Prostata-Epithel-Linien im Organoid-Assay zu validieren.
Prozesse wie Entwicklung, Differenzierung und Transformation sind nicht nur für die Prostatabiologie relevant, sondern auch relevant für die Biologie anderer Gewebe wie Gehirn, Lunge, Darm, Bauchspeicheldrüse und Leber. Die beschriebenen Methoden erleichtern die Nutzung des Organoidmodells, um diese Prozesse nicht nur in der Prostata, sondern auch in einer Vielzahl von Geweben zu untersuchen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
PDC und JMG werden durch den Ruth L. Kirschstein National Research Service Award GM007185 unterstützt. JAD wird vom National Institute of General Medical Sciences der National Institutes of Health (R25GM055052) unterstützt, das an T. Hasson und das Saul Martinez Stipendium verliehen wird. Die ASG wird durch den Spitzer Family Foundation Fund und das Gill Endowment unterstützt. Diese Arbeit wurde von der American Cancer Society (RSG-17-068-01-TBG), Department of Defense (W81XWH-13-1-0470), Margaret E. unterstützt. Early Medical Research Trust, NIH/NCI (P50CA092131/UCLA SPORE in Prostatakrebs), Rose Hills Foundation und Unterstützung durch das Jonsson Comprehensive Cancer Center der UCLA, das Broad Stem Cell Research Center, das Clinical and Translational Science Institute und das Institute of Urologic Oncology.
Materialien
| Name | Company | Catalog Number | Comments |
| µ-Dish 35 mm, high | ibidi | 81156 | |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 50-980-487 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | D1306 | |
| A83-01 | Tocris | 2939 | |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634010 | |
| APC/Cy7 anti-mouse CD326 (Ep-CAM) Antibody, 100 μg | BioLegend | 118218 | |
| B-27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| Complete Protease Inhibitor Cocktail | Sigma | 11836145001 | |
| (DiHydro)testosterone (5α-Androstan-17β-ol-3-one) | Sigma | A-8380 | |
| Dispase II, Powder | Thermo Fisher Scientific | 17-105-041 | |
| Fetal Bovine Serum (FBS) | Sigma | F8667 | |
| FITC anti-mouse CD31 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 102405 | |
| FITC anti-mouse CD45 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 103107 | |
| FITC anti-mouse TER-119/Erythroid Cells Antibody (0.5 mg/mL, 50 μg) | BioLegend | 116205 | |
| Goat anti-mouse IgG-Alexa Fluor 488 | Invitrogen | A28175 | |
| Goat anti-rabbit IgG-Alexa Fluor 594 | Invitrogen | A11012 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Halt Phosphatase Inhibitor | Thermo Fisher Scientific | 78428 | |
| Matrigel GFR Membrane Matrix | Corning | CB-40230C | |
| Mouse anti-cytokeratin 8 | BioLegend | 904804 | |
| N-acetyl-L-cysteine | Sigma | A9165 | |
| Normocin | Thermo Fisher Scientific | ant-nr-1 | |
| PE anti-human/mouse CD49f Antibody | BioLegend | 313612 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15-140-122 | |
| Poly(2-hydroxyethyl methacrylate) (Poly-HEMA) | Sigma | P3932-25G | |
| Rabbit anti-p63 | BioLegend | 619002 | |
| Radioimmunoprecipitation assay (RIPA) | Thermo Fisher Scientific | PI89901 | |
| Recombinant Human EGF, Animal-Free | PeproTech | AF-100-15 | |
| Recombinant Human Noggin | PeproTech | 120-10C | |
| RPMI 1640 Medium, HEPES (cs of 10) | Thermo Fisher Scientific | 22400105 | |
| Sonic Dismembrator | Thermo Fisher Scientific | FB120 | |
| Sucrose | Sigma | S0389-500G | |
| Triton X-100 | Sigma | X100-5ML | |
| Y-27632 dihydrochloride (ROCK inhibitor) | Selleck Chemical | S1049-50MG |
Referenzen
- Kwon, O. J., Xin, L. Prostate epithelial stem and progenitor cells. American Journal of Clinical and Experimental Urology. 2 (3), 209-218 (2014).
- Choi, N., Zhang, B., Zhang, L., Ittmann, M., Xin, L. Adult Murine Prostate Basal and Luminal Cells Are Self-Sustained Lineages that Can Both Serve as Targets for Prostate Cancer Initiation. Cancer Cell. 21 (2), 253-265 (2012).
- Ousset, M., Van Keymeulen, A., et al. Multipotent and unipotent progenitors contribute to prostate postnatal development. Nature Cell Biology. 14 (11), 1131-1138 (2012).
- Wang, J., et al. Symmetrical and asymmetrical division analysis provides evidence for a hierarchy of prostate epithelial cell lineages. Nature Communications. 5, 1-13 (2014).
- Wang, Z. A., Mitrofanova, A., et al. Lineage analysis of basal epithelial cells reveals their unexpected plasticity and supports a cell-of-origin model for prostate cancer heterogeneity. Nature Cell Biology. 15 (3), 274-283 (2013).
- Kwon, O. J., Zhang, B., Zhang, L., Xin, L. High fat diet promotes prostatic basal-to-luminal differentiation and accelerates initiation of prostate epithelial hyperplasia originated from basal cells. Stem Cell Research. 16 (3), 682-691 (2016).
- Kwon, O. J., Zhang, L., Ittmann, M. M., Xin, L. Prostatic inflammation enhances basal-to-luminal differentiation and accelerates initiation of prostate cancer with a basal cell origin. Proceedings of the National Academy of Sciences. 192 (3), 997-999 (2014).
- Stoyanova, T., et al. Prostate cancer originating in basal cells progresses to adenocarcinoma propagated by luminal-like cells. Proceedings of the National Academy of Sciences. 110 (50), 20111-20116 (2013).
- Agarwal, S., Hynes, P. G., et al. Identification of Different Classes of Luminal Progenitor Cells within Prostate Tumors. Cell Reports. 13 (10), 2147-2158 (2015).
- Ku, S. Y., et al. Rb1 and Trp53 cooperate to suppress prostate cancer lineage plasticity, metastasis, and antiandrogen resistance. Science. 355 (6320), 78-83 (2017).
- Mu, P., et al. SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science. 355 (6320), 84-88 (2017).
- Bishop, J. L., et al. The Master Neural Transcription Factor BRN2 Is an Androgen Receptor-Suppressed Driver of Neuroendocrine Differentiation in Prostate Cancer. Cancer Discovery. 7 (1), 54-71 (2016).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Drost, J., Karthaus, W. R., et al. Organoid culture systems for prostate epithelial and cancer tissue. Nature Protocols. 11 (2), 347-358 (2016).
- McCray, T., Richards, Z., Marsili, J., Prins, G. S., Nonn, L. Handling and Assessment of Human Primary Prostate Organoid Culture. Journal of Visualized Experiments. (143), e59051(2019).
- Lawson, D. A., Xin, L., Lukacs, R. U., Cheng, D., Witte, O. N. Isolation and functional characterization of murine prostate stem cells. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 181-186 (2007).
- Chen, H. Y., Kaya, K. D., Dong, L., Swaroop, A. Three-dimensional retinal organoids from mouse pluripotent stem cells mimic in vivo development with enhanced stratification and rod photoreceptor differentiation. Molecular vision. 22, 1077-1094 (2016).
- Liu, X., et al. Low CD38 Identifies Progenitor-like Inflammation-Associated Luminal Cells that Can Initiate Human Prostate Cancer and Predict Poor Outcome. Cell Reports. 17 (10), 2596-2606 (2016).
- Lukacs, R. U., Goldstein, A. S., Lawson, D. A., Cheng, D., Witte, O. N. Isolation, cultivation and characterization of adult murine prostate stem cells. Nature protocols. 5 (4), 702-713 (2010).
- Chua, C. W., Shibata, M., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nature Cell Biology. 16 (10), 951-961 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten