Method Article
Ein implantierbares System für die chronische In-Vivo-Elektromyographie
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll zur Herstellung eines implantierbaren Systems zur in vivo-chronologischen Aufzeichnung evozierter und spontaner elektromyographischer Potentiale vorgestellt. Das System wird auf die Untersuchung der Reinnervation der Kehlkopfmuskulatur nach Einer Nervenverletzung angewendet.
Zusammenfassung
Die Elektromyographie (EMG) misst die Muskelreaktion auf elektrische Stimulation oder spontane Aktivität von Motoreinheiten und spielt eine wichtige Rolle bei der Beurteilung der neuromuskulären Funktion. Chronische Aufzeichnung der EMG-Aktivität, die den Reinnervationsstatus eines Muskels nach einer Nervenverletzung widerspiegelt, wurde aufgrund der invasiven Natur traditioneller EMG-Aufnahmetechniken eingeschränkt. In diesem Zusammenhang ist ein implantierbares System für die Langzeit-, In-vivo-EMG-Aufnahme und Nervenstimulation konzipiert. Es wurde in einer Studie über Reinnervation der Kehlkopfmuskulatur angewendet und getestet. Dieses System besteht aus 1) zwei bipolaren Elektrodennervenmanschetten und führt zur Stimulierung von jeweils zwei Nerven: dem rezidivierenden Kehlkopfnerv (RLN) und dem inneren Zweig des überlegenen Kehlkopfnervs (SLN); 2) zwei EMG-Aufnahmeelektroden und Leitungen für jede der beiden Kehlkopfmuskeln: hintere Cricoarytenoid (PCA) Muskel und Thyroarytenoid-lateralcricoarytenoid (TA-LCA) Muskelkomplex; und 3) eine Hautaufnahme, die alle implantierten Bleiklemmen über ein Anschlusskabel mit einem externen Aufnahmevorverstärker und Stimulator umgibt. Die Drahtleitungen sind Teflon-beschichtet, Multi-Filament, Typ 316 Edelstahl. Sie sind gewickelt und können sich während der Körperbewegung des wachen Tieres dehnen, um Bleibruch und Elektrodenmigration zu verhindern. Dieses System wird während einer aseptischen Operation implantiert. Danach werden EMG-Basisaufnahmen durchgeführt, bevor das RLN in der zweiten Operation zur Untersuchung der Muskelreinnervation transsektiert wird. Während der gesamten Studie werden mehrere physiologische Sitzungen in dem anästhesierten Tier durchgeführt, um evozierte und spontane EMG-Aktivität zu erhalten, die den Reinnervationsstatus der Kehlkopfmuskulatur widerspiegelt. Das System ist kompakt, im Laufe der Studie ohne Infektionen und sehr langlebig. Dieses implantierbare System kann eine zuverlässige Plattform für die Forschung bieten, bei der eine Langzeitaufzeichnung oder Nervenstimulation bei einem anästhesierten oder sich frei bewegenden Tier erforderlich ist.
Einleitung
Die EMG-Aufzeichnung ist eine nützliche Technik zur Messung der elektrischen Aktivität, die von einem Skelettmuskel erzeugt wird, wenn er durch elektrische Stimulation seines Nervs oder spontanes Abfeuern seiner Motoreinheiten aktiviert wird. Die Überwachung von EMG-Signalen kann zur Beurteilung der neuromuskulären Übertragung und Muskelbiomechanik1verwendet werden. EMG-Aufnahme spielt auch eine wichtige Rolle bei der Charakterisierung der Qualität und Größe der Muskelreinnervation nach Nervenverletzung2,3,4,5. Mehrere EMG-Aufnahmen über den gesamten Zeitraum der Reinnervation können jedoch nicht durch einen invasiven Ansatz erreicht werden. Daher wurden implantierbare Geräte für wiederholte, chronische Stimulation und Aufzeichnung in neuromuskulären Systemen6,7,8,9,10,11,12,13entwickelt. Ziel dieses Papiers ist es, ein Protokoll zur Herstellung und Implantation eines stabilen Systems zur Gewinnung zuverlässiger chronologischer EMG-Daten aus dem Kehlkopf zu beschreiben.
Dieses System wird hier auf die Untersuchung der Kehlkopfmuskelreinnervation angewendet. Zur Orientierung erhalten Sie einen kurzen Überblick über den Kehlkopf (Abbildung 1). Eine präzise Abstimmung zwischen sensorischen und motorischen Komponenten ist für die richtige Muskelbewegung während der Atmung, der Stimmabgabe und des Atemwegsschutzes unerlässlich. Der PCA-Muskel, der sich im hinteren Kehlkopf befindet, ist der einzige Entführer der Stimmfalte. Dieser Muskel wird spontan während der Inspiration aktiviert, um den Glottalbereich für die Inhalation zu erhöhen. Der TA-LCA-Komplex ist der Hauptadduktoren der Stimmfalte. Die Aktivierung dieses Muskelkomplexes zusammen mit einem weiteren Adduktoren (d.h. dem Interarytenoid-Muskel) vermittelt die Falte für Vibrations- und Schallproduktion und schließt die Falte für den Atemwegsschutz beim Schlucken.
Zusätzlich, Motor-Neuron-Fasern innervate sowohl Entführer und Adduktorenmuskeln in der RLN. Die Entführer- und Adduktorenmuskulatur kann anhand der Motoreinheitszusammensetzung14,15unterschieden werden. Der PCA-Muskel zeigt erhöhte Serfeuer während hyperkapnischer und/oder hypoxischer Bedingungen16 aufgrund des Vorhandenseins von inspiratorischen Motoreinheiten. Im Gegensatz dazu sind reflexglottische Verschlusseinheiten (RGC) im TA-LCA-Muskelkomplex vorhanden, die die Glottis reflexartig durch Aktivierung sensorischer Rezeptoren innerhalb der Kehlkopfschleimhaut schließen. Der innere Zweig des überlegenen Kehlkopfnervs (SLN) trägt die affegenen Fasern der Sensorrezeptoren im Kehlkopf17. Obwohl Voicing in erster Linie eine Adduktorenfunktion ist, sind sowohl Entführer- als auch Adduktorenmotoreinheiten an diesem hochentwickelten Kehlkopfverhalten beteiligt.

Abbildung 1: Anatomie des Kehlkopfes. Die Komponenten dieses implantierbaren Systems werden ebenfalls angezeigt. SLN = überlegener Kehlkopfnerv; RLN = rezidivierender Kehlkopfnerv; PCA = hintere Cricoarytenoid Muskel; TA-LCA = Thyroarytenoid-lateraler Cricoarytenoid Muskelkomplex; DBS = Tiefenhirnstimulation. Diese Zahl wurde mit Genehmigung von Wiley27reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Eine Verletzung des RLN kann zu einer Stimmfaltenlähmung (VFP) führen, die sowohl Entführungs- als auch Adduktionsfunktionen durch Kehlkopfmuskeldenervation14,18,19beeinträchtigt. In der Folge tritt die Regeneration der RLN-Nervenfasern und die Reinnervation der Muskeln häufig auf. Jedoch, Reinnervation ist ein zufälliger Prozess und führt in fehlgeleiteten, unangemessene Muskelwiederverbindung in den meisten Fällen. Dies wird als Synkinese bezeichnet, bei der die spontane Aktivierung von Entführer- und Adduktorenantagonisten fehlerhaft ist und eine ineffektive oder sogar paradoxe Bewegung der Stimmfalten14,19,20,21erzeugt. Bei der Synkinese ist die kritische Funktion, die verloren geht, die Stimmfaltenentführung, was zu einer unzureichenden Belüftung führt. Obwohl es laufende Versuche gibt, die Kehlkopfsynkinese entweder durch 1) Blockierung des glottischen Verschlusses mit Botox22,23 oder 2) elektrisch zu stimulierender Glottiköffnung mit einem implantierbaren Herzschrittmacher24,25, gibt es keinen klinischen Eingriff, der die Synkinese zuverlässig verhindert26. Jedoch, Es gibt Hinweise darauf, dass elektrische Konditionierung des PCA-Muskels während der Reinnervation bei einer niedrigen Frequenz fördert angemessene neuromuskuläre Wiederverbindung und minimiert Synkinese von geschieht. Derzeit werden Studien durchgeführt, um die zugrunde liegenden Mechanismen zu klären2.
Der Schwerpunkt dieses Papiers liegt auf der Beschreibung eines einfachen und kostengünstigen implantierbaren Systems zur chronischen Nervenstimulation und EMG-Aufzeichnung. Dieses System kann verwendet werden, um die Auswirkungen der niederfrequenten elektrischen Konditionierung des PCA-Muskels auf die Spezifität seiner nachfolgenden Reinnervation zu untersuchen. EMG-Signale, die von diesem System erhalten werden, können die Qualität und Quantität der Kehlkopfmuskelreinnervation im Laufe der Zeit widerspiegeln.
Protokoll
Diese Studie wurde vom institutionellen Ausschuss für Tierpflege und -nutzung (IACUC) der Vanderbilt University genehmigt und in Übereinstimmung mit dem Guide for the Care and Use of Laboratory Animals (National Institutes of Health, Bethesda, Maryland) durchgeführt. Dieses System umfasst fünf implantierbare Komponenten und ein externes Kabel.
1. Zwei bipolare RLN Stimulus Elektroden Manschetten, jeweils mit paar gewickelten Bleidrähten und Klemmenstiften
- Verwenden Sie Teflon-beschichtete, Multi-Filament, Typ 316 Edelstahldraht (mit isoliertem Durchmesser von 0,0078" oder 0,198 mm) für jeden Manschettenbleidraht. Schneiden Sie einen 70 cm langen Draht und wickeln Sie ihn mit einer Wickelvorrichtung in eine 12 cm lange Feder oder beschaffen Sie vorgefertigte gewickelte Leitungen. Bei Bedarf dehnen Sie die Feder, um ihre Länge für jede Implantatstelle zu erhöhen. Lassen Sie die Enden der gewickelten Leitungen gerade bei 3 mm und 10 mm Länge und entdämmen Sie sie.
- Löten Sie einen vergoldeten Kupfer-Buchsenstift auf das 3 mm-Ende der gewickelten Leitung.
- Zur Vorbereitung der Nervenmanschette ein 5 mm Segment Silikonrohr (OD = 0,156", ID = 0,094" oder OD = 3,96 mm, ID = 2,39 mm) aus einer Schlauchrolle schneiden.
- Um eine Leine in das Rohr einzufügen, verwenden Sie eine 25 G hypodermische Nadel, um durch die Rohrwand 1,5 mm vom Ende und aus der Mitte in der Nähe der Innenwand zu durchdringen. Füllen Sie das 10 mm Ende der Leitung in die Spitze der Nadel. Ziehen Sie die Nadel ab, um den entdämmten Teil in das Rohr zu legen. Biegen Sie das nackte Drahtende außerhalb des Rohres zurück und drehen Sie sich an der Stelle des Eintritts in das Rohr auf die Leitung.
HINWEIS: Verwenden Sie ein Operationsmikroskop, um diese Schritte auszuführen. Eine Sonde kann in das Rohr gelegt werden, um den Draht gegen die Innenwand zu biegen. Das Ziel ist es, den nackten Teil des Drahtes so zu positionieren, dass Reize an den Nerv abgegeben werden können, ohne mechanische Schäden am Nerv zu riskieren. - Legen Sie die zweite Leitung 1,5 mm vom gegenüberliegenden Ende des Rohres mit dem gleichen Verfahren. Richten Sie den Einstiegspunkt an den Punkt des ersten Leads aus. Pierce die Wand mit der Nadel, so dass der nackte Teil des Drahtes in der Nähe der inneren Wand gegenüber der ersten Blei abgelagert wird.
HINWEIS: Wenn man die Röhre hinunterschaut, sollten die beiden Stimuluselektroden eine 45° "V"-Form bilden, die den Nerv einmal an Ort und Stelle streift und die Stromabgabe durch den Nerv von Anode zu Kathode sicherstellt. - Machen Sie einen S-förmigen Schlitz in der Rohrwand gegenüber den Elektrodenpunkten des Eintritts mit einer gekrümmten Schere.
HINWEIS: Die spiralförmigen Lippen der Manschette können dann geöffnet werden, um den Nerv im Inneren zwischen den Elektroden während der Operation zu situieren. - Legen Sie eine Länge von 6-0 Monofilament, nicht resorbierbare Naht in die Manschettenwand an jedem Ende mit einer gebogenen mikrochirurgischen Nadel für die eventuelle Sicherung der Manschette um den Nerv.
- Tragen Sie medizinisches Typ-A Silikongel auf, um alle freiliegenden blanken Drähte außerhalb der Manschette wieder zu isolieren.
2. Zwei bipolare SLN Stimulus Elektroden Manschetten, jeweils mit paar gewickelten Bleidrähten und Klemmenstiften
- Montieren Sie die SLN Stimuluselektrodenmanschette auf die gleiche Weise wie die RLN Stimuluselektrodenmanschette. Verwenden Sie jedoch das kleinere Rohr mit einem Durchmesser (OD = 0,125", ID = 0,062" oder OD = 3,18 mm, ID = 1,57 mm), da der Nerv kleiner im Durchmesser ist.
3. Zwei PCA-Muskel EMG Aufnahmeelektroden, jeweils mit gewickeltem Bleidraht und Klemmenpin
- Montieren Sie eine gewickelte Leitung für die PCA-Muskelelektrode, wie in Schritt 1.1 getan.
- Löten Sie einen weiblichen Stift auf die Leitung, wie in Schritt 1.2 getan.
- Setzen Sie das 10 mm-Ende der PCA-Muskelleitung in die Spitze einer Deep Brain Stimulation (DBS) Elektrode ein, indem Sie die gleiche Strategie für das Einsetzen von Nadelblei in eine Manschette verwenden (Schritt 1.4). Biegen Sie das Ende der Leitung, um einen Haken zu bilden und clip es, um insgesamt 5 mm Aufnahmelänge zur Verfügung zu stellen.
HINWEIS: In dieser Anwendung sind der PCA-Muskel und seine reinnervierenden Nervenklemmen elektrischer Konditionierung ausgesetzt. Stimuli werden durch einen implantierbaren Impulsgenerator (IPG) erzeugt und über eine DBS-Elektrode an den Kehlkopfmuskel abgegeben (Abbildung 1, Einschub). Dieses System ist an die therapeutische Hirnstimulation (z.B. Parkinson-Krankheit) angepasst. Die DBS-Elektrode wird in eine submuskuläre Tasche eingeführt und an Ort und Stelle verankert. Wenn keine Technologie zur elektrischen Konditionierung des Muskels erforderlich ist, kann die PCA EMG Elektrode direkt in den Muskel eingesetzt und durch ihren Haken verankert werden.
4. Zwei TA-LCA Muskelkomplex EMG Aufnahmeelektroden, jeweils mit gewickeltem Bleidraht und Klemmenstift
- Montieren Sie eine gewickelte Leitung für die TA-LCA-Muskelelektrode, wie in Schritt 1.1 getan.
- Löten Sie einen weiblichen Stift auf die Leitung, wie in Schritt 1.2 getan.
- Verbrauchen Sie ein 5 mm x 10 mm rechteckiges Stück gestricktes Polyestertransplantat. Machen Sie ein Loch in der Mitte des Netzes mit einer 20 G hypodermischen Nadel. Führen Sie das 10 mm Ende der Leitung in das Loch ein, wobei weitere 3 mm Spule über das Loch hinausragen. Befestigen Sie die Leitung mit 6-0 Monofilament, nicht resorbierbare Naht.
HINWEIS: Dieses Stück Mesh wird verwendet, um die Elektrode führen, um die Schilddrüsenknorpel über dem Muskelkomplex zu verankern. - Biegen Sie das Ende der Leitung, um einen Haken zu bilden und clip es, um insgesamt 5 mm Aufnahmelänge zur Verfügung zu stellen.
5. Hautbehälter für Verbindungsverbindungen zwischen Elektroden und externen Geräten
- Verwenden Sie einen einreihigen weiblichen Stiftstreifenstecker, um die Buchse zu machen. Schneiden Sie zwei Stücke (jeweils 17,5 mm Länge) aus dem Streifen, die jeweils acht Stiftlöcher enthalten. Zuerst die Außenflächen jedes Stücks mit Schleifpapier aufgravieren und dann mit Phenol in einer Dunstabzugshaube zusammenkleben, um einen zweireihigen Stecker herzustellen. Legen Sie den Stecker in 60–80 °C Wasser in eine Dunstabzugshaube für 30 min, um die Leimhärtung zu ermöglichen.
HINWEIS: Dieses zweireihige Baugruppenformat bietet Komfort bei der Zuweisung von Lochlöchern für Links- und Rechtselektroden. - Schneiden Sie ein 25,6 mm langes Stück aus dem Streifen, um die Frontplatte des Verbinders zu bilden (der Teil, der außerhalb der Implantatstelle für die Hautverankerung ragt). Schneiden Sie ein 5,4 mm x 17,4 mm rechteckiges Loch in die Mitte der Frontplatte mit einem Skalpell.
- Platzieren Sie den zweireihigen Stecker in das rechteckige Loch der Frontplatte, bis er ohne Vorvorsprung mit der Faceplate-Oberfläche gespült wird. Wenn der Stecker nicht in die rechteckige Bohrung der Frontplatte passt, kann das Loch leicht mit einer Datei vergrößert werden. Da die Steckverbinderbohrungen nicht symmetrisch sind, legen Sie die Steckerkante mit den Bohrungen mit größerem Durchmesser in die Frontplatte ein.
HINWEIS: Als Ergebnis wird ein weiblicher Stift, der in die gegenüberliegende Kante des Steckers mit dem kleineren Durchmesser Loch eingesetzt wird, einrastet und sich an Ort und Stelle verriegelt. - Verwenden Sie Phenol, um den Stecker und die Frontplatte zusammenzukleben. Legen Sie die Baugruppe in 60–80 °C Wasser in eine Dunstabzugshaube für 30 min, um die Leimhärtung zu ermöglichen.
- Bohren Sie ein 1,3-mm-Loch an jeder Ecke der Frontplatte und auf jeder Seite der Frontplatte auf halbem Weg von den Enden für insgesamt sechs Löcher.
HINWEIS: Diese Löcher werden verwendet, um die endgültige Hautaufnahme an der Implantatstelle zu befestigen. - Schneiden Sie ein 15 mm langes Rohr aus gestricktem Polyestertransplantat, um die Baugruppe unter der Frontplatte zu umgeben, wodurch die Baugruppe biokompatibel wird. Um das Rohr an der Baugruppe zu befestigen, verwenden Sie eine hypodermische Nadel, um Edelstahldrähte in drei gleichmäßig verteilten Positionen (jeweils 3,8 mm voneinander) entlang ihrer Länge durch die Wand zu fädeln.
- Platzieren Sie in jeder Ecke des Verbinders gleich verteilte Kerben, um die Drähte an der Baugruppenoberfläche zu verankern. Drehen Sie die Enden jedes Drahtes mit einer Zange, um das Rohr zur Baugruppe zu umdrehen, um einen Rock zu bilden.
- Machen Sie eine dauerhafte Markierung auf dem Polyester-Patch an einem Ende der Aufnahme.
HINWEIS: Verwenden Sie diese Markierung zur Orientierung, um das rostrale Ende der Aufnahme während der Implantatoperation zu identifizieren. In rostraler bis kaudaler Richtung sollte die folgende Pinelektrodenzuweisung für jede der beiden Reihen (linke und rechte Seite) wie folgt lauten: PCA EMG, TA-LCA EMG, leeres Loch, leeres Loch, RLN-Anode, RLN-Kathode, SLN-Anode und SLN-Kathode.
6. Externes Anschlusskabel an Aufnahmevorverstärker und Stimulator
HINWEIS: Ein Kabel dient zur Herstellung von Verbindungen zwischen dem implantierten Hautgefäß und externen Geräten während der Nervenstimulation-EMG-Aufnahmesitzungen (Abschnitte 8 und 10). Es besteht aus 12 isolierten Drähten, die mit männlichen Stiften enden, um sie in weibliche Stifte in die Hautaufnahme einzufügen. Dieses Kabel besteht aus zwei Teilen: einem EMG-Aufnahmestecker und Nervenstimulationsdrähten. Ein Aufnahmestecker ist notwendig, um Niederspannungs-EMG-Signale von höheren Spannungsreizartefakten zu isolieren, die von Stimulusstiften ausstrahlen. Aus dem gleichen Grund bleiben zwei Löcher in jeder Reihe des Hautgefäßes unbesetzt, um Aufnahmestifte von Stimulationsstiften zu trennen.
- Verwenden Sie zum Herstellen des EMG-Aufnahmesteckers einen männlichen Streifenstecker (gleiche Länge und Breite, aber die Hälfte der Höhe eines Buchsensteckers). Schneiden Sie es in zwei Stücke, die jeweils nur zwei Löcher enthalten. Befestigen Sie die beiden Teile mit Phenolkleber nach dem gleichen Ansatz, um den zweireihigen Stecker in der Hautaufnahme herzustellen (Schritt 5.1). Nehmen Sie die vier EMG-Aufnahmedrähte im Kabel und stecken Sie ihre Klemmenstecker in jedes der vier Löcher, bis sie sich mit den Spitzen, die über die Bandkante hinausragen, verriegeln.
- Verwenden Sie Knochenzement, um die Oberseite des Steckers zu versiegeln, um Draht-Pin-Verbindungen zu isolieren.
- Verwenden Sie die restlichen acht Drähte im Kabel, die in männlichen Stiften enden, um über ihre weiblichen Pins individuelle Verbindungen zu den Nervenstimulationsmanschetten herzustellen.
7. Erste Implantatchirurgie
- Erhalten Sie einen 1-2 Jahre alten, 20–25 kg schweren Kaneinen beider lei.a. von einem lizenzierten Bauernhof. Akklimatisieren Sie das Tier vor der aseptischen Implantatchirurgie. Autoklav alle Geräte vor der Operation. Halten Sie Nahrung für 10-12 h vor der Operation zurück.
- Bereiten Sie das Tier auf eine Operation vor.
- Rasieren Sie den Kopf und Hals des Tieres und reinigen Sie die Haut mit Alkohol und Betadin Peeling-Lösung. Anästhesisieren Sie das Tier durch intravenöse Injektion von 2–4 mg/kg Tiletamin und Zolazepam-Kombination, gefolgt von 3% Isofluran in Sauerstoff durch Intubation.
- Legen Sie das Tier auf einen Operationstisch mit einem Heizkissen in Supine-Position und drapieren Sie das Tier chirurgisch. Überwachen Sie die Herzfrequenz, Atemfrequenz, Körpertemperatur und Sauerstoffsättigung des Tieres mindestens alle 15 Min während der Operation, um die physiologische Stabilität bei einer moderaten Anästhesieebene zu gewährleisten.
- Machen Sie einen Mittellinienausschnitt von der Schilddrüsenkerbe zum Manubrium. Sezieren Sie die Luftröhre frei von der Speiseröhre und entlarven Sie die untere Grenze des Cricoid Knorpel.
- Positionieren Sie die Stimulusmanschette auf jedem der bilateralen SLNs und RLNs. Schließen Sie die Lippen jeder Manschette mit den beiliegenden Nähten.
- Machen Sie ein Knorpelfenster mit einem Biopsie-Punch (4 mm Durchmesser) an der vorderen Oberfläche des Schilddrüsenknorpels auf jeder Seite. Zeigen Sie die seitlichen Aspekte der beiden TA-LCA-Muskelkomplexe. Setzen Sie die EMG-Aufnahmeelektroden mit einer 23 G Nadel in die TA-LCA-Muskelkomplexe ein, indem Sie den Widerhaken in die Nadelspitze einsetzen. Die Elektrode Polyester-Patch auf Knorpel.
- Platzieren Sie die DBS-Elektrode zusammen mit ihrem Begleithakendraht EMG Aufnahmeelektrode unter dem PCA-Muskel auf jeder Seite. Verwenden Sie ein Endoskop, um zu bestätigen, dass die Stimulation zu einer Stimmfaltenentführung für jeden Kanal führt. Verankern Sie die DBS-Elektroden an dem Cricoid-Knorpel durch 4-0 nicht resorbierbare Nähte.
- Legen Sie alle Drahtleitungen der Nervenstimulations-EMG-Aufnahmeelektroden über ihre weiblichen Pins in die Aufnahme ein. Drücken Sie die Stifte in Löcher mit einem Einsteckwerkzeug, das aus einem Hämostat gestaltet wurde. Versiegeln Sie die untere Oberfläche der Buchse, um Blei-Pin-Verbindungen mit Knochenzement zu isolieren.
- Nachdem der Zement aushärtet, legen Sie den Behälter am rostralen Ende des Mittellinienschnitts durch die Haut und verankern Sie ihn über seinen Polyesterrock zu subkutanen Geweben. Befestigen Sie die Hautkante an der Buchse durch Nähte, die durch die Löcher in der Faceplate gehen.
HINWEIS: Ein Kiefer des Hämostats hat einen Endschlitz, der zu einem Gegensenkerloch führt. Der Bleidraht kann durch den Schlitz in das Loch positioniert und die Stheime gegen den Kopf des Stifts platziert werden. Der zweite Kiefer wird auf der gegenüberliegenden Seite des Behälters platziert. Durch Drücken des Hämostats drückt der Stift in das jeweilige Aufnahmeloch.
- Nachdem der Zement aushärtet, legen Sie den Behälter am rostralen Ende des Mittellinienschnitts durch die Haut und verankern Sie ihn über seinen Polyesterrock zu subkutanen Geweben. Befestigen Sie die Hautkante an der Buchse durch Nähte, die durch die Löcher in der Faceplate gehen.
- Machen Sie einen Schnitt am linken Hals, um den Trapezmuskel freizulegen. Führen Sie eine Sezierung durch, um eine submuskuläre Tasche für die Platzierung des implantierbaren Impulsgenerators zu erstellen. Tunnel jeder DBS führen subkutan zum Nackenschnitt für die Einfügung in das IPG.
- Schließen Sie alle chirurgischen Wunden mit Nähten. Überwachen Sie das Tier genau bis zur vollständigen Genesung von der Operation.
- Postoperative Analgetika (z. B. Buprenorphin: 0,01–0,02 mg/kg) routinemäßig für bis zu 48 h zur Verfügung stellen. Antibiotika (z. B. Cefpodoxim: 10 mg/kg) mindestens 3 Tage lang oral verabreichen. Beherbergen Sie das Tier danach singly für die gesamte Studie, und beschränken Sie die Bewegung für einen Zeitraum von 10 Tagen, um eine normale Wundheilung und Stabilisierung des implantierten Geräts zu ermöglichen.
HINWEIS: Die Hautaufnahme sollte täglich mit gewebekompatibler antiseptischer Lösung gereinigt werden. Darüber hinaus sollten Dummy-Männchen-Pins routinemäßig in die weiblichen Stifte der Hautaufnahme eingesetzt werden, außer während der EMG-Aufnahmesitzungen. Dieses Manöver wird die Ansammlung von Schmutz in der Aufnahme vermeiden, effektive Verbindungen mit dem externen Kabel ermöglichen und Infektionen verhindern.
8. Nervenstimulation-EMG Aufnahmesitzungen an der Grundlinie
HINWEIS: Führen Sie diese Sitzungen 2x–3x nach einer Implantatoperation (Abschnitt 7) und vor einer Nerventransektionsoperation (Abschnitt 9) durch, um EMG-Basissignale zu erhalten, wenn die bilateralen RLN intakt sind. Wenden Sie das folgende Protokoll während einer Standard-Nervenstimulation-EMG-Aufnahmesitzung an (Abschnitte 8 und 10).
- Halten Sie Lebensmittel vor dem Verfahren für 10-12 h. Anästhesisieren Sie das Tier mit Tiletamin und Zolazepam-Kombination (Anfangsbelastungsdosis 2–4 mg/kg durch intravenöse Injektion, dann mit 0,4 mg/kg pro Stunde über eine i.v.-Linie warten). Legen Sie das Tier auf ein Heizkissen in Supine-Position und halten Sie das Tier in einer moderaten Ebene der Anästhesie. Überwachen Sie die Vitalität des Tieres während des Verfahrens, wie in Schritt 7.2 beschrieben.
- Fügen Sie ein null Grad starres Endoskop mit einer angeschlossenen CCD-Videokamera durch ein Laryngoskop ein, um die Stimmfaltbewegung auf der Ebene der Glottis zu visualisieren.
- Verbinden Sie das externe Kabel, das mit dem Laborstimulator und den EMG-Vorverstärkern verbunden ist, über stecker und pins mit der Hautaufnahme. Schließen Sie die Ausgänge der Vorverstärker an ein Datenerfassungsgerät und/oder ein Oszilloskop an, um EMG-Signale anzuzeigen, aufzuzeichnen und zu messen.
- Geben Sie Reize (einzelne rechteckige Impulse, 0,1–0,5 ms Dauer, 0,5–2,0 mA Amplitude) nach links bzw. rechts RLNs, um evozierte EMG-Antworten von bilateralen TA-LCA-Komplexen und PCA-Muskeln unter jeder Bedingung aufzuzeichnen.
- Geben Sie Reize (einzelne rechteckige Impulse, 0,1–0,5 ms Dauer, 0,5–2,0 mA Amplitude) nach links bzw. rechts SLNs, um evozierte EMG-Antworten von bilateralen TA-LCA-Komplexen und PCA-Muskeln unter jeder Bedingung aufzuzeichnen.
- Liefern Sie CO2 gemischt mit Raumluft durch den Mund des Tieres, um Hyperkapniezuführen und die Atemanstrengungdeskraft des Tieres zu erhöhen. Begrenzen Sie die Exposition auf 1 min, während der die maximale Rekrutierung von inspiratorischen Motoreinheiten erfolgt. Zeichnen Sie spontane EMG-Aktivitäten von TA-LCA-Komplexen und PCA-Muskeln unter diesem hyperkapnischen Zustand auf.
- Überwachen Sie das Tier bis zur vollständigen Genesung von der Anästhesie und bringen Sie das Tier in die Anlage zurück.
9. Zweite Operation für Nerventransektion und Anastomose
- Führen Sie die zweite Operation 10-14 Tage nach der ersten Operation durch. Halten Sie Lebensmittel für 10-12 h vor der Operation zurück.
- Anästhetisieren Sie das Tier, drapieren und überwachen Sie Vitalstoffe intraoperativ mit der in Schritt 7.2 beschriebenen Technik.
- Entfernen Sie die Nähte und öffnen Sie den Mittellinienschnitt durch stumpfe Sezierung, wann immer möglich. Vermeiden Sie Schäden an der vorherigen Implantation während der Zerlegung. Stellen Sie die bilateralen RLNs durch Sezieren zur Welt. Isolieren, transect und anastomose jeden Nerv mit 7-0 Monofilament, nicht resorbierende Nähte, um bilaterale Kehlkopflähmung zu induzieren.
- Den Halsschnitt mit steriler Saline und Gentamycin-Antibiotikum bewässern. Schließen Sie das Muskel- und Unterhautgewebe mit 3-0 resorbierbaren Nähten. Schließen Sie die Haut mit 3-0 nicht resorbierbaren Monofilament-Nähten.
- Beobachten Sie das Tier genau bis zur vollständigen Genesung von der Operation.
- Analgetika (z. B. Buprenorphin: 0,01–0,02 mg/kg) regelmäßig für bis zu 48 h postoperativ zur Verfügung stellen. Antibiotika (z. B. Cefpodoxim: 10 mg/kg) mindestens 3 Tage lang oral an das Tier geben. Beschränken Sie das Tier von der Ausübung für einen Zeitraum von 10 Tagen, um eine normale Wundheilung zu ermöglichen.
10. Nervenstimulation-EMG-Aufnahmesitzungen nach bilateralen RLN-Verletzungen
- Führen Sie diese Sitzungen 1x pro Woche während der ersten 3 Monate durch, danach zweiwöchentlich. Befolgen Sie das protokoll, das in Abschnitt 8 für diese Sitzungen beschrieben wird.
Ergebnisse
Beispiele für die Komponenten sind in Abbildung 2dargestellt. Von links nach rechts in Abbildung 2A befinden sich die Nervenreizmanschette, die TA-LCA-Aufnahmeelektrode, die PCA-Aufnahmeelektrode bzw. die Hautschnittstellenaufnahme. Die relative Größe dieser Komponenten kann geschätzt werden. Die Hautaufnahme (Abbildung 2B) hat zwei Reihen von Löchern, in die die weiblichen Stifte am Ende jedes gewickelten Drahtes (Abbildung 2D) eingefügt werden. Sie werden während der Implantationsoperation gegenüber der Frontplatte (Pfeil) eingesetzt. Die Buchse hat eine Polyesterrock (Abbildung 2C) an den Verbinder Seitenwänden befestigt. Dieser Rock wurde entwickelt, um die Aufnahme in Position durch Bindegewebe infiltration zu verankern. Jedes Teflon-beschichtete EMG-Blei aus Edelstahl(Abbildung 2E) ist an der Spitze entdämmt (5 mm), um eine Hakenelektrode für die Muskelaufzeichnung zu bilden. Die Stimulationsmanschette hat zwei Elektroden, die gegen die innere Manschettenwand gefädelt sind. Sie sind durch einen Abstand von 2 mm(Abbildung 2F)getrennt und bilden eine "V"-Form (Abbildung 2G), um die Stromabgabe über den Nerv zu gewährleisten.

Abbildung 2: Komponenten des Implantatsystems. (A) Von links nach rechts ist die Nervenreizmanschette, TA-LCA-Aufnahmeelektrode, PCA-Aufnahmeelektrode bzw. Hautschnittstellen-Buchse. (B) Die Hautaufnahme zeigt zwei Reihen von Löchern. (C) Die Buchse mit einem Polyesterrock, der an den Seitenwänden des Verbinders befestigt ist. (D) Gewickelter Draht mit Buchsenstiften, die in B. (E)Einschub- und Teflon-beschichtetes EMG-Blei aus Edelstahl eingesetzt werden sollen, wird an der Spitze entdämmt (5 mm) zu einer Hakenelektrode für die Muskelaufzeichnung. (F) Die Stimulationsmanschette hat zwei Elektroden, die gegen die innere Manschettenwand gefädelt sind, die durch 2 mm getrennt sind. (G) "V" Formbildung von Elektroden, um die Stromabgabe über den Nerv zu gewährleisten. Diese Zahl wurde mit der Berechtigung27geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 3 zeigt den implantierten Hautbehälter und wie das Kabel von externen Geräten mit den Buchsen verbunden ist. Es sollte beachtet werden, dass Dummy-Männchen-Pins (nicht gezeigt) in die weiblichen Stifte der Buchse eingesetzt werden, um sie zwischen den Aufnahmesitzungen frei von Schmutz zu halten.
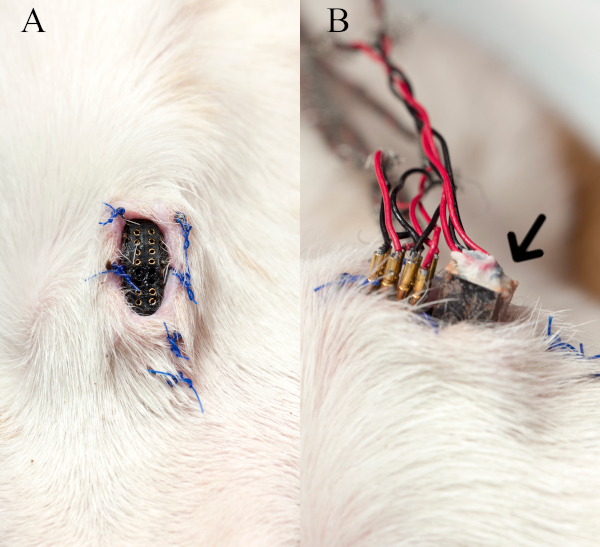
Abbildung 3: Hautaufnahme und Schnittstellenkabel. (A) Die implantierte Hautaufnahme am vorderen Hals ohne Dummy-Männchen-Pins wird gezeigt. (B) Das Bild zeigt, wie die Stimulusstifte und der EMG-Aufnahmestecker (Pfeil) des Kabels von externen Geräten während einer Nervenstimulations-EMG-Aufnahmesitzung mit dem Behälter verbunden werden. Diese Zahl wurde mit der Berechtigung27geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 4 zeigt eine EMG-Aufzeichnung aus einer der Basissitzungen mit intakten RLNs.
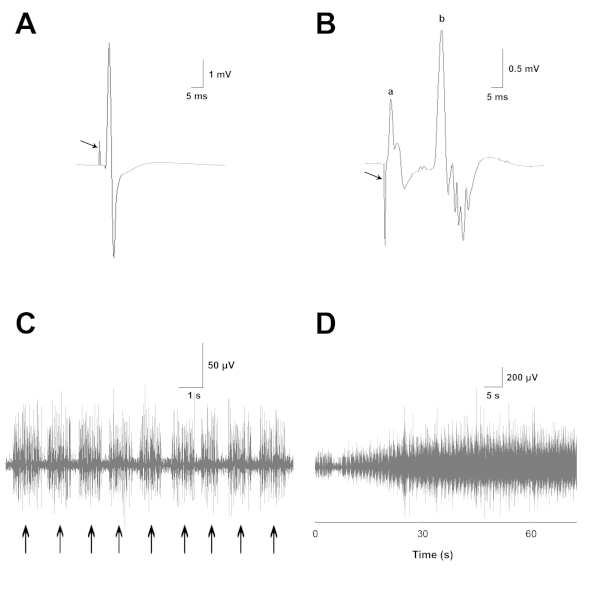
Abbildung 4: EMG-Aufnahmen von Kehlkopfmuskeln mit normaler Innervation. (A) Beispielaufnahme aus dem PCA-Muskel, bei der die RLN-Stimulation ein Reizartefakt (Pfeil) erzeugt, gefolgt von einem großen evozierten EMG-Potenzial. (B) Beispielaufzeichnung des TA-LCA-Muskelkomplexes, bei dem die SLN-Stimulation ein Reizartefakt (Pfeil) erzeugt. Hier vertreten ist (a) eine kurze latenz monosynaptische Muskelreaktion und (b) eine längere latenz polysynaptische RGC-Antwort. (C) Bursts (Pfeile) der spontanen EMG-Aktivität, die während normaler Inspirationen vom PCA-Muskel aufgezeichnet wurde. (D) Zunahme der inspiratorischen EMG-Tätigkeit im Laufe derCO2-Lieferung. Diese Zahl wurde mit der Berechtigung27geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
In einer Aufnahme aus dem PCA-Muskel (Abbildung 4A) erzeugt die RLN-Stimulation ein Reizartefakt (Pfeil), gefolgt von einem großen evozierten EMG-Potenzial. Die maximalen RLN-evozierten Antworten liefern einen guten Index der Gesamtgröße der normalen Innervation sowie des Reinnervationsniveaus nach anschließender Neurorrhaphy, unabhängig vom Typ der Motoreinheit. Dies gilt, weil der RLN Nervenfasern sowohl von inspiratorischen als auch von reflexglottischen Verschlusseinheiten (RGC) enthält. DIE RLN-Stimulation rekrutiert beide Arten von Einheiten. Die evozierte EMG-Motoreinheitsaktivität wird über einen Zeitraum von 20 ms korrigiert und integriert, um ein quantitatives Maß für die Muskelinnervation zu erhalten.
In einer Aufnahme aus dem TA-LCA-Muskelkomplex (Abbildung 4B) erzeugt die SLN-Stimulation ein Reizartefakt (Pfeil). Auf dieses Artefakt folgt eine monosynaptische Muskelreaktion mit kurzer Latenz (a) und eine polysynaptische RGC-Reaktion (b) mit längerer Latenz. Das Potential (a) ist eine direkte Reaktion des Cricothyroidmuskels, da dieser Muskel durch den nahe gelegenen externen Zweig der SLN innerviert wird. Die Stray-Aktivierung dieses Zweigs erfolgt häufig während der Nervenmanschettenstimulation des internen Zweigs, um die RGC-Antwort zu aktivieren. Das Cricothyroid-Potenzial wird von der TA-LCA-Elektrode aufgezeichnet, da sich dieser Muskel in der Nähe des Komplexes befindet. Frühere Studien haben gezeigt, dass das cricothyreoschildige Potential, das durch interne Zweigstimulation hervorgerufen wird, selektiv durch Die Sektionierung des externen Zweigs der SLN (Zealear, unveröffentlichte Beobachtungen) beseitigt werden kann. Die maximalen SLN-evozierten EMG-Antworten spiegeln das Ausmaß der natürlichen Innervation des TA-LCA-Komplexes durch seinen Sensor-Motor-Signalweg RGC wider. Vor RLN Neurorrhaphy, Es gibt keine RGC-Innervation des PCA-Muskels, so dass kein SLN-Potenzial von diesem Muskel erkannt werden sollte. Nach Der Nerventransektion und -reparatur spiegeln SLN-evozierte Potentiale die Menge der korrekten RGC-Reinnervation des TA-LCA-Komplexes und die falsche RGC-Reinnervation des PCA-Muskels wider. Die RGC-Aktivität wird durch Korrektur und Integration über einen Zeitraum von 20 ms quantifiziert, um die gesamte RGC-Wellenform zu erfassen.
In (Abbildung 4C) werden Ausbrüche (Pfeile) spontaner EMG-Aktivität während normaler Inspirationen aus dem PCA-Muskel aufgezeichnet. Diese inspiratorische EMG-Aktivität nimmt im Laufe derCO2-Abgabe zu, wie in (Abbildung 4D) mit einer langsameren Sweep-Geschwindigkeit dargestellt. Spontane PCA EMG Aktivität bietet eine gute Schätzung der Größe der normalen Innervation dieses Muskels durch seine ursprünglichen inspiratorischen Motoneuronen. Es gibt keine inspiratorische Innervation des TA-LCA-Komplexes, daher sollten keine inspiratorischen Potenziale aus diesen Muskeln erkannt werden. Denn nur inspiratorische Motoreinheiten sind an der Entführung der Stimmfalte bei maximaler Inspiratoriumsleistung im anästhesierten Tier beteiligt. Nach Nerventransektion und Reparatur spiegeln spontane inspiratorische Potenziale das Ausmaß der korrekten Reinnervation des PCA-Muskels und die Größe der falschen Reinnervation des TA-LCA-Komplexes wider. Aufnahmen der inspiratorischen EMG-Aktivität werden über einen Zeitraum von 8 s verstärkt, korrigiert und integriert.
Diskussion
In diesem Beitrag werden die Schritte beschrieben, die bei der Herstellung eines neuartigen, wirtschaftlichen und implantierbaren Systems zur Stimulation von Kehlkopfnerven und zur Aufzeichnung von EMG-Antworten aus Kehlkopfmuskeln über einen längeren Dauer erforderlich sind. Das Protokoll ist unkompliziert und kann ein Implantat produzieren, das kompakt genug ist, um bei einem so kleinen Tier wie einer Ratte eingesetzt zu werden. Es gibt mehrere wichtige Schritte, die hervorgehoben werden sollten. Zunächst sollten Bleidrähte sorgfältig und gleichmäßig gewickelt werden, um eine Entdämmung, Verknickung oder Einen Bruch zu verhindern. Wenn keine Wickelmaschine verfügbar ist, können vorgefertigte gewickelte Leitungen kommerziell bezogen werden. Zweitens ist die Strategie, Bleidrähte in ein Silikonrohr einzufügen, um ein "V" zu bilden, das den Nerv überspannt, entscheidend, um die Stromabgabe durch den Nerv in der Manschette zu fördern. Wenn beide Leitungen auf der gleichen Seite des Rohres platziert sind, kann es zu einem Rangieren des Stroms zwischen den Elektroden kommen. Es ist auch wichtig, dass die Leitungen gegen die Rohrinnenwand positioniert sind, um die Möglichkeit einer Schnittverletzung am Nerv zu vermeiden.
Drittens sollten während der Implantationsoperation Die Kehlkopfnerven sorgfältig seziert werden, um Schäden zu vermeiden. Im späteren Stadium der Implantation, beim Einsetzen von Stiften in die Buchse, sollte Kraft auf den Stift in Ausrichtung auf seine Bohrung angewendet werden, um eine plötzliche Beugung des Kopfes des Stiftes zu verhindern. Anschließend sollte Knochenzement gründlich auf dem Behälterboden verteilt werden, um eine vollständige Isolierung und Vermeidung von Übersprechen zwischen kanälen zu ermöglichen. Schließlich ist die Prävention von Infektionen von entscheidender Bedeutung, um die Integrität des Implantatsystems im Laufe der Zeit zu gewährleisten. Es kann durch eine Kombination von mehreren Manövern erreicht werden: Zugabe eines Rocks an der Aufnahme, Verabreichung von Antibiotika, tägliche Reinigung der Wunde und Aufnahme mit gewebekompatibler antiseptischer Lösung, und Platzierung von Dummy-Männchen-Pins in die weiblichen Stifte der Aufnahme, um sie von Schmutz zwischen den Sitzungen zu reinigen.
Das Protokoll hat sich bei diesem Hundekehlkopfmodell bewährt. Einige Änderungen oder alternative Strategien können jedoch für andere Anwendungen in Betracht gezogen werden. So werden beispielsweise die entdämmten Sensorspitzen der PCA- und TA-LCA EMG-Elektroden durch ein externes Mittel in den Muskeln verankert – entweder das Polyestertransplantat oder die DBS-Elektrode. In einer Anwendung, bei der keine externe Verankerung benötigt oder durchgeführt wird, kann allein der Widerhaken der Elektrode als Anker dienen. In einem solchen Fall kann Teflon-beschichteter, rostfreier Edelstahl-Monofilamentdraht angesichts seiner größeren Zugfestigkeit dem Multifilamentdraht vorzuziehen sein, der einen Imgewebe stabileren Widerhaken liefert. Es sollte jedoch beachtet werden, dass Multifilamentdrähte weniger bruchanfällig sein können. Eine alternative Strategie zur Herstellung und Montage der Hautaufnahme ist der 3D-Druck mit biokompatiblen Polymeren (z.B. MED610 von Stratasys). Dies kann den Herstellungsprozess vereinfachen.
Nach der Implantationsoperation und der Genesung des Tieres werden physiologische Sitzungen mit den noch intakten RLNs durchgeführt, um Basisdaten zu erhalten. Während einer Sitzung kann das Fehlen von EMG-Signalen von einem Kehlkopfmuskel nach DER RLN-Stimulation auftreten. Um die Ursache zu beheben (Tabelle 1), sollte zunächst festgestellt werden, ob eine Stimmfaltenbewegung vorhanden ist. Wenn es vorhanden ist, bedeutet dies, dass der Nerv effektiv durch die Manschette aktiviert wird, aber es gibt ein Problem mit dem EMG-Blei. In dieser Situation sollten Benutzer das EMG-Stimulus-Artefakt genauer betrachten. Wenn das EMG-Artefakt fehlt, liegt wahrscheinlich eine Diskontinuität im EMG-Eingang für den Vorverstärker vor. Sechzig-Zyklus-Lärm wird auch vorhanden und groß in Amplitude sein. Wenn das Artefakt groß ist, kann das Rangieren von einem Stimulus-Pin zum Aufnahme-Pin für die Sättigung des Kanalvorverstärkers und das Auslöschen der EMG-Antwort verantwortlich sein. Wenn das Artefakt normal ist, hat sich das EMG-Blei wahrscheinlich vom Muskel entfernt und kann seine Aktivität nicht erkennen. Auf der anderen Seite, wenn die Stimmfaltenbewegung fehlt, dann wird der Nerv nicht aktiviert. Wenn das Artefakt fehlt, kann es zu einer Diskontinuität im Stimulationskreis kommen, die eine Nervenaktivierung verhindert. Wenn das Artefakt normal erscheint, kann der Nerv während einer Implantatoperation verletzt worden sein oder die Manschette ist vom Nerv abgewandert. Eine ähnliche Strategie kann angewendet werden, um die Ursache fehlender EMG-Signale während der SLN-Stimulation zu beheben.
| Stimulierter Nerv | Zielmuskel(n) | Ipsilaterale Stimmfaltenbewegung | Stimulus-Artefakt | Ursachen |
| RLN | PCA und/oder TA-LCA | Ja | Abwesend (60-Zyklus-Rauschen vorhanden) | Diskontinuität im EMG-Eingang zum Vorverstärker (z.B. Blei, Stift, Kabel); |
| Große | Cross-Talk zwischen Stim und Aufnahmestiften am Behälter | |||
| Normalen | Dislokation der EMG-Elektrode | |||
| Nein | Abwesend | Diskontinuität im Stimulationskreis | ||
| Normalen | 1. RLN-Verletzung; 2. Manschettenverrenkung | |||
| SLN | TA-LCA | Ja | Abwesend (60-Zyklus-Rauschen vorhanden) | Diskontinuität im EMG-Eingang zum Vorverstärker (z.B. Blei, Stift, Kabel); |
| Große | Cross-Talk zwischen Stim und Aufnahmestiften am Behälter | |||
| Normalen | Dislokation der EMG-Elektrode | |||
| Nein | Abwesend | Diskontinuität im Stimulationskreis | ||
| Normalen | 1. SLN- oder RLN-Verletzung; 2. Manschettenverrenkung |
Tabelle 1: Leitfaden zur Fehlerbehebung.
Es sollte erwähnt werden, dass es zwei kleinere Einschränkungen in der aktuellen Anwendung dieser Technologie gibt. Zunächst ist es in mehreren Fällen zu einer plötzlichen Beugung des weiblichen Stifts während des Einsetzens in die Aufnahme gekommen. Glücklicherweise können die Stifte begradigt und erfolgreich in ihre Löcher eingesetzt werden. Wenn der Stiftschaden irreparabel ist, müssen das Blei und seine gesamte Komponente ausgetauscht werden. Daher sollten Backup-Komponenten vor der Operation leicht verfügbar sein. Zweitens ist die Zeit, die für die chirurgische Implantation benötigt wird, lang (ca. 10 h). Die lange Dauer spiegelt teilweise die große Anzahl von Stimulations- und Umcodierungskomponenten wider, die für diese Studie erforderlich sind: vier Nerven, vier Muskeln, ein Gefäß und ein IPG. Wenn mit dieser Technologie weniger Komponenten benötigt werden, sollte die Implantationszeit deutlich reduziert werden (z.B. das Rattenzungenmodell28).
Dieser technologische Ansatz führt mehrere Funktionen ein, die gegenüber bestehenden Methoden von Vorteil sind. Das Aufwickeln von Bleidrähten ist das neuste und wichtigste Merkmal dieses Systems. Gewickelte Leitungen sind trotz der vielen Vorteile, die sie bieten, nicht allgemein für nicht-kommerzielle Tierversuche verfügbar. Ein gewickeltes Blei kann während der Implantation auf die gewünschte Länge erweitert werden. Darüber hinaus wird es sich im wachen, beweglichen Tier dehnen, um eine Verwerfung der Elektrodenspitze oder eines Drahtbruchs nach der Implantation zu verhindern. Diese Funktion sorgt für Langlebigkeit des Implantats und stabile Nervenstimulation und Muskelaufzeichnung auf lange Sicht. Darüber hinaus verhindert das Hinzufügen eines gewebekompatiblen Rocks um die Aufnahme die Exposition der Wunde gegenüber diesem Fremdkörper und fördert die normale Fibrose und Wundheilung ohne Infektion. Frühere Studien ohne diesen Rock führten zu einer frühen Infektion und einem vorzeitigen Abbruch des Experiments. Schließlich ist dieses Implantatsystem kompakt und multichanneled, was eine effektive Datenerfassung von zahlreichen neuromuskulären Strukturen in Tiermodellen unterschiedlicher Größe ermöglicht.
Dieser technische Ansatz wurde angepasst und erfolgreich in ein Rattenmodell übersetzt. Diese Studie wurde entwickelt, um die Wirkung der elektrischen Konditionierung bei der Verhinderung von Zungenmuskelatrophie und Dysfunktion bei der alternden Ratte zu untersuchen. Die hypoglossalen Nerven wurden mit den Manschettenelektroden zur Konditionierung und der Zunge mit den EMG-Aufnahmeelektroden28implantiert. Diese Technologie kann auch in anderen Forschungsanwendungen eingesetzt werden. Als Erweiterung des aktuellen Protokolls im Kehlkopf wird derzeit die Wirkung der elektrischen Konditionierung auf die Förderung der selektiven Reinnervation in der Gesichtsmuskulatur von Kaninchen untersucht. Diese Studie kann eine Grundlage für die Prävention von Gesichtssynkinese bei Patienten mit Bells Lähmung, eine häufige und schwächende Erkrankung bieten. Ein letzter möglicher Einsatz dieser Technologie besteht darin, wache, frei bewegliche Tiere zu stimulieren und aufzuzeichnen. Derzeit wurden solche Daten über externes Kabel von wachen, hemmungslosen Ratten28erhalten. In Zukunft kann dieses wirtschaftliche System auch mit einer Fernaufzeichnungs-Stimulationstechnologie (z.B. Telemetrie) kombiniert werden, um neuromuskuläre Systeme drahtlos zu aktivieren oder zu sonden.
Offenlegungen
Dr. David Zealear vertreibt diese implantierbare Nervenstimulations-EMG-Technologie für eine Vielzahl von neuromuskulären Systemen und Tiermodellen.
Danksagungen
Die Autoren danken Dr. Hongmei Wu für ihren Beitrag zur Tierpflege und Datenerhebung während der gesamten Studie. Wir danken Amy Nunnally, Jamie Adcock und Phil Williams für ihre Hilfe bei sterilen Operationen. Das Know-how und das Engagement der Mitarbeiter der Vanderbilt University Animal Care Facility war von unschätzbarem Wert. Diese Forschung wurde durch das NIH-Stipendium U01DC016033 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 20 G x 1" Gauge hypodermic needle | BD | 305175 | |
| 23 G x 1" Gauge hypodermic needle | BD | 305145 | |
| 25 G x 1" Gauge hypodermic needle | BD | 305125 | |
| 3-0 absorbable sutures, COATED VICRYL | Ethicon | J219H | |
| 3-0 monofilament, nonabsorbable sutures, Prolene | Ethicon | 8684G | |
| 4-0 monofilament, nonabsorbable sutures, Prolene | Ethicon | 8871H | |
| 6-0 monofilament, nonabsorbable taper needle suture, Prolene | Ethicon | 8805 | |
| 7-0 monofilament, nonabsorbable sutures, Prolene | Ethicon | M8735 | |
| Adhesive silicone solvent-Hexamethydisiloxane 98% | ACROS | code 194790100 | for dilution of modical adhesive silicone |
| Bone cement | Zimmer | 1102-16 | 20g powder 10 mL liquid |
| Buprenorphine (Buprenex, ampules of 1 mLl) | Reckitt Benckiser Healthcare (UK) Ltd | 12496-0757-1 | |
| CCD video camera attached to the endoscope | Sony | MCC500MD | |
| Cefpodoxime (Simplicef 100 mg tablets) | Zoetis | 5228 | |
| Data acquisition device , PowerLab 16/35 | ADInstruments, Inc | 5761-E | |
| Deep-brain stimulation (DBS) electrodes | Abbott | 6172ANS | |
| Digital oscilloscope | Tektronix | DPO71304SX | |
| Implantable pulse generator (IPG), Infinity | Abbott | 6660ANS | |
| Knitted polyester graft | Meadox Medical Inc | 92220 | 20 mm in diameter |
| Medical Grade Polyethylene Micro Tubing | Amazon.com | BB31695-PE/13-10 | OD 0.156", ID 0.094" |
| Metal female pin | Allied Electronics & Automation | 220-S02-100 | |
| Metal male pin | CDM electronics | 220-p02-1 | |
| Prefabricated coiled leads | Medical innovations Inc. | ||
| Silastic Laboratory Tubing | Cole-Parmer | 2415569 | OD 0.125", ID 0.062" |
| Silastic Medical Adhesive Silicone | Dow corning | Type A, 2 oz | |
| Stainless steel monofilament wire | The Harris Products Group | type 316 | 0.008" (coated), 0.005" (bare) |
| Sterile Disposable Biopsy Punch (4 mm) | Sklar Instruments | 96-1146 | |
| Strip connector | CDM electronics | 2.6 x 11.6 x 101.5 mm | single row, round, through hole |
| Teflon-coated multi-filament stainless steel wire | Medwire | Part 316, ss7/44T | |
| Tiletamine and Zolazepam combination, Telazol - 5 mL | Zoetis | 004866 | |
| Tissue-compatible antiseptic solution, Nolvasan - 1 Gallon | Zoetis | 540561 | |
| Zero-degree rigid endoscope | Karl Storz | 8712AA |
Referenzen
- Electromyography. Wikipedia, The Free Encyclopedia Available from: https://en.wikipedia.org/wiki/Electromyography (2019)
- Zealear, D. L., et al. Stimulation of denervated muscle promotes selective reinnervation, prevents synkinesis, and restores function. The Laryngoscope. 124 (5), 180-187 (2014).
- Gaweł, M. Electrodiagnostics: MUNE and MUNIX as methods of estimating the number of motor units - biomarkers in lower motor neurone disease. Neurologia i neurochirurgia polska. 53 (4), 251-257 (2019).
- Foerster, G., Mueller, A. H. Laryngeal EMG: Preferential damage of the posterior cricoarytenoid muscle branches especially in iatrogenic recurrent laryngeal nerve lesions. Laryngoscope. 128 (5), 1152-1156 (2018).
- Lin, R. J., Smith, L. J., Munin, M. C., Sridharan, S., Rosen, C. A. Innervation status in chronic vocal fold paralysis and implications for laryngeal reinnervation. Laryngoscope. 128 (7), 1628-1633 (2018).
- Koh, T. J., Leonard, T. R. An implantable electrical interface for in vivo studies of the neuromuscular system. Journal of Neuroscience Methods. 70 (1), 27-32 (1996).
- Grimonprez, A., et al. A Preclinical Study of Laryngeal Motor-Evoked Potentials as a Marker Vagus Nerve Activation. International Journal of Neural Systems. 25 (8), 1550034 (2015).
- Haidar, Y. M., et al. Selective recurrent laryngeal nerve stimulation using a penetrating electrode array in the feline model. The Laryngoscope. 128 (7), 1606-1614 (2018).
- Kneisz, L., Unger, E., Lanmüller, H., Mayr, W. In Vitro Testing of an Implantable Wireless Telemetry System for Long-Term Electromyography Recordings in Large Animals. Artificial Organs. 39 (10), 897-902 (2015).
- Inzelberg, L., Rand, D., Steinberg, S., David-Pur, M., Hanein, Y. A Wearable High-Resolution Facial Electromyography for Long Term Recordings in Freely Behaving Humans. Scientific Reports. 8 (1), (2018).
- Horn, K. M., Pong, M., Batni, S. R., Levy, S. M., Gibson, A. R. Functional specialization within the cat red nucleus. Journal of Neurophysiology. 87 (1), 469-477 (2002).
- Larson, C. R., Kistler, M. K. The relationship of periaqueductal gray neurons to vocalization and laryngeal EMG in the behaving monkey. Experimental Brain Research. 63 (3), 596-606 (1986).
- Zealear, D., Larson, C. A Microelectrode Study of Laryngeal Motoneurons in the Nucleus Ambiguus of the Awake Vocalizing Monkey. Vocal Fold Physiology Volume. 2, 229-238 (1988).
- Zealear, D. L., Billante, C. R. Neurophysiology of vocal fold paralysis. Otolaryngologic Clinics of North America. 37 (1), 1-23 (2004).
- Zealear, D. L., et al. Electrical Stimulation of a Denervated Muscle Promotes Selective Reinnervation by Native Over Foreign Motoneurons. Journal of Neurophysiology. 87 (4), 2195-2199 (2002).
- Insalaco, G., Kuna, S. T., Cibella, F., Villeponteaux, R. D. Thyroarytenoid muscle activity during hypoxia, hypercapnia, and voluntary hyperventilation in humans. Journal of Applied Physiology. 69 (1), 268-273 (1990).
- Ludlow, C. L., Van Pelt, F., Koda, J. Characteristics of Late Responses to Superior Laryngeal Nerve Stimulation in Humans. Annals of Otology, Rhinology & Laryngology. 101 (2), 127-134 (1992).
- Li, Y., et al. Comparison of Ventilation and Voice Outcomes between Unilateral Laryngeal Pacing and Unilateral Cordotomy for the Treatment of Bilateral Vocal Fold Paralysis. ORL. 75 (2), 68-73 (2013).
- Mueller, A. H. Laryngeal pacing for bilateral vocal fold immobility. Current Opinion in Otolaryngology & Head and Neck Surgery. 19 (6), 439-443 (2011).
- Crumley, R. L. Laryngeal Synkinesis Revisited. Annals of Otology, Rhinology & Laryngology. 109 (4), 365-371 (2000).
- Hydman, J., Mattsson, P. Collateral reinnervation by the superior laryngeal nerve after recurrent laryngeal nerve injury. Muscle & Nerve. 38 (4), 1280-1289 (2008).
- Marie, J. P., Navarre, I., Lerosey, Y., Magnier, P., Dehesdin, D., Andrieu Guitrancourt, J. Bilateral laryngeal movement disorder and synkinesia: value of botulism toxin. Apropos of a case. Rev Laryngol Otol Rhinol (Bord). 119 (4), 261-264 (1998).
- Zealear, D. L., Billante, C. R., Sant’anna, G. D., Courey, M. S., Netterville, J. L. Electrically stimulated glottal opening combined with adductor muscle botox blockade restores both ventilation and voice in a patient with bilateral laryngeal paralysis. Annals of Otology, Rhinology and Laryngology. 111 (6), 500-506 (2002).
- Zealear, D. L., et al. Reanimation of the paralyzed human larynx with an implantable electrical stimulation device. Laryngoscope. 113 (7), 1149-1156 (2003).
- Mueller, A. H., et al. Laryngeal pacing via an implantable stimulator for the rehabilitation of subjects suffering from bilateral vocal fold paralysis: A prospective first-in-human study. Laryngoscope. 126 (8), 1810-1816 (2016).
- Li, Y., Garrett, G., Zealear, D. Current Treatment Options for Bilateral Vocal Fold Paralysis: A State-of-the-Art Review. Clinical and Experimental Otorhinolaryngology. 10 (3), 203-212 (2017).
- Li, Y., Huang, S., Zealear, D. An implantable system for In Vivo chronic electromyographic study in the larynx. Muscle & Nerve. 55 (5), 706-714 (2017).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & Nerve. 47 (2), 230-240 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten