Method Article
Transduktion und Erweiterung von primären T-Zellen in neun Tagen mit Erhaltung des Zentralen Speicherphänotyps
In diesem Artikel
Zusammenfassung
Wir skizzieren ein 9-Tage-Protokoll für die Transduktion und Expansion von rhesus-makaken peripheren Mononuklezellen im Blut, das Zellen mit hervorragender Koexpression der Gene von Interesse in ausreichender Anzahl für Infusionsstudien zur Zellwirksamkeit ergibt.
Zusammenfassung
Neue Immuntherapien zur Behandlung von Infektionskrankheiten und Krebsarten beinhalten häufig die Transduktion von Zellpopulationen mit Genen, die krankheitsorientierte Proteine kodieren. Zum Beispiel, chimeric Antigen-Rezeptor (CAR)-T-Zellen zur Behandlung von Krebs und Virusinfektionen beinhalten die Transduktion von T-Zellen mit synthetischen Genen, die CAR-Moleküle kodieren. Die CAR-Moleküle lassen die T-Zellen Krebs oder viral infizierte Zellen gezielt erkennen und abtöten. Zellen können auch mit anderen Genen von Interesse kodukiert werden. Beispielsweise können Zellen mit Genen kodukiert werden, die Proteine kodieren, die Zellen an bestimmte Orte zielen. Hier stellen wir ein Protokoll zur Transduce primärperipherer peripherer mononukleärer Blutzellen (PBMCs) mit Genen vor, die für ein virusspezifisches CAR und das B-Zellfollikel-Homingmolekül Chemokin-Rezeptor Typ 5 (CXCR5) kodieren. Dieses Verfahren dauert neun Tage und führt zu transduzierten T-Zellpopulationen, die einen zentralen Speicher-Phänotyp beibehalten. Die Aufrechterhaltung eines zentralen Gedächtnisses oder eines weniger differenzierten Phänotyps hat sich nach der Infusion mit der Persistenz von Zellen in Verbindung gebracht. Darüber hinaus weisen Zellen, die mit dieser Methode hergestellt werden, ein hohes Maß an Lebensfähigkeit, ein hohes Maß an Koexpression der beiden transduzierten Gene und genügend Zellen für eine immuntherapeutische Infusion auf. Dieses neuntägige Protokoll kann allgemein für CAR-T-Zellen und andere T-Zell-Immuntherapie-Ansätze verwendet werden. Die hier beschriebenen Methoden basieren auf Studien, die in unseren früheren Publikationen vorgestellt wurden.
Einleitung
Zelluläre Immuntherapien entwickeln sich zu einem neuen Mittel zur Behandlung von Krankheiten wie Krebs und Infektionskrankheiten. Diese Immuntherapie-Methoden beinhalten oft genetisch manipulierende therapeutische Zellen, um bestimmte Moleküle auszudrücken. Zum Beispiel, chimeric Antigen-Rezeptor (CAR) T-Zellen sind entwickelt, um ein CAR-Molekül auszudrücken, die eine extrazelluläre Domäne hat, die speziell Moleküle auf erkrankte Zellen bindet und eine Signaldomäne, die die Immunzellen auslöst, um die erkrankte Zelle zu töten. CAR-T-Zellen werden erfolgreich in Krebsimmuntherapien eingesetzt und sind besonders wirksam bei der Behandlung von B-Zell-Leukämien1,2,3. CAR-T-Zellen werden auch entwickelt, um virale Infektionen wie HIV zu behandeln. HIV-spezifische CARs zielen auf die Hüllkurvenproteine auf der Oberfläche von viral infizierten Zellen4ab. Immuntherapeutische Zellen können auch entwickelt werden, um homing Moleküle auszudrücken, um therapeutische Zellen auf bestimmte Gewebestandorte zu zielen. Wir haben Vektoren entwickelt, die sowohl ein virusspezifisches CAR als auch das lymphoide Follikel-Homingmolekül CXCR55transduzieren.
Die Virusreplikation einiger Viren, einschließlich des humanen Immundefizienzvirus (HIV) und des Simian-Immundefizienzvirus (SIV), konzentriert sich innerhalb der B-Zellfollikel in sekundären Lymphgeweben6. B-Zellfollikel sind etwas immunprivilegierte Stellen, an denen niedrige Mengen an virusspezifischer CTL eine laufende Virusreplikation ermöglichen7,8. Aus diesen Gründen ist die Ausrichtung von HIV/SIV-spezifischen T-Zellen auf den Follikel durch Expression von CXCR5 eine Strategie zur Eliminierung des Follikelreservoirs von viral infizierten Zellen9,10. Insbesondere zielen wir auf SIV-spezifische CAR-T-Zellen auf B-Zellfollikel über CXCR5-Co-Expression.
In diesem Protokoll beschreiben wir eine Methode zur Transduce von CAR/CXCR5 und zur Erweiterung von PBMCs, um CAR/CXCR5 T-Zellen in ausreichender Menge für die therapeutische Infusion zu produzieren. Zellen, die mit diesen Methoden transduziert werden, erhalten einen zentralen Memory-Phänotyp. Studien haben gezeigt, dass Zellen mit einem weniger differenzierten Phänotyp, wie zentrale Gedächtnis-T-Zellen und T-Speicherstammzellen besser bestehen als differenziertere Zellen11,12. Darüber hinaus haben viele Protokolle zur Produktion von adoptiv übertragenen Zellen relativ lange Kulturzeiten, die zu Zellen führen, die einen differenzierteren Phänotyp und eine reduzierte Persistenz haben13. Darüber hinaus, Adoptiv übertragene Zellen mit langen Kulturzeiten in der Lunge statt Ziel-Lymphgewebe in Rhesus makaken14,15angesammelt. In den Methoden, die wir hier beschreiben und demonstrieren, transduzieren und erweitern wir rhesus-makake PBMCs schnell, um transduzierte T-Zellen zu produzieren, die einen zentralen Speicherphänotyp beibehalten.
Sowohl CD4- als auch CD8-T-Zellen sind in unserem Immuntherapie-Ansatz enthalten. Diese gemischte Zellpopulation wurde gewählt, weil in klinischen Studien das Fehlen von CD4+ T-Zellen im CD8+ T-Zellprodukt mit einem Versagen infundierter CD8-T-Zellen korreliert wurde, um 16zu persistieren. Die hier beschriebenen Methoden beginnen mit der Aktivierung von PBMCs mit Anti-CD3- und Anti-CD28-Antikörpern, die den T-Zellrezeptor stark stimulieren und ein kostimulierendes Signal liefern, um klonale Anergie zu vermeiden17,18.
Nach der Aktivierung werden die Zellen mit einem gammaretroviralen Vektor transduziert, der ein virusspezifisches CAR und das lymphoide Homingmolekül CXCR5 kodiert. Die transduzierten Zellen werden dann mit Platten erweitert, die für die nicht haftende Zellvermehrung ausgelegt sind und an der Basis eine gasdurchlässige Membran haben. Diese Membran ermöglicht den Gasaustausch am Boden des Brunnens, was zu einem verbesserten Zellüberleben und einer verbesserten Nährstoffverfügbarkeit19führt. Mit diesen Methoden können in einem 9-Tage-Zeitrahmen für In-vivo-Infusionsstudien ausreichend funktionelle Zellen produziert werden. Während dieses Protokoll für die Transducing und Erweiterung von Rhesus-Makaken-T-Zellen mit leichter Modifikation der artspezifischen aktivierenden Antikörper konzipiert ist, kann es mit Zellen anderer Arten verwendet werden. Diese Methoden basieren auf unseren zuvor veröffentlichten Studien9,20.
Protokoll
HINWEIS: Dieses Rhesus PBMC-Transduktionsprotokoll erfordert die Verwendung eines gammaretroviralen Vektors. Beachten Sie, dass Gammaretrovirus entweder im Labor produziert oder an eine virale Produktionsfirma ausgelagert werden kann. In labor kann die Produktion mit dem in Schritt 1 beschriebenen Protokoll durchgeführt werden und das Virus kann wie in Schritt 2 beschrieben gezähmt werden. Ob das Virus vor Ort oder von einer Produktionsfirma produziert wird, sollte für jede neu produzierte Viruszubereitung und die von Interesse bestimmten Zellen ein MOI (Verhältnis von infektiösen Virionen zu Zellen in kultur) bestimmt werden.
VORSICHT: Die Arbeit mit gammaretroviralen Vektoren oder anderen retroviralen Vektoren erfordert angemessene Sicherheitsvorkehrungen wie die Verwendung von Labormänteln und doppelten Handschuhschichten. Der gesamte Umgang mit dem Virus muss in der Biosicherheitshaube erfolgen. Alle Pipetten sollten in einer Lösung von 10% Bleichmittel für 30 min dekontaminiert werden. Alle flüssigen infektiösen Abfälle sollten mit einer Endkonzentration von 10% Bleichmittel dekontaminiert werden. Sekundäres Containment mit einer Dichtung, die die Freisetzung mikrobiologischer Aerosole verhindert, ist für die Zentrifugation erforderlich
1. Herstellung des Gammaretroviralstocks
- Platte 293T Zellen für die Transfektion. Eine vollständige Viruspräparation erfordert 12 T75-Flaschen mit 4,5 x 106 Zellen/Kolben in Dulbeccos modifiziertem Eagle Medium (DMEM) + 10% fetalem Rinderserum (FBS) ohne Antibiotika.
- Lassen Sie die Zellen über Nacht bei 37 °C vor der Transfektion wachsen.
- Verdünnen Sie 60 l Transfektionsreagenz in 1,5 ml reduzierten Serummedien. Bereiten Sie eine Röhre für jeden Kolben vor. 5 Minuten bei RT inkubieren.
- Bereiten Sie für jeden Kolben ein Rohr vor, das 1,5 ml reduzierte Serummedien und die folgenden Plasmide enthält: 9,0 g eines Transferplasmids, das das/die Gen(e) enthält, 3 g RD114 und 1,2 g VSV-G (Umschlagplasmide) und 3 g Knebel/Pol.
HINWEIS: Die Hülle und Knebel/Pol-Gene werden für retrovirale Verpackungen benötigt. Für unsere retrovirale Produktion fügen wir sowohl den RD114-Umschlag als auch, für zusätzliche Stabilität, eine kleine Menge VSV-G-Umschlag hinzu. - Verdünnte Plasmide (Schritt 1.4) zu verdünntem Transfektionsreagenz hinzufügen (Schritt 1.3). Mischen Sie sanft. 20 min bei Raumtemperatur inkubieren.
- Futterzellen 5 ml frische serfüllende Medien und fügen Sie 3 ml Transfektionsreagenz/Plasmid-Gemisch tropfenweise pro Kolben hinzu und inkubieren Sie für 5–6 h bei 37 °C.
- Fügen Sie den Kolben weitere 5 ml frisches Medium hinzu und brüten Sie 42–43 h bei 37 °C.
- Nach einer Gesamttransfektionszeit von 48 h Medien und Zentrifugen bei 1282 x g für 3 min bei 4 °C sammeln, um Zellablagerungen zu entfernen.
- Aliquot in geeignete Mengen für die zukünftige Verwendung, Blitz einfrieren das Virus in einem Ethanol / Trockeneisbad und lagern bei -80 °C.
2. Titering des Gammaretrovirus
HINWEIS: Es können mehrere Verdünnungen des Virus erforderlich sein, um einen gültigen Titer zu erhalten.
- Platte 293T Zellen bei 600.000 Zellen/gut in einer 6-Well-Platte und inkubieren die Platten für 24 h bei 37 °C.
- Entfernen Sie das Medium aus den Zellen und fügen Sie die gewünschte Menge DMEM + 10% FBS zum 293T (2 ml Gesamtvolumen des Virus) hinzu.
- Fügen Sie das Virus in den entsprechenden Brunnen und wirbeln sanft zu mischen. Fügen Sie z. B. 4 Bohrungen mit 4 Bohrungen hinzu. Schließen Sie einen Brunnen ohne Virus für die Durchflusszytometrie ein (Mock-Probe).
- 48 h bei 37 °C inkubieren.
- Versuchen Sie die 293T-Zellen, indem Sie 0,5 ml Trypsin-EDTA hinzufügen und 4 min bei 37 °C inkubieren. Stoppen Sie das Trypsin, indem Sie 1,5 ml DMEM + 10% FBS hinzufügen. Zählen Sie die Zellen und bestimmen Sie die Lebensfähigkeit mit einem automatisierten Zellzähler oder einem Hämozytometer.
- Um den Zellzähler zu verwenden, fügen Sie 10 L Zellen zu 10 l Trypan-Blau hinzu, mischen, laden Sie das Kammerschiebeblatt und fügen Sie ihn in den Zähler ein. Drücken Sie die Schaltfläche "Capture", um die Zellen zu zählen.
- Sammeln Sie 0,5–1 x 106 Zellen und bewerten Sie die Konzentrationen von CAR und CXCR5 durch Durchflusszytometrie (siehe Schritt 9.5). Die Expression von CD4 oder MBL zusammen mit CXCR5 identifiziert transduzierte 293T-Zellen, die car und CXCR5 ko-exproszieren. Siehe reaktive Antikörper in Schritt 9.5.1.
- Berechnen Sie viralen Titer.
HINWEIS: Wählen Sie die Probe mit einem Transduktionsgrad von 20 % oder weniger für die Berechnung des Titers aus.- Verwenden Sie die folgende Formel, um Titer zu berechnen:
Transduktionseinheiten/ml = (Anzahl der Zellen in Kultur)(% der übertragenen Zellen)/Volumen des Virus, das der Kultur zugesetzt wurde
- Verwenden Sie die folgende Formel, um Titer zu berechnen:
3. Bestimmung des optimalen MOI für eine neu produzierte virale Zubereitung und die Voninteresse gewonnenen Zellen
- Folgen Sie dem Transduktionsprotokoll (Abschnitte 4–9) mit primären PBMCs und zweifachen Verdünnungen der Gammaretroviral-Präparation.
- Bewerten Sie den Grad der Expression der Gene von Interesse durch Durchflusszytometrie (Schritt 9.5).
- Wählen Sie eine Viruskonzentration, die eine maximale Transduktion ohne Verlust der Zelllebensfähigkeit ermöglicht.
4. Vorbereitung von Platten für die T-Zellaktivierung durch Beschichtung von Brunnen mit Anti-CD3-Antikörpern
- Bereiten Sie Anti-Macaque CD3-Antikörper (FN18) vor, indem Sie den Bestand in phosphatgepufferter Saline (PBS) auf 10 g/ml verdünnen.
- 2 ml/gut in 6-Well-Platten geben. Bei 37 °C für 2 h inkubieren. Alternativ können die Platten über Nacht bei 4 °C inkubiert werden.
- Aspirieren Sie die PBS und ungebundene Antikörper. Spülen Sie Brunnen zweimal mit 2 ml PBS und verwenden Sie sofort, um PBMCs zu verplatten.
5. Stimulierung von Rhesus-PBMCs mit plattengebundenem Anti-CD3 und löslichem Anti-CD28
- Primäre Rhesus-PBMCs in einem 37 °C-Wasserbad mit sanfter Rührung auftauen, bis nur noch eine kleine Menge Eis übrig bleibt.
- In der Haube, sanft Pipettenzellen in ein konisches Rohr. Spülen Sie die Durchstechflasche mit 1 ml Basismedium und fügen Sie sie langsam zu den Zellen hinzu. Als nächstes fügen Sie den Zellen langsam weitere 9 ml warmes Basismedium hinzu.
HINWEIS: Dieser Schritt kann skaliert werden, aber nie mehr als 4 Durchstechflaschen gleichzeitig auftauen. - Zentrifuge bei 600 x g für 5 min bei 22 °C, um die Zellen zu pellet. Den Überstand ansaugen und dann das Pellet in einem kleinen Wachstumsmedium wieder aussetzen. Wählen Sie ein Volumen so, dass die Konzentration der Zellen an dieser Stelle 2 x 106 Zellen/ml überschreitet, da die Endkonzentration 2 x 106 Zellen/ml betragen sollte.
- Stain Zellen mit Trypan blau und zählen Sie die Zellen, um die Anzahl der lebensfähigen Zellen zu bestimmen.
HINWEIS: Dies kann mit einem Standardhämozytometer oder einem automatisierten Zellzähler erfolgen. Wir verwenden einen automatisierten Zellzähler, der die Lebensfähigkeit und Anzahl der lebenden Zellen anzeigt.- Um den Zähler zu verwenden, fügen Sie 10 L Zellen zu 10 l Trypan blau hinzu, mischen, laden Sie den Kammerschlitten und legen Sie ihn in den Zähler ein. Drücken Sie die Schaltfläche "Capture", um die Zellen zu zählen.
- Berechnen Sie die Gesamtzahl der Zellen, indem Sie die Zellkonzentration mit dem Volumen multiplizieren, und verdünnen Sie die Zellen dann auf 2 x 106 Zellen/ml im Wachstumsmedium. Vor der Beschichtung anti-CD28 zu einer Endkonzentration von 5 g/ml hinzufügen, um ein notwendiges Co-Stimulatoriumssignal für die T-Zellaktivierung bereitzustellen.
- Pipettenzellen in Anti-CD3-beschichtete Platten. Fügen Sie 3–6 x 106 Zellen pro Bohrkörper hinzu (ein gutes Ziel sind 4 x 106 Zellen in 2 ml Medien pro Bohrkörper) und 2 Tage lang bei 37 °C in 5% CO2brüten.
6. Vorbereitung von Fibronectin-beschichteten Platten
HINWEIS: PBMC- und T-Zellen exprimieren Integrinrezeptoren VLA-4 oder VLA-5 und sind gute Ziele für fibronectin-vermittelte Transduktion.
- Vor der Beschichtung der Platten, bereiten Sie zunächst Fibronectin Reagenz durch Verdünnen es 1:100 in sterilen PBS.
- 2 ml der sterilen Fibronectin-Lösung in jeden Brunnen einer 6-Well-Platte. Leicht Gesteinsplatten für 2 h bei Raumtemperatur.
HINWEIS: In diesem Schritt sollten unbehandelte, zellkulturtaugliche Gewebekulturplatten oder -gerichte verwendet werden. - Entfernen Sie die Fibronectin-Lösung durch Aspiration und blockieren Sie dann mit 1 ml sterilem 2% Rinderserumalbumin (BSA, Fraktion V) in PBS. Schaukeln Sie die Platten bei Raumtemperatur für 30 min.
- Aspirieren Sie die BSA-Lösung und waschen Sie die Platte mit 2 ml PBS. Nach dem Absonieren des PBS können die fibronectinbeschichteten Platten mit Dichtungsfolie versiegelt und bis zu einer Woche bei 4 °C gelagert werden.
HINWEIS: Wir bereiten die Platten in der Regel einen Tag vor der Transduktion vor.
7. Transduktion aktivierter Rhesus-PBMCs
VORSICHT: Die Arbeit mit viralen Vektoren oder mit Rhesus-Makaken-PBMCs erfordert die Verwendung geeigneter Sicherheitsvorkehrungen wie die Verwendung von Labormänteln und doppelten Handschuhschichten. Der umgang mit dem Virus und den Zellen muss in der Biosicherheitshaube erfolgen. Alle Pipetten sollten in einer Lösung von 10% Bleichmittel für 30 min dekontaminiert werden. Alle flüssigen infektiösen Abfälle sollten mit einer Endkonzentration von 10% Bleichmittel dekontaminiert werden. Für die Zentrifugation ist eine sekundäre Einschließung mit einer Dichtung erforderlich, die die Freisetzung mikrobiologischer Aerosole verhindert.
- Befestigen Sie den gammaretroviralen Transducing-Vektor an den fibronectinbeschichteten Brunnen.
- Erwärmen Sie eine Zentrifuge auf 32 °C, indem Sie bei 2000 x g für ca. 30 min laufen.
- Erwärmen Sie sowohl serumfreie als auch Wachstumsmedien in einem 37 °C-Wasserbad.
- Tauen Sie das Virus auf Eis oder durch sanftes Wirbeln der Durchstechflasche in einem 37 °C Wasserbad, bis nur noch eine geringe Menge Eis übrig bleibt. Um eine Verschlechterung der virusbiologischen Zubereitung zu vermeiden, lassen Sie den Inhalt nicht aufwärmen.
- Verdünnen Sie das Retrovirus zu einer vorgegebenen optimalen Infektionsvielfalt (MOI) im serumfreien Medium.
HINWEIS: Mit unserem Gammaretrovirus und Rhesus PBMC haben wir festgestellt, dass ein MOI von 0,5 optimal ist.- Beispiel Verdünnung: Um 4 Brunnen mit Virus zu beschichten und 1,5 x 106 Zellen hinzuzufügen, werden (4)(1,5 x 106)(0,5) = 3 x 106 TU benötigt. Wenn der virale Titer 1,1 TU/ml ist, dann verwenden Sie 2,7 ml Virus in 5,3 ml Medien für ein Gesamtvolumen von 8 ml.
- Fügen Sie 2 ml verdünntes Retrovirus in jeden Brunnen der Fibronectin-beschichteten Platte hinzu.
- Für negative Kontroll-Mock-transduced Zellen, fügen Sie Medien allein zu den fibronectin-beschichteten Brunnen.
- Legen Sie die Platten in die vorgewärmte 32 °C-Zentrifuge in Mikroplattenträgern mit biosicheren Abdeckungen und Zentrifuge bei 2000 x g für 2 h.
HINWEIS: Virusbeschichtete Platten können sofort verwendet oder mit Virus bei 4 °C über Nacht gelagert werden. - Für den sofortigen Gebrauch, aspirieren Sie die Virus-Vorbereitung aus den Brunnen und fügen Sie 2 ml Wachstumsmedium. Halten Sie die virenbeschichteten Brunnen vor dem Trocknen.
- Die stimulierten PBMCs.
- Überprüfen Sie die Zellen mit einem invertierten Mikroskop. Die Zellen sollten gesund aussehen, was bedeutet, dass sie rund, hell und gebrochenes Licht sind. Sie sollten auch ein verklumptes Aussehen zeigen, das stimulationiert.
- Sammeln Sie die Zielzellen und übertragen Sie sie in ein 50 ml konisches Rohr. Spülen Sie den Brunnen einmal mit 1 ml Wachstumsmedium und fügen Sie die konische Röhre hinzu. Zählen Sie die Anzahl der lebenden Zellen mit dem automatisierten Zellzähler wie in Schritt 5.4.
HINWEIS: Stimulierte Zellen werden verklumpt und diese Verklumpung kann zu Schwierigkeiten bei der genauen Zählung der Zellen führen. - Pellet die Zellen in den Rohren durch Zentrifugieren bei 600 x g für 5 min bei 32 °C. Die Medien aus dem Zellpellet absaugen und die Zellen im Wachstumsmedium in einer Konzentration von 1,5 x 106 Zellen/ml wieder aussetzen.
- Zu jedem virusbeschichteten Brunnen (vorbereitet in Schritt 7.1) 1 ml Zellsuspension für insgesamt 1,5 x 106 Zellen/3 ml hinzufügen. Beachten Sie, dass jeder Brunnen bereits 2 ml Wachstumsmedium enthält. Führen Sie die gleichen Schritte für Mock-transduced Zellen, aber Platte sie auf fibronectin-beschichteten Brunnen, die kein Virus erhalten.
- Zentrifugieren Sie die Platten bei 1000 x g für 10 min bei 32 °C.
- Inkubieren Sie die Platten für 48 h bei 37 °C unter 5%CO2.
8. Ausdehnung der transduzierten Zellen
- Zeichnen Sie den Inhalt der Bohrungen mit einer 5 ml Pipette nach oben und unten, um die Zellen wieder zu suspendieren und dann in ein 50 ml konisches Rohr zu übertragen.
- Fügen Sie 1 ml Wachstumsmedien zu jedem Brunnen hinzu und ziehen Sie mit einer sterilen Transferpipette nach oben und unten, um anhaftende Zellen zu entfernen.
- Zählen Sie Zellen, um die Gesamtzahl und Lebensfähigkeit anhand eines automatisierten Zellzählers wie in Schritt 5.4 zu bestimmen.
- Entfernen Sie auf Wunsch 1 x 106 Zellen für die Durchflusszytometrie, um genexpression und phänotyp zu bewerten. Siehe Schritt 9.5.1 und die Tabelle der Materialien für empfohlene Antikörper und Gating-Strategie.
- Zentrifugieren Sie die Zellen bei 600 x g für 10 min bei 25 °C.
- Die Medien ansaugen und die Zellen in Expansionsmedien auf eine Konzentration von 1 x 106 Zellen/ml aussetzen. Samen jeder gasdurchlässigen Brunnen einer 6-Well-Platte mit 5 ml Zellen. Schichtung von zusätzlichen 25 ml Erweiterungsmedien pro Brunnen.
HINWEIS: Wir fügen die Zellen in einem kleinen Volumen hinzu und schichten dann die verbleibenden Medien, sodass die Zellen auf der Unterseite des Brunnens verbleiben. - Inkubieren Sie die Zellen 4 Tage lang2 ungestört bei 37 °C in 5% CO2-Inkubator.
9. Sammlung erweiterter Zellen und Bewertung des Phänotyps der transducierten Zellpopulation
- Sammeln Sie Zellen aus gasdurchlässigen Brunnen, indem Sie 20 ml-Medien entfernen und entsorgen. Vorsicht ist geboten, um eine Störung der Zellen zu vermeiden.
HINWEIS: Wir erweitern die Zellen für nur 4 Tage und sammeln die Zellen an dieser Stelle. Wenn jedoch zusätzliche Kulturtage gewünscht werden, entfernen Sie 20 ml Medien, ohne die Zellen zu stören, und ersetzen Sie sie durch 20 ml frische Expansionsmedien. - Pipetdieren Sie die verbleibenden Medien nach oben und unten, um die Zellen zu vertreiben. Die Medien sollten sehr trübe sein, wenn die Zellen gut gewachsen sind.
- Mit einer sterilen Transferpipette spülen Sie jeden Brunnen mit 3 ml Medien ab, um Restzellen zu sammeln.
- Zählen Sie die Zellen mit dem automatisierten Zähler oder einem Hämozytometer, um die Lebensfähigkeit und die Zellennummer zu überprüfen.
- Führen Sie die Durchflusszytometrie durch, um die transduzierte Genexpression und den Zellphänotyp zu bestimmen.
- In diesem Beispiel bestimmen Sie rhesus makaken PBMC-Phänotyp mit Antikörpern gegen CD4 (M-T477), einem Klon, der sowohl mit endogenem rhCD4 als auch mit dem rhCD4-MBL CAR reaktiv ist; gegen CD3 (SP34-2) und CD8 (RPA-T8), die insgesamt T-Zellen bzw. CD8-T-Zellen färben; gegen den Todesrezeptor CD95 (DX2) und das kostimulierende Molekül CD28 (CD28.2), die zur Bestimmung des Speicherphänotyps der Zellen verwendet werden; CXCR5 (MU5UBEE) und MBL (3E7) zur Erkennung der CXCR5 und CD4-MBL CAR auf den transduzierten Zellen.
- Die Beurteilung der Lebensfähigkeit wurde mit einem fixierbaren Rentabilitätsfarbstoff bewertet.
- Bereiten Sie Zellen auf die Durchflusszytometrie vor.
- Erstellen Sie einen Antikörper-Master-Mix für die Gesamtanzahl der Rohre. Bringen Sie das Gesamtvolumen mit PBS auf.
- Fügen Sie die Zellen zu Flow-Rohren hinzu. Platzieren Sie 0,5–1 x 106 Zellen pro Tube. Schließen Sie negative Kontrollen wie ungefärbte Zellen sowie gefärbte Mock-Transduzierte Zellen ein.
- Fügen Sie den Zellen 2 ml PBS, Zentrifuge bei 400 x g für 5 min bei Raumtemperatur (RT) und Dekant.
- Fügen Sie 100 l Antikörpermischung in die Röhren und inkubieren für 30 min bei RT.
- Fügen Sie 2 ml PBS, Zentrifuge bei 400 x g für 5 min bei RT und Dekant.
- Fügen Sie 300 l von 1% Paraformaldehyd hinzu und brüten sie für 15 min.
- Zentrifuge bei 400 x g für 5 min bei RT und Dekant. Fügen Sie 300 L PBS und mischen.
- Erfassen Sie auf einem Durchflusszytometer 150.000 Ereignisse für jede Probe.
- Analysieren Sie die Daten mit der Strömungsanalysesoftware.
HINWEIS: Die Gating-Strategie wurde zuvor veröffentlicht20.- Zur Identifizierung von transduzierten Zellen, Gatezellen auf Lymphozyten, Singlets, Live, CD3+ und MBL+CXCR5+.
- Zur Identifizierung der zentralen Speicherpopulation, Torzellen auf Lymphozyten, Singlets, Live-CD3+, CD8+, CD28+ CD95+.
- Verwenden Sie Zellen nach Bedarf. Zellen können für In-vitro-Assays der Funktion verwendet werden, wie z. B. einen Transwell-Migration-Assay9 oder In-vitro-Zell-Tötungs-Assays5,9. Zellen können zur Infusion in Tiere verwendet werden. Alternativ können Sie alle verbleibenden Zellen in 90% FBS mit 10% Dimethylsulfoxid (DMSO) für die spätere Verwendung oder Analyse einfrieren
HINWEIS: Während eine Zieldosis für die Infusion von adoptiv übertragenen Zellen in einen Rhesusmakaken noch nicht festgelegt ist, haben veröffentlichte Adoptivtransferstudien an nichtmenschlichen Primaten 0,6 bis 1,2 x 107 Zellen/kg21, 1 bis 5 x 108 Zellen/kg22 und 1,4 bis 8 x 108 Zellen/kg10verwendet. Mit diesem Bereich als Richtlinie können mit diesem 9-Tage-Protokoll genügend Zellen für die Infusion produziert werden.
Ergebnisse
Zellproduktion
Die in dieser Veröffentlichung vorgestellten Ergebnisse ähneln denen in unseren zuvor veröffentlichten Arbeiten9,20. Unter Verwendung des hier vorgestellten Protokolls erwarten wir eine mindestens 8-fache Erweiterung der Zellen zwischen den Tagen 5 und 9 (Median 11,1-fach, Bereich 8,7-13-fach). Gasdurchlässige Brunnen wurden mit einer Anfangsdichte von 5 x 106 Zellen ausgesät und nach 4 Tagen Wachstum erreichten wir eine Mittlere Dichte von 55,6 x 106 Zellen pro Bohrkörper (Bereich 43,5–64,8 x 106) (Abbildung 1A). Die Zellzählung mit Trypan Blue-Ausschluss zeigt, dass die Zellen während des gesamten Protokolls eine hohe Lebensfähigkeit aufweisen (Tag 9 Median 85,8 %, Bereich 83–95%) (Abbildung 1B). Wir finden tierische Variabilität in der Fähigkeit der Zellen zu erweitern; Bei einer Ausgangspopulation von 50–100 x 106 Zellen am ersten Tag haben wir dieses Protokoll jedoch verwendet, um genügend Zellen für eine Rhesus-Makaken-Infusion von 1–2 x 108 Zellen/kg zu produzieren.
Die Koexpression der transduzierten Gene wurde mit Durchflusszytometrie überwacht (Abbildung 2A). Die Expression der CAR und CXCR5 auf der Oberfläche der transduzierten Zellen war zwischen den Tagen 5 und 9 dieses Erweiterungsprotokolls relativ stabil. Am 5. Tag lag ein Median von 42,8% (Bereich 36,5–46,9%) der Zellen wurden sowohl mit CD4-MBL CAR als auch mit CXCR5 transduziert, während am 9. Tag die Medianexpression 47,6% betrug (Bereich 44,5–64,5%) mit einer einzigen Transduktionsrunde (Abbildung 2B). Obwohl einige Protokolle eine zweite Runde der Transduktion erfordern, haben wir keinen Nutzen in Bezug auf die Gesamttransduced-Zellen am Ende des Protokolls gesehen (Daten nicht gezeigt).
Zellphänotyp
Transduzierte Zellen wurden durch Durchflusszytometrie analysiert, um ihren Speicherphänotyp zu überwachen. Vor der Transduktion und Expansion werden naive, zentrale Speicher- und Effektorspeicherpopulationen identifiziert (Daten werden nicht dargestellt), aber die naive Population geht mit der Kultivierung verloren und die Zellen sind in erster Linie zentrale Speicherzellen am Tag 5 (Abbildung 3A) und Tag 9 (Abbildung 3B), wie durch CD95+ CD28+ Expression identifiziert. Die Verwendung dieses schnellen Transduktions- und Expansionsprotokolls hat Zellen hervorgebracht, die in erster Linie zentrale Gedächtniszellen sind und sich daher eher vermehren und fortbestehen, wenn sie in ein Versuchstier infundiert werden.
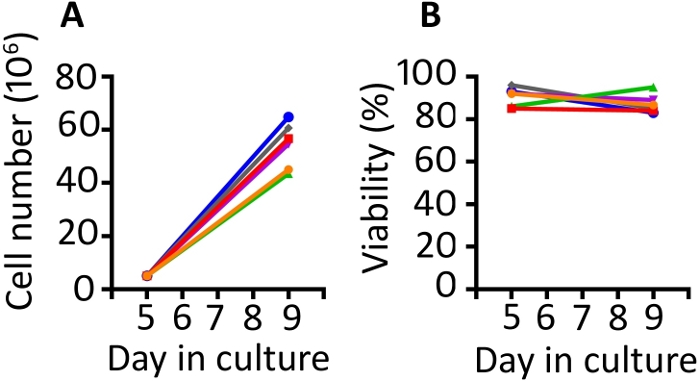
Abbildung 1: Das Transduktions- und Expansionsprotokoll erzeugt reichlich transduzierte Zellen, die sehr lebensfähig sind. (A) Ausdehnung der transduzierten Zellen von 6 verschiedenen Tieren von den Tagen 5 bis 9 in den gasdurchlässigen Gefäßen und (B) Lebensfähigkeit des transduzierten PBMC von denselben 6 Tieren. Trypan blue exclusion using a automated cell counter was used to monitor cell number and viability. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
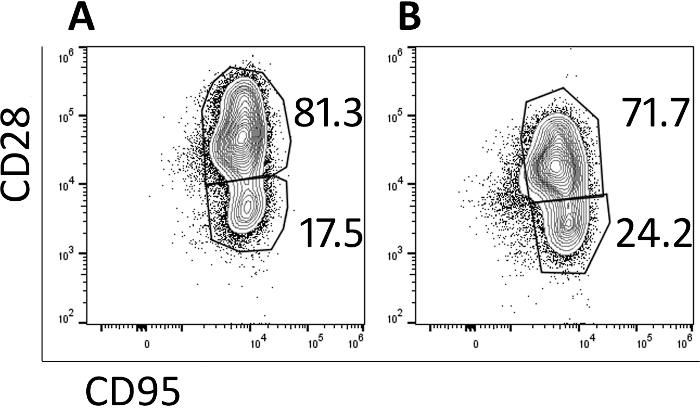
Abbildung 2: Das Transduktionsprotokoll produziert Zellen, die die Koexpression der beiden transduzierten Gene beibehalten. (A) Ein repräsentatives Durchflussdiagramm von rhesus PBMC am 9. Tag des Transduktions- und Erweiterungsprotokolls, das die Expression sowohl der CD4-MBL CAR als auch der CXCR5 demonstriert. (B) Ausdruck der CD4-MBL CAR und CXCR5 auf transduziertem Rhesus PBMC von 6 verschiedenen Tieren an den Tagen 5 und 9 in der Kultur gemessen an der Durchflusszytometrie. Gates wurden auf live gesetzt, CD3+ Zellen. Transduced Zellen werden als MBL+ CXCR5+identifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
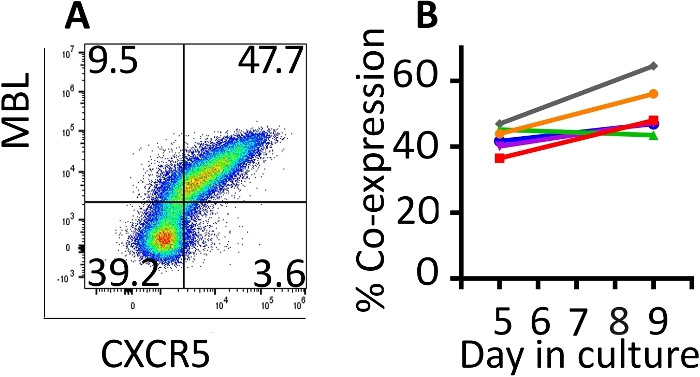
Abbildung 3: Die Mehrheit der im 9-Tage-Protokoll produzierten Zellen haben einen zentralen Memory-Phänotyp. Repräsentative Durchflusszytometrie-Plots von (A) Tag 5 und (B) Tag 9 CAR/CXCR5-transduced rhesus PBMC. Gates wurden auf live gesetzt, CD3+, CD8+ Zellen. Zentraler Speicher wurde als CD28+ CD95+definiert. Der Effektorspeicher wurde als CD28-, CD95+definiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll skizziert eine Produktionsstrategie für T-Zellen-Immuntherapie, die einen gammaretroviralen Vektor nutzt, um Rhesus-Makaken-PBMC zu transdutieren, was zu einer T-Zellpopulation führt, die eine antivirale CAR sowie den follikulären Homing-Rezeptor CXCR5 ausdrückt. Mit insgesamt 8 Tagen Ex-vivo-Kulturzeit werden lebensfähige, funktionelle CAR-T-Zellen in einer Menge produziert, die innerhalb des veröffentlichten Bereichs10,21,22 für die Infusion in nichtmenschliche Primaten für präklinische Wirksamkeitstests verwendet wird.
Der Erfolg des Transduktionsprotokolls beruht sowohl auf gesunden, stimulierten PBMCs als auch auf Qualitätspräparaten des Gammaretrovirus. Um eine erfolgreiche Stimulation und Transduktion zu erreichen, ist es wichtig, dass beim Einfrieren und Transportieren der PBMCs nach der Entnahme die richtige Sorgfalt vornimmt. Im Idealfall, wenn die Zellen außerhalb des Standorts gesammelt werden, werden sie in flüssigem Stickstoff versendet und schnell in langfristige Flüssigstickstofflagerung gelegt. PBMCs müssen mitotisch aktiv sein, um erfolgreich durch ein Gammaretrovirus transduziert zu werden. Man sollte visuell für die Clustering der Zellen nach stimulation mit Anti-CD3/Anti-CD28 überwachen. Ein Nichtaktivieren der korrekten Aktivierung führt zu einem geringen Effizienzderwirkung der Transduktion. Es ist auch wichtig, die Lebensfähigkeit in den stimulierten Zellen zu überwachen. Schlechte Lebensfähigkeit nach dem Stimulationsschritt führt in der Regel zu einer weniger erfolgreichen Transduktion. Unabhängig davon, ob Viruspräparate im Labor hergestellt oder ausgelagert werden, sollten sie bei -80 °C in Einweg-Aliquots gelagert werden, um Tauwetterzyklen zu vermeiden, die das Virus schädigen und die Transduktionseffizienz beeinträchtigen können. Das Virus muss gezähnt werden, damit in jedem Experiment konsistente Mengen an Viren verwendet werden können. Wenn Sie das Virus zur Transduktion verwenden, tauen Sie das Virus schnell auf und speichern Sie es auf Eis, bis es nötig ist. Die Wahl von Promotor-, Enhancer- und Hüllproteinen kann sich auf die Transduktionseffizienz und die Expression von Transgen in Zielzellen auswirken. Daher muss ein MOI empirisch bestimmt werden. Darüber hinaus hat die Verwendung eines Mediums zur Unterstützung von T-Zellen und Platten mit gasdurchlässigen Bohrkörpern zur Expansion zu einer ausgezeichneten Ausdehnung der transduzierten Zellen geführt. Allerdings gibt es tier-tier-Variabilität in der Zellexpansionsrate. Wir empfehlen eine Studie, um die Fähigkeit eines bestimmten Zellpräparats zu bestimmen, transduced und erweitert zu werden. Die Expansionsstufen sind sowohl bei kleinen als auch in großen Transduktionen konsistent.
Mit diesem Protokoll haben wir bis zu 2,5 x 109 Zellen für die Infusion in Versuchstiere produziert. Obwohl wir es zu diesem Zeitpunkt für unnötig hielten, das Protokoll zu skalieren, ist die Verwendung von 6 Brunnenplatten eine Beschränkung der großflächigen Zellpräparation, und das Protokoll würde eine Änderung erfordern, um eine größere Anzahl von Zellen zu erzeugen. Beispiele für mögliche Modifikationen sind die Durchführung der Transduktion in einem fibronectinbeschichteten Kulturbeutel, um die Anzahl der transduzierten Zellen zu erhöhen und ein größeres gasdurchlässiges Kulturgefäß für den Expansionsschritt zu nutzen. Obwohl wir diese Änderungen noch nicht vorgenommen haben, verwenden sie kommerziell erhältliche Produkte und sind machbare Änderungen am aktuellen Protokoll.
Mit dieser Methode haben wir transduzierte Zellen aus PBMC hergestellt, isoliert von nicht infizierten Tieren, SIV-infizierten Tieren und von SIV-infizierten Tieren, die mit antiretroviraler Therapie (ART) behandelt wurden. Wir haben jedoch eine Verringerung der Transduktionseffizienz in den ART behandelten Zellen20festgestellt. Diese Reduktion ist vermutlich auf die Hemmung der Reverse-Transkriptase und/oder Integrase durch die Medikamente zurückzuführen. Transduktionen von Zellen von ART-behandelten Tieren erfordern Änderungen an diesem Protokoll, wie z. B. die Verringerung des intrazellulären Gehalts der ART-Medikamente durch stoppende ART für mehrere Tage vor dem Sammeln der PBMC oder durch die Verwendung eines alternativen Vektors, der nicht von den häufig verwendeten ART-Medikamenten beeinflusst wird.
Es ist wichtig, dass die für die Immuntherapie produzierten Zellen einen minimal differenzierten Phänotyp aufweisen, damit sie nach der Infusion fortbestehen12. Obwohl viele Protokolle für die Adoptivübertragung von Zellen lange Kulturzeiten erfordern, wurde eine reduzierte Ex-vivo-Kulturzeit sowohl mit einer Verringerung der Differenzierung als auch mit einer Verbesserung der CAR-T-Zellfunktionkorreliert 13. Der relativ schnelle Zeitrahmen dieses Transduktions- und Erweiterungsprotokolls ermöglicht die Aufrechterhaltung des gewünschten zentralen Speicherphäpnotyps und produziert gleichzeitig genügend Zellen für die Erprobung ihres immuntherapeutischen Potenzials20.
Das Ziel der Produktionsstrategie für dieses T-Zell-Immuntherapie-Produkt ist es, T-Zellen herzustellen, die SIV-infizierte Zellen erkennen, den Verkehr zum Ort der Virusreplikation im B-Zellfollikel verfolgen und im Tier verbleiben, was zu einer langfristigen funktionelle Heilung ohne antiretrovirale Medikamente. Für die Übersetzung in ein humanes Immuntherapieprodukt kann dieses Protokoll geändert werden, um menschliche T-Zellen durch den Einsatz von humanspezifischen Antikörpern und Zytokinen und die Umsetzung von GMP-Standards zu transduzieren, mit dem Endziel, eine funktionelle Heilung für Hiv.
Offenlegungen
Dr. Pamela Skinner ist Mitbegründerin und wissenschaftliche Leiterin von MarPam Pharma.
Danksagungen
Diese Studie wurde durch die NIH-Stipendien 5R01AI096966-06S1 (PS, EC und EB), 1UM1AI26617 (PS, EC und EB), P51OD011106/P51RR000167 (ER), MN REACH Grant 5U01HL127479-03 (PS), 1R01A14 3380-01 (PS und EB), 1UM14126617 (PS und EG) sowie Mittel der NIAID Division of Intramural Research und des NIH Intramural AIDS Targeted Antiviral Program. Anti-CD3 und Anti-CD28, die in diesen Studien verwendet wurden, wurden von der NIH Nonhuman Primate Reagent Resource (R24 OD010976, U24 AI126683) bereitgestellt. IL-2, das in diesen Studien verwendet wurde, wurde vom NCI Preclinical Repository bereitgestellt. Wir danken unseren Mitarbeitern in diesem CD4-MBL CAR/CXCR5-Projekt, Dr. Elizabeth Connick an der University of Arizona, Dr. Edward A Berger an der NIAID, NIH, Dr. Eva G Rakasz am Wisconsin National Primate Research Center und Dr. Geoff Hart und Frau Preethi Haran an der University of Minnesota, Dr. Leslie Kean an der Harvard Medical School und Dr. Catherine Bollard am Children' Research Institute. Wir danken auch Dr. Scott McIvor von der University of Minnesota, Dr. Christopher Peterson am Fred Hutchinson Cancer Center, Dr. Matthew Trivett am NIH, Dr. Agne Taraseviciute am Seattle Children es Hospital und Dr. Conrad Russell Cruz vom Children es Research Institute für ihre sehr hilfreiche Unterstützung bei der Optimierung dieses Protokolls. Wir danken auch Frau Chi Phan und Frau Jhomary Alegria-Berrocal an der University of Minnesota für die Gammaretroviralproduktion und Frau Kim Weisgrau von der University of Wisconsin-Madison für die Isolierung von Rhesus-Macaque PBMC.
Materialien
| Name | Company | Catalog Number | Comments |
| Gammaretrovirus preparation | |||
| 0.025% Trypsin, 0.01% EDTA | Gibco | R-001-100 | |
| 293T cells | ATCC | CRL-3216 | |
| 6 well plates, treated | CytoOne | CC7682-7506 | |
| DMEM | Gibco | 10569-010 | |
| Heat-inactivated FBS | Hyclone | Sh30088.03 | |
| Lipofectamine | Invitrogen | 11668019 | transfection reagent |
| Opti-Mem | Invitrogen | 31985070 | reduced serum media |
| pBS-CMV-gagpol | Addgene | 35614 | A gift from Dr. Patrick Salmon |
| pMSGV1 containing CAR P2A CXCR5 | custom order from GenScript | ||
| RD114 | A gift from Dr. Ed Berger | ||
| T75 flasks | CytoOne | CC7682-4875 | |
| VSV-G | pMD.G | A gift from Dr. Scott McIvor | |
| T cell stimulation | |||
| 6 well plates, untreated | CytoOne | CC7672-7506 | |
| Anti-CD28 | NHP Reagent Resource | Clone: CD28.2 | |
| Anti-macaque CD3 | NHP Reagent Resource | Clone: FN18 | |
| Phosphate buffered saline | Gibco | 14190-144 | |
| Rhesus macaque PBMC or CD8 T cells | WNPRC | Primary cells | |
| For Fibronectin coating | |||
| 6 well plates, untreated | CytoOne | CC7672-7506 | |
| BSA (Fraction V) | HyClone | SH 30574.02 | |
| RetroNectin (1 mg/ml) | TaKaRa | T100A | |
| For T cell Expansion | |||
| G-Rex 6 Well Plate | Wilson Wolf | P/N 80240M | Plates with gas permeable wells |
| Media Components | |||
| b mercaptoethanol | Gibco | 21985-023 | |
| Heat-inactivated FBS | Hyclone | Sh30088.03 | |
| IL-2 | NCI Preclinical Repository | ||
| Penicillin/Streptomycin/Glutamine | Gibco | 10378-016 | |
| X-Vivo-15 medium | Lonza | 04-418Q | |
| Variations of Media used | |||
| Basic medium: | X-Vivo 15 medium, 10% heat-inactivated FBS, 1 x Penicillin/Streptomycin/L-Glutamine | ||
| Expansion medium: | Growth medium + 50 mM b mercaptoethanol | ||
| Growth medium: | Basic medium + 50 IU/ml IL-2 | Completion of media by addition of anti-CD28, IL-2 or b-mercaptoethanol should occur on the day of use. | |
| Cell counting | |||
| Countess cell counting chambers | Invitrogen | AMQAF1000 | |
| Countess II FL Automated Cell Counter | Invitrogen | T10282 | |
| Trypan blue, 0.4% solution | Invitrogen | T10282 | |
| Flow Cytometry | |||
| Alexa Fluor 647 Antibody Labeling Kit | Invitrogen | A20186 | for conjugation of MBL antibody |
| anti-CD28-BV605 | BD Biosciences | 562976 | |
| anti-CD3-AF700 | BD Biosciences | 557917 | |
| anti-CD4-FITC | BD Biosciences | 556615 | |
| anti-CD8-BV788 | BD Biosciences | 563824 | |
| anti-CD95-PerCP Cy5.5 | BD Biosciences | 561655 | |
| anti-CXCR5-PE | eBioscience | 12-1985-42 | |
| anti-MBL | Invitrogen | MA1-40145-S6 | |
| Flow Analysis software | FlowJo, LLC | FlowJo v10 | |
| Flow Cytometer | Beckman | CytoFlex | |
| Live/Dead Near IR | Invitrogen | L10119 | |
| Other equipment | |||
| Aerosolve canisters to contain aerosol leakage | Beckman | SX4750 | Safety equipment |
| Beckman Allegra Centrifuge | Beckman | Sterilgard e3 | |
| Cell culture incubator | Thermo Fisher | Everlast 247 | |
| Class II Laminar flow hood | Baker | Heracell Vios 160i | |
| Extra-Safe Disposable lab coat | Fisher Scientific | 359232 | Personal protective equipment |
| Microplate carriers with biocertified covers | Beckman | SX4750A | Safety equipment |
| Rocking platform | Benchmark | C10228 | |
| Swinging bucket rotor | Beckman | X13-R | |
| X-Gen Nitrile gloves | Genesee | Personal protective equipment |
Referenzen
- Klebanoff, C. A., Rosenberg, S. A., Restifo, N. P. Prospects for gene-engineered T cell immunotherapy for solid cancers. Nature Medicine. 22 (1), 26-36 (2016).
- Lim, W. A., June, C. H. The Principles of Engineering Immune Cells to Treat Cancer. Cell. 168 (4), 724-740 (2017).
- Sadelain, M., Rivière, I., Riddell, S. Therapeutic T cell engineering. Nature. 545 (7655), 423-431 (2017).
- Kuhlmann, A., Peterson, C. W. Chimeric antigen receptor T-cell approaches to HIV cure. Current Opinion in HIV and AIDS. 13 (5), 446-453 (2018).
- Ghanem, M. H., Bolivar-Wagers, S., et al. Bispecific chimeric antigen receptors targeting the CD4 binding site and high-mannose Glycans of gp120 optimized for anti-human immunodeficiency virus potency and breadth with minimal immunogenicity. Cytotherapy. 20, 407-419 (2018).
- Folkvord, J. M., Armon, C., Connick, E. Lymphoid Follicles Are Sites of Heightened Human Immunodeficiency Virus Type 1 (HIV-1) Replication and Reduced Antiretroviral Effector Mechanisms. AIDS Research and Human Retroviruses. , (2005).
- Connick, E., Mattila, T., et al. CTL Fail to Accumulate at Sites of HIV-1 Replication in Lymphoid Tissue. The Journal of Immunology. 178 (11), 6975-6983 (2007).
- Connick, E., Folkvord, J. M., et al. Compartmentalization of Simian Immunodeficiency Virus Replication within Secondary Lymphoid Tissues of Rhesus Macaques Is Linked to Disease Stage and Inversely Related to Localization of Virus-Specific CTL. The Journal of Immunology. 193 (11), 5613-5625 (2014).
- Haran, K. P., Hajduczki, A., et al. Simian immunodeficiency virus (SIV)-specific chimeric antigen receptor-T cells engineered to target B cell follicles and suppress SIV replication. Frontiers in Immunology. 9 (MAR), 1-12 (2018).
- Ayala, V. I., Deleage, C., et al. CXCR5-Dependent Entry of CD8 T Cells into Rhesus Macaque B-Cell Follicles Achieved through T-Cell Engineering. Journal of Virology. 91 (11), e02507-e02516 (2017).
- Redeker, A., Arens, R. Improving adoptive T cell therapy: The particular role of T cell costimulation, cytokines, and post-transfer vaccination. Frontiers in Immunology. 7 (SEP), 1-17 (2016).
- Klebanoff, C. A., Gattinoni, L., Restifo, N. P. Sorting Through Subsets. Journal of Immunotherapy. 35 (9), 651-660 (2012).
- Ghassemi, S., Nunez-Cruz, S., et al. Reducing Ex Vivo Culture Improves the Antileukemic Activity of Chimeric Antigen Receptor (CAR) T Cells. Cancer Immunology Research. 6 (9), 1100-1109 (2018).
- Minang, J. T., Trivett, M. T., Bolton, D. L., Trubey, C. M., Estes, J. D., Li, Y., et al. Efficacy of Adoptively Transferred Central and Effector Memory-Derived Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones in Rhesus Macaques during Acute Infection. The Journal of Immunology. 184 (1), 315-326 (2010).
- Bolton, D. L., Minang, J. T., et al. Trafficking, persistence, and activation state of adoptively transferred allogeneic and autologous Simian Immunodeficiency Virus-specific CD8(+) T cell clones during acute and chronic infection of rhesus macaques. Journal of immunology (Baltimore, Md. : 1950). 184 (1), 303-314 (2010).
- Patel, S., Jones, R. B., Nixon, D. F., Bollard, C. M. T-cell therapies for HIV : Preclinical successes and current clinical strategies. Cytotherapy. 18 (8), 931-942 (2019).
- Chambers, C. A., Allison, J. P. Costimulatory regulation of T cell function. Current Opinion in Cell Biology. 11 (2), 203-210 (1999).
- Schwartz, R. H. A cell culture model for T lymphocyte clonal anergy. Science. 248 (4961), 1349-1356 (1990).
- Bajgain, P., Mucharla, R., et al. Optimizing the production of suspension cells using the G-Rex M series. Molecular Therapy - Methods and Clinical Development. 1, 14015(2014).
- Pampusch, M. S., Haran, K. P., et al. Rapid transduction and expansion of transduced T cells with maintenance of central memory populations. Molecular Therapy - Methods and Clinical Development. 16, 1-10 (2019).
- Taraseviciute, A., Tkachev, V., et al. Chimeric antigen receptor T cell-mediated neurotoxicity in nonhuman primates. Cancer Discovery. 8 (6), 750-763 (2018).
- Berger, C., Sommermeyer, D., et al. Safety of targeting ROR1 in primates with chimeric antigen receptor-modified T cells. Cancer Immunology Research. 3 (2), 206-216 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten