Method Article
Eine integrierte Raman-Spektroskopie- und Massenspektrometrie-Plattform zur Untersuchung der Aufnahme von Einzelzellen-Medikamenten, des Stoffwechsels und der Effekte
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine integrierte Raman-Spektroskopie-Massenspektrometrie-Plattform (MS) dar, die in der Lage ist, eine einzellige Auflösung zu erreichen. Raman-Spektroskopie kann verwendet werden, um zelluläre Reaktion auf Medikamente zu studieren, während MS für die gezielte und quantitative Analyse der Arzneimittelaufnahme und des Stoffwechsels verwendet werden kann.
Zusammenfassung
Es ist bekannt, dass Zellen in ihren Reaktionen auf Medikamente von Natur aus heterogen sind. Daher ist es wichtig, dass die heterogene Heterogenität von Einzelzellen in Studien zur Entdeckung von Arzneimitteln berücksichtigt wird. Dies kann erreicht werden, indem die Fülle der zellulären Wechselwirkungen zwischen einer Zelle und einem Medikament auf Einzelzellebene (d. h. Wirkstoffaufnahme, Stoffwechsel und Wirkung) genau gemessen wird. Dieses Papier beschreibt eine einzellige Raman-Spektroskopie und Massenspektrometrie -Plattform (MS), um metabolische Veränderungen von Zellen als Reaktion auf Medikamente zu überwachen. Mit dieser Plattform können metabolische Veränderungen in Reaktion auf das Medikament durch Raman-Spektroskopie gemessen werden, während das Medikament und sein Metabolit mit Massenspektrometrie in der gleichen Zelle quantifiziert werden können. Die Ergebnisse deuten darauf hin, dass es möglich ist, Auf informationen über die Aufnahme von Medikamenten, den Stoffwechsel und die Reaktion auf einer Einzelzellebene zuzugreifen.
Einleitung
Zellen reagieren unterschiedlich auf Veränderungen in ihrer Mikroumgebung auf einzelzelliger Ebene, ein Phänomen, das als zelluläre Heterogenität1bezeichnet wird. Trotzdem basieren aktuelle Studien zur Arzneimittelentdeckung auf durchschnittlichen Messungen von Zellpopulationen, die Informationen über potenzielle Subpopulationen sowie einzellige Variationen verschleiern2. Diese fehlenden Informationen können erklären, warum einige Zellen anfälliger für Medikamente sind, während andere resistent sind. Interessanterweise ist der Mangel an einzelligen Informationen über die Arzneimittelreaktion ein möglicher Grund für das Scheitern klinischer Phase-II-Studien mit Medikamenten3. Um dieses Problem anzugehen, müssen daher zelluläre Wechselwirkungen mit dem Medikament (d. h. Aufnahme, Stoffwechsel und Ansprechverhalten) auf einzelzelliger Ebene gemessen werden.
Um dies zu erreichen, haben wir ein einzigartiges System entwickelt, in dem lebende Einzelzellen mittels etikettenfreier Raman-Spektroskopie abgeschirmt und dann mit Dermassenspektrometrie4weiter charakterisiert werden. Die Raman-Spektroskopie liefert einen molekularen Fingerabdruck des Zellzustands, ein komplexes Spektrum, das sich aus den Beiträgen vieler Moleküle innerhalb der Zelle ergibt. Trotz dieser Komplexität kann davon ausgegangen werden, dass Raman-Fingerabdrücke die Struktur und den Stoffwechsel einer ganzen Zelle widerspiegeln5,6. Die Raman-Spektroskopie zeichnet sich durch die Messung von Zellzuständen in einer nichtinvasiven und relativ hohen Durchsatzweise aus, was sie für das Screening und die Beurteilung der Arzneimittelreaktion auf einzelzelliger Ebene nützlich macht.
Im Gegensatz dazu bietet MS die erforderliche Empfindlichkeit und Selektivität für die Messung der Arzneimittelaufnahme auf einzelzeller Ebene. Da MS destruktiv ist (die Probe [Zelle] wird in der Regel während der Analyse verbraucht), kann die Integration mit der zerstörungsfreien, etikettenfreien Raman-Spektroskopie einen hohen Durchsatz und ein empfindliches System bieten. Diese kombinierte Plattform ist in der Lage, mehr Informationen über die Aufnahme von Medikamenten, Stoffwechsel, und Effekte auf der einzelzelligen Ebene.
Dieses Manuskript erläutert ein Protokoll, das verwendet wird, um zelluläre Wechselwirkungen mit Medikamenten auf einzelzelliger Ebene unter Verwendung von In-vitro-Kulturen mithilfe einer integrierten Raman-MS-Plattform zu untersuchen. Dazu werden hepatozelluläre Karzinomzellen (HepG2) und Tamoxifen als Modell verwendet. HepG2-Zellen wurden ausgewählt, weil sie Tamoxifen aufnehmen und das Medikament verstoffwechseln, und sie sind gleichzeitig aufgrund seiner hepatotoxischen Wirkungen betroffen. In diesem Manuskript werden zwei Zustände verwendet: medikamentöse Zellen im Vergleich zu nicht behandelten Zellen (Kontrolle).
Protokoll
1. Zellkultur
- Kulturzellen, die an einem geeigneten Kulturmedium interessiert sind. Penicillin-Streptomycin kann hinzugefügt werden, um eine Kontamination zu vermeiden. Bei HepG2-Zellen werden Kulturzellen in einem Kulturmedium, das Das modifizierte Eagle-Medium (DMEM) von Dulbecco enthält, mit 10% fetalem Rinderserum (FBS) und 0,1% Penicillin-Streptomycin ergänzt. Um Die Messungen der Raman-Spektroskopie zu fadenzieren, können Zellen auf einer gelatinebeschichteten Glasbodenschale oder Quarzdias angebaut werden.
- Inkubieren Sie Zellen für 2 Tage bei 37 °C und 5%CO2 in einem befeuchteten Inkubator.
- Synchronisieren Sie Zellkulturen, um 70% Konfluenz zu erreichen.
- Subkulturzellen in eine 35 mm Glasbodengitterschale oder Quarzschlitten mit dem gleichen Medium bei einer Sädichte von 0,7 x 106, dann bei 37 °C für 24 h inkubieren.
HINWEIS: Kulturgerichte oder Dias können mit Kollagen- oder Gelatinebeschichtungslösung mit einem Kulturoberflächenverhältnis von 5 ug/cm2 vorbeschichtet werden, damit sie sich fixieren können, um ihr Überleben während der Messung zu gewährleisten.
2. Drogenbehandlung
- Zellkulturen aus dem Inkubator entfernen und 2x mit vorgewärmten PBS-Puffer (37 °C) waschen.
HINWEIS: Es ist optimal, Zellen für die medikamentöse Behandlung bei einer Konfluenz von 50%-60% zu entfernen. - Teilen Sie Zellen in medikamentös behandelte und unbehandelte Untergruppen in 35 mm Kulturgerichten auf.
- Mischen Sie die Droge der Wahl mit den Kulturmedien. Lösen Sie z. B. Tamoxifen in Dimethylsulfoxid (DMSO) und mischen Sie es mit den Kulturmedien, um eine Endvolumenmenge von 2 ml und eine Tamoxifenkonzentration von 10 m zu erhalten. Dies wird die drogenbehandelte Gruppe sein.
- Mischen Sie ein entsprechendes Volumen lösungsmittel (DMSO) in das Medium als Kontrolle, um die Auswirkungen von DMSO zu untersuchen. Dies wird die Kontrollgruppe sein.
- Inkubieren Sie beide Gruppen in 2 ml der spiked Medien in den Schritten 2.3-2.4 für 24 h vorbereitet. Die erwartete Konfluency nach der Inkubation sollte 70%-80% betragen.
3. Raman Spektrale Bildgebung und spektrale Verarbeitung
HINWEIS: Obwohl Raman-Spektroskopiesysteme im Handel erhältlich sind, ist das hier verwendete Raman-Spektroskopiesystem ein selbstgebautes Konfokalmikroskop, das zuvor beschrieben wurde7,8. Kurz gesagt, ist dieses System mit einem 532 nm Diode gepumpt Enkstate-Laser ausgestattet. Das Laserlicht wird mit einer zylindrischen Linse zu einer Ebene geformt, die die Messung von 400 Spektren in einer einzigen Belichtung ermöglicht. Raman-Spektren wurden mit einer gekühlten CCD-Kamera aufgenommen, die auf einem Polychromator montiert ist, der ein 1.200 Nuten/mm Gitter verwendet, um die spektrale Auflösung des Fingerabdruckbereichs zu maximieren (von 500-1.800 cm-1). Dieser Spektralbereich enthält eine hohe Dichte von Frequenzen, die spezifisch für Moleküle sind, die Raman-Streuung erzeugen. Eine Wasser-Immersionobjektivlinse (NA = 0,95) wird ebenfalls verwendet. Die räumliche Auflösung dieses Systems beträgt 300 nm und die Spektralauflösung 1 cm-1. Um das Überleben der Zelle während des Experiments zu gewährleisten, wird eine Mikrokammer verwendet, die auf einer motorisierten Mikroskopstufe befestigt ist.
- Überprüfen Sie vor spektralen Messungen die Ausrichtung der Optik. Mit einem 50-mm-Loch kann überprüft werden, ob loch und laserposition genau übereinstimmen. Geben Sie den Spektralphotometer-Schlitz ein, wenn Sie so weit wie möglich verengt sind.
- Verwenden Sie Ethanol, um das Spektralphotometer vor jedem Experiment zu kalibrieren. Um dies zu tun, legen Sie EtOH in eine Glasbodenschale, messen Sie das Spektrum bei einer bestimmten Laserintensität (gemessen an der Probe) für 1 s und assoziieren Sie den Peak zu bekannten Wellenlängen7.
- Minimieren Sie die Laserintensität an der Probe auf 2,4mW/m2, damit die Zellen die Laserexposition überleben.
- Richten Sie die Mikrokammer bei 5%CO2 und 37 °C ein.
- Sobald das Mikroskopsystem fertig ist, entfernen Sie Zellen aus dem Inkubator und spülen Sie zellen sofort 2x mit erwärmtem PBS-Puffer (37 °C) aus, und fügen Sie dann 2 ml erwärmtes PBS (37 °C) oder DMEM hinzu, um die Zellen wieder aufzuhängen.
HINWEISE: Sowohl PBS als auch FluoroBrite DMEM-basierte Medien sind ausreichend Optionen für Raman-Spektroskopie-Messungen, da sie ein minimales Hintergrundsignal erzeugen. - Fügen Sie 10 l Wasser auf die Wasser-Immersion-Objektivlinse und legen Sie die Glasboden-Zellschale zart auf die Mikroskop-Bühne.
- Messen Sie jede Zelle, indem Sie die Laserlinie fokussieren. Eine Belichtungszeit von 15 s pro Zelle reicht hier aus, um einen Querschnitt einer Zelle mit einem klaren Raman-Signal zu erhalten. Ein Galvanospiegel ermöglicht das Scannen einer Zelle oder einer Gruppe von Zellen innerhalb von mehreren Dutzend Minuten.
HINWEISE: Eine höhere Auflösung der vollständigen spektralen Bildgebung von Zellen erfordert mehr Zeit und kann zu Photoschäden führen. Hier wurden die Zellen mit einer einzeiligen Exposition gemessen, um einen Querschnitt jeder Zelle zu erhalten. Dieser Ansatz ist ein guter Kompromiss, um den Durchsatz zu erhöhen und ausreichende Informationen zu erhalten, um Zellen zu diskriminieren, während gleichzeitig die Zelllebensfähigkeit durch die Begrenzung von Photoschäden sichergestellt wird.
4. Vorverarbeitung von Spektraldaten und multivariaten Analysen
HINWEIS: Die Vorverarbeitung ist ein notwendiger Schritt vor der zusätzlichen Analyse, um unerwünschte technische Abweichungen innerhalb der Spektraldaten zu entfernen. Aufgrund der Vielfalt der Methoden und Software kann keine erschöpfende Liste zur Verfügung gestellt werden, und es gibt viele hilfreiche Bewertungen in der Literaturgefunden 7,8. In diesem Abschnitt beschreiben wir kurz den Ansatz zur Analyse und Interpretation von spektralen Raman-Daten, die aus lebenden Einzelzellen gewonnen wurden.
- Extrahieren und vorverarbeiten Raman-Bilder, um mögliche kosmische Strahlungsstörungen zu entfernen.
HINWEIS: Die Spektralachse von Spektren, die während verschiedener Tage/Wochen/Monate gewonnen werden, kann aufgrund kleiner technischer Schwankungen während der Kalibrierung mit Ethanol einige Abweichungen aufweisen. Dies wird sich stark auf die nachfolgenden multivariaten Analysen und statistischen Vergleiche auswirken. Für den Fall, dass Experimente in verschiedenen Wochen/Monaten durchgeführt werden, werden kleine optische Variationen erwartet. In diesem Fall müssen die Daten interpoliert werden, um eventuelle spektrale Verschiebungen der Daten über Experimente hinweg zu korrigieren. Hier wird die Interpolation mit kubischem Spline verwendet. Nach diesem Schritt sollte die gesamte Spektrenachse ausgerichtet werden. Für die nachfolgende Analyse wird ein Bereich von 500-1.800 cm-1 berücksichtigt. - Extrahieren Sie Spektraldaten von Zellen und Hintergrund (Abwesenheit von Zellen) aus jedem Bild mit einem hausgemachten Algorithmus. Subtrahieren Sie das Hintergrundsignal vom Signal der Zelle. Dann durchschnittlich die Spektren der verbleibenden Pixel, die einer einzelnen Zelle entsprechen sollten. Die folgenden Schritte werden mit den 2D-Spektren der Zellen durchgeführt.
- Führen Sie eine Baseline-Korrektur mit modPoly9 oder einem anderen Algorithmus durch, der auf ausreichend gepasst hat. Schneiden Sie den Spektralbereich auf 600-1.700 cm-1 ab, um den Fingerabdruckbereich auszuwählen und sicherzustellen, dass es aufgrund der schlechten Polynomanpassung keine unerwünschten Kanteneffekte auf die Spektren gibt.
- Führen Sie einen Normalisierungsschritt wie vektornormalisierung (die Intensität bei jeder Wellenzahl wird durch die globale l2-Norm oder den maximalen Singularwert eines Spektrums geteilt), um die Spektralintensität10zu normalisieren, obwohl andere Normalisierungen in Betracht gezogen werden können.
- Bereiten Sie ein Dataset mit der entsprechenden Bezeichnung für jede Klasse/Bedingung vor.
HINWEIS: Vergleichende Spektralanalysen können perforiert werden, um die Art möglicher Unterschiede zwischen Zellklassen/Bedingungen zu untersuchen (z. B. durch Subtraktion des durchschnittlichen Spektrums der Kontrollgruppe auf andere Gruppen, um Interessengebiete zu identifizieren [wie potenzielle Biomarker]). ANOVA- und Fisher-Scores-Berechnungen können auch10durchgeführt werden. - Um behandelte und unbehandelte Zellen anhand von spektralen Merkmalen zu identifizieren, können multivariate Analysen angewendet werden. Normalisierte Spektraldaten sollten als Trainingsdatensatz und ein unbekanntes Dataset (ohne Beschriftung) aus einem Replikationsexperiment nach Möglichkeit als Testdaten verwendet werden.
ANMERKUNG: Discriminant-Analysen, die an einem Vektor einer Hauptkomponentenanalyse (PCA-DA10) durchgeführt werden, projektionen latente Werte, gefolgt von Diskriminanzanalyse (PLS-DA) und Support Vector Machines (SVM)11 sind Modelle, die häufig im Feld verwendet werden, und stellen jeweils unterschiedliche statistische Überlegungen dar. Die Vorverarbeitung der Daten sollte konsequent erfolgen. - Verwenden Sie maschinelles Lernen, das den experimentellen Zielen entspricht. Hier wird eine Projektion auf latente Struktur (PLS) Modell mit dem spektralen Fingerabdruckbereich von Raman Spektren (600-1,710 cm-1)11,12gebaut. Mittleren Zentrieren Sie die Daten nach Bedarf. Für die Kreuzvalidierung des Modells können verschiedene Techniken angewendet werden.
HINWEIS: Hier wird eine venezianische Blind-Cross-Validierung mit 10 Splits angewendet. Die Modellkomplexität (Anzahl der Komponenten oder latente Variable) sollte getestet werden, damit das beste Modell den RMSE-Wert (Root Mean Square Error) minimiert. Es wurde festgestellt, dass drei latente Vektoren (LVs) die beste Diskriminierung mit unserem Datensatz darstellten. - Identifizieren Sie, welche Raman-Spektralspitzen zur Diskriminierung der Zellen beitragen (z. B. durch Plotten der Punktzahl von variabler Bedeutung in der Projektion [VIP] für jede Raman-Wellenzahl oder die Größe des Regressionskoeffizienten).
HINWEISE: Der VIP-Score einer Variablen wird als gewichtete Summe der quadrierten Korrelationen zwischen den PLS-DA-Komponenten und der ursprünglichen Variablen berechnet. Details zum PLS- und VIP-Scores-Algorithmus finden Sie in der Literatur11,12.
5. Einrichtung von Einzelzellenproben und Verfahren
- Fixieren Sie das Zellentnahmesystem auf dem Raman-Mikroskop, wie in Abbildung 1dargestellt. Schließen Sie den 3D-Mikromanipulator an den Glaskapillarhalter an, der an einer leeren Spritze zum Probensaugen befestigt ist, indem Sie Unterdruck anwenden (Abbildung 1).
- Stellen Sie das Mikroskop auf ein hoch vergrößertes Feld (40x) ein, um die Spitze der Glaskapillare zu beobachten und sicherzustellen, dass es nicht gebrochen ist. Steuern Sie die Position der Glaskapillare mit dem Mikromanipulator (x-, y-, z-Achsen). Stellen Sie sicher, dass die Kapillarspitze im Sichtfeld zentriert ist, und bewegen Sie dann die Kapillare auf der Z-Achse nach oben, um später Freiraum für die Kulturschale zu geben.
ANMERKUNG: Die Mikroprobe der Zellen erfolgt durch die Glaskapillare für Zellen mit Durchmessern zwischen 10 und 15 m. Es wird eine Kapillare mit einer Bohrungsgröße von 5 m empfohlen. Wenn die Bohrungsgröße zu klein ist, wird die Kapillarspitze von der Zelle gesteckt, und wenn sie zu groß ist, kann die Empfindlichkeit späterer MS-Messungen beeinträchtigt werden. - Legen Sie die Probenplatte/Schale auf die Bühne des Mikroskops, passen Sie die Vergrößerung und den Fokus an, wählen Sie die Zielzelle auf der Gitterschale aus und verschieben Sie sie in die Mitte der Ansicht. Dann die Glaskapillare vorsichtig mit Mikromanipulator (Z-Achse) nach unten senken, bis die Spitze in den Fokus rückt.
HINWEIS: Achten Sie darauf, die Kapillare in den x- und y-Achsen nicht zu bewegen, bis die Kapillare im Fokus steht. - Berühren Sie unter mikroskopischer Beobachtung die Ziel-Einzelzelle mit der Kapillarspitze, und setzen Sie dann mit der Spritze unter Druck, um die Zelle in der Kapillarspitze einzufangen. Zeichnen Sie dieses Verfahren auf, indem Sie ein Foto oder Video aufnehmen, um das Timing und die gesaugte Position der Zelle bei Bedarf genau zu überprüfen.
- Bewegen Sie die Kapillare auf der Z-Achse nach oben. Lösen Sie dann die Kapillare mit Zangen aus dem Kapillarhalter, um die MS-Analyse vorzubereiten.
6. Massenspektrometriemessungen
- Kalibrieren Sie die Massengenauigkeit des MS-Instruments gemäß den Empfehlungen des Herstellers. Stellen Sie nach der Kalibrierung sicher, dass der Massenfehler nicht größer als 3 ppm ist.
- Optimieren Sie das MS-Instrument auf Parameter, die für den anfallenden Analyten am besten geeignet sind.
HINWEIS: Bei Tamoxifen- und 4-OHT-Analysen werden die Geräteparameter wie folgt eingestellt: Einlasskapillartemperatur: 400 °C, Sprühspannung: 1500 V, automatischeverstärkungskontrollziel (AGC): 5.00E+06, S-Objektiv-HF-Pegel: 90%, SIM-Bereich: 347-397 m/z, SIM maximale Einspritzzeit: 200 ms, SIM-Auflösung: 140.000 FWHM, MS/MS-Bereich: 50-400 m/z, MS/MS AGC-Ziel: 2,00E+05, MS/MS maximale Einspritzzeit: 100 ms, MS/MS-Auflösung: 17.500 FWHM, MS/MS-Isolationsfenster: 1 m/z, MS/MS normalisierte Kollisionsenergie (NCE): 35. - Richten Sie eine automatische Erfassungsmethode mit einer Dauer von 5 minuten für den SIM-Modus ein, um eine relative Quantifizierung zu erreichen, und eine weitere MS/MS-Methode zur positiven Identifizierung des Arzneimittels und seines Metaboliten. Die Parameter der Erfassungsmethode sollten auf die in Schritt 6.2 genannten optimierten Werte gesetzt werden.
- Bereiten Sie das Ionisationslösungsmittel unter einer Dunstabzugshaube vor. Die Lösungsmittelzusammensetzung hängt vom Analyten des Interesses ab. Hier bei diesem Gehalt besteht das verwendete organische Lösungsmittel aus 80% MeOH, 10% DMSO und 0,1% Ameisensäure.
- Mischen Sie vor den Messungen einen geeigneten internen Standard mit dem organischen Lösungsmittel. In diesem Experiment wird 5,31 nM d5-Tamoxifen als interner Standard verwendet.
- Um Fehlalarme zu vermeiden, aspirieren Sie die Medien, die die mit dem Medikament behandelten Zellen umgeben, mit einer 1 m Bohrerkapillare mit konstanter mikroskopischer Beobachtung, um eine Probenahme von Zellteilen zu vermeiden.
- Fügen Sie 2 L des Ionisationslösungsmittels an das breite Ende der Kapillare, die das Medium enthält, mit einer Pipette, die an Laderspitzen befestigt ist. Analysieren Sie dann die abgetasteten Medien nach MS, überprüfen Sie, ob der Analyt von Interesse ist (normalerweise sollte es nicht nachweisbar sein).
- Fügen Sie 2 L das Ionisationslösungsmittel in die Kapillare, die die Zelle enthält, an einen Nanoelektrospray-Adapter (Nano-ESI) zu befestigen, der mit einem geeigneten Massenspektrometer verbunden ist, und starten Sie die automatische Erfassungsmethode.
7. Massenspektrometrie Datenverarbeitung und -analyse
HINWEIS: Jede geeignete Software kann für die Datenanalyse verwendet werden. Wenn Forscher jedoch Datenanalysen mit einer Software durchführen möchten, die nicht vom MS-Anbieter bereitgestellt wird, sollten die Rohdaten vom proprietären Herstellerformat in ein offenes Format oder als Textdatei zuerst konvertiert werden (was hier geschehen ist).
- Normalisieren Sie die Daten, indem Sie den Spitzenbereich des Analyten von Interesse(en) durch den des internen Standards aus demselben MS-Scan dividieren. Anschließend transformieren Sie die Spitzenverhältnisse, um die Schiefe zu reduzieren.
- Zeichnen Sie die normalisierte Intensität des Arzneimittels oder seines Metaboliten als Boxplot oder Dichtekurve, um die Verteilung über einzelne Zellen zu visualisieren. Hier wird r.statistische Software verwendet, zusammen mit dem paket ggplot2.
- Berechnen Sie das metabolisierte Medikament zu unmetabolisierten Wirkstoffverhältnis, indem Sie die Häufigkeit des Arzneimittelmetaboliten durch die des nicht metabolisierten Elternmoleküls in jeder Zelle (d. h. 4-OHT bzw. Tamoxifen) dividieren.
ANMERKUNG: Die Korrelation zwischen Variationen spezifischer Raman-Spitzen und den Variationen der MS-Spitzen des Arzneimittels oder seiner Metaboliten kann untersucht werden. Dies ist eine Ergänzung zur möglichen Korrelation zwischen dem Medikament selbst und seinem Metaboliten in einzelnen Zellen. Dies kann durch Berechnung des Pearson-Korrelationskoeffizienten mit einem zweischwänzigen Test erfolgen. Auch fortgeschrittenere integrative Ansätze sollten in Betracht gezogen werden.
Ergebnisse
Die Einzelzellanalyse von Wechselwirkungen zwischen Arzneimitteln (Aufnahme, Stoffwechsel und Wirkungen) ist wichtig, um versteckte oder medikamentenresistente Subpopulationen aufzudecken und die Auswirkungen der zellulären Heterogenität zu verstehen. In diesem Protokoll wurden zwei komplementäre Techniken verwendet, um die oben genannten Wechselwirkungen in einzelnen Zellen zu messen: Raman-Spektroskopie und MS. Raman-Spektrometrie identifiziert zellen, die von Medikamenten auf der Grundlage von spektralen Biomarkern der Arzneimittelreaktion betroffen sind, schnell. MS wird verwendet, um die Aufnahme und den Stoffwechsel des Arzneimittels selektiv und semi-quantitative zu überwachen. Die Zellen wurden zunächst durch Raman-Spektroskopie untersucht und dann einzeln zur Analyse durch MS abgetastet.
Abbildung 2zeigt eine vergleichende Analyse des durchschnittlichen Spektrums jeder Erkrankung (mit und ohne medikamentöse Behandlung). Das gemittelte Spektrum der beiden Bedingungen unterscheidet sich deutlich an verschiedenen Spitzen, die zuvor identifiziert und molekularen Verbindungen2zugeordnet wurden. Insbesondere die Spitzen bei 1000 cm- (zu aromatischen Verbindungen wie Phenylalanin und Tyrosin) zeigen starke Unterschiede. Die Signifikanz des statistischen Unterschieds sollte durch weitere multivariate Analysen bewertet werden.
Der Datensatz wurde dann verwendet, um ein PLS-Modell (Schritte 4.5-4.8) zu trainieren, das darauf abzielte, die beiden Zellbehandlungen zu unterscheiden (mit Medikament: n = 290, ohne Medikament: n = 115). Die prädiktive Fähigkeit, die in Gegenwart von Tamoxifen kultivierten Zellen zu klassifizieren, erreichte eine 100%ige Empfindlichkeit und 72% Spezifität in den Testdaten (unbekannt aus dem kreuzvalidierten trainierten Modell). Sensitivität ist ein Maß für die wahren Positiven, die vom Modell korrekt identifiziert werden, während spezifität ein Maß für die tatsächlichen Negative ist, die vom Modell identifiziert werden. Alternative Modelle wie SVMs, LDAs und neuronale Netzwerke können ähnliche oder bessere Ergebnisse liefern, obwohl in dieser Studie kein umfassender Vergleich durchgeführt wurde.
Basierend auf dem PLS-Modell wurden die VIP-Scores berechnet, die die Bedeutung von Wellenlängen (Raman-Verschiebungen) bei der Unterscheidung der experimentellen Bedingungen darstellen (Abbildung 3). Wichtig ist, dass die höchsten Gipfel der VIP-Profile Raman-Spitzen entsprachen, für die starke Unterschiede zwischen den beiden Behandlungen zu beobachten waren. Dies bestätigte die spezifischen molekularen Unterschiede zwischen behandelten und unbehandelten Zellen. Daher können Forscher mögliche spektrale Biomarker identifizieren, die die Reaktion einzelner Zellen auf die medikamentöse Behandlung widerspiegeln. Diese Biomarker können weiter getestet werden, um ihre biologische Relevanz und Verallgemeinerung über verschiedene Bedingungen und Zelllinien hinweg zu überprüfen.
Ein live esieine einzelliges Massenspektrometriesystem (LSC-MS) konnte sowohl das Medikament als auch seine Metaboliten in einzelnen, medikamentös behandelten HepG2-Zellen detektieren, die zuvor durch Raman-Spektroskopie gemessen wurden. Darüber hinaus kann Tandem-MS verwendet werden, um die Struktur beider Moleküle zu bestätigen. Nach positiver Identifizierung wurde die relative Häufigkeit des Arzneimittels und seiner Metaboliten in jeder Zelle gemessen und mit Hintergrundspitzen in unbehandelten Zellen verglichen. Starke Variation wurde in Tamoxifen Fülle beobachtet, und dieses Phänomen war noch stärker ausgeprägt im Fall von seinem Metaboliten, 4-OHT (Abbildung 4). Die Beziehung zwischen Tamoxifen-Überfluss und ihren Metaboliten wurde ebenfalls untersucht, bei der eine signifikante positive Korrelation zwischen den beiden gefunden wurde (r = 0,54, p = 0,0001, n = 31).

Abbildung 1: Zellentnahmesystem, das auf einer Mikroskopbühne montiert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
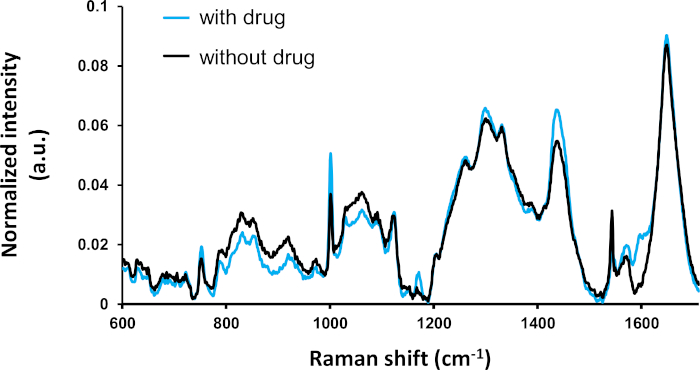
Abbildung 2: Durchschnittliches Spektrum der medikamentös behandelten Zellen (mit Tamoxifen: n = 295) und unbehandelten Zellen (ohne Tamoxifen: n = 115). Raman-Spitzen lassen sich aus der Literatur erkennen. Die meisten starken Spektralunterschiede sind statistisch signifikant (ANOVA, p - 0,5) wie zuvor beschrieben4. Diese Zahl wurde gegenüber einer früheren Veröffentlichunggeändert 4. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
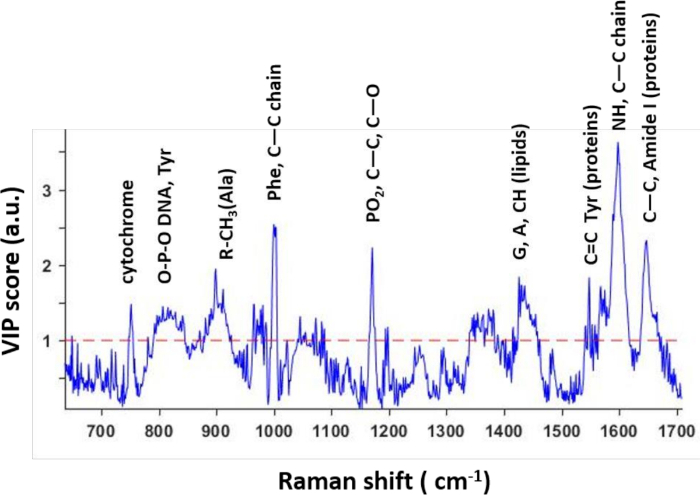
Abbildung 3: VIP-Scores aus dem prädiktiven PLS-Modell extrahiert. VIP-Scores spiegeln die Wellenlängen wider, die zur Unterscheidung zwischen den beiden Klassen im Modell beitragen. Die meisten Spitzen entsprechen bestimmten Molekülen, die als spektrale Biomarker von Arzneimittelwirkungen auf medikamentöse Zellen beobachtet werden. Diese Zahl wurde gegenüber einer früheren Veröffentlichunggeändert 4. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
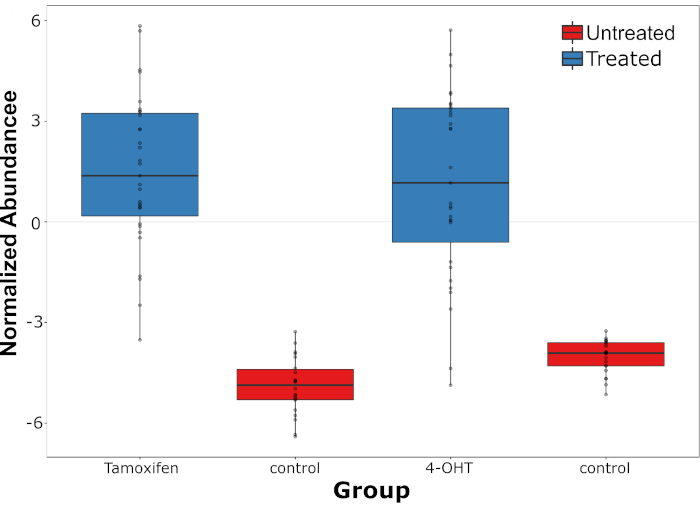
Abbildung 4: Verteilung der Tamoxifenfülle und ihres Metaboliten. Verteilung der Tamoxifenfülle und ihres Metaboliten 4-OHT (gemessen auf Einzelzellebene) im Vergleich zu endogenen Spitzen in den unbehandelten Zellen (Kontrolle). Diese Zahl wurde gegenüber einer früheren Veröffentlichunggeändert 4. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Manuskript wurde ein einfacher Fall ausgewählt, in dem HepG2-Zellen Tamoxifen ausgesetzt waren (oder nicht). Die Fähigkeit eines Raman-Spektroskopie- und Massenspektrometriesystems wird gezeigt, um die Auswirkungen von Tamoxifen auf Zellen zu überwachen. Die Raman-Spektroskopie ermöglichte die Identifizierung potenzieller Biomarker, die eine allgemeine Reaktion einzelner Zellen auf die Exposition gegenüber Arzneimitteln widerspiegelten. Es wurde eine gewisse Heterogenität zwischen einzelnen Zellen beobachtet, was darauf hindeutet, dass einige Zellen nicht auf die Exposition gegenüber Medikamenten reagierten. Andererseits war LSC-MS in der Lage, eine gezielte Analyse des Arzneimittels und seines Metaboliten auf einzelzelliger Ebene durchzuführen, bei der ein hohes Maß an Heterogenität im Arzneimittel und seiner Metabolitenfülle beobachtet wurde. Diese Heterogenität hilft zu erklären, warum einige Zellen von dem Medikament betroffen sind, während andere scheinbar nicht, trotz der Zellen, die aus einer angeblich einheitlichen Population12stammen.
Unter den besonderen Aspekten dieser Technik, die Aufmerksamkeit erfordern, ist es wichtig, die Qualität des Mikroskopaufbaus und der Signalverarbeitung zu bewerten, um die Reproduzierbarkeit der Daten zu gewährleisten. Wenn die Vorverarbeitung der Spektren sorgfältig erfolgt, sollten die Signalvariationen am lokalen Maximum jeder Spitze maximiert werden. Im Gegensatz dazu sollten sich die Grundlinie und die Kante der Spektren zwischen den getesteten Zellbedingungen überlappen. Ein weiterer wichtiger Aspekt ist das multivariate Modell, das verwendet wird, um Unterschiede zwischen den Behandlungen zu untersuchen. Man muss die Modelle und Modellparameter sorgfältig auswerten, um eine präzise und genaue Analyse zu gewährleisten. Ein Vorteil des PLS-Modells ist im Gegensatz zu neuronalen Netzwerken, dass es den Zugriff auf die Gewichte ermöglicht, die mit jeder Wellenlänge verbunden sind (Raman-Verschiebungen), die die vom Modell getesteten Bedingungen am besten unterscheiden.
Obwohl die Raman-Spektroskopie die Wirkstoffreaktion erfolgreich diskriminiert, sollte betont werden, dass diese Technik in ihrer Verwendung begrenzt ist, um biologische Interpretation zu bieten. Dies ist vor allem auf die Komplexität des Spektralsignals zurückzuführen, das eine Mischung aus Tausenden von Molekülen umfasst. Daher sind weitere Untersuchungen erforderlich, um systematische Variationen zwischen Raman-Spektralintensitäten und Variationen der Arzneimittelkonzentrationen zu bewerten. Auch sind ähnliche Studien anderer Zelllinien erforderlich, um die Verallgemeinerung von Spektralbiomarkern im Zusammenhang mit Tamoxifen zu bewerten.
Darüber hinaus kann es von Interesse sein, Messungen von lebenden Geweben durchzuführen, um die Pharmakodynamik zu bewerten und zu untersuchen, wie Medikamente in jede Zelle eindringen und fließen. Darüber hinaus ist darauf hinzuweisen, dass die Probenahmein in LSC-MS in hohem Maße von den Fähigkeiten des Bedieners abhängt. Parameter wie räumliche Auflösung, Zellposition innerhalb der Kapillare nach der Probenahme und Durchsatzstärke sind vollständig vom Bediener abhängig, was die großflächige Einführung von LSC-MS einschränkt. Obwohl automatisierte Stichprobensysteme dieses Problem lindern können. Darüber hinaus zeichnet sich LSC-MS bei der Probenahme von anhaftenden oder schwebenden Zellen in ihren nativen Zuständen aus, während es bei der Probenahme von Zellen, die in Gewebeabschnitte eingebettet sind, schlechter abschneidet. Dies ist auf die Tendenz der Probenahmekapillarspitze zurückzuführen, bei hoher Probendichte zu brechen. Daher kann ein anderer Ansatz wie die Single-Sonde in solchen Fällen besser geeignet sein14,15.
Da die hier verwendeten Zellen unter Umgebungsbedingungen mit minimaler Probenvorbereitung abgetastet werden, kann LSC-MS problemlos in andere Technologien integriert werden, wie die Integration mit Raman in diesem Protokoll zeigt. Eine weitere ähnliche Integration mit 3D-Holographie hat es ermöglicht, eine absolute Quantifizierung zellulärer Metaboliten auf der subzellulären Ebene16zu erreichen. Zusätzlich hat die Integration mit der Durchflusszytometrie die Aufdeckung von metabolischen Biomarkern in einzelnen zirkulierenden Tumorzellen von Neuroblastom-Krebspatienten17,18ermöglicht.
In Zukunft könnte es aufgrund des in jüngster Zeit zunehmenden Interesses an der Kombination von Datensätzen aus bildgebenden Modalitäten19auch von Interesse sein, die systematischen Variationen zwischen Raman-Signalen und Massenspektrometrie-Ergebnissen (sowie anderen Omics-Methoden) mit integrativen Rechenansätzen zu untersuchen. Interessanterweise haben wir bereits mehrere schwache, aber signifikante lineare Korrelationen zwischen den Intensitäten der Raman-Peaks gefunden, die durch VIP-Scores identifiziert werden, und der Fülle von Tamoxifen oder seinem Metaboliten auf der einzelzelligen Ebene, wie sie durch MS4identifiziert wurden. Diese Daten können auf eine metabolische Beziehung zwischen MS-Profilen und Raman-Spektren und die Möglichkeit hindeuten, diese Werte vorherzusagen.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Die Autoren danken Toshio Yanagida für seine Unterstützung und DEN internen Kooperationsfonds von RIKEN, die Dr. Arno Germond zugeschrieben werden.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.1% penicillin-streptomycin | Nacalai Tesque | 09367-34 | |
| 35mm glass bottom grid dish | Matsunami | ||
| 4-Hydroxy Tamoxifen standard | Sigma-Aldrich | 94873 | |
| 532 nm diode pumped solid-state laser | Ventus, Laser Quantum | ||
| BIOS-L101T-S motorized microscope stage | OptoSigma | ||
| CT-2 cellomics coated sampling capillaries | HUMANIX | ||
| d5-Tamoxifen standard | Cambridge Isotope Laboratories | ||
| Dimethyl sulfoxide LC-MS grade | Nacalai Tesque | D8418 | |
| Dulbecco's Modified Eagle's medium | Sigma-Aldrich | D5796 | |
| Eppendorf GELoader tips | Eppendorf | ||
| fetal bovine serum | Hyclone laboratories | SH3006603 | |
| FluoroBrite DMEM | Thermo Fisher Scientific | ||
| Formic acid LC-MS grade | Sigma-Aldrich | 33015 | |
| HepG2 cell line (RCB1886) | RIKEN cell bank center | RCB1886 | |
| MC0-19A1C Incubator | Sanyo Electric Co. | MC0-19A1C | |
| Methanol LC-MS grade | Sigma-Aldrich | 1060352500 | |
| MMO-203 3-D Micromanipulator | Narshige | MMO-203 | |
| NA:0.95, UPL40 water-immersion Olympus objective lens | Olympus | ||
| Nanoflex nano-ESI adaptor | Thermo Fisher Scientific | ES071 | |
| On-stage incubator | ibidi | ||
| Pierce LTQ Velos ESI calibration solution | Thermo Fisher Scientific | 88323 | |
| PIXIS BR400 cooled CCD camera | Princeton Instruments | ||
| Q-Exactive Orbitrap | Thermo Fisher Scientific | ||
| Rat-tail collagen coating solution | Cell Applications Inc. | ||
| Tamoxifen standard | Sigma-Aldrich | 85256 |
Referenzen
- Altschuler, S. J., et al. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Ali, A., et al. Single-cell metabolomics by mass spectrometry: Advances, challenges, and future applications. TrAC Trends in Analytical Chemistry. , (2019).
- Bunnage, M., et al. Target validation using chemical probes. Nature Chemical Biology. 9 (4), 195-199 (2013).
- Ali, A., et al. Single-Cell Screening of Tamoxifen Abundance and Effect Using Mass Spectrometry and Raman-Spectroscopy. Analytical Chemistry. 91 (4), 2710-2718 (2019).
- Wu, H., et al. In vivo lipidomics using single-cell Raman spectroscopy. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3809-3814 (2011).
- Okada, M., et al. Label-free Raman observation of cytochrome c dynamics during apoptosis. Proceedings of the National Academy of Sciences of the United States of America. 109 (1), 28-32 (2012).
- Palonpon, A. F., et al. Raman and SERS microscopy for molecular imaging of live cells. Nature Protocols. 8 (4), 677-692 (2013).
- Butler, H. J., et al. Using Raman spectroscopy to characterize biological materials. Nature Protocols. 11 (4), 664-687 (2016).
- Mark, H., Workman, J. . Chemomtrics in Spectroscopy. , (2018).
- Lieber, C. A., Mahadevan-Jansen, A. Automated method for subtraction of fluorescence from biological Raman spectra. Applied Spectroscopy. 57, 1363-1367 (2003).
- Germond, A., et al. Raman spectral signature reflects transcriptomic features of antibiotic resistance in Escherichia coli. Communications Biology. 1, 85 (2018).
- Wold, S., et al. Partial Least Squares Projections to Latent Structures (PLS) in Chemistry. Encyclopedia of Computational Chemistry. , (2002).
- Chong, I. G., Jun, C. H. Performance of some variable selection methods when multicollinearity is present. Chemometrics and Intelligent Laboratory Systems. 78, (2005).
- Inde, Z., Dixon, S. J. The impact of non-genetic heterogeneity on cancer cell death. Critical Reviews in Biochemistry and Molecular Biology. 53 (1), 99-114 (2018).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Analytical chemistry. 86 (19), 9376-9380 (2014).
- Rao, W., et al. Applications of the Single-probe: Mass Spectrometry Imaging and Single Cell Analysis under Ambient Conditions. Journal of Visualized Experiments. (112), e53911 (2016).
- Ali, A., et al. Quantitative Live Single-cell Mass Spectrometry with Spatial Evaluation by Three-Dimensional Holographic and Tomographic Laser Microscopy. Analytical Sciences: the International Journal of the Japan Society for Analytical Chemistry. 32 (2), 125-127 (2016).
- Abouleila, Y., et al. Live single cell mass spectrometry reveals cancer-specific metabolic profiles of circulating tumor cells. Cancer Science. 110, 697-706 (2018).
- Hiyama, E., et al. Direct Lipido-Metabolomics of Single Floating Cells for Analysis of Circulating Tumor Cells by Live Single-cell Mass Spectrometry. Analytical Sciences: the International Journal of the Japan Society for Analytical Chemistry. 31 (12), 1215-1217 (2015).
- Ryabchykov, O., et al. Fusion of MALDI Spectrometric Imaging and Raman Spectroscopic Data for the Analysis of Biological Samples. Frontiers in Chemistry. 6, 257 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten