Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Wiederholbarer Treppenschritt-Assay zum Zugriff auf das allelopathische Potenzial von Weedy Rice (Oryza sativa ssp.)
In diesem Artikel
Zusammenfassung
Die Allelopathie hat sich als nützliche ergänzende Unkrautbekämpfungsstrategie in Erntesystemen als vielversprechend erwiesen. Zur Bestimmung des allelopathischen Potenzials einer gewünschten Pflanzenprobe wird ein Treppenstufen-Screening-Verfahren bereitgestellt.
Zusammenfassung
Der Unkrautwettbewerb trägt wesentlich zu Ertragsverlusten bei Erntesystemen weltweit bei. Die Entwicklung der Resistenz bei vielen Unkrautarten gegen kontinuierlich angewandte Herbizide hat die Notwendigkeit zusätzlicher Bewirtschaftungsmethoden ergeben. Allelopathie ist ein physiologischer Prozess, den einige Pflanzenarten besitzen, die der Pflanze einen Vorteil gegenüber ihren Nachbarn verschaffen. Allelopathische Pflanzensorten wären mit der Fähigkeit ausgestattet, das Wachstum der umliegenden Wettbewerber zu unterdrücken und so potenzielle Ertragsverluste durch Unkrautstörungen zu reduzieren. Dieses Papier konzentriert sich auf den Bau und Betrieb eines Treppenstufen-Assays, der für das Screening des allelopathischen Potenzials einer Spenderart (Oryza sativa) gegen eine Empfängerkrautart (Echinochloa crus-galli) in einer Gewächshausumgebung verwendet wird. Die in diesem Papier beschriebene Struktur dient als Staus für die Pflanzenproben und beinhaltet ein zeitzeitliches Bewässerungssystem für die Ansammlung und Verteilung von Allelochemikalien. Allelochemikalien, die von den Pflanzenwurzeln produziert werden, dürfen durch eine Reihe von vier Töpfen getrennt in einen Sammeltank fließen und durch elektrische Pumpen zurück in die oberste Anlage zurückgeführt werden. Diese Methode des Screenings bietet eine Möglichkeit für die Allelochemikalien aus der Spenderpflanze, ohne Ressourcenwettbewerb Empfängeranlagen zu erreichen, wodurch eine quantitative Messung des allelopathischen Potenzials der ausgewählten Spenderpflanze ermöglicht wird. Das allelopathische Potential ist durch die Höhenreduzierung der Empfängerpflanzen messbar. Vorläufige Screening-Daten für die Wirksamkeit dieser Methode zeigten Höhenreduktion bei der Empfängerart, Barnyardgrass (E. crus-galli), und damit das Vorhandensein von allelopathischen Rückständen aus der Spenderpflanze, Unkrautreis (Oryza sativa).
Einleitung
Die Allelopathie ist ein natürliches und komplexes Phänomen, das in den letzten Jahrzehnten im Fokus vieler Pflanzenwissenschaftler stand. Die Mechanismen der Alleopathie zur Verwendung in Kulturpflanzen sind seit den 1930er Jahren Gegenstand vieler Forschungen, als Molisch feststellte, dass eine Pflanze durch die Produktion und Sekretion chemischer Verbindungen in die Umwelt eine direkte oder indirekte Wirkung auf eine benachbarte Pflanze hat1. Allelopathie ist die Produktion von sekundären Metaboliten, die hemmende Auswirkungen auf das Wachstum und die Keimung einiger Pflanzenarten haben. Freigesetzte allopathische chemische Verbindungen helfen, den Spenderpflanzen einen Wettbewerbsvorteil zu verschaffen, indem phytotoxine der Umwelt um sie herum hinzugefügt werden2. Viele Faktoren tragen zur allelopathischen Aktivität bei. Es ist selektiv in seiner Wirksamkeit und variiert zwischen Sorten, Umweltbedingungen, Wachstumsstadium, Stress, Umwelt und Nährstoffverfügbarkeit3.
In den letzten Jahren wurde die Alleopathie in der Forschung als mögliche Ergänzung zur ständigen und wachsenden Unkrautbekämpfungskrise hervorgehoben. Mit der wachsenden Weltbevölkerung ist die Nachfrage nach nachhaltiger Nahrungsmittel- und Faserproduktion gestiegen4. Unkrautbekämpfung ist eine der größten Bedrohungen für die Produktion von Agronomenkonfrontiert 5,6. Traditionelle Unkrautbekämpfungsmethoden konzentrieren sich auf mechanische, chemische und kulturelle Praktiken. Die kontinuierliche Verwendung von Herbiziden, obwohl effektiv, nützlich und effizient, hat die Entwicklung von resistenten Unkrautpopulationen in einem alarmierend schnellen Tempo gefördert7. Gentechnik und Züchtungspraktiken wurden effektiv eingesetzt, um Pflanzen Wettbewerbsvorteile gegenüber Unkraut zu verschaffen, indem sie sie so gestalteten, dass sie chemischen Anwendungen standhalten, die ihre Nachbarn nicht überleben können7,8. Obwohl diese Technologien wirksam sind, sind sie nicht immer nachhaltig und stellen manchmal überkreuzende Bedenkenauf 9. Zusätzliche Unkrautmanagement-Praktiken müssen eingeführt werden, wenn das Ziel der Steigerung der Nahrungsmittelproduktion erreicht werden soll10. Allelopathy zeigt ausgezeichnete versprechen als ein neues Verteidigungsinstrument für Kulturen, um ihre Qualität zu verbessern und ihre Konkurrenten zu übertreffen1,7.
Allelochemikalien sind oft Sekundärprodukte, und da ihre Produktion stark von Umweltfaktoren beeinflusst wird, können die spezifischen Verbindungen, die mit der Pflanzenunterdrückung verbunden sind, schwierig zu identifizieren sein3. Produktionsfaktoren sind Genetik und die gemeinsame Wirkung von sekundären Metaboliten, die synergistisch wirken können11,12. Es ist eine Herausforderung, allelopathische Aktivitäten von der Konkurrenz zu trennen, die natürlicherweise in pflanzenhaltigen Wechselwirkungen besteht, und aus diesem Grund muss es beim Screening auf Alleopathie einen Standardsatz von Ergebnissen geben, die den Test als gültig und wiederholbar qualifizieren. Im Folgenden finden Sie eine Reihe von Kriterien, die Die Ergebnisse der Alleopathie gemäß Olofsdotter et al.12 1) eine Pflanze muss die Unterdrückung einer anderen Pflanze in einem Muster nachweisen; 2) Die Chemikalien, die in bioaktiven Mengen in die Umwelt freigesetzt werden, müssen von der Spenderpflanze hergestellt werden; 3) Die hergestellten Chemikalien müssen zur Empfängeranlage transportiert werden können; 4) Ein gewisser Aufnahmemechanismus muss in der Empfängeranlage vorhanden sein; 6) Das beobachtete Hemmungsmuster darf keine andere ausschließliche Erklärung haben (z. B. Wettbewerb um Ressourcen)12.
In dem Bestreben, die Barriere zwischen dem Mangel an Wissen über die Mechanismen zur Unterstützung der Allelopathie und Der Sortenentwicklung zu überwinden, können phänotypische Merkmale im Zusammenhang mit allelopathischen Sorten identifiziert und für die weitere Forschung und Verwendung ausgewählt werden. Einige Pflanzen, die allelopathische Eigenschaften haben, sind Roggen, Sorghum, Reis, Sonnenblumen, Raps und Weizen13. Während der ersten Beobachtungen der Alleopathie in Kulturpflanzen wurde aufgrund der ausgeprägten Grenzen des Unkrautwachstums bei Feldversuchen vorgeschlagen, dass Chemikalien beteiligt waren und nicht der Wettbewerb um Ressourcen14. Die meisten Studien waren jedoch Feldexperimente, die es unmöglich machten, den Wettbewerb als Faktor14zu beseitigen. Die Bemühungen zur Beseitigung des Wettbewerbs wichen Labor- und Gewächshausexperimenten, um allelopathische Aktivitäten in Reis und anderen Kulturen zu beweisen und zu quantifizieren. Feld- und Gewächshausmethoden zur Abschirmung von Pflanzen auf Alleopathie zeigen, dass allelopathische Tendenzen in beiden Wachstumsbedingungen vorhanden sind11,15. Einige Kritiker glauben, dass Labor-Screenings nur begrenzten Wert aufgrund des Mangels an natürlichen Bedingungen haben können, die die Ergebnisse beeinflussen können15.
Die vorgeschlagene Methode zum Screening des allelopathischen Potenzials in Pflanzen bietet ausreichende Ressourcen und Raum und eliminiert den Ressourcenwettbewerb durch die Verwendung einer Treppenstufenstruktur11,17. Die Methode wurde von früheren Experimenten zur Erforschung der Alleopathie in Rasengras und Gerste17,18angepasst und modifiziert. Diese Studien ergaben, dass ein ähnliches System in der Lage war, genaue Ergebnisse über das allelopathische Potenzial einer Zielpflanze zu liefern und gleichzeitig alle Zweifel auszuräumen, dass die Beobachtungen auf den natürlichen Wettbewerb zurückgeführt werden könnten. Die Treppenschrittmethode erzeugt ein Kreislaufsystem, bei dem eine Nährstofflösung aus einem Reservoir durch jede Pflanze durch ein paar Schritte zu einer Inkubationsschale radeln kann. Eine elektrische Pumpe recycelt dann die Lösung zusammen mit allen Allelochemikalien produziert18. Eine methode wie diese ist sowohl in Zeit, Raum als auch in Ressourcen effizient. Es bietet auch ähnliche Feldbedingungen für die Anlagen und eliminiert jeglichen Ressourcenwettbewerb. Die Methoden und Werkzeuge, die zum Screening verwendet werden, lassen sich leicht an die gewünschten Studienziele, Bedingungen und spezifischen Arten anpassen. Ziel dieser Studie ist es, die Unkraut-Reis-Alleopathie durch Höhenunterdrückungsmessungen auf Stallgras mit der Treppenstufenmethode zu bestätigen.
Protokoll
1. Standbau
HINWEIS: Die Maße für das Holz sind als Dicke (cm) x Breite (cm) x Länge (m) aufgeführt.
- Holz in entsprechende Größen und Mengen schneiden: fünf 10,16 cm x 5,08 cm x 0,91 m Holzstücke, drei 10,16 cm x 5,08 cm x 0,76 m Holzstücke, drei 10,16 cm x 5,08 cm x 0,61 m Holzstücke, fünf 10,16 cm x 5,08 cm x 0,46 m Holzstücke , drei 10,16 cm x 5,08 cm x 0,3 m Holzstücke und drei 10,16 cm x 5,08 cm x 0,15 m Holzstücke.
- Für die höchste Ebene stehen Sie ein 2,44 m-Brett über zwei 0,91 m-Stücke an jedem Ende an der Kante und bohren Sie zwei Schrauben vertikal in jedes der 0,91 Stück. Schrauben Sie ein weiteres 0,91 m Stück 1,22 m von jedem Ende für die Unterstützung, und legen Sie ein 2,44 m-Brett über die Rückseite der 0,91 m Ständer und Schraube in Platz für die Unterstützung.
HINWEIS: Die acht 3,175 cm x 15,24 cm x 2,44 m werden so gehalten, wie es ist, und ungeschnitten, um als Tischplatte für jede Bankebene zu dienen. - Wiederholen Sie Schritt 1.2 für die nächste Bankebene mit den 0,76 m Stück.
- Wiederholen Sie Schritt 1.2 für die nächste Bank mit den 0,61 m Stück bis zur sechsten Bank bei 0,15 m.
HINWEIS: Für Bänke 3–6 wird kein tragendes 2,44 m-Brett benötigt. Der letzte Stand hat sechs Bänke mit je drei vertikalen Stützen, eine an jedem Ende und eine in der Mitte. - Linienbänke in absteigender Höhenreihenfolge mit der überhängenden Lippe, die auf die Rückseite blickt und die Bank darüber berührt, was einen Abstand zwischen den Ebenen ermöglicht.
- Legen Sie ein 0,91 cm Brett an jedem der unteren Ränder der Bänke entlang des Bodens und schrauben Sie die Bänke an Ort und Stelle.
- Schrauben Sie eine 0,46 m Brett horizontal für die Unterstützung auf den höchsten drei Bänke auf jeder Seite der Struktur 0,61 m vom Boden entfernt.
- Schrauben Sie drei Eckklammern auf die vorderen Enden und die Mitte der höchsten Bank.
- Schrauben Sie ein 2,54 cm x 5,08 cm x 20,32 cm Holzstück über die Klammern 2,54 cm vom Fuß der Bank.
HINWEIS: Machen Sie eine 0,91 m mal 0,91 m mal 2,44 m Struktur. Siehe Abbildung 1 für das endgültige Basisprodukt. Die Dimensionen können sich mit den experimentellen Erfordernissen ändern. Die beschriebene Struktur wurde für 15,24 cm Töpfe ausgelegt. Die Höhen zwischen den Bänken wurden so gestaltet, dass sie die in diesem Experiment verwendeten Töpfe und Pflanzenmaterialien passen, um einen stetigen Fluss von Allelochemikalien und Lösung von einem Topf zum anderen durch die Schwerkraft auf den Bänken zu erhalten.

Abbildung 1: Vorderansicht des hölzernen Sockelständers. Ein Holzsockel dient als Ständer für die Pflanzenproben. Die Materialien für das System sind je nach Anzahl der für das Experiment benötigten Proben zusammenzubauen und hinzuzufügen. In dieser Studie dienten zwei Stände als Basis für 31 Proben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Systemmontage
- Entfernen Sie die Kappe aus einer 1 L Sodaflasche und sprühen Sie Farbe mit schwarzer Farbe.
HINWEIS: Die Sodaflaschen dienen als Reservoir an der Oberseite des Systems für eine Säule. Die Farbe stellt einen Block für das Licht dar und verringert oder verhindert das Algenwachstum. - Bohren Sie an der Unterseite jeder Sodaflasche ein kleines Loch, das gerade groß genug ist, um einen 0,35 cm Innendurchmesser (ID), 0,64 cm Außendurchmesser (OD), 5,08 cm langes Kunststoff-PVC-Rohr einzubetten.
- Verschmieren Sie eine Schicht aus Silikon wasserdichte Dichtmittel um den Rand des Loches nach dem Einsetzen, um Leckagen zu verhindern. Lassen Sie es vollständig trocknen.
- Wiederholen Sie die Schritte 2.2 und 2.3 auf jedem der Kunststoffschalen, die verwendet werden, um die Töpfe zu halten.
HINWEIS: Für eine Spalte werden vier Gerichte benötigt. - Entfernen Sie den Deckel und sprühen Sie die Außenseite von 2,27 L Kunststoffkanistern mit schwarzer Farbe. Diese Kanister dienen als Sammelbehälter an der Basis jeder Säule.
- Bohren Sie ein kleines Loch in die obere Rückseite des Kanisters.
HINWEIS: Die in den Schritten 2.1–2.6 aufgeführten Verbrauchsmaterialien bilden eine Spalte. Die Anzahl der Spalten hängt von der Anzahl der Proben ab, die für das gewünschte Experiment benötigt werden. Für ein Beispiel werden zwei Spalten benötigt. Alle Dimensionen können sich je nach experimentellem Bedarf ändern. - Nachdem die Vorräte vorbereitet und getrocknet sind, legen Sie die Sodaflasche auf die höchste Bank, so dass das PVC-Rohr über dem Rand mit Blick auf die Treppe hängt.
- Direkt unter der Sodaflasche auf der nächsten Bank, legen Sie eine Plastikschale mit seinem Rohr über dem Rand der Bank hängen.
- Wiederholen Sie Schritt 2.8 für die nächsten beiden Bänke.
- Legen Sie den Kanister auf die untere Bank mit dem Loch nach hinten.
- Verbinden Sie den Kanister mit der Schale darüber, indem Sie das Rohr von der Schale durch das Loch in der Rückseite des Kanisters spannen.
- Verschmieren Sie wasserdichte Dichtstoffe um den Rand des Kanisters, wo das Rohr durchläuft, um Leckagen zu verhindern.
- Legen Sie eine 21 W 1.000 L/h Tauchpumpe in den unteren Kanister.
- Schließen Sie ein 1,07 m langes, 1,27 cm ID, 1,59 cm OD PVC-Rohr an die Düse der elektrischen Pumpe an.
- String die Röhre durch den Spalt zwischen den Bänken und über die Rückseite der Sodaflasche an der Oberseite des Systems.
- Schließen Sie die Pumpe an einen digitalen Timer an und stellen Sie die Timer-Einstellung nach Bedarf ein.
HINWEIS: Der Timer wurde während des gesamten Experiments für 1 min alle 3 stunden ausgeführt. Das gewählte Timing ermöglichte es, die maximale Flüssigkeitsmenge im Sammelbehälter zu fahren und bei jedem Einschalten der Pumpe ca. 10 min Durchfluss zu erreichen, während Überschwemmungen und Überflutungen vermieden wurden.
3. Pflanzung
- Sterilisieren Sie alle Reissamen, die sie benötigen, indem Sie 70% Ethanol für 30 s spülen, 5% Bleichmittel für 20 min einweichen und 6x mit destilliertem Wasser spülen.
- Prägerminieren Sie die sterilisierten Reissamen in Petrischalen, die mit Filterpapier gefüllt sind, gefüllt mit 5 ml destilliertem Wasser in einer Wachstumskammer, die bei 25 °C eingestellt ist.
- Nachdem die Samen keimen, säumen Sie den Boden jedes Topfes mit zwei großen Kaffeefiltern, indem Sie sie in ihre natürliche Becherform in die Töpfe legen.
- Füllen Sie jeden Topf an die Spitze des Filters (ca. 75% des Topfes) mit autoklavierten, gewaschenen und geschirmten speziell abgestuften Quarzsand. Dämpfen Sie den Sand mit destilliertem Wasser, indem Sie Wasser über die Oberseite des Sandes gießen oder Töpfe in Pflanzschalen legen, die nur leicht mit destilliertem Wasser gefüllt sind, damit die Töpfe das Wasser aufsaugen und feucht bleiben. Transplantieren Sie sechs prägerminierte Spenderpflanzensämlinge in Sand, gleichmäßig verteilt.
- Die Sämlinge mit Sand bedecken.
- Lassen Sie die Sämlinge für 3 Wochen aufstellen.
HINWEIS: Der Sand trocknet sehr schnell. Daher ist das Platzieren von Töpfen in Schalen eine effiziente Bewässerungstechnik. Das ständige Auswechseln des Wassers hilft, Schimmel zu verhindern. - Prägerminieren Sie die EmpfängerPflanze Sämlinge (E. crus-galli) in Petrischalen 3 Wochen nach der Pflanzung Spenderpflanzen durch Auskleidung der Unterseite der Schale mit Filterpapier und zusammen mit 5 ml destilliertem Wasser. Legen Sie das Geschirr 3–5 Tage lang bei 25 °C in eine Wachstumskammer.
- Bereiten Sie die Töpfe wie in den Schritten 3.1–3.2 beschrieben vor.
- Nachdem die Sämlinge keimen, drei Sämlinge in die vorbereiteten Töpfe transplantieren und mit Sand bedecken.
HINWEIS: Das Experiment beginnt einen Tag nach der Behandlung (DAT) oder dem Tag, an dem die Empfängerpflanzensämlinge auftauchen und transplantiert und in das System gelegt werden.
4. Probenplatzierung
- Legen Sie vier Töpfe von einem Beitritt von Spenderpflanzen in die vier Gerichte der Spalte 1, ein einziger Topf pro Reihe. Spalte 1 besteht nur aus Spenderpflanzen.
- Legen Sie zwei Töpfe des gleichen Beitritts der Spenderpflanzen in die Gerichte der Spalte 2 in der ersten und dritten Reihe der Spalte.
- Legen Sie zwei Töpfe von Empfängerpflanzen in die Gerichte der Spalte 2 auf der zweiten und vierten Reihe in der Spalte.
- Stellen Sie für jede Replikation sicher, dass nur eine Reihe von Empfängeranlagen hinzugefügt wird. Zwei Säulen, die erste besteht nur aus Spenderpflanzen und die zweite abwechselnde Spender und Empfänger, machen eine Behandlung (Abbildung 2).
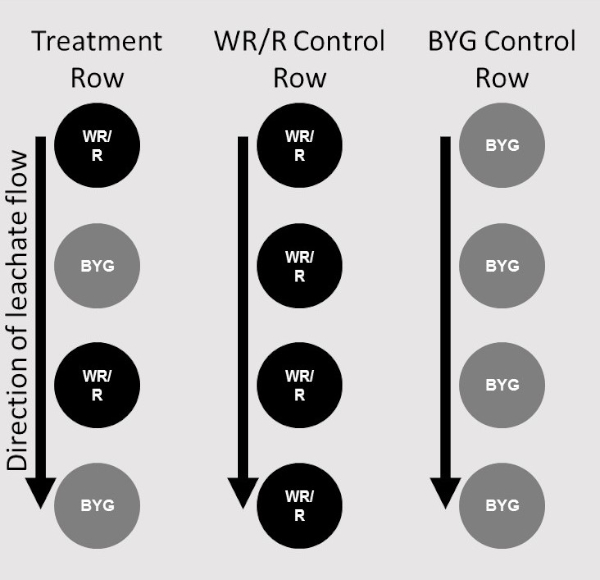
Abbildung 2: Platzierungskarte. Diagramm zur Darstellung von Platzierungen von Spenderanlagen (WR/R) und Empfängeranlagen (BYG) in den jeweiligen Positionen im Treppenstufensystem. Zwei Säulen des Treppenstufensystems mit Anlagen umfassen eine Behandlung. Eine einzige Spalte von Empfängeranlagen diente als Steuerung für eine Replikation (ganz rechts), eine einzelne Spalte von Spenderpflanzen als Steuerung für jeden Beitritt (Mitte), und die Behandlungskolonne bestand aus abwechselnden Spender- und Empfängerpflanzen (ganz links). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Wiederholen Sie die Schritte 4.1–4.4 für jede Behandlung oder jeden Beitritt der Spenderpflanze (Abbildung 3).
HINWEIS: Für jede Replikation ist eine Spalte mit Empfänger-Pflanzenproben erforderlich, die als Steuerelement für eine Replikation dienen. Die Behandlungen wurden 3x in einem randomisierten kompletten Blockdesign repliziert.

Abbildung 3: Endgültige Treppenbaustruktur. Das Treppenstufensystem wurde mit den Anlagen an Ort und Stelle montiert. Das System enthielt vier Reihen von Pflanzenproben und einen Sammelbehälter an der Unterseite für die Lösung, um zur oberen Flasche und nach unten durch die Schwerkraft durch jeden jeweiligen Topf zu radeln. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Betrieb
- Füllen Sie auf DAT 1 den Sammelbehälter an der Unterseite jeder Säule mit halbfester Hoagland-Lösung17 in destilliertem Wasser, ca. 1.500 ml.
- Stellen Sie die Timer so ein, dass sie in der Auto-Off-Einstellung wie gewünscht ausgeführt werden.
- Bedecken Sie die Sammelbehälter mit schwarzem Kunststoff, um lichtbelichtete Und Verdunstung zu begrenzen.
- Füllen Sie die Tanks alle 2 Tage mit 500 ml Hoaglands Lösung, um das System konstant fließen zu lassen.
- Halten Sie die Gewächshaustemperaturen bei 28 °C während des Tages und 24 °C in der Nacht mit einem 16/8 h Split und Feuchtigkeit bei 53%.
6. Datenerhebung
- Messen und erfassen Sie die Höhe jeder Pflanze im Treppenstufensystem auf DAT 1 und einmal pro Woche bis DAT 21, indem Sie ein Lineal an der Basis jeder Pflanze platzieren und den höchsten Blattständer beobachten.
- Messen und erfassen Sie die Chlorophyllgehalte jeder Pflanze auf DAT 7 und 14 mit dem Chlorophyll-Gehaltmeter.
- Beschriften Sie am letzten Tag des Experiments (d.h. DAT 21) eine Papiertüte für jeden Topf.
- Pflanzenproben an der Basis schneiden und in separate Säcke legen.
- Alle Proben in einem Ofentrockner auf 60 °C für 48 h16legen.
- Entfernen Sie getrocknete Proben und leere Inhalte einzeln auf einer Waage und notieren Sie das Gewicht in Gramm.
7. Datenanalyse
- Berechnen Sie das allelopathische Potenzial der Spenderpflanzen anhand der prozentualen Hemmung der Empfängerpflanze anhand dieser Gleichung:
Höhenreduzierung (%) = [Höhe der Kontrolle (cm) – Höhe der behandelten (cm)] - Berechnen Sie die Erhöhung der Spenderpflanzenhöhe als Überprüfung auf einen umgekehrten Effekt, den die Empfängerpflanze auf die Zielpflanzen haben kann.
- Analysieren Sie Beitritte als festen Effekt, während Replikationen und Ausführungen die Zufallseffektesind 18.
- Analysieren Sie die Daten anhand eines allgemeinen linearen Modells mit Mittelwerten, die mit Fishers geschütztem am wenigsten signifikanten Unterschied auf oder unter einem Wahrscheinlichkeitsniveau von 0,05 in einer statistischen Software (z. B. JMP 14) getrennt sind.
- Visualisieren Sie die Korrelation zwischen den ursprünglichen Variablen mithilfe der Prinzipkomponentenanalyse von durch Hochladen von Daten.
- Wählen Sie die Registerkarte Analysieren in der Symbolleiste aus, wählen Sie Y nach X anpassenaus. Markieren Sie unter Spalten die Antwortvariablen (d. h. die Prozentuale Höhenreduzierung), und klicken Sie dann auf Y, um den für Y beobachteten Faktor anzugeben (d. h. die Prozentuale Höhenreduzierung). Für den X-Faktor, Hightlight-Beitritt und klicken Sie auf X, Faktor, und wählen Sie dann OK.
- Wählen Sie den roten Abwärtspfeil auf der Oneway-Analyseleiste aus, wählen Sie Mittel/ANOVA. Wählen Sie erneut den Abwärtspfeil auf der Oneway-Analyseleiste aus und markieren Sie die Mittelwerte vergleichen, und wählen Sie dann jedes Paar, das T des Schülers, aus.
Ergebnisse
Zwei vorläufige Screenings mit dieser Methode wurden an neun Unkrautreis-Beitritten (B2, S33, B83, S97, S94, B81, B8, B34, B14) und fünf kultivierten Reislinien (PI338046, Rex, Rondo, PI312777, CL163) durchgeführt. Unkrautreis-Beitritte und Reislinien wurden auf der Grundlage ihrer Leistung in früheren allelopathischen Screenings von Shrestha (2018)18ausgewählt. Die unkrautigen Reissamen wurden aus dem ganzen Bundesstaat Arkansas gesammelt. Die ausgewählten Reislinien sind in den USA häufig...
Diskussion
Die Ausnutzung der Allelopathie kann potenziell als biologische Kontrolle für Unkraut dienen, das schwer zu verwalten ist1,7,13. Die Allelopathie hat großes Potenzial als mögliche Lösung für die Unkrautkrise bei Reis gezeigt und dient als Alternative oder Ergänzung zu Chemikalien und manuellen Unkrautbekämpfungspraktiken5,13,19. ...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Finanzierung dieses Projekts wurde von der Special Research Initiative Grant bereitgestellt, die von der Mississippi Agricultural and Forestry Experiment Station gesponsert wurde und auf Arbeiten basiert, die vom National Institute of Food and Agriculture, U.S. Department of Landwirtschaft, Hatch-Projekt unter der Beitrittsnummer 230060.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.25 in by 6 in by 8 ft standard severe weather wood board | Lowe's, Mooresville, NC | 489248 | N/A |
| 2 in by 4 in by 8 ft white wood stud | Lowe's, Mooresville, NC | 6005 | Cut into appropriate sizes |
| 63 mm (2.5 in) corner braces | Lowe's, Mooresville, NC | 809449 | N/A |
| Asporto 16 oz Round Black Plastic To Go Box - with Clear Lid, Microwavable – 6.25 in by 6.25 in by 1.75 in - 100 count box | Restaurantware.com, Chicago, IL | RWP0191B | black |
| ATP vinyl-flex PVC food grade plastic tubing, clear, 0.125 in id by 0.25 in od, 100 ft | Amazon, Seattle WA | B00E6BCV0G | N/A |
| Ccm-300 chlorophyll content meter | Opti-Sciences, Inc. Hudson, NH | ccm/300 | N/A |
| Common 1 in by 2 in by 8 ft pine board | Lowe's, Mooresville, NC | 1408 | N/A |
| Contractors choice contractor 24-pack 42-gallon black outdoor plastic construction trash bag | Lowe's, Mooresville, NC | 224272 | Cut to cover collection tanks |
| EURO POTS | Greenhouse Megastore, Danville, IL | CN-EU | 15 cm short black 6 in diameter 4.25 in height 1.37 qt volume |
| Fisher brand petri dish with clear lid | Fisher Scientific, Waltham, MA | FB0857513 | N/A |
| Aexit Ac 220 V-240 V electrical equipment US plug 21 W 1,000 L/hr multipurpose submersible pump | Amazon, Seattle WA | B07MBMYQNT | Nozzle size should fit tubes and can be repaced |
| Woods 50015 WD outdoor 7 day heavy-duty digital outlet timer | Walmart, Bentonville, AR | 565179767 | 20 settings |
| GE silicone 2+ 10.1 oz almond silicone caulk | Lowe's, Mooresville, NC | 48394 | Sealant for edges of any attached tubing |
| Great Value Distilled Water | Walmart, Bentonville, AR | 565209428 | N/A |
| Great Value White Basket coffee filters 200 count | Walmart, Bentonville, AR | 562723371 | Size may vary |
| Grip-rite primgaurd plus #9-3 in pollimerdex screws | Lowe's, Mooresville, NC | 323974 | N/A |
| Hoagland’s No. 2 basal salt mixture | Caisson Laboratories, INC. Smithfield, UT | HOP01/50LT | ½ strength rate |
| JMP (14) | SAS Institute Inc. North Carolina State University, NC | N/A | |
| Project source flat black spray paint | Lowe's, Mooresville, NC | 282254 | N/A |
| Project source utility 1.88 in by 165 ft gray duct tape | Lowe's, Mooresville, NC | 488070 | N/A |
| Rubbermaid 2 qt square food storage canister clear | Walmart, Bentonville, AR | 555115144 | Collection tank discard lid |
| Sealproof unreinforced PVC clear vinyl tubing, food-grade .5 in id by .625 in od, 100 ft | Amazon, Seattle WA | B07D9CLGV3 | Connects to pump |
| Short Mountain Silica 50 lb Play sand | Lowe's, Mooresville, NC | 10392 | Sand should be purified |
| Steve Spangler's 1 L Soda Bottles - 6 Pack - For Science Experiment Use | Amazon, Seattle WA | UPC 192407667341 | Top step tank discard lid |
Referenzen
- Weston, L. A. History and Current Trends in the Use of Allelopathy for Weed Management. HortTechnology. 15 (3), 529-534 (2005).
- Pratley, J. E. Allelopathy in annual grasses. Plant Protection Quarterly. 11, 213-214 (1996).
- Bertin, C., Yang, X., Weston, L. A. The role of root exudates and allelochemicals in the rhizosphere. Plant and Soil. 256 (1), 67-83 (2003).
- Stevenson, G. R. Pesticide Use and World Food Production: Risks and Benefits. Environmental Fate and Effects of Pesticides. American Chemical Society. , 261-270 (2003).
- Chopra, N., Tewari, G., Tewari, L. M., Upreti, B., Pandey, N. Allelopathic Effect of Echinochloa colona L. and Cyperus iria L. Weed Extracts on the Seed Germination and Seedling Growth of Rice and Soybean. Advances in Agriculture. 2017, 1-5 (2017).
- Jabran, K., Mahajan, G., Sardana, V., Chauhan, B. S. Allelopathy for weed control in agricultural systems. Crop Protection. 72, 57-65 (2015).
- Worthington, M., Reberg-Horton, C. Breeding Cereal Crops for Enhanced Weed Suppression: Optimizing Allelopathy and Competitive Ability. Journal of Chemical Ecology. 39, 213-231 (2013).
- Sudianto, E., et al. Corrigendum to "Clearfield (R) rice: Its development, success, and key challenges on a global perspective.". Crop Protection. 55, 142-144 (2014).
- Gressel, J., Valverde, B. E. A strategy to provide long-term control of weedy rice while mitigating herbicide resistance transgene flow, and its potential use for other crops with related weeds. Pest Management Science. 65, 723-731 (2009).
- Muthayya, S., Sugimoto, J. D., Montgomery, S., Maberly, G. F. An overview of global rice production, supply, trade, and consumption. Annals of the New York Academy of Sciences. 1324, 7-14 (2014).
- Chung, I. M., Kim, K. H., Ahn, J. K., Lee, S. B., Kim, S. H. Allelopathy Comparison of Allelopathic Potential of Rice Leaves, Straw, and Hull Extracts on Barnyardgrass. Agronomy Journal. 95 (4), 1063-1070 (2003).
- Olofsdotter, M., Jensen, L. B., Courtois, B. Improving crop competitive ability using allelopathy Ð an example from rice. Journal of Plant Breeding. 121, 1-9 (2002).
- Olofsdotter, M., Navarez, D., Rebulanan, M., Streibig, J. C. Weed-suppressing rice cultivars-does allelopathy play a role. Weed Research. 39 (6), 441-454 (1999).
- Jensen, L. B., et al. Locating Genes Controlling Allelopathic Effects against Barnyardgrass in Upland Rice. Agronomy Journal. 93 (1), 21-26 (2001).
- Kuijken, R. C., Eeuwijk, F. A. V., Marcelis, L. F., Bouwmeester, H. J. Root phenotyping: from component trait in the lab to breeding. Journal of Experimental Botany. 66 (18), 5389 (2015).
- Lickfeldt, D. W., Voigt, T. B., Branham, B. E., Fermanian, T. W. Evaluation of allelopathy in cool season turfgrass species. International Turfgrass Society. 9, 1013-1018 (2001).
- Liu, D. L., Lovett, J. V. Biologically active secondary metabolites of barley: Developing techniques and assessing allelopathy in barley. Journal of Chemical Ecology. 19, 2217-2230 (1993).
- Shrestha, S. . Evaluation of Herbicide Tolerance and Interference Potential among Weedy rice germplasm. , (2018).
- Kim, K. U., Shin, D. H., Olofsdotter, Rice allelopathy research in Korea. Allelopathy in Rice. IRRI. , (1998).
- Quasem, J. R., Hill, T. A. On difficulties with allelopathy. Weed Research. 29, 345-347 (1989).
- Singh, S., et al. Evaluation of mulching, intercropping with Sesbania and herbicide use for weed management in dry-seeded rice (Oryza sativa L.). Crop Protection. 26, 518-524 (2007).
- Kong, C. H., Li, H. B., Hu, F., Xu, X. H., Wang, P. Allelochemicals released by rice roots and residues in soil. Plant and Soil. 288 (1-2), 47-56 (2006).
- Ervin, G. N., Wetzel, R. G. Allelochemical autotoxicity in the emergent wetland macrophyte Juncus effusus (Juncaceae). American Journal of Botany. 87 (6), 853-860 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten