Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantifizierung der biventrikulären Funktion und Morphologie durch kardiale Magnetresonanztomographie bei Mäusen mit Pulmonalarterienbanding
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Um die Pathophysiologie der rechtsventrikulären (RV) Anpassung an abnormale Belastungen zu verstehen, sind experimentelle Modelle von entscheidender Bedeutung. Die Bewertung der Abmessungen und Funktionen von Wohnmobilen ist jedoch komplex und herausfordernd. Dieses Protokoll bietet eine Methode zur Durchführung der kardialen Magnetresonanztomographie (CMR) als nicht-invasives Benchmark-Verfahren bei Mäusen, die einer RV-Druckbelastung ausgesetzt sind.
Zusammenfassung
Die Funktion und das Versagen des Rechtsventrikulums (RV) sind wichtige Determinanten für das Ergebnis bei erworbenen und angeborenen Herzerkrankungen, einschließlich pulmonaler Hypertonie. Die Beurteilung der Funktion und Morphologie des RV ist komplex, was zum Teil auf die komplexe Form des RV zurückzuführen ist. Derzeit ist die kardiale Magnetresonanztomographie (CMR) der goldene Standard für die nichtinvasive Beurteilung der Funktion und Morphologie des RV. Das aktuelle Protokoll beschreibt die CMR-Bildgebung in einem Mausmodell der RV-Druckbelastung, die durch Pulmonalarterienbanding (PAB) induziert wird. PAB wird durchgeführt, indem eine 6-0-Naht um die Lungenarterie über einer 23-G-Nadel gelegt wird. Der PAB-Gradient wird nach 2 und 6 Wochen echokardiographisch bestimmt. Nach 6 Wochen werden die Morphologie und Funktion des Rechts- und Linksventrikels beurteilt, indem sowohl das endsystolische als auch das enddiastolische Volumen und die Masse mit einem 9,4-T-Magnetresonanztomographen mit einem 1.500 mT/m-Gradienten gemessen werden. Repräsentative Ergebnisse zeigen, dass PAB einen signifikanten Anstieg der RV-Druckbelastung induziert, mit signifikanten Auswirkungen auf die biventrikuläre Morphologie und die RV-Funktion. Es wird auch gezeigt, dass bei 6 Wochen RV-Druckbelastung das Herzzeitvolumen aufrechterhalten wird. Hier wird ein reproduzierbares Protokoll zur Quantifizierung der biventrikulären Morphologie und Funktion in einem Mausmodell der RV-Druckbelastung vorgestellt und kann als Methode für Experimente zur Untersuchung von Determinanten des RV-Umbaus und der Dysfunktion dienen.
Einleitung
Bei Patienten mit erworbenen und angeborenen Herz-Kreislauf-Erkrankungen, einschließlich pulmonaler Hypertonie (PH), besteht das Risiko einer rechtsventrikulären Dysfunktionund eines Versagens 1. Die RV-Adaptation als Folge einer erhöhten Druckbelastung ist durch eine konzentrische Hypertrophie in frühen Stadien und eine fortschreitende Dilatation im Endstadium der Erkrankung gekennzeichnet. Darüber hinaus wird es mit Störungen des Stoffwechsels und der extrazellulären Matrix, Entzündungsprozessen und schließlich dem Versagen des RV in Verbindung gebracht 2,3,4,5,6. Tiermodelle wurden entwickelt, um die zugrundeliegenden Prozesse des Fortschreitens zum Versagen von Wohnmobilen zu untersuchen. Die Optimierung der Modelle und die angemessene Bewertung der Funktionen und Abmessungen von Wohnmobilen war jedoch eine Herausforderung. Für die nicht-invasive Beurteilung der Funktion und der Abmessungen von RVs ist die kardiale Magnetresonanztomographie (CMR) der goldene Standard. Bei dieser Technik werden Bilder des schlagenden Herzens erstellt, indem ein starkes Magnetfeld und Hochfrequenzwellen verwendet werden. CMR ist sowohl für den Menschen als auch für Tiere wie Labornagetiere verfügbar. Da letztere aufgrund der geringeren Größe des Herzens eine höhere räumliche Auflösung erfordern, muss das Magnetfeld, das für adäquate Bilder erforderlich ist, im Vergleich zum Menschen höher sein.
Es sind mehrere Modelle erhältlich, die eine RV-Drucküberlastung nachahmen, einschließlich Modelle mit PH 7,8,9,10,11,12,13,14,15,16,17 und Modelle mit proximaler RV-Drucklast 2,3,10,18, 19,20,21,22,23. Die Wahl eines PH-Modells oder eines Modells der proximalen RV-Druckbelastung hängt von der Forschungsfrage ab: der Wirkung eines Eingriffs auf das pulmonale Gefäßsystem und damit möglicherweise der RV-Nachlastmodulation (d.h. PH-Modelle) oder der direkten Wirkung auf die RV (d.h. proximale RV-Druckbelastungsmodelle). Es stehen mehrere Methoden zur experimentellen Induktion der PH zur Verfügung, darunter die Verwendung von Monocrotalin (MCT)12,13,14,16,22,24,25,26, MCT in Kombination mit einem aortocavalen Shunt 9, chronische Hypoxie 7,27,28,29 und die Kombination eines vaskulären endothelialen Wachstumsfaktor-Rezeptor-Antagonisten, Sugen 5416, mit chronischer Hypoxie 8,10,30,31. Solche Modelle stellen progressive pulmonale Modelle der proximalen RV-Druckbelastung dar und zielen nicht auf das Lungengefäßsystem ab, sondern induzieren eine konstante Nachlast durch Verengung der Lungenarterie mit einer begleitenden Erhöhung der RV-Nachlast 2,3. Dies kann durch ein Nahtband (Pulmonalarterienbanding, PAB) oder einen Gefäßclip um die Lungenarterie erfolgen. PAB wurde bei mehreren Tierarten durchgeführt, und die kardialen Dimensionen und Funktionen wurden auf verschiedene Weise untersucht, wie z. B. Histologie, transthorakale Echokardiographie (einschließlich Speckle-Tracking) und Herzkatheterisierung 2,32,33,34,35,36,37,38,39,40 . PAB bei kleinen Nagetieren, wie z. B. Mäusen, ist eine Herausforderung. Dies liegt daran, dass subtile Unterschiede zwischen der Enge der Arterienverengung deutliche Auswirkungen auf den Grad der RV-Druckbelastung und den anschließenden Funktionsstatus und das Überleben haben. Wenn die Einengung sehr eng ist, stirbt das Tier während oder kurz nach der Operation, während der gewünschte Phänotyp nicht erreicht wird, wenn die Einschnürung nicht fest genug ist. Der Einsatz von Mäusen hat jedoch Vorteile im Vergleich zu anderen Tieren, aufgrund der hervorragenden genetischen Veränderungsmöglichkeiten (d.h. transgene oder Knockout-Modelle) und der schnellen Vermehrung. Dies ist ein Mehrwert bei der Erforschung von Krankheiten und bei der Erforschung des Beitrags molekularer und (epi-)genetischer Faktoren.
Die Studiendesigns an Tieren verlagern sich in Richtung der Untersuchung zeitlicher Veränderungen während der Krankheit 2,3,8,13,21. Für solche Studien sind nicht-invasive Modalitäten notwendig, da serielle Assessments durchgeführt werden können. Alternativen zur CMR bei der Beurteilung des kardialen Umbaus könnten (1) die Gewebecharakterisierung mittels Histopathologie sein, bei der mehrere Tiere zu unterschiedlichen Zeitpunkten getötet werden, (2) die invasive funktionelle Beurteilung durch Druck-Volumen-Analyse oder (3) die Echokardiographie, die es dem Forscher ermöglicht, eine kardiale Hypertrophie oder Dilatation nicht-invasiv innerhalb desselben Tieres seriell zu identifizieren. CMR hat zwei große Vorteile bei der Beurteilung des RV: (1) CMR ist eine nicht-invasive Modalität, die serielle Messungen an einem Tier ermöglicht und damit dazu beiträgt, die für Studien benötigten Tierzahlen zu reduzieren, und (2) CMR verlässt sich nicht auf eine bestimmte geometrische Form und visualisiert dreidimensional. CMR-abgeleitete RV-Volumina und Funktionsmessungen haben sich als genau erwiesen und gelten als nicht-invasiver goldener Standard bei verschiedenen kardialen Entitäten beim Menschen 42,43,44,45, wurden aber noch nicht in ein CMR-Protokoll für Mäuse mit RV-Drucküberlastung übersetzt.
In der Literatur sind viele Modelle von PAB beschrieben, jedoch mit hoher Heterogenität in den Methoden zur Bewertung hämodynamischer Effekte und der RV-Funktion und -Anpassung. Dieses Protokoll beschreibt das Verfahren der PAB bei Mäusen mit Validierung des Modells durch Messung des PAB-Gradienten durch Echokardiographie und Bewertung der Herzdimensionen und -funktion mit CMR. Während für Ratten ein Protokoll der CMR bei Tieren, die einer PAB unterzogen wurden, veröffentlicht wurde, wurde diese Kombination bisher nicht für Mäuse beschrieben. Während Ratten am häufigsten für PH-Modelle verwendet werden, 8,12,13,14,15,16,22,24,25,26,27,28,29,30,31,46werden Mäuse am häufigsten für transgene oder Knock-out-Studien verwendet und tragen damit zum Verständnis der Mechanismen des druckbelasteten RV-Versagens bei. Dieses Protokoll könnte die Grundlage für zukünftige Studien bilden, um Signalwege zu entschlüsseln, die am Übergang zum Versagen von Wohnmobilen beteiligt sind.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle Versuche und die Tierpflege werden gemäß dem niederländischen Tierversuchsgesetz durchgeführt und entsprechen dem Leitfaden für die Pflege und Verwendung von Labortieren, der von den US National Institutes of Health veröffentlicht wurde. Der Tierversuchsausschuss der Universität Groningen, Niederlande, hat das aktuelle Versuchsprotokoll genehmigt (Zulassungsnummer: 2014-041/3005).
1. Unterbringung und Akklimatisation
- Verwenden Sie 20–30 g Wildtyp-Mäuse vom Typ C57 black 6 (C57BL/6) (zuvor beschriebene institutionelle Zuchtlinie47), männlich und weiblich, alle älter als 8 Wochen. Halten Sie die Mäuse in Gruppen mit maximal fünf pro Käfig. Um sich an den Umgang mit dem Menschen zu gewöhnen, lassen Sie die Mäuse mindestens 7 Tage akklimatisieren. Führen Sie während dieser Zeit keine Eingriffe durch.
2. Operation des Lungenarterienbandes
- Präparat
- Legen Sie die Maus in die mit 5 % Isofluran/100 % Sauerstoff gefüllte Induktionskammer. Überprüfen Sie, ob keine Reflexe vorhanden sind, indem Sie einen Schmerzreiz geben (z. B. Zehenkneifen).
- Rasieren Sie das linke Hemithorax der Maus mit einem Elektrorasierer.
- Ziehen Sie die Zunge vorsichtig heraus und halten Sie sie mit leichter Spannung.
- Beleuchten Sie den inneren Hals, indem Sie eine Lichtquelle auf dem äußeren Hals auf Höhe der Stimmritze platzieren.
- Intubieren Sie die Maus endotracheal mit einer flexiblen 20-G-Kanüle.
- Legen Sie das Tier mit der rechten Seite auf eine Heizmatte (Temperatur auf 37 °C einstellen).
- Verbinden Sie die Kanüle mit dem Minibeatmungsgerät und beginnen Sie die Beatmung mit 1,5 % bis 2,5 % Isofluran/Sauerstoff (180 Atemzüge/min, tidal 250 μL).
- Injizieren Sie 0,1 mg/kg Buprenorphin subkutan zur postoperativen Analgesie.
- Verhindern Sie die Austrocknung des Auges mit Augensalbe.
- Operation eines Lungenarterienbandes durch linke laterale Thorakotomie
- Platzieren Sie die Maus auf der rechten Seite, indem Sie das rechte Vorderbein in eine neutrale Position bringen, das rechte Hinterbein ausgestreckt und das linke Vorderbein nach hinten beugen.
- Desinfizieren Sie die Haut am Brustkorb mit Chlorid-Hexidin, tupfen Sie 2x ab.
- Verwenden Sie sterile Instrumente für die Chirurgie. Öffnen Sie die Haut mit einer kleinen Schere (runder Griff, 12 mm Klingen) von der linken Achselhöhle parallel zur zweiten und dritten Rippe.
- Identifizieren Sie den M. pectoralis superficialis (schräger, oberflächlicher Muskel) und den M. pectoralis profundus (schräger, darunter liegender Muskel).
- Ziehen Sie den M. pectoralis superficialis mit Hilfe von Nahtschlaufen zur ventralen Seite und den M. pectoralis profundus zur dorsalen Seite der Maus.
- Öffnen Sie den zweiten Interkostalraum und spreizen Sie die Rippen mit angepassten Büroklammern, so dass das linke Herzohr, die linke Lunge und die Lungenarterie sichtbar werden.
- Trennen Sie die Arteria pulmonalis von der Aorta. Legen Sie mit einer stumpfen 25-G-Nadel, die eine 6-0-Naht enthält, eine Nahtschlaufe um die Lungenarterie und platzieren Sie eine lose 2-1-1-Ligatur um die Arteria pulmonalis.
- Platzieren Sie eine 23 G Nadel parallel zur Arteria pulmonalis innerhalb der 6-0 Naht und fixieren Sie zuerst den proximalsten Nahtknoten und dann den distalen Knoten der 2-1-1 Naht. Die 23 G Nadel herausnehmen. Stellen Sie sicher, dass der Knoten ausreichend ist.
- Verschließen Sie den Thorax mit zwei oder drei separaten Nähten mit einem monofilen Nahtmaterial aus Polypropylen 5-0. Setzen Sie den M. pectoralis superficalis und den M. pectoralis profundus frei.
- Vernähen Sie die Haut mit einem Naht aus reiner Polyglykolsäure 5-0. Verwenden Sie eine kontinuierliche Nahttechnik, um die Narbenbildung im Gewebe zu minimieren. Narbengewebe beeinflusst die Bildqualität der Echokardiographie.
- Schalten Sie das Isofluran aus, während Sie während der Genesung von der Narkose die Beatmung mit Sauerstoff fortsetzen, bis die Maus ihre eigene, spontane Atmung wiedererlangt, wie sie an der Bewegung des Bauches zu beobachten ist.
- Entkoppeln Sie den Endotrachealtubus vom Beatmungsgerät. Auf Spontanatmung prüfen, nur extubieren, wenn spontane Atmungswirkung sichtbar ist. Wenn keine Spontanatmung zu sehen ist, schließen Sie den Schlauch wieder an das Beatmungsgerät an und kehren Sie zu Schritt 2.2.12 zurück.
- Beobachte die Maus, bis sie wieder zu Bewusstsein kommt.
- Schein-Operation
- Führen Sie das obige Verfahren mit Ausnahme der Streifenbildung (Schritte 2.2.2–2.2.6) durch.
- Postoperative Phase
- Lagern Sie die Maus einzeln für 24 h in einem Inkubator (37 °C).
- Beobachten Sie die Maus täglich während der ersten 3 postoperativen Tage. Bei Anzeichen von Beschwerden injizieren Sie 2x täglich 0,1 mg/kg Buprenorphin subkutan zur postoperativen Analgesie.
3. Echokardiographie
- Präparat
- Führen Sie 14 Tage nach der PAB-Operation eine PAB-Gradientenanalyse mittels Echokardiographie durch.
- Starten Sie das Echokardiographiegerät. Wählen Sie das Herzpaket und einen 14,0 MHz Schallkopf.
- Anästhesie
- Legen Sie die Maus in die Induktionskammer, die mit einem Gemisch aus 5 % Isofluran und 100 % Sauerstoff gefüllt ist.
- Rasieren Sie den Brustkorb der Maus.
- Legen Sie die Maus auf den Rücken auf die Heizmatte (Temperatur 37 °C) und legen Sie die Schnauze in die Lüftungsmaske.
- Mit einem Gemisch aus 1,5 % bis 2,5 % Isofluran und 100 % Sauerstoff (0,15 l/min) und Raumluft (0,3 l/min) belüften.
- Überprüfen Sie die Tiefe der Anästhesie, indem Sie eine Zehenkneifung durchführen und die Anästhesie entsprechend anpassen.
- Verhindern Sie eine Austrocknung des Auges durch die Verwendung von Augensalbe.
- Bestimmung des PAB-Gradienten durch Echokardiographie
- Kleben Sie pädiatrische Elektrokardiogramm-Aufkleber auf jedes Vorderbein und einen auf beide Hinterbeine. Verwenden Sie die Aufkleber, um das Tier zu halten.
- Tragen Sie Ultraschallgel auf den rasierten Teil des Brustkorbs der Maus auf.
- Um die Bilder der Lungenarterie zu erhalten, können zwei Ansichten verwendet werden: die parasternale Längsachse (PLAX) oder die parasternale Kurzachse (PSAX). Erhalten Sie beides und verwenden Sie die Ansicht, die die beste Messqualität und die höchsten Geschwindigkeiten für die Analyse bietet.
- Abrufen von PLAX- und PSAX-Ansichten.
- Drücken Sie die Farbdoppler-Taste , um den Blutfluss zu visualisieren.
- Platzieren Sie die Ultraschallsonde in einem Winkel von 30° zur parasternalen Linie, um PLAX zu erhalten (für eine detaillierte Beschreibung siehe Cheng, et al.48), und visualisieren Sie die aufsteigende Aorta.
- Streichen Sie die Sonde minimal nach links, so dass die aufsteigende Aorta hinter der Lungenarterie verschwindet. Der geeignete PLAX wird identifiziert, wenn die Lungenarterie sichtbar gemacht wird, wobei das Blut vertikal fließt.
- Platzieren Sie den Cursor in einer Linie mit der Lungenarterie. Drücken Sie die Doppler-Taste (CW), um Geschwindigkeits-Zeit-Integralmessungen während drei Herzzyklen abzuleiten. Drücken Sie Speichern.
- Drehen Sie die Sonde um 90° im Uhrzeigersinn vom PLAX aus, um den PSAX zu erhalten, und neigen Sie die Sonde dann leicht in kraniale/ventrale Richtung, um den PSAX auf Höhe der Aorta abzuleiten. Die entsprechende PSAX-Ansicht wird identifiziert, wenn sich der RV-Abflusstrakt zwischen der Aorta und der Sonde befindet. Dies setzt sich in der Lungenarterie fort, wobei das Blut vertikal fließt. Für eine detaillierte Beschreibung siehe Cheng et al.48
- Platzieren Sie den Cursor in einer Linie mit der Lungenarterie. Drücken Sie die Doppler-Taste (CW), um Geschwindigkeits-Zeit-Integralmessungen während drei Herzzyklen abzuleiten. Drücken Sie Speichern.
- Messen Sie die drei maximalen Geschwindigkeiten der besten Ansicht (PSAX oder PLAX) und berechnen Sie den Mittelwert. Verwenden Sie das vereinfachte Bernoulli-Prinzip, um den PAB-Gradienten in Millimeter Quecksilbersäule (mmHg) abzuleiten.
4. Herzliche Magnetresonanztomographie
- Präparat
- Führen Sie die CMR-Analyse 6 Wochen (d. h. 42 Tage) nach der PAB-Operation durch.
HINWEIS: Darüber hinaus können je nach Forschungsfrage frühere Zeitpunkte nach der PAB-Operation gewählt werden, wenn mehrere Zeitpunkte einbezogen werden sollen. Spätere Zeitpunkte könnten in Betracht gezogen werden; Es kann jedoch zunehmend zu einem Ausfall und Tod des Wohnmobils kommen. - Verwenden Sie einen ausreichend starken Magneten (in der Regel wird >7 T für CMR-Scans von Nagetieren verwendet). Für das aktuelle Protokoll wird ein 9,4 T Vertikalsystem mit einem Gradientensatz von 1.500 mT/m und einer Bohrungsgröße von 89 mm verwendet.
- Installieren Sie die CMR-Nachbearbeitungssoftware zur Analyse von Volumina und Massen in den abgeleiteten Bildern. Die Software wird als geeignet erachtet, wenn sie eine manuelle Segmentierung zur Bestimmung des enddiastolischen (ED) und endsystolischen (ES) Volumens (EDV bzw. ESV) und der ventrikulären Masse (gemessen sowohl ED als auch ES) ermöglicht.
- Führen Sie die CMR-Analyse 6 Wochen (d. h. 42 Tage) nach der PAB-Operation durch.
- Anästhesie und Fixierung
- Legen Sie die Maus in die Induktionskammer, die mit einem Gemisch aus 5 % Isofluran und 100 % Sauerstoff gefüllt ist. Überprüfen Sie die Wirkung der Anästhesie, indem Sie einen Schmerzreiz durch ein Zehenkneifen geben.
- Tragen Sie Augensalbe auf die Augen der Maus auf, um sie während des Scannens feucht zu halten.
- Platzieren Sie die Maus in einem Tierbett des Scanners mit integrierter Luftzufuhr, einem erwärmten (37 °C) Gemisch aus 1,5 % bis 2,5 % Isofluran, 100 % Sauerstoff (0,15 l/min) und Raumluft (0,3 l/min) sowie einem Druckpolster, das die Beobachtung der Herzfrequenz (angestrebt 400–500 Schläge pro Minute) und der Atemfrequenz (angestrebt ~35 Atemzüge pro Minute) während des Scannens ermöglicht. Regulieren Sie die Anästhesie basierend auf diesen beiden Parametern. Stellen Sie sicher, dass das Bett aus Kunststoff und ohne magnetisches Material besteht.
- Setzen Sie das Tierbett mit der Maus in den Scanner ein.
- Durchführung der kardialen Magnetresonanztomographie
- Nehmen Sie Anpassungen vor der Erfassung vor, indem Sie die Hochfrequenz-Vogelkäfigspule auf 1 Wasserstoff (1 H) Resonanzfrequenz einstellen.
- Stellen Sie dann das Magnetfeld mit dem automatischen Shimming-Verfahren so homogen wie möglich ein.
HINWEIS: Das computergestützte Shimming erfolgt nach der sogenannten Tuning-Methode, bei der die Fläche unter dem 1 H FID als Qualitätsparameter verwendet wird. In dieser Tuning-Prozedur wird eine benutzerdefinierte Gruppe von Shims (Z, Z2, X, Y, XZ und YZ) in einem iterativen Zyklus untersucht. Jede Unterlegscheibe wird nacheinander individuell angepasst, um die Fläche unter dem FID zu maximieren. Dies ist im Wesentlichen ein lineares Verfahren, das schnell gut funktioniert. - Optimieren Sie den HF-Impuls durch Maximierung des eindimensionalen Bildprofils durch Anpassung der HF-Impulsleistung.
- Weisen Sie die genaue Position des Herzens im Scanner zu, indem Sie Scout-Scans mit einer Tripilot-Sequenz durchführen. Verwenden Sie eine schnelle Gradienten-Echosequenz, um die Scout-Bilder durch den Thorax aufzunehmen: einen transversalen, einen koronalen und einen sagittalen Schnitt. (Abbildung 1A,B,C)
- Passen Sie die Achsen an die tatsächlichen Achsen der Axial-, Zweikammer- und Vierkammeransicht an (Abbildung 1D,E).
- Positionieren Sie anschließend die Cine-Scheiben senkrecht zu einer imaginären Achse zwischen dem RV-Abflusstrakt und dem äußersten apikalen Teil des RV.
- Leiten Sie zehn bis elf 1 mm dicke Cine-Schichten ohne Schichtspalt ab, um die gesamte Top-to-Base-Bildgebung des RV abzudecken (Abbildung 1F) mit Hilfe der Self-gated IntraGate-Fast Low-Angle Shot (FLASH)-Methode, die ein Elektrokardiogramm (EKG) und ein Respiratory Gating überflüssig macht. Die Erfassungsparameter sind in Tabelle 1 dargestellt. Speichern Sie die Bilder im DICOM-Format.
- Durchführen von Analysen der aufgenommenen Bilder
- Doppelklicken Sie auf die Software, um das Programm zu öffnen.
- Öffnen Sie Bilder in der CMR-Nachbearbeitungssoftware, indem Sie auf die Schaltfläche "Importieren" klicken.
- Identifizieren Sie die endsystolische Phase (definiert als die Phase mit der visuell kleinsten RV-Kavität) und die enddiastolische Phase (definiert als die Phase mit der visuell größten RV-Kavität).
- Gemäß den Richtlinien der Society for Cardiovascular Magnetic Resonance49 zeichnen Sie die Epikardkonturen manuell in der Enddiastole und der Endsystole von der Spitze bis zur Basis, indem Sie mehrere Punkte am Epikardrand jedes Bildes markieren. Doppelklicken Sie an der letzten Stelle, um die Epikardkontur zu vervollständigen.
- Machen Sie dasselbe für die endokardialen Konturen. (Abbildung 2). Die linksventrikuläre und rechtsventrikuläre EDV-, ESV-, ED-Masse und ES-Masse werden jetzt automatisch von der Software berechnet.
HINWEIS: Die Masse ist definiert als Myokardvolumen mal Myokarddichte (d. h. 1,05). - Abhängig von der Forschungsfrage und der untersuchten Population indizieren Sie diese Variablen für die Probandengröße anhand der Tibialänge oder des Körpergewichts gemäß den zuvor veröffentlichten Formeln50.
- Berechnen Sie den Exzentrizitätsindex (EI) sowohl in der Enddiastole als auch in der Endsystole, indem Sie den Durchmesser der LV-Kavität parallel zum intraventrikulären Septum (IVS) durch den Durchmesser der LV-Kavität senkrecht zum IVS dividieren, abgeleitet von der kurzen Achse auf mittlerer papillärer Ebene.
- Die Software berechnet das Schlagvolumen (SV) in mL als
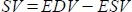 und die Ejektionsfraktion (EF, %) als
und die Ejektionsfraktion (EF, %) als 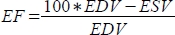 .
. - Berechnen Sie das Herzzeitvolumen (CO) in ml/min als
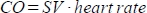 . Die Herzfrequenz wird wie oben beschrieben manuell durch das in das Tierbett eingelassene Druckkissen gemessen, da der Scanner nicht in der Lage ist, die hochfrequente Herzfrequenz ausreichend zu registrieren.
. Die Herzfrequenz wird wie oben beschrieben manuell durch das in das Tierbett eingelassene Druckkissen gemessen, da der Scanner nicht in der Lage ist, die hochfrequente Herzfrequenz ausreichend zu registrieren. - Abhängig von der Forschungsfrage und der untersuchten Population wird das CO und SV für die Probandengröße anhand der Tibialänge oder des Körpergewichts nach zuvor veröffentlichten Formelnindiziert 50.
5. Statistische Analysen
- Öffnen Sie die Software, die für die Datenvisualisierung und statistische Analysen verwendet wird.
- Sortieren Sie die Daten pro Gruppe (PAB und Sham), wobei jede Gruppe in einer separaten Spalte steht.
- Verwenden Sie den Mann-Whitney-Test, um PAB und Schein für jede Variable zu vergleichen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die Sterblichkeitsrate des PAB-Operationsverfahrens liegt bei etwa 10%. Die vorgestellten Ergebnisse zeigen Merkmale von Mäusen in den Gruppen sham (n = 5) und PAB (n = 8). Wie in Abbildung 3 gezeigt, stiegen die PAB-Gradientenwerte im Vergleich zu Scheintieren 2 und 6 Wochen nach der PAB signifikant an. Diese Zunahme der Belastung verursachte eine RV-Dilatation, die sich in erhöhter RV, EDV und RV ESV ausdrückte (Abbildung 4A,B
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieses Protokoll bietet eine reproduzierbare Methode für PAB bei Mäusen und die anschließende Beurteilung des kardialen Umbaus und der funktionellen Anpassung mittels CMR.
PAB unterscheidet sich von anderen Modellen mit erhöhter RV-Druckbelastung dadurch, dass es sich um eine absolute und statische Erhöhung der Nachlast ohne das Vorhandensein anderer Auslöser handelt. Die RV-Druckbelastung in Modellen von Hypoxie, Monocrotalin, Shunt oder einer Kombinati...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Das Universitätsklinikum Groningen hat mit Actelion und Lilly einen Vertrag über die Beratungstätigkeit von R.M.F. Berger außerhalb des Inhalts dieses Manuskripts abgeschlossen. Die anderen Autoren erklären, dass sie keine konkurrierenden Interessen haben.
Danksagungen
Wir danken P. Da Costa-Martins für ihre Unterstützung bei den Tierversuchen in dieser Studie.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
Referenzen
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065(2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119(2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6(2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041(2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten