Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrofluidische Produktion von Lysolipid-haltigen temperaturempfindlichen Liposomen
In diesem Artikel
Zusammenfassung
Das Protokoll stellt die optimierten Parameter für die Herstellung thermoempfindlicher Liposomen mit dem gestaffelten Fischgrät-Mikrofluidikgerät vor. Dies ermöglicht auch die Kokapselung von Doxorubicin und Indocyaningrün in die Liposomen und die photothermal ausgelöste Freisetzung von Doxorubicin zur kontrollierten/ausgelösten Wirkstofffreisetzung.
Zusammenfassung
Das vorgestellte Protokoll ermöglicht eine kontinuierliche Hochdurchsatz-Vorbereitung von niedrigtemperaturempfindlichen Liposomen (LTSLs), die in der Lage sind, Chemotherapeutika wie Doxorubicin (DOX) zu laden. Dazu werden ein Ethanol-Lipid-Gemisch und eine Ammoniumsulfatlösung in einen gestaffelten Fischgrät-Mikromixer (SHM) injiziert. Die Lösungen werden schnell vom SHM gemischt und bieten eine homogene Lösungsmittelumgebung für die Liposomen-Selbstmontage. Gesammelte Liposomen werden zuerst geglüht, dann dialysiert, um Restethanol zu entfernen. Durch Pufferaustausch der externen Lösung wird durch Verwendung der Größenausschlusschromatographie ein Ammoniumsulfat-pH-Gradient hergestellt. DOX wird dann mit hoher Verkapselungseffizienz (> 80%) aus der Ferne in die Liposomen geladen. Die erhaltenen Liposomen sind homogen in der Größe mit einem Z-Durchschnittsdurchmesser von 100 nm. Sie sind in der Lage, bei leichter Hyperthermie (42 °C) eine temperaturgesteuerte Burstfreisetzung von gekapseltem DOX zu erreichen. Indocyaningrün (ICG) kann auch in die Liposomen für die nahinfrarote Laser-trigger DOX-Freisetzung mitgeladen werden. Der mikrofluidische Ansatz gewährleistet eine hohe Durchsatz-, reproduzierbare und skalierbare Aufbereitung von LTSLs.
Einleitung
Die LTSL-Formulierung ist ein klinisch relevantes liposomales Produkt, das zur Abgabe des Chemotherapeutikums Doxorubicin (DOX) entwickelt wurde und eine effiziente Freisetzung von Burst-Medikamenten bei klinisch erreichbarer leichter Hyperthermie (T bei 41 °C)ermöglicht 1. Die LTSL-Formulierung besteht aus 1,2-Dipalmitoyl-sn-Glycero-3-Phosphocholin (DPPC), dem Lysolipid 1-Stearoyl-2-hydroxy-sn-glycero-3-phosphatidylcholin (MSPC; M steht für "mono") und PEGylated lipid 1,2-distearoyl-sn-glycero-3-phosphoethanolamin-N-[methoxy(polyethylenglykol)-2000] (DSPE-PEG2000). Nach Erreichen der Phasenübergangstemperatur (Tm bei 41 °C) erleichtern Lysolipid und DSPE-PEG2000 zusammen die Bildung von Membranporen, was zu einer Burstfreisetzung des Medikaments2führt. Bei der Herstellung von LTSLs wird in erster Linie ein Bulk-Top-Down-Ansatz verwendet, nämlich Lipidfilmhydratation und Extrusion. Es bleibt schwierig, große Chargen mit identischen Eigenschaften und in ausreichenden Mengen für klinische Anwendungen zu reproduzierbar vorzubereiten3.
Mikrofluidik ist eine neue Technik zur Herstellung von Liposomen und bietet abstimmbare Nanopartikelgröße, Reproduzierbarkeit und Skalierbarkeit3. Sobald die Fertigungsparameter optimiert sind, kann der Durchsatz durch Parallelisierung skaliert werden, mit Eigenschaften, die mit denen identisch sind, die auf der Tischskala3,4,5vorbereitet werden. Ein großer Vorteil der Mikrofluidik gegenüber herkömmlichen Schüttgütertechniken ist die Fähigkeit, kleine Flüssigkeitsvolumina mit hoher Beherrschung in Raum und Zeit durch Miniaturisierung zu handhaben, was eine schnellere Optimierung ermöglicht, während sie kontinuierlich und automatisiert arbeitet6. Die Herstellung von Liposomen mit mikrofluidischen Geräten wird durch einen Bottom-up-Nanopräzipitierungsansatz erreicht, der zeit- und energieeffizienter ist, da Homogenisierungsprozesse wie Extrusion und Beschallung unnötig sind7. Typischerweise wird eine organische Lösung (z. B. Ethanol) von Lipiden (und hydrophoben Nutzlast) mit einem mischbaren Nichtlösungsmittel (z. B. Wasser und hydrophile Nutzlast) vermischt. Da sich das organische Lösungsmittel mit dem Nichtlösungsmittel vermischt, wird die Löslichkeit für die Lipide reduziert. Die Lipidkonzentration erreicht schließlich eine kritische Konzentration, bei der der Fällungsprozess ausgelöst wird7. Nanopräzipitate von Lipiden wachsen schließlich in der Größe und nähern sich in einem Liposom. Die wichtigsten Faktoren für die Größe und Homogenität der Liposomen sind das Verhältnis zwischen nicht-solvent und lösungsmittel (d. h. wässrig-organisches Durchflussverhältnis; FRR) und die Homogenität der Lösungsmittelumgebung bei der Selbstmontage von Lipiden in Liposomen8.
Effizientes Flüssigkeitsmischen in der Mikrofluidik ist daher für die Herstellung homogener Liposomen unerlässlich, und verschiedene Ausführungen von Mischern wurden in verschiedenen Anwendungen eingesetzt9. Staggered Heringbone Micromixer (SHM) stellt eine der neuen Generationen von passiven Mischern dar, die einen hohen Durchsatz (im Bereich von mL/min) mit einem niedrigen Verdünnungsfaktor ermöglicht. Dies ist den herkömmlichen mikrofluidischen hydrodynamischen Mischvorrichtungen8,10überlegen. Die SHM hat gemusterte Fischgrätrillen, die Flüssigkeiten durch chaotische Advektion schnell mischen9,11. Die kurze Mischzeitskala von SHM (< 5 ms, kleiner als die typische Aggregationszeitskala von 10–100 ms) ermöglicht die Lipidselbstmontage in einer homogenen Lösungsmittelumgebung und erzeugt Nanopartikel mit gleichmäßiger Größenverteilung3,12.
Die Herstellung von LTSLs mit Mikrofluidik ist jedoch nicht so einfach im Vergleich zu herkömmlichen liposomalen Formulierungen aufgrund des Mangels an Cholesterin8, ohne die Lipid-Doppelschichten anfällig für Ethanol-induzierte Interdigitation13,14,15sind. Bisher ist die Wirkung von Restethanol während der mikrofluidischen Produktion von Liposomen nicht gut verstanden worden. Die meisten der gemeldeten Formulierungen sind von Natur aus resistent gegen Interdigitation (mit Cholesterin oder ungesättigten Lipiden)16 ,die im Gegensatz zu LTSLs sowohl gesättigt als auch cholesterinfrei sind.
Das hier vorgestellte Protokoll verwendet SHM, um LTSLs für die Lieferung von Temperatur-Trigger-Freisetzungsmedikamenten vorzubereiten. In der vorgestellten Methode haben wir sichergestellt, dass die mikrofluidisch hergestellten LTSLs nanogroß (100 nm) und gleichmäßig (Dispersity < 0.2) durch dynamische Lichtstreuung (DLS) sind. Darüber hinaus haben wir DOX mit der Transmembran-Ammoniumsulfat-Gradientenmethode (auch als Fernbelastung bezeichnet)17 als Validierung der Integrität der LTSL Lipid-Bilayer gekapselt. Die Fernbelastung von DOX erfordert das Liposom, um einen pH-Gradienten beizubehalten, um eine hohe Verkapselungseffizienz (EE) zu erreichen, was ohne eine intakte Lipid-Bilayer unwahrscheinlich ist. Bei dieser vorgestellten Methode, die sich von typischen mikrofluidischen Liposomenpräparationsprotokollen unterscheidet, ist ein Glühschritt erforderlich, bevor das Ethanol entfernt wird, um die Remote-Ladefähigkeit zu ermöglichen; d.h. die Integrität der Lipid-Bilayer wiederherzustellen.
Wie bereits erwähnt, können hydrophile und hydrophobe Nutzlasten auch in die ersten Lösungen für die gleichzeitige Verkapselung von Nutzlasten während der Bildung von LTSLs eingeführt werden. Als Proof-of-Concept wird Indocyaningrün (ICG), ein von der FDA zugelassener Nahinfrarot-Fluoreszenzfarbstoff, der auch ein vielversprechendes photothermisches Mittel ist, in das ursprüngliche Lipidgemisch eingeführt und erfolgreich in die LTSLs eingeladen. Ein 808 nm Laser wird verwendet, um die DOX/ICG-geladenen LTSLs zu bestrahlen und innerhalb von 5 min erfolgreich photothermische, heizausgelöste Burst-Freisetzung von DOX zu induzieren.
Alle Instrumente und Materialien sind im Handel erhältlich, gebrauchsfertig und ohne Anpassungsbedarf. Da alle Parameter für die Formulierung von LTSLs optimiert wurden, konnten Forscher ohne Vorkenntnisse in der Mikrofluidik auch die LTSLs vorbereiten, die als Grundlage für ein thermosensitives Arzneimittelabgabesystem dienen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Ausrüstungsaufbau
- Montieren Sie die Spritzenpumpen und SHM wie folgt.
- Schließen Sie den "To Computer"-Anschluss der sekundären Spritzenpumpe (Pumpe 02, für wässrige Lösung) mit dem Netzwerkkabel "An Netzwerk" der Master-Spritzenpumpe (Pumpe 01, für Ethanol-Lipid-Lösung) mit dem Netzwerkkabel Pumpe zu Pumpeanden Anschluss "To Network"an.
- Schließen Sie den "An Computer"-Anschluss der Masterpumpe an den "RS232 Serial"-Anschluss des Computers mit dem PC-to-Pump-Netzwerkkabel an (Abbildung 1, blau).
- Verbinden Sie Schläuche mit jedem der Ein- und Auslässe des SHM mit einer Mutter und Ferrule. Konvertieren Sie die Klemme des Schlauches für beide Einlässe in weibliche Luer mit einer anderen Mutter und Ferrule und einer Union-Montage. Längere Schläuche der Einlässe ermöglichen eine einfachere Befestigung an den Spritzen (Abbildung 2).
- Richten Sie die Pumpensteuerungssoftware ein.
- Weisen Sie die Adresse der Hauptspritzenpumpe und der Sekundärspritzenpumpe "Ad:01" bzw. "Ad:02" mit der Taste "Setup" der Spritzenpumpe zu. Dies muss nur zum ersten Mal geschehen.
- Öffnen Sie die Pumpensteuerungssoftware am Computer. Die beiden Spritzenpumpen sollten automatisch erkannt werden, gefolgt von einem Piepton. Andernfalls klicken Sie auf Pumpen und Suchen nach Pumpen, um die Verbindung zu aktualisieren. (Abbildung 3).
- Weisen Sie den Durchmesser 12,45 (mm) zu, indem Sie "HSW Norm-Ject 5 cc (Dia=12.45)" wählen.
- Zuweisen von 0,25 ml/min für Pumpe 01 (Ethanol-Lipidlösung) und 0,75 ml/min für Pumpe 02 (wässrige Lösung). Die Durchflussraten entsprechen einer Gesamtdurchflussrate (TFR) von 1 ml/min und einem wässrigen Ethanol-Durchflussverhältnis (FRR) von 3.
- Weisen Sie Volumen allen Werten über 5 ml zu.
HINWEIS: Das angestrebte Infusionsvolumen ist unter Berücksichtigung des Hohlraumvolumens der Schläuche größer als das geladene Flüssigkeitsvolumen eingestellt. - Wählen Sie den INF-Modus (Infusion) für beide Pumpen.
- Drücken Sie Set, um die Einstellungen zu bestätigen.
2. Bereiten Sie die LTSLs vor
- Vorbereiten eines LTSL10- oder LTSL10-ICG-Lipidgemisches (siehe Tabelle 1).
- 1 ml Lipidmischung und mindestens 3 ml (NH4)2SO4 Lösung mit zwei 5 ml Luer-Sperrspritzen zurückziehen.
- Installieren Sie die beiden Spritzen auf die Spritzenpumpen in aufrechter Position, indem Sie den Fassflansch der Spritze auf den Spritzenhalter der Pumpe und den Kolbenflansch der Spritze auf den Schubblock der Pumpe schieben (Abbildung 4).
- Wickeln Sie das Ende des Heizbandes mit der wässrigen Lösung in die Spritze. Wickeln Sie das andere Ende des Heizbandes und der Temperatursonde des Thermostats um die Spritze mit der Lipidlösung. Es ist hilfreich, diesen Schritt mit leeren Spritzen an Ort und Stelle zu üben, um den Montageprozess zu erleichtern (Abbildung 5A).
- Schließen Sie die beiden Spritzen an die weiblichen Luer-Adapter der entsprechenden Einlässe des SHM an. Stellen Sie sicher, dass die Spritzen, die das Lipidgemisch und (NH4)2SO4 Lösungen enthalten, Ethanol- bzw. wässrige Einlass enthalten. Passen Sie die Kolbenposition an, um Luftblasen von den Spritzen zu entfernen (Abbildung 5B).
HINWEIS: Stellen Sie sicher, dass die Spritzen noch sicher auf dem Spritzenhalter der Pumpen positioniert sind. - Erhitzen Sie die Spritzen mit einem Heizband mit einer 10 s-Heizsitzung auf über 51 °C. Lassen Sie den Thermostat die Temperatur der Spritzen aktualisieren. Wiederholen Sie diesen Schritt in den folgenden Schritten, um die Temperatur während der Infusion beizubehalten.
VORSICHT: Schalten Sie das Heizband nach 10 s aus, um Temperaturüberschreitungen zu verhindern und dem Thermostat zu ermöglichen, die tatsächliche Temperatur zu aktualisieren. Das Heizband sollte auch mit Vorsicht behandelt werden, da seine Temperatur sehr schnell ansteigt. Durch die kontinuierliche Erwärmung können die Geräte und Spritzen beschädigt werden, da der Thermostat die gemessene Temperatur aktualisiert. - Sobald die Temperatur über 51 °C liegt, führen Sie die Spritzenpumpen durch Drücken von Run All in der Pumpensteuerungssoftware aus (Abbildung 3).
- Stellen Sie sicher, dass der Flüssigkeitsfluss frei von Luftblasen und Leckagen ist. Entsorgen Sie das Anfangsvolumen (ca. 0,5 ml) Flüssigkeit aus dem Auslauf als Abfall.
HINWEIS: Dieses anfängliche Abfallvolumen ist nicht eindeutig und hängt vom internen Volumen des Setups ab, d. h. vom Volumen für Flüssigkeit, das von den Spritzen durch die Schläuche und SHM zum Auslass wandern soll. - Sammeln Sie den Rest der Flüssigkeit als Liposomenproben in ein Mikrozentrifugenrohr oder eine Bijou-Durchstechflasche.
- Halten/stoppen Sie die Infusion, wenn die Flüssigkeit in einer der Spritzen fast leer ist.
HINWEIS: Die Pumpen sollten manuell gestoppt werden, da die Pumpen die Position, wenn die Spritzen leer sind, möglicherweise nicht genau erkennen. - Die gesammelten Liposomenlösungen in ein 60 °C-Wasserbad für 1,5 h in Diene geben.
HINWEIS: Dieser Schritt ist wichtig, um die Beladung von Medikamenten in die Liposomen zu ermöglichen. - Übertragen Sie die Lösungen auf Dialyserohre. Dialyze die Lösungen gegen 1 L von 240 mM (NH4)2SO4 bei 37 °C für mindestens 4 h, um gereinigte Liposomen zu erhalten.
HINWEIS: Das Protokoll kann hier angehalten werden. Liposomen in diesem Schritt sind bei 5 mM Phospholipid. Gereinigte Liposomen können bei 4 °C gelagert werden. - Um den SHM für den wiederholten Gebrauch zu reinigen, spülen Sie den SHM sequenziell mit entionisiertem Wasser, Ethanol und trocknen Sie ihn mit Stickstoffgas.
3. Fernladen von DOX in LTSLs durch Transmembran-pH-Gradient
- Tauschen Sie den externen Puffer von LTSLs in HEPES-gepufferte Saline (HBS) aus, indem Sie die Größenausschlusschromatographie (SEC) verwenden, um einen pH-Gradienten für Transmembranen zu erstellen.
- Fügen Sie insgesamt 25 ml HBS am oberen Rand einer SEC-Spalte hinzu, um die Spalte vorzubereiten. Lassen Sie alle Eluenten durch die Säule zu löschen und entsorgen Sie das Eluat.
- 1 ml dialysierte Liposomen, die ab Schritt 2.12 zubereitet werden, in die Säule geben und die Elute entsorgen.
- Fügen Sie 1,5 ml HBS in die Spalte und entsorgen Sie die Elute.
- Fügen Sie der Spalte 3 ml HBS hinzu und sammeln Sie die 3 ml Elute.
HINWEIS: Das Protokoll kann hier angehalten werden. Liposomen werden bei diesem Schritt gesammelt und sind bei 1,67 mM Phospholipid. Pufferausgetauschte Liposomen können bei 4 °C gelagert werden.
- INkubieren Sie LTSLs mit Doxorubicin (DOX) und reinigen Sie LTSLs.
- Fügen Sie doX-Lösung in 1:20 DOX-zu-Phospholipid-Molar-Verhältnis in 1 ml puffergetortes Liposomenlösung (1,67 mmol) in einer Bijou-Durchstechflasche enthalten. Dies kann durch Zugabe von 48,4 l von 1 mg/ml DOX-Lösung (83,4 x mol) erreicht werden.
- Legen Sie die Bijou-Durchstechflasche 1,5 h in ein 37 °C-Wasserbad, damit DOX in die Liposomen geladen werden kann.
- Mischen Sie 10 l der Liposomen mit 170 l HBS und 20 l von 1% (v/v) Triton X-100 Lösung in einer schwarzen 96-Well-Platte. Wiederholen Sie dies für drei Bohrungen. Diese Brunnen entsprechen dem DOX-Gehalt "vor der Reinigung".
- Bei der Herstellung von LTSL10-ICG 40 l der Liposomen mit 160 l DMSO in einer klaren 96-Well-Platte mischen. Wiederholen Sie dies für drei Bohrungen. Diese Brunnen entsprechen dem ICG-Gehalt "vor der Reinigung".
- Reinigen Sie die Liposomenlösung, wie in Schritt 3.1 beschrieben.
ANMERKUNG: Um die Säule für die zukünftige Reinigung wiederzuverwenden, reinigen Sie die Säule von kostenlosem DOX, indem Sie zuerst 1 ml verdünnte 0,5 M NaOH-Lösung hinzufügen, bevor Sie Schritt 3.1.1 ausführen. Free DOX in rot wird violett-blau und elute durch die Säule schnell. - Mischen Sie 30 l der gereinigten Liposomenlösung mit 150 l HBS und 20 l von 1% (v/v) Triton X-100 Lösung in einer schwarzen 96-Well-Platte. Wiederholen Sie dies für drei Bohrungen. Diese Brunnen entsprechen dem DOX-Gehalt "nach der Reinigung".
- Mischen Sie bei LTSL10-ICG 40 l der gereinigten Liposomenlösung mit 160 l DMSO in einer klaren 96-Well-Platte. Wiederholen Sie dies für drei Bohrungen. Diese Brunnen entsprechen dem ICG-Gehalt "nach der Reinigung".
- Messen Sie die DOX-Fluoreszenzintensität der Brunnen vor (Schritt 3.2.3) und nach (Schritt 3.2.5) Reinigung mit hilfe eines Mikroplattenlesers (z.B. = 485 nm, -em = 590 nm).
- Berechnen Sie die Verkapselungseffizienz von DOX (DOX EE), indem Sie das Verhältnis der Fluoreszenzintensitäten vor und nach der Reinigung nehmen.
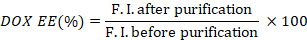
- Messen Sie die ICG-Absorption der Brunnen vor und nach der Reinigung mit einem Mikroplattenleser (600 bis 1000 nm).
- Berechnen Sie die Verkapselungseffizienz von ICG (ICG EE), indem Sie das Verhältnis der Absorption bei 792 nm vor und nach der Reinigung unter Berücksichtigung des Verdünnungsfaktors (3-mal) während der Reinigung berücksichtigen.

4. Dynamische Lichtstreuung (DLS)
- Fügen Sie die Liposomenlösung (Schritt 2,12) 50 l auf 450 l entionisiertes Wasser hinzu.
- Legen Sie die Küvette in das DLS-Instrument und führen Sie die Messung gemäß den Anweisungen des Herstellers durch.
- Zeichnen Sie den mittleren Z-Durchschnittsdurchmesser und die Dispergität von drei Messungen für jede Probe auf.
5. Differential-Scanning-Kalorimetrie (DSC)
- Konzentrat 1 ml der Liposomenproben (Schritt 2.12) mit einer Zentrifugalfiltereinheit auf 0,5 ml (endgültige Lipidkonzentration von 10 mM). Drehen Sie mit einem Festwinkelrotor ca. 15 min bei 7500 x g.
- Übertragen Sie 20 l (NH4)2SO4 Lösungs- und Liposomenproben auf zwei entsprechende DSC-Pfannen. Versiegeln Sie die Pfannen mit DSC-Hermetikdeckeln mit dem DSC-Probenpresskit.
- Messen Sie die Probe von 30 °C bis 60 °C bei einer Heizrate von 1 °C/min mit einem Differential-Scanning-Kalorimeter.
- Analysieren Sie die Daten mit entsprechender Software. Nehmen wir die Phasenübergangstemperatur (Tm) als Beginn des Phasenübergangs (Schmelzspitze), der durch den x-Abfang der Tangente des Punkts der maximalen Steigung gemessen wird.
6. Doxorubicin-Freisetzung
- HBS bei einer bestimmten Temperatur (37 oder 42 °C) mit einem Wasserbad vorheizen. Bereiten Sie ein Eiswasserbad zum Abschrecken der Proben vor.
- Fügen Sie 100 l gereinigte DOX-belastete Liposomen (Schritt 3.2.5) in 1,9 ml HBS in einem Mikrozentrifugenrohr hinzu. Legen Sie das Rohr in das Wasserbad der angegebenen Temperatur.
- Ziehen Sie sofort 200 l Proben aus der Röhre ab und legen Sie sie schnell in das Eiswasserbad, um jede nachfolgende Wirkstofffreisetzung zu löschen. Diese Stichprobe entspricht dem Anfangszeitpunkt (t = 0).
- Ziehen Sie 200 l Proben zu den nachfolgenden Zeitpunkten (t = 5, 10, 15, 30, 60 min) ab und legen Sie sie schnell in das Eiswasserbad, um jede Wirkstofffreisetzung zu löschen.
- Mischen Sie 50 l der Probe von jedem Zeitpunkt mit 150 l HBS in einer schwarzen 96-Well-Platte. Messen Sie die DOX-Fluoreszenzintensität mit einem Plattenleser.
- Fügen Sie 20 L von 1% (v/v) Triton X-100 in zufällig ausgewählte Brunnen, die in Schritt 6.5 vorbereitet werden. Messen Sie die DOX-Fluoreszenzintensität dieser Brunnen mit einem Plattenleser. Diese Werte entsprechen dem vollständig freigegebenen (t = 100 % Release) Zeitpunkt.
- Berechnen und zeichnen Sie den Prozentsatz von DOX, der durch Interpolation der Fluoreszenzintensität jedes Zeitpunktes (I(t)) im Vergleich zum ursprünglichen (I(0)) und vollständig freigegebenen Wert (I()) freigesetzt wird.
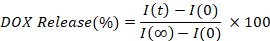
7. Laserheizung und ausgelöste Freisetzung
- Stellen Sie die Wasserbadtemperatur auf 37 °C ein und lassen Sie die Temperatur stabilisieren.
- Fügen Sie 200 L VON DOX geladenen LTSL10-ICG ([ICG] = 10 g/ml) zu einer klaren 96-Well-Platte hinzu, legen Sie sie dann in das Wasserbad, halten Sie den Boden in Wasser getaucht.
- Stellen Sie den Strom des Lasersystems auf 2,27 A ein. Stellen Sie den Kollimator des Lasersystems auf 5 cm vertikal über der Oberfläche der 96-Well-Platte, was einem Energiefluss von 0,5 W/cm2 entspricht [Abbildung 6].
VORSICHT: Das Lasersystem sollte in Übereinstimmung mit den einschlägigen Lasersicherheitsmaßnahmen betrieben werden. - Schalten Sie den Laser ein und überwachen Sie die Temperatur jede Minute mit einer Lichtwellenleiter-Temperatursonde.
- Bei 5 und 10 min 10 l laserbestrahlte Liposomen von der klaren 96-Well-Platte abziehen und mit 190 l HBS für drei Bohrungen in einer schwarzen 96-Well-Platte mischen.
- Mischen Sie 10 l der Liposomen mit 170 l HBS und 20 l von 1% (v/v) Triton X-100 Lösung für drei Bohrungen in einer schwarzen 96-Well-Platte. Diese Brunnen entsprechen den "100% veröffentlichten" DOX-Inhalten. Messen Sie die DOX-Fluoreszenzintensität und berechnen Sie die DOX-Freisetzung, wie in Schritt 6.7 beschrieben.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die Herstellung von LTSLs durch Mikrofluidik erfordert die Lipidzusammensetzung von DPPC/MSPC/DSPE-PEG2000 (80/10/10, Molverhältnis; LTSL10). Abbildung 7A (links) zeigt das Auftreten von hergestelltem LTSL10 ab Schritt 2.9 als klare und nicht-viskose Flüssigkeit. LtSL10-Formulierung wird aus der herkömmlichen Formulierung LTSL4 (DPPC/MSPC/DSPE-PEG2000, 86/10/4, Molar-Verhältnis) entwickelt, da LTSL4 eine gelartige vi...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das vorgestellte Protokoll beschreibt die Herstellung von niedrigtemperaturempfindlichen Liposomen (LTSLs) mit einem gestaffelten Fischgrät-Mikromixer (SHM). Die LTSL10-Formulierung ermöglicht eine temperaturgesteuerte Burstfreisetzung von Doxorubicin innerhalb von 5 Minuten bei einer klinisch erreichbaren hyperthermischen Temperatur von 42 °C. Indocyaningrün (ICG) kann auch für photothermische Erwärmung mitgeladen werden, ausgelöst die Freisetzung von DOX. Die Methode beruht auf: (i) Selbstmontage von Phospholipi...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Prostate Cancer UK (CDF-12-002 Fellowship) und dem Engineering and Physical Sciences Research Council (EPSRC) (EP/M008657/1) für die Finanzierung.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
Referenzen
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten