Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bestimmung der chemischen Inhibitor-Effizienz gegen intrazelluläre toxoplasma Gondii Wachstum mit einem Luziferase-basierten Wachstumstest
In diesem Artikel
Zusammenfassung
Präsentiert hier ist ein Protokoll zur Bewertung der Hemmungswirksamkeit chemischer Verbindungen gegen in vitro intrazelluläres Wachstum von Toxoplasma gondii mit einem luziferase-basierten Wachstumstest. Die Technik wird verwendet, um die Hemmungsssspezifität durch genetische Deletion des entsprechenden Zielgens zu bestätigen. Die Hemmung von LHVS gegen TgCPL-Protease wird als Beispiel bewertet.
Zusammenfassung
Toxoplasma gondii ist ein Protozoen-Erreger, der die menschliche Bevölkerung stark betrifft. Die aktuellen Antibiotika zur Behandlung der klinischen Toxoplasmose sind begrenzt. Darüber hinaus zeigen sie Nebenwirkungen in bestimmten Gruppen von Menschen. Daher ist die Entdeckung neuartiger Therapeutika für die klinische Toxoplasmose unerlässlich. Der erste Schritt der neuartigen Antibiotikaentwicklung besteht darin, chemische Verbindungen zu identifizieren, die eine hohe Wirksamkeit bei der Hemmung des Parasitenwachstums zeigen, indem eine Screening-Strategie mit hohem Durchsatz verwendet wird. Als obligate intrazellulärer Erreger kann sich Toxoplasma nur innerhalb von Wirtszellen replizieren, was die Verwendung optischer Absorptionsmessungen als schneller Wachstumsindikator verbietet. Hier wird ein detailliertes Protokoll für einen luziferase-basierten Wachstumstest vorgestellt. Als Beispiel wird diese Methode verwendet, um die Verdoppelungszeit von Toxoplasma-Parasiten des Typs Wildtyp zu berechnen und die Wirksamkeit von Morpholinurea-Leucyl-Homophenyl-Vinyl-Sulfonphenyl (LHVS, einer Cystein-Protease-targeting-Verbindung) in Bezug auf die Hemmung des intrazellulären Parasitenwachstums zu messen. Ebenfalls beschrieben ist ein CRISPR-Cas9-basiertes Gen-Löschprotokoll in Toxoplasma unter Verwendung von 50 bp homologen Regionen für homologieabhängige Rekombination (HDR). Durch die Quantifizierung der Hemmungswirksamkeiten von LHVS in Wildtyp und TgCPL (Toxoplasma cathepsin L-like protease)-defizienten Parasiten wird gezeigt, dass LHVS das Wildtyp-Parasitenwachstum effizienter hemmt als das Wachstum von Cpl, was darauf hindeutet, dass TgCPL ein Ziel ist, an das LHVS in Toxoplasmabindet. Die hohe Empfindlichkeit und einfache Operation dieses luziferase-basierten Wachstumstests machen es geeignet für die Überwachung der Toxoplasma-Proliferation und die Bewertung der Arzneimittelwirksamkeit in einer hohen Durchsatz-Weise.
Einleitung
Toxoplasma gondii ist ein sehr erfolgreicher obligate intrazellulärer Parasit, der etwa ein Drittel der menschlichen Bevölkerung infiziert. Seine hohe Übertragungsrate ist vor allem auf seine vielfältigen Übertragungswege zurückzuführen, einschließlich des Verzehrs von untergekochtem Fleisch, der Exposition gegenüber Säugetierreservoirs und der angeborenen Übertragung während der Geburt. T. gondii verursacht hauptsächlich opportunistische Infektionen, die zu schwerer Morbidität und Mortalität bei immungeschwächten Personen führen können1,2,3,4,5,6. Die Antibiotika, die derzeit zur Behandlung von akuter Toxoplasmose verwendet werden, sind besonders ineffizient bei der Behandlung angeborener und latenter Infektionen und verursachen bei einigen Personen schwere Reaktionen3,7,8. Daher besteht dringender Bedarf an der Identifizierung neuartiger Therapeutika. Das Verständnis der Unterschiede in subzellulären Prozessen innerhalb von Toxoplasma und seinem Wirt wird helfen, potenzielle Arzneimittelziele zu identifizieren. Daher sind effiziente und bequeme Genommanipulationstechniken erforderlich, um die Rolle einzelner Gene innerhalb von Toxoplasmazu untersuchen. Darüber hinaus gehört Toxoplasma zum Phylum Apicomplexa, das mehrere andere bedeutende menschliche Krankheitserreger umfasst, wie Plasmodium spp. und Cryptosporidium spp. Daher kann Toxoplasma als Modellorganismus verwendet werden, um grundlegende Biologie bei anderen apicomplexan Parasiten zu studieren.
Um neuartige Antibiotika gegen mikrobielle Krankheitserreger zu identifizieren, wird zunächst ein Hochdurchsatz-Screening einer Bibliothek chemischer Verbindungen durchgeführt, um ihre Wirksamkeit bei der Unterdrückung des mikrobiellen Wachstums zu bestimmen. Bisher wurden mehrere mikroplattenbasierte Wachstumstests zur Messung des intrazellulären Wachstums von T entwickelt. gondii (d.h. radioaktive 3H-Uracil-Inkorporations-basierte Quantifizierung9, quantitativeR ELISA-basierter Parasitennachweis mit T. gondii-spezifischen Antikörpern10,11, Reporter-Protein-basierte Messung mit den Toxoplasma-Stämmen 12,13und einem kürzlich entwickelten hochgehaltigen bildgebenden Assay14).
Diese individuellen Strategien haben alle einzigartige Vorteile; bestimmte Einschränkungen schränken jedoch auch ihre Anwendungen ein. Da sich Beispielsweise Toxoplasma nur innerhalb nukleierter Tierzellen replizieren kann, verursachen Autofluoreszenz und unspezifische Bindung von Anti-T.Gondii-Antikörpern an Wirtszellen Interferenzen in fluoreszenzbasierten Messungen. Darüber hinaus erfordert die Verwendung radioaktiver Isotope besondere Sicherheitsvorschriften und potenzielle Sicherheitsprobleme. Einige dieser Assays eignen sich eher für die Bewertung des Wachstums zu einem einzigen Zeitpunkt als für eine kontinuierliche Überwachung des Wachstums.
Hier wird ein auf Luziferase basierendes Protokoll zur Quantifizierung des intrazellulären Toxoplasmawachstums vorgestellt. In einer früheren Studie wurde das NanoLuc-Luziferase-Gen unter dem Toxoplasma-Tubulin-Promotor geklont, und dieses Luziferase-Expressionskonstrukt wurde in Wild-Typ-Parasiten (RH-ku80-hxg-Stamm) transfiziert,hxg um einen RH-Ku80-Hxg zu erzeugen ::NLuc-Stamm (bezeichnet alsku80RH-Ku80::NLuc im Folgenden)15. Toxoplasma ku80hxg Dieser Stamm diente als elterlicher Stamm für die intrazelluläre Wachstumsbestimmung und Genlöschung in dieser Studie. Mit demRH-Ku80::NLuc-Stamm, Parasitenwachstum in menschlichen Vorhaut-Fibroblasten (HFFs) wurde über einen Zeitraum von 96 h nach der Infektion überwacht, um Parasiten-Verdoppelungszeit zu berechnen.
Darüber hinaus kann die Hemmungswirksamkeit von LHVS gegen Parasitenwachstum bestimmt werden, indem Toxoplasma-Wachstumsraten gegen serielle LHVS-Konzentrationen aufgezäunt werden, um den IC50-Wert zu identifizieren. Frühere Literatur hat berichtet, dass TgCPL ist ein wichtiges Ziel von LHVS bei Parasiten und dass die Behandlung mit LHVS verringert die Entwicklung von akuten und chronischen Toxoplasma-Infektionen 16,17,18,19. Zusätzlich wurdeRH-ku80::NLuc als elterlicher Stamm zur Genommodifikation verwendet, um einen TgCPL-Mangelstammzu erzeugen (RH-ku80-cpl::NLuc), und die Hemmung von LHVS wurde gegen diese Mutante gemessen.ku80 Durch die Beobachtung einer Upshift von IC50-Werten für LHVS in den TgCPL-mangelhaftenParasiten im Vergleich zum WT-Stamm wurde bestätigt, dass TgCPL von LHVS in vivo ins Visier genommen wird.
In diesem Protokoll wirdRH-ku80::NLuc als elterlicher Stamm verwendet, dem ein effizienter nicht-homologe Endverbindungsweg (NHEJ) fehlt, wodurch eine Doppelüber-Homologie-abhängige Rekombination (HDR)20,21ermöglicht wird. Zusätzlich werden 50 bp homologe Regionen an beiden Enden einer Arzneimittelresistenzkassette durch PCR flankiert. Das PCR-Produkt dient als Reparaturvorlage, um den gesamten Gen-Locus über HDR mit CRISPR-Cas9-basierten Genom-Editing-Tools zu entfernen. Solche kurzen homologen Regionen können leicht in Primer integriert werden, was eine bequeme Strategie für die Herstellung der Reparaturschablone bietet. Dieses Protokoll kann geändert werden, um universelle Genlöschung und endogene Gen-Tagging durchzuführen.
In unserer jüngsten Veröffentlichung wurden beispielsweise drei Proteasegene, TgCPL, TgCPB (Toxoplasma cathepsin B-like protease) und TgSUB1 (Toxoplasma subtilisin-like protease 1) genetisch in TgCRT (Toxoplasma Chloroquine-Resistance Transporter) -mangelhafte Parasiten mit dieser Methodeabgeschwächt 15. Zusätzlich wurde TgAMN (ein vermeintliches Aminopeptidase N [TgAMN, TGGT1_221310]) endogen mit15markiert. Das Lourido-Labor berichtete auch unter Verwendung kurzer homologe Regionen im Bereich von 40-43 bp für die Einführung von standortgesteuerter Genmutation und endogener Gen-Tagging im Toxoplasma-Genom mit einer ähnlichen Methode22. Diese erfolgreichen Genommodifikationen deuten darauf hin, dass eine homologe Region von 40-50 bp für eine effiziente DNA-Rekombination im TgKU80-Mangelstammausreicht, was die Genommanipulation in Toxoplasma gondiierheblich vereinfacht.
Protokoll
Toxoplasma gondii ist in die Risikogruppe 2 eingeteilt und muss auf einer Biosicherheitsstufe 2 (BSL-2) behandelt werden. Das Protokoll wurde vom Institutional Biosafety Committee der Clemson University überprüft und genehmigt.
1. Luziferase-basierte Toxoplasma-Wachstumstest
- Samen menschlicher Vorhaut-Fibroblasten (HFFs) 1 Woche vor der Parasitenimpfung, um sicherzustellen, dass wirtszellen vollständig konfluent sind. Führen Sie einen Mock-Assay in einer transparenten Platte durch, um sicherzustellen, dass Parasiten während des gesamten Bewertungszeitraums intrazellulär bleiben.
HINWEIS: Hier wird der Test in 96 Brunnen-Mikroplatten durchgeführt. Je nach experimentellem Bedarf kann es bis zu 384 oder 1536 Well-Mikroplatten skaliert werden. - Übergeben Sie Toxoplasma-Parasiten 2 Tage vor der Verwendung in konfluente HFFs, indem Sie 0,3-0,4 ml voll lysierte Parasiten in einen T25-Kolben übertragen. Inkubieren Sie infizierte Wirtszellen bei 37 °C mit 5%CO2 für 2 Tage.
- Spritze 5 ml frisch lysierte Parasiten durch eine 21 G Sicherheitsnadel 5x, um intrazelluläre Parasiten zu befreien, dann durch einen 3 m Filter passieren, um Wirtszellablagerungen zu entfernen. Restparasiten mit 7 ml phenolrot-freiem D10-Medium aus dem Kolben spülen und dann wieder durch den Filter leiten.
- Zentrifugenparasiten bei 1000 x g für 10 min bei Raumtemperatur (RT). Gießen Sie den Überstand ab und setzen Sie das Pellet in 10 ml phenolrot-freier D10-Medien wieder auf.
- Zählen Sie Parasiten mit einem Hämozytometer, um die Konzentration zu bestimmen.
- Verdünnen Sie Parasiten auf 1 x 104 Parasiten/ml für den Wildtypstamm (WT). Bei wachstums-defizienten Parasitenstämmen, erhöhen Sie die Konzentration entsprechend, um eine signifikante Zunahme der Luziferase-Signale zu beobachten.
- Aspirieren Sie Medien sorgfältig aus 96 Well-Mikroplatten, die mit HFFs vorgesät sind, und impfen Sie 150 l Parasitenresuspension in Brunnen in einem Format von drei Spalten und fünf Reihen, was drei technische Replikationen und fünf Zeitpunkte darstellt.
- Inkubieren Sie die Mikroplatte bei 37 °C und 5%CO2 für 4 h.
- Aspirieren Sie Medien sorgfältig aus den Brunnen, um nicht eingedrungene Parasiten zu entfernen, dann füllen Sie die Brunnen mit RT Phenol rot-freie Medien in jeder Reihe (mit Ausnahme der ersten Reihe).
- Mischen Sie gleiche Volumina von PBS und 2x Luziferase-Assay-Puffer und verdünnen Sie das Luziferase-Substrat auf 12,5 M.
- Fügen Sie 100 l verdünntes Luziferasesubstrat in jeden Brunnen der oberen Reihe ein. Inkubieren Sie die Mikroplatten bei RT für 10 min, damit die Zellen vollständig lysieren können.
- Messen Sie die Luziferase-Aktivität mit einem Mikroplattenleser. Die Plattenlesereinstellungen sind in Tabelle 1aufgeführt. Jeder Messwert stellt die anfängliche Anzahl der eingedrungenen Parasiten bei 4 h nach der Infektion dar.
- Wiederholen Sie die Schritte 1.9-1.12 für jede Zeile alle 24 stunden für 4 Tage, ohne das Medium zu ändern. Diese Messwerte spiegeln die Gesamtzahl der replizierten Parasiten bei 24 h, 48 h, 72 h und 96 h nach der Infektion wider.
- Berechnen Sie die durchschnittlichen Messwerte zu jedem Zeitpunkt und dividieren Sie sie durch die durchschnittlichen Messwerte bei 4 h, um die Faltenveränderungen im Parasitenwachstum im Laufe der Zeit zu bestimmen.
- Zeichnen Sie die Daten mithilfe der Grafiksoftware. Eine repräsentative Wachstums-Lesetabelle und Diagramme vonRH-Ku80::NLuc Parasiten sind in Abbildung 1A,Bdargestellt.
- Um die Verdoppelungszeit zu berechnen, zeichnen Sie die log2-Werte der Falzänderungen zu den einzelnen Zeitpunkten über die Inkubationszeit. Verwenden Sie eine lineare Regressionsfunktion, um die Neigung zu berechnen, die die Verdoppelungszeit jedes Stammes darstellt (Abbildung 1A,C).
2. Bewertung der Wirksamkeit der chemischen Wirkstoffhemmung gegen Toxoplasma-Wachstum
HINWEIS: Hier wird die Bewertung der Hemmung von LHVS im Toxoplasma-Wachstum als Beispiel vorgestellt. Acht verschiedene Konzentrationen von LHVS werden getestet, und für jede der drei biologischen Replikationen werden drei technische Replikationen fürRH-ku80durchgeführt::NLuc undRH-ku80-cpl::NLuc-Stämme.
- Vor der Parasiteninfektion, Samen HFFs zu 96 gut Mikroplatten im Format von drei Reihen und neun Spalten für eine biologische Replikation pro Verbindung pro Stamm. Hostzellen dürfen vor der Verwendung mindestens 7 Tage lang wachsen.
- Pass RH-ku80::NLuc und RH-ku80cpl::NLuc Parasiten für 2 Tage vor der Verwendung. Befolgen Sie die Schritte 1.2-1.6 für die Parasitenreinigung und -quantifizierung. Parasiten in phenolrotfreien Medien bei 1 x 104 Parasiten/ml wieder aussetzen.
- Aspirieren Sie Medien von einer Platte, die konfluente HFFs enthält, und impfen Sie jeden Brunnen mit 150 l Parasitenresuspension. Inkubieren Sie die Mikroplatte bei 37 °C und 5%CO2 für 4 h.
- Bereiten Sie LHVS in acht verschiedenen Konzentrationen in einem 12 Brunnenreservoir durch serielle Verdünnung vor. Im Allgemeinen werden die Konzentrationen in serieller Verdünnungsweise um das Dreifache verringert.
HINWEIS: Die niedrigste Konzentration wird im Verhältnis zur höchsten Konzentration um das 6.561-fache reduziert. Die Faltenänderung der Verdünnung kann entsprechend an die unterschiedlichen Eigenschaften einzelner Verbindungen angepasst werden. - Bei 4 h nach der Infektion, Aspirat-Medien, um nicht eingedrungene Parasiten zu entfernen und füllen Sie jeden Brunnen aus Spalten 2-9 mit 150 L Medien mit LHVS in verschiedenen Konzentrationen ergänzt. Lassen Sie die erste Spalte mit regulärem Medium gefüllt, um als nicht behandeltes Steuerelement zu dienen.
- Inkubieren Sie die Mikroplatte bei 37 °C und 5%CO2 für weitere 96 h.
- Führen Sie die Schritte 1.9-1.11 aus und messen Sie die Luziferaseaktivität einzelner Brunnen.
- Durchschnittlich die luziferase Aktivitäten von drei technischen Replikationen aus Brunnen jeder einzelnen LHVS-Konzentration.
- Teilen Sie die durchschnittliche Luziferase-Aktivität für jede LHVS-Konzentration durch die durchschnittliche Luziferase-Aktivität, die von unbehandelten Parasiten abgeleitet wird, um die normalisierte Luziferase-Aktivität als Prozentsatz zu berechnen.
- Plotten Sie die normalisierten Luziferase-Aktivitäten gegen die einzelnen LHVS-Konzentrationen mit Graphik (Abbildung 2). Hemmung von Pyrimethamin gegen Parasitenwachstum wird auch als Kontrolle gemessen. Pyrimethamin ist ein klinisches Antibiotikum zur Behandlung der akuten Toxoplasmose durch Hemmung des Folsäurestoffwechsels in Toxoplasma.
- Berechnen Sie die IC50-Werte für einzelne Verbindungen mit der eingebetteten Methode in der Graphik, normalisiertes Ansprechen vs. [Hemmer], unter dem Regressionsprogramm "Dosis-Reaktion-Hemmung". Der IC50 wird nach folgender Formel berechnet:
Y = 100/(1 + X/IC50)
Wo: Y stellt normalisierte Luziferase-Aktivitäten infizierter Zellen unter verschiedenen Inhibitorkonzentrationen dar, und X stellt individuelle Konzentrationen von Inhibitoren dar.
3. CRISPR-Cas9-basierte Genlöschung bei Toxoplasma-Parasiten
- Erzeugung eines Plasmidkonstrukts, das Führungs-RNA (sgRNA) und Cas9 zum Löschen eines von Interesse sindden Gens exzessiert
- Gehen Sie zu www.ToxoDB.org und rufen Sie die gesamte Gencodierungssequenz, einschließlich Introns und Exons, zusammen mit 1,5 kb 5'-UTRs und 3'-UTRs (unübersetzte Regionen) ab.
HINWEIS: Hier wird TgCPL (TGGT1_321530) als repräsentatives Beispiel ins Visier genommen. - Kopieren Sie die abgerufene TgCPL-Sequenz in die Sequenzanalysesoftware (siehe Tabelle der Materialien für den Namen und die Version) und beschriften Sie die 5'- und 3'-UTR-Regionen.
- Wählen Sie das Symbol Extras in der oberen Menüleiste aus, und wählen Sie dann Klonen | Finden Sie CRISPR-Sites.
- Wählen Sie 3'(Cas9)' für den Standort der PAM-Site und wählen Sie den Ordner mit der Toxoplasma-Genomsequenz im Abschnitt Spezifitätsbewertung aus. Lassen Sie die restlichen Einstellungen als Standardeinstellungen.
- Wählen Sie eine sgRNA mit den folgenden beiden Kriterien: 1) zeigt eine hohe Spezifitätspunktzahl, in der Regel >98%, und 2) fehlt ein G nach der NGG, eine Protospacer benachbarte Motiv (PAM) Sequenz. Die ausgewählte sgRNA befindet sich in der Regel an Standorten in der Nähe des Start- und Stoppcodons des Gens von Interesse.
- Kopieren Sie die Sequenz der ausgewählten sgRNA und fügen Sie sie in die folgende Primervorlage ein.

Der rot-rote Teil stellt die ausgewählte TgCPL sgRNA-Sequenz dar. Es kann durch verschiedene sgRNAs für verschiedene Gene von Interesse ersetzt werden.
HINWEIS: Wenn die ausgewählte sgRNA nicht mit G beginnt, fügen Sie G am Anfang der sgRNA hinzu, um ihre Expression zu verbessern. - Führen Sie eine PCR-Reaktion durch, um das bereits vorhandene Plasmid, das sgRNA exsemitt,(Abbildung 3A) zu modifizieren, das auf Toxoplasma uracil phosphoribosyltransferase (TgUPRT) Gen23 abzielt, wobei ein PCR-Premix mit den in Tabelle 2angegebenen Einstellungen verwendet wird.
- Führen Sie das PCR-Produkt auf einem Agarose-Gel aus, um eine erfolgreiche Verstärkung zu bestätigen. Es wird erwartet, dass ein 10 kb PCR-Produkt verstärkt wird (Abbildung 3B).
- Extrahieren Sie das PCR-Produkt mit einem DNA-Gel-Extraktionskit und zirkulieren Sie es mit einem standortgesteuerten Mutagenese-Kit. Das Rezept finden Sie in Tabelle 3. Inkubieren Sie die Reaktion für 10-20 min bei RT.
- Verwandeln Sie das zirkulierte PCR-Produkt in E. coli und wählen Sie 10 Klone für die weitere Überprüfung der Einbindung von entwickelter sgRNA.
- Wachsen Sie zwei Klone und extrahieren Sie Plasmide. Schneiden Sie die gereinigten Plasmide mit BamHI und EcoRV. Die Kandidatenplasmide ergeben zwei Bänder bei 2,4 kb und 7,2 kb (Abbildung 3C).
- Senden Sie die Plasmide für die Sanger-Sequenzierung mit M13-Reverse-Primern, um den erfolgreichen Ersatz von TgUPRT sgRNA durch die entworfene sgRNA zu bestätigen (Abbildung 3D).
- Gehen Sie zu www.ToxoDB.org und rufen Sie die gesamte Gencodierungssequenz, einschließlich Introns und Exons, zusammen mit 1,5 kb 5'-UTRs und 3'-UTRs (unübersetzte Regionen) ab.
- Generierung einer Reparaturvorlage zur Genlöschung über HDR-Mechanismus
- Je nach den Targeting-Sites der ausgewählten sgRNA, lokalisieren Sie 50 bp von 5'-UTRs oder 3'-UTRs des Zielgens für eine homologieabhängige Rekombination (HDR, siehe Diskussionsabschnitt). Die Auswahl der Regionen folgt den unten aufgeführten Kriterien, abhängig von der Position, die die sgRNA-Ziele anvisieren.
- Wenn sich die Spaltungsstelle von Cas9 von Anfang an stromaufwärts befindet, wählen Sie Folgendes aus: eine 50 bp DNA-Sequenz vor der Spaltungsstelle als linke HDR-Region und eine 50 bp DNA-Sequenz flussabwärts vom Stop-Codon als rechte HDR-Region.
- Wenn sich die Spaltstelle von Cas9 zwischen den Start- und Stopp-Codons befindet, wählen Sie Folgendes aus: eine 50 bp DNA-Sequenz vor dem Startcodon als linke HDR-Region und eine 50 bp DNA-Sequenz flussabwärts vom Stop-Codon als rechte HDR-Region.
- Wenn sich die Spaltungsstelle von Cas9 flussabwärts vom Stop-Codon befindet, wählen Sie Folgendes aus: eine 50 bp-DNA-Sequenz vor dem Startcodon als linke HDR-Region und eine 50 bp-DNA-Sequenz flussabwärts von der Dekolleté-Stelle als rechte HDR-Region.
HINWEIS: Für das TgCPL-Gen befindet sich die Spaltstelle zwischen den Start- und Stopp-Codons. Daher sind die folgenden Primer für die Verstärkung der Reparaturvorlage mit pMDC64 als Vorlage konzipiert, die eine Pyrimethamin-Widerstandskassette kodiert. Die Sequenzen in schwarz anneal zum pMDC64-Plasmid zur PCR-Amplifikation. Die rot beschrifteten Regionen sind TgCPL-spezifischeSequenzen für die homologe Rekombination.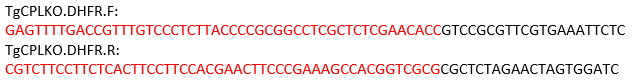
- PCR mit einem PCR-Premix unter den in Tabelle 4beschriebenen PCR-Bedingungen durchführen.
- Führen Sie das PCR-Produkt auf einem Agaro-Gel (Abbildung 3E), gefolgt von Gelextraktion und Standard-Nukleinsäure-Quantifizierungsverfahren.
HINWEIS: Wenn das erwartete Band nicht erfolgreich verstärkt werden kann, optimieren Sie die PCR-Bedingungen und/oder die Switch-Primerpaare.
- Je nach den Targeting-Sites der ausgewählten sgRNA, lokalisieren Sie 50 bp von 5'-UTRs oder 3'-UTRs des Zielgens für eine homologieabhängige Rekombination (HDR, siehe Diskussionsabschnitt). Die Auswahl der Regionen folgt den unten aufgeführten Kriterien, abhängig von der Position, die die sgRNA-Ziele anvisieren.
- Toxoplasma-Transfektion
- Pass RH-ku80::NLuc Parasiten für 2 Tage in einem T25-Kolben mit konfluenten HFFs. Ein T25-Kolben volllysierter Parasiten ist ausreichend für zwei bis drei Transfektionen.
- Spritze und Filter-reinigen Parasiten wie in Schritt 1.2 beschrieben. Parasiten im Cytomix-Puffer wieder aussetzen und bei 1.000 x g 10 min bei RT nach unten drehen.
- Pelletparasiten mit 10 ml Zytomixpuffer waschen und die Parasiten bei 1.000 x g 10 min bei RT versenken.
- Gießen Sie den Überstand vorsichtig ab und setzen Sie die Parasiten im selben Puffer in einer Konzentration von 1 x 108 Parasiten/ml wieder aus.
- Mischen Sie 2 g Reparaturschablonen-DNA mit 20 g der sgRNA/Cas9-Expressionsplasmide (Massenverhältnis = 1:5, entspricht einem 1:3-Molarenverhältnis). Wenn die Verstärkungsausbeute der Reparaturschablone gering ist, reduzieren Sie den Input beider DNA-Stücke entsprechend. Es können mindestens 0,5 g Reparaturschablonen verwendet werden.
- Mischen Sie 400 l Parasitenresuspension, DNA und 5 l von 200 mM ATP/500 mM reduziertes Glutathion (GSH) in einem 1,5 ml Zentrifugenrohr. Bringen Sie das Gesamtvolumen bei Bedarf auf 500 L mit Cytomix-Puffer.
- Übertragen Sie das Gemisch aus Parasiten und DNA auf eine Elektroporationsküvette (4 mm Spaltbreite) und führen Sie die Elektroporation (2 kV Spannung, 50 -Zoll-Widerstand) mit einem Elektroporationsgerät durch.
- Übertragen Sie elektroporated Parasiten auf einen T25-Kolben, der konfluente HFFs in frischem D10-Medium enthält. Geeignetes Antibiotikum zur Arzneimittelauswahl nach 24 h auftragen.
- Halten Sie den selektiven Druck der Medikamente, bis das Wachstum der transgenen Parasiten stabil ist.
- Reinigen Sie genomische DNA aus der Knockout-Population und prüfen Sie die Integration der Pyrimethamin-Resistenzkassette in den TgCPL-Lokus per PCR. Fahren Sie nach der Überprüfung mit Abschnitt 3.4 fort. Wenn nicht, führen Sie eine weitere Runde der Parasitentransfektion und Medikamentenauswahl durch. Die Unfähigkeit, die korrekte Integration der Arzneimittelresistenzkassette zu erkennen, deutet in der Regel darauf hin, dass das Zielgen wesentlich ist oder dass der Genort nicht zugänglich ist.
- Klonen von Knockout-Parasiten
- Säen Sie zwei 96 Well-Mikroplatten mit HFF-Zellen und inkubieren Sie bei 37 °C und 5%CO2 für 1 Woche vor dem Klonen von Parasiten.
- Passieren Sie 0,3-0,4 ml der Population transgener Parasiten in einem T25-Kolben, der konfluente HFFs enthält, und wachsen Sie sie für 2 Tage. Erwägen Sie, mehr Parasiten zu passieren, wenn die Mutante Wachstumsdefekte aufweist.
HINWEIS: Um die beste Ausbeute und Lebensfähigkeit zu erzielen, sind die Wirtszellen stark von den Parasiten infiziert, und die meisten Parasiten werden im intrazellulären Stadium gehalten. - Spritzen infizierte Wirtszellen und filterreinigen frisch lysierte Parasiten, wie in Schritt 1.3 erwähnt. Setzen Sie die Parasiten in D10 medium aus und drehen Sie sie bei 1.000 x g für 10 min bei RT.
- Setzen Sie die pelletierten Parasiten in 10 ml D10 medium aus.
- Zählen Sie Parasiten mit einem Hämozytometer, um die Parasitenkonzentration zu bestimmen.
- Führen Sie eine zweistufige Verdünnung durch, um die Konzentration auf 10 Parasiten/ml in D10-Medium zu bringen, die mit dem entsprechenden Antibiotikum ergänzt werden. In der Regel wird die anfängliche Parasitenresuspension um das 1.000-fache verdünnt, gefolgt von einer zweiten Verdünnung auf 10 Parasiten/ml.
- Aspirieren Sie Medien von 96 Well-Mikroplatten, die konfluente HFFs enthalten, und impfen Sie 150 l verdünnter Parasiten in jeden Brunnen.
- Inkubieren Sie Platten bei 37 °C mit 5%CO2 für 7 Tage ohne Störung, um plaque bildung zu ermöglichen. Die Inkubationszeit kann länger sein, wenn transgene Parasiten Wachstumsdefekte aufweisen.
- Sieb die Platten mit einem Phasenkontrastmikroskop und markieren Sie nur die Brunnen, die eine einzige Plaque enthalten.
- Führen Sie Kolonie-PCR aus, um korrekte Klone zu identifizieren.
- Verwenden Sie Pipettenspitzen, um den Boden jedes Brunnens zu kratzen, um infizierte HFF-Monolayer zu heben.
- Pipetten Sie 75 l der Zellresuspension von jeder markierten gut in 1,5 ml Mikrozentrifugenrohre.
- Zentrifugenrohre für 10 min bei maximaler Geschwindigkeit bei RT. Den Überstand vorsichtig ansaugen und das Pellet in 10,25 l Lysepuffer mit Verdünnungspuffer und DNA-Freisetzungsadditiv im Kit(Materialtabelle)wieder aufsetzen.
- Inkubieren Sie die Proben für 4 min bei RT, dann 2 min bei 98 °C. Danach können Proben für PCR verwendet oder bei -20 °C bis zur Verwendung gelagert werden. Drei Sätze von PCR-Reaktionen werden verwendet, um für die Integration der Arzneimittelresistenzkassette und den Verlust des Gens von Interesse zu testen (Abbildung 4A). Siehe Tabelle 5 für PCR-Reaktionseinrichtung und Tabelle 6 für Thermocycler-Einstellungen.
- Identifizieren Sie die richtigen Klone und übertragen Sie vier Klone in T25-Flaschen, die konfluente HFFs enthalten.
- Nach einzelnen Klonen Lyse-Wirtszellen, reinigen Genom-DNA für weitere PCR-Verifikation.
- Wenn ein Antikörper verfügbar ist, der das Protein von Interesse erkennt, folgen Sie einem Standard-Immunoblotting-Verfahren, um den Verlust des Zielproteins in den richtigen Toxoplasma-Knockouts zu überprüfen. Repräsentative Bilder zum Screening eines TgCPL-Löschmutantensind in Abbildung 4B,Cdargestellt.
Ergebnisse
Abbildung 1 stellt ein Beispiel für eine Wachstumskurve für denRH-Ku80 dar::NLuc-Stamm und die abgeleitete Berechnung für seine Verdoppelungszeit. Im Allgemeinen wird der Test in drei technischen Replikationen für jede der drei biologischen Replikationen durchgeführt, um Variationen von Luziferase-Aktivitätsmessungen zu berücksichtigen. Um die normalisierte Faltenveränderung des Parasitenwachstums zu berechnen, wurde jeder Messwert b...
Diskussion
++Dieses Protokoll beschreibt ein auf Luziferase basierendes Protokoll zur Bewertung des intrazellulären Toxoplasmawachstums und zur Bewertung der Hemmungswirksamkeit chemischer Verbindungen gegen Parasitenwachstum. Im Vergleich zu den bestehenden Strategien zur Messung des intrazellulären Toxoplasmawachstums weist diese Methode eine hohe Empfindlichkeit und Spezifität auf. Während der Überwachung des Parasitenwachstums wird ein Mock-Assay in einer klaren 96-Well-Mikroplatte empfohlen, um zu bestä...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken Drs. Sibley und Carruthers für die gemeinsame Nutzung von pSAG1-Cas9-sgRNA-TgUPRT Plasmid und Anti-TgCPL- und TgActin-Antikörpern. Diese Arbeit wurde durch den Clemson Startup Fund (zu Z.D.), Knights Templar Eye Foundation Pediatric Ophthalmology Career-Starter Research Grant (zu Z.D.), ein Pilotstipendium eines NIH COBRE-Zuschusses P20GM109094 (bis Z.D.) und NIH R01AI143707 (bis Z.D.) unterstützt. Die Geldgeber spielten keine Rolle bei der Studiengestaltung, Datenerhebung und -analyse, der Entscheidung zur Veröffentlichung oder der Vorbereitung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| Agarose gel extraction kit | New England BioLabs | T1020L | |
| BamHI | New England BioLabs | R0316S | |
| Biotek Synergy H1 Hybrid Multi-Mode Microplate Reader | BioTek Instuments | ||
| BTX Gemini Twin Waveform Electroporation System | Harvard Apparatus | ||
| Chemically competent E. coli cells | New England BioLabs | C29871 | |
| CloneAmp HiFi PCR premix | Takara Bio | 639298 | |
| Coelenterazine h | Prolume | 301-10 hCTZ | |
| EcoRV | New England BioLabs | R3195S | |
| Phire Tissue Direct PCR Master Mix | Thermo Scientific | F170L | |
| Plasmid miniprep kit | Zymo Research | D4054 | |
| Q5 Site-Directed Mutagenesis kit | New England BioLabs | E0554S | |
| Software | |||
| Geneious software for sgRNA design (version: R11) | |||
| GraphPad Prism software (8th version) | |||
| SnapGene for molecular cloning (version: 4.2.11) |
Referenzen
- Blader, I. J., Coleman, B. I., Chen, C. T., Gubbels, M. J. Lytic Cycle of Toxoplasma gondii: 15 Years Later. Annual Review of Microbiology. 69 (1), 1-23 (2014).
- Jones, J. L., Kruszon-Moran, D., Rivera, H., Price, C., Wilkins, P. P. Toxoplasma gondii Seroprevalence in the United States 2009-2010 and Comparison with the Past Two Decades. The American Journal of Tropical Medicine and Hygiene. 90 (6), (2014).
- Kieffer, F., Wallon, M. Congenital toxoplasmosis. Handbook of Clinical Neurology. 112, 1099-1101 (2013).
- Hoffmann, S., Batz, M. B., Morris, G. J. Annual cost of illness and quality-adjusted life year losses in the United States due to 14 foodborne pathogens. Journal of Food Protection. 75 (7), 1292-1302 (2012).
- Dubey, J. Toxoplasmosis. Journal of the American Veterinary Medical Association. 205 (11), 1593-1598 (1994).
- Lindsay, D., Dubey, J. Toxoplasma gondii: the changing paradigm of congenital toxoplasmosis. Parasitology. 138 (14), 1-3 (2011).
- Deng, Y., Wu, T., Zhai, S., Li, C. Recent progress on anti-Toxoplasma drugs discovery: Design, synthesis and screening. European Journal of Medicinal Chemistry. 183, 111711 (2019).
- Butler, N. J., Furtado, J. M., Winthrop, K. L., Smith, J. R. Ocular toxoplasmosis II: clinical features, pathology and management. Clinical & Experimental Ophthalmology. 41 (1), 95-108 (2013).
- Pfefferko, E., Pfefferko, L. C. Specific Labeling of Intracellular Toxoplasma gondii with Uracil. Journal of Eukaryotic Microbiology. 24 (3), 449-453 (1977).
- Merli, A., Canessa, A., Melioli, G. Enzyme immunoassay for evaluation of Toxoplasma gondii growth in tissue culture. Journal of Clinical Microbiology. 21 (1), 88-91 (1985).
- Derouin, F., Chastang, C. Enzyme immunoassay to assess effect of antimicrobial agents on Toxoplasma gondii in tissue culture. Antimicrobial Agents and Chemotherapy. 32 (3), 303-307 (1988).
- McFadden, D., Seeber, F., Boothroyd, J. Use of Toxoplasma gondii expressing beta-galactosidase for colorimetric assessment of drug activity in vitro. Antimicrobial Agents and Chemotherapy. 41 (9), 1849-1853 (1997).
- Gubbels, M. J., Li, C., Striepen, B. High-Throughput Growth Assay for Toxoplasma gondii Using Yellow Fluorescent Protein. Antimicrobial Agents and Chemotherapy. 47 (1), 309-316 (2003).
- Touquet, B., et al. High-content imaging assay to evaluate Toxoplasma gondii infection and proliferation: A multiparametric assay to screen new compounds. PLoS ONE. 13 (8), e0201678 (2018).
- Thornton, L. B., et al. An ortholog of Plasmodium falciparum chloroquine resistance transporter (PfCRT) plays a key role in maintaining the integrity of the endolysosomal system in Toxoplasma gondii to facilitate host invasion. PLOS Pathogens. 15 (6), e1007775 (2019).
- Larson, E. T., et al. Toxoplasma gondii cathepsin L is the primary target of the invasion-inhibitory compound morpholinurea-leucyl-homophenyl-vinyl sulfone phenyl. The Journal of Biological Chemistry. 284 (39), 26839-26850 (2009).
- Dou, Z., McGovern, O. L., Cristina, M., Carruthers, V. B. Toxoplasma gondii Ingests and Digests Host Cytosolic Proteins. mBio. 5 (4), e01188-14 (2014).
- Cristina, M., et al. Toxoplasma depends on lysosomal consumption of autophagosomes for persistent infection. Nature Microbiology. 2, 17096 (2017).
- Parussini, F., Coppens, I., Shah, P. P., Diamond, S. L., Carruthers, V. B. Cathepsin L occupies a vacuolar compartment and is a protein maturase within the endo/exocytic system of Toxoplasma gondii. Molecular Microbiology. 76 (6), 1340-1357 (2010).
- Huynh, M. H., Carruthers, V. B. Tagging of endogenous genes in a Toxoplasma gondii strain lacking Ku80. Eukaryotic cell. 8 (4), 530-539 (2009).
- Fox, B. A., Ristuccia, J. G., Gigley, J. P., Bzik, D. J. Efficient gene replacements in Toxoplasma gondii strains deficient for nonhomologous end joining. Eukaryotic Cell. 8 (4), 520-529 (2009).
- Sidik, S. M., Hackett, C. G., Tran, F., Westwood, N. J., Lourido, S. Efficient Genome Engineering of Toxoplasma gondii Using CRISPR/Cas9. PLoS ONE. 9 (6), e100450 (2014).
- Shen, B., Brown, K. M., Lee, T. D., Sibley, D. L. Efficient Gene Disruption in Diverse Strains of Toxoplasma gondii Using CRISPR/CAS9. mBio. 5 (3), e01114-14 (2014).
- Radke, J. R., et al. Defining the cell cycle for the tachyzoite stage of Toxoplasma gondii. Molecular and Biochemical Parasitology. 115 (2), 165-175 (2001).
- Ran, A. F., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Labun, K., Montague, T. G., Gagnon, J. A., Thyme, S. B., Valen, E. CHOPCHOP v2: a web tool for the next generation of CRISPR genome engineering. Nucleic Acids Research. 44 (W1), W272-W276 (2016).
- Heigwer, F., Kerr, G., Boutros, M. E-CRISP: fast CRISPR target site identification. Nature Methods. 11 (2), 2812 (2014).
- Peng, D., Tarleton, R. EuPaGDT: a web tool tailored to design CRISPR guide RNAs for eukaryotic pathogens. Microbial Genomics. 1 (4), e000033 (2015).
- Doench, J. G., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nature Biotechnology. 32 (12), 1262-1267 (2014).
- Sidik, S. M., et al. A Genome-wide CRISPR Screen in Toxoplasma Identifies Essential Apicomplexan Genes. Cell. 166 (6), 1423-1435 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten