Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bewertung der zellulären Oxidation mit einem subzellulären Kompartiment-spezifischeredox-sensitivegrüne fluoreszierende Protein
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Bewertung des subzellulären Kompartiment-spezifischen Redoxstatus innerhalb der Zelle. Eine redoxempfindliche Fluoreszenzsonde ermöglicht eine komfortable ratiometrische Analyse in intakten Zellen.
Zusammenfassung
Die Messung des intrazellulären Oxidations-/Reduktionsgleichgewichts bietet einen Überblick über den physiologischen und/oder pathophysiologischen Redoxstatus eines Organismus. Thiole sind besonders wichtig für die Beleuchtung des Redoxstatus von Zellen über ihre reduzierten Dithiol- und oxidierten Disulfidverhältnisse. Entwickelte cysteinhaltige fluoreszierende Proteine eröffnen eine neue Ära für Redox-empfindliche Biosensoren. Eines davon, redoxsensitives grünes fluoreszierendes Protein (roGFP), kann leicht in Zellen mit adenoviraler Transduktion eingeführt werden, so dass der Redoxstatus subzellulärer Kompartimente ausgewertet werden kann, ohne zelluläre Prozesse zu stören. Reduzierte Cysteins und oxidierte Zystiker von roGFP haben Anregungsmaxima bei 488 nm bzw. 405 nm, mit Emission bei 525 nm. Die Beurteilung der Verhältnisse dieser reduzierten und oxidierten Formen ermöglicht die bequeme Berechnung des Redox-Gleichgewichts innerhalb der Zelle. In diesem Methodenartikel wurden verewigte menschliche dreifach-negative Brustkrebszellen (MDA-MB-231) verwendet, um den Redoxstatus innerhalb der lebenden Zelle zu bewerten. Die Protokollschritte umfassen MDA-MB-231 Zelllinientransduktion mit Adenovirus zur Exprimierbarkeit von Zytosol-RoGFP, Behandlung mit H2O2und Bewertung des Cystein- und Cystin-Verhältnisses mit Durchflusszytometrie und Fluoreszenzmikroskopie.
Einleitung
Oxidativer Stress wurde 1985 von Helmut Sies als "Störung des prooxidant-antioxidativen Gleichgewichts zu Gunsten des ersten"definiert,und es wurde eine Fülle von Forschungsarbeiten durchgeführt, um einen krankheits-, ernährungs- und alterungsspezifischen Redoxstatus von Organismen1,2,3zu erhalten. Seitdem ist das Verständnis von oxidativem Stress breiter geworden. Das Testen der Hypothesen der Verwendung von Antioxidantien gegen Krankheiten und/oder Alterung hat gezeigt, dass oxidativer Stress nicht nur Schaden verursacht, sondern auch andere Rollen in Zellen spielt. Darüber hinaus haben Wissenschaftler gezeigt, dass freie Radikale eine wichtige Rolle bei der Signaltransduktion2spielen. Alle diese Studien stärken die Bedeutung der Bestimmung der Veränderungen des Reduktions-Oxidations-Verhältnisses (Redox) von Makromolekülen. Enzymaktivität, Antioxidantien und/oder Oxidationsmittel sowie Oxidationsprodukte können mit verschiedenen Methoden bewertet werden. Unter diesen, Methoden, die Thiol-Oxidation bestimmen sind wohl die am häufigsten verwendeten, weil sie über das Gleichgewicht zwischen Antioxidantien und Prooxidantien in Zellen berichten, sowie Organismen4. Insbesondere werden die Verhältnisse zwischen Glutathion (GSH)/Glutathiondisulfid (GSSG) und/oder Cystein (CyS)/Cystin (CySS) als Biomarker zur Überwachung des Redoxstatus von Organismen2verwendet.
Methoden, die zur Aschägung des Gleichgewichts zwischen Prooxidanzien und Antioxidantien verwendet werden, basieren hauptsächlich auf dem Niveau reduzierter/oxidierter Proteine oder kleiner Moleküle in Zellen. Westliche Flecken und Massenspektrometrie werden verwendet, um die Verhältnisse von reduzierten/oxidierten Makromolekülen (Protein, Lipide usw.) umfassend zu bewerten, und GSH/GSSG-Verhältnisse können mit Spektrophotometrie5bewertet werden. Ein gemeinsames Merkmal dieser Methoden ist die physikalische Störung des Systems durch Zelllyse und/oder Gewebehomogenisierung. Diese Analysen werden auch dann schwierig, wenn es notwendig ist, den Oxidationsstatus verschiedener Zellkompartimente zu messen. Alle diese Störungen verursachen Artefakte in der Assay-Umgebung.
Redoxempfindliche fluoreszierende Proteine eröffneten eine vorteilhafte Ära zur Bewertung des Redoxgleichgewichts, ohne eine Störung in den Zellen zu verursachen6. Sie können verschiedene intrazelluläre Kompartimente ins Visier nehmen, um die Quantifizierung von kompartifenspezifischen Aktivitäten (z. B. Die Untersuchung des Redoxzustands von Mitochondrien und des Zytosols) zu ermöglichen, um das Übersprechen zwischen zellulären Organellen zu untersuchen. Gelbefluoreszenzproteine (YFP), grünes fluoreszierendes Protein (GFP) und HyPeR-Proteine werden von Meyer undKollegen6 überprüft. Unter diesen Proteinen ist Redox-sensitive sywertGFP (roGFP) aufgrund unterschiedlicher fluoreszierender Auslesungen seiner CyS (z.B. 488 nm/em. 525 nm) und CySS (z.B. 405 nm/525 nm) Rückstände einzigartig, was im Gegensatz zu anderen Redox-empfindlichen Proteinen wie YFP7,8eine ratiometrische Analyse ermöglicht, was eine ratiometrische Analyse ermöglicht. Die ratiometrische Ausgabe ist wertvoll, da sie die Unterschiede zwischen Expressionsstufen, Erkennungsempfindlichkeiten und Photobleaching8ausbalanciert. Subzelluläre Kompartimente von Zellen (Zytosol, Mitochondrien, Kern) oder verschiedenen Organismen (Bakterien sowie Säugetierzellen) können durch Modifizieren von roGFP7,9,10gezielt werden.
roGFP-Assays werden mit fluoreszierenden Bildgebungstechniken durchgeführt, insbesondere für Echtzeit-Visualisierungsexperimente. Flow-zytometrische Analysen von roGFPs sind auch für Experimente mit vorgegebenen Zeitpunkten möglich. Der aktuelle Artikel beschreibt sowohl die Verwendung von Fluoreszenzmikroskopie als auch die Durchflusszytometrie, um eine ratiometrische Bewertung des Redoxstatus in Säugetierzellen durchzuführen, die roGFP (gezielt auf Zytosol) über adenovirale Transduktion überexzieren.
Access restricted. Please log in or start a trial to view this content.
Protokoll
HINWEIS: Dieses Protokoll wurde für 70 % –80 % konfluente MDA-MB-231-Zellen optimiert. Bei anderen Zelllinien sollten die Anzahl der Zellen und die Vielzahl der Infektionen (MOI) neu optimiert werden.
1. Vorbereitung der Zellen (Tag 1)
- MDA-MB-231 Zelllinie in 75 cm2 Kolben mit 10 ml Dulbeccos modifiziertem Eagle Medium (DMEM) zu halten, ergänzt mit 10% fetalem Rinderserum (FBS) bei 37 °C in einer 5%CO2 befeuchteten Atmosphäre.
HINWEIS: DMEM, ergänzt durch 10% FBS, 37 °C und eine 5%CO2 befeuchtete Atmosphäre, werden für alle Befestigungs- und Behandlungsinkubationen während des gesamten Protokolls verwendet. - Bereiten Sie die MDA-MB-231-Zellen für Experimente vor.
- Saugen Sie das Medium innerhalb des Kolbens, lösen Sie die Zellen mit 2 ml 0,25% Trypsin-EDTA-Lösung für 2 min und inaktivieren Sie die Trypsin-Aktivität mit 6 ml komplettem Medium (DMEM mit 10% FBS). Zentrifugieren Sie die Zellen bei 150 x g für 5 min. Aspirieren Sie den Überstand und suspendieren Sie die Zellen in 5 ml komplettem Medium.
- Mischen Sie eine Zelle mit gleichem Volumen und 0,4% Trypan blau. Nehmen Sie 10 l dieser Mischung und zählen Sie die Zellen mit dem automatisierten Zellzähler.
HINWEIS: Ein Coulter-Zähler oder ein Hämozytometer kann auch für die Zellzählung verwendet werden. - Säen Sie die Zellen in eine 6-Well-Platte für Durchflusszytometrie-Analysen und säen Sie 150.000 Zellen in 1 ml Medium pro Brunnen. Warten Sie 16 h auf Zellanhaftung.
- Säen Sie die Zellen in ein 4-Well-Kammer-Dia für fluoreszierende Bildgebung und Samen 25.000 Zellen in 0,5 ml Medium pro Brunnen. Warten Sie 16 h auf Zellanhaftung.
HINWEIS: Samenkontrollbrunnen zusätzlich zu Behandlungsbrunnen. Verwenden Sie eine der Kontrollbrunnen, um die Zellnummer zu bestimmen (optional: wenn die Bindungsdauer für die Zellen kürzer als die Verdoppelungszeit ist, kann davon ausgegangen werden, dass die Zellenzahl mit der Saatdichte identisch ist) und die andere für eine nicht infizierte Kontrolle (0 MOI).
2. Adenovirale RoGFP-Transduktion (Tag 2 und 3)
VORSICHT: Adenoviren können Krankheiten verursachen. Verwenden Sie bei der Transducing der Zellen gefilterte Spitzen und dekontaminieren Sie Spitzen, Pasteurpipetten und Mikrozentrifugenröhrchen mit 10% Bleichmittel.
HINWEIS: Dieses Protokoll wurde mit zytosolspezifischem RoGFP demonstriert, aber andere zelluläre Kompartimente (z. B. Mitochondrien oder mitochondrialer Intermembranraum) können mit demselben Protokoll gezielt werden.
- Generieren Sie eine Dosis-Wirkungs-Kurve für den MOI, um die höchste Transduktionseffizienz zu erzielen, indem Sie das Volumen des Adenovirus (mL) berechnen, das für jeden MOI-Wert für die MDA-MB-231-Zelllinie erforderlich ist (Tabelle 1):
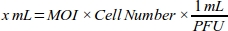
HINWEIS: Der funktionelle Titer jeder Charge adenoviraler Bestände, die als Plaque-Formeinheit (PFU) pro ml ausgedrückt wird, wird vom Unternehmen bereitgestellt. Der optimale MOI für die Transduktion unterscheidet sich von Zelltypen aus. Für die meisten Säugetierzellen liegt der optimale MOI-Bereich zwischen 10 und 300. Gemäß der zellulären Reaktion sollten MOI-Werte neu berechnet werden (z. B. sollte der MOI-Bereich reduziert werden, wenn Zellen eine zytotoxische Reaktion haben, oder der Bereich sollte erhöht werden, wenn Zellen eine geringe Transduktionseffizienz aufweisen). - Machen Sie 1:100 Verdünnung von 6 x 1010 PFU/ml adenovirale roGFP-Lösung mit Zellkulturmedium (DMEM mit 10% FBS) für zuverlässige Pipettierung.
- Pipette und fügen Sie 0,0125 ml (12,5 l), 0,025 ml (25 l), 0,05 ml (50 l) adenovirale roGFP-Verdünnung in jeden Brunnen der 6 Brunnenplatte, um die 150.000 Zellen mit 50, 100 bzw. 200 MOI für die Durchflusszytometrieanalyse zu transduzieren (1).
- Pipette und fügen Sie 0,0042 ml (4,2 l) adenovirale roGFP-Verdünnung in den 4-Kammer-Diabrunnen hinzu, um 25.000 Zellen mit 100 MOI für Fluoreszenz-Bildgebung zu transduzieren (Tabelle 1).
HINWEIS: In den Brunnen sollte eine minimale Menge an Medium verwendet werden, um die höchste Wechselwirkung zwischen dem adenoviralen RoGFP-Konstrukt und den Zellen zu gewährleisten. Der Serumgehalt des Kulturmediums muss möglicherweise für verschiedene Zelllinien verringert werden, da hohe Serumwerte die Transduktionseffizienz in einigen Zelltypen negativ beeinflussen können. - Inkubieren Sie Zellen für 16–24 h unter den Bedingungen der Zellerhaltung. Am nächsten Tag (Tag 3) ändern Sie das Medium-Zell-Kulturmedium (DMEM mit 10% FBS), um eine Zellwiederherstellung für weitere 24 h zu ermöglichen. Visualisierung von Zellen unter dem Mikroskop, um ihre Morphologie zu bewerten; Zellen können roGFP ausdrücken, auch wenn sie morphologische Veränderungen haben.
HINWEIS: Am 3. Tag sollten die Zellen beginnen, roGFP auszudrücken; Daher kann die Transduktionseffizienz mit der Fluoreszenzmikroskopie (Filter mit ex. 488/em. 525) überwacht werden. Um konsistente Assay-Ergebnisse zu erhalten, sollten Sie sich der morphologischen Veränderungen unter dem Phasenkontrastmikroskop bewusst sein und diese dokumentieren und die Morphologie beobachten, während Sie die Transduktionseffizienz bewerten. - Konstruieren Sie eine Dosis-Wirkungs-Kurve mit den 50, 100 und 200 MOI-Proben, die in Schritt 2.3 erstellt wurden, und deren Transduktionseffizienzergebnisse aus der Durchflusszytometrieanalyse (Schritte 3.1 und 4.1). Bewerten Sie die optimale Transduktionseffizienz mit der Dokumentation morphologischer Veränderungen (Schritt 2.5) und der Dosis-Wirkungs-Kurve von MOI.
HINWEIS: Obwohl mehr als 98% der Zellpopulation bei 100 MOI und 200 MOI roGFP ausdrücken (siehe repräsentative Ergebnisse), zeigten 200 MOI-Gruppen wesentliche Veränderungen in der Zellmorphologie von MDA-MB-231-Zellen. Folglich wurde die wirksamste MOI für MDA-MB-231-Zellen auf 100 MOI festgelegt. - Nachdem optimales MOI (hier 100 MOI) für die MDA-MB-231-Zelllinie ausgewählt wurde, führen Sie Experimente mit Testmaterialien (10 M H2O2 und seinem Fahrzeug 0,1% entionisiertes Wasser) durch.
- Bereiten Sie die Zellen gemäß Abschnitt 1 vor und säen Sie sie aus. Unter Verwendung des adenoviralen Transduktionsvolumens für 100 MOI, berechnet in Schritt 2.1, wiederholen Sie die Schritte 2.2-2.4 für 100 adenovirale MOI-Transduktion von Zellen. Dann inkubieren Sie die Platte und Kammer gleitet nach Schritt 2.5.
3. Erwerb der CyS/CySS-Bilanz
- Durchflusszytometrie (Tag 4)
- An Tag 4 die Zellen ab Schritt 2.7.1 mit 10 'MH2O2 für 1 h inkubieren.
ANMERKUNG: Als Prüfsubstanz wurden 10 m H2O2 und in diesem Protokoll 0,1 % entionisiertes Wasser als Fahrzeugbehandlung verwendet. Andere Oxidationsmittel können hier als positiv gesteuert werden. - Aspirieren Sie Medien aus der 6-Well-Platte, ersetzen Sie durch 750 l 0,25% Trypsin-EDTA-Lösung und warten Sie 2 min, bis sich die Zellen lösen. Inaktivieren Sie Trypsin mit 2 ml komplettem Medium (DMEM mit 10% FBS) und sammeln Sie das Volumen in 15 ml konische Rohre.
- Zentrifugieren Sie die Rohre bei 150 x g für 5 min bei 4oC. Überstand entsorgen und die Zellen in 500 l Phosphat-gepufferter Saline (PBS) aussetzen.
- Wiederholen Sie Schritt 3.1.3
- Filtern Sie die Zellsuspensionen in strömungszytometrie-kompatible Rohre mit 40 m Mesh. Halten Sie die Rohre auf Eis und weg vom Licht und folgen Sie Schritt 4.1 für die Datenanalyse.
- An Tag 4 die Zellen ab Schritt 2.7.1 mit 10 'MH2O2 für 1 h inkubieren.
- Mikroskopische Bildgebung (Tag 4)
- Behandeln Sie am 4. Tag Zellen mit 10 M H2O2, erfassen Sie bilder sofort (Zeitpunkt 0) und 1 h nach der Behandlung und folgen Sie Schritt 4.2 für die Datenanalyse.
4. Datenanalyse
- Flusszytometrie-Quantifizierung
- Festlegen der Durchflusszytometriemethode für 3 verschiedene Analysen über Probenerfassungssoftware (siehe Materialtabelle):Vorwärtsstreuung (FCS) auf x-Achse und Seitenstreuung (SSC) auf y-Achse zur Bewertung der Zellgröße und -komplexität von Zellen (SSC kann zur groben Identifizierung von toten und lebenden Zellen verwendet werden); z.B. 488 nm/em. 525 nm (Fluorescein isothiocyanat [FITC]) Bandpassfilter auf x-Achse und SSC auf y-Achse zur Beurteilung von CyS-roGFP; z.B. 405 nm/em. 525 nm (Brilliant Violet 510 [BV510]) Bandpassfilter auf x-Achse und SSC auf y-Achse zur Beurteilung von CySS-roGFP.
- Erfassen Sie 0 MOI-Steuerung und visualisieren Sie Zellen mit Probenerfassungssoftware. Wiederholen Sie diesen Schritt für die verbleibenden Proben (50, 100, 200 MOI-Gruppen und später 10 M H2O2 behandelte Zellen und fahrzeugbehandelte Zellen). Speichern Sie die Dateien für die Datenanalyse.
- Öffnen Sie Datenanalysesoftware (siehe Tabelle der Materialien) und öffnen Sie 0 MOI-Beispieldatei. Bewerten Sie die Zellpopulation von Interesse (Tor 1). Richten Sie die folgenden Gatings ein, um die Hintergrundfluoreszenz für z.B. 488 nm/em zu minimieren. 525 nm (Tor 2) und ex. 405 nm/em. 525 nm (Gate 3) Bandpassfilter mit den nicht infizierten (0 MOI) Steuerzellen.
- Öffnen Sie 50, 100 und 200 MOI-Beispieldateien in der Datenanalysesoftware, um die Dosis-Wirkungs-Kurve zu bewerten. Analysieren Sie die mittleren Fluoreszenzintensitäten mit Gates 2 und 3 für jede Probe. Wiederholen Sie diesen Schritt für Testproben (10 M H2O2 behandelte Zellen und fahrzeugbehandelte Zellen).
- Berechnen Sie das mittlere fluoreszierende Intensitätsverhältnis zwischen oxidierten und reduzierten Formen von RoGFP mit der folgenden Gleichung.

- Image-Bewertung
- Verwenden Sie ein Mikroskop, das Fluoreszenzfilter für CyS-roGFP und CySS-roGFP (z.B. 488 nm/em. 525 nm bzw. ex. 405 nm/em. 525 nm Filter) enthält.
- Wählen Sie in jedem Brunnen der Kammerfolie 4 zufällige Bereiche aus, um Bilder zu erfassen, wobei sie das 4x-Ziel verwenden, um größere Bereiche zu visualisieren.
HINWEIS: 20x Objektiv kann auch für Bildanzeigen verwendet werden. - Öffnen Sie das Bild mit ImageJ Software11. Anwenden von Analyze | Messen Sie Befehle für jedes Bild, und verwenden Sie die Gleichung in Schritt 4.1.5, um die Daten zu quantifizieren.
ANMERKUNG: Die Quantifizierung der Bilder ist ratiometrisch; Daher enthält das Protokoll keine Subtraktion des Hintergrunds. Um Bilder vergleichen zu können, müssen Helligkeit, Kontrast und Sättigung jedoch für jedes Bild gleich sein. Die statistische Signifikanz wurde mit einer einseitigen Varianzanalyse (ANOVA) und Tukeys Post-hoc-Test bewertet.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Der Redoxzustand von CyS/CySS lässt sich leicht mit transduzierten RoGFPs überprüfen. Die fluoreszierende Sonde quantifiziert das Verhältnis zwischen den reduzierten und oxidierten Formen (Erregungswellenlängen 488 nm bzw. 405 nm). Fluoreszenzdaten können sowohl durch Durchflusszytometrie als auch durch Mikroskopie ermittelt werden.
Eine große Anzahl von Zellen kann konsistent und bequem mit Durchflusszytometrie erfasst werden. Die Analyse besteht aus 3 Hauptschritten: 1) Wählen Sie di...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das Thiol/Disulfid-Gleichgewicht in einem Organismus spiegelt den Redoxstatus von Zellen wider. Lebende Organismen haben Glutathion, Cystein, Proteinthiole und niedermolekulare Thiole, die alle von der Oxidation betroffen sind und den Redoxstatus der Zellen4wiedergeben. Technische ROGFPs ermöglichen die unterbrechungsfreie Quantifizierung des Thiol/Disulfid-Gleichgewichts über ihre CyS-Rückstände7. Die ratiometrische Eigenschaft von roGFP liefert zuverlässige Redoxmess...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Das Konstrukt und rekombinante Adenovirus zur Exdinierung von Cytosol-spezifischem RoGFP in Zellen wurden im Labor von Paul T. Schumacker, PhD, Freiberg School of Medicine, Northwestern University und ViraQuest Inc. erzeugt. Diese Studie wurde vom Center for Studies of Host Response to Cancer Therapy Grant P20GM109005 durch das NIH National Institute of General Medical Sciences Centers of Biomedical Research Excellence (COBRE NIGMS), National Institute of General Medical Sciences Systems Pharmacology and Toxicology Training Program Grant T32 GM106999, UAMS Foundation/Medical Research Endowment Award AWD00053956, UAMS Year-End Chancellor es Awards AWD00053484. Die Durchflusszytometrie-Kernanlage wurde teilweise vom Center for Microbial Pathogenesis und Host Inflammatory Responses Grant P20GM103625 über das COBRE NIGMS unterstützt. Der Inhalt liegt allein in der Verantwortung der Autoren und stellt nicht unbedingt die offiziellen Ansichten des NIH dar. ATA wurde vom Wissenschafts- und Technologieforschungsrat der Türkei (TUBITAK) 2214-A Stipendium unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
Referenzen
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten