Method Article
Eine Open-Source-Technologieplattform zur automatisierten und standardisierten Herstellung von Hydrogel-basierten 3D-Kulturmodellen
In diesem Artikel
Zusammenfassung
Dieses Protokoll dient als umfassendes Tutorial für das standardisierte und reproduzierbare Mischen viskoser Materialien mit einer neuartigen Open-Source-Automatisierungstechnologie. Detaillierte Anleitungen zum Betrieb einer neu entwickelten Open-Source-Workstation, zur Verwendung eines Open-Source-Protokolldesigners sowie zur Validierung und Verifizierung zur Identifizierung reproduzierbarer Mischungen werden bereitgestellt.
Zusammenfassung
Aktuelle Mischschritte viskoser Materialien beruhen auf sich wiederholenden und zeitaufwändigen Aufgaben, die hauptsächlich manuell in einem Niedrigdurchsatzmodus ausgeführt werden. Diese Probleme stellen Nachteile in Arbeitsabläufen dar, die letztendlich zu einer Unreproduzierbarkeit von Forschungsergebnissen führen können. Manuelle Arbeitsabläufe schränken die Weiterentwicklung und weit verbreitete Einführung viskoser Materialien wie Hydrogele für biomedizinische Anwendungen weiter ein. Diese Herausforderungen können durch den Einsatz automatisierter Workflows mit standardisierten Mischprozessen zur Erhöhung der Reproduzierbarkeit bewältigt werden. In dieser Studie präsentieren wir Schritt-für-Schritt-Anleitungen zur Verwendung eines Open-Source-Protokolldesigners, zum Betrieb einer Open-Source-Workstation und zur Identifizierung reproduzierbarer Mischungen. Konkret führt der Open-Source-Protokolldesigner den Anwender durch die experimentelle Parameterauswahl und generiert einen gebrauchsfertigen Protokollcode zur Bedienung der Workstation. Diese Workstation ist für das Pipettieren von viskosen Materialien optimiert, um eine automatisierte und äußerst zuverlässige Handhabung durch die Integration von Temperaturdocks für thermoresponsive Materialien, Verdrängerpipetten für viskose Materialien und einem optionalen Tip Touch Dock zum Entfernen von überschüssigem Material von der Pipettenspitze zu ermöglichen. Die Validierung und Verifizierung von Gemischen erfolgt durch eine schnelle und kostengünstige Absorptionsmessung von Orange G. Dieses Protokoll enthält Ergebnisse zur Erzielung von 80% (v/v) Glyceringemischen, einer Verdünnungsreihe für Gelatinemethacryloyl (GelMA) und Doppelnetzwerkhydrogelen von 5% (w/v) GelMA und 2% (w/v) Alginat. Eine Anleitung zur Fehlerbehebung ist enthalten, um Benutzer bei der Protokollübernahme zu unterstützen. Der beschriebene Workflow kann breit auf eine Reihe von viskosen Materialien angewendet werden, um benutzerdefinierte Konzentrationen automatisiert zu erzeugen.
Einleitung
Reproduzierbarkeit und Replizierbarkeit sind in der wissenschaftlichen Arbeit von größter Bedeutung1,2,3,4. Jüngste Erkenntnisse haben jedoch erhebliche Herausforderungen bei der Wiederholung von hochwirksamen biomedizinischen Studien in der Grundlagenforschung sowie in der translationalen Forschung aufgezeigt4,5,6,7. Faktoren, die zu nicht reproduzierbaren Ergebnissen beitragen, sind komplex und vielfältig, wie z. B. schlechtes oder verzerrtes Studiendesign6,8, unzureichende statistische Aussagekraft3,9, fehlende Einhaltung der Berichtsstandards7,10,11, Druck zur Veröffentlichung6 oder nicht verfügbare Methoden oder Softwarecode6,9 . Unter ihnen wurden subtile Änderungen im Protokoll und menschliche Fehler bei der Durchführung von Experimenten als weitere Elemente identifiziert, die für die Unreproduzierbarkeit verantwortlich sind4. Beispielsweise führen manuelle Pipettieraufgaben zu intra- und interindividuellen Ungenauigkeiten12,13 und erhöhen die Wahrscheinlichkeit menschlicher Fehler14. Während kommerzielle Liquid-Handling-Roboter in der Lage sind, diese Nachteile zu überwinden und eine erhöhte Zuverlässigkeit für Flüssigkeiten gezeigt haben15,16,17, ist die automatisierte Handhabung von Materialien mit signifikanten viskosen Eigenschaften immer noch eine Herausforderung.
Kommerzielle Liquid-Handling-Roboter verwenden üblicherweise Luftkissenpipetten, auch bekannt als Luftkolben- oder Luftverdrängungspipetten. Das Reagenz und der Kolben sind durch ein Luftkissen getrennt, das während der Dosierschritte schrumpft und sich während der Saugschritte ausdehnt. Bei der Verwendung von Luftkissenpipetten "fließen" viskose Materialien nur langsam in die Spitze hinein und wieder heraus, und eine frühzeitige Entnahme der Pipette aus dem Reservoir kann zur Ansaugung von Luftblasen führen. Bei Dosieraufgaben hinterlässt das zähflüssige Material einen Film an der inneren Spitzenwand, der nur langsam oder gar nicht "fließt", wenn er von der Luft gedrückt wird. Um diese Probleme zu lösen, wurden Verdrängerpipetten kommerziell eingeführt, um das viskose Material mit einem festen Kolben aktiv aus der Spitze zu extrudieren. Obwohl diese Verdrängerpipetten eine genaue und zuverlässige Handhabung viskoser Materialien ermöglichen, sind automatisierte Lösungen mit Verdrängerpipetten für akademische Laborumgebungen immer noch zu teuer, und daher verlassen sich die meisten Arbeitsabläufe mit viskosen Materialien ausschließlich auf manuelle Pipettieraufgaben18.
Im Allgemeinen ist die Viskosität definiert als der Fließwiderstand einer Flüssigkeit, und viskose Materialien werden ferner als Materialien mit einer höheren Viskosität von Wasser (0,89 mPa·s bei 25 °C) definiert. Im Bereich biomedizinischer Anwendungen enthalten Versuchsaufbauten häufig mehrere Materialien mit einer höheren Viskosität als Wasser, wie Dimethylsulfoxid (DMSO; 1,99 mPa·s bei 25 °C), Glycerin (208,1 mPa·s bei 25 °C für 90% Glycerin [v/v]), Triton X-100 (240 mPa·s bei 25 °C) und wassergeschwollene Polymere, die als Hydrogele bezeichnet werden19, 20. Auflage. Hydrogele sind hydrophile Polymernetzwerke, die in einem physikalischen und/oder chemischen Modus angeordnet sind und für verschiedene Anwendungen verwendet werden, einschließlich Zellverkapselung, Arzneimittelabgabe und weiche Aktuatoren19,20,21,22. Die Viskosität von Hydrogelen hängt von der Polymerkonzentration und dem Molekulargewicht ab19. Routinemäßig verwendete Hydrogele für biomedizinische Anwendungen weisen Viskositätswerte zwischen 1 und 1000 mPa·s auf, während spezifische Hydrogelsysteme mit Werten von bis zu 6 x 107 mPa·s19,23,24 berichtet wurden. Viskositätsmessungen von Hydrogelen sind jedoch in Bezug auf messprotokoll und Probenvorbereitung nicht standardisiert, und daher sind Viskositätswerte zwischen verschiedenen Studien schwer zu vergleichen.
Da kommerziell erhältliche automatisierte Lösungen, die speziell für Hydrogele entwickelt wurden, entweder fehlen oder zu teuer sind, hängen die aktuellen Arbeitsabläufe für Hydrogel von der manuellen Handhabung ab18. Um die Grenzen des derzeitigen manuellen Workflows für das Pipettieren von Hydrogelen zu verstehen, ist es wichtig, die wesentlichen Handhabungsaufgaben zu verstehen18. Sobald beispielsweise ein neuartiges Hydrogelmaterial synthetisiert wurde, wird eine gewünschte Konzentration oder eine Verdünnungsreihe mit unterschiedlichen Konzentrationen erzeugt, um zuverlässige Syntheseprotokolle und Vernetzungseigenschaften mit anschließender Analyse der mechanischen Eigenschaften zu identifizieren25,26,27,28 . Im Allgemeinen wird eine Stammlösung hergestellt oder gekauft und anschließend mit einem Verdünnungsmittel und/oder anderen Reagenzien gemischt, um eine Mischung zu erhalten. Die Mischaufgaben werden meist nicht direkt in einer Wellplatte (oder einem beliebigen Ausgabeformat) ausgeführt, sondern in einem separaten Reaktionsrohr, das gemeinhin als Master-Mix bezeichnet wird. Während dieser Vorbereitungsaufgaben sind verschiedene Saug- und Dosierschritte erforderlich, um das/die viskose(n) Material(e) zu übertragen, die Reagenzien zu mischen und die Mischung in ein Ausgabeformat (z. B. eine 96-Well-Platte) zu übertragen. Diese Aufgaben erfordern eine hohe Menge an menschlicher Arbeit18, lange experimentelle Stunden und erhöhen die Wahrscheinlichkeit menschlicher Fehler, die sich möglicherweise als ungenaue Ergebnisse manifestieren können. Darüber hinaus verhindert die manuelle Handhabung eine effiziente Vorbereitung hoher Probenzahlen, um verschiedene Parameterkombinationen für eine detaillierte Charakterisierung zu screenen. Die manuelle Verarbeitung behindert auch den Einsatz von Hydrogelen für Hochdurchsatz-Screening-Anwendungen, wie die Identifizierung vielversprechender Verbindungen während der Arzneimittelentwicklung. Die derzeitigen manuellen Vorbereitungsschritte sind nicht durchführbar, um Arzneimittelbibliotheken, die aus Tausenden von Arzneimitteln bestehen, zu screenen. Aus diesen Gründen sind automatisierte Lösungen erforderlich, um einen effizienten Entwicklungsprozess zu ermöglichen und die erfolgreiche Translation von Hydrogelen für Drug-Screening-Anwendungen zu ermöglichen.
Um von manuellen Arbeitsabläufen zu automatisierten Prozessen überzugehen, haben wir einen kommerziellen Open-Source-Pipettierroboter für die Handhabung viskoser Materialien durch die Integration von Temperaturdocks für thermoresponsive Materialien, die Verwendung von handelsüblichen Verdrängerpipetten mit Kapillarkolbenspitzen und ein optionales Spitzen-Touchdock für die Pipettenspitzenreinigung optimiert. Dieser Pipettierroboter wurde als Pipettiermodul weiter in eine neu entwickelte Open-Source-Workstation integriert, die aus einbaufertigen und anpassbaren Modulen besteht18,29. Detaillierte Montageanleitungen für die entwickelte Workstation inklusive Hard- und Softwaredateien sind über GitHub (https://github.com/SebastianEggert/OpenWorkstation) und das Zenodo Repository (https://doi.org/10.5281/zenodo.3612757) frei zugänglich. Neben der Hardwareentwicklung wurde eine Open-Source-Protokolldesign-Anwendung programmiert und freigegeben, um den Benutzer durch den Parameterauswahlprozess zu führen und einen gebrauchsfertigen Protokollcode (https://github.com/SebastianEggert/ProtocolDesignApp) zu generieren. Dieser Code läuft sowohl auf dem kommerziellen Open-Source-Pipettierroboter als auch auf der entwickelten Open-Source-Workstation.
Hierin wird ein umfassendes Tutorial zur Bedienung der Open-Source-Workstation zur Automatisierung von Mischaufgaben für viskose Materialien bereitgestellt (Abbildung 1). Die Tutorial-spezifischen Protokollschritte können sowohl mit der entwickelten Open-Source-Workstation als auch mit dem kommerziellen Open-Source-Pipettierroboter durchgeführt werden. Unterstützt durch eine selbst entwickelte Open-Source-Protokolldesign-Anwendung wird das automatisierte Mischen und Präparation der erforderlichen Konzentrationen für Glycerin, Gelatine Methacryloyl (GelMA) und Alginat demonstriert. Glycerin wurde in diesem Tutorial ausgewählt, da es gut charakterisiert ist30,31, es ist kostengünstig und leicht verfügbar und wird daher häufig als viskoses Referenzmaterial für automatisierte Pipettieraufgaben verwendet. Als Beispiele für Hydrogele, die in biomedizinischen Anwendungen eingesetzt werden, wurden GelMA- und Alginat-Hydrogel-Vorläuferlösungen für automatisierte Mischexperimente eingesetzt. GelMA stellt eines der am häufigsten verwendeten Hydrogele für Zellverkapselungsstudien dar32,33, und Alginat wurde in dieser Studie ausgewählt, um die Fähigkeit zur Herstellung von Doppelnetzwerk-Hydrogelen zu demonstrieren34,35. Mit Orange G als Farbstoff wurde ein schnelles und kostengünstiges Verfahren implementiert, um die Mischergebnisse mit einem Spektralphotometer16 zu validieren und zu verifizieren.
Ein kommerzieller Open-Source-Pipettierroboter wurde als Pipettiermodul in die entwickelte Open-Source-Workstation integriert (Abbildung 2a), und daher wird der Name "Pipettiermodul" weiter verwendet, um den Pipettierroboter zu beschreiben. Eine detaillierte Beschreibung der installierten Hardware geht über den Rahmen dieses Protokolls hinaus und ist über die bereitgestellten Repositories verfügbar, die auch eine Schritt-für-Schritt-Anleitung für die allgemeine Montage der Open-Source-Plattform enthalten. Das Pipettiermodul kann mit zwei Pipetten (Ein- oder 8-Kanal-Pipette) ausgestattet werden, die auf Achse A (rechts) und Achse B (links) installiert sind (Abbildung 2b). Das Pipettiermodul bietet eine Kapazität von 10 Decks gemäß den Standards des American National Standards Institute/Society for Laboratory Automation and Screening (ANSI/SLAS), und die folgenden Standortpositionen sind auf dem Deck definiert: A1, A2, B1, B2, C1, C2, D1, D2, E1, E2 (Abbildung 2c). Um die photoinduzierte Polymerisation von Hydrogellösungen einzuleiten, ist ein separates Vernetzermodul erforderlich, das dem Arbeitsplatz hinzugefügt wurde. Das Vernetzungsmodul ist mit LEDs mit einer Wellenlänge von 400 nm ausgestattet und daher können Substanzen, die bei einer Wellenlänge des sichtbaren Lichts anregen, mit den aktuellen Systemen verwendet werden, wie z.B. Lithiumphenyl-2,4,6 trimethylbenzoylphosphinat (LAP)36,37. Die Intensität (in mW/cm2) der LEDs kann vom Benutzer in der Protokolldesignanwendung angegeben werden, um das Vernetzungsverhalten zu untersuchen38. Die Workstation enthält auch ein Speichermodul, um Studien mit erhöhtem Durchsatz zu ermöglichen. Dieses Modul wird jedoch in dieser Studie nicht verwendet und daher nicht weiter beschrieben. Generell empfiehlt es sich, das Pipettiermodul in einer biologischen Sicherheitswerkbank zu betreiben, um eine Probenkontamination zu vermeiden. Der Hauptstromkreis für den Betrieb des Pipettiermoduls ist ein 12-V-Stromkreis, der in den meisten Ländern als Niederspannungsanwendung gilt. Alle elektrischen Komponenten basieren auf einem speziellen Steuerkasten, der verhindert, dass Benutzer mit der Quelle einer elektrischen Gefahr in Kontakt kommen.
Durch die Einhaltung dieser standardisierten Mischprotokolle sind Forscher in der Lage, zuverlässige Mischungen sowohl für viskose als auch für nicht viskose Materialien automatisiert zu erreichen. Der Open-Source-Ansatz ermöglicht es Benutzern, Mischsequenzen zu optimieren und neu entwickelte Protokolle mit der Community zu teilen. Letztendlich wird dieser Ansatz das Screening mehrerer Parameterkombinationen erleichtern, um die Abhängigkeiten zwischen verschiedenen Faktoren zu untersuchen und dadurch die zuverlässige Anwendung und Entwicklung viskoser Materialien für biomedizinische Anwendungen zu beschleunigen.
Protokoll
HINWEIS: Das Protokoll beginnt mit einer Einführung in (1) die Software und (2) das Hardware-Setup, um den Benutzer mit den erforderlichen Installationen und der Workstation vertraut zu machen. Nach einem Abschnitt über (3) die Materialvorbereitung und (4) die Verwendung der Protokolldesigneranwendung, (5) die Kalibrierung des Pipettiermoduls und (6) die Ausführung des automatisierten Protokolls wird ausführlich hervorgehoben. Schließlich werden (7) Validierungs- und Verifizierungsverfahren beschrieben, einschließlich Absorptionsmessung und Datenanalyse. Ein allgemeiner Protokollworkflow mit einzelnen Aufgaben ist in Abbildung 1 dargestellt.
1. Software-Einrichtung
HINWEIS: Dieser Abschnitt enthält eine detaillierte Anleitung zur Installation der Anwendungsprogrammierschnittstelle (API) sowie der erforderlichen Protokolldesigneranwendung und des Kalibrierterminals. Die folgenden Anweisungen sind für einen Raspberry Pi (RPi) Einplatinencomputer geschrieben. aber auch Windows 8, 10 und macOS 10.13+ wurden erfolgreich mit der API und den Anwendungen verwendet.
- Richten Sie die Computerumgebung ein.
HINWEIS: Seien Sie mit den Grundlagen von Python39 vertraut, wie Sie einen Raspberry Pi40,41 einrichten und verwenden und wie Sie eine Verbindung zum Internet herstellen42. Die folgenden Tutorial-Schritte konzentrieren sich auf protokollspezifische Schritte und zusätzliche Informationen zur Verwendung eines Raspberry Pi sind online verfügbar40.- Öffnen Sie ein Terminalfenster über die Taskleiste oder das Anwendungsmenü.
- Aktualisieren Sie die Paketliste des Systems:
sudo apt-get Aktualisieren - Aktualisieren Sie alle installierten Pakete:
sudo apt-get dist-upgrade - Starten Sie den Raspberry Pi neu:
sudo Neustart - Überprüfen Sie die installierte Python-Version:
python3 --version
Stellen Sie sicher, dass mindestens Python 3.5 installiert ist. Wenn nicht, installieren Sie die neueste Version43. - Installieren Sie python pip, das Python-Pakete mit dem Python-Paket Index44 veröffentlicht:
sudo apt-get installieren python3-pip - Abhängigkeiten installieren:
pip installieren numpy
pip installieren python-resize-image
HINWEIS: Wenn Sie Windows verwenden, müssen Sie das Windows-curses-Paket installieren über: python -m pip install windows-curses
- Installieren Sie die Anwendungsprogrammierschnittstelle (API).
HINWEIS: Die API bietet ein einfaches Python-Framework, das entwickelt wurde, um experimentelle Protokolle zu schreiben und die Workstation zu betreiben. Die folgenden beiden APIs sind erforderlich, um den generierten Protokollcode erfolgreich auszuführen.- Workstation-API installieren:
pip install openworkstation - Installieren Sie Opentrons API, um das Pipettiermodul zu betreiben:
pip install opentrons==2.5.2 - Überprüfen Sie, ob die API erfolgreich installiert wurde:
Python3
>>> Import von Openworkstation
opentrons importieren >>>
HINWEIS: Die Größe der API und der Protokollentwurfsanwendung beträgt 2,2 MB bzw. 1,2 MB. Bei Verwendung mit begrenztem Speicherplatz (200 MB) traten während der Installation keine Probleme auf. Die Speicherplatzanforderungen hängen jedoch vom Betriebssystem ab.
- Workstation-API installieren:
- Wählen Sie ein Verzeichnis für den Dateidownload (Kalibrierterminal, Protokolldesignanwendung usw.).
HINWEIS: Dateien können anschließend kopiert und an anderer Stelle eingefügt werden. - Klonen Sie Dateien aus dem GitHub-Repository:
git klonen https://github.com/SebastianEggert/OpenWorkstation
HINWEIS: Der Befehl 'git clone' klont und speichert anschließend alle Dateien in dem Verzeichnis, das zu diesem Zeitpunkt im Terminal geöffnet ist. Da das Repository auch die Hardwaredateien für die Assembly enthält, ist nicht das gesamte Repository erforderlich, um die dargestellten Protokolle auszuführen. Alle erforderlichen Dateien zum Replizieren der Experimente stehen als Supplemental File und im GitHub-Repository unter "/examples/publication-JoVE" zur Verfügung. - Öffnen Sie den heruntergeladenen Ordner. Wenn das gesamte Repository heruntergeladen wurde, navigieren Sie zum Ordner 'publication-JoVE' über
cd openworkstation/beispiele/publikation-JoVE
HINWEIS: Dieser Ordner enthält Dateien, die für den Betrieb der Workstation und die Verwendung der Protokoll-Designer-Anwendung und des Kalibrierterminals erforderlich sind.
2. Hardware-Einrichtung
- Stellen Sie den Arbeitsplatz in eine biologische Sicherheitswerkbank, um eine Kontamination der Probe zu vermeiden.
- Installieren Sie Pipetten auf der Workstation.
- Wählen Sie die Pipettengröße basierend auf dem Versuchsaufbau aus. Nehmen Sie im Allgemeinen eine Pipettengröße, deren volumen sich am oberen ende des Bereichs befindet. Wenn für eine bestimmte Einrichtung Mischaufgaben mit Volumina von mehr als 1 ml erforderlich sind (z. B. Ansaugen/Dosieren von 2 ml), wählen Sie den M1000E mit einem maximalen Saug-/Dosiervolumen von 1.000 μL, um pipettierende Schritte zu minimieren und Zeit zu sparen.
HINWEIS: Eine detaillierte Anleitung für Luftverdrängungspipetten ist online verfügbar45. Das entwickelte Pipettiermodul ist in der Lage, die folgenden handelsüblichen Verdrängerpipetten zu integrieren: M10E (1–10 μL), M25E (3–25 μL), M50E (20–50 μL), M100E (10–100 μL), M250E (50–250 μL), M1000E (100–1.000 μL). - Verwenden Sie einen M4-Inbusschlüssel, um Schrauben zu lösen und festzuziehen.
- Befestigen Sie die beiden Pipettenbefestigungsplatten (weiße Acrylplatten) an der Aluminiumschiene und ziehen Sie die M5-Schrauben locker fest.
- Setzen Sie die Pipette in die beiden Pipettenbefestigungsplatten ein und stellen Sie sicher, dass der ergonomische Schwanz der Pipette auf der gegenüberliegenden Seite der Acrylbefestigungsplatte aufliegt.
- Ziehen Sie die vier Schrauben der beiden Pipettenbefestigungsplatten fest an.
- Schieben Sie die beiden quadratischen Befestigungsmuttern, die an der Acryl-Montageplatte befestigt sind, in den Extrusionsschlitz der z-Achse und ziehen Sie die Schrauben fest.
HINWEIS: Befestigen Sie die Pipette fest, um Bewegungen während des Betriebs zu vermeiden.
- Wählen Sie die Pipettengröße basierend auf dem Versuchsaufbau aus. Nehmen Sie im Allgemeinen eine Pipettengröße, deren volumen sich am oberen ende des Bereichs befindet. Wenn für eine bestimmte Einrichtung Mischaufgaben mit Volumina von mehr als 1 ml erforderlich sind (z. B. Ansaugen/Dosieren von 2 ml), wählen Sie den M1000E mit einem maximalen Saug-/Dosiervolumen von 1.000 μL, um pipettierende Schritte zu minimieren und Zeit zu sparen.
3. Materialaufbereitung
HINWEIS: Die viskosen Materialien (Glycerin, GelMA, Alginat) werden für die in dieser Studie vorgestellten Experimente verwendet, und daher sind vorbereitete Volumina und Handhabungsaufgaben (z. B. Hinzufügen von 5 ml Stammlösung in 5 ml Reaktionsröhrchen) speziell für diesen Versuchsaufbau.
- Gelatine Methacryloyl (GelMA)
HINWEIS: GelMA-Funktionalisierung, Dialyse und Lyophilisation sind nicht Gegenstand dieses Papiers, und ein Schritt-für-Schritt-Protokoll ist in Loessner et al.33 verfügbar. Das Protokoll beginnt mit lyophilisiertem GelMA, das im eigenen Haus zubereitet oder kommerziell gekauft werden kann.- Berechnen Sie die erforderliche Masse von GelMA (mGelMA) basierend auf der gewünschten Endstockkonzentration (cGelMA) und dem Volumen (VGelMA) unter Verwendung der Gleichung:
mGelMA = cGelMA x VGelMA
HINWEIS: VGelMA hängt vom Versuchsaufbau ab und es wird empfohlen, 20-30% überschüssiges Material vorzubereiten. Die vorgestellten Protokolle beginnen mit 5 ml 20% (w/v) GelMA als Stammlösung. - Wiegen Sie die erforderliche Menge an lyophilisiertem GelMA, geben Sie es in ein 50 ml Reaktionsröhrchen und fügen Sie die erforderliche Menge an phosphatgepufferter Kochsalzlösung (PBS) hinzu.
- Mischen Sie GelMA entweder durch Einweichen in das Lösungsmittel bei 4 °C über Nacht oder durch Erhitzen auf 60 °C für 6 h in einem Wasserbad.
HINWEIS: Sterile GelMA-Lösungen können mindestens sechs Monate lang lichtgeschützt bei 4 °C gelagert werden. - Füllen Sie 5 ml GelMA in 5 ml Reaktionsröhrchen.
- Berechnen Sie die erforderliche Masse von GelMA (mGelMA) basierend auf der gewünschten Endstockkonzentration (cGelMA) und dem Volumen (VGelMA) unter Verwendung der Gleichung:
- Photoinitiator: Lithiumphenyl-2,4,6-trimethylbenzoylphosphinat (LAP)
HINWEIS: Vermeiden Sie zusätzliche Raumlichteinwirkung, da LAP lichtempfindlich ist.- Berechnen Sie die erforderliche LAP-Masse (mLAP) basierend auf der gewünschten Endstockkonzentration (cLAP) und dem erforderlichen Volumen (VLAP) unter Verwendung der Gleichung:
mLAP = cLAP x VLAP
HINWEIS: Es wird empfohlen, eine 3% ige (w/v) Stammlösung herzustellen. - Wiegen Sie die erforderliche Menge LAP, geben Sie sie in ein 15-ml-Reaktionsröhrchen und fügen Sie PBS hinzu.
- Wickeln Sie das Röhrchen in Aluminiumfolie, um eine photoinduzierte Zersetzung zu verhindern.
- Lösen Sie LAP auf, indem Sie das Reaktionsröhrchen für 2 h oder bis zur vollständigen Auflösung in ein Wasserbad bei 37 °C legen.
- Füllen Sie 1 ml LAP-Stammlösung in 5-ml-Röhrchen.
- Berechnen Sie die erforderliche LAP-Masse (mLAP) basierend auf der gewünschten Endstockkonzentration (cLAP) und dem erforderlichen Volumen (VLAP) unter Verwendung der Gleichung:
- Alginat
- Berechnen Sie die erforderliche Menge an Alginat (Malginat) basierend auf der gewünschten Endgültigen Stammkonzentration (Calginat) und dem Volumen (Valginat) unter Verwendung der Gleichung:
malginate = calginate x Valginate
HINWEIS: Valginat hängt vom Versuchsaufbau ab und es wird empfohlen, 20-30% überschüssiges Material herzustellen. Die vorgestellten Protokolle beginnen mit 5 ml 4% (w/v) Alginat als Stammlösung. - Wiegen Sie die erforderliche Masse alginat, geben Sie es in ein 50 ml Reaktionsröhrchen und fügen Sie PBS hinzu.
- Die Alginatmischung für 4 h in ein Wasserbad bei 37 °C geben.
HINWEIS: Die Verwendung eines Wirbelmischers beschleunigt den Auflösungsprozess, erzeugt aber auch Luftblasen. Gelöstes Alginat kann bei 4 °C für mindestens sechs Monate gelagert werden. - Füllen Sie 5 ml Alginat in 5 mL Reaktionsröhrchen.
- Berechnen Sie die erforderliche Menge an Alginat (Malginat) basierend auf der gewünschten Endgültigen Stammkonzentration (Calginat) und dem Volumen (Valginat) unter Verwendung der Gleichung:
- Füllen Sie 5 ml Glycerin in 5 ml Reaktionsröhrchen.
- Orange G Lösung
- Bereiten Sie eine 10 mg/ml Stammlösung von Orange G in einem 50 ml Reaktionsröhrchen vor.
HINWEIS: Das Volumen hängt von der Anzahl der Experimente ab. Je nach Verdünnungsmitteltyp die Stammlösung entweder in Reinstwasser, PBS oder einem geeigneten Verdünnungsmittel herstellen. In den vorgestellten Experimenten wurde Reinstwasser zur Verdünnung von Glycerin und PBS zur Verdünnung von GelMA und Alginat verwendet. PBS wurde als Verdünnungsmittel für GelMA und Alginat verwendet und kann entweder mit Tabletten zubereitet oder von der Stange gekauft werden. - Mischen Sie für 10 s durch Wirbeln.
- Wickeln Sie das Röhrchen in Aluminiumfolie, um eine photoinduzierte Zersetzung zu verhindern.
HINWEIS: Die Stammlösung kann nach 24 h verwendet werden, um eine ordnungsgemäße Auflösung von Orange G zu gewährleisten. - Verdünnen Sie die Stammlösung zu einer 1 mg/ml Arbeitslösung in einem 50 ml Reaktionsröhrchen.
- Übertragen Sie die Arbeitslösung auf geeignete Kolben/Röhrchen für den Versuchsaufbau.
HINWEIS: Für die vorgestellten Experimente wurde die Arbeitslösung in 5 ml Röhrchen gefüllt. Orange G Stamm und Arbeitslösung können bei 4 °C gelagert und innerhalb von drei Monaten nach der Zubereitung verwendet werden. - Füllen Sie 5 ml der 1 mg/ml Orange G Arbeitslösung in 5 ml Reaktionsröhrchen.
- Bereiten Sie eine 10 mg/ml Stammlösung von Orange G in einem 50 ml Reaktionsröhrchen vor.
4. Generieren von Protokollcode mit der Protokoll-Designer-Anwendung
ANMERKUNG: Die in den Schritten 4.2−4.7 angegebenen Parameter sind für alle durchgeführten Versuche gleich, mit Ausnahme der Stammkonzentration des Materials und der Endgültigen Ausgangskonzentration. Diese Parameter sind in Tabelle 1 zusammengefasst und im Folgenden werden Parameter verwendet, um Doppelnetzwerkhydrogele mit 5% (w/v) GelMA, 2% (w/v) Alginat, 0,15% (w/v) LAP und PBS als Verdünnungsmittel herzustellen.
- Öffnen Sie die Protokoll-Designer-Anwendung, indem Sie 'ProtocolDesignApp.html' ausführen.
HINWEIS: Die App "ProtocolDesignApp.html" führt den Anwender durch den Parameterauswahlprozess und generiert automatisch das gebrauchsfertige Protokoll zur Bedienung der Workstation. Die Benutzeroberfläche läuft auf jedem gängigen Internetbrowser (z.B. Chrome, Firefox, Safari, Edge, Internet Explorer). - Geben Sie den Protokollnamen (z. B. Doppelnetzwerk-Hydrogele) auf der Setup-Seite ein.
- Klicken Sie auf "Weiter", um den Protokollnamen zu bestätigen und mit dem nächsten Schritt fortzufahren.
- Definieren Sie das Einzugsfach, indem Sie "3x4 Heizblock" aus dem Dropdown-Menü und den folgenden Eingabeparametern auswählen:
- Wählen Sie "Gel 1" aus dem Dropdown-Menü, geben Sie den Namen "GelMA" ein, geben Sie die Lagerkonzentration "20%" ein, legen Sie "Anzahl der Proben" auf "3" fest, um eine Spalte zu füllen. Klicken Sie auf '+hinzufügen', um Einträge zu speichern.
- Wählen Sie "Gel 2" aus dem Dropdown-Menü, geben Sie den Namen ein: "Alginat", geben Sie die Stammkonzentration "4%" ein, setzen Sie "Anzahl der Proben" auf "3", um eine Spalte zu füllen. Klicken Sie auf '+hinzufügen', um Einträge zu speichern.
- Wählen Sie "Photoinitiator" aus dem Dropdown-Menü, geben Sie den Namen ein: "LAP", geben Sie die Lagerkonzentration "3%" ein, setzen Sie "Anzahl der Proben" auf "3", um eine Spalte zu füllen. Klicken Sie auf '+hinzufügen', um Einträge zu speichern.
- Wählen Sie "Verdünnungsmittel 1" aus dem Dropdown-Menü, geben Sie den Namen ein: "PBS", setzen Sie "Anzahl der Proben" auf "3", um eine Spalte zu füllen. Klicken Sie auf '+hinzufügen', um Einträge zu speichern.
HINWEIS: Die Visualisierung des Eingabefachs wird automatisch aktualisiert, sobald auf "+Hinzufügen" geklickt wird. Wenn mehr Eingaben als die Kapazität des Fachs hinzugefügt werden, wird dem Benutzer die Warnung "Zu viele Proben für dieses Fach" angezeigt.
- Definieren Sie Vernetzungsparameter, indem Sie "Fotovernetzung" aktivieren und die Zeit in Sekunden, "30" und die Intensität W/m2 mit "2" eingeben.
- Beenden Sie die Eingabeeinrichtung, indem Sie auf "WEITER" klicken.
- Definieren Sie die Einrichtung des Ausgabefachs, indem Sie im Dropdown-Menü für den Well-Plattentyp "96 Well Plate" auswählen.
- Klicken Sie auf "Gruppe1", um Ausgaben zu definieren, indem Sie eine Gruppe von Stichproben erstellen.
- Geben Sie die Ausgangszusammensetzung an, indem Sie die gewünschten Konzentrationen und das Probenvolumen in die Felder für jede Eingabe eingeben: GelMA = '5', Alginat = '2', LAP = '0,15', Gesamtvolumen = '60'.
- Kontrollkästchen, um das erweiterte Mischprotokoll anzuwenden.
- Geben Sie die Anzahl der Proben an, indem Sie die Anzahl der Proben in das Feld "Anzahl der Proben" eingeben: "96".
HINWEIS: Die Visualisierung des Probenfachs wird automatisch aktualisiert, sobald auf "+Gruppe hinzufügen" geklickt wird. Wenn mehr Proben als die Kapazität des Fachs hinzugefügt werden, wird dem Benutzer die Warnung "Zu viele Proben für dieses Fach" angezeigt. - Beenden Sie die Ausgabeeinrichtung, indem Sie auf "WEITER" klicken.
- Wählen Sie die Ablageposition auf dem Decklayout und bereiten Sie die Plattform entsprechend vor:
- Aktivieren Sie das Häkchen im Feld "SLOT A1" und wählen Sie "Empty_Cell" aus dem Dropdown-Menü.
- Aktivieren Sie das Häkchen im Feld "SLOT A2" und wählen Sie "Trash_Cell" aus dem Dropdown-Menü.
- Aktivieren Sie das Häkchen im Feld 'SLOT B1' und wählen Sie 'Tips_Cell_100 μL' aus dem Dropdown-Menü.
- Aktivieren Sie das Häkchen im Feld 'SLOT B2' und wählen Sie 'Tips_Cell_1000 μL' aus dem Dropdown-Menü.
- Aktivieren Sie das Häkchen im Feld "SLOT C1" und wählen Sie "Input_Cell" aus dem Dropdown-Menü.
- Aktivieren Sie das Häkchen im Feld "SLOT C2" und wählen Sie "Empty_Cell" aus dem Dropdown-Menü.
- Aktivieren Sie das Häkchen im Feld "SLOT D1" und wählen Sie "Mixing_Cell" aus dem Dropdown-Menü.
- Aktivieren Sie das Häkchen im Feld "SLOT D2" und wählen Sie "Output_Cell" aus dem Dropdown-Menü.
- Definieren Sie Typ und Eigenschaften der ersten Pipette (M100E), indem Sie "Pipette links" aktivieren, "10-100μL Positive Displacement" aus dem Dropdown-Menü auswählen und die Sauggeschwindigkeit = '600', Dosiergeschwindigkeit = '800' einstellen.
- Definieren Sie Den Typ und die Eigenschaften der zweiten Pipette (M1000E), indem Sie "Pipette Right" aktivieren, "100-1000μL Positive Displacement" aus dem Dropdown-Menü auswählen und die Sauggeschwindigkeit = '800', Dosiergeschwindigkeit = '1200' einstellen.
- Klicken Sie auf 'GENERATE PROTOCOL', um die Einrichtung zu bestätigen und das Protokollskript zu generieren.
HINWEIS: Die entwickelte Protokoll-Designer-App generiert automatisch einen neuen Ordner, wenn ein neues Protokoll generiert wird. Alle Dateien, die für dieses Experiment und den Betrieb der Workstation benötigt werden, werden in diesem Ordner gespeichert, der nach dem Protokollnamen benannt ist. Der Ordner kann in verschiedene Verzeichnisse kopiert werden, ohne Probleme zu verursachen. - Schließen Sie die Schnittstelle nicht, da sie zum Ausführen des Protokolls verwendet wird (siehe Schritt 6.6.).
5. Kalibrierung des Pipettiermoduls
HINWEIS: Behälter (z. B. Brunnenplatten, Spitzengestell, Müll) und Pipetten (z. B. M1000E) müssen zunächst kalibriert werden. Wenn ein Behälter und/oder eine Pipettenposition geändert/geändert werden, muss die neue Position kalibriert werden.
- Navigieren Sie zum Protokollordner und öffnen Sie das Kalibrierterminal, indem Sie die Datei 'calibrate.py' in einer Klemme windox ausführen (siehe Schritt 1.1.1):
phython.calibrate.py
HINWEIS: Die Schnittstelle "calibrate.py" führt den Benutzer durch die Kalibrierung des Deck-Setups und der Pipetten. Stellen Sie sicher, dass sich die Datei im selben Ordner wie die Protokolldatei und die Moduldateien befindet. Sie wird in Schritt 4.10 automatisch generiert. - Wählen Sie bewegungsschritte für plungerx, y, z Bewegung mit der numerischen Tastatur (1−8): '1' für 0,1 mm, '2' für 0,5 mm, '3' für 1 mm, '4' für 5 mm, '5' für 10, '6' für 20 mm, '7' für 40 mm und '8' für 80 mm.
- Kalibrieren Sie die Pipette.
- Drücken Sie die Tastenkombination P , um die Pipettengröße auszuwählen.
- Drücken Sie die Tastenkombination V , um in den Kolbenkalibrierungsmodus zu wechseln.
HINWEIS: Es wird empfohlen, mit kleinen Schritten (2, 5 und 10 mm) zu beginnen, um sich mit der Inkrementgröße und der Bewegungswirkung des Pipettenkopfes vertraut zu machen. - Kalibrieren Sie die folgenden Kolbenpositionen für eine Verdrängerpipette: T–Top = Ruheposition; B–Bottom = Kolben wird gedrückt, bis der Widerstand erreicht ist; P–Pick-up = Kolben wird in eine Position geschoben, in der eine Kolbenspitze angebracht werden kann; E–Eject = Kolben wird gedrückt, bis eine angebrachte Spitze ausgeworfen wird. Variieren Sie die Kolbenpositionen mit den Pfeilen nach oben und unten auf der Tastatur und speichern Sie die endgültige Position mit S auf der Tastatur.
- Verlassen Sie den Pipettenkolben-Kalibrierungsmodus, indem Sie die Tastenkombination V drücken.
- Kalibrieren Sie die Behälterposition relativ zur Pipettenspitze.
- Drücken Sie die Tastenkombination P , um den Pipettentyp auszuwählen. Stellen Sie sicher, dass eine Spitze mit dem ausgewählten Pipettier verbunden ist.
- Drücken Sie die Tastenkombination C , um den Containertyp auszuwählen.
- Wählen Sie ein geeignetes Bewegungsinkrement und bewegen Sie die Pipettenspitze an die folgenden Positionen. Kalibrieren Sie bei Bohrlochplatten auf die Bohrlochposition "A1" an der Unterseite. Kalibrieren Sie für das Spitzenrack auf die Position "A1"; Wählen Sie für den Papierkorb eine Position (definiert als Punkt), an der die Spitze in den Papierkorb geworfen werden kann.
- Drücken Sie die Tastenkombination S , um die Position zu speichern.
- Wiederholen Sie die Schritte 5.3.1 bis 5.3.3 für alle Behälter, die für den ausgewählten Pipettentyp unter 'C' aufgeführt sind.
- Wiederholen Sie 5.3.1−5.3.5 für den zweiten Pipettentyp.
- Schließen Sie das Kalibrierungsskript.
6. Protokollausführung mit der Workstation
HINWEIS: Auf Protokolldateien kann über das Repository zugegriffen werden und sie sind auch als Ergänzende Datei verfügbar.
- Positionieren Sie Müllbehälter, Kippregale, Einzugsfach, Mischwanne und Ausgang auf dem Deck (definiert in Schritt 4.3).
- Kalibrieren Sie Pipetten und Instrumente gemäß Abschnitt 5.
- Schalten Sie bei Bedarf das Temperatur-Dock EIN und wählen Sie die Temperatur für Eingang und Mischfach.
ANMERKUNG: Die Experimente in diesem Tutorial wurden ohne Temperaturregelung und bei 40 °C für Glycerin und 37 °C für GelMA und Alginatpipettieren durchgeführt. - Positionieren Sie Rohre mit Eingangsreagenzien in den Aluminiumblöcken auf den Temperaturdocks entsprechend dem gewählten Setup.
- Warten Sie, bis die Eingangsreagenzien die gewünschte Temperatur erreicht haben.
HINWEIS: Um eine korrekte Temperaturverteilung zu gewährleisten, wird für GelMA und Alginat eine Inkubationszeit von 30 min empfohlen. - Führen Sie die Protokolldatei aus, indem Sie auf 'RUN PYTHON SCRIPT' klicken
HINWEIS: Das ausgewählte Protokoll wird nun von der Workstation ausgeführt. Das begleitende Video zeigt das automatisierte Mischen von GelMA und die Verteilung von 60 μL in eine 96-Well-Platte. - Der Lauf ist abgeschlossen, wenn 'Beendet' angezeigt wird.
7. Validierungs- und Verifizierungsprozess
- Entfernen Sie die Bohrlochplatte von der Workstation und transportieren Sie die Vertiefungsplatte mit den Proben zu einem Spektralphotometer.
- Ablesen der Absorption mit einem Spektralphotometer bei 450 nm. Lesen Sie jede Platte 2x, um die Ergebnisse zu vergleichen und konsistente Ergebnisse sicherzustellen.
- Exportieren und speichern Sie Absorptionswerte.
- Datenanalyse.
HINWEIS: Experimentelle Daten können einzeln verarbeitet oder kopiert und in die bereitgestellte Vorlage eingefügt werden, um den Mittelwert, die Standardabweichung und den CV-Wert (Coefficient of Variance) mithilfe von Tabellenkalkulationssoftware zu bewerten.- Öffnen Sie die Supplemental File 'supplementary_template-analysis.xlsx", die auch im GitHub-Repository unter 'openworkstation/examples/publication-JoVE abrufbar ist.
- Kopieren Sie die Absorptionswerte in das "Rohdatenblatt", stellen Sie sicher, dass alle Zellbezüge in allen Tabellen korrekt definiert sind, und klicken Sie auf das Analyseblatt, um Informationen zu den Werten für Durchschnitt, Standardabweichung und Varianzkoeffizient (CV) zu erhalten.
HINWEIS: Abhängig von der Stichprobenverteilung auf einer Bohrlochplatte stehen mit der Vorlage die folgenden voreingestellten Auswertungstypen zur Verfügung: Der Typ "Uniform" wird verwendet, wenn alle Stichproben die gleiche Zusammensetzung haben, der Typ "Nach Zeilen" wird verwendet, wenn Stichproben in verschiedenen Zeilen unterschiedliche Zusammensetzungen aufweisen, der Typ "Nach Spalten" wird verwendet, wenn Stichproben in verschiedenen Spalten unterschiedliche Zusammensetzungen aufweisen, und der Typ "Customized" wird verwendet, wenn die Stichprobenpositionen benutzerspezifisch sind.
Ergebnisse
Dieses Tutorial präsentiert Ergebnisse für Experimente mit Glycerin (Abbildung 3) und GelMA mit LAP und Alginat (Abbildung 4).
Die Erzeugung einer 80%igen (v/v) Glycerinlösung wurde entweder ohne Temperaturregelung (Raumtemperatur, 22 °C) und ohne Spitzenberührung (definiert als Setup 1), mit Temperaturregelung (40 °C) und ohne Spitzenberührung (Setup 2) oder mit Temperaturregelung (40 °C) und mit Spitzenberührung (Setup 3) untersucht (Abbildung 3a-i). Diese beiden Temperatureinstellungen wurden gewählt, um den Unterschied in der Handhabung zu bewerten, da die Viskosität von Glycerin bei Erwärmung von 22 °C (139,5 mPa·s) auf 40 °C (46,6 mPa·s)30 fast um den Faktor 3 abnimmt. Eine 85%ige (v/v) Stammlösung von Glycerin wurde auf eine Endkonzentration von 80% verdünnt und gleichmäßig in eine 96-Well-Platte (n = 96 pro Aufbau) verteilt. Die Versuchszeit, die das Dosieren jedes Materials in das Mischungsröhrchen, die jeweiligen Mischaufgaben und die Probenverteilung in eine 96-Well-Platte umfasst, betrug 30 min 42 s. Um Unterschiede zwischen Verdünnungsmischungen zu identifizieren, wurde Reinstwasser – als Verdünnungsmittel für Glycerin – mit 1 mg/ml Orange G hergestellt. Die Absorptionswerte zeigen, dass die Integration der Temperaturregelung und der Spitzenberührung die Gemische erheblich beeinflusst (p < 0,0001). Zusätzlich zur durchgeführten Zwei-Wege-Varianzanalyse (ANOVA) wurden die CV-Werte berechnet, um die relative Standardabweichung zu bewerten. Der Variationskoeffizient beschreibt einen standardisierten Indikator zur Bestimmung des Abweichungsgrades im Verhältnis zum Mittelwert und wird als Prozentsatz ausgedrückt. Wenn nicht die Probenmittelwerte von Interesse sind, sondern die Variabilität innerhalb der Messungen, liefert der Variationskoeffizient zusätzliche Erkenntnisse zur Identifizierung reproduzierbarer Gemische46. Innerhalb dieses Experiments mit drei verschiedenen Setups zeigten die Absorptionswerte abnehmende CV-Werte von 5,6%, 4,2% bis 2,0% für Setup 1, Setup 2 bzw. Setup 3, was den signifikanten Einfluss des Temperaturdocks und der Tip-Touch-Funktion auf die Erzeugung zuverlässiger Ergebnisse zeigt (Abbildung 3a-ii). Das Aufzeichnen von Probenabsorptionswerten für Setup 3 (Probennummer #1 bis #96 in einer 96-Well-Platte) ergibt während des gesamten Experiments keine steigenden oder abnehmenden Werte und zeigt daher keinen Einfluss der Probenposition auf die Absorptionswerte (Abbildung 3a-iii). Die Visualisierung der Daten für jede gemessene Bohrlochplatte mit Heatmaps bietet zusätzliche Einblicke, um Heterogenitäten für eine bestimmte Zeile oder Spalte oder variierende Absorptionswerte während der gesamten Dosieraufgaben zu identifizieren. Die visualisierten Heatmaps für die drei Setups zeigen eine verringerte Heterogenität über die gesamten Bohrlochplatten von Setup 1 bis Setup 3 (Abbildung 3b). Schließlich wurde die Replizierbarkeit der leitungsgeführten Mischung innerhalb von acht unabhängigen Durchläufen bewertet (Abbildung 3c-i,ii), wobei jeder Lauf 6 min 57 s dauerte. Einzelne Mischläufe zeigten niedrige CV-Werte zwischen 1,1% bis 2,6%, was auf sehr zuverlässige Misch- und Dosieraufgaben für die einzelnen Durchläufe hinweist. Absorptionswerte aller acht Durchläufe ergaben einen CV-Wert von 3,3% und zeigten die Reproduzierbarkeit des etablierten Mischprotokolls.
GelMA-Verdünnungsreihen wurden hergestellt, indem eine 20% (w/v) Stammlösung mit PBS auf 14, 12, 10, 8, 6, 4, 2 und 0% (w/v) verdünnt und LAP auf eine konstante Konzentration von 0,15% (w/v) gegeben wurde (Abbildung 4a-i), was insgesamt 55 min 12 s dauerte. Wie im experimentellen Protokollskript angegeben, vernetzte sich das Hydrogel für 30 s mit einer Intensität von 2,0 mW/cm2 bei 400 nm. Um die Unterschiede zwischen den Mischungen zu bewerten, wurde PBS – als Verdünnungsmittel für GelMA und Alginat – mit 1 mg/ml Orange G hergestellt. Die gemessenen Absorptionswerte der einzelnen Konzentrationsschritte sind signifikant unterschiedlich (p < 0,0001) und haben sehr niedrige CV-Werte zwischen 1,2% und 3,4% während der gesamten Konzentrationsschritte (n = 12 pro Konzentrationsschritt). Die lineare Regression zeigte eine hohe Übereinstimmung mit einem R²-Wert von 0,9869 (Abbildung 4a-ii) und eine Heatmap bestätigte die homogene Verteilung für jede Konzentration und die Differenz zwischen den Konzentrationen (Abbildung 4a-iii). Das automatisierte Mischen von vier Reagenzien wurde zur Erzeugung von 5% (w/v) GelMA, 2% (w/v) Alginat, 0,15% (w/v) LAP und PBS als Verdünnungsmittel ohne (Setup 2) und mit (Setup 3) Touch-Spitze (n = 96 für jeden Aufbau) mit den gleichen Vernetzungsparametern (30 s, 2,0 mW/cm2, 400 nm) durchgeführt. Das Dosieren der vier Materialien, das Mischen und Verteilen in eine 96-Well-Platte dauerte 32 min 22 s. Alle Experimente mit GelMA und Alginat wurden bei 37 °C durchgeführt, um eine thermische Gelierung zu verhindern, die das Pipettieren von GelMA verhindert. Mit der Tip-Touch-Option konnte der CV-Wert von 5,2 % auf 3,4 % gesenkt und insbesondere Ausreißer im unteren Bereich durch entfernendes überschüssiges Material aus der Spitze verhindert werden (Abbildung 4b-i). Obwohl der Mittelwert von 1,927 und 1,944 für Setup 2 und Setup 3 sehr nahe beieinander liegt, hebt der Variationskoeffizient die abnehmende Abweichung im Verhältnis zum Mittelwert hervor. Einzelne Zeilen der 96-Well-Platte können mithilfe einer Heatmap-Visualisierung miteinander verglichen werden, um Zeilen- und/oder Spaltenunterschiede zu erkennen (Abbildung 4b-ii).
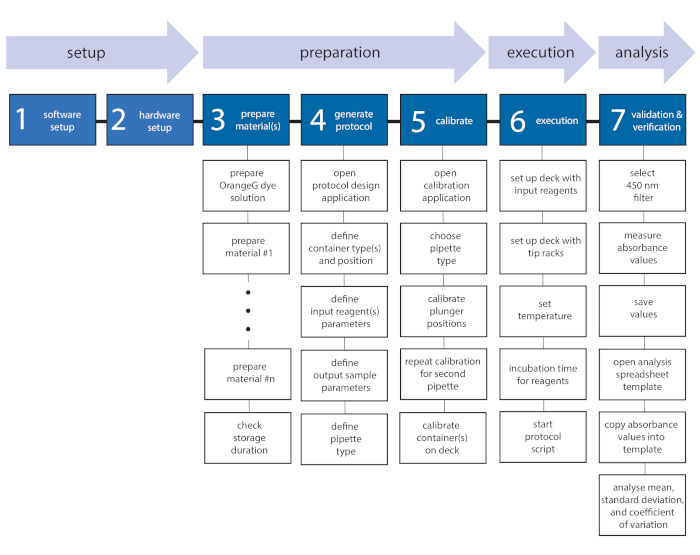
Abbildung 1: Protokollworkflow mit einzelnen Aufgaben. Der beschriebene Workflow ist in sieben Aufgaben unterteilt, die in Setup, Vorbereitung, Ausführung und Analyse unterteilt sind. Am Anfang müssen sowohl die Software (Task 1) als auch die Hardware (Task 2) eingerichtet werden. Nach der Vorbereitung der Materialien (Aufgabe 3) und der Generierung des Protokollskripts (Aufgabe 4) wird das Pipettiermodul durch Definition der Pipetten- und Behälterpositionen kalibriert (Aufgabe 5). Als nächstes wird das Protokollskript auf der Workstation ausgeführt (Aufgabe 6) und die Validierung und Verifizierung (Aufgabe 7) von Gemischen zur Bewertung von Gemischen durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
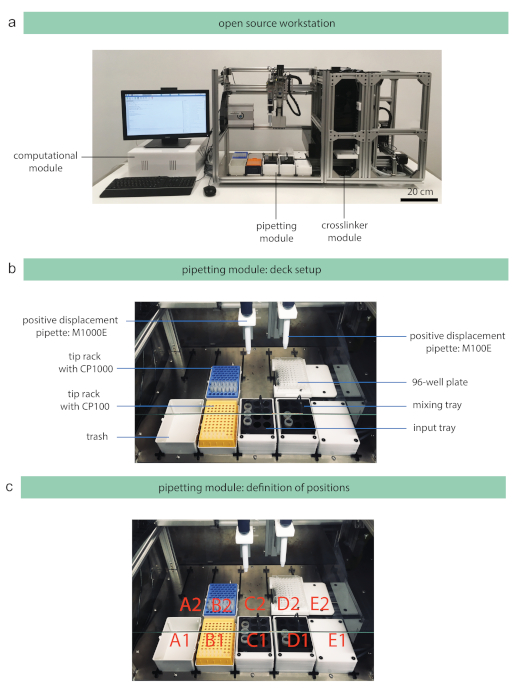
Abbildung 2: Open-Source-Workstation- und Deck-Setup des Pipettiermoduls. (a) Die entwickelte Workstation ist von einem Fließbandansatz inspiriert, bei dem Proben durch verschiedene Module transportiert werden, und besteht aus den folgenden Modulen: Pipettieren, Vernetzer, Lagerung, Transport und Rechenmodul. (b) Das Deck des Pipettiermoduls wird in Abhängigkeit von der Versuchsanordnung (z. B. Wellplattentyp, Rohrvolumen usw.) aufgebaut. Der dargestellte Deckaufbau wurde für die vorgestellten Experimente verwendet und besteht aus Verdrängerpipetten mit einem Bereich von 10−100 μL (M100E) und 100−1.000 μL (M1000E), den Spitzengestellen mit Kapillarkolben (CP) für 100 μL (CP1000) und 1.000 μL (CP1000), einem Müllcontainer, einem Mischtablett und einem Einzugsfach für die Eingangsreagenzien. (c) Die verfügbaren Deckpositionen werden mit den angezeigten Nummern definiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
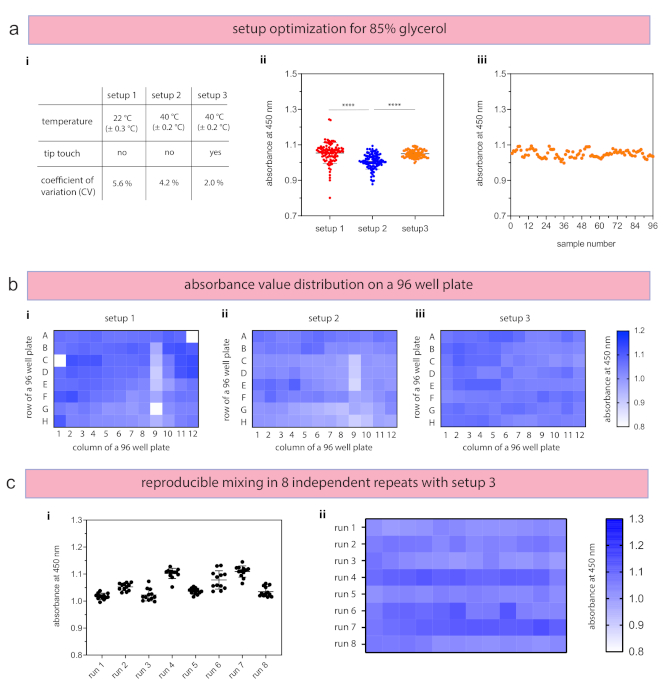
Abbildung 3: Ergebnisse für das automatisierte Pipettieren von Glyceringemischen. (a) Das flexible Arbeitsplatzdesign ermöglicht die Bewertung von drei verschiedenen Setups (i) um optimale Parameter für reproduzierbare Ergebnisse zu identifizieren. (ii) Die Zugabe einer Spitzenberührung und das Erhitzen des Materials führten zu einem verringerten Varianzkoeffizienten (CV) und hochreproduzierbaren Mischungen für Den Aufbau 3. Jedes Experiment wurde mit 96 Proben durchgeführt. (iii) Die Darstellung einzelner Probenwerte zeigte keinen Einfluss auf die Pipettierreihenfolge. (b) Die experimentellen Ergebnisse jedes Aufbaus wurden mit Heatmaps visualisiert, um den Einfluss auf Roh-/Säulenunterschiede, Kanten oder Master-Mischungen zu identifizieren. (c) Die Reproduzierbarkeit von Setup 3 wurde innerhalb von acht unabhängigen Durchläufen unter Verwendung von (i) Median, Standardabweichung, CV-Wert und (ii) Heatmaps analysiert. Die Daten in den Panels a-ii (n = 96) und b-i (n = 12) werden mit den Mittelwerten und den einzelnen Datenpunkten dargestellt. Die statistische Signifikanz wurde als ****p < 0,0001 unter Verwendung der Zwei-Wege-Varianzanalyse (ANOVA) definiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
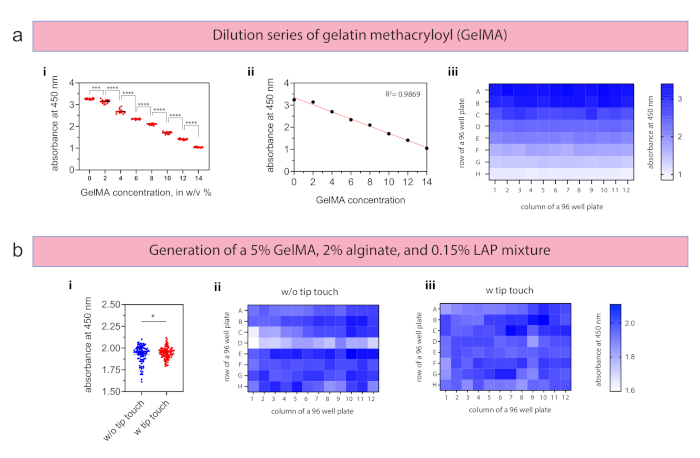
Abbildung 4: Ergebnisse für Mischaufgaben mit Hydrogelen. (a) Aus einer Gelatine-Metacryloyl (GelMA) 20% (w/v) Stammlösung wurde innerhalb eines Versuchslaufs eine serielle Verdünnung von 14, 12, 10, 8, 6, 4, 2 und 0% (w/v) unter Verwendung einer 96 Well Plate (n = 12 pro Konzentration) erzeugt. (i) Die Werte des Varianzkoeffizienten (CV) variierten zwischen 1,2 % und 3,4 % während der gesamten hergestellten Konzentrationen, und (ii) die lineare Regression zeigte eine hohe Übereinstimmung mit einem R²-Wert von 0,9869. (iii) Homogene Verdünnungen wurden mit der erzeugten Heatmap visuell bestätigt. (b) Doppelnetzwerkhydrogele wurden mit 5 % (w/v) GelMA, 2 % (w/v) Alginat und 0,15 % (w/v) LAP (i) mit und ohne Spitzenberührung (n = 96 für jeden Aufbau) erzeugt und für 30 s mit einer Intensität von 2,0 mW/cm2 bei 400 nm vernetzt. Die Integration des Tip Touch führte zu sinkenden CV-Werten von 5,2% auf 3,4%. ii,iii) Heatmaps bestätigen weniger Abweichungen bei der Verwendung von Tip Touch, um überschüssiges Material von der Spitze zu entfernen. Die Daten in den Panels a-i und b-i werden mit den Mitteln und den einzelnen Datenpunkten dargestellt. Die statistische Signifikanz wurde definiert als *p < 0,05, ***p < 0,001 und ****p < 0,0001 mittels Einweg-Varianzanalyse (ANOVA). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Zusammenfassung des Pipettentypunterschieds und der Probleme mit viskosen Biomaterialien. (a) Das Reagenz und der Kolben sind durch ein Luftkissen getrennt, das während der Dosierschritte schrumpft und sich während der Saugschritte ausdehnt. Beim Ansaugen und Dosieren viskoser Materialien führt der langsame "Fluss" zu Problemen wie Luftblasen und unregelmäßigem Pipettierverhalten. b) Verdrängerpipetten ermöglichen ein zuverlässiges Absaugen und Dosieren von viskosem Material durch Verwendung eines Kolbens in der Spitze. c) Das Pipettieren von hochviskosen Materialien (z. B. 4 % (w/v) Alginat) kann zur Ansammlung von überschüssigem Material auf der Spitze führen, was zu Ungenauigkeiten während der gesamten Versuche führt. (d) Die Implementierung eines einfachen Tip-Touch-Trays ermöglicht das Entfernen des überschüssigen Materials auf der Spitze und führt zu genauen Saug- und Dosiervolumina. Dies wird durch die Verwendung der Innenseite des Well-Plate-Deckels realisiert, die auf einem Tip-Rack-Behälter platziert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Material #1 (Lagerkonzentration) | Endkonzentration des Materials #1 | Material #2 (Lagerkonzentration) | Endkonzentration des Materials #2 | Materialien #3 (Lagerkonzentration) | Endkonzentration des Materials #3 | Verdünnungsmittel (Orange G Arbeitslösung) | Endgültige Orange G-Konzentration im Gemisch | In Abbildung dargestellt |
| Glycerin (85% (w/v)) | 80% (w/v) | Wasser (1 mg/ml Orange G) | 0,059 mg/ml | Abbildung 3a−c | ||||
| GelMA (20% (w/v)) | 0% (w/v) | LAP (3% (w/v)) | 0,15% (w/v) | PBS (1 mg/mL Orange G) | 1 mg/ml | Abbildung 4a | ||
| GelMA (20% (w/v)) | 2% (w/v) | LAP (3% (w/v)) | 0,15% (w/v) | PBS (1 mg/mL Orange G) | 0,85 mg/ml | Abbildung 4a | ||
| GelMA (20% (w/v)) | 4% (w/v) | LAP (3% (w/v)) | 0,15% (w/v) | PBS (1 mg/mL Orange G) | 0,75 mg/ml | Abbildung 4a | ||
| GelMA (20% (w/v)) | 6% (w/v) | LAP (3% (w/v)) | 0,15% (w/v) | PBS (1 mg/mL Orange G) | 0,65 mg/ml | Abbildung 4a | ||
| GelMA (20% (w/v)) | 8% (w/v) | LAP (3% (w/v)) | 0,15% (w/v) | PBS (1 mg/mL Orange G) | 0,55 mg/ml | Abbildung 4a | ||
| GelMA (20% (w/v)) | 10% (w/v) | LAP (3% (w/v)) | 0,15% (w/v) | PBS (1 mg/mL Orange G) | 0,45 mg/ml | Abbildung 4a | ||
| GelMA (20% (w/v)) | 12% (w/v) | LAP (3% (w/v)) | 0,15% (w/v) | PBS (1 mg/mL Orange G) | 0,35 mg/ml | Abbildung 4a | ||
| GelMA (20% (w/v)) | 14% (w/v) | LAP (3% (w/v)) | 0,15% (w/v) | PBS (1 mg/mL Orange G) | 0,25 mg/ml | Abbildung 4a | ||
| GelMA (20% (w/v)) | 5% (w/v) | Alginat (4% (w/v)) | 2% (w/v) | LAP (3% (w/v)) | 0,15% (w/v) | PBS (1 mg/mL Orange G) | 0,2 mg/ml | Abbildung 4b |
Tabelle 1: Parameterübersicht für die durchgeführten Experimente.
| Protokollschritt | Problem | Möglicher Grund | Lösung |
| 1.1 | Software kann nicht installiert oder aktualisiert werden | Auf der SD-Karte entfällt der Speicherplatz | Überprüfen Sie den Speicherplatz auf der SD-Karte. Entfernen Sie bei Bedarf unnötige Gegenstände, leeren Sie den Papierkorb oder verwenden Sie eine SD-Karte in geeigneter Größe. |
| 1.2 | API kann nicht installiert werden | Die Installationsfähigkeit des Benutzers ist eingeschränkt (keine Root-Benutzerberechtigung) | Verwenden Sie den Befehl 'sudo' vor den angegebenen Befehlen, um Administratorrechte zu erhalten. Unter Linux wird diese Art des Zugriffs als Superuser bezeichnet. |
| 3.1 | Probleme mit GelMA | Funktionalisierung, Dialyse oder Lyophilisation | Detailliertes Schritt-für-Schritt-Protokoll inklusive Fehlerbehebungsliste verfügbar in Loessner et al.33. |
| 5.1 und 6.2 | Workstation reagiert nicht auf Befehle | Verbindungsprobleme | Drehen Sie alles ab und fahren Sie den Computer herunter. Schalten Sie das Netzteil für 10 s aus. Power-Computer und Workstation wieder eingeschaltet. |
| 5.1 und 6.2 | Workstation reagiert nicht auf Befehle | Verbindungsprobleme | Überprüfen Sie, ob der Computer die USB-Verbindung erkennt und der USB-Anschluss korrekt definiert ist. Stellen Sie sicher, dass die Firewall den Verbindungsvorgang nicht verhindert (siehe Link unter Tabelle 2). |
| 5.1 und 6.2 | Datei kann nicht geöffnet werden | Falsches Verzeichnis | Überprüfen Sie den Director (Ordnerpfad), um sicherzustellen, dass der richtige Pfad verwendet wird. Wenn eine Datei (z. B. interface.py) nicht gefunden werden kann, ist es wahrscheinlich, dass der falsche Pfad verwendet wird. |
| 6.6.2 | Die Spitze ist nicht richtig befestigt oder fällt während der Bewegung | Problem mit der Kalibrierung | Wiederholen Sie die Kalibrierschritte für die Pipette und stellen Sie sicher, dass der Kapillarkolben ordnungsgemäß mit der Pipette verbunden ist. |
| 6.6.2 | Die Spitze ist nicht richtig befestigt oder fällt während der Bewegung | Problem mit Anhängen | Die Pipette ist nicht richtig mit der Pipettenachse verbunden und bewegt sich während der Bewegungsschritte. Schrauben Fest anziehen, um dies zu verhindern. |
| 6.6.2 | Die Spitze saugt über dem Material auf | Problem mit der Kalibrierung | Wiederholen Sie die Kalibrierung dieses Fachtyps, um die Höhe richtig zu definieren. |
| 6.6.2 | Die Spitze saugt über dem Material auf | Problem mit der Kalibrierung | Überprüfen Sie die Lautstärke im Rohr, und stellen Sie sicher, dass die Lautstärke der in der Protokoll-Designer-Anwendung definierten Lautstärke entspricht. |
| 6.6.2 | Material taucht während der Bewegung ein | Zu viel überschüssiges Material an der Spitze | Tipp-Touch-Dock-Option hinzufügen; optional kann auch die Zeit für die Spitzenberührung erhöht werden. |
| 6.6.2 | Material ist fest oder zu viskos für das Pipettieren | Thermoresponsives Verhalten des Materials | Überprüfen Sie die thermoresponsive Materialcharakterisierung und passen Sie die Heiz- / Kühltemperatur des Temperaturdocks entsprechend an. |
| https://support.opentrons.com/en/articles/2687601-c-having-trouble-connecting-try-this-basic-troubleshooting | |||
Tabelle 2: Fehlerbehebungstabelle mit identifizierten Problemen, möglichen Gründen sowie Lösungen zur Lösung der Probleme.
Ergänzende Datei. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das Pipettieren von viskosen Materialien, insbesondere Hydrogelen für biomedizinische Anwendungen19,20,21,33,47, sind Routineaufgaben in vielen Forschungslabors, um eine benutzerdefinierte Konzentration oder eine Verdünnungsreihe mit unterschiedlichen Konzentrationen herzustellen. Obwohl es sich wiederholt und die Ausführung eher einfach ist, wird es meist manuell mit geringem Stichprobendurchsatz durchgeführt18. Dieses Tutorial stellt die Bedienung einer Open-Source-Workstation vor, die speziell für viskose Materialien entwickelt wurde, um das automatisierte Mischen viskoser Materialien zur reproduzierbaren Erzeugung gewünschter Konzentrationen zu ermöglichen. Diese Workstation ist für das Pipettieren von Hydrogelen optimiert, um eine automatisierte und äußerst zuverlässige Handhabung durch die Integration von Temperaturdocks für thermoresponsive Materialien, Verdrängerpipetten für viskose Materialien und einem optionalen Tip Touch Dock zum Entfernen von überschüssigem Material von der Spitze zu ermöglichen. Das Pipettiermodul wurde speziell optimiert, um die standardisierte und automatisierte Bearbeitung von viskosem Material zu ermöglichen. Im Vergleich zu Luftkissenpipetten (Abbildung 5a) dosieren Verdrängerpipetten (Abbildung 5b) viskose Materialien, ohne Restmaterial in der Spitze zu belassen, was zu genauen Saug- und Dosiervolumina führt. Das optionale Tip Touch Dock entfernt überschüssiges Probenmaterial aus der Spitze (Abbildung 5c,d), das für klebrige Materialien (z. B. 4% (w/v) Alginat) nützlich ist.
Die Protokolldesigner-Anwendung wurde speziell für Hydrogele programmiert und ermöglicht die Verdünnung von bis zu vier Reagenzien mit unterschiedlichen Konzentrationen und bis zu zwei Verdünnungsmitteln. Das Risiko von Fehlern bei der Berechnung der Endverdünnungen wird in dieser Anwendung vermieden, da die Benutzer nur die gewünschte Konzentration oder die seriellen Verdünnungsschritte wählen. Erforderliche Ansaug- und Dosiermengen werden automatisch berechnet, in einer separaten Dokumentationstextdatei gespeichert und dann in das Protokollskript eingegeben. Diese Protokolldesign-Anwendung gibt dem Benutzer die volle Kontrolle über alle experimentellen Parameter (z. B. Pipettiergeschwindigkeit) und gewährleistet die interne Dokumentation der wichtigen Parameter. Die Protokolldesign-App berücksichtigt den Füllstand des Reservoirs (z. B. gut) und variiert die Saug- / Dosierhöhe, um ein unnötiges Eintauchen in die viskosen Materialien zu vermeiden. Diese integrierte Funktion vermeidet Materialansammlungen an der Außenwand der Spitze und gewährleistet so zuverlässige Saug- und Dosieraufgaben während des gesamten Protokolls. Obwohl die Protokolldesigner-Anwendung für Hydrogel-Verdünnungsschritte entwickelt wurde, kann sie auch zur Verdünnung von nichtviskosen Flüssigkeiten wie Orange G-Farbstoffen verwendet werden. Die Protokoll-Designer-Anwendung, die über das Repository unter '/examples/publication-JoVE' zugänglich ist, ist die Version, die im Protokollabschnitt erklärt und im Video hervorgehoben wird. Diese Version wird nicht aktualisiert. Eine aktualisierte Version der Protokoll-Designer-Anwendung ist jedoch über die Haupt-Repository-Seite verfügbar. Die Kalibrierklemme wurde ursprünglich von Sanderson48 entwickelt und für die Kalibrierung von Verdrängerpipetten optimiert.
Wie im Protokollabschnitt 4 beschrieben, müssen sowohl Pipetten als auch Behälter zunächst kalibriert werden. Dieser Kalibrierungsprozess ist entscheidend, um die Positionen zu definieren und zu speichern, die dann zur Berechnung der Bewegungsschritte verwendet werden. Daher hängt eine erfolgreiche Protokollausführung von klar definierten Kalibrierpositionen ab, da falsche Kalibrierpunkte zum Absturz der Spitze in einen Behälter führen können. Da die Kolbenpositionen der Pipetten manuell kalibriert werden müssen, hängen Pipettiergenauigkeit und -präzision stark von der durchgeführten Kalibrierung ab. Diese Kalibrierungsverfahren hängen stark von der Benutzererfahrung mit dem Pipettiermodul ab, und daher wird zu Beginn eine Schulung mit erfahrenem Personal empfohlen, um ordnungsgemäße Kalibrierverfahren sicherzustellen. Zusätzlich zur manuellen Kalibrierung am Pipettiermodul muss die Pipette selbst kalibriert werden, um ein genaues Pipettieren zu gewährleisten. Es wird empfohlen, die Pipetten mindestens alle 12 Monate zu kalibrieren, um die Akzeptanzkriterien gemäß ISO 8655 zu erfüllen. Um die Pipettenkalibrierung intern zu bewerten, sind Validierung und Verifizierung verfügbar, wie von Stangegaard et al.16 beschrieben.
Für die Generierung eines zuverlässigen Datensatzes ist es entscheidend, mit Reagenzien von hoher Qualität zu beginnen. Dies ist besonders wichtig für Hydrogelverarbeitungsaufgaben, da sich Batch-to-Batch-Variationen auf die generierten Ergebnisse innerhalb dieses Protokolls auswirken können. Neben Batch-to-Batch-Variationen können auch subtile Änderungen bei der Vorbereitung kleiner Volumina zu Eigenschaftsunterschieden beitragen. Um dies zu verhindern, empfiehlt sich die Vorbereitung größerer Volumina, die für die gesamten Experimente verwendet werden können.
Die Validierungs- und Verifizierungsverfahren beruhen auf der Verwendung eines Farbstoffs, um zuverlässige Gemische zu identifizieren. Das vorgestellte Protokoll beschreibt die Anwendung von Orange G, aber der allgemeine Protokoll- und Analyseablauf kann auch an Fluoreszenzfarbstoffe angepasst werden49,50. Die Verwendung von Orange G reduziert die technischen Anforderungen an das Spektralphotometer und eliminiert Vorsichtsmaßnahmen, die getroffen wurden, um ein Bleichen der Fluoreszenzfarbstoffe nach Lichteinwirkung zu verhindern. Probleme im Auflösungsverhalten oder in der Clusterbildung des Farbstoffs wurden bei den vorgestellten Materialien während der Experimente nicht beobachtet, können aber bei anderen Materialien auftreten. Eine mögliche Clusterbildung und damit die Wechselwirkung zwischen Farbstoff und Material ließe sich leicht mit einem Mikroskop nachweisen.
Die in diesem Tutorial vorgestellten Verfahren und Techniken erweitern aktuelle Workflows für viskose Materialien um Automatisierungsfunktionen, um äußerst zuverlässige Aufgaben mit minimalem Arbeitsaufwand zu erfüllen. Die bereitgestellte Fehlerbehebungstabelle (Tabelle 2) enthält identifizierte Probleme und zeigt mögliche Gründe sowie Lösungen zur Lösung der Probleme auf. Die vorgestellte Workstation wurde erfolgreich auf natürliche (Gelatine, Gellangummi, Matrigel) und synthetische (z.B. Poly(ethylenglykol) [PEG], Pluronic F127, Lutrol F127) polymere Materialien für automatisierte Pipettieraufgaben angewendet. Insbesondere die Kombination aus einer Open-Source-Workstation und einer Open-Source-Protokolldesignanwendung für viskose Materialien wird für Forscher in den Bereichen Biomedizintechnik, Materialwissenschaften und Mikrobiologie sehr nützlich sein.
Offenlegungen
CM und DWH sind Gründer und Aktionäre von Gelomics Pty Ltd. CM ist auch direktor von Gelomics Pty Ltd. Die Autoren erklären keinen Interessenkonflikt, der für das Thema dieses Artikels relevant ist. Die Autoren haben keine anderen relevanten Verbindungen oder finanziellen Beteiligungen an einer Organisation oder einem Unternehmen mit einem finanziellen Interesse an oder einem finanziellen Konflikt mit dem Thema oder den Materialien, die in dem Artikel diskutiert werden, mit Ausnahme der offengelegten.
Danksagungen
Die Autoren danken den Mitgliedern des Zentrums für Regenerative Medizin am QUT, insbesondere Antonia Horst und Pawel Mieszczanek für ihre hilfreichen Anregungen und rückmeldungen. Diese Arbeit wurde durch den Postgraduate Research Award des QUT für SE und vom Australian Research Council (ARC) im Rahmen der Finanzhilfevereinbarung IC160100026 (ARC Industrial Transformation Training Centre in Additive Biomanufacturing) unterstützt. NB wurde von einem Peter Doherty Early Career Research Fellowship (APP1091734) des National Health and Medical Research Council (NHMRC) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 reaction tubes | Fisher Scientific, Inc. (USA) | 14-959-53A | |
| 5 mL tubes | Pacific Laboratory Products Australia Pty. Ltd. (Australia) | SCT-5ML | size depends on experimentl protocol; also Eppies (0.5, 1, 1.5 mL) or Falcon tubes (15, 50mL) can be used; product is manufactured by Axygen, Inc. https://www.pacificlab.com.au/shop/tubes-plastic/sct-5ml-tubewith-screwcap-blue-unassembled-5ml-self-standing/1/name |
| 50 mL reaction tubes | Fisher Scientific, Inc. (USA) | 14-432-22 | |
| 70% w/w Ethanol | LabChem, Inc. (USA) | aja726-5Lpl | |
| 96-well plate | Thermo Fisher Scientific, Inc. (USA) | https://www.thermofisher.com/order/catalog/product/168055 | |
| Alginate | NovaMatrix | 4200001 | https://www.novamatrix.biz/store/pronova-up-lvg/ |
| Demineralized or ultrapure (MilliQ) water | |||
| Gelatin methacryloyl (GelMA) | Synthetized in-house | detailed protocol (incl materials and references) is available in Loessner et al. (2016), Nature Protocols. https://www.nature.com/articles/nprot.2016.037 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich, Inc. (USA) | 900889 | |
| M4 and M5 Allen key | OpenBuilds, inc. (USA) | 179, 190 | also available in every hardware store. https://openbuildspartstore.com/allen-wrench/ |
| OrangeG | Fisher Scientific (USA) | O267-25 | https://www.fishersci.com/shop/products/orange-g-certified-biological-stain-fisher-chemical/O26725 |
| Phosphate-buffered saline (PBS) | Thermo Fisher Scientific, Inc. (USA) | 14190-144 | alternativly: PBS tablets: 18912014 (Thermo Fisher Scientific) |
| Equipment | |||
| Aluminium blocks for temperature dock | Ratek Instruments Pty. Ltd. (Australia) | SB16 | blocks for different tube sizes are available. http://www.ratek.com.au/products/SB16-Block-with-12x16mm-holes.html |
| Analytical balance | Sartorius AG (Germany) | ED224S | |
| Open source liquid handling robot: commercial product | Opentrons Laboratories, Inc. (USA) | OT-One S Pro | https://shop.opentrons.com/products/ot-one-pro |
| Open source liquid handling robot: open source hardware | Assembled in-house following an open source approach | hardware and software files are freely accessible on GitHub and Zenodo (links provided); building instructions are provided. https://github.com/SebastianEggert/OpenWorkstation. https://zenodo.org/record/3612757#.XipEjBV7F24 | |
| Positive displacement pipette: MicromanE | Gilson, Inc. (USA) | FD10006 | depends on required size. https://www.gilson.com/default/shop-products/pipettes/positive-displacement.html |
| Spectrophotometer | BMG LABTECH GmbH (Germany) | CLARIOstar | |
| Tips: capillary pistons | Gilson, Inc. (USA) | F148180 | depends on required size. https://www.gilson.com/default/shop-products/pipette-tips.html?technique_en_ww_lk=191 |
Referenzen
- Jarvis, M. F., Williams, M. Irreproducibility in Preclinical Biomedical Research: Perceptions, Uncertainties, and Knowledge Gaps. Trends in Pharmacological Sciences. 37 (4), 290-302 (2016).
- Collins, F. S., Tabak, L. A. Policy: NIH plans to enhance reproducibility. Nature. 505 (7485), 612-613 (2014).
- Freedman, L. P., Cockburn, I. M., Simcoe, T. S. The economics of reproducibility in preclinical research. PLoS Biology. 13 (6), 1-9 (2015).
- Niepel, M., et al. A Multi-center Study on the Reproducibility of Drug-Response Assays in Mammalian Cell Lines. Cell Systems. 9 (1), 35-48 (2019).
- Prinz, F., Schlange, T., Asadullah, K. Believe it or not: how much can we rely on published data on potential drug targets. Nature Reviews Drug Discovery. 10 (9), 712(2011).
- Baker, M. 1,500 scientists lift the lid on reproducibility. Nature. 533 (7604), 452-454 (2016).
- Begley, C. G., Ellis, L. M. Raise standards for preclinical cancer research. Nature. 483 (7391), 531-533 (2012).
- Sena, E. S., van der Worp, H. B., Bath, P. M. W., Howells, D. W., Macleod, M. R. Publication Bias in Reports of Animal Stroke Studies Leads to Major Overstatement of Efficacy. PLoS Biology. 8 (3), 1000344(2010).
- Ioannidis, J. P. A., Kim, B. Y. S., Trounson, A. How to design preclinical studies in nanomedicine and cell therapy to maximize the prospects of clinical translation. Nature Biomedical Engineering. 2 (11), 797-809 (2018).
- Enserink, M. Sloppy reporting on animal studies proves hard to change. Science. 357 (6358), 1337-1338 (2017).
- Freedman, L. P., Inglese, J. The Increasing Urgency for Standards in Basic Biologic Research. Cancer Research. 74 (15), 4024-4029 (2014).
- Lippi, G., Lima-Oliveira, G., Brocco, G., Bassi, A., Salvagno, G. L. Estimating the intra- and inter-individual imprecision of manual pipetting. Clinical Chemistry and Laboratory Medicine (CCLM). 55 (7), 962-966 (2017).
- Hentz, N. G., Knaide, T. R. Effect of Liquid-Handling Accuracy on Assay Performance. Journal of Laboratory Automation. 19 (2), 153-162 (2014).
- Reason, J. Understanding adverse events: human factors. Quality and Safety in Health Care. 4 (2), 80-89 (1995).
- Schober, L., et al. Cell Dispensing in Low-Volume Range with the Immediate Drop-on-Demand Technology (I-DOT). Journal of Laboratory Automation. 20 (2), 154-163 (2015).
- Stangegaard, M., Hansen, A. J., Frøslev, T. G., Morling, N. A Simple Method for Validation and Verification of Pipettes Mounted on Automated Liquid Handlers. Journal of Laboratory Automation. 16 (5), 381-386 (2011).
- Crombie, D. E., et al. Development of a Modular Automated System for Maintenance and Differentiation of Adherent Human Pluripotent Stem Cells. SLAS Discovery. 22 (8), 1016-1025 (2017).
- Eggert, S., Hutmacher, D. W. In vitro disease models 4.0 via automation and high-throughput processing. Biofabrication. 11 (4), 043002(2019).
- Malda, J., et al. 25th Anniversary Article: Engineering Hydrogels for Biofabrication. Advanced Materials. 25 (36), 5011-5028 (2013).
- Zhang, Y. S., Khademhosseini, A. Advances in engineering hydrogels. Science. 356 (6337), (2017).
- Kratochvil, M. J., et al. Engineered materials for organoid systems. Nature Reviews Materials. 4 (9), 606-622 (2019).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Pati, F., et al. Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink. Nature Communications. 5, 1-11 (2014).
- Gao, G., Huang, Y., Schilling, A. F., Hubbell, K., Cui, X. Organ Bioprinting: Are We There Yet. Advanced Healthcare Materials. 7 (1), 1701018(2018).
- Schuurman, W., et al. Gelatin-Methacrylamide Hydrogels as Potential Biomaterials for Fabrication of Tissue-Engineered Cartilage Constructs. Macromolecular Bioscience. 13 (5), 551-561 (2013).
- Lim, K. S., et al. New Visible-Light Photoinitiating System for Improved Print Fidelity in Gelatin-Based Bioinks. ACS Biomaterials Science and Engineering. 2 (10), 1752-1762 (2016).
- Müller, M., et al. Development and thorough characterization of the processing steps of an ink for 3D printing for bone tissue engineering. Materials Science and Engineering C. 108, 110510(2020).
- Sewald, L., et al. Beyond the Modification Degree: Impact of Raw Material on Physicochemical Properties of Gelatin Type A and Type B Methacryloyls. Macromolecular Bioscience. 18 (12), 1-10 (2018).
- Eggert, S., Mieszczanek, P., Meinert, C., Hutmacher, D. W. A modular open source technology for automated in vitro workflows. Zenodo. , (2020).
- Volk, A., Kähler, C. J. Density model for aqueous glycerol solutions. Experiments in Fluids. 59 (5), 75(2018).
- Zhang, H., Grinstaff, M. W. Recent Advances in Glycerol Polymers: Chemistry and Biomedical Applications. Macromolecular Rapid Communications. 35 (22), 1906-1924 (2014).
- Klotz, B. J., Gawlitta, D., Rosenberg, A. J. W. P., Malda, J., Melchels, F. P. W. Gelatin-Methacryloyl Hydrogels: Towards Biofabrication-Based Tissue Repair. Trends in Biotechnology. 34 (5), 394-407 (2016).
- Loessner, D., et al. Functionalization, preparation and use of cell-laden gelatin methacryloyl-based hydrogels as modular tissue culture platforms. Nature Protocols. 11 (4), 727-746 (2016).
- Ansari, S., et al. Regulation of the fate of dental-derived mesenchymal stem cells using engineered alginate-GelMA hydrogels. Journal of Biomedical Materials Research Part A. 105 (11), 2957-2967 (2017).
- Axpe, E., Oyen, M. Applications of Alginate-Based Bioinks in 3D Bioprinting. International Journal of Molecular Sciences. 17 (12), 1976(2016).
- Ma, X., et al. 3D printed micro-scale force gauge arrays to improve human cardiac tissue maturation and enable high throughput drug testing. Acta Biomaterialia. 95, 319-327 (2019).
- Bas, O., et al. Rational design and fabrication of multiphasic soft network composites for tissue engineering articular cartilage: A numerical model-based approach. Chemical Engineering Journal. 340, 15-23 (2018).
- O'Connell, C. D., et al. Tailoring the mechanical properties of gelatin methacryloyl hydrogels through manipulation of the photocrosslinking conditions. Soft Matter. 14 (11), 2142-2151 (2018).
- LearnPython.org. , Available from: https://www.learnpython.org (2020).
- Raspberry Pi Foundation: Using your Raspberry Pi. , Available from: https://projects.raspberrypi.org/en/projects/raspberry-pi-using (2020).
- Raspberry Pi Foundation: Setting up your Raspberry Pi. , Available from: https://projects.raspberrypi.org/en/projects/raspberry-pi-setting-up/4 (2020).
- Raspberry Pi Foundation: Connect your Raspberry Pi. , Available from: https://projects.raspberrypi.org/en/projects/raspberry-pi-setting-up/3 (2020).
- Python Software Foundation: python.org. , Available from: https://www.pthon.org (2020).
- Python Software Foundation: pypi.org. , Available from: https://pypi.org (2020).
- Opentrons Labworks, Inc: Installing pipettes. , Available from: https://support.opentrons.com/en/articles/689945-installing-pipettes (2020).
- Kang, C. W., Lee, M. S., Seong, Y. J., Hawkins, D. M. A Control Chart for the Coefficient of Variation. Journal of Quality Technology. 39 (2), 151-158 (2007).
- Annabi, N., et al. 25th Anniversary Article: Rational Design and Applications of Hydrogels in Regenerative Medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Theo Sanderson: OpenTronsTerminalCalibration. , Available from: https://github.com/theosanderson/OpentronsTerminalCalibration (2020).
- Rhode, H., et al. An Improved Method for Checking HTS/uHTS Liquid-Handling Systems. Journal of Biomolecular Screening. 9 (8), 726-733 (2004).
- Taylor, P. B., et al. A Standard Operating Procedure for Assessing Liquid Handler Performance in High-Throughput Screening. Journal of Biomolecular Screening. 7 (6), 554-569 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten