Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Charakterisierung der Intra-Knorpel-Transporteigenschaften von Kationischen Peptidträgern
In diesem Artikel
Zusammenfassung
Dieses Protokoll bestimmt die Gleichgewichtsaufnahme, die Penetrationstiefe und die Nicht-Gleichgewichtsdiffusionsrate für kationische Peptidträger im Knorpel. Die Charakterisierung der Transporteigenschaften ist entscheidend für die Gewährleistung einer effektiven biologischen Reaktion. Diese Methoden können für die Entwicklung eines optimal geladenen Arzneimittelträgers zur Ausrichtung negativ geladener Gewebe angewendet werden.
Zusammenfassung
Mehrere negativ geladene Gewebe im Körper, wie Knorpel, stellen eine Barriere für die gezielte Medikamentenabgabe aufgrund ihrer hohen Dichte von negativ geladenen Aggrecans dar und erfordern daher verbesserte Targeting-Methoden, um ihre therapeutische Reaktion zu erhöhen. Da Knorpel eine hohe negative feste Ladungsdichte aufweist, können Medikamente mit positiv geladenen Arzneimittelträgern modifiziert werden, um elektrostatische Wechselwirkungen zu nutzen, was einen verbesserten Intra-Knorpel-Drogentransport ermöglicht. Die Untersuchung des Transports von Drogenträgern ist daher von entscheidender Bedeutung für die Vorhersage der Wirksamkeit von Arzneimitteln bei der Induktion einer biologischen Reaktion. Wir zeigen das Design von drei Experimenten, die die Gleichgewichtsaufnahme, die Penetrationstiefe und die Nicht-Gleichgewichtsdiffusionsrate von kationischen Peptidträgern in Knorpelexaten quantifizieren können. Gleichgewichtsaufnahmeexperimente liefern ein Maß für die gelöste Konzentration innerhalb des Knorpels im Vergleich zu seinem umgebenden Bad, was nützlich ist, um das Potenzial eines Arzneimittelträgers bei der Verbesserung der therapeutischen Konzentration von Medikamenten im Knorpel vorherzusagen. Die Tiefenderdringungsstudien mittels konfokaler Mikroskopie ermöglichen die visuelle Darstellung der 1D-gelösten Diffusion von der oberflächlichen in die tiefe Knorpelzone, was wichtig für die Beurteilung ist, ob Solutes ihre Matrix- und Zellzielstellen erreichen. Nicht-Gleichgewichtsdiffusionsratenstudien mit einer kundenspezifischen Transportkammer ermöglichen die Messung der Stärke von Bindungswechselwirkungen mit der Gewebematrix, indem die Diffusionsraten fluoreszierend markierter Gelöstheitim Gewebe charakterisiert werden; dies ist vorteilhaft für die Gestaltung von Trägern mit optimaler Bindungsfestigkeit mit Knorpel. Zusammen liefern die Ergebnisse der drei Transportexperimente eine Richtlinie für die Entwicklung optimal aufgeladener Arzneimittelträger, die schwache und reversible Ladungsinteraktionen für Arzneimittelabgabeanwendungen nutzen. Diese experimentellen Methoden können auch angewendet werden, um den Transport von Drogen und Drogenträger-Konjugaten zu bewerten. Darüber hinaus können diese Methoden für den Einsatz bei der Ausrichtung auf andere negativ geladene Gewebe wie Meniskus, Hornhaut und den Glaskörper Humor angepasst werden.
Einleitung
Die Medikamentenabgabe an negativ geladene Gewebe im Körper bleibt eine Herausforderung aufgrund der Unfähigkeit von Medikamenten, tief in das Gewebe einzudringen, um Zell- und Matrix-Zielstellen zu erreichen1. Einige dieser Gewebe bestehen aus dicht gepackten, negativ geladenen Aggrecanen, die eine hohe negative feste Ladungsdichte (FCD)2 im Gewebe erzeugen und als Barriere für die Abgabe der meisten Makromoleküle3,4fungieren. Mit Hilfe von positiv geladenen Drogenträgern kann diese negativ geladene Gewebebarriere jedoch tatsächlich über elektrostatische Ladungswechselwirkungen für die nachhaltige Medikamentenabgabe1,5,6,7( Abbildung1) in ein Arzneimitteldepot umgewandelt werden.
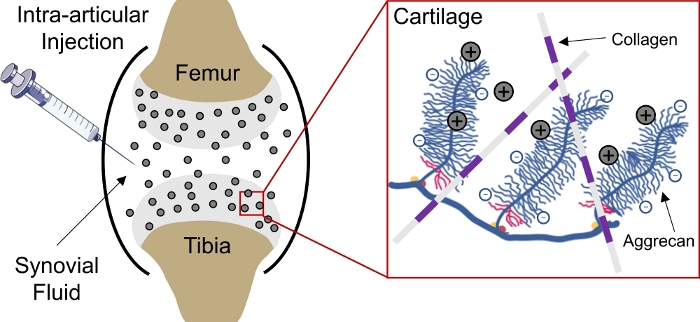
Abbildung 1: Gebührenbasierte Intraknorpellieferung von CPCs. Intraartikuläre Injektion von CPCs in den Kniegelenksraum. Elektrostatische Wechselwirkungen zwischen positiv geladenen CPCs und negativ geladenen Aggrecangruppen ermöglichen eine schnelle und vollständige Tiefendurchdringung durch Knorpel. Diese Zahl wurde von Vedadghavami et al4geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Kürzlich wurden kurzdurchdachte kationische Peptidträger (CPCs) mit dem Ziel entwickelt, kleine kationische Domänen zu schaffen, die größere Therapeutika zur Abgabe an den negativ geladenen Knorpel4transportieren können. Für eine wirksame Medikamentenabgabe an den Knorpel zur Behandlung von vorherrschenden8,,9 und degenerativen Erkrankungen wie Arthrose (OA)10ist es entscheidend, dass therapeutische Konzentrationen von Medikamenten tief in das Gewebe eindringen, wo ein Großteil der Knorpelzellen (Chondrozyten)11liegen. Obwohl es mehrere potenzielle Krankheit modifizierende Medikamente zur Verfügung, keine haben FDA-Zulassung erhalten, weil diese nicht in der Lage sind, effektiv den Knorpel12,13. Daher ist die Bewertung der Transporteigenschaften von Arzneimittelträgern notwendig, um die Wirksamkeit von Medikamenten bei der Induktion einer therapeutischen Reaktion vorherzusagen. Hier haben wir drei separate Experimente entwickelt, die zur Beurteilung der Gleichgewichtsaufnahme, der Penetrationstiefe und der Nicht-Gleichgewichtsdiffusionsrate von CPCs4verwendet werden können.
Um eine ausreichende Wirkstoffkonzentration im Knorpel zu gewährleisten, die eine optimale therapeutische Reaktion bieten kann, wurden Aufnahmeexperimente entwickelt, um die Gleichgewichtskonzentration der CPC im Knorpel zu quantifizieren4. Bei dieser Konstruktion kann nach einem Gleichgewicht zwischen dem Knorpel und seinem umgebenden Bad die Gesamtmenge der Gelösten im Knorpel (entweder an die Matrix gebunden oder frei) anhand eines Aufnahmeverhältnisses bestimmt werden. Dieses Verhältnis wird berechnet, indem die Konzentration der Gelösten im Knorpel auf die des Gleichgewichtsbades normalisiert wird. Grundsätzlich hätten neutrale Gelösthemmer, deren Diffusion durch den Knorpel nicht durch Ladungswechselwirkungen unterstützt wird, ein Aufnahmeverhältnis von weniger als 1. Umgekehrt weisen kationische Gelöste, deren Transport durch elektrostatische Wechselwirkungen verbessert wird, ein Aufnahmeverhältnis von mehr als 1 auf. Wie bei CPCs gezeigt, kann die Verwendung einer optimalen positiven Ladung jedoch zu wesentlich höheren Aufnahmeverhältnissen (größer als 300)4führen.
Obwohl eine hohe Medikamentenkonzentration im Knorpel wichtig ist, um therapeutischen Nutzen zu erzielen, ist es auch wichtig, dass Medikamente durch die volle Dicke des Knorpels diffundieren. Daher sind Studien erforderlich, die die Tiefe der Penetration zeigen, um sicherzustellen, dass Medikamente tief in den Knorpel gelangen, so dass die Matrix- und zellulären Zielstellen erreicht werden können, wodurch eine effektivere Therapie ermöglicht wird. Dieses Experiment wurde entwickelt, um die einseitige Diffusion von Gelösten durch Knorpel zu bewerten und die Diffusion von Medikamenten in Knorpel nach intraartikulärer Injektion in vivo zu simulieren. Fluoreszenz-Bildgebung mittels konfokaler Mikroskopie ermöglicht die Beurteilung der Eindringtiefe in Knorpel. Die Nettopartikelladung spielt eine Schlüsselrolle bei der Moderation, wie tiefe Medikamente durch die Matrix diffundieren können. Eine optimale Nettoladung auf Basis eines Gewebe-FCD ist erforderlich, um schwach-reversible Bindungswechselwirkungen zwischen kationischen Partikeln und der anionischen Gewebematrix zu ermöglichen. Dies impliziert, dass jede Wechselwirkung schwach genug ist, so dass Teilchen sich von der Matrix trennen können, aber in der Natur reversibel sind, so dass sie an eine andere Matrixbindungsstelle tiefer im Gewebe binden kann4. Umgekehrt kann eine übermäßige positive Nettoladung eines Teilchens schädlich gegenüber der Diffusion sein, da eine zu starke Matrixbindung das Ablösen von Partikeln von der ursprünglichen Bindungsstelle in der oberflächlichen Zone des Knorpels verhindert. Dies würde zu einer unzureichenden biologischen Reaktion führen, da die Meisten Der Zielstellen tief im Gewebe liegen11.
Um die Stärke der Bindungswechselwirkungen weiter zu quantifizieren, ist die Analyse der Wirkstoffdiffusionsraten durch Knorpel von Vorteil. Nicht-Gleichgewichtsdiffusionsstudien ermöglichen den Vergleich von Echtzeitdiffusionsraten zwischen verschiedenen Gelösten. Da Medikamente durch die oberflächlichen, mittleren und tiefen Zonen des Knorpels diffundieren, kann das Vorhandensein von Bindungswechselwirkungen die Diffusionsraten stark verändern. Wenn Bindungswechselwirkungen zwischen Medikamenten und der Knorpelmatrix vorhanden sind, wird sie als effektive Diffusivität (DEFF) definiert. In diesem Fall wird, sobald alle Bindungsstellen belegt sind, die Diffusionsrate von Medikamenten durch die stationäre Diffusion (DSS)bestimmt. Der Vergleich zwischen dem DEFF verschiedener Gelöster bestimmt die relative Bindungsfestigkeit von Gelösten mit der Matrix. Wenn sich die DEFF und DSS innerhalb derselben Größenordnung befinden, bedeutet dies für einen bestimmten Solute, dass es eine minimale Bindung zwischen dem Medikament und der Matrix während der Diffusion gibt. Wenn DEFF jedoch größer als DSSist, besteht eine wesentliche Bindung von Partikeln an die Matrix.
Die konzipierten Experimente ermöglichen individuell die Charakterisierung des gelösten Transports durch den Knorpel, jedoch ist eine ganzheitliche Analyse aller Ergebnisse erforderlich, um einen optimal aufgeladenen Drogenträger zu konstruieren. Die schwache und reversible Natur von Ladungswechselwirkungen steuert die Partikeldiffusionsrate und ermöglicht eine hohe Gleichgewichtsaufnahme und eine schnelle Volltiefe penetration durch Knorpel. Durch Gleichgewichtsaufnahmeexperimente sollten wir nach Trägern suchen, die eine hohe Aufnahme als Ergebnis von Ladungswechselwirkungen aufweisen, die mit Nicht-Gleichgewichtsdiffusionsratenstudien überprüft werden können. Diese Bindungswechselwirkungen sollten jedoch schwach und reversibel sein, um eine vollständige Dicke des Gelösten durch Knorpel zu ermöglichen. Ein idealer Arzneimittelträger würde eine optimale Ladung besitzen, die eine starke Bindung für die Aufnahme und hohe Intra-Knorpel-Medikamentenkonzentrationen ermöglicht, aber nicht zu stark, um die Volldicke diffusion zu behindern4. Die vorgestellten Experimente werden bei den Konstruktionsmerkmalen für ladungsbasierte Gewebe-Targeting-Medikamenteträger helfen. Diese Protokolle wurden zur Charakterisierung des CPC-Transports durch Knorpel4verwendet, können jedoch auch auf eine Vielzahl von Medikamenten und Drogenträgern durch Knorpel und andere negativ geladene Gewebe angewendet werden.
Protokoll
Für die Durchführung von Experimenten mit abgestorbenem Gewebe wurden zulassungen von der Universität eingeholt. Rinderfugen wurden kommerziell aus einem Schlachthof gewonnen.
1. Knorpelexplantation
- Mit einem Skalpell (#10 Klinge), schneiden und entfernen Sie Fett, Muskeln, Bänder, Sehnen und alle anderen Bindegewebe, um den Knorpel aus der femoropatellaren Nut der RinderKniegelenke zu belichten.
- Mit 3 mm und 6 mm dermalen Stempeln, machen senkrechte Stempel in den Knorpel, um zylindrische Stecker zu extrahieren. Legen Sie die Stecker sofort in einzelne Brunnen einer 48-Well-Platte, die 500 l 1x Phosphat gepufferte Kochsaline (PBS) enthält, ergänzt durch 1% v/v Antimykotik.
- Legen Sie die oberflächliche Seite eines Knorpelsteckers nach unten in einen Brunnen in die Schneidvorrichtung (Abbildung 2). Schneiden Sie mit einer Rasierklinge den Stecker entlang der Oberfläche der Schneidevorrichtung, um ein 1 mm dickes Knorpelexplant zu erhalten, das die oberflächliche Zone einschließt. Wiederholen Sie dies für jeden Knorpelstecker.
- Knorpelexplante einzeln in Polypropylen-Röhren lagern, die 500 l 1x PBS enthalten, ergänzt mit Protease-Inhibitoren (PBS-PI, 1 PI Mini-Tablette pro 50 ml 1x PBS) bei -20 °C.
- Bevor Sie die folgenden Transportexperimente durchführen, die explanthaltigen Fläschchen 30 min in einem 37 °C-Wasserbad auftauen.
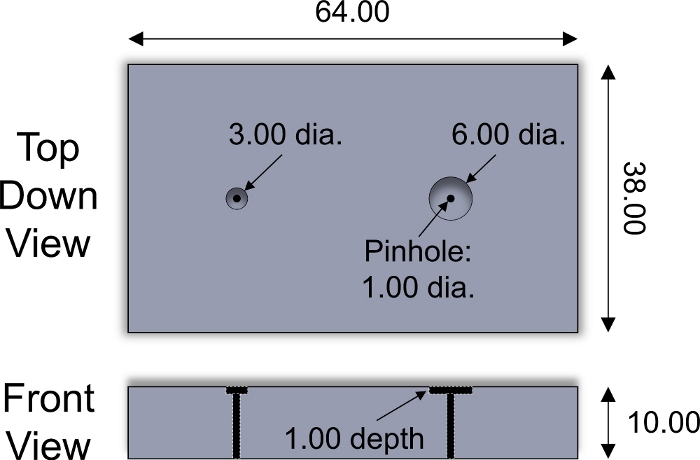
Abbildung 2: Maßgeschneiderte Schneidevorrichtung. Konstruktionsparameter der Edelstahl-Schneidvorrichtung, die zum Schneiden von Knorpelexpflanzen mit 3 und 6 mm Durchmesser verwendet wird. Kunststoffeinsätze unterschiedlicher Dicke wurden in Brunnen platziert, um die Dicke der in Scheiben geschnittenen Explants anzupassen. Edelstahl-Zylinderstift mit <1 mm Durchmesser wurde verwendet, um Explant aus der Halterung zu schieben. Alle numerischen Werte werden in mm dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Gleichgewichtsaufnahme von CPCs im Knorpel
- Zahngedünnte Knorpelexplantationen (3 mm Durchmesser X 1 mm dick)mit einem empfindlichen Aufgabenwisch, um überschüssige 1x PBS von der Explantoberfläche zu entfernen. Mit einem Gleichgewicht, schnell das Nassgewicht jeder Explant aufzeichnen und dann sofort in ein 1x PBS Bad legen, um Austrocknung zu verhindern.
- Bereiten Sie 30 -M-Lösungen (300 l pro Explantation) von fluoreszierend gekennzeichneten CPCs in 1x PBS-PI vor. Verwenden Sie RNase-freie Polypropylen-Rohre für die Rekonstitution.
- In einer 96-Well-Platte, Pipette 300 l von jeder 30-M-CPC-Lösung in separaten Brunnen. Vermeiden Sie die Verwendung von Brunnen in der Nähe des Rands der Platte, um Verdunstung zu verhindern. Übertragen Sie mit einem Spachtel jede Explantation in die Lösung, die Brunnen enthält.
- Füllen Sie umliegende Brunnen mit 300 l 1x PBS und bedecken Sie die Wellplatte mit Deckel. Versiegeln Sie die Kanten der Platte mit einem flexiblen Film, um die Verdunstung zu minimieren.
- Legen Sie die Platte im Inneren eines 37 °C-Inkubators auf einen Plattenstreuer, um die Partikelsedimentation zu begrenzen. 24 h unter sanfter Rotation inkubieren (50 U/min bei einer Umlaufbahn von 15 mm), um die Gleichgewichtsaufnahme von CPCs im Knorpel zu ermöglichen (Abbildung 3).
- Generieren einer Standardkurve für die Korrelation von Fluoreszenz mit CPC-Konzentration
- Bereiten Sie serielle Verdünnungen von CPC-Lösungen von 30 m – 0 m (10 2-fache Verdünnungen) in 1x PBS-PI in Polypropylen-Rohren vor. Stellen Sie sicher, dass mindestens 500 l jeder Verdünnung vorhanden sind.
- Fügen Sie 200 l jeder Verdünnung zu aufeinanderfolgenden Brunnen in einer schwarzen 96-Well-Platte hinzu. Duplizieren Sie in einer anderen Zeile, um die Stichprobengröße zu erhöhen.
- Erhalten Sie Fluoreszenzwerte jeder Probe mit einem Plattenleser an den Anregungs- und Emissionswellenlängen des Fluoreszenzetiketts mit einem Plattenleser.
- Plotfluoreszenzmessung vs. CPC-Konzentration und ableiten eine Gleichung für den linearen Teil der Kurve.
ANMERKUNG: Um die Variabilität der Fluoreszenzwerte zu begrenzen, inkubieren Sie die CPC-Lagerlösung unter den gleichen Bedingungen wie die Probenplatte vor der Erzeugung der Standardkurve.
- Nach 24 h Inkubation das Gleichgewichtsbad von jedem Brunnen in separaten Polypropylenröhren sammeln.
- Übertragen Sie 200 l jeder Lösung in separate Brunnen einer schwarzen 96-Well-Platte. Erhalten Sie Fluoreszenzwerte jeder Probe unter den gleichen Fluoreszenzeinstellungen wie für die Standardkurve. Verdünnen Sie die Probe ggf. in 1x PBS-PI, um sicherzustellen, dass die Messwerte innerhalb des linearen Teils der Standardkurve liegen.
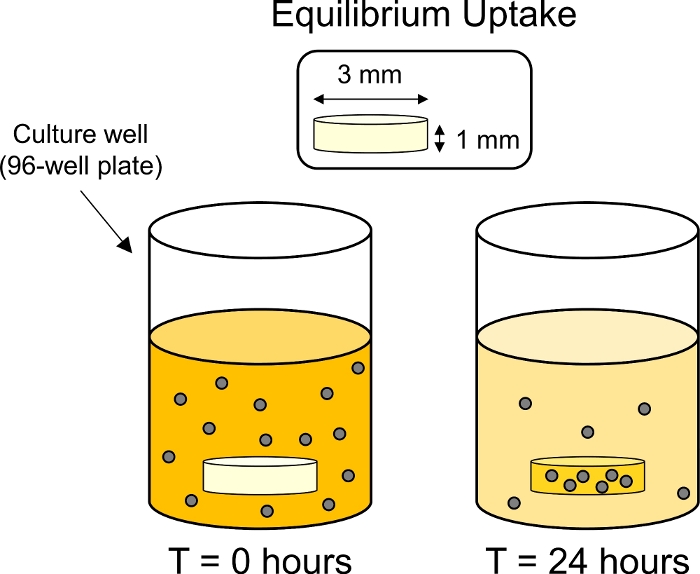
Abbildung 3: Schematische Gleichgewichtsaufnahmeexperimente. Knorpelexplantationen (3 mm Durchmesser x 1 mm dick) wurden in Einzelbrunnen in einer 96-Well-Platte mit fluoreszierender CPC-Lösung platziert. Nach 24 h wurden CPCs vom Knorpel aufgenommen, wodurch die Fluoreszenz des umgebenden Bades reduziert wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Tiefe der Penetration von CPCs im Knorpel
- Bereiten Sie 30 -M-Lösungen (300 l pro Explantation) von fluoreszierend gekennzeichneten CPCs in 1x PBS-PI vor. Verwenden Sie RNase-freie Polypropylen-Rohre für die Rekonstitution.
- Mit einem Skalpell Knorpelexplanten (6 mm Durchmesser x 1 mm Dicke) halbieren, um Halbscheiben herzustellen. Bewahren Sie die Explantation beim Schneiden mit einer Schicht von 1x PBS-PI auf.
- Kleben Sie eine halbscheibenverlaufende Anlage in die Mitte eines Brunnens der kundenspezifischen eindimensionalen Transportkammer mit einem Epoxid (Abbildung 4, Abbildung 5). Stellen Sie sicher, dass Epoxid auf die umlaufende (gekrümmte) Seite der Explantation aufgebracht wird. Entfernen Sie überschüssigen Kleber aus dem Brunnen, um den Kontakt mit der Diffusionsoberfläche des Knorpels zu verhindern und notieren Sie sich die oberflächliche Seite des Explants.
- Fügen Sie auf beiden Seiten des Explants 80 l von 1x PBS-PI hinzu. Pipette die Flüssigkeit auf und ab von einer Seite der Explant, um auf Leckage auf der anderen Seite zu überprüfen. Wenn Leckagen auftreten, explantieren und Epoxid nach Bedarf auftragen.
- Ersetzen Sie den 1x PBS-PI von der Seite zur oberflächlichen Knorpeloberfläche (vorgelagert) durch 80 L mit 30 M CPC-Lösung. Halten Sie 80 l von 1x PBS-PI auf der Seite mit Blick auf die tiefe Knorpelzone (nachgeschaltet).
- Legen Sie die Transportkammer vorsichtig in einen überdeckenden Behälter. Bedecken Sie die Basis des Behälters mit einer Schicht 1x PBS, um eine Verdunstung von Lösungen zu vermeiden. Stellen Sie sicher, dass kein direkter Kontakt zwischen Lösungen aus vor- und nachgelagerten Kammern besteht.
- Legen Sie den abgedeckten Behälter auf einen Plattenstreuer, um die Partikelsedimentation zu begrenzen. Inkubieren Sie entweder für 4 oder 24 h bei Raumtemperatur unter sanfter Rotation (50 U/min bei einer Umlaufbahn von 15 mm).
- Nach der Inkubation die Explantation aus der Kammer entfernen und die Scheibe von 100 m aus der Mitte der Explantation schneiden.
HINWEIS: Dieser Querschnitt beinhaltet die oberflächlichen, mittleren und tiefen Zonen des Knorpels. - Legen Sie die Scheibe zwischen eine Glasrutsche und einen Deckelschlupf. Hydratieren Sie die Scheibe mit einer Schicht von 1x PBS-PI.
- Bei 10-facher Vergrößerung, Bild durch die volle Dicke der Scheibe, um Z-Stack von fluoreszierenden Bildern mit einem konfokalen Mikroskop zu erhalten.
- Mit ImageJ projizieren Sie die durchschnittliche Intensität der Bilder innerhalb des Z-Stacks, um die Tiefe der Penetration von CPCs im Knorpel zu bestimmen.
- Öffnen Sie den Bildstapel, indem Sie auf Datei | Öffnen.
- Klicken Sie auf 'Bild' auf der Taskleiste und klicken Sie auf Bild | Stapel | Z Projekt aus dem Dropdown-Menü.
- Eingabeslice-Nummern von 1 bis zum endgültigen Slice. Wählen Sie 'Durchschnittliche Intensität' unter Projektionstyp. Klicken Sie auf 'OK.'
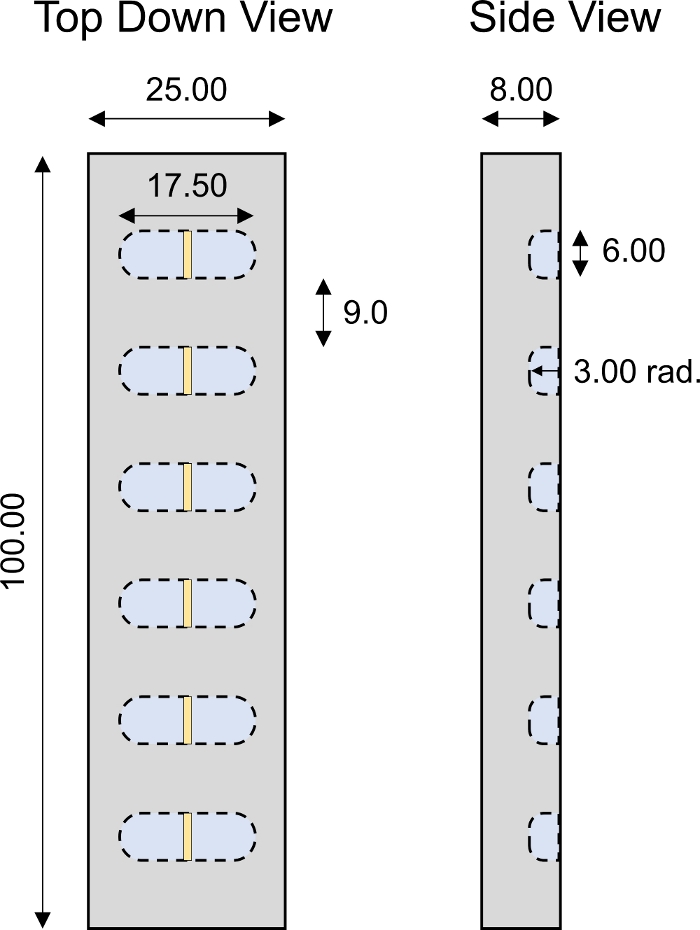
Abbildung 4: Maßgeschneiderte 1-D-Transportkammer. Konstruktionsparameter der PMMA 1D Transportkammer mit 6 Einzelbohrungen. Alle numerischen Werte werden in mm dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
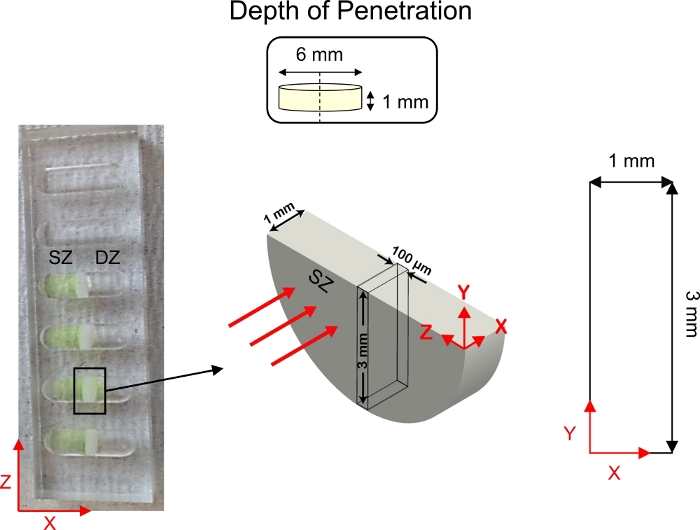
Abbildung 5: Schematische Tiefentiefe von Penetrationsstudien. Knorpelexpflanzen (6 mm Durchmesser x 1 mm Dicke) wurden halbiert und in der Mitte von 1D diffusiven Transportbrunnen befestigt. Fluoreszierend getaggte CPC-Lösung wurde an der Seite des Brunnens in Kontakt mit der oberflächlichen Zone (SZ) des Knorpels hinzugefügt. 1x PBS-PI wurde an der Seite des Brunnens in Kontakt mit der Tiefenzone (DZ) des Knorpels hinzugefügt. Nach der Diffusion wurde ein Knorpelquerschnitt (3 mm x 1 mm) mittels konfokaler Mikroskopie abgebildet. Diese Zahl wurde von Vedadghavami et al.4 und Bajpayee et al.3geändert.Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Nicht-Gleichgewichtsdiffusionsrate von CPCs im Knorpel
- Bringen Sie die beiden Hälften der kundenspezifischen Transportkammer (Abbildung 6) zusammen, um die Kammer zu montieren und zu schließen. Verwenden Sie Unterlegscheiben, Muttern und Schrauben, um die Kammer mit einem Schraubenschlüssel fest zu schließen.
HINWEIS: Die Transportkammer muss durchscheinend sein, um fluoreszierende Messwerte nicht zu stören. Die in diesem Protokoll verwendeten Transportkammern bestehen aus Polymethylmethacrylat (PMMA). - Beschichten Sie den Innenraum der Kammer mit 0,5% w/v fettfreie Rindermilchlösung in 1x PBS (2 ml pro Kammer) für 15 min, um eine unspezifische Bindung von CPCs an Kammerwände zu verhindern. Dann spülen Sie die Kammer mit 1x PBS (2 ml für jede Kammer).
- Mit der kundenspezifischen Schneidevorrichtung(Abbildung 2) und einer Rasierklinge, schneiden Sie eine Knorpelexplantation (Querebene) mit einem Durchmesser von 6 mm auf eine Dicke von 500-800 m, einschließlich der oberflächlichen Zone. Bewahren Sie die Explantation mit 1x PBS hydratisieren auf.
- Erstellen Sie mit hammergetriebenen und dermalen Schlägen Dichtungen aus Gummiblechen, wie in Abbildung 7dargestellt.
- Montieren Sie jede halbe Transportkammer mit 1 großen Gummidichtung, 1 PMMA-Einsatz und je 1 kleinen Gummidichtung. Legen Sie die Explantation in die Brunnen des Kunststoffeinsatzes, wobei die oberflächliche Zone der vorgelagerten Kammer zugewandt ist. Die beiden Hälften zusammenstecken, um die Baugruppe zu vervollständigen, und mit einem Schraubenschlüssel fest verschrauben (Abbildung 7).
- Füllen Sie die vorgeschaltete Kammer mit 2 ml 1x PBS-PI und beobachten Sie die nachgeschaltete Kammer für das Auslaufen von Flüssigkeit aus der vorgelagerten Kammer. Wenn Leckage vorhanden ist, montieren Sie die Kammer wieder, stellen Sie die Dichtungsposition und die Dichtheit der Schrauben ein. Wenn keine Leckage, füllen Sie die nachgeschaltete Kammer mit 2 ml 1x PBS-PI.
- Fügen Sie sowohl den nach oben als auch nachgeschalteten Kammern eine Mini-Rührstange hinzu und legen Sie die Kammer auf eine Rührplatte. Richten Sie die Kammer so aus, dass der Laser vom Spektralphotometer in Richtung der Mitte der nachgeschalteten Kammer fokussiert ist. Platzieren Sie den Signalempfängerteil des Spektralphotometers hinter der nachgeschalteten Kammer (Abbildung 8).
HINWEIS: Der Laser und der Empfänger des Spektralphotometers müssen mit den entsprechenden Filtern ausgestattet sein, um Signale des fluoreszierend gekennzeichneten Proteins zu anregen, auszusenden und zu übertragen. Schützen Sie die Transportkammer während des Experimentierens mit einer Blackbox vor Licht, um Störungen des Fluoreszenzsignals zu vermeiden. Es ist am besten, die Öffnungen auf der Oberseite der Kammer mit einer flexiblen Folie zu versiegeln, um Verdunstung zu vermeiden. - Sammeln Sie nachgeschaltete Fluoreszenz-Emissionswerte in Echtzeit und sorgen Sie für ein stabiles Signal für mindestens 5 min.
HINWEIS: Aliquots aus der nachgeschalteten Kammer können mit einem Plattenleser auf Fluoreszenz untersucht werden, wenn kein maßgeschneidertes Spektralphotometer oder eine transluzente Transportkammer verfügbar ist. - Pipetten Sie ein vorberechnetes Volumen der Lagerlösung von fluoreszierend getaggten CPCs in die vorgelagerte Kammer, um eine Endkonzentration von 3 M in der vorgelagerten Kammer zu gewährleisten. Beobachten Sie das nachgeschaltete Fluoreszenzsignal und ermöglichen Sie einen gelösten Transport, um eine stetige Steigung zu erreichen.
HINWEIS: Eine dickere Knorpelexplantation benötigt längere Zeit, um einen stationären Zustand zu erreichen. - Sobald der stationäre Zustand erreicht ist, nehmen Sie 20 l aus der vorgelagerten Kammer und fügen Sie die nachgeschaltete Kammer hinzu ("Spike-Test").
HINWEIS: Es wird eine Spitze der nachgeschalteten Fluoreszenz beobachtet. Dies ermöglicht eine Korrelation zwischen Fluoreszenzmessungen und CPC-Konzentration. - Sammeln Sie downstream Fluoreszenzwerte in Echtzeit.
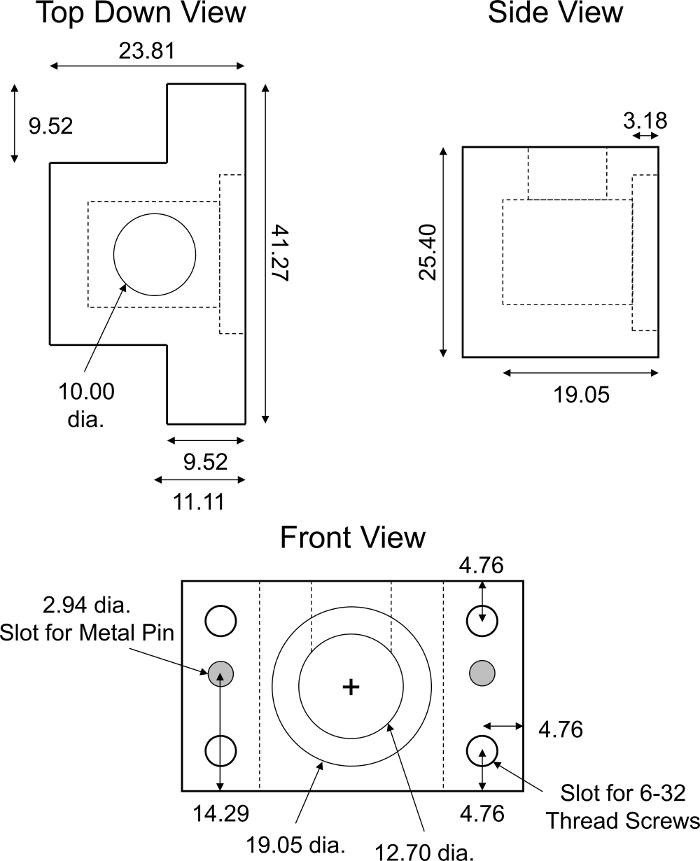
Abbildung 6: Maßgeschneiderte Nicht-Gleichgewichtsdiffusionstransportkammer. Konstruktionsparameter der PMMA-Nicht-Gleichgewichtsdiffusionstransportkammer. Die Kammer muss durchscheinend sein, um fluoreszenzmesswerte nicht zu stören. Die komplette Transportkammer bestand aus zwei identischen Hälften der gezeigten Vorrichtung. Zwei zylindrische Edelstahlstifte (2,94 mm Durchmesser, 18 mm Länge) waren erforderlich, um die Ausrichtung und den vollständigen Verschluss der Kammerhälften zu gewährleisten. Vier identische Schlitze für 6-32 Gewindeschrauben wurden in jeder Ecke der Kammer für die schraubendichte Montage gemacht. Alle numerischen Werte werden in Millimetern dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
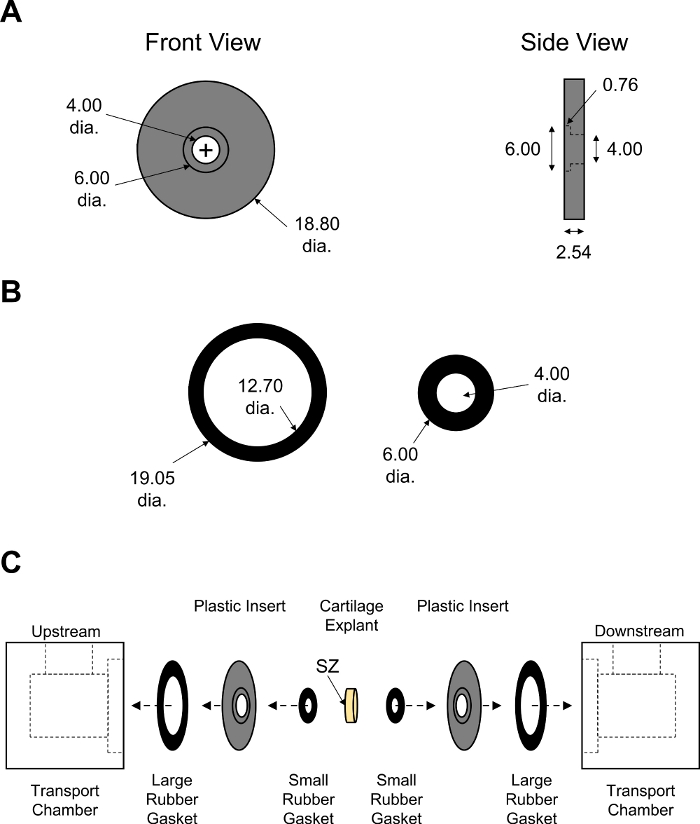
Abbildung 7: Montage der Nicht-Gleichgewichtsdiffusionstransportkammer. Konstruktionsparameter von (A) schwarzen PMMA-Einsätzen und (B) großen und kleinen Gummidichtungen. Die Dicke der Gummidichtungen wurde angepasst, um einen dichten Verschluss der Kammer zu gewährleisten. Alle numerischen Werte werden in mm. (C) Schemat dargestellt, das die Reihenfolge der Montage für zwei Hälften der Transportkammer mit Knorpelexplant in der Mitte zeigt. Die SZ zeigt eine oberflächliche Knorpelzone an, die der vorgelagerten Kammer zugewandt war. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
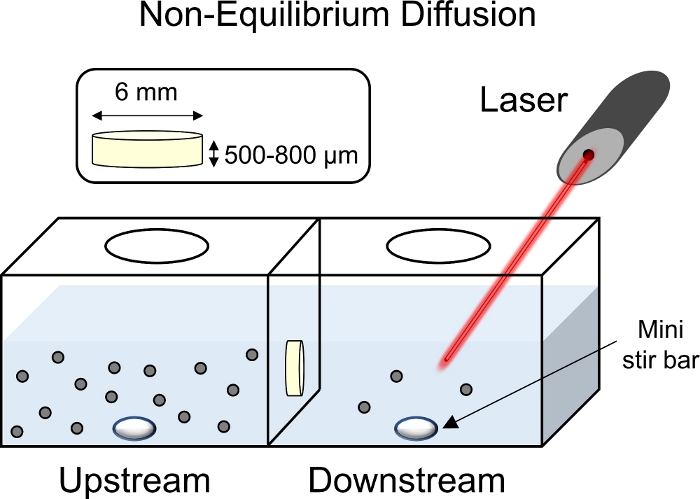
Abbildung 8: Schematische Nicht-Gleichgewichtsdiffusionsexperimente. Knorpelexpflanzen (6 mm Durchmesser x 1 mm Dicke) wurden in der Mitte der Transportkammer mit der oberflächlichen Oberfläche zur vorgelagerten Kammer gelegt. Sowohl die Seiten nach oben als auch nach unten der Kammer wurden mit 1x PBS-PI gefüllt und mit einer Mini-Rührstange gemischt. Mit einem Laser, der auf die nachgeschaltete Kammer zeigte, um fluoreszierende Messwerte zu sammeln, wurde der vorgeschalteten Kammer eine fluoreszierend markierte CPC-Lösung hinzugefügt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Nach der Gleichgewichtsabsorption von CPCs durch Knorpel nimmt die Badfluoreszenz ab, wenn die Lösung vom Gewebe aufgenommen wurde. Wenn jedoch der Fluoreszenzwert des Endbades ähnlich dem ursprünglichen bleibt, bedeutet dies, dass es keine/minimale Gelöste Aufnahme gibt. Eine weitere Bestätigung der gelösten Aufnahme ist, wenn das Gewebe die Farbe sichtbar in die Farbe des Fluoreszenzfarbstoffs geändert hat. Die quantitative Aufnahme von Gelösten im Knorpel wurde anhand des Aufnahmeverhältnisses (RU)...
Diskussion
Die hier beschriebenen Methoden und Protokolle sind für den Bereich der gezielten Medikamentenabgabe an negativ geladene Gewebe von Bedeutung. Aufgrund der hohen Dichte negativ geladener Aggrekane, die in diesen Geweben vorhanden sind, wird eine Barriere geschaffen, die verhindert, dass Medikamente ihre zellulären Zielstellen erreichen, die tief in der Matrix liegen. Um dieser noch offenen Herausforderung zu begegnen, können Medikamente modifiziert werden, um positiv geladene Drogenträger zu integrieren, die die Tran...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde vom US-Verteidigungsministerium durch die Congressionally Directed Medical Research Programs (CDMRP) unter Vertrag W81XWH-17-1-0085 und das National Institute of Health R03 EB025903-1 finanziert. AV wurde vom College of Engineering Dean es Fellowship an der Northeastern University finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18x18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7x2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
Referenzen
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis - An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta - Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten