Method Article
Visualisierung der synaptischen Degeneration bei erwachsenen Drosophila in Verbindung mit Neurodegeneration
In diesem Artikel
Zusammenfassung
Das Ziel dieses Verfahrens ist es, das dorsale Längsmuskelgewebe (DLM) zu sezieren, um die strukturelle Integrität von NEUROmuskulären DLM-Knoten (NMJs) in neurodegenerativen Krankheitsmodellen mit Drosophila melanogasterzu bewerten.
Zusammenfassung
Drosophila dient als nützliches Modell für die Beurteilung der synaptischen Struktur und Funktion im Zusammenhang mit neurodegenerativen Erkrankungen. Während viel Arbeit auf neuromuskuläre Kreuzungen (NMJs) in Drosophila Larven konzentriert hat, Bewertung der synaptischen Integrität bei erwachsenen Drosophila hat viel weniger Aufmerksamkeit erhalten. Hier bieten wir eine einfache Methode zur Zerlegung der dorsalen Längsmuskeln (DLMs), die für die Flugfähigkeit erforderlich sind. Neben dem Flug als Verhaltensauslesung ermöglicht diese Sezierung, dass sowohl die DLM-Synapsen als auch das Muskelgewebe mit fluoreszierend markierten Antikörpern für synaptische Marker oder Proteine von Interesse strukturell analysiert werden können. Dieses Protokoll ermöglicht die Bewertung der strukturellen Integrität von Synapsen bei erwachsenen Drosophila während des Alterns, um die progressive, altersabhängige Natur der meisten neurodegenerativen Erkrankungen zu modellieren.
Einleitung
Synaptische Dysfunktion gehört zu den frühesten bekannten Kennzeichen der meisten wichtigsten neurodegenerativen Erkrankungen1,2,3,4,5,6. Allerdings ist sehr wenig darüber bekannt, wie diese strukturellen und funktionellen Beeinträchtigungen mit späteren Stadien der Krankheitsprogression zusammenhängen. Drosophila hat sich als ein nützliches Modellsystem für das Verständnis von Synapsenwachstum und Entwicklung mit Larven NMJs7,8,9. Die dritte Larven-Insternphase dauert jedoch nur wenige Tage und begrenzt ihren Nutzen beim Studium progressiver, altersabhängiger Neurodegeneration. Eine Alternative zur Beurteilung von Larven-NMJs ist die Untersuchung synaptischer Strukturen in erwachsenen Drosophila, wie die Synapsen, die auf den Dorsal Longitudinal Muscles (DLMs) gebildet werden, die für Flug10,,11,12,,13,14,15,,16benötigt werden. Diese dreigliedrigen Synapsen sind strukturell ähnlich wie Säugetiersynapsen17organisiert, was einen einzigartigen Vorteil für die Bewertung von Modellen neurodegenerativer Erkrankungen bietet.
Hier beschreiben wir eine einfache Methode zur Analyse der strukturellen Integrität von erwachsenen NMJs in einem Drosophila-Modell der Neurodegeneration. Frühere DLM-Sektionsmethoden und Studien haben die Bedeutung der Erhaltung von Muskelgewebe für eine Vielzahl von Anwendungenbetont 18,19,20,21,22,23. Unser Protokoll bietet eine umfassende Methode, um sowohl neuronales als auch Muskelgewebe zu erhalten, um neurodegenerative Erkrankungen zu untersuchen. Ein weiterer wichtiger Bestandteil des Studiums dieser Krankheiten ist die Fähigkeit, neuronalen Verlust in einer altersabhängigen Weise zu verstehen. Frühere Arbeiten liefern ein kritisches und tiefes Verständnis dafür, wie die DLM NMJs während der Metamorphose ins frühe Erwachsenenalter gebildet werden11,12,14,15,16,24. Unser Protokoll legt eine Methode fest, um auf dieser Arbeit aufzubauen, um DLM NMJs altersabhängig bei alternden und neurodegenerativen Erkrankungen zu untersuchen.
Protokoll
1. Erzeugung von transgenen Fliegen
- Um transgene Fliegen für dieses Experiment zu erzeugen, sammeln OK371-Gal425 jungfräuliche weibliche Fliegen und Männchen von UAS-TDP-43M337V 26 (Abbildung 1A) durch Anästhesisierung fliegen mit CO2 auf einem Pad zu sortieren.
- Sortieren Sie anästhetische Fliegen in Fläschchen mit Standard-Drosophila-Medien für das Kreuz. Etikettierte Fläschchen bei 25 °C platzieren, damit die nächste Generation entsteht.
HINWEIS: Löschen Sie die Erwachsenen von den Durchstechflaschen, bevor die Nachkommen entstehen, um den richtigen Genotyp zu gewährleisten. - Sobald Nachkommen auftauchen, sammeln Sie die transgenen Fliegen in Fläschchen und sortieren nach Geschlecht, um mit dem Altern für experimentelle Bedingungen zu beginnen.
- Sobald die Fliegen abgeholt sind, transferieren Sie fliegen zu frischen Lebensmitteln alle 2 Tage, bis die Fliegen 21 Tage alt sind.
2. Dissektionsvorbereitung
- Zur Vorbereitung auf Sezierungen erhalten Sie raumtemperaturgepufferte Saline (1x PBS), eine 10 cm Sezierschale, die mit einem Silikonelastomer beschichtet ist, gerade Randschere, ein Satz stumpfer Sezierzangen, eine P200 Pipette und Pipettenspitzen, 2,0 ml Mikrozentrifugenrohre, Standard-Büroschere, 70% Ethanol, eine 6 cm Petrischale und 32% Formaldehyd verdünnt auf 4% mit 1x PBS.
- Beschriften Sie die Rohre für jeden Genotyp oder Zustand und fügen Sie jedem Rohr 900 l 1x PBS (Raumtemperatur) und 150 l 32 % Formaldehyd hinzu. Tragen Sie Handschuhe und Schutzbrillen bei der Zubereitung des 4% Formaldehyd-Fixativs.
- Anästhetisieren Sie 6-u201210 Fliegen pro Gruppe direkt aus der Durchstechflasche mit CO2 und tauchen Sie in eine 6 cm Petrischale mit 70% Ethanol. Drücken Sie die Fliese mit einem Pinsel in das Ethanol, um sicherzustellen, dass die Proben vollständig untergetaucht sind. Dadurch wird die Ölschicht auf der äußeren Nagelhaut entfernt.
3. Thoraxisolierung und -fixierung
- Vor der Sezierung jeder Probe ca. 7-u201210 ml 1x PBS in die mit Silikonelastomer beschichtete Sezierschale geben. Dieses Volumen sollte sicherstellen, dass die Gewebeproben vollständig untergetaucht sind.
- Übertragen Sie eine Fliege auf die Sezierschale aus dem 70% Ethanol mit stumpfer Zange und greifen entweder die Flügel oder die Beine.
- Fokussieren Sie die Probe in der Sezierschale unter einem Seziermikroskop. Als nächstes tauchen Sie die Probe in 1x PBS, und entfernen Sie vorsichtig die Flügel mit stumpfen Dumont #5 feinen Zangen.
- Mit Vannas gerade Rand Feder Sezierschere, entfernen Sie die Beine durch die Schaffung eines kleinen Schnitt in der ventralen Seite der Nagelhaut. In Schritt 3.8 ermöglicht dieser Schnitt das Eindringen des Formaldehyds in das Gewebe.
- Nehmen Sie die Schere in einer Hand und halten Sie die Zange in der anderen, um die fliegende ventrale Seite nach oben zu positionieren. Während Sie die Probe mit der stumpfen Zange an Ort und Stelle halten, entfernen Sie den Kopf und den Bauch mit der Sezierschere.
- Übertragen Sie den isolierten Thorax mit der modifizierten Pipettenspitze ab Schritt 3.2 in das beschriftete Rohr.
HINWEIS: Stellen Sie die Pipette auf 40 l ein, um zu vermeiden, dass dem Fixiermittel zusätzliche 1x PBS hinzugefügt werden. - Wiederholen Sie die oben genannten Schritte 3.2-u20123.6 für jede Probe.
- Proben für 30 min bei Raumtemperatur fixieren.
- Entfernen Sie die Korrektur mit einer Pasteur Pipette und entsorgen Sie sie im richtigen Abfallbehälter unter der Dunstabzugshaube. Spülen Sie Proben dreimal mit 1,5 ml 1x PBS, jeweils mit einer Pasteur Pipette. Schließen Sie eine vierte Spülung mit nur 750 l ab und lassen Sie Gewebe in 1x PBS.
HINWEIS: An dieser Stelle können Gewebeproben bis zu 3 Tage bei 4 °C bleiben, bevor Sie mit den nächsten Schritten fortfahren.
4. Flash-Gefrier- und Thoraxbisektion
- Bevor Sie mit den Bisektionen beginnen, füllen Sie einen Dewar-Kolben mit flüssigem Stickstoff mit richtigen Kryo-Schutzhandschuhen und einer Schutzbrille. Erhalten Sie einen Klingenbrecher, Federblätter, ein Paar feine Zangen, Eis, eiskalte 1x PBS und kryogene Pinzette.
- Bereiten Sie einen Eiskübel vor, um 1x PBS eiskalt zu halten.
- Verwenden Sie den Klingenbrecher, um die Federklinge in einem Winkel zu greifen, und biegen Sie die Klinge, um ein kleines Stück abzubrechen. Der Klingenbrecher kann dann die Klinge für den Einsatz als kleines Skalpell in Position bringen.
HINWEIS: Ein Blatt sollte für alle Gruppen dauern. Schalten Sie, wenn die Klinge bricht oder stumpf wird. - Fügen Sie dem P200 eine saubere Pipettenspitze hinzu und entfernen Sie 1/5der Spitze, um Proben zu transportieren.
- Bereiten Sie ein neues Mikrozentrifugenrohr für jede Gruppe vor und fügen Sie jedem Rohr 200 L 1x PBS hinzu. Diese zweite Röhre wird verwendet, um die letzten DLM-Preps zu sammeln.
- Entfernen Sie alle 1x PBS aus Rohren mit einer Pasteur Pipette.
- Tragen Sie die richtige Schutzausrüstung, tauchen Sie das Rohr in den flüssigen Stickstoffkolben für 10 s mit der kryogenen Pinzette.
HINWEIS: Die Rohre sollten fest geschlossen werden, damit das Rohr nicht explodiert. - Entfernen Sie das Rohr aus dem flüssigen Stickstoff und fügen Sie den Proben mit einer Pasteur-Pipette ca. 300 l eiskalte 1x PBS hinzu. Halten Sie die Proben auf Eis.
- Die mit Silikonelastomer beschichtete 10 cm-Sezierschale eiskalt 1x PBS hinzufügen und den ersten Thorax mit der modifizierten 200-L-Pipette abgeben.
- Legen Sie die Thorax-Ventralseite nach oben. In der einen Hand verwenden Sie ein stumpfes Paar Zangen, um den Thorax zu positionieren und in der anderen ein feines Paar Zangen, um einige der Brustganglien zu entfernen, um die Mittellinie des Thorax zu belichten.
- Verwenden Sie die Mittellinie des Thorax als Leitfaden, um einen flachen Schnitt durch 1/3des Thorax mit der Klinge zu machen.
- Entfernen Sie die Klinge vom Thorax und positionieren Sie den Thorax in einem 45°-Winkel mit den stumpfen Zangen. Setzen Sie die Klinge wieder ein und schneiden Sie die Mittellinie des Thorax gerade nach unten. Dies wird zu zwei Hemithoraces führen.
- Nehmen Sie einen Hemithorax nach dem anderen und entfernen Sie das überschüssige Gewebe unter DLM Muskelfaser F (Abbildung 1B), die ventrale Faser. Verwenden Sie die Klinge, um sorgfältig ein oder zwei Schnitte zu machen, um das überschüssige Gewebe zu entfernen, ohne die DLMs zu beschädigen.
- Nach der Isolation die Hemithorax mit 1x PBS in das richtige Rohr übertragen.
- Wiederholen Sie die Schritte 4.6-u20124.14, bis 10 sezierte Hemithoraces pro Gruppe durchgeführt werden.
5. Strukturelle Färbung
- Nach der Absektierung der Thoraxproben das Gewebe in einen Blockierpuffer (1x PBS mit 0,1% normalem Ziegenserum und 0,2% Triton X-100 bei pH 7,4) legen, um das Gewebe zu permeabilisieren und unspezifische Färbungen zu verhindern. Verwenden Sie eine Pasteur-Pipette, um überschüssige 1x PBS zu entfernen und jedem Rohr 1,5 ml Sperrpuffer hinzuzufügen. Blockgewebe für mindestens 1 h bei 4 °C.
- Bereiten Sie die Proben für die strukturelle Färbung mit einem fluoreszierend konjugierten Antikörper, Meerrettichperoxidase 488 (Anti-HRP-488) bei einer Verdünnung von 1:200 und Phalloidin-647 bei einer Verdünnung von 1:1000 im Sperrpuffer vor, um Motorneuronen bzw. Muskelgewebe zu färben. Machen Sie genug Fleck, um 150 l pro Rohr zu haben. Bewahren Sie den Fleck bei 4 °C mit Folie oder in einer dunklen Schachtel auf, bis er zur Färbung bereit ist.
- Entfernen Sie nach dem Blockieren den überschüssigen Sperrpuffer mit einer glasigen Pasteurpipette.
- Vor dem Dosieren des Strukturflecks den Fleck wirbeln. Fügen Sie jedem Röhrchen 150 L des Flecks hinzu. Legen Sie die Proben in einer dunklen Box auf den Rotator bei Raumtemperatur für 2 h.
- Entfernen Sie den Fleck und waschen Sie das Gewebe viermal in 1,5 ml Raumtemperatur 1x PBS mit 0,3% Triton X-100 für 5 min auf dem Rotator in einem dunklen Kasten. Die Proben können nun an einer Folie montiert werden.
6. Montagegewebe
- Nach dem Waschen von Proben in PBST, bereiten Sie ein Mikroskop-Dia, um Gewebe für die Färbung zu montieren. Bereiten Sie zusätzliche Vorräte vor, darunter Glasabdeckungsscheine, eine P200-Pipette, 200 L Pipettenspitzen, Scheren, klare Verstärkungen, gerade Kantenzangen, Anti-Fade-Fluoreszenz-Montagemedien, Nagellack und eine dunkle Box, um die Dias zu bedecken.
- Beschriften Sie die Folie, um die Proben zu identifizieren, und reinigen Sie die Folie mit Kimwipes, um sicherzustellen, dass keine Flecken vorhanden sind.
- Um sicherzustellen, dass die Hemithorax-Proben nicht durch den Abdeckschlupf beschädigt werden, bauen Sie eine "Brücke" mit Bewehrungsetiketten. Nehmen Sie ein Bewehrungsetikett, schneiden Sie es in die Hälfte, und legen Sie jede Hälfte ca. 15 mm auseinander. Dieser Abstand muss kleiner als die Breite des Abdeckbelegs sein. Wiederholen Sie diesen Schritt viermal, um eine "Brücke" abzuschließen, die 5 Etiketten hoch ist.
- Nehmen Sie die P200 Pipette und modifizieren Sie eine Spitze, indem Sie 1/5der Spitze abschneiden, um die Proben auf die Folie zu übertragen. Proben sollten auf die Folie in der Mitte der Brücke übertragen werden.
- Nehmen Sie den Rand eines Labors wischen und entfernen Sie überschüssige PBST. Mit Zangen, ordnen Sie die DLMs so, dass alle Proben sind nach oben und Cuticle Seite nach unten.
- Mit einer Standard-P200-Pipettenspitze, tragen Sie 70 L Montagemedien auf den Schlitten auf, um Luftblasen zu vermeiden. Geben Sie die Medien in einem kreisförmigen Muster innerhalb der Verstärkungen von außen in die Mitte.
- Legen Sie einen Deckelschlupf über die Verstärkungen.
- Verwenden Sie Nagellack, um die Außenkanten um den Umfang des Deckels zu beschichten. Großzügig auftragen, um eine vollständige Versiegelung des Gewebes zu bilden.
- Platzieren Sie die Rutsche auf einer ebenen Oberfläche im Dunkeln, so dass mindestens 10 min trocknen und Photobleichungen oder Fluoreszenzverlust verhindern. Dias können nun sofort für die Bildgebung verwendet oder anderweitig in einem Folienordner bei -20 °C für eine spätere Anzeige gespeichert werden.
7. Alternative: Färbung mit primären Antikörpern
HINWEIS: Dieser Abschnitt ist optional und sollte auf Wunsch direkt zwischen den Abschnitten 4 und 5 verwendet werden.
- Um Gewebe mit primären Antikörpern zu färben, tauchen Sie Gewebe für mindestens 1 h in einen Blockierpuffer.
- Bereiten Sie primären Antikörper mit der richtigen Verdünnung im Blockierpuffer vor. Bereiten Sie mindestens eine ausreichende Antikörpermischung vor, um 150 L pro Gruppe zu haben. Beachten Sie, dass die Proben still gehalten werden. Bei 4 °C lagern, bis sie einsatzbereit sind.
- Entfernen Sie überschüssigen Blockierpuffer mit einer Pasteur Pipette. Kurz wirbeln Sie den primären Antikörper kurz aus, und fügen Sie jeder Gruppe 150 L Antikörpermischung hinzu und legen Sie die Proben über Nacht bei 4 °C ab.
- Am nächsten Tag, entfernen Primäre Antikörper und waschen Gewebe 4 mal mit PBST für jeweils 5 min auf einem Rotator.
- Bereiten Sie sekundären Fleck im Blockierpuffer vor. Fügen Sie den sekundären Fleck in die Probe und halten Sie es dann eine Raumtemperatur für 2 h in einem dunklen Kasten auf dem Rotator.
HINWEIS: Die sekundäre Färbung kann auch HRP und Phalloidin enthalten. - Nach der 2 h Inkubation, um das sekundäre Flecken waschgewebe 4 mal für 5 min mit PBST zu entfernen und mit der Montage fortzufahren.
Ergebnisse
Die Erzeugung von transgenen Fliegen, die menschliches Tar-Binding Protein von 43 kDa Mutant (TDP-43M337V) exlastet, wird durch das Schaltplan dargestellt (Abbildung 1A). Dies zeigt die Anwendung des binären Gal4/UAS-Systems in Drosophila27. Die Abbildung zeigt einen Hemithorax mit sechs Muskelfasern, A'u2012F geht von der dorsalsten Faser A auf die ventrale F (Abbildung 1B)11,12. Um die synaptische Integrität zu beurteilen, wurden NMJs mit HRP und Phalloidin befleckt (Abbildung 1C-u2012E). Motorneuronen in TDP-43M337V Mutanten (Abbildung 1F) haben bis Tag 21 wenig bis gar keine HRP-Färbung, während WT (Oregon-R) intakt bleibt (Abbildung 1C). Es gibt keine sichtbaren Unterschiede in der Muskelfärbung (Abbildung 1D,G). Die Veränderungen in der Grobmorphologie, die bei TDP-43M337V-Mutationen beobachtet wurden, zeigen, wie synaptische Integrität in ein neurodegeneratives Krankheitsmodell der amyotrophen Lateralsklerose (ALS) mit dem erwachsenen DLM-Modell involviert werden kann. Neben der strukturellen Färbung kann die Färbung der DLM NMJs auch eine Bewertung der synaptischen Integrität mit präsynaptischen (Abbildung 2A-u2012R) und post synaptischen (Abbildung 2S'u2012X) Marker bieten. Zusammen zeigen diese Ergebnisse, wie dieses Sezierprotokoll auf die Untersuchung von DLM-Gewebe bei neurodegenerativen Erkrankungen angewendet werden könnte.
Ein wichtiger Aspekt dieser Sezierung ist die Anwendung von flüssigem Stickstoff, um das Gewebe zu einfrieren, um die Bisektion zu erleichtern. Der Nutzen des flüssigen Stickstoffs wird bei WT-Fliegen mit flüssigem Stickstoff nachgewiesen, bei denen Muskelgewebe keine Schäden oder geknickte Fasern hat (Abbildung 3A-u2012C). Ohne flüssigen Stickstoff kann das Gewebe schwieriger zu sezieren sein. Zum Beispiel, nach diesem Protokoll und überspringen die flüssige Stickstoff Flash Gefrierschritt ermöglicht es dem Gewebe anfälliger für Schäden durch die Sezierwerkzeuge wie beschädigte Neuronen (Abbildung 3D) oder beschädigte Muskelfasern (Abbildung 3E). Die Anwendung von flüssigem Stickstoff hilft, Gewebeschäden zu verhindern, die bei der Arbeit mit DLM-Gewebe auftreten können, unabhängig vom Genotyp der Probe (Abbildung 3Cund 3F).
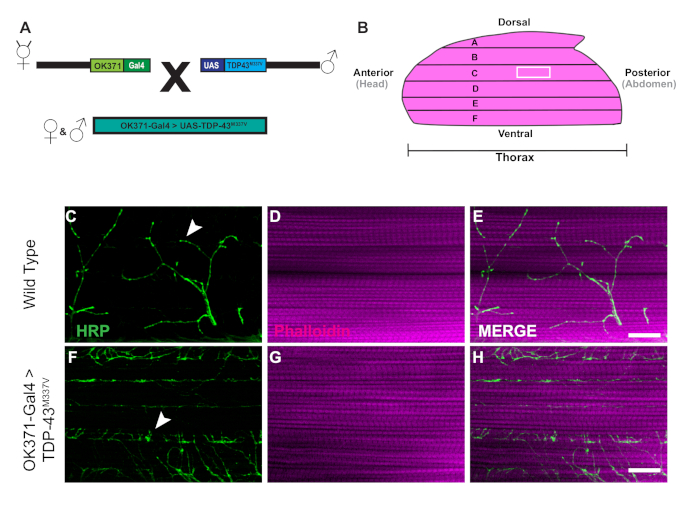
Abbildung 1: Progressive Denervation von DLM-Synapsen in einem Drosophila-Modell von ALS. (A) Die Erzeugung von ALS transgenen Fliegen, die eine menschliche mutierte Form von Tar-Binding Protein von 43 kDa (TDP-43) exemiten, sind im Schaltplan dargestellt. (B) Die Abbildung zeigt die Form und Ausrichtung eines Hemithorax in einer erwachsenen Drosophila. Mit dem Protokoll können wir den fortschreitenden Verlust der synaptischen Integrität von DLM NMJ-Synapsen durch strukturelle Färbung von motorischen Neuronen mit HRP (grün) und Muskelgewebe mit Phalloidin (Magenta) beobachten. Unser Modell zeigt den Verlust der synaptischen Integrität in einem erwachsenen Modell von ALS durch die Erzeugung von erwachsenen Fliegen, die eine Mutante aus menschlichen TDP-43M337V in motorischen Neuronen ausdrücken (Abbildung 1F'u2012H) im Vergleich zu WT (Abbildung 1C'u2012E) Fliegen in Muskelfaser C. Pfeile markieren Beispiele einer WT-Synapse (Abbildung 1C) und ein Beispiel für den Verlust der synaptischen Integrität. Skalenbar =20 m bei 63-facher Vergrößerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
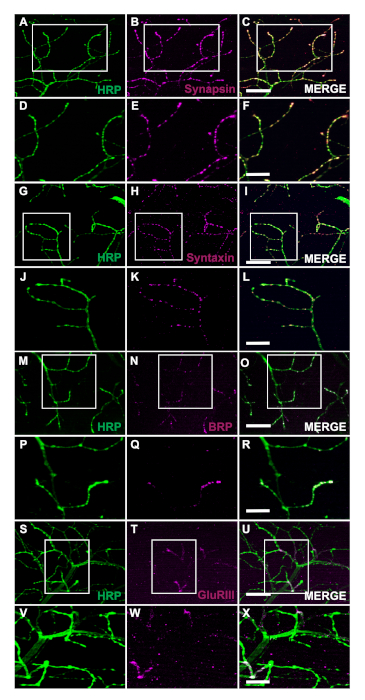
Abbildung 2: Bewertung der synaptischen Integrität mit präsynaptischen Markern bei erwachsenen NMJs. Synaptische Integrität kann auch mit präsynaptischen und postsynaptischen Markern in WT-Fliegen bewertet werden, die 14 Tage alt in Muskelfaser C sind. Die präsynaptischen Marker Synapsin (B), Syntaxin (H) und Bruchpilot (BRP) (N) sind mit HRP (A, G, M) ko-befleckt. Die Färbung stellt die Lokalisierung dieser Marker zu den präsynaptischen Klemmen dar (C, I, O). Bei höherer Vergrößerung veranschaulichen die Bilder die Lokalisierung von Synapsin (E), Syntaxin (K) und BRP (Q) mit HRP (D, Jund P) im Detail (Abbildung F, Lund R). Wir zeigen auch einen postsynaptischen Marker Glutamat-Rezeptor III (GluRIII) (T) mit HRP (S) ko-gebeizt. Die Co-Färbung demonstriert den Nutzen dieser Marker (U). Bei höherer Vergrößerung veranschaulichen die repräsentativen Bilder die Lokalisierung (X) von GluRIII (W) und HRP (V) zum postsynaptischen Muskelgewebe bzw. den präsynaptischen Klemmen. Die Skalenleiste für die Paneele A-u2012C, G-I, M-u2012O, S-u2012U entspricht 20 m bei 63-facher Vergrößerung. Die Skalenleiste für die Paneele D-u2012F, 2J-2L, 2P-2R und 2V-2X entspricht 10 m bei 63-facher Vergrößerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
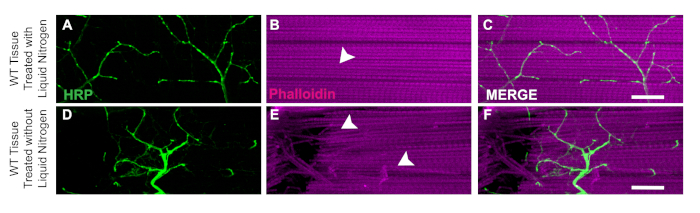
Abbildung 3: Nutzen von flüssigem Stickstoff für DLM-Sektionen. Um den Nutzen von flüssigem Stickstoff für die DLM-Sektionen zu demonstrieren, zeigen wir einen Vergleich von Tag 21 WT-Fliegen mit und ohne flüssigen Stickstoff aus Muskelfaser C. Mit flüssigem Stickstoff bleibt Phalloidin (B) intakt und beeinträchtigt die HRP-Färbung (A, C) nicht. Ohne flüssigen Stickstoff wird Muskelgewebe stringy und schwer zu bissekten (E) und HRP Färbung (D, F) wird durch technische Fehler kompromittiert. Weiße Pfeile zeigen einen Bereich ohne Muskelschäden mit flüssigem Stickstoff (B) und beschädigtem Muskelgewebe (E). Skala bar = 20 'm bei 63-facher Vergrößerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Mit den in diesem Protokoll beschriebenen Methoden bieten wir einen einfachen Ansatz für die Zerlegung des DLM-Gewebes und zeigen, wie dies angewendet werden kann, um die synaptische Integrität durch strukturelle Färbung und synaptische Marker bei erwachsenen Drosophila zu bewerten. Ein wichtiger Schritt im Protokoll, der das DLM-Gewebe leichter zu sezieren macht, ist das Einfrieren des Blitzes mit flüssigem Stickstoff. Ohne diesen Schritt ist das Gewebe weniger fest und schwieriger genau zu schneiden, wie in Abbildung 3beobachtet. Dieses Protokoll baut auf früheren Seziermethoden auf, um die Erhaltung von Motorneuronen und Muskelgewebe18,19,20,21,22,23zu ermöglichen. Eine Einschränkung dieses Protokolls ist, dass es schwierig sein kann, zwei saubere Preps pro Thorax zu erhalten, wenn man die Mittellinie für den Biabschnitt reduziert. Eine Möglichkeit, mindestens eine Hemithorax pro Fliege zu gewährleisten, können Sie absichtlich auf eine Seite des Thorax abgeschnitten werden, um eine saubere Vorbereitung zu erhalten. Mit dieser Modifikation muss man möglicherweise auch zusätzliches überschüssiges Gewebe aus dem Schnitt entfernen, um die Probe mit dem Klingenbrecher zu reinigen. Für diejenigen, die neu in dieser Technik, mit fortgesetzter Praxis, Genauigkeit der Bisektion erhöht.
Die hier beschriebene Methode ermöglicht es Forschern, die strukturelle Integrität von erwachsenen DLM-NMJs jederzeit während ihrer gesamten Lebensdauer einfach zu beurteilen. Ein großer Vorteil dieses Protokolls ist die Fähigkeit, auf synaptische Integrität in neurodegenerativen Krankheitsmodellen zuzugreifen, indem synaptische Marker verwendet werden. Wir zeigen, dass diese Anwendung helfen kann, Veränderungen in der groben Morphologie mit struktureller Färbung zu visualisieren (Abbildung 1C-u2012H). Darüber hinaus kann die synaptische Integrität mit der Färbung von präsynaptischen Markern bewertet werden, einschließlich, aber nicht beschränkt auf Synapsin28 (Abbildung 2A-u2012F), Syntaxin29 (Abbildung 2G-u2012L) und BRP30 (Abbildung 2M-u2012R). Das postsynaptische Muskelgewebe kann auch mit dem Glutamat-Rezeptor III-Subunit-Antikörper31 (Abbildung 2S-u2012X) bewertet werden, der den Nutzen dieses Protokolls demonstriert.
Forscher können diese Seziermethode auch nutzen, um funktionelle Daten zu ergänzen, um die strukturelle Integrität von Synapsen, die mit einer Vielzahl von Krankheiten verbunden sind, umfassend zu untersuchen. Diese Synapsen ermöglichen auch eine funktionelle Analyse durch elektrophysiologische Aufnahmen32,33,34 und den Flugtest10. Dieses Protokoll kann auch einen einfachen Zugang zum Gewebe für viele Anwendungen und Assays bieten. Zukünftige Studien könnten z. B. dieses Protokoll nutzen, um synaptische Veränderungen durch Quantifizierung der Dichte und Anzahl der Synapsen15,16zu quantifizieren. Während das hier beschriebene Protokoll speziell die synaptische Integrität von motorischen Neuronen untersucht, können komplementäre Protokolle zur Beurteilung des Muskelzellverlusts auch mit dieser Zerlegung mit TUNEL-Färbung35durchgeführt werden. Zur Untersuchung des neuronalen Verlustes könnte die Zerlegung des Brustganglials36 auch mit TUNEL-Färbung verwendet werden. Wir gehen davon aus, dass die hier beschriebene Sezierung mehr Anwendungen für zukünftige Studien zur Bewertung altersbedingter Pathologien sowie neurodegenerativer Erkrankungen haben wird.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health (R01 NS110727) bis D.T.B unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 32% Formaldehyde | Electron Microscopy Sciences | 15714 | Tissue preservation |
| Alexa Fluor 568 goat anti mouse | Fisher Scientific | A11031 | Labels primary antibodies. Used at 1:200 concentration. |
| Alexa Fluor 568 goat anti rabbit | Fisher Scientific | A11036 | Labels primary antibodies. Used at 1:200 concentration. |
| anti- Bruchpilot (BRP) antibody | Developmental Studies Hybridoma Bank | NC82 | Stains the active zones in presynaptic neurons. Used at 1:25 concentration. |
| anti-GluRIII antibody | Gift from Aaron DiAntonio | N/A | Labels glutamate receptor subunits. Used at 1:1000 concentration. |
| anti-Synapsin antibody | Developmental Studies Hybridoma Bank | 3C11 | Labels the synaptic protein synapsin. Used at 1:50 concentration. |
| anti-Syntaxin antibody | Developmental Studies Hybridoma Bank | 8C3 | labels the synaptic protein syntaxin. Used at 1:10 concentration. |
| BenchRocker | Genesee Scientific | 31-302 | Rotating samples during staining |
| Blade Breaker | Fine Science Tools | 10053-09 | Used for holding feather blade |
| cover slips | Fisher Scientific | 12548A | For mounting tissue |
| cryogenic gloves | VWR | 97008-198 | protect hands from liquid nitrogen |
| cryogenic tweezers | VWR | 82027-432 | Hold 2.0 mL tube in liquid nitrogen |
| dewar flask-1900 mL | Thomas Scientific | 5028M54 | Hold liquid nitrogen |
| Feather Blades | Electron Microscopy Sciences | 72002-01 | Scalpel Blades |
| Fine Forecps x 2 | Fine Science Tools | 11252-20 | One fine pair for Clearing midline of thorax. The other pair can be dulled using a sharpening stone. |
| FITC-conjugated anti HRP | Jackson Laboratories | 123-545-021 | Stains Motor Neurons. Used at 1:100 concentration |
| freezer box (Black) | Fisher Scientific | 14100F | Protects samples from light |
| glass pasteur pipettes | VWR | 14637-010 | Used to transfer samples |
| glass slides | Fisher Scientific | 12550143 | For mounting tissue |
| mounting media (vectashield) anti-fade | VWR | 101098-042 | Mounting media retains fluorescent signaling |
| nail polish | Electron Microscopy Sciences | 72180 | Seals microscope slides |
| normal goat serum | Fisher Scientific | PCN5000 | Prevents non-specific binding of antibodies |
| paint brush | Genesee Scientific | 59-204 | Transferring flies |
| PBS | Fisher Scientific | 10-010-023 | Saline solution for dissecting and staining |
| Phalloidin 647 | Abcam | AB176759 | Stains F-Actin in muscle Tissue. Used at 1:1000 concentration |
| plastic petri dish (100 mm) | VWR | 25373-100 | Dissection dish |
| reinforcement labels | W.B. Mason | AVE05722 | Provides support for glass coverslip over the mounted tissue |
| sharpening block | Grainger | 1RDF5 | Keeping fine forceps sharp and also dulling separate pair |
| slide folder | VWR | 10126-326 | Sample storage |
| standard office scissors | W.B. Mason | ACM40618 | Cutting reinforcement labels |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | Coating for dissection dish |
| Triton-X-100 | Electron Microscopy Sciences | 22140 | Helps to permeabilize tissue |
| Vannas Disssection Sissors | Fine Science Tools | 1500-00 | Ued for removing fly legs and making an incision on thorax |
Referenzen
- Casas, C., Manzano, R., Vaz, R., Osta, R., Brites, D. Synaptic failure: focus in an integrative view of ALS. Brain Plasticity. 1, 159-175 (2016).
- Lodato, M. A., et al. Aging and neurodegeneration are associated with increased mutations in single human neurons. Science. 359, 555-559 (2018).
- López-Erauskin, J., et al. ALS/FTD-linked mutation in FUS suppresses intra-axonal protein synthesis and drives disease without nuclear loss-of-function of FUS. Neuron. 100, 816-830 (2018).
- Munsie, L., et al. Retromer-dependent neurotransmitter receptor trafficking to synapses is altered by the Parkinson's disease VPS35 mutation p. D620N. Human Molecular Genetics. 24, 1691-1703 (2015).
- Oddo, S., et al. Triple-transgenic model of Alzheimer's disease with plaques and tangles: intracellular Aβ and synaptic dysfunction. Neuron. 39, 409-421 (2003).
- Selkoe, D. J. Alzheimer's disease is a synaptic failure. Science. 298, 789-791 (2002).
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Current Opinion in Neurobiology. 17, 35-42 (2007).
- Jan, L., Jan, Y. Properties of the larval neuromuscular junction in Drosophila melanogaster. The Journal of Physiology. 262, 189-214 (1976).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Babcock, D. T., Ganetzky, B. An improved method for accurate and rapid measurement of flight performance in Drosophila. Journal of Visualized Experiments. , e51223 (2014).
- Fernandes, J., Bate, M., Vijayraghavan, K. Development of the indirect flight muscles of Drosophila. Development. 113, 67-77 (1991).
- Fernandes, J., VijayRaghavan, K. The development of indirect flight muscle innervation in Drosophila melanogaster. Development. 118, 215-227 (1993).
- Fernandes, J. J., Keshishian, H. Patterning the dorsal longitudinal flight muscles (DLM) of Drosophila: insights from the ablation of larval scaffolds. Development. 122, 3755-3763 (1996).
- Fernandes, J. J., Keshishian, H. Nerve-muscle interactions during flight muscle development in Drosophila. Development. 125, 1769-1779 (1998).
- Hebbar, S., Fernandes, J. J. Pruning of motor neuron branches establishes the DLM innervation pattern in Drosophila. Journal of Neurobiology. 60, 499-516 (2004).
- Hebbar, S., Fernandes, J. J. A role for Fas II in the stabilization of motor neuron branches during pruning in Drosophila. Developmental Biolology. 285, 185-199 (2005).
- Danjo, R., Kawasaki, F., Ordway, R. W. A tripartite synapse model in Drosophila. PloS One. 6, (2011).
- Hunt, L. C., Demontis, F. Whole-mount immunostaining of Drosophila skeletal muscle. Nature Protocols. 8, 2496-2501 (2013).
- Kucherenko, M. M., et al. Paraffin-embedded and frozen sections of Drosophila adult muscles. Journal of Visualized Experiments. , e2438 (2010).
- Llamusi, B., et al. BSF and TBPH are mislocalized in the muscle sarcomere of a Drosophila myotonic dystrophy model. Disease Models & Mechanisms. 6, 184-196 (2013).
- Pantoja, M., Fischer, K. A., Ieronimakis, N., Reyes, M., Ruohola-Baker, H. Genetic elevation of sphingosine 1-phosphate suppresses dystrophic muscle phenotypes in Drosophila. Development. 140, 136-146 (2013).
- Schnorrer, F., et al. Systematic genetic analysis of muscle morphogenesis and function in Drosophila. Nature. 464, 287-291 (2010).
- Viswanathan, M. C., Blice-Baum, A. C., Schmidt, W., Foster, D. B., Cammarato, A. Pseudo-acetylation of K326 and K328 of actin disrupts Drosophila melanogaster indirect flight muscle structure and performance. Frontiers in Physiology. 6, 116 (2015).
- Hebbar, S., Fernandes, J. J. Glial remodeling during metamorphosis influences the stabilization of motor neuron branches in Drosophila. Developmental Biology. 340, 344-354 (2010).
- Mahr, A., Aberle, H. The expression pattern of the Drosophila vesicular glutamate transporter: a marker protein for motoneurons and glutamatergic centers in the brain. Gene Expression Patterns. 6, 299-309 (2006).
- Ritson, G. P., et al. TDP-43 mediates degeneration in a novel Drosophila model of disease caused by mutations in VCP/p97. Journal of Neuroscience. 30, 7729-7739 (2010).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Klagges, B. R., et al. Invertebrate synapsins: a single gene codes for several isoforms in Drosophila. Journal of Neuroscience. 16, 3154-3165 (1996).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proceedings of the National Academy of Sciences of the United States of America. 79, 7929-7933 (1982).
- Wagh, D. A., et al. a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila. Neuron. 49, 833-844 (2006).
- Marrus, S. B., DiAntonio, A. Preferential localization of glutamate receptors opposite sites of high presynaptic release. Current Biology. 14, 924-931 (2004).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological recordings from the giant fiber pathway of D. melanogaster. Journal of Visualized Experiments. , e2412 (2011).
- Maccioni, R., et al. Standardized phytotherapic extracts rescue anomalous locomotion and electrophysiological responses of TDP-43 Drosophila melanogaster model of ALS. Scientific Reports. 8, 16002 (2018).
- Siddiqi, O., Benzer, S. Neurophysiological defects in temperature-sensitive paralytic mutants of Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 73, 3253-3257 (1976).
- Wang, Z. H., Clark, C., Geisbrecht, E. R. Drosophila clueless is involved in Parkin-dependent mitophagy by promoting VCP-mediated Marf degradation. Human Molecular Genetics. 25, 1946-1964 (2016).
- O'Sullivan, A., et al. Multifunctional Wing Motor Control of Song and Flight. Current Biology. 28, 2705-2717 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten