Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine standardisierte Methode zur Messung der Ellenbogenkinästhesie
In diesem Artikel
Zusammenfassung
Hier stellen wir eine standardisierte Methode zur Messung der ellenbogenpassiven Kinesthesie unter Verwendung des Schwellenwerts zur Detektion passiver Bewegungen (TDPM) vor, die für eine Forschungsumgebung geeignet sind.
Zusammenfassung
Propriozeption ist ein wichtiger Bestandteil der kontrollierten Bewegung. Der Schwellenwert für den Nachweis passiver Bewegungen (TDPM) ist eine häufig verwendete Methode zur Quantifizierung der propriozeptiven Submodalität der Kinästhesie in Forschungsumgebungen. Das TDPM-Paradigma hat sich als gültig und zuverlässig erwiesen; Die für TDPM verwendeten Geräte und Methoden variieren jedoch zwischen den Studien. Insbesondere die Forschungslaborgeräte zur Passiven Bewegung einer Extremität werden oft von einzelnen Laboratorien individuell konstruiert oder sind aufgrund hoher Kosten unzugänglich. Es ist eine standardisierte, gültige und zuverlässige Methode zur Messung von TDPM mit leicht verfügbaren Geräten erforderlich. Der Zweck dieses Protokolls ist es, eine standardisierte Methode zur Messung von TDPM am Ellenbogen bereitzustellen, die wirtschaftlich und einfach zu verwalten ist und quantitative Ergebnisse für Messzwecke in forschungsbasierten Einstellungen liefert. Diese Methode wurde an 20 gesunden Erwachsenen ohne neurologische Beeinträchtigung und acht Erwachsenen mit chronischem Schlaganfall getestet. Die erzielten Ergebnisse deuten darauf hin, dass diese Methode eine zuverlässige Möglichkeit zur Quantifizierung von Ellenbogen-TDPM bei gesunden Erwachsenen ist und eine erste Unterstützung für die Gültigkeit bietet. Forscher, die ein Gleichgewicht zwischen der Erschwinglichkeit der Geräte und der Messgenauigkeit suchen, finden dieses Protokoll am ehesten von Nutzen.
Einleitung
Propriozeptive Informationen sind ein wichtiger Beitrag zur Kontrolle der menschlichen Bewegung. Propriozeptive Defizite begleiten eine breite Palette von neurologischen Erkrankungen wie Schlaganfall1,2,3,4,5,6, Parkinson-Krankheit7und sensorische Neuropathien8. Orthopädische Verletzungen wie Bänder- und Muskelrisse haben sich auch gezeigt, propriozeptive Funktion zu reduzieren9. Das Konstrukt der Propriozeption wird oft in klinischen Ergebnismaßnahmen durch Nachweis von vom Anbieter angewendeten kleinen Veränderungen in der Finger- oder Zehenposition10,,11,12,13,14getestet. Solche Messungen führen zu relativ groben Messungen: "abwesend", "beeinträchtigt", "normal"12. Während für den Nachweis von grobpropriozeptiven Beeinträchtigungen ausreichend sind, sind mechanische Laborprüfverfahren erforderlich, um subtile propriozeptive Beeinträchtigungen genau zu messen14,15,16.
Forscher und Kliniker teilen Propriozeption oft in Submodalitäten für die Messung. Die am häufigsten untersuchten Submodalitäten der Propriozeption sind gelenker Positionssinn (JPS) und Kinästhesie, typischerweise definiert als Bewegungssinn3,16,17. Der Gelenkpositionssinn wird oft über aktive Matching-Aufgaben getestet, bei denen Individuen einen Referenzgelenkwinkel18,19replizieren. Die Kinästhesie wird üblicherweise anhand des Schwellenwerts zur Detektion passiver Bewegung (TDPM) gemessen, wobei die Gliedmaßen eines Teilnehmers passiv langsam bewegt werden, wobei der Teilnehmer den Punkt angibt, an dem die Bewegung zuerst erkannt wird16,17,19. Die Messung von TDPM erfordert in der Regel die Verwendung spezieller Geräte, um die langsame passive Bewegung bereitzustellen und den Punkt der Detektion17zu bezeichnen.
Gültige und zuverlässige Ergebnisse wurden an verschiedenen Gelenken mit TDPM-Methoden9,16,19,,20,21,22gefunden. Allerdings gibt es erhebliche Unterschiede in tDPM-Ausrüstung und -Methoden, was eine Herausforderung für den Vergleich der Ergebnisse in den Studien16,17darstellt. Laboratorien entwickeln oft ihre eigenen Gliedmaßenbewegungs- und Messgeräte oder verwenden teure kommerzielle Geräte und Software16. Passive Bewegungsgeschwindigkeiten variieren ebenfalls; Es ist bekannt, dass die Bewegungsgeschwindigkeit die Erkennungsschwellen7,16,23beeinflusst. Es ist eine standardisierte, leicht reproduzierbare Methode erforderlich, die Instanddesraten über eine Reihe von Beeinträchtigungsstufen quantifizieren kann. Da sich die Anatomie und Physiologie der einzelnen Gelenke unterscheiden, sollten Protokolle gelenkspezifisch sein19. Das hier skizzierte Protokoll ist spezifisch für das Ellenbogengelenk. Die Methoden dieses Protokolls können jedoch nützlich sein, um Protokolle für andere Verbindungen festzulegen.
Um die Verallgemeinerung in sensorimotorischen Forschungslaboratorien zu erhöhen, wäre das bevorzugte Gerät zur Bereitstellung der passiven Bewegung für Ellbogen-TDPM-Tests zu erschwinglichen Kosten kommerziell erhältlich. Zu diesem Zweck wurde eine Bogenkontinuierlich-Passivbewegung (CPM) Maschine (verfügbarer Drehzahlbereich 0,23°/s – 2,83°/s) gewählt, um die motorisierte, konsistente Bewegung zu erzeugen. CPM-Maschinen sind häufig in Rehabilitationskliniken und medizinischen Versorgungsgeschäften zu finden und können gemietet oder ausgeliehen werden, um forschungskostenzu reduzieren. Weitere Anforderungen an die Ausrüstung umfassen Gegenstände, die häufig in sensorimotorischen Laboratorien (z. B. Elektrogoniometer- und Elektromyographie-Sensoren (EMG)) zu finden sind), und Instandeder (z. B. PVC-Rohre, Schnur und Klebeband).
Zwei verschiedene Gruppen wurden getestet, um die Messeigenschaften dieses TDPM-Protokolls zu untersuchen: gesunde Erwachsene und Erwachsene mit chronischem Schlaganfall. Bei Erwachsenen mit chronischem Schlaganfall wurde der ipsilesionale (d.h. weniger betroffene) Arm getestet. Kinesthetic Sinn im ipsilesionalen Ellenbogen bei Erwachsenen mit chronischem Schlaganfall kann normal mit klinischen Tests erscheinen, aber beeinträchtigt, wenn mit quantitativen Labormethoden5,15bewertet. Dieses Beispiel veranschaulicht die Bedeutung der Entwicklung und Verwendung sensibler und präziser Messgrößen für somatosensorische Beeinträchtigungen und macht dies zu einer nützlichen Population zu Testzwecken. Für die Validierung dieses Protokolls haben wir die Methode24der bekannten Gruppen verwendet. Wir verglichen TDPM mit einem anderen quantitativen Maß der Kinästhesie, dem Brief Kinesthesia Test (BKT). Es hat sich gezeigt, dass das BKT empfindlich auf ipsilesionale Beeinträchtigung der oberen Extremität nach Schlaganfall25ist. Die Tablet-basierte Version (tBKT) wurde in dieser Studie verwendet, weil es der gleiche Test wie die BKT ist, die auf einer Tablette mit mehr Studien verabreicht wird. Der tBKT hat sich bei der einwöchigen Test-Retest-Messung als stabil erwiesen und ist empfindlich gegenüber propriozeptivem Knockdown26. Es wurde vermutet, dass die Ellbogen-TDPM- und tBKT-Ergebnisse korreliert würden, da die sensorimotorische Kontrolle des Ellenbogens zur BKT-Leistung26beiträgt.
Der Zweck dieses Papiers ist es, eine standardisierte Methode zur Messung von Ellenbogen-TDPM zu skizzieren, die mit gängigen Geräten reproduzierbar ist. Es werden Daten über die Zuverlässigkeit und die anfängliche Gültigkeitsprüfung der Methode sowie über die Durchführbarkeit der Anwendung für Personen ohne bekannte Pathologie und personen, bei denen eine leichte somatosensorische Beeinträchtigung vermutet wurde, vorgelegt.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Das Institutional Review Board am College of St. Scholastica hat die Studie genehmigt, unter der dieses Protokoll entwickelt und getestet wurde.
1. Herstellung des visuellen Bildschirms
- Schneiden Sie das PVC-Rohr mit einem Durchmesser von 1,9 cm in verschiedene Längen: zwei 76,2 cm große Stücke (Bildschirmsockel); zwei 8 Zoll (20,3 cm) Stück (Bildschirmsockel); ein 44 Zoll (111,8 cm) Stück (vertikale Bildschirmstütze); und ein 32 Zoll (81,3 cm) Stück (Bildschirmstoffhalter).
- Legen Sie eine Endkappe auf ein Ende jedes 30 Zoll (76,2 cm) Stück, und einen 90° PVC-Ellbogen auf dem anderen Ende. Legen Sie 8 Zoll (20,3 cm) Stücke in die verbleibenden offenen Enden beider Ellenbogen ein. Schließen Sie offene Enden der beiden 8 Zoll (20,3 cm) Stücke mit dem PVC-T-Shirt an, um eine Bildschirmbasis zu erstellen.
- Legen Sie das 44 Zoll (111,8 cm) PVC-Stück in den vertikalen Teil des PVC-T-Shirts ein, um eine vertikale Unterstützung für den Bildschirm zu erstellen. Legen Sie den 45° PVC-Bogen am offenen Ende des 44 Zoll (111,8 cm) Stücks. Setzen Sie das 32 Zoll (81,3 cm) Stück in das offene Ende des 45° PVC-Bogens ein, um einen Siebstoffhalter zu erstellen. Legen Sie eine Endkappe auf das offene Ende des 32 Zoll (81,3 cm) Stücks.
- Legen Sie Geschirrtücher übereinander, um stoffodienizität zu gewährleisten. Sichern Sie sich das 32 Zoll (81,3 cm) Stück mit Athletikband. Der vollständig montierte Bildschirm ist in Abbildung 1zu sehen.
2. Vorbereitung der Prüfgeräte
- Kalibrieren Sie Elektrogoniometer- und Elektromyographie-Sensoren (EMG) gemäß den Anweisungen der Hersteller.
- Schalten Sie die kontinuierliche passive Bewegungsmaschine (CPM) ein und aktivieren Sie den Erweiterungs-/Flexion-Modus. Programmieren Sie die CPM-Maschine, um sich durch eine Ellenbogenverlängerung von 90° bis 130° mit einer Geschwindigkeit von 0,23°/s zu bewegen.
3. Vorbereitung des Teilnehmers auf TDPM-Tests
- Setzen Sie den Teilnehmer in einen Standard-Höhenstuhl (18 Zoll/45,7 cm), so dass das Sitzen mit geradem Rücken und Füßen flach auf dem Boden.
- Bereiten Sie den Teilnehmer mit einem standardisierten Skript verbal auf den EMG-Sensor und die Elektrogoniometer-Platzierung vor: "Zunächst werde ich Ihre Haut auf die Befestigung von Sensoren vorbereiten. Sie helfen, Bewegung aufzuzeichnen und sicherzustellen, dass Ihre Muskeln während des Tests entspannt sind. Ich werde Markierungen auf Ihrem Arm markieren und beginnen, die Sensoren zu befestigen, so dass Sie einfach in der Position entspannen können, in der ich Sie platzieren."
- Befestigen Sie die Bizeps brachii und die Trizeps brachii EMG Sensoren.
- Widerstehen Sie manuell Ellbogenbeugung, um den Bizeps brachii Muskelbauch zu lokalisieren und markieren Sie den zentralen Punkt des Muskelbauchs mit einem kleinen Punkt von waschbaren Marker, um die Position für die EMG-Sensorplatzierung zu bezeichnen. Bereiten Sie die Haut vor, indem Sie die abgestorbenen Hautzellen entfernen, gefolgt von dem Schrubben mit einem Alkoholtupfer, und befestigen Sie dann den EMG-Sensor.
- Handlich widerstehen Ellenbogenverlängerung, um den Muskelbauch des seitlichen Kopfes des Trizeps brachii zu lokalisieren und markieren Sie den zentralen Punkt in der Masse des Muskelbauchs mit einem kleinen Punkt von waschbaren Marker, um die Position für die EMG-Sensorplatzierung zu bezeichnen. Bereiten Sie die Haut vor, indem Sie abgestorbene Hautzellen entfernen, gefolgt von dem Schrubben mit einem Alkoholtupfer, und befestigen Sie dann den EMG-Sensor.
- Testen Sie die EMG-Funktion, indem Sie eine isometrische Bizepsbrachii-Kontraktion heraufbeschwören, gefolgt von einer isometrischen Trizeps-Brachii-Kontraktion und Beobachtung für die EMG-Aktivierung.
- Befestigen Sie das Elektrogoniometer am Teilnehmer.
- Bestimmen Sie den Mittelpunkt des dorsalen Aspekts des Handgelenks und markieren Sie mit einem waschbaren Marker.
- Palpate den prominentesten Aspekt der seitlichen Epicondyle und markieren Sie mit einem waschbaren Marker.
- Palpate die größere Knolle des Humerus und markieren Sie mit einem waschbaren Marker. Überprüfen Sie die größere Knollenposition, indem Sie den Prüfarm bei Bedarf passiv durch interne und externe Rotation des Humerus bewegen.
- Befestigen Sie ein Ende der Saite mit Papierband an der seitlichen Epicondyle-Markierung. Ziehen Sie die Schnur straff, verbindet sie mit der dorsalen Handgelenk-Mittelpunktmarkierung.
- Verfolgen Sie eine Linie entlang des proximalen Unterarms in Übereinstimmung mit der Schnur mit einem waschbaren Marker.
- Verschieben Sie das freie Ende der Zeichenfolge in die größere Knollenmarkierung, und ziehen Sie die Schnur straff.
- Verfolgen Sie eine Linie entlang des distalen Humerus in Übereinstimmung mit der Zeichenfolge mit einem waschbaren Marker, und entfernen Sie dann die Zeichenfolge.
- Platzieren Sie das distale Paddel des Elektrogonometers entlang des Pfades der verfolgten Linie, 1,5 Zoll (3,8 cm) distal von der seitlichen Epicondyle-Marke entfernt.
- Platzieren Sie das proximale Paddel des Elektrogonometers entlang des Pfades der verfolgten Linie, 1,5 Zoll (3,8 cm) proximal von der seitlichen Epicondyle-Marke entfernt. Befestigen Sie die restlichen Komponenten des Elektrogonometers mit Papierband auf der Haut.
- Positionieren Sie die obere Extremität des Teilnehmers bequem in der CPM-Maschine.
- Passen Sie die Höhe und Ausrichtung der CPM-Maschine an, um eine Position von 90° sagittalebener Schulterflexion, 90° Ellenbogenbeugung und einem neutralen Unterarm zu erreichen. Richten Sie das seitliche Epicondyle des Teilnehmers an der Rotationsachse der CPM-Maschine aus.
- Passen Sie die Handstütze der CPM-Maschine so an, dass sie bequem mit der Handfläche des Teilnehmers zusammenpasst und den Unterarm über ein Armband sichert. Abbildung 1 zeigt die endgültige Teilnehmereinrichtung für TDPM-Tests.
4. Verwaltung des TDPM-Tests
- Informieren Sie den Teilnehmer über das Testverfahren mit folgenden standardisierten verbalen Informationen: "Während dieses Tests wird sich die Maschine sehr langsam bewegen, um entweder den Ellenbogen zu begradigen oder zu biegen. Wir werden zu Beginn jedes Prozesses "beginnen" sagen, es wird acht Prüfungen geben. Wenn ich sage, beginnen, kann die Maschine oder nicht bewegen Sie Ihren Arm. Bitte drücken Sie die Taste, sobald Sie spüren, dass sich Ihr Arm bewegt, aber nur, wenn Sie Bewegung spüren. Wenn Sie keine Bewegung spüren, werden wir die Prüfung nach einer gewissen Zeit beenden; versuchen, aufmerksamkeit zu schenken, bis wir die Studie beenden. Dies ist die Schaltfläche, die Sie verwenden werden. Bitte drücken Sie jetzt die Taste, um sie zu testen."
- Geben Sie dem Teilnehmer den Elektrogoniometer-Ereignismarkierungsauslöserschalter und testen Sie den Schalter.
- Informieren Sie den Teilnehmer über weitere Aspekte des Verfahrens: "Zwischen jedem Versuch, ob sich ihr Arm bewegt oder nicht, nehmen wir Ihren Arm aus der Maschine und richten ihn aus und legen ihn dann wieder in die Maschine. Bitte bleiben Sie entspannt. Haben Sie Fragen zum Test? Wir werden diesen Vorhang verwenden, um Ihre Sicht während dieses Tests zu blockieren und diesen Gehörschutz über Ihre Ohren zu legen, um alle Geräusche zu minimieren, die Sie während des Tests hören könnten."
- Schließen Sie die visuelle Eingabe ab, indem Sie die Ansicht des zu testenden Arms und der CPM-Maschine mithilfe eines visuellen Bildschirms blockieren. Drape Bildschirmmaterial an der Schulter des Teilnehmers, um sensorische Eingaben während der Armbewegung zu vermeiden. Verringern Sie den akustischen Eingang, indem Sie geräuschunterdrückende Kopfhörer auf den Teilnehmer legen (siehe Abbildung 1).
- Geben Sie laut "begin" an, und warten Sie die entsprechende Zeit pro Versuch, bevor Sie die Bewegung der CPM-Maschine starten, um das Erraten der Teilnehmer zu verringern, wann die Bewegung beginnt19. Standardisierte Verzögerungszeiten sind in Tabelle 1dargestellt.
| Testnummer | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Verzögerung (s) | 1 | Fangen | 3 | 1 | 2 | Fangen | 3 | 1 |
Tabelle 1: Standardisierte Zeitverzögerungen und Fangversuchsorte. Abwechslungsreiche Zeitverzögerungen bei Teststarts sind enthalten, um teilnehmerversuche zu verhindern, zu erraten, wann die Bewegung beginnt. Fangversuche sind enthalten, um zu testen, ob der Teilnehmer tatsächlich Bewegung19,31erkennt.
- Beobachten Sie für die Aktivierung von Bizeps brachii und Trizeps brachii Muskeln durch die Überwachung EMG Sensor Feedback Messungen, um sicherzustellen, dass der Teilnehmer nicht versucht, aktive Bewegung zu verwenden, um bei der Bewegungserkennung zu unterstützen.
- Wenn die Muskelaktivierung festgestellt wird, beenden Sie die Studie und verwenden Sie das folgende standardisierte Skript: "Ihre Muskeln aktivieren sich. Bitte versuchen Sie, Ihren Arm während des Tests entspannt zu halten." Diese Studie sollte für den Ausschluss von der Datenanalyse beachtet werden, wobei der Forscher mit dem Zurücksetzen des Teilnehmers und CPM fortfährt, um die nächste Studie zu starten (Protokollschritt 4.7).
- Entfernen Sie zwischen jeder Studie den Prüfarm des Teilnehmers von der CPM-Maschine und bringen Sie die CPM-Maschine in eine 90°-Startposition zurück. Bewegen Sie den Ellenbogen des Teilnehmers passiv durch die volle Verlängerung und dann wieder auf 90° Flexion, um die Bewegungshistorie der Muskelspindel zu standardisieren27,28. Legen Sie den Arm für die nächste Testversion wieder in die CPM-Maschine.
- Führen Sie acht Versuche durch, darunter zwei "Catch"-Tests, bei denen der Arm des Teilnehmers nicht bewegt wird19. Beenden Sie jede Testversion (Catch und Non-Catch), wenn der Teilnehmer den Triggerschalter deprimiert, oder nach 15 Sekunden, wenn der Triggerschalter nicht gedrückt wird.
- Wenn ein Teilnehmer während eines Fangversuchs mündlich berichtet, dass er keine Bewegung fühlen kann, oder den Triggerschalter drückt, verwenden Sie die folgende standardisierte Antwort: "Ihr Arm hat sich während dieser Prüfung nicht wirklich bewegt. Ich weiß, es ist schwer zu fühlen, die Maschine bewegt sich sehr langsam; versuchen Sie, sich zu konzentrieren und drücken Sie den Knopf, sobald Sie das Gefühl haben, dass sich Ihr Arm bewegt oder sich Ihre Armposition geändert hat."
5. Berechnung des TDPM-Scores des Teilnehmers
- Identifizieren Sie mithilfe der Elektrogoniometer-Tracing die Elektrogoniometerwinkelmessung für den Punkt, an dem die CPM-Maschinenbewegung begann, und für den Punkt, an dem der Teilnehmer den Triggerschalter gedrückt hat, der die Bewegung anzeigt. Ein repräsentatives Beispiel finden Sie in Abbildung 2.
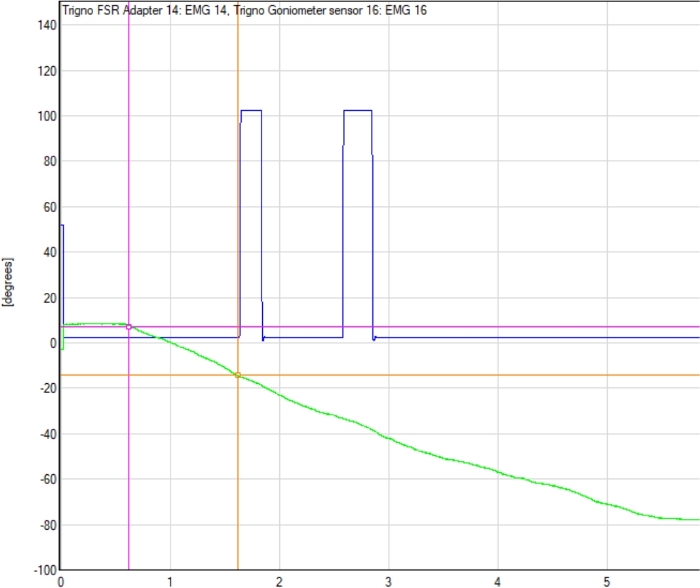
Abbildung 2: Beispiel Elektrogoniometer-Tracing mit Detektionspunkt. Die Elektrogoniometer-Linienverfolgung (grüne Linie), der Startpunkt der kontinuierlichen passiven Bewegung (CPM) Maschinenbewegung und der Punkt, an dem teilnehmerangegebene Bewegung erkannt wurde (erste blaue Spitze), werden angezeigt. Der Unterschied zwischen den Elektrogoniometerwerten zu Beginn der Studie (rosa Kreis) und dem Detektionspunkt (orangefarbener Kreis) bestimmt den TDPM-Wert für diese Studie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Subtrahieren Sie den Startwinkel vom letzten Winkel, wodurch die Anzahl der Grade identifiziert wird, die das CPM bewegt hat; Dies ist der TDPM-Wert des Teilnehmers für diese Testversion.
- Um den Gesamten TDPM-Wert des Teilnehmers zu ermitteln, entfernen Sie die kleinsten und größten TDPM-Werte aus den sechs Nicht-Catch-Tests, und durchschnittlich die verbleibenden vier Testergebnisse29.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Teilnehmer:
Anhand des hier vorgestellten Protokolls wurde Ellbogen-TDPM in einem akademischen Forschungslabor für zwei verschiedene Personengruppen gemessen: 20 gesunde Erwachsene und acht Erwachsene mit chronischem Schlaganfall. Die Teilnehmer beider Gruppen wurden aus der Community mit Flyern, E-Mails und Mundpropaganda rekrutiert. Die gesunden Erwachsenen (14 Frauen, sechs Männer; Durchschnittsalter (SD) = 28 (7,9) Jahre; 19 Rechts- und eine Linkshänder) wurden getestet, um repräsentative Erge...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das vorgestellte Protokoll beschreibt, wie Ellenbogen-TDPM auf standardisierte Weise mit einer gemeinsamen CPM-Maschine gemessen wird, um die passive Bewegung bereitzustellen. Bei 20 gesunden Teilnehmern wurde festgestellt, dass die durchschnittliche TDPM-Messung des Ellenbogens dem in früheren Studien ermittelten Durchschnittswert mit anderen TDPM-Messeinrichtungen7,19,32ähnelte und zuverlässige Ergebnisse in den Testsitzung...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Die Autoren danken Dr. Jon Nelson für die technische Unterstützung der hier eingesetzten EMG- und Elektrogoniometer-Geräte.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 3/4 inch diameter PVC pipe | Charlotte Pipe | Pipe to be cut into lengths of: 30 inches/76.2 cm (x2); 8 inches/20.3 cm (x2); 44 inches/111.8 cm (x1); 32 inches/81.3 cm (x1). | |
| 3/4 inch diameter PVC pipe end caps (x3) | Charlotte Pipe | ||
| 3/4 inch diameter PVC tee (x1) | Charlotte Pipe | ||
| 45° PVC elbow (x1) | Charlotte Pipe | ||
| 90° PVC elbows (x2) | Charlotte Pipe | ||
| Athletic tape | 3M | ||
| Delsys acquisition software (EMGworks) | Delsys | ||
| Double-sided tape | 3M | ||
| Duct tape | 3M | Used to assist in removal of dead skin cells on participant's skin prior to EMG sensor placement. | |
| Elbow Continuous Passive Motion (CPM) Machine | Artromot | Chattanooga Artromot E2 Compact Elbow CPM; Model 2038 | |
| Electrogoniometer | Biometrics, Ltd | ||
| Flour sack dishcloths (x2) | Room Essentials | Fabric used for creation of visual screen. | |
| Handheld external trigger switch | Qualisys | Trigger switch used for electrogoniometer event marking. | |
| Hearing occlusion headphones | Coby | ||
| Isopropyl alcohol | Mountain Falls | ||
| Paper tape | 3M | ||
| Ruler with inch markings | Westcott | ||
| Standard height chair | KI | ||
| String | Quality Park | Approximately 15 inches of string needed. String used for standardization of electrogoniometer placement. | |
| Trigno Goniometer Adapter | Delsys | ||
| Trigno Wireless Electromyography Sensors | Delsys | ||
| Washable marker | Crayola | ||
| Washcloth | Aramark | Used in combination with isopropyl alcohol for cleaning participant's skin prior to EMG sensor placement. |
Referenzen
- Coderre, A. M., et al. Assessment of upper-limb sensorimotor function of subacute stroke patients using visually guided reaching. Neurorehabilitation and Neural Repair. 24 (6), 528-541 (2010).
- Dukelow, S. P., et al. Quantitative assessment of limb position sense following stroke. Neurorehabilitation and Neural Repair. 24 (2), 178-187 (2010).
- Semrau, J. A., Herter, T. M., Scott, S. H., Dukelow, S. P. Robotic identification of kinesthetic deficits after stroke. Stroke. 44 (12), 3414-3421 (2013).
- Meyer, S., Karttunen, A. H., Thijs, V., Feys, H., Verheyden, G. How do somatosensory deficits in the arm and hand relate to upper limb impairment, activity, and participation problems after stroke? A systematic review. Physical Therapy. 94 (9), 1220-1231 (2014).
- Desrosiers, J., Bourbonnais, D., Bravo, G., Roy, P. M., Guay, M. Performance of the 'unaffected' upper extremity of elderly stroke patients. Stroke. 27 (9), 1564-1570 (1996).
- Carey, L. M., Matyas, T. A. Frequency of discriminative sensory loss in the hand after stroke in a rehabilitation setting. Journal of Rehabilitation Medicine. 43 (3), 257-263 (2011).
- Konczak, J., Krawczewski, K., Tuite, P., Maschke, M. The perception of passive motion in Parkinson's disease. Journal of Neurology. 254 (5), 655(2007).
- Van Deursen, R. W. M., Simoneau, G. G. Foot and ankle sensory neuropathy, proprioception, and postural stability. Journal of Orthopaedic & Sports Physical Therapy. 29 (12), 718-726 (1999).
- Reider, B., et al. Proprioception of the knee before and after anterior cruciate ligament reconstruction. Arthroscopy: The Journal of Arthroscopic & Related Surgery. 19 (1), 2-12 (2003).
- Hizli Sayar, G., Unubol, H. Assessing Proprioception. The Journal of Neurobehavioral Sciences. 4 (1), 31-35 (2017).
- Fugl-Meyer, A. R., Jääskö, L., Leyman, I., Olsson, S., Steglind, S. The post-stroke hemiplegic patient. 1. a method for evaluation of physical performance. Scandinavian journal of Rehabilitation Medicine. 7 (1), 13-31 (1975).
- Stolk-Hornsveld, F., Crow, J. L., Hendriks, E., Van Der Baan, R., Harmeling-van Der Wel, B. The Erasmus MC modifications to the (revised) Nottingham Sensory Assessment: a reliable somatosensory assessment measure for patients with intracranial disorders. Clinical Rehabilitation. 20 (2), 160-172 (2006).
- Winward, C. E., Halligan, P. W., Wade, D. T. The Rivermead Assessment of Somatosensory Performance (RASP): standardization and reliability data. Clinical Rehabilitation. 16 (5), 523-533 (2002).
- Lincoln, N. B., et al. The unreliability of sensory assessments. Clinical rehabilitation. 5 (4), 273-282 (1991).
- Sartor-Glittenberg, C. Quantitative measurement of kinesthesia following cerebral vascular accident. Physiotherapy Canada. 45, 179-186 (1993).
- Hillier, S., Immink, M., Thewlis, D. Assessing proprioception: a systematic review of possibilities. Neurorehabilitation and Neural Repair. 29 (10), 933-949 (2015).
- Han, J., Waddington, G., Adams, R., Anson, J., Liu, Y. Assessing proprioception: a critical review of methods. Journal of Sport and Health Science. 5 (1), 80-90 (2016).
- Goble, D. J. Proprioceptive acuity assessment via joint position matching: from basic science to general practice. Physical Therapy. 90 (8), 1176-1184 (2010).
- Juul-Kristensen, B., et al. Test-retest reliability of joint position and kinesthetic sense in the elbow of healthy subjects. Physiotherapy Theory and Practice. 24 (1), 65-72 (2008).
- Deshpande, N., Connelly, D. M., Culham, E. G., Costigan, P. A. Reliability and validity of ankle proprioceptive measures. Archives of Physical Medicine and Rehabilitation. 84 (6), 883-889 (2003).
- Boerboom, A., et al. Validation of a method to measure the proprioception of the knee. Gait & Posture. 28 (4), 610-614 (2008).
- Nagai, T., Sell, T. C., Abt, J. P., Lephart, S. M. Reliability, precision, and gender differences in knee internal/external rotation proprioception measurements. Physical Therapy in Sport. 13 (4), 233-237 (2012).
- Refshauge, K. M., Chan, R., Taylor, J. L., McCloskey, D. Detection of movements imposed on human hip, knee, ankle and toe joints. The Journal of Physiology. 488 (1), 231-241 (1995).
- Portney, L. G., Watkins, M. P. Foundations of Clinical Research: Applications to Practice. 892, Pearson/Prentice Hall. Upper Saddle River, NJ. (2009).
- Borstad, A., Nichols-Larsen, D. S. The Brief Kinesthesia test is feasible and sensitive: a study in stroke. Brazilian Journal of Physical Therapy. 20 (1), 81-86 (2016).
- Vernoski, J. L. J., Bjorkland, J. R., Kramer, T. J., Oczak, S. T., Borstad, A. L. A Simple Non-invasive Method for Temporary Knockdown of Upper Limb Proprioception. Journal of Visualized Experiments. (133), e57218(2018).
- Proske, U., Tsay, A., Allen, T. Muscle thixotropy as a tool in the study of proprioception. Experimental Brain Research. 232 (11), 3397-3412 (2014).
- Wise, A. K., Gregory, J. E., Proske, U. Detection of movements of the human forearm during and after co-contractions of muscles acting at the elbow joint. The Journal of Physiology. 508, Pt 1 325(1998).
- Wilcox, R. R., Granger, D. A., Clark, F. Modern robust statistical methods: Basics with illustrations using psychobiological data. Universal Journal of Psychology. 1 (2), 21-31 (2013).
- Oldfield, R. C. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Piriyaprasarth, P., Morris, M. E., Delany, C., Winter, A., Finch, S. Trials needed to assess knee proprioception following stroke. Physiotherapy Research International. 14 (1), 6-16 (2009).
- Juul-Kristensen, B., et al. Poorer elbow proprioception in patients with lateral epicondylitis than in healthy controls: a cross-sectional study. Journal of Shoulder and Elbow Surgery. 17 (1), 72-81 (2008).
- Skinner, H. B., Barrack, R. L., Cook, S. D. Age-related decline in proprioception. Clinical Orthopaedics and Related Research. (184), 208-211 (1984).
- Pai, Y. C., Rymer, W. Z., Chang, R. W., Sharma, L. Effect of age and osteoarthritis on knee proprioception. Arthritis & Rheumatism. 40 (12), 2260-2265 (1997).
- Dunn, W., et al. Measuring change in somatosensation across the lifespan. American Journal of Occupational Therapy. 69 (3), (2015).
- Alghadir, A., Zafar, H., Iqbal, Z., Al-Eisa, E. Effect of sitting postures and shoulder position on the cervicocephalic kinesthesia in healthy young males. Somatosensory & Motor Research. 33 (2), 93-98 (2016).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten