Method Article
Ein halbautomatisches ChIP-Seq-Verfahren für groß angelegte epigenetische Studien
In diesem Artikel
Erratum Notice
Zusammenfassung
Dieser Artikel beschreibt ein halbautomatisches, mikroskaliertes ChIP-Seq-Protokoll von DNA-Regionen, die mit einer spezifischen Histonmodifikation (H3K27ac) unter Verwendung einer ChIP-Liquid-Handler-Plattform assoziiert sind, gefolgt von der Bibliotheksvorbereitung mittels Tagmentation. Das Verfahren umfasst eine Kontrollbewertung für Qualitäts- und Quantitätszwecke und kann auf andere Histonmodifikationen oder Transkriptionsfaktoren angewendet werden.
Zusammenfassung
Chromatin-Immunpräzipitation gefolgt von Sequenzierung (ChIP-Seq) ist ein leistungsfähiger und weit verbreiteter Ansatz zur Profilierung von Chromatin-DNA, die mit spezifischen Histonmodifikationen wie H3K27ac assoziiert ist, um die Identifizierung von cis-regulatorischen DNA-Elementen zu unterstützen. Der manuelle Prozess zur Fertigstellung eines ChIP-Seq ist arbeitsintensiv, technisch anspruchsvoll und erfordert oft große Zellzahlen (>100.000 Zellen). Die hier beschriebene Methode hilft, diese Herausforderungen zu meistern. Ein komplettes halbautomatisches, mikroskaliertes H3K27ac ChIP-Seq-Verfahren einschließlich Zellfixierung, Chromatinscherung, Immunpräzipitation und Sequenzierungsbibliotheksvorbereitung für Batch von 48 Proben für Zellzahleingaben unter 100.000 Zellen wird detailliert beschrieben. Die halbautonome Plattform reduziert die technische Variabilität, verbessert das Signal-Rausch-Verhältnis und reduziert den Arbeitsaufwand drastisch. Das System kann dadurch die Kosten senken, indem es reduzierte Reaktionsvolumina ermöglicht und die Anzahl der teuren Reagenzien wie Enzyme, Magnetperlen, Antikörper und die erforderliche praktische Zeit begrenzt. Diese Verbesserungen der ChIP-Seq-Methode eignen sich hervorragend für groß angelegte epigenetische Studien an klinischen Proben mit begrenzten Zellzahlen in einer hochreproduzierbaren Weise.
Einleitung
Die breite Verwendung von ChIP-Seq-Assays zur Bestimmung von DNA-Fragmenten, die mit spezifischen Histonmodifikationen assoziiert sind, ist zum Teil auf ihre Fähigkeit zurückzuführen, cis-regulatorische DNA-Elemente zu identifizieren, einschließlich aktiver Enhancer, Promotoren, Schalldämpfer, Heterochromatin und anderer1,2,3,4. Die Identifizierung von nicht-kodierenden regulatorischen Regionen im gesamten Genom hat wertvolle Erkenntnisse zum besseren Verständnis der Genregulation in Gesundheit und Krankheiten gezeigt4. Frühere Arbeiten aus dem Labor haben chIP-Seq verwendet, um zu zeigen, dass cis-regulatorischeElemente in verschiedenen Zelltypen eine wichtige Rolle spielen können5. Transkriptionsfaktor (TF) ChIP-Assays wurden verwendet, um krankheitsassoziierte Risiko-Einzelnukleotid-Polymorphismen6 zuzeigen.
Die Verwendung von ChIP-Seq mit menschlichen klinischen Proben ist eine Herausforderung, hauptsächlich aufgrund der Begrenzung der Zellzahlen oder der gewünschten Gewebeprobe. Infolgedessen gab es konzertierte Anstrengungen auf diesem Gebiet, um diese Techniken zu verbessern und zu mikroskalieren, und infolgedessen sind mehrere Assays entstanden, wie CUT & TAG5,7,8,9,10,11,12. Dieser Assay verwendet eine Transposase, um genomische Regionen zu markieren und zu isolieren, die durch einen spezifischen Antikörper gebunden sind9. Diese Technik war in der Lage, die Zellzahlen auf 1.000 und in einigen Fällen auf eine einzelne Zelle zu reduzieren, jedoch hat die Verwendung dieser Technik in der translationalen Forschung und im klinischen Aufbau Einschränkungen aufgrund der Anforderungen der Verwendung lebender Zellen für diese Methode gezeigt9,12. Die Anforderung an lebende Zellen erschwert die logistische Handhabung klinischer Proben und kann batch-Effekte verursachen, wenn die Proben nicht gleichzeitig verarbeitet werden. Andere haben mikroskalige Techniken für formaldehydfixierte Zellen optimiert, darunter die Entwicklung der ChIPmentation11, die hier hochdurchsatzartig angepasst wird. Die Verwendung von festen Zellen ermöglicht es, Proben bis zur Entnahme und anschließenden Verarbeitung aller Proben zusammen zu lagern, um Batch-Effekte zu minimieren.
Hier wird ein halbautomatischer mikroskaliger ChIP-Seq-Assay beschrieben, der die experimentelle Hands-on-Zeit zur Profilierung von Histonmodifikationenreduziert 10. Die halbautomatische Methode ermöglicht ChIP-Seq-Assays mit hohem Durchsatz, so dass bis zu 48 Proben in nur 5 Tagen vollständig verarbeitet und für die Sequenzierung bereit sind, für nur 10.000 Zellen pro Probe mit einem ChIP-Liquid-Handler. Der Handler vervollständigt die Immunpräzipitation (IP) und die anschließenden Waschungen auf autonome Weise, was dazu beiträgt, die Variabilität zwischen den Proben zu reduzieren. Die halbautomatische Methode senkt sowohl die Hands-on-Zeit um über 15 h für 48 Proben als auch die technische Variabilität, so dass groß angelegte epigenetische Studien reproduzierbar und schnell für primär oder kultivierte Zellen durchgeführt werden können. Das Protokoll erklärt den Prozess von Anfang bis Ende für qualitativ hochwertiges ChIP-Seq. Wenn die spezifischen Computer nicht verfügbar sind, ist das Protokoll immer noch eine nützliche Ressource, um ChIP-Seq-Experimente manuell einzurichten und zu beheben.
Der Assay wurde mit drei verschiedenen primären menschlichen Immunzelltypen und einer kultivierten Zelllinie (HUT78 – ATCC: TIB-161) durchgeführt. Aus Gründen der Klarheit wurde das Protokoll in sieben Abschnitte unterteilt: Zellfixierung, Chromatinscherung durch Beschallung, automatisierte Chromatin-Immunpräzipitation, Bibliotheksvorbereitung durch DNA-Fragment-Tagmentierung, Bibliotheksamplifikation, Bibliotheksreinigung, gefolgt von DNA-Quantifizierung. Für Pufferrezepte siehe Ergänzende Tabelle 1.
Protokoll
Das Institutional Review Board (IRB) des La Jolla Institute for Allergy and Immunology (LJI; IRB-Protokoll Nr. SGE-121-0714) genehmigte die Studie. Gesunde Freiwillige wurden rekrutiert und lieferten Leukaphereseproben nach schriftlicher Einverständniserklärung.
1. Zellfixierung
- Bringen Sie die Zellsuspensionskonzentration auf 1 bis 2 x10 6 Zellen/ ml mit vollständigem Zellkulturmedium in einem 15 ml Röhrchen (<10 ml Suspension) oder 50 ml Röhrchen (10-30 ml Zellen). Wenn <1 x 106 Zellen, verwenden Sie 0,5 ml des Mediums in einem 1,5 ml Röhrchen.
- Die Zellsuspension vorsichtig wirbeln, 10x Zellfixationspuffer tropfenweise (1:10; vol:vol) hinzufügen und bei Raumtemperatur (RT) 10 min mit niedriger Geschwindigkeit drehen.
- Stoppen Sie die Reaktion durch vorsichtiges Wirbeln und fügen Sie 2,5 M Glycin im Verhältnis 1:20 (vol:vol) hinzu. Drehen Sie die Röhrchen einige Male um und inkubieren Sie mindestens 5 min auf Eis.
- Führen Sie die restlichen Schritte bei 4 °C oder auf Eis durch. Die Röhren bei 800 x g für 5 min bei 4 °C drehen und den Überstand verwerfen.
- Besuspen Sie das Pellet vorsichtig mit 5 ml eiskaltem 1x PBS und inkubieren Sie es für 2 min auf Eis.
- Wiederholen Sie 1,4 und 1,5 mit 1 ml eiskaltem 1x PBS und geben Sie die Probe in ein vorgekühltes 1,5 ml Röhrchen (für die Langzeitlagerung gekennzeichnet). Gegebenenfalls wird die Zubereitung von Aliquots empfohlen.
- Drehen Sie die Röhren bei 1.200 x g bei 4 °C und entfernen Sie so viel überstanden wie möglich, ohne das Zellpellet zu stören. Snap Freeze das Pellet in flüssigem Stickstoff. Bei -80 °C lagern.
VORSICHT: Achten Sie beim Umgang mit flüssigem Stickstoff auf einen angemessenen Schutz.
2. Chromatinscherung
HINWEIS: Dieses Protokoll ist für die Chromatinscherung von Pellets mit 0,3 bis 3 x 106 Zellen in 0,65 ml low binding tubes optimiert.
- Entfernen Sie das Probenröhrchen mit gefrorenen Zellpellets ab -80 °C und lagern Sie es auf Trockeneis, um ein Auftauen des Pellets vor Zugabe des Lysepuffers zu vermeiden. Dieser Schritt ist entscheidend.
- 70 μL frischen RT-Lysispuffer in das Pellet geben und 1 min bei RT aufbewahren.
- Resuspendieren Sie das Pellet für 1 min ohne das Einbringen von Blasen und inkubieren Sie dann die Zellsuspension bei RT für 1 min, bevor Sie die Probe auf Eis legen.
- Das resuspendierte Pellet in ein 0,65 ml niedriges Bindungsrohr geben und auf Eis aufbewahren.
HINWEIS: Um eine reproduzierbare Beschallung zu erhalten, erwärmen Sie den Ultraschallgerät vor, indem Sie ihn mit nur leeren Röhren für 3-6 Zyklen betreiben, bevor Sie die Proben beschallen. - Legen Sie die Proben in den Röhrchenhalter des Ultraschallgerätes und füllen Sie alle Lücken mit Ausgleichsröhrchen, die mit 70 μL Wasser gefüllt sind. Lassen Sie die Proben ca. 1 min im Wasserbad, bevor Sie mit der Beschallung beginnen.
- Führen Sie die Beschallung für x Zyklen (abhängig vom Zelltyp) mit 16 s ON / 32 s OFF pro Zyklus durch.
HINWEIS: Dieser Schritt erfordert Validierungsexperimente, um die optimale Anzahl von Zyklen für eine effiziente Beschallung zu bestimmen. - Entfernen Sie nach jeweils 3 Zyklen die Proben aus dem Ultraschallgerät, wirbeln Sie vorsichtig und pulsieren Sie die Röhren, bevor Sie sie wieder in den Halter legen. Stellen Sie sicher, dass sich keine kleinen Tröpfchen an der Außenseite des Röhrchens befinden, da dies zu Blasenbildung führen kann.
- Nach Abschluss der erforderlichen Zyklen werden die Proben bei >14.000 x g für 15 min bei 4 °C gedreht. Übertragen Sie den Überstand auf ein neues, vorgekühltes, unverbindliches 0,65 ml Low-Binding-Rohr und halten Sie es auf Eis.
- Entkreuzen Sie einen Bruchteil der beschallten Samples, um die Beschallungseffizienz zu überprüfen.
- Übertragen Sie 1-7 μL des Überstands (entspricht etwa 250 ng geschorenem Chromatin) in ein 0,2 mL PCR-Röhrchen und machen Sie das Volumen auf 10 μL mit Kurzzeit-Lysepuffer bei RT.
- 1 μL RNase A zugeben und 30 min bei 37 °C bei 800 U/min inkubieren, dann 1 μL Proteinase K zugeben.
- 2 h bei 55 °C mit Schütteln bei 1.000 U/min inkubieren.
- Entfernen Sie 2 μL der entkreuzten Probe zur DNA-Quantifizierung mit Fluoreszenzquantifizierungsassay10 (ein Spektralphotometer wird nicht empfohlen, da Seife und abgebautes Protein zu Verzerrungen in den Ergebnissen führen können).
- Die verbleibende Probe auf einem 1,2% igen Agarosegel für 1 h bei 70 V einfärben. Mit Nukleinsäurefarbstoff (1:20.000) färben und das Gel mit einem UV-Transilluminator ablesen.
- Chromatin-Stamm-Aliquots für die Lagerung vorbereiten (verdünnen Sie die Probe auf 25 ng / μL in 20 μL mit vollständigem Lysepuffer). Lagern Sie das gesamte geschorene Chromatin bei -80 °C.
3. Automatisiertes ChIP-Seq zur Histonmodifikation
HINWEIS: Dieses Protokoll ist für die Ausführung auf einem ChIP-Liquid-Handler ausgelegt. Obwohl das System benutzerdefinierte Puffer verwenden kann, werden alle Puffer mit dem ChIP-Kit bereitgestellt. Die in diesem Abschnitt verwendeten ChIP-Streifen mit 8 Tuben sind spezifisch für den ChIP-Liquid-Handler.
- 16 Proben-Aliquots mit 500 ng geschertem Chromatin in 20 μL ab -80 °C transferieren und auf Eis legen, um das Chromatin langsam aufzutauen. Nach dem vollständigen Auftauen kurz wirbeln und pulsieren.
- Herstellung von Chromatin
- 100 μL tC1-Puffer, ergänzt mit 1x Proteaseinhibitor und 20 mM Natriumbutyrat (kompletter tC1-Puffer) in zwei ChIP 8-Röhrchenstreifen pipettiert.
- 20 μL jeder Chromatinprobe werden in ein geeignetes Röhrchen der ChIP 8-Röhrchenstreifen mit den 100 μL des vollständigen tC1-Puffers überführt. Waschen Sie die Chromatinröhrchen, indem Sie 80 μL vollständigen tC1-Puffer zu den Chromatinröhrchen geben und dann zurück in das entsprechende Röhrchen der ChIP 8-Röhrchenstreifen für ein Endvolumen von 200 μL überführen.
- Herstellung des Antikörpers
- Berechnen Sie das Volumen des Antikörpers so, dass sich 0,5 μg Antikörper in jedem Röhrchen befinden.
Volumen des Antikörpers = (Anzahl der Proben x Antikörper pro Reaktion) / Antikörperkonzentration - Fügen Sie die berechnete Menge des Antikörpers in 500 μL tBW1-Puffer hinzu. Schnell Wirbel und Puls-Spin.
- 70 μL tBW1 in jeden der beiden ChIP 8-Röhrchenstreifen pipettieren und 30 μL des Antikörpers + tBW1 in jedes der Röhrchen geben. Dadurch wird das Gesamtvolumen in jedem der Röhrchen auf 100 μL erhöht.
- Berechnen Sie das Volumen des Antikörpers so, dass sich 0,5 μg Antikörper in jedem Röhrchen befinden.
- Vorbereitung der Magnetperle
- Wirbeln Sie das Protein A-Perlenlösung gründlich. Für 0,5 μg Antikörper pipettieren Sie 5 μL Perlen in einen neuen Satz von ChIP 8-Röhrchenstreifen und Pulsspin.
- Füllen Sie die letzte Zeile des ChIP Liquid-Handlers mit beschrifteten, leeren ChIP 8-Röhrchen-Streifen.
- Befolgen Sie die Spezifikationen des ChIP-16-IPure-200D-Programms für die Platzierung aller Bänder in der ChIP-Flüssigkeitsbehandlungsmaschine. Fügen Sie die Puffer an der richtigen Position hinzu, verwenden Sie jedoch tW4 anstelle des tE1-Puffers.
HINWEIS: Organisieren Sie den Tag so, dass der ChIP-Liquid-Handler den ChIP über Nacht durchführt. Das Programm läuft ca. 16 h für 16 Proben. Dies markiert das Ende von Tag 1.
4. Transposase-Integration von Bibliotheksadaptern zur Bibliotheksvorbereitung
- Stellen Sie einen Thermomixer auf 37 °C und 500 U/min vor. Kühlen Sie einen Magneten für 0,2 ml Rohrstreifen auf Eis ab.
- Bereiten Sie für 16 Proben 440 μL Tagmentierungspuffer auf Eis vor. 53 μL in einen einzigen neuen 8-Rohr-Streifen pipettieren und auf Eis aufbewahren.
- In einem neuen 0,2 ml 8-Rohr-Streifen 220 μL kalten tC1-Puffer hinzufügen und auf Eis aufbewahren. Die 8 Streifenrohre können dieses Volumen aufnehmen und trotzdem gekappt werden.
- Entfernen Sie das Streifenrohr "IP-Proben" aus der ChIP-Liquid-Handler-Maschine (Reihe 12) und verschließen Sie die Röhrchen vor dem Pulsspinnen. Fangen Sie die Perlen mit dem Magneten für 8-Rohr-Streifen für 2 min ein und entfernen Sie vorsichtig den Überstand.
- 25 μL des Markierungspuffers mit einem Mehrkanal auf die Kügelchen übertragen, vom Magneten entfernen und vorsichtig mischen, bis die Kügelchen homogen sind (ca. 5 mal auf und ab mit der Pipette auf 20 μL eingestellt).
- Die Röhrchen verschließen und in den vorgewärmten Thermomixer geben und 3 min inkubieren. Eine Erhöhung der Zeit verringert die Effizienz der Bibliotheksvorbereitung.
- Geben Sie die Röhrchen in ein gekühltes Metallgestell und geben Sie 100 μL gekühlten tC1-Puffer zu jeder Probe hinzu. Stellen Sie eine Mehrkanalpipette auf 80 μL und mischen Sie die Probe, bis die Kügelchen homogen sind, um die Markierungsreaktion zu stoppen.
- Legen Sie die Proben wieder in den ChIP-Liquid-Handler und fahren Sie mit dem Waschvorgang Washing_for_IP-reacts_16_Ipurefort. Stellen Sie sicher, dass das Waschen zweimal mit tC1-Puffer und zweimal mit tW4 durchgeführt wird. Die Elution sollte wie durch das Programmlayout gekennzeichnet mit dem Puffer tE1 abgeschlossen werden.
- Entkreuzung der DNA
- Entfernen Sie die ChIP 8-Röhrchenstreifen in der letzten Reihe des ChIP Liquid-Handlers und geben Sie 2 μL RNase A zu jeder Probe hinzu.
- Kappen Sie die Röhrchen, pulsieren Sie, mischen Sie die Perlen vorsichtig mit einer Mehrkanalpipette, bis die Mischung homogen ist, und schließen Sie die Röhrchen wieder ab.
- Inkubieren Sie die Proben in einem Thermomixer für 30 Minuten bei 37 °C und 900 U/min.
- Entfernen Sie die Proben aus dem Thermomixer, geben Sie 2 μL Proteinase K hinzu. Befolgen Sie das gleiche Verfahren wie 4.9.2 nach der Zugabe.
- Inkubieren Sie die Proben in einem Thermomixer für 4 h bei 55 °C und 1.250 U/min, gefolgt von 65 °C bei 1.000 U/min über Nacht.
HINWEIS: Dies ist das Ende von Tag 2.
5. Aufreinigung markierter DNA-Fragmente
- Markieren Sie sechzehn 1,5-ml-Röhrchen mit der entsprechenden Probennummer und geben Sie jeweils 400 μL DNA-Bindungspuffer aus dem DNA-Reinigungskit hinzu.
- Entfernen Sie die 8-Rohr-Streifen aus dem Thermomixer und drehen Sie die Streifen im Puls, um sicherzustellen, dass das verdampfte Produkt erhalten bleibt. Legen Sie Streifen auf einen 8-Streifen-Magneten, um die Perlen einzufangen.
- Übertragen Sie 100 μL entvernetzte DNA in jedes der 1,5 ml Röhrchen. 100 μL des DNA-Bindungspuffers in die 8-Röhrchenstreifen geben, um die Kügelchen zu waschen, und dann in das entsprechende 1,5-ml-Röhrchen überführen.
- Wirbel für ca. 10 s und Puls-Spin die 1,5 ml Rohre.
- Laden Sie die Säulen mit den 600 μL, die den DNA-Bindungspuffer und die ChIP-Probe enthalten.
- Proben für 20 s bei 10.000 x g drehen und die Säule mit dem Durchfluss nachladen. Drehen Sie erneut unter den gleichen Bedingungen und verwerfen Sie den Durchfluss.
- Waschen Sie die Säulen zweimal mit 200 μL Waschpuffer (gleiche Zentrifugation wie im vorherigen Schritt) und verwerfen Sie den Durchfluss.
- Trocknen Sie die Säulen durch Zentrifugieren für 2 min bei 12.000 x g.
- Übertragen Sie die Säule auf ein neues 1,5 ml Auffangröhrchen und geben Sie 9 μL warmen TE Buffer (vorgewärmt auf 55 °C) direkt in die Säulenmatrix. Lassen Sie die Säule 1 min vor der Zentrifugation für 1 min bei 10.000 x ginkubieren.
- Übertragen Sie die 9 μL des Eluts auf einen geeigneten neuen Satz von 8-Röhrchen-Streifen.
- Schließen Sie die Elution wie bisher mit 8 μL TE Buffer ab. Die Eluierung in die entsprechenden 8-Röhrchenstreifen (Endvolumen 17 μL pro Probe) überführen und auf Eis aufbewahren.
6. Amplifikation und Größenauswahl der gereinigten Proben
- Die folgenden Schritte verwenden qPCR, um die Anzahl der Zyklen zu bestimmen, die für eine optimale Amplifikation erforderlich sind (CtD – Ct-Bestimmung)
- Bereiten Sie den CtD-Mix für alle Proben vor, indem Sie den Inhalt des CtD-Mix-Puffers mit der Anzahl der Proben multiplizieren.
- Geben Sie 3,6 μL CtD-Mix in eine qPCR-Platte und fügen Sie 1,4 μL markierte DNA-Proben hinzu (~ 10 % des Gesamtvolumens). Führen Sie die folgende qPCR durch: 98 °C für 3 min, 72 °C für 5 min, 98 °C für 30 s, 26 Zyklen von 98 °C für 10 s, 63 °C für 30 s und 72 °C für 30 s.
- Bereiten Sie den Amp Mix für alle Samples vor, indem Sie den Inhalt des AMP Mix Buffers mit der Anzahl der Samples multiplizieren. Geben Sie 14 μL markierte DNA in separate Vertiefungen einer PCR-Platte und geben Sie dann 2,5 μL von zwei Sequenzierungsindex-Primern (25 μM) zu jeder Probe hinzu (das endgültige Reaktionsvolumen beträgt 50 μL).
- Mischen Sie die Proben mit einer Mehrkanalpipette und führen Sie das im CtD verwendete Verstärkungsprogramm mit der entsprechenden Anzahl von Zyklen durch.
HINWEIS: Dies ist ein guter Haltepunkt, da die amplifizierten Proben einige Wochen bei -20 °C gelagert werden können. Die Reinigung kann jedoch noch am selben Tag abgeschlossen werden. Für 48 Proben wurden die Schritte 3 - 6.5 mit zwei weiteren separaten Chargen abgeschlossen und dann in einer Charge wie unten beschrieben amplifiziert. - Führen Sie die Post-Amplifikation, Größenauswahl und Quantifizierung der markierten DNA wie unten beschrieben durch. Dies kann in der Regel mit 48 Proben abgeschlossen werden (kann je nach Wunsch mit weniger Proben abgeschlossen werden).
- Fügen Sie 90 μL paramagnetische Perlen (Verhältnis 1: 1,8) in jede Vertiefung hinzu, mischen Sie sie und lassen Sie sie 2 Minuten lang bei RT inkubieren.
- Fangen Sie die Perlen mit einem Plattenmagneten ein und entsorgen Sie den Überstand. Waschen Sie die Perlen 3 mal mit 200 μL frischem 80% Ethanol, ohne das Perlenpellet zu stören.
- Entfernen Sie überschüssiges Ethanol nach dem letzten Waschen mit 20 μL-Spitzen und lassen Sie die Perlen 10 minuten trocknen oder bis Risse in den Perlenpellets auftreten.
- Wenn sich die Platte noch auf dem Magneten befindet, fügen Sie jedem Brunnen 40 μL des vorgewärmten Wassers hinzu. Verschließen Sie die Platte, wirbeln Sie gründlich und drehen Sie die Platte kurz im Puls.
- Erfassen Sie die Kügelchen, indem Sie die Platte wieder auf den Magneten legen und die 40 μL-Elute auf eine neue "Probenplatte" übertragen. Die Proben werden nun gereinigt, und die nächsten Schritte reichern Fragmente im Bereich von 200-1.000 bp an.
- Optionaler QC-Schritt: Entfernen Sie 4 μL aus den Proben und übertragen Sie sie auf eine QC-Platte. Geben Sie 4 μL Wasser zurück zu den Proben. Dies bestimmt den Prozentsatz großer Fragmente.
- 22 μL paramagnetische Kügelchen (Verhältnis 1:0,55) zu den Proben geben, vorsichtig mischen und bei RT für 2 min inkubieren.
- Legen Sie auf den Magneten, um die Perlen für 5 min einzufangen und die Überstände in die Säulen 7-12 der "Probenplatte" zu übertragen. Entfernen Sie die Platte vom Magneten und fügen Sie 30 μL Perlen hinzu (Endverhältnis 1:1,3). Vorsichtig mischen und 2 Minuten bei RT ruhen lassen.
- Fange die Perlen für 5 Minuten ein und verwerfe dann den Überstand.
- Alle Kügelchen 3 mal mit 200 μL frischem 80 % Ethanol wie zuvor beschrieben waschen (Schritt 6.6.2 – 6.6.3).
- Sobald die Pellets trocken sind, eluieren Sie DNA mit 8 μL vorgewärmtem TE-Puffer zu jedem Bohrloch, während Sie sich noch auf dem Magneten befinden.
- Entfernen Sie die Platte gründlich vom Magneten, versiegeln und wirbeln Sie sie gründlich. Lassen Sie die Platte für 2 min bei RT, Puls-Spin, inkubieren und legen Sie die Platte für 2 min wieder auf den Magneten. Übertragen Sie den Überstand auf eine neue Platte (Platte 2).
- Für eine maximale Ausbeute wiederholen Sie die Elution mit einem zusätzlichen 8 μL vorgewärmten TE-Puffer. Legen Sie die Proben in die entsprechenden Vertiefungen, so dass jede Probe 16 μL der endgültigen Bibliothek hat.
HINWEIS: Am Ende dieses Schritts sollten sich zwei Platten befinden (eine, wenn keine QC-Platte fertiggestellt wurde). Die QC-Platte enthält die vordimensional ausgewählten Fragmente und die zweite Platte sollte 48 Vertiefungen der endgültigen Bibliothek (insgesamt 16 μL) aufweisen.
7. Quantifizieren Sie die endgültigen Bibliotheken und QC-Proben mit einem Fluoreszenzassay
- Vollständige DNA-Quantifizierung mit einem Fluoreszenz-Quantifizierungsassay oder einer ähnlichen Methode.
- Wenn die QC-Quantifizierung abgeschlossen wurde, bestimmen Sie den Prozentsatz des Probenverlusts, der < 1.000 bp lag. Es sollte nicht mehr als etwa 20% Verlust geben - wenn es mehr gäbe, könnte es ein Problem mit den angewendeten Perlenverhältnissen geben.
- Bestimmen Sie die Größe der Fragmente jeder Probe, vorzugsweise mit einer Kapillarelektrophoresemaschine. Um die molare Konzentration zu berechnen, verwenden Sie die folgende Gleichung: [Bibliothekskonzentration (ng/μL) * 106]/[660 * Mediane Fragmentgröße (bp)]).
HINWEIS: Die Bibliotheken sind bereit, nach Standardsequenzierungsverfahren der nächsten Generation gepoolt (äquimolare Mengen) und sequenziert zu werden.
Ergebnisse
Als Proof of Concept wurde ChIP-Seq für sechs menschliche Spender mit drei Sätzen von Immunzelltypen fertiggestellt: naive CD4-T-Zellen (CD4), klassische Monozyten (MO) und natürliche Killerzellen (NK), angereichert durch FACS-Sortierung wie zuvor beschrieben13. Das unterstrichene Verfahren besteht aus neun verschiedenen Verfahren, wie in Abbildung 1 dargestellt.
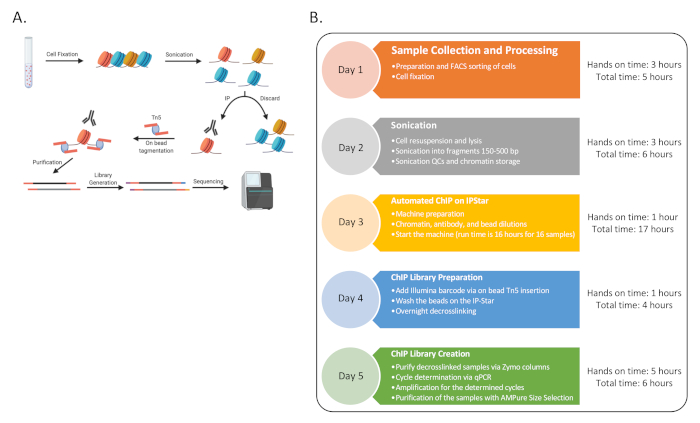
Abbildung 1: Allgemeines Flussdiagramm für das Verfahren. (A) Eine Karikatur des Gesamtverfahrens (generiert in BioRender). (B) Flussdiagramm für alle wichtigen Schritte für das Protokoll und die geschätzte praktische und Gesamtzeit, die mit jedem Tag verbunden ist. Die Sequenzierung kann am Ende von Tag 5 oder später mit mehreren Runden erfolgen. Die Zeitleiste kann auch über die Woche gestaffelt sein, wobei die sequenziellen Tage 3-4 mehrmals in einer Woche abgeschlossen werden können, um 48 ChIP-Proben zu generieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Nach der Zellisolierung mittels Durchflusszytometrie13wurden sortierte Zellen zentrifugiert und Zellen wie oben beschrieben fixiert und gelagert. Nachdem alle Proben gesammelt waren, wurden die Proben lysiert und für die chromatische Scherung in Chargen von 12 wie oben beschrieben vorbereitet. Für jede Probe wurde die Anzahl der Zyklen zur Erreichung einer optimalen Beschallungabgeschlossen 10. Quantitative Messungen sowie Messungen der Größe von gescherten Chromatinfragmenten zeigten eine große Reproduzierbarkeit unserer Methode an den drei Sätzen von Immunzellen (Abbildung 2A). Die verschiedenen menschlichen Immunzellen wurden in separaten Chargen beschallt und ergaben sehr konsistent mit > 70% der Probe zwischen 100 - 500 bp für 14 Zyklen (16 s ON, 32 s OFF pro Zyklus). Zu diesem Zeitpunkt wurden Proben mit großen Fragmenten nach der Beschallung (< 70% der Probe zwischen 100 - 500 bp) als fehlgeschlagen angesehen. Diese Proben konnten entweder für 1-2 zusätzliche Zyklen beschallt werden oder wurden verworfen und später durch Zellen aus einem anderen Pellet ersetzt. Unsere Methode zeigte, dass keine der Proben mehr Beschallung erforderte oder eliminiert wurde, was auf eine absolute Robustheit des Verfahrens hindeutet.
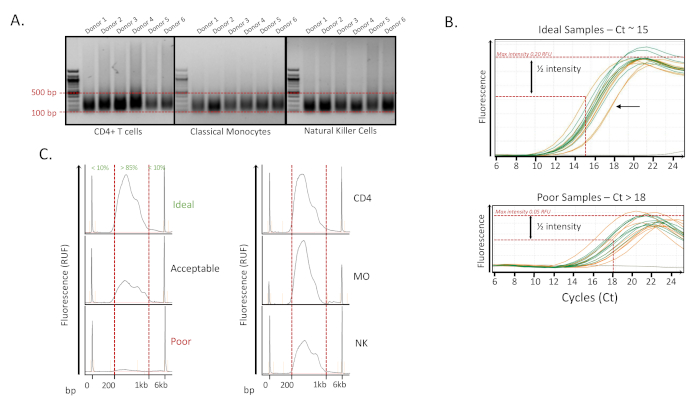
Abbildung 2: Pre-Sequencing QC-Beispiele. (A) 1,2% Agarosegele zeigen die Reproduzierbarkeit der Beschallung. Ultraschallproben für 6 Spender in drei Zelltypen: naive CD4-T-Zellen (CD4), klassische Monozyten (MO) und natürliche Killerzellen (NK). Die Proben wurden 14 Zyklen lang beschallt (16 s ON, 32 s OFF pro Zyklus). Für jede Probe wurden etwa 200 ng entvernetztes Chromatin auf ein 1% iges Agarosegel geladen. Die Proben wurden als gut angesehen, wenn mehr als 70 % der Fragmente innerhalb von 100-500 bp liegen. (B) Top - Analyse qPCR-Amplifikationskurven zur Bestimmung der optimalen Anzahl von Zyklen für die Amplifikation (Ct bei 1/2 der maximalen Intensität). Die idealen Proben haben ein Ct von etwa 15 und die Amplifikation kann bis zu 2 Zyklen mehr des gemessenen Ct abgeschlossen werden. Der Pfeil ist ein Beispiel für ein schlechtes Beispiel, bei dem das Ct größer als 18 ist. Unten - Ein Beispiel für einen schlechten Satz von Stichproben wird gezeigt, die ein Ct größer als 18 haben. Diese Proben zeigten auch eine geringere Fluoreszenzintensität. (C) Links - Fragmentanalysator-Elektrophoresespuren zeigten die Verteilung der endgültigen markierten Bibliotheken nach Verstärkung und Größenauswahl. Proben mit mehr als 85 % fragmentarischen Liegt innerhalb von 200-1.000 bp wurden als gute Proben angesehen. Die Messung der Spitzenintensität der Fluoreszenz wird auch als wichtiger QC-Parameter angesehen, in der Tat, wenn das Signal niedrig ist, ist es unwahrscheinlich, dass die Probe gut sequenziert. Rechts - Beispiele für positive Proben in CD4, MO und NK werden gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Nach der Quantifizierung wurden die Proben auf einem ChIP-Liquid-Handler mit H3K27ac-Antikörpern durchgeführt, gefolgt von einer Markierung mit dem Tn5-Transposase-Enzym. Um die angemessene Anzahl von Amplifikationszyklen durch qPCR zu bestimmen, wurden 10% der markierten Proben verwendet. Für die Bestimmung der Anzahl der Zyklen für die Amplifikation der Proben finden wir den Zyklus, bei dem die Intensität der Probe die Hälfte des durchschnittlichen Maximums für die Zyklusbestimmung beträgt (Abbildung 2B). Proben mit Ct-Werten von mehr als 18 schnitten nach der Sequenzierung nicht gut ab und ihr Ct-Wert war somit ein Hinweis auf eine fehlgeschlagene ChIP-Probe. Diese Proben ergaben im Allgemeinen auch eine geringere Menge an DNA nach der Amplifikation. Stichproben (100.000 Eingegebene Zellen) mit einem Ct-Wert gleich oder kleiner als 15 waren ideal und Proben zwischen 15 und 18 waren akzeptabel, aber weniger konsistent nach der Sequenzierung. Für Proben mit weniger als 100.000 Eingangszellen wurden die Ct-Werte normalerweise zwischen 15 und 18 gefunden, benötigten aber nicht mehr als 18 Zyklen, um genügend Produkt für die Sequenzierung zu erhalten.
Nach der DNA-markierten Amplifikation wurden die Bibliotheken gereinigt und die Größe ausgewählt, um eine ideale Größenverteilung von 200 bis 1.000 bp für die NextGen-Sequenzierung zu erhalten. Die Bewertung der Größenverteilung in jeder der Bibliotheken wurde abgeschlossen, da die besten Sequenzierungsdaten erzielt wurden, wenn mehr als 85% der DNA-Fragmente zwischen 200 und 1.000 bp lagen (Abbildung 2C). Insbesondere als die gleiche Menge an DNA (gemessen durch Fluoreszenzquantifizierung) geladen wurde, wurde festgestellt, dass die Proben mit geringerer Fluoreszenzintensität im Allgemeinen schlecht sequenzierten (Abbildung 2C).
Nach der Sequenzierung wurden Standard-Qualitätskontrollen auf der Grundlage der ENCODE ChIP-Seq-Richtlinienangewendet 5,14,15.
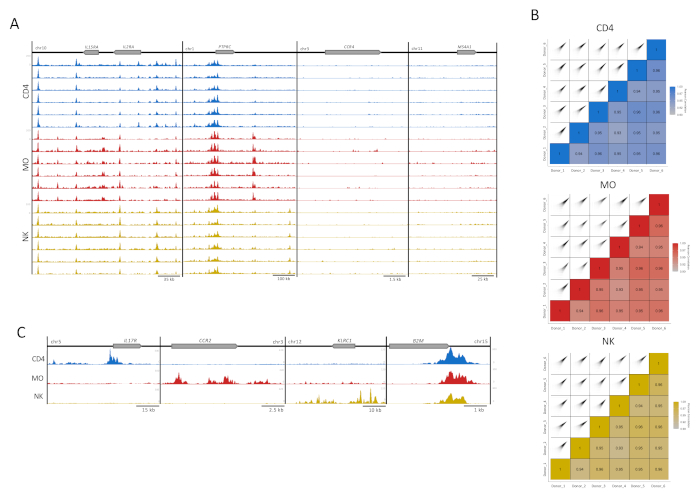
Abbildung 3: Reproduzierbarkeit der Immunzellproben. (A) H3K27ac tracks (UCSC Genome Browser, maximale Intensität, Glättungsfunktion von 4, alle mit gleich skalierter Y-Achse) für 6 Spender (100.000 Zellen pro Replikat) in jedem Zelltyp (CD4, MO und NK). Es werden vier beispielhafte Loci gezeigt, zwei mit (IL2RA-Locus und PTPRC) und zwei ohne Anreicherung für H3K27ac (CCR4 und MS4A1). (B) Pearson-Korrelation zwischen den Donatoren und entsprechenden Korrelationsdiagrammen, die unter Verwendung einer 300 bp-Erweiterung und eines 500 bp-Fensters innerhalb des MEDIPS-Pakets für jeden der Zelltypen generiert werden, repliziert16. (C) Zusammengeführte Spenderdateien für jeden Zelltyp, die H3K27ac-Spuren (maximale Intensität des UCSC-Genombrowsers, Glättungsfunktion von 4) in zelltypspezifischen Regionen (IL17R für CD4, CCR2 für MO und KLRC1 für NK) und das in allen Zelltypen vorhandene Hausgen B2M zeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Für die visuelle Qualitätskontrolle wurden H3K27ac-Anreicherungsspuren für die Anzeige im UCSC-Genombrowser vorbereitet. Für vier Genloci zeigten einzelne Spuren für jede Probe eine hohe Kartierungsqualität und ein hohes Signal-Rausch-Verhältnis, was die hohe Konsistenz und Robustheit unseres Assays widerspiegelt (Abbildung 3A). Die beiden Loci auf der linken Seite beherbergen gut exprimierte Gene in diesen Zelltypen, während die Gene in den beiden Loci rechts nicht exprimiert werden und als Hintergrundkontrollen dienen13 (Abbildung 3A). Darüber hinaus wurde das MEDIPS-Analysepaket als Postsequenzierungsvariable verwendet, um den Korrelationsindex zwischen technischen Replikaten zu bewerten (Abbildung 3B)5,16,17, um den Grad der Korrelation für den Anreicherungsgrad von Lesevorgängen für 500 bp-Behälter16zu bestimmen. Für die Mehrheit der paarweisen Vergleiche zeigten die Pearson-Korrelationsindizes eine Korrelation von mehr als 90%, was auf eine hohe Konsistenz zwischen den biologischen Replikaten hindeutet (Abbildung 3B). Replikate mit akzeptabler Korrelation wurden zusammengeführt, um das Signal-Rausch-Verhältnis zu erhöhen. Während zelltypspezifische Loci in den entsprechenden Zellen eine hohe Anreicherung zeigten, zeigte ein Hausfrauengen (B2M) eine sehr konsistente Histonmodifikation (Abbildung 3C). Für die Analyse erhöht das Zusammenführen von Spuren aus Replikaten die Anreicherung, verstärkt das spezifische Signal, auch für wichtige zelltypspezifische Enhancer, und reduziert die interindividuelle Variabilität, die menschlichen Proben innewohnt5.
Obwohl für diese Studie 100.000 Zellen verwendet wurden, gab es eine hohe Reproduzierbarkeit für nur 10.000 Zellen in einer humanen kultivierten T-Zelllinie (HUT78). Die Korrelationsanalyse zwischen dem ChIP-Seq-Datensatz, der aus Proben mit weniger als 100.000 Zellen durchgeführt wurde, zeigte eine hohe Reproduzierbarkeit und Korrelation bis hinunter zu 10.000 Zellen (Abbildung 4A).
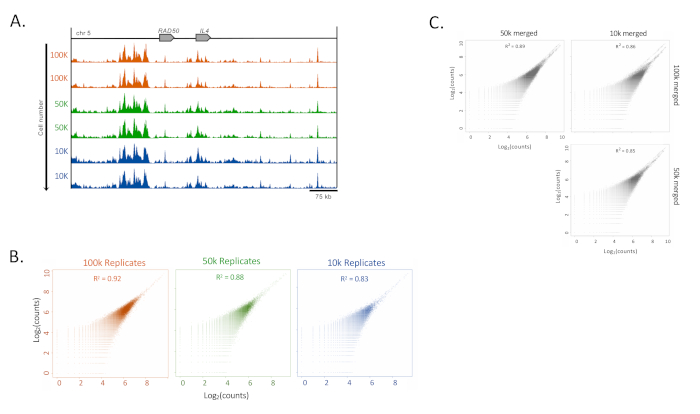
Abbildung 4: Reproduzierbarkeit von Low-Input-Proben. (A) Beispiele für die Konsistenz von H3K27ac ChIP-Seq für Zellen von 100.000 bis 10.000 in HUT-78-Zellen (eine T-Zell-Lymphom-Zelllinie). Die Tracks (UCSC Genome Browser, maximale Intensität, Glättungsfunktion von 4, alle mit gleich skalierter Y-Achse) zeigen den IL4-Locus. (B) Pearson-Korrelationen der Replikate unter Verwendung einer 300 bp-Erweiterung und eines 500 bp-Fensters innerhalb des MEDIPS-Pakets16. (C) Pearson-Korrelationen zwischen den verschiedenen Zellzahlgruppen (100.000, 50.000 und 10.000 Zellen) unter Verwendung der gleichen MEDIPS-Parameter wie in (B)16. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Pearson-Korrelationsanalyse zeigte einen hohen Korrelationsindex (83% bis 92%), was auf die Aufrechterhaltung des Signals in Proben mit niedriger Zellzahl hindeutet. Es gab jedoch einen erhöhten Hintergrund, da die Zellzahlen reduziert wurden, sowie ein Abfall der Korrelationskoeffizienten (Abbildung 4B). Um niedrige Hintergrundsignale aufrechtzuerhalten, wurden technische Duplikate zusammengeführt und die Korrelation zwischen gruppen getestet (Abbildung 4C).
| 10-facher Zellfixationspuffer | |
| Verbindung | Endgültige Konzentration |
| Formaldehydlösung | 11% |
| NaCl | 100 mM |
| EDTA, pH 8,0 | 1 mM |
| EGTA, pH 8,0 | 0,5 mM |
| HEPES, pH 7,5 | 50 mM |
| Vollständiger Lysepuffer | |
| Verbindung | Endgültige Konzentration |
| Tris-HCI, pH 8,0 | 50 mM |
| EDTA, pH 8,0 | 10 mM |
| SDS | 0.25% |
| Natriumbutyrat | 20 mM |
| Protease-Inhibitor-Cocktail | 1X |
| Kurzfristiger Lysepuffer | |
| Verbindung | Endgültige Konzentration |
| Tris-HCI, pH 8,0 | 50 mM |
| EDTA, pH 8,0 | 10 mM |
| SDS | 0.25% |
| Tagmentation Mischung | |
| Verbindung | Endgültige Konzentration |
| Tris-HCI, pH 8,0 | 10 mM |
| MgCl2 | 5 mM |
| N,N-Dimethylformamid | 10% |
| Illumina Tagmentierungsenzym | 1:24 Vol:Vol |
| CtD Mischung | |
| Verbindung | Pro Probe (μL) |
| NextEra Index Primer A (25 μM) | 0.275 |
| NextEra Index Primer B (25 μM) | 0.275 |
| 2x KAPA HiFi HotStart Ready Mix | 2.75 |
| 1:1000 SYBR Grüner Farbstoff | 0.11 |
| ROX Passivfarbstoff | 0.11 |
| Wasser | Füllung auf 4 μL |
| AMP-Mix | |
| Verbindung | Pro Probe (μL) |
| 2x KAPA HiFi HotStart Ready Mix | 27.5 |
| Wasser | Füllung auf 31 μL |
Ergänzende Tabelle 1: Pufferrezepte.
Ergänzende Tabelle 2: Spearman- und Pearson-Stichprobenkorrelationen für die 6 Spender und jeden Zelltyp. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Die hier beschriebene Methode erweitert das ChIPmentation-Verfahren11, das ein Tagmentationsbibliotheksvorbereitungsprotokoll vor der DNA-Aufreinigung implementiert, indem das Protokoll automatisiert und mikroskaliert wird. Seit dem Beginn von ChIP-Seq wurde die erforderliche Zellzahl drastisch reduziert, von etwa 20 Millionen Zellen für Histone auf Hunderte und sogar Einzelzellen 1 ,7,10,12,18,19,20,21. Diese neu entwickelten Methoden haben ein tieferes Verständnis dafür ermöglicht, wie cis-Regulationsmechanismen in Zellen wirken, indem sie die Empfindlichkeit erhöhen und es ermöglichen, seltene klinische Zellpopulationen zu testen5,6, 12,17. Zum Beispiel eines der neueren und populäreren Verfahren, genannt CUT&TAG, als robuste und empfindliche ChIP-Seq-Alternative9. Es erzeugt ein hervorragendes Signal-Rausch-Verhältnis, da das Tn5-Enzym kovalent an Protein A gebunden ist und die Fc-Kette des ChIP-Antikörpers mit hoher Spezifitäterkennt 9. Die Hintergrundaktivität des Tn5-Enzyms ist reduziert, da das Enzym vor der Bindung an den Zielantikörper nicht funktionsfähig ist9. Die Implementierung dieser Methode in einem klinischen Kontext ist jedoch begrenzt, da sie nicht fixierte, lebende Zellen erfordert. Auch die Entfernung von DNA-Fragmenten aus dem hypotonen Kern könnte negative Auswirkungen auf das Chromatin haben, da es während des Assays entfernt wird. Die notwendige Voraussetzung, mit frischen und lebenden Zellen zu arbeiten, ist eine Quelle von Problemen für seltene klinische Proben und für große Kohorten von Proben, da große Kohorten mehrere Jahre brauchen können, um5zu sammeln. Eine andere Art von Methode, Drop-ChIP, verwendet elegant ein Mikrofluidik-Gerät, um Tröpfchen-basiertes Tagmention vor der Verarbeitung des ChIP19zu erzeugen. Es verwendet jedoch ein hochspezialisiertes mikrofluidisches Gerät und während es möglich ist, Einzelzell-ChIP-Seq zu vervollständigen, ist es auch auf die Verwendung von lebenden Zellen7,8,9,18,19beschränkt . Neuere Methoden, die sich auf ChIP-Seq wie PLAC-Seq oder HiChIP stützen, versuchen, 3-dimensionale (3D) Wechselwirkungen zwischen den ChIP-Seq-Peaks22,23zu verstehen. Diese 3D-Methoden sind spannend, da sie cis-regulatorischeoder TF-vermittelte Wechselwirkungen im gesamten Genom identifizieren und das Verständnis der Regulation der Genexpression in Zelltypen von Interesse, in gesundem Gewebe und im Zusammenhang mit Krankheiten verbessern.
Es gibt einige kritische Schritte zu berücksichtigen, damit das Protokoll erfolgreich ist, wie die Qualität des beschallten Chromatins und die Qualität des Antikörpers. Schereffizienz ist kritisch, wenn das Chromatin nicht gut beschallt wird, nimmt die Effizienz des Assays drastisch ab24. Die Beschallung ist aufgrund der erforderlichen Zellzahlen ein herausfordernder Aspekt von ChIP-Seq. Auf dem im Protokoll verwendeten Ultraschallgerät wurde die Effizienz unter 300.000 Zellen drastisch reduziert. Dies ist ein herausfordernder Aspekt in ChIP-Seq, da die Beschallung unter diesem Niveau oft eine enzymatische Fragmentierung erfordern würde, die weniger unparteiisch ist. Infolgedessen ist die Beschallung ein wichtiger begrenzter Faktor für echtes mikroskaliges ChIP-Seq. Andere Beschallungsplattformen und kommerziell erhältliche Kits wurden für die Beschallung von Chromatin getestet, aber der hier verwendete Ultraschallgerät hatte die robustesten und reproduzierbarsten Ergebnisse. Ein weiterer Vorteil des Ultraschallgerätes besteht darin, dass keine speziellen Röhren für die Beschallung gekauft werden müssen, was die Kosten bei der Bearbeitung einer großen Anzahl von Proben senkt. Für eine optimale Beschallung ist es zunächst wichtig, den Ultraschallgerät wie oben beschrieben vorzuwärmen. Zweitens, um das Pellet zu lysieren, wird empfohlen, die Pipettenspitze den Boden des Rohres berühren zu lassen, während sie lysiert, um die Zellen mit mehr physikalischen Einschränkungen aufzubrechen. Drittens behindert jede Blasenbildung vor der Beschallung die Fähigkeit der Probe, gleichmäßig beschallt zu werden. Wenn sich während der Lyse Blasen bilden, ist es wichtig, sie mit einer Pipette zu entfernen. Dies kann eine Herausforderung sein, ohne viel Probe zu entfernen, aber wenn die Spitze leicht gegen die Blase gedrückt wird, kann sie langsam ohne Verlust von viel Probe gezogen werden. Schließlich, wenn Sie die Anzahl der Zyklen bestimmen, schließen Sie einen Zeitkurs ab, bei dem alle drei Zyklen die Probe entnommen, gereinigt und auf einem Agarosegel ausgeführt wird. Vermeiden Sie eine Über-/Unterbeschallung von Proben, da dies die ChIP-Effizienz verringert. Wird die Probe unterbeschallt, können sich die großen Fragmente negativ auf die ChIP-Seq-Qualitätauswirken 24. Auf der anderen Seite, wenn die Probe überbeschallt ist, besteht die Gefahr, dass das Zielepitop dabei verloren geht.
Ein weiterer wesentlicher Bestandteil von ChIP-Seq ist die Qualität des Antikörpers. Vor der Durchführung einer groß angelegten Studie ist es notwendig, den verwendeten Antikörper zu optimieren. Ziel ist es, ein signifikant hohes Signal-Rausch-Verhältnis bekannter Regionen des Genoms zu erhalten und ein weiteres ist die Reproduzierbarkeit. Wenn der Antikörper viel Hintergrundsignal zieht, kann es empfehlen, einen größeren Eingang zu verwenden oder ein anderes Los / einen anderen Lieferanten auszuprobieren. Dies wird die Zeit verlängern, bevor ein groß angelegtes Experiment gestartet wird, aber es ist ein wesentlicher Schritt. Um auf das Signal-Rauschen zu testen, wird empfohlen, qPCR mit Regionen zu verwenden, von denen bekannt ist, dass sie ein Ziel Ihres Antikörpers sind, und einer anderen Region, von der bekannt ist, dass sie nicht vorhanden ist. Es wurde festgestellt, dass Histonmodifikationen robuster und einfacher zu optimieren sind als TFs.
Das oben beschriebene Protokoll bietet eine robuste Methode für die Hochdurchsatz-Histonmodifikation ChIP-Seq in einer halbautonomen, mikroskaligen Weise. Die Methode begrenzt den Umfang der praktischen Zeit und erhöht die Reproduzierbarkeit gegenüber manuellem ChIP-Seq. Frühere im Labor durchgeführte Studien verwendeten manuelles ChIP an technischen Replikaten und erhielten einen Spearman-Korrelationsdurchschnitt von0,50 5,jedoch mit dem halbautomatischen System die Spearman-Korrelation zwischen verschiedenen Spendern mit einem NK-Zelldurchschnitt von 0,66 (Ergänzende Tabelle 2). Dies wurde auch mit etwa 40% weniger praktischer Zeit abgeschlossen. Die hier beschriebene Methode wurde für Histon-Modifikationen optimiert (H3K27ac hier gezeigt, aber das Protokoll sollte keine Modifikation für andere benötigen) und würde nur geringfügige Modifikationen erfordern, um für TF ChIP-Seq implementiert zu werden. Trotz der Qualität des Antikörpers wäre die Hauptmodifikation für die Beschallungszeit und möglicherweise die Puffer, die während der IP verwendet wurden. Normalerweise kann die Methode für TF-ChIP-Assays mit etwas längeren Chromatinfragmenten (mit einem Bereich von etwa 350-800 bp) besser funktionieren, da TF: DNA-Komplexe wahrscheinlich weniger durch rigorose Beschallung aufrechterhalten werdenkönnen 6. Die Puffer müssen möglicherweise auch zu einem benutzerdefinierten Mix oder anderen in der Branche verfügbaren Kits wechseln, da sich TFs anders verhalten können als Histonmodifikationen.
Obwohl der automatisierte ChIP-Liquid-Handler bereits für 10.000 Zellen getestet wurde, gab es eine spürbare Abnahme der Reproduzierbarkeit bei niedrigeren Chromatinkonzentrationen. Aus diesem Grund wurde das Protokoll nicht für weniger als 10.000 Zellen empfohlen, wobei 100.000 Zellen die optimalen Bedingungen waren. Das Protokoll wurde auch unter Verwendung von ChIP-Puffern der Industrie vervollständigt, was einen zusätzlichen Aufwand darstellte, aber Daten von höherer Qualität lieferte. Das Protokoll könnte in Bezug auf die Beschallungsbedingungen modifiziert werden (solange das geschorene Chromatin im gleichen Bereich gehalten wird), Puffer könnten für die Immunpräzipitation angepasst werden (IP; optimierung kann erforderlich sein) oder der ChIP-Liquid-Handler darf nicht verwendet werden. Eine Einschränkung des Protokolls ist die Verwendung des ChIP-Liquid-Handlers, der eine teure Investition sein kann und nur 16 Proben gleichzeitig ausführen kann. Der ChIP Liquid-Handler ist auf reaktionen im kleinen Maßstab beschränkt und Zellzahlen von mehr als einer Million werden nicht empfohlen. Das Protokoll könnte jedoch ohne es vervollständigt werden, indem die IP- und Waschschritte manuell ausgeführt werden. Wenn die IP und die Waschungen von Hand durchgeführt wurden, erhöht sich die Zeit bis zum Abschluss des Assays und die Reproduzierbarkeit kann abnehmen, aber dieser Leitfaden wird immer noch nützlich sein, um ein hochwertiges ChIP-Seq-Experiment durchzuführen. Bemerkenswert ist, dass andere Liquid Handler angepasst werden könnten, um halbautomatische ChIP-Reaktionen durchzuführen.
Zusammenfassend lässt sich sagen, dass die Hauptvorteile dieses Systems der hohe Durchsatzcharakter ist, da die IP- und Waschschritte autonom durchgeführt werden. So können aufeinanderfolgende Runden von ChIP-Experimenten abgeschlossen werden, so dass bis zu 48 Proben in 5 Tagen vollständig verarbeitet und für die Sequenzierung bereit sind, mit begrenzter praktischer Zeit im Vergleich zu manuellen ChIP-Seq-Experimenten. Ein weiterer Vorteil ist die erhöhte Reproduzierbarkeit, da es schwierig sein kann, mit ChIP-Seq hochreproduzierbare Ergebnisse zu erzielen. Andere Methoden erfordern entweder lebende Zellen, komplexe Mikropipettiersysteme oder die Arbeit, die von Hand erledigt wird. Dieses System muss für Proben mit geringem Input (<10.000 Zellen) optimiert werden, was letztendlich Einzelzell-ChIP-Reaktionen ermöglicht. Das System ist auch in der Lage, für die neueren ChIP-Methoden wie PLAC-Seq und HiChIP22,23angepasst zu werden.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken den Vijayanand-Labormitgliedern für technische Hilfe und konstruktive Diskussionen sowie Dr. Sharron Squazzo und Herrn Geoffrey Berguet von Diagenode für die technische Unterstützung mit der Ultraschall- und ChIP-Liquid-Handler-Maschine und den Protokollen. Diese Arbeit wurde durch die NIH-Zuschüsse AI108564, R01HL114093, S10RR027366 (BD FACSAria II) und S10OD016262 (Illumina HiSeq 2500) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 200 µl tube strips (8 tubes/strip) + cap strips | Diagenode | C30020002 | Strip tubes for use on the IP Star; ChIP 8-tube strip |
| AMPure XP for PCR Purification | Beckman Coulter | A63880 | SPRI beads |
| Axygen 0.6 mL MaxyClear Snaplock Microcentrifuge Tube | Corning | MCT-060-C | 0.65 mL low binding tube |
| Bioruptor Pico Sonicator | Diagenode | B01060010 | Sonicator used in the lab but others can be used |
| ChIP DNA Clean & Concentrator (Capped Columns) | Zymo Research | D5205 | DNA clean-up kit |
| Dynabeads Protein A for Immunoprecipitation | ThermoFisher | 10001D | |
| EDTA (0.5 M), pH 8.0, RNase-free | ThermoFisher | AM9260G | |
| EGTA pH 8.0 | Millipore Sigma | E3889-25G | |
| Eppendorf ThermoMixer C | Eppendorf | 2231000667 | |
| Formaldehyde solution | Millipore Sigma | 252549-1L | |
| Glycine | Millipore Sigma | 50046-250G | |
| H3K27ac polyclonal antibody - Premium | Diagenode | C15410196 | |
| HEPES (1 M) pH 7.5 | ThermoFisher | 15630080 | |
| IDT for Illumina Nextera DNA Unique Dual Indexes | Illumina | 20027213 | |
| Illumina Tagment DNA Enzyme and Buffer Small Kit | Illumina | 20034197 | |
| IP-Star Compact Automated System | Diagenode | B03000002 | Automated system for ChIP-Seq studies; ChIP liquid handler |
| KAPA HiFi HotStart ReadyMix | Roche | KK2601 | PCR mix |
| Medium reagent container for SX-8G IP-Star Compact | Diagenode | C30020003 | |
| MgCl2 (magnesium chloride) (25 mM) | ThermoFisher | R0971 | |
| N,N-Dimethylformamide | Millipore Sigma | D4551-250ML | CAUTION - low flash point |
| NaCl (5 M), RNase-free | ThermoFisher | AM9760G | |
| PBS (10X), pH 7.4 | ThermoFisher | 70011044 | |
| PCR Flex-free 8-tube stripes, attached individual optical caps | USA Scientific | 1402-4700 | 8 strip tubes, 0.2 mL 8-tube strip |
| Proteinase Inhibitor Cocktail | Millipore Sigma | P8340 | |
| Proteinase K Solution (20 mg/mL), RNA grade | ThermoFisher | 25530049 | |
| PureLink RNase A (20 mg/mL) | ThermoFisher | 12091021 | |
| Quant-iT PicoGreen dsDNA Reagent | ThermoFisher | P7581 | Used in the flourescence quantification |
| QuantStudio 6 Flex Real-Time PCR System | ThermoFisher | 4485699 | qPCR |
| ROX Reference Dye | ThermoFisher | 12223012 | |
| Sodium butyrate | Millipore Sigma | 303410-100G | |
| SYBR Gold Nucleic Acid Gel Stain (10,000X Concentrate in DMSO) | ThermoFisher | S11494 | nucleic acid dye |
| SYBR Green I Nucleic Acid Gel Stain - 10,000X concentrate in DMSO | ThermoFisher | S7563 | |
| TE Buffer | ThermoFisher | 12090015 | |
| Tips (bulk) | Diagenode | C30040020 | Tips for the IP Star |
| True MicroChIP Kit | Diagenode | C01010130 | Contains all the buffers for the IP; ChIP kit |
| UltraPure 1M Tris-HCI, pH 8.0 | ThermoFisher | 15568025 | |
| UltraPure SDS Solution, 10% | ThermoFisher | 24730020 |
Referenzen
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Johnson, D., Mortazavi, A., Myers, R., Wold, B. Genome-Wide Mapping of in Vivo Protein-DNA Interactions. Science. 316, 1497-1502 (2007).
- Mikkelsen, T. S., et al. Genome-wide maps of chromatin state in pluripotent and lineage-committed cells. Nature. 448 (7153), 553-560 (2007).
- Furey, T. S. ChIP-seq and beyond: new and improved methodologies to detect and characterize protein-DNA interactions. Nature Reviews Genetics. 13 (12), 840-852 (2012).
- Seumois, G., et al. Epigenomic analysis of primary human T cells reveals enhancers associated with TH2 memory cell differentiation and asthma susceptibility. Nature Immunology. 15 (8), 777-788 (2014).
- Schmiedel, B. J., et al. 17q21 asthma-risk variants switch CTCF binding and regulate IL-2 production by T cells. Nature Communication. 7, 13426 (2016).
- Ai, S., et al. Profiling chromatin states using single-cell itChIP-seq. Nature Cell Biology. 21 (9), 1164-1172 (2019).
- Brind'Amour, J., et al. An ultra-low-input native ChIP-seq protocol for genome-wide profiling of rare cell populations. Nature Communication. 6, 6033 (2015).
- Kaya-Okur, H. S., et al. CUT&Tag for efficient epigenomic profiling of small samples and single cells. Nature Communication. 10 (1), 1930 (1930).
- Youhanna Jankeel, D., Cayford, J., Schmiedel, B. J., Vijayanand, P., Seumois, G. An Integrated and Semiautomated Microscaled Approach to Profile Cis-Regulatory Elements by Histone Modification ChIP-Seq for Large-Scale Epigenetic Studies. Methods Molecular Biology. 1799, 303-326 (2018).
- Schmidl, C., Rendeiro, A. F., Sheffield, N. C., Bock, C. ChIPmentation: fast, robust, low-input ChIP-seq for histones and transcription factors. Nature Methods. 12 (10), 963-965 (2015).
- Skene, P. J., Henikoff, S. An efficient targeted nuclease strategy for high-resolution mapping of DNA binding sites. Elife. 6, 21856 (2017).
- Schmiedel, B. J., et al. Impact of Genetic Polymorphisms on Human Immune Cell Gene Expression. Cell. 175 (6), 1701-1715 (2018).
- Landt, S. G., et al. ChIP-seq guidelines and practices of the ENCODE and modENCODE consortia. Genome Research. 22 (9), 1813-1831 (2012).
- Chen, L., et al. Genetic Drivers of Epigenetic and Transcriptional Variation in Human Immune Cells. Cell. 167 (5), 1398-1414 (2016).
- Lienhard, M., Grimm, C., Morkel, M., Herwig, R., Chavez, L. MEDIPS: genome-wide differential coverage analysis of sequencing data derived from DNA enrichment experiments. Bioinformatics. 30 (2), 284-286 (2014).
- Engel, I., et al. Innate-like functions of natural killer T cell subsets result from highly divergent gene programs. Nature Immunology. 17 (6), 728-739 (2016).
- Grosselin, K., et al. High-throughput single-cell ChIP-seq identifies heterogeneity of chromatin states in breast cancer. Nature Genetics. 51 (6), 1060-1066 (2019).
- Rotem, A., et al. Single-cell ChIP-seq reveals cell subpopulations defined by chromatin state. Nature Biotechnology. 33 (11), 1165-1172 (2015).
- Wang, Q., et al. CoBATCH for High-Throughput Single-Cell Epigenomic Profiling. Molecular Cell. 76 (1), 206-216 (2019).
- Consortium, E. P. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Fang, R., et al. Mapping of long-range chromatin interactions by proximity ligation-assisted ChIP-seq. Cell Research. 26 (12), 1345-1348 (2016).
- Mumbach, M. R., et al. HiChIP: efficient and sensitive analysis of protein-directed genome architecture. Nature Methods. 13 (11), 919-922 (2016).
- Diagenode. The Ultimate Guide for Chromatin Shearing Optimization with Bioruptor Standard and Plus. Diagenode. , (2012).
Erratum
Formal Correction: Erratum: A Semiautomated ChIP-Seq Procedure for Large-scale Epigenetic Studies
Posted by JoVE Editors on 9/14/2020. Citeable Link.
An erratum was issued for: A Semiautomated ChIP-Seq Procedure for Large-scale Epigenetic Studies. An author's name was updated.
The name was corrected from:
Pandurangan Vijayanad
to:
Pandurangan Vijayanand
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten