Method Article
Bestrahlungsinbetriebnahme und Dosimetrie zur Bewertung von LQ-α und β Parametern, Strahlungsdosierungsschema und in-vivo-Dosisabscheidung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Strahlendosimetrie bietet eine Technik zur Verbesserung der Genauigkeit präklinischer Experimente und zur Sicherstellung, dass die gelieferten Strahlendosen eng mit klinischen Parametern verknüpft sind. Dieses Protokoll beschreibt die Schritte, die in jeder Phase während präklinischer Strahlungsexperimente zu ergreifen sind, um eine ordnungsgemäße versuchsweise Planung zu gewährleisten.
Zusammenfassung
Die Strahlendosimetrie ist entscheidend für die genaue Abgabe und Reproduzierbarkeit von Strahlungsschemata in präklinischen Modellen für eine hohe translationale Relevanz. Vor der Durchführung von In-vitro- oder In-vivo-Experimenten ist die spezifische Dosisleistung für den Bestrahlungskörper und einzelne Versuchsentwürfe zu bewerten. Mit Hilfe einer Ionisationskammer, eines Elektrometers und eines Festwasseraufbaus kann die Dosisleistung von breiten Feldern im Isozentrum bestimmt werden. Mit einem ähnlichen Aufbau mit radiochromen Filmen anstelle der Ionisationskammer können auch Dosisraten für kleinere Felder in unterschiedlichen Tiefen bestimmt werden. In vitro clonogene Überlebenstests von Krebszellen als Reaktion auf die Strahlenbehandlung sind kostengünstige Experimente, die ein Maß für die inhärente Radioempfindlichkeit von Zelllinien liefern, indem diese Daten mit dem traditionellen linear-quadratischen Modell in Verbindung gebracht werden. Modellparameter, die aus diesen Assays geschätzt werden, in Kombination mit den Prinzipien biologischer effektiver Dosen, ermöglichen es, unterschiedliche Fraktionierungspläne für die Strahlenbehandlung zu entwickeln, die in tumortragenden Tierversuchen gleichwertige effektive Dosen liefern. Dies ist ein wichtiger Faktor, den man beim Vergleich von In-vivo-Strahlentherapieplänen berücksichtigen und korrigieren sollte, um mögliche Verwechsgung enertalgegenüberierung von Ergebnissen aufgrund von Varianz in den gelieferten wirksamen Dosen zu beseitigen. Zusammengenommen bietet dieser Artikel eine allgemeine Methode zur Dosisausgangsüberprüfung präklinischer Tier- und Kabinettbestrahlungsgeräte, zur In-vitro-Bewertung der Radioempfindlichkeit und zur Überprüfung der Strahlenabgabe in kleinen lebenden Organismen.
Einleitung
Krebserkrankungen stellen kollektiv die zweithäufigste Todesursache in den USA und in vielen Ländern rund um den Globusdar 1. Strahlentherapie ist ein Eckpfeiler der Behandlung für viele Tumorsubtypen und wird etwa der Hälfte aller Krebspatienten2,3verabreicht. Die Patientenergebnisse für fast alle Krebsarten haben sich im Laufe der Zeit verbessert, da die Ausrüstung, die zur Bereitstellung von Strahlendosen verwendet wird, stetig fortgeschritten ist und einige effektive multimodale Therapieansätze entwickelt wurden4,5,6, aber die Rezidiv- und Sterblichkeitsraten für Patienten mit bestimmten Tumorarten bleiben hoch7,8,9. So ist die Strahlentherapie bei Krebs nach wie vor ein aktiver Bereich der Grundlagen- und klinischen Forschung. Viele präklinische Strahlentherapie-Studien verwenden den Einsatz von kleinen Bestrahlungsgeräten, um Strahlendosen an In-vitro- oder Tiermodelle von Krebs artenzuleinen. Bei einer Vielzahl potenzieller Experimente zur Untersuchung mechanistischer radiobiologischer Details oder neuartiger Behandlungen können häufige Fallstricke auftreten, die zu falschen Schlussfolgerungen, schlechter Reproduzierbarkeit und verschwendeten Ressourcen führen. Diese Fallstricke fallen in drei wichtige Bereiche: Bestrahlungsdosimetrie, In-vitro-Charakterisierung von Modellzelllinien und In-vivo-Bestrahlungs-Dosierplan und -Einrichtung. Genaue und reproduzierbare Ergebnisse aus fortgeschritteneren Experimenten sind ohne vorherige Berücksichtigung dieser grundlegenden Aspekte der Strahlentherapieforschung nur schwer zu erreichen.
Das hier beschriebene Protokoll beschreibt eine allgemeine Strategie zur Vermeidung oder Milderung dieser Probleme und stützt sich auf mehrere zuvor entwickelte Methoden, die für den unabhängigen Gebrauch bestimmt sind. Diese unterschiedlichen Methoden wurden zusammengeführt, so dass ein Forscher, der an der Beginn oder Verbesserung präklinischer Strahlentherapieexperimente interessiert ist, dies als robustes experimentelles Layout verwenden könnte. Der vorgeschlagene Rahmen umfasst methodenmäßig für die Inbetriebnahme von kleinräumigen Tierbestrahlungsgeräten, für die Bestimmung der grundlegenden radiobiologischen Eigenschaften von Modellkrebszelllinien und für die angemessene Gestaltung und Verwaltung eines Dosier- und Fraktionierungsplans für In-vivo-Tumormodelle.
Protokoll
Alle Schritte dieses Protokolls, die die Verwendung von Labortieren betreffen, einschließlich Handhabung und Verfahren, wurden vom Institutional Animal Care and Use Committee der West Virginia University in Morgantown, West Virginia (Protokollnummer: 1604001894) genehmigt.
1. Bestimmung der Dosisleistung
- Verwenden Sie dieses Protokoll, basierend auf dem "In-Phantom-Methode"-Protokoll der American Association of Physicists in Medicine Task Group (AAPM TG) 6110 und ähnlich dem von Xstrahl festgelegten Inbetriebnahmeprotokoll, um die Strahlleistung des Kleintierbestrahlungsators in Bezug auf eine bestimmte Geometrie unter den folgenden Rüstbedingungen zu bestimmen.
- Stellen Sie den Bestrahlungskörper so ein, dass er Strahlung auf 220 kVp und 13 mA liefert, wobei ein offenes Feld (17 cm x 17 cm) am Isocenter oder 35 cm von der Quelle entfernt positioniert ist. Filtern Sie den Strahl zusätzlich mit einem 0,15 mm Cu-Filter mit einem breiten Fokus. Einige Zellstrahler enthalten nur eine radioaktive Quelle, dieses Protokoll kann nur für Röntgenbestrahlungen verwendet werden.
- Richten Sie die Festwasser-Phantome in der folgenden Reihenfolge aus: 1 cm Platte, 2 cm Platte mit Ionisationskammerschlitz, 2 cm Platte, 1 cm Platte. Das Stapeln der Festwasser-Phantome in dieser Reihenfolge positioniert die Ionisationskammer in einer Tiefe von 2 cm, so dass auch 4 cm für die Rückstreuung möglich sind. Siehe Abbildung 1 für eine grafische Darstellung des Dosimetrie-Setups.
HINWEIS: Um den großen, ziemlich schweren Stapel festes Wasser unterzubringen, empfehlen die Autoren den Erwerb einer benutzerdefinierten 3D-gedruckten Couch mit variabler Unterstützung, um sicherzustellen, dass der Phantomstapel eben ist und im richtigen Abstand von der Quelle über die Oberfläche des Materials, nicht nur in der Mitte.
- Verwenden Sie die Messgeräte (d. h. ADCL kalibrierte Ionisationskammer, Elektrometer) und eine Erklärung der verwendeten Korrekturfaktoren finden Sie in Tabelle der Materialien bzw. Tabelle 1.
HINWEIS: Die ADCL stellt Werte von Nk an einigen Punkten für verschiedene Halbwertschichten (HVL, Maß der Strahlqualität) bereit. Der im Protokoll zu verwendende Wert von Nk sollte auf einer Interpolation der ADCL-Werte für die gemessene HVL der Einheit basieren. Der Hersteller hat die HVL unseres Gerätes gemessen und wir haben diese bei unserer Dosisleistungsbestimmung verwendet. - Richten Sie den Phantomstapel ein, und legen Sie die Ionisationskammer wie in Schritt 1.1.2 angegeben in das Phantom ein.
- Stellen Sie den Phantomstapel so ein, dass die Quelle auf den Oberflächenabstand (SSD) oder der Abstand von der Strahlungsquelle zur ersten Oberfläche 33 cm beträgt, wenn sie entsprechend nivelliert wird.
HINWEIS: Die Autoren schlagen vor, eine benutzerdefinierte, 3D-gedruckte Couch zu erstellen, die groß genug ist, um die Abmessungen der massiven Wasserplatten zu unterstützen. Zusätzlich verfügt die in diesem Protokoll verwendete Komponente über eine einstellbare Komponente zum Nivellieren des Phantomstapels.
- Stellen Sie den Phantomstapel so ein, dass die Quelle auf den Oberflächenabstand (SSD) oder der Abstand von der Strahlungsquelle zur ersten Oberfläche 33 cm beträgt, wenn sie entsprechend nivelliert wird.
- Nehmen Sie den Durchschnitt von drei separaten Röntgenbelichtungen, eine Minute Messwerte mit der Elektrometer-Bias-Spannung auf 300 V eingestellt. Das Ergebnis wird m+bezeichnet.
HINWEIS: Bestrahlungen werden mit dem Instrument durchgeführt, das eine Strahlung von 220 kVp und 13 mA liefert. Dies gilt auch für die nächsten beiden Schritte (Schritte 1.5-1.6). Stellen Sie zur Benutzersicherheit sicher, dass die Türen während der Behandlungen geschlossen bleiben. - Führen Sie einen weiteren Satz von drei separaten Röntgenbelichtungen durch, 1 min Messwerte mit der Elektrometer-Biasspannung auf -150 V. Das Ergebnis wird M L als MLbezeichnet.
- Führen Sie einen weiteren Satz von drei separaten Röntgenbelichtungen durch, 1 min Messwerte mit der Elektrometer-Biasspannung auf -300 V. Das Ergebnis wird MHoder auch M-bezeichnet.
- Berechnen Sie Ppol und Pion mit Gleichung 1 bzw. Gleichung 2 wie unten beschrieben:
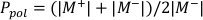 (Gleichung 1)
(Gleichung 1)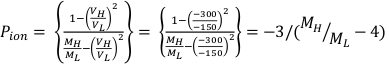 (Gleichung 2)
(Gleichung 2) - Messen Sie die Temperatur in Celsius und den Druck in kPa im Inneren des Bestrahlungsators mit einem kalibrierten digitalen Thermometer und Barometer. Berechnen Sie dann PTP wie unten in Gleichung 3angegeben.
HINWEIS: Bei dieser Berechnung wird davon ausgegangen, dass die ADCL Standardtemperatur- und Druckwerte von 22 °C und 101,33 kPa verwendet hat, wenn ihr Wert für den Luftkerma-Kalibrierungsfaktor angegeben wird.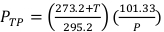 (Gleichung 3)
(Gleichung 3) - Berechnen Sie den korrigierten Kammerwert, M, indem Sie den Rohkammerwert, MH, mit Pelec, Ppol, Pionund PTPmultiplizieren. Diese Gleichung finden Sie unten in Gleichung 4.
HINWEIS: Bei dieser Berechnung wird davon ausgegangen, dass die ADCL ihre Kalibrierung mit der auf -300V eingestellten Vorspannung durchgeführt hat, was eine ziemlich gängige Praxis ist.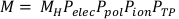 (Gleichung 4).
(Gleichung 4). - Multiplizieren Sie den korrigierten Kammerwert weiter mit Nk, [(μen/p)wair]water, PQ, chamund Pmantel. P-Mantel wird nur für Messungen in Wasser erhalten benötigt. Daher istp-Mantel für dieses Protokoll nur 1.
HINWEIS: Unter Verwendung der Bedingungen in diesem Protokoll geben die letzten drei Elemente einen Wert von 1.0731 an. Dieser Wert hängt von der Strahlqualität ab, daher muss der HVL bekannt sein, um ihn zu bestimmen. Der Wert von 1.0731 ist spezifisch für unsere Einheit und wird als Beispiel gegeben. Um die für Ihr Gerät spezifischen Werte von PQ,cham und [(μen/p)wair]Wasser zu bestimmen, verwenden Sie die gemessene HVL und interpolieren Sie aus Tabelle VIIund Tabelle VIIIund korrigieren Sie die Referenzfeldgröße gemäß Abbildung 3 und Abbildung 4 aus dem AAPM TG61-Protokoll10. In unserem Fall liefert die Multiplikation von Nk mit 1.0731 die Dosis zu Wasser, Dw, in Gy für eine Nominellzeit von 1 min, vorausgesetzt, der ADCL Nk-Wert ist in Gy/Coulumbs angegeben. - Bestimmen Sie die Endwirkung des verwendeten Bestrahlungsstrahlers. Wenn die Röntgenstrahlen zum ersten Mal erzeugt werden, steigt die Ausgabe über eine gewisse Zeit auf ihren vollen Wert. Wenn die Röntgenquelle ausgeschaltet ist, sinkt die Ausgabe über eine gewisse Zeit auf Null.
- Berücksichtigen Sie die Zeit für diesen Übergang oder den Endeffekt. Dies kann durch die Einnahme des Durchschnitts von drei Messwerten mit der Elektrometer-Biasspannung auf -300 V für eine Vielzahl von Zeiteinstellungen erfolgen. Tun Sie dies für 6, 12, 18, 24, 30 und 60 Sekunden.
- Zeichnen Sie die Elektrometer-Messwerte gegen die Zeit und finden Sie die beste gerade Linie. Die Gesamtzeit, t, für eine 1-minütige Behandlung kann durch Gleichung 5 berechnet werden:
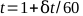 (Gleichung 5).
(Gleichung 5).
- Berechnen Sie die Dosisrate für einen bestimmten Bestrahlungskörper durch Gleichung 6:
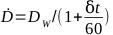 (Gleichung 6)
(Gleichung 6)
2. Erstellen einer radiochromen Filmkalibrierungskurve
- Eine Liste der erforderlichen Materialien finden Sie unter Materialtabelle.
- Platzieren Sie den Film mit einem nahezu identischen Aufbau wie das vorherige Protokoll in einer Tiefe von 2 cm in den Festen Wasser-Phantomstapel. Die Reihenfolge der festen Wasser-Phantome ist unbedeutend, solange es 2 cm festes Wasser über und 4 cm festes Wasser unten für Aufbau- und Rückstreueffekte gibt.
- Bestimmen Sie anhand der in Protokoll 1 in Auftrag gegebenen ermittelten Dosis die Behandlungszeiten für die in Tabelle 2 aufgeführten Dosen anhand von Gleichung 7:
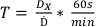 (Gleichung 7)
(Gleichung 7) - Bereiten Sie mehrere Filmstücke vor, die sicherstellen, dass jede Folie die gleiche Größe hat und von der Behandlung bis zur Scanerfassung in der gleichen Ausrichtung bleibt. Dies kann durch Platzieren eines kleinen diagonalen Schnitts in der unteren linken Ecke erfolgen. Jeder Film von diesem Punkt an muss aus der gleichen Charge des Films stammen.
HINWEIS: Bereiten Sie 3 separate Replikationen für jeden zu bewertenden Dosispunkt vor. - Scannen Sie die geschnittenen Teile mit einem 48-Bit-Farbfotoscanner, bei dem alle Korrekturen deaktiviert sind. Stellen Sie sicher, dass jeder Film in der genauen Mitte des Scanbetts platziert wird. Die ermittelten Werte sind die Pre-Expositions-Scans, die zur Bestimmung der nicht exponierten optischen Dichte11,12verwendet werden. Speichern Sie alle Bilder im . Tiff-Dateiformat, um die Komprimierung von Schlüsseldaten zu vermeiden.
HINWEIS: Die Autoren empfehlen, die Filme dreimal zu scannen und den erhaltenen Durchschnitt als Einzelwert für einen bestimmten Film zu verwenden. - Beginnen Sie die Bestrahlung der Filme, indem Sie ein Filmstück auf 4 cm festes Wasser legen und die restlichen 2 cm festes Wasser darüber positionieren, wie in diesem Abschnitt zuvor beschrieben.
- Stellen Sie den Phantomsatz so ein, dass der Film den gleichen Abstand von der Quelle hat wie die Ionisationskammer bei der Bestimmung des Dosisausgangs. Dies ist der isozentrische Punkt des Bestrahlungsators.
- Programmieren Sie die Behandlungszeit, die in Schritt 2.3 oben für eine verordnete Dosis berechnet wurde.
- Wiederholbehandlung für jede der in Tabelle 2aufgeführten Dosen .
- Lassen Sie Filme 24 Stunden lang lichtgeschützt ruhen.
- Erwerben Sie die Scans nach der Belichtung auf die gleiche Weise wie oben.
- Importieren Sie Bilder in die ImageJ-Analysesoftware und führen Sie alle Messungen auf dem roten Kanal durch.
- Ziehen Sie das Bild in . Tiff-Dateiformat in ImageJ.
- Klicken Sie auf das Dropdown-Menü Bild. Wählen Sie Das Dropdown-Menü Farbe aus Bild aus. Wählen Sie Split-Kanäle aus der Option Farbe aus.
- Zeichnen Sie mit dem Rechteckwerkzeug nur den roten Bildkanal. Drücken Sie Strg+M. Mittleren Wert aus dem Ergebnisfenster transkribieren.
- Wiederholen Sie die Schritte 2.12.1-2.12.4 für alle gescannten Filme.
- Erhalten Sie den Pixelwert in einem zentral gelegenen Quadrat von 1 cm x 1 cm sowohl für die nicht belichteten als auch für die exponierten Filme. Diese Werte werden als PVU(D) bzw. PV(D) bezeichnet und können zur Berechnung der optischen Nettodichte gemäß Gleichung 8verwendet werden.
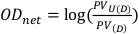 (Gleichung 8) 13
(Gleichung 8) 13
- Wiederholen Sie Schritt 2.13 für jedes Paar Filmbilder, sowohl vor- als auch nach der Belichtung.
- Zeichnen Sie einen Graphen der Dosis im Vergleich zur optischen Nettodichte und passen Sie die Kurve an ein kubisches Polynom im Format y = ax3 + bx2 + cx + d an. Ein Beispiel finden Sie in Abbildung 2B.
3. Bestimmung des α/β Wertes für bestimmte Krebszelllinien mittels clonogener Assay
HINWEIS: Das folgende Protokoll ist eine modifizierte Version der von Franken et al14 beschriebenen Methoden und ist in Abbildung 3zu sehen.
- Wachsen Sie Zellen bis zu 80 % Konfluenz. Vermeiden Sie die Verwendung überlaufener Zellquellen für dieses Experiment, da es notwendig ist, dass sich die Zellen in der Logphase des Zellwachstums befinden. Für die repräsentativen clonogenen Testergebnisse in Abbildung 3Cwurden hirntropische MDA-MB-231 Brustkrebszellen in Dulbeccos Modified Eagle Medium (DMEM) kultiviert, ergänzt mit 10% fetalem Rinderserum und Penicillin/Streptomycin und wurden bei 37 °C und 5% Kohlendioxid in einem befeuchteten Inkubator inkubiert.
- Samen Sie die Zellen in der gewünschten Dichte für den Kolonietest. Genaue Verdünnungen während der Aussaat sind entscheidend für die Bestimmung der Beschichtungseffizienz des Assays. Achten Sie darauf, mehrere Replikationen zu verkleben.
- Fahren Sie mit diesem Schritt fort, wenn die Strahlenbehandlung der Zellbeschichtung vorangeht (Abbildung 3A). Alternativ fahren Sie mit Schritt 3.4 fort, wenn die Zellbeschichtung der Strahlenbehandlung vorausgeht.
- Führen Sie die gewünschte Strahlenbehandlung auf Kulturkolben durch. Alle zusätzlichen Behandlungen (d. h. medikamentöse Behandlungen) können jederzeit vor oder nach dieser Behandlung durchgeführt werden. Für die repräsentativen Ergebnisse in Abbildung 3Cerfolgte die Strahlenbehandlung nach der Beschichtung von Zellen, die in Schritt 3.4 beschrieben sind.
- Extrahieren Sie die Zellen mit der bevorzugten Trypsinisierungsmethode, und erstellen Sie eine Einzelzellsuspension. Entfernen Sie Kulturmedien und fügen Sie rekombinantes Enzym (z. B. TrypLE Express) hinzu, um Zellen aus dem Kolben zu lösen. Inkubieren Sie Zellen mit dem Enzym für ca. 3 Minuten, bis die Zellen abgelöst wurden, wie sie mit einem Lichtmikroskop detektiert wurden. Neutralisieren Sie das Enzym mit einem gleichen Volumen von Zellkulturmedien. Zentrifugenzellen bei 300 x g für 10 min und resuspendieren auf die gewünschte Konzentration im Kulturmedium.
- Plate die Zellen bei gewünschten Dichten in mehreren Replikationen.
- Ersetzen Sie es nach den ersten 24 h durch frische Medien.
- Fahren Sie alle 2-3 Tage fort, die Medien zu ersetzen.
- Fahren Sie mit der Kultivierung von Zellen fort, bis die Kontrollkolonien 50 Zellen pro Kolonie überschreiten, 9-14 Tage. Kontrollkolonien sind jene Behandlungsgruppen, die keine Strahlendosen erhalten. Für Experimente mit medikamentösen Behandlungen wird auch eine andere Kontrollgruppe mit Medikamentendosing, aber keine Strahlenbehandlung erforderlich sein.
- Fahren Sie mit diesem Schritt fort, wenn Sie Zellen vor der Strahlenbehandlung aussäen (Abbildung 3B).
- Extrahieren Sie Zellen mit der bevorzugten Trypsinisierungsmethode, und erstellen Sie eine Einzelzellsuspension.
- Platzieren Sie Zellen bei gewünschten Dichten in mehreren Replikationen.
- Lassen Sie Zellen über Nacht auf der Platte haften.
- Führen Sie die gewünschten Strahlendosen aus. Zusätzliche Behandlungen, wie die Medikamentendosierung, können an jedem Punkt vor oder nach diesem Schritt durchgeführt werden, solange Zellen an ihren Behandlungsplatten befestigt sind. Für die repräsentativen Ergebnisse in Abbildung 3Cwurden 1250 hirntropische MDA-MB-231-Zellen vor der Behandlung plattiert (Schritt 3.4). Anschließend wurden die Zellen 3 Stunden vor der Bestrahlung mit 3 Gy Röntgenstrahlen mit 15 nM Doxorubicin behandelt.
- Ersetzen Sie das Medium nach den anfänglichen 24 h.
- Ersetzen Sie die Medien alle 2-3 Tage.
- Kultur der behandelten Zellen, bis die Kontrollgruppenkolonien 50 Zellen übersteigen, 9-14 Tage. Kontrollkolonien sind jene Behandlungsgruppen, die keine Strahlendosen erhalten. Für Experimente mit medikamentösen Behandlungen wird auch eine andere Kontrollgruppe mit Medikamentendosing, aber keine Strahlenbehandlung erforderlich sein.
- Entfernen Sie Kulturmedien aus Brunnen oder Geschirr und waschen Sie sie mit PBS.
- Fixzellen für 15 Minuten in einer 1:7 (v:v) Lösung von Eisessigsäure und Methanol.
- Entfernen Sie die Fixierungslösung.
- Nach der Fixierung, Fleckenzellen für 30 Minuten, oder 2 h, wenn Zeit verfügbar ist, bei Raumtemperatur mit einer 2,5-5,0 mg/ml Lösung von Kristallviolett in einer 4:1 (v:v) Lösung von destilliertem Wasser und Methanol.
- Entfernen Sie die Färbelösung und waschen Sie Zellen in einem großen Wasserbad mit Raumtemperatur.
HINWEIS: Nicht unter fließendem Wasser waschen. - Zählen Sie die resultierende Anzahl von Kolonien in jeder Behandlungsgruppe und berechnen Sie den Überlebensanteil jeder Platte.
- Plotten Sie den Überlebensanteil gegen die entsprechende Dosis und passen Sie die Kurve mit einer exponentiellen Passform an.
- Um den wert α/β zu schätzen, verwenden Sie eine exponentielle Anpassung des obigen Diagramms, um die Werte für jeden der einstellbaren Parameter in der unten findenden linear-quadratischen Gleichung zu schätzen:
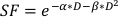 (Gleichung 9)
(Gleichung 9)
HINWEIS: Die Bestrahlung von Zellen kann in der Regel im Isocenter ohne Kollimation erfolgen, sofern die Feldgröße groß genug ist, um gute Teller oder Petrischalen aufzunehmen. Mögliche Fallstricke in diesem Protokoll können Erträge wie keine Koloniebildung, signifikante Zellmigration mit klarem Zellwachstum, aber keine echten Kolonien oder Kontamination aufgrund der Behandlung in einer nicht-sterilen Bestrahlungskammer sein.
4. Bestimmung der spezifischen Dosisleistung für variable Versuchskonstruktionen
- Entscheiden Sie über die gewünschte Feldgröße und den Abstand von der Quelle.
HINWEIS: Die Kollimation ändert die Dosisrate unabhängig von der Größe oder Entfernung des Kollimators von der Röntgenquelle. - Positionieren Sie einen Film in der richtigen Ausrichtung, der das experimentelle Design am besten darstellt, indem Sie Festwasser-Phantome verwenden, um Aufbau und Rückstreuung zu ermöglichen.
HINWEIS: Bei jedem Versuchsaufbau liefert festes Wasser möglicherweise nicht die genaueste Darstellung eines bestimmten Entwurfs. Stattdessen empfehlen wir die Verwendung der eigentlichen Versuchsgefäße (d.h. Petrischale, Brunnenplatten, kleine Tier-Phantome, etc.). - Strahlen sie filme für 1 (N=3) und 2 (N=3) Minuten.
- Lassen Sie Filme 24 Stunden lang lichtgeschützt ruhen.
- Bestimmen Sie die optische Nettodichte der einzelnen Filme nach den Verfahren aus Abschnitt 2. Verwenden Sie die Filmkalibrierungskurve, um die Dosis aus der optischen Nettodichte zu bestimmen.
- Bestimmen Sie die Dosis bei 1 Minute,D1, als Ausgangsdosisrate, Ḋ, für diesen experimentellen Aufbau, der in Gleichung 10 wie folgt definiert ist:
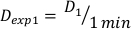 (Gleichung 10)
(Gleichung 10) - In ähnlicher Weise caluclate die Dosis bei 2 Minuten durch Gleichung 11 wie folgt:
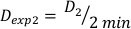 (Gleichung 11)
(Gleichung 11) - Aufgrund des Endeffekts kann die Dosisrate für die oben genannten Berechnungen leicht unterschiedlich sein. Verwenden Sie daher zur Berechnung von Dexp für das gewünschte Versuchsdesign einen Mittelwert des einzelnen Dexp, wie in Gleichung 12angegeben:
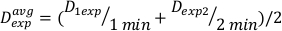 (Gleichung 12)
(Gleichung 12) - Definieren Sie anhand dieses Durchschnitts die Zeit für die Behandlung einer beliebigen Dosis für diese spezielle Einrichtung in Gleichung 13:
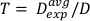 (Gleichung 13)
(Gleichung 13)
5. Behandlung von Mäusen, die Tumore an einer anatomischen Stelle von Interesse tragen
- Anästhesisieren Sie Maus mit sicheren und humanen Anästhesietechniken, die von der IACUC der Institution zugelassen wurden.
- Anästhesisiertes Tier in Zurückhaltung geben, wie in der gewünschten Versuchskonstruktion angegeben.
- Dieser Schritt ist optional, falls nicht verfügbar, fahren Sie mit Schritt 5.6 fort. Erhalten Sie ein Radiogramm mit einer Onboard-Portalkamera der Maus ohne Kollimation mit einem Aluminiumfilter.
- Erhalten Sie ein zweites Radiogramm mit Kollimation an Ort und Stelle.
- Überlagern Sie Radiogramme in ImageJ, um die Strahlpositionierung zu demonstrieren.
- Bestimmen Sie anhand des vorgegebenen α/β-Werts das Dosisschema, das den vernünftigsten Ansatz zur Beantwortung einer Forschungsfrage bietet (d. h. wenn Sie die Auswirkungen einer Dosis von 30Gy in 10 Fraktionen von 3 Gy modellieren möchten, aber nur vier Fraktionen geben möchten). Unter Verwendung von Gleichung 14, mit einem angenommenen α/β Wert von 10 (dieser Wert kann für einzelne Krebszelllinien in Protokoll 3bestimmt werden) und einem BED ähnlich dem von 30 Gy/10 F, behandeln Sie mit 24 Gy in 4 Fraktionen von 6 Gy.
- Behandeln Sie das Tier für die vorgeschriebene Zeit, die für die gewünschte Dosis gegeben wird.
6. Histologische Bestätigung der Dosisabscheidung in vivo
- Nach Protokoll 5, sammeln Gewebe von Interesse innerhalb von 1 Stunde nach der Behandlung15,16. Nach der Gewebeernte mit dem bevorzugten Immunhistochemieprotokoll fortfahren. Ein Beispiel finden Sie unten.
- Perfuse Tier mit eiskalten 4% Paraformaldehyd (PFA).
- Nachfix in PFA bei 4 °C.
- Fixieren Sie das Gewebe nach der Fixierung sequenziell in 10%, 20% und 30% Saccharose für jeweils 24 Stunden bei Raumtemperatur.
- Gewebe in Gelatine einbetten und sequenziell in 4% PFA und wieder in 10-30% Saccharose für jeweils 24 Stunden bei Raumtemperatur fixieren.
- Block beschneiden und 30 Minuten bei -80 °C platzieren.
- Gewebe in 20-30 -m Abschnitte schneiden.
- Immunostain gleitet als frei schwebende Abschnitte in einer sechs Well-Platte17,18.
- Waschen Sie dreimal und durchlässig für 30 Minuten auf einem Shaker mit 1,83% Lysin in 1% Triton, und 4% hitzeinaktiviertes Ziegenserum.
- Inkubieren Sie Abschnitte mit Anti-H2AX-Antikörper für 24 Stunden, gefolgt von einer 2-stündigen Inkubation mit gewünschtem Sekundärantikörper.
- Coverslip-Schlitten mit Glasabdeckungen mit bevorzugten Montagemedien.
- Bild auf einem Fluoreszenzmikroskop.
Ergebnisse
Nach Protokoll 1 wird eine Dosisrate in Gy/min, die spezifisch für den verwendeten Bestrahlungskörper ist. Unabhängig vom Typ des Bestrahlungsators kann jedoch mit einer bekannten Dosisrate eine Kalibrierkurve mit Protokoll 2 erzeugt werden, das ähnliche Filme und eine ähnliche Kalibrierkurve wie in Abbildung 2A-Bergibt. Ein erfolgreicher Test aus Protokoll 3 ergibt deutliche, gut abgegrenzte Zellkolonien, die homogen violett färben. Die Schätzung von α/β kann mit Literaturwerten oder anderen Behandlungsgruppen verglichen werden, um die Radioempfindlichkeit der gegebenen Zelllinie zu interpretieren. Unter Verwendung der nach Protokoll 2 entwickelten und in Abbildung 2Bdargestellten Kalibrierkurve ergeben Protokoll 4 zwei Filmproben, die Abbildung 2A ähneln und zur Schätzung der erforderlichen experimentellen Bestrahlungszeiten verwendet werden können. Wenn für den verwendeten Bestrahlungsstrahler eine Bordportal-Bildkamera zur Verfügung steht, können Mit und ohne Kollimation Radiogramme von Kleintieren erhalten werden. Die Überlagerung dieser Bilder zeigt die genaue Positionierung des kollimierten Strahlungsstrahls im Verhältnis zu dem Kleintier, das wie in Abbildung 4Adargestellt behandelt wird. Eine erfolgreiche Dosisabscheidung im Protokoll 5 kann nach Protokoll 6 bestätigt werden. Ein Indiz dafür, dass Strahlung in einem In-vivo- oder In-vitro-System abgelagert wird, ist der Nachweis von doppelsträngigen DNA-Brüchen. In Abbildung 4Bdargestellt zeigt die gleiche Maus, die ausschließlich durch die rechte Hemisphäre in Abbildung 4Abehandelt wird, eine positive H2AX-Färbung nur in der behandelten Hemisphäre. In dieser Abbildung sind die Kerne mit DAPI befleckt, um zwei Dinge zu zeigen; 1) das Ganze sind vom Gehirn, auf das der Anti-H2AX-Antikörper während der histologischen Analyse angewendet wurde, und 2) die unbehandelte Gehirnhälfte bleibt unbefleckt.
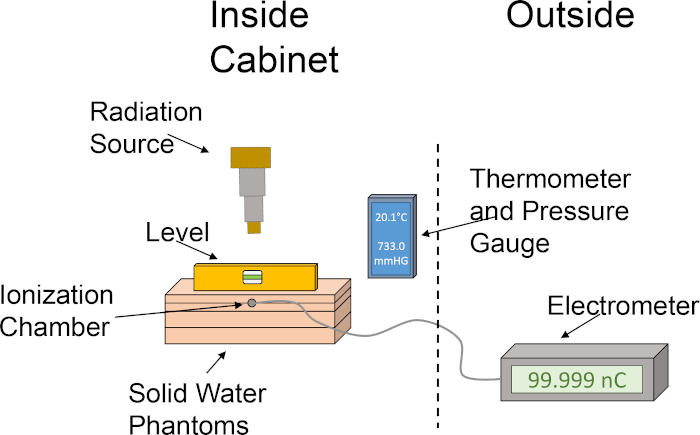
Abbildung 1: Grober Aufbau der Ionisationskammer und des Wasser-Phantoms zur Bestimmung der Dosisleistung eingerichtet. Das Piktogramm zeigt eine grundlegende Einrichtung unter Verwendung der verschiedenen Komponenten, die für die Dosimetrie erforderlich sind, mit einer Ionisationskammer und festen Wasser-Phantomen im Schrank des Bestrahlungsators. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Erzeugung einer Kalibrierkurve mit radiochromem Film. (A) Repräsentativer Farbwechsel von radiochromem Film mit steigender Dosis. Oben links (0 cGy); unten rechts (2000 cGy). (B) Potenzielle radiochrome Filmkalibrierungskurve, die die optische Nettodichte und -dosis vergleicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
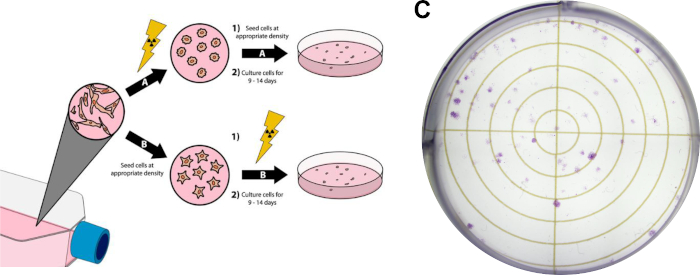
Abbildung 3: Clonogener Assay von Krebszellen. Die Strahlenbehandlung der Zellen kann vor der Beschichtung in sechs Brunnenplatten/Petrischalen (A) oder nach (B )erfolgen. Im Panel (C) wird ein repräsentatives Bild eines erfolgreichen clonogenen Assays mit MDA-MB-231 Brustkrebszellen nach dem Protokoll Abschnitt 3 angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
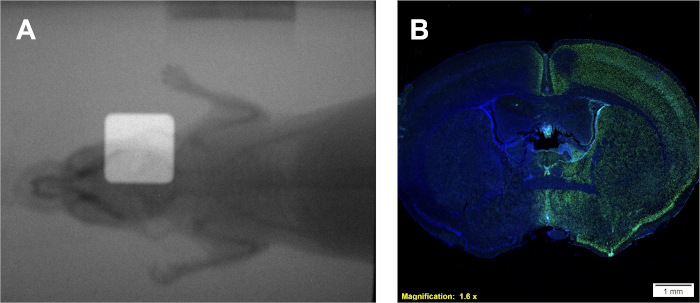
Abbildung 4: Verwendung von dual überlagerten Radiogrammen zur Positionierung (falls verfügbar) und positiver immunhistochemischer Färbung von H2AX zur Bestätigung der Dosisabscheidung. (A) Repräsentative überlagerte Radiogramme, die die Platzierung des Strahlungsstrahls darstellen. (B) Repräsentative Ergebnisse, die die Dosisabscheidung auf die rechte Hemisphäre anzeigen, wie durch erhöhte H2AX-Intensität nachgewiesen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Korrekturfaktor | Erklärung | |
| Na | Luftkerma-Kalibrierungsfaktor | |
| [(μen/)Wair] Wasser | Ration der Massenenergieabsorptionskoeffizienten von Wasser zu Luft; ca. 1,05 | |
| Pq,Cham | Berichtigungsrechnung für Kammerstamm, der die Photonenfluenzrelevanz nach Kammer beeinflusst; ca. 1.022 | |
| PMantel | Korrekturrechnung für MantelschutzIonisationskammer; Wert von 1, da Kammer wasserdicht ist | |
| Ppol | Korrekturfaktor, der die Polarität berücksichtigt; im Protokoll 1 bestimmt | |
| P-Ion | Korrekturfaktor, der die Ionenrekombination berücksichtigt; im Protokoll 1 bestimmt | |
| PTp | Korrekturfaktor für Temerpatur und Druck am Experimenttag; im Protokoll 1 bestimmt | |
Tabelle 1: Korrekturfaktoren, die für die Bestimmung der Dosisrate in Protokoll 1 erforderlich sind.
| Dosis | N |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| * Nur für Dosen über 10 für Einzelexperimente notwendig. | |
Tabelle 2: Dosen zur Erzeugung radiochromischer Filmkalibrierungskurven.
Diskussion
Das obige Protokoll beschreibt einen benutzerfreundlichen Ansatz für die Strahlendosimetrie, die Bestimmung von α/β-Werten in Krebszelllinien und ein kurzes Beispiel für einen Ansatz für die Bestrahlung in einem präklinischen Modell der Hirnmetastasierung von Brustkrebs. Diese Methoden können verwendet werden, um jedes Modell von Krebs zu studieren und sind nicht nur auf Gehirnmetastasen von Brustkrebs beschränkt. In diesem Abschnitt werden wir die relevanten Feinheiten diskutieren, die präklinischen Strahlentherapieexperimenten zugrunde liegen.
Die Dosimetrie besteht aus zwei Teilen: 1) Kalibrieren Sie den Ausgang mit einer Bauernkammer, so dass die Dosisrate der Röntgeneinheit ermittelt wird, und 2) bereiten Sie ein praktisches Dosimetrie-Messsystem mit radiochromem Film vor. In Bezug auf die Ausgangskalibrierung bietet TG-61 eine reproduzierbare Methode in Wasser. Das Protokoll verwendet hier Gammex RMI 457 Festwasser, wie von XStrahl, dem Hersteller des Bestrahlungskörpers, empfohlen. Obwohl die relative Dosimetrie (Profile oder Tiefendosiskurven normalisiert auf die maximale Dosis) Mit festem Wasser besser als 1% mit der von Wasser übereinstimmt, gibt es einen Unterschied von etwa 3 bis 4% in absoluter Dosis aufgrund eines höheren Massenenergieaufnahmekoeffizienten für festes Wasser im Vergleich zu Wasser. Da jedoch alle Installationen des XStrahl-Systems das Festwasserprotokoll für die Ausgangskalibrierung verwenden, haben wir diese Unterschiede nicht korrigiert. Die Kenntnis der Ausgabe ermöglicht die Berechnung der Belichtungszeit, die erforderlich ist, um eine gewünschte Dosis zu liefern. Wenn wir den Film in der gleichen Einrichtung wie die Bauernkammer platzieren, können wir bekannte Dosen an den Film liefern. Das Scannen des Films sorgt dann für optische Dichten. Die Dosis des Films kann dann mit der entsprechenden optischen Nettodichte (Differenz in der optischen Dichte nach und vor der Belichtung) dargestellt werden. Dadurch wird eine Filmkalibrierungskurve erzeugt. Wenn wir Versuchsaufbauten ändern, könnte sich die Dosisrate in dieser Situation ändern, da die Dosisrate von Feldgröße, Tiefe und bestrahltem Material abhängt. Die Exposition von Film mit dem experimentellen Aufbau bietet uns eine Netto-Optikdichte, und mit der Filmkalibrierungskurve können wir dann die entsprechende Dosis bestimmen. Wenn wir diese Dosis bis zur Bestrahlung des Films dividieren, erhalten wir die Dosisrate. Diese Dosisrate kann dann verwendet werden, um die Belichtungszeit zu berechnen, um eine gewünschte Dosis für den gegebenen Versuchsaufbau zu liefern. Das oben beschriebene Protokoll behandelt mehrere Nuancen im Zusammenhang mit der Filmdosimetrie. Beispielsweise benötigt der Film nach der Belichtung etwa 24 Stunden, bis die chemischen Reaktionen in der aktiven Schicht des Films praktisch vollständig sind. Wenn Sie nicht auf diese Zeit warten, führt dies zu einer geringeren optischen Dichte.
Damit jede Studie reproduzierbare Dosimetrie hat, ist es wichtig, einige der Schlüsselelemente eines bestimmten Bestrahlungsstrahlers zu kennen und zu verstehen. Insbesondere es ist wichtig, anderen Forschern die Herstellung und das Modell des verwendeten Bestrahlungsators, den Quelltyp (Röntgen, Radio, etc.), Energie, Halbwertschicht, Feldgröße, Quelle zu Oberfläche und Quelle zu isozentrischen Entfernungen, Größe des bestrahlten Materials, Dämpfung vor und Rückstreuung nach dem bestrahlten Material, experimentierspezifische Dosisrate, Fraktionierungsschema, exakte Dosimetriegeräte zu kennen und zu isokatralisieren. All diese Informationspunkte sind es, die die Strahlqualität eines bestimmten Bestrahlungskörpers kohäsiv beschreiben, bevor eine Dosis an ein Tier oder eine Zelle geliefert wird19. Ein weiterer relevanter Informationspunkt aus diesem Protokoll und anderen ist, dass die in Protokoll 1 erreichte Dosisrate einfach die Ausgabe des verwendeten Bestrahlungsators ist. Für jedes Experiment ist es wichtig, die Dosisrate für dieses bestimmte Setup (Protokoll 4) im Vergleich zu einer erzeugten radiochromen Filmkalibrierungskurve (Protokoll 2) zu definieren.
In-vitro-Experimente liefern wichtige Details über das radiobiologische Verhalten von Krebszelllinien. In vitro clonogene Zellüberlebens-Assays schätzen und quantifizieren die inhärente Radioempfindlichkeit einer Zelllinie20, die bei der Entwicklung von Fraktionierungsplänen in nachfolgenden Zell- oder Kleintierversuchen hilft21. Insbesondere nähern sich diese Assays den Werten für die Parameter α und β an, die im linear-quadratischen Modell verwendet werden, um den Zelltod als Reaktion auf die Strahlentherapie gemäß der Gleichung vorherzusagen:
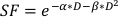 (Gleichung 9)
(Gleichung 9)
wobei SF der überlebende Anteil klonogen lebensfähiger Zellen ist, D die Strahlendosis in Gy ist und α und β die Parameter22. Das Verhältnis α/β bietet ein inhärentes Maß für die zelluläre Radioempfindlichkeit, wobei höhere Werte mit einer erhöhten Empfindlichkeit einer Zelllinie korrelieren22. Da diese funktionelle Beziehung in Bezug auf die Dosis nicht linear ist, beziehen sich die biologischen Wirkungen eines Strahlentherapie-Fraktionierungsschemas nicht nur auf die gesamte abgegebene Dosis, sondern auch auf die Anzahl und Größe der Fraktionen23. Die biologische effektive Dosis (BED) ist ein Maß für die wahre biologische Dosis, die an ein Gewebe abgegeben wird und ermöglicht den direkten Vergleich verschiedener Fraktionenschematatodaten 24,25. Die BED-Gleichung erfordert nur eine Schätzung von α/β und wird unten angezeigt:
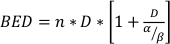 (Gleichung 14)
(Gleichung 14)
wobei n die Anzahl der Fraktionen der Dosis D ist. Clonogene Zellüberlebenstests schätzen α/β und erleichtern den direkten Vergleich von Strahlentherapie-Fraktionierungsschemata über die BED-Gleichung. Falsche Schlussfolgerungen hinsichtlich einer Gewebe- oder Organreaktion auf Strahlentherapie (oder Kombinationen von Strahlentherapie mit anderen Modalitäten) können gezogen werden, wenn die BED in den Behandlungsgruppen innerhalb oder zwischen den Experimenten nicht gerecht ist. Zum Beispiel ergeben 2 Fraktionen von 10 Gy im Vergleich zu 4 Fraktionen von 5 Gy nicht das gleiche BED, und daher können diese Dosierschemata nicht direkt in Bezug auf die biologische Reaktion verglichen werden. Die BED-Gleichung ist zwar aufgrund der inhärenten Einschränkungen im linear-quadratischen Modell unvollkommen, schätzt aber zuverlässig gerechte Effekte für eine Vielzahl experimenteller Behandlungsbedingungen24,25.
Clonogene Zellüberlebens-Assays spielen eindeutig eine wichtige Rolle bei der Untersuchung von Strahlentherapie-Effekten in Krebsmodellen, aber In-vitro-Experimente bieten eine Reihe zusätzlicher Optionen, um mechanistische Details der Krebszellradiobiologie weiter zu erforschen. Einfache Modifikationen des Clonogenzellüberlebens-Assays wurden verwendet, um die Wirkmodi für einige radiosensibilisierende Chemotherapien wie Paclitaxel oder Etoposid26,27zu bestimmen. Weitere in vitro experimentelle Optionen umfassen Immunzytochemie-Studien zur Untersuchung spezifischer zellulärer Reparaturwege, wie γ-H2AX-Foci und/oder 53BP1-Färbung für doppelsträngige DNA-Bruchreparatur28. Diese Experimente können besonders interessant sein, wenn man die Strahlentherapie als eine einzige Modalität mit Kombinationstherapien vergleicht, insbesondere wenn man mechanistische Details für eine bestimmte Zelllinie untersucht. Weitere experimentelle Optionen umfassen Zytokinmessungen zur Untersuchung der angeborenen Rolle der entzündlichen Reaktion einer Zelle auf bestrahlung oder Analysen der Art des Zelltodes (d. h. Apoptose, Nekrose, mitotische Katastrophe usw.) unter verschiedenen therapeutischen Bedingungen29,30,31. Diese Art von Experimenten kann Tierversuche ergänzen oder ersetzen und ein vollständigeres Verständnis der Radiobiologie einer Krebszelllinie vermitteln. Ungeachtet der Wahl zusätzlicher Experimente, die durchgeführt werden sollen, ist ein Standard-Clonogenzell-Überlebenstest, wie in Protokoll 3 beschrieben, eine wichtige erste radiobiologische Bewertung einer Zelllinie.
Clonogene Assays und Strahlendosimetrie bieten dem Forscher die Möglichkeit, Experimente präzise zu planen, um klinischen Szenarien direkter zu ähneln. Mit der Zugabe von präklinischen Krebs-Kleinnagetiermodellen ist es möglich, die Reaktion auf Strahlung allein oder im Rahmen eines Behandlungsplans in vivo zu untersuchen. Vor der Verwendung von Tieren ist es wichtig, die relative Dosisleistung des spezifischen Setups zu bestimmen, wenn er von dem Setup für die Bestimmung der Dosisleistung32,33abweicht. Wenn es um die Bestimmung einer Dosisrate für Feldgrößen von <10 mm geht, wird die Verwendung einer Ionisationskammer aufgrund der Ausrichtung innerhalb eines kleinen Feldes und der partiellenVolumenmittelungseffekte 33weniger genau. Die Verwendung von radiochromem Film zur Bestimmung der Leistung in Kombination mit immunhistochemischen In-vivo-Experimenten wurde verwendet, um die Ausgabe und Dosisabscheidung in den letzten16,34,35,36,37,38zu bestimmen.
Offenlegungen
Die Autoren haben keine Angaben zu machen.
Danksagungen
Die Autoren danken den Mikroskop- und Tiermodellen Imaging Facilites an der WVU für die Nutzung ihrer Geräte, die durch die Fördernummer P20GM103434 unterstützt werden. Darüber hinaus wurde diese Arbeit durch die Grant-Nummer P20GM121322 vom National Institue of General Medical Sciences, durch die Fördernummer F99CA25376801 und den Mylan Chair Endowment Fund unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
Referenzen
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5 (2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001 (2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104 (2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. . Radiobiology for the radiologist. Eighth edition. , (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96 (2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251 (2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204 (2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134 (2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten