Method Article
Polarisation von M1 und M2 Human Monocyte-Derived Cells und Analyse mit Durchflusszytometrie bei Mycobacterium tuberculosis Infection
In diesem Artikel
Erratum Notice
Zusammenfassung
Dieses Protokoll bietet eine Methode zur Untersuchung der Mycobacterium tuberculosis-Infektion bei menschlichen M1- oder M2-polarisierten Makrophagen auf der Grundlage der Differenzierung von peripheren Blutmonozyten zu Makrophagen-ähnlichen Zellen, die mit dem GFP-markierten virulenten Stamm H37Rv infiziert und mit Durchflusszytometrie mit einem 10-Farben-Panel einschließlich der Expression ausgewählter M1/M2-Marker analysiert werden.
Zusammenfassung
Humane Makrophagen sind primäre Wirtszellen der intrazellulären Mycobacterium tuberculosis (Mtb)-Infektion und spielen somit eine zentrale Rolle bei der Immunkontrolle von Tuberkulose (TB). Wir haben ein experimentelles Protokoll entwickelt, um die immunpolarisation von myeloiden Zellen in M1 (klassisch aktiviert) oder M2 (alternativ aktivierte) Makrophagen-ähnliche Zellen durch Bewertung mit einem 10-farbenigen Durchflusszytometrie-Panel zu verfolgen, das die Visualisierung und Tiefencharakterisierung von grünfluoreszierendem Protein (GFP)-markierten Mtb in verschiedenen Makropages-Untersätzen ermöglicht. Monozyten, die von gesunden Blutspendern gewonnen wurden, wurden in M1- oder M2-Zellen polarisiert, wobei die Differenzierung mit Granulozytenmakrophagen-Kolonie-stimulierendem Faktor (GM-CSF) oder Makrophagenkolonien-stimulierendem Faktor (M-CSF) gefolgt von einer Polarisation mit IFN-γ und Lipopolysaccharid (LPS) bzw. IL-4 erfolgte. Voll polarisierte M1- und M2-Zellen wurden 4 Stunden lang mit Mtb-GFP infiziert, bevor freigelöste Mtb-infizierte Makrophagen nach einer 4- oder 24-stündigen Nachinfektion mit Durchflusszytometrie befleckt wurden. Die Probenerfassung wurde mit Durchflusszytometrie durchgeführt und die Daten mit einer Flow-Zytometrie-Analysesoftware analysiert. Manuelles Gating sowie Dimensionalitätsreduktion mit Uniform Manifold Approximation and Projection (UMAP) und Phenograph analyse wurde durchgeführt. Dieses Protokoll führte zu einer effektiven M1/M2-Polarisation, die sich durch erhöhte Konzentrationen von CD64, CD86, TLR2, HLA-DR und CCR7 auf nicht infizierten M1-Zellen auszeichnete, während nicht infizierte M2-Zellen eine starke Upregulation der M2-Phänotypmarker CD163, CD200R, CD206 und CD80 aufwiesen. M1-polarisierte Zellen enthielten in der Regel weniger Bakterien als M2-polarisierte Zellen. Mehrere M1/M2-Marker wurden nach einer Mtb-Infektion herunterreguliert, was darauf hindeutet, dass Mtb die Makrophagenpolarisation modulieren kann. Darüber hinaus wurden 24 verschiedene Zellcluster unterschiedlicher Größe bei 24-Stunden-Nachinfektions-Zellen auf einzigartige Weise auf die nicht infizierten und Mtb-infizierten Zellen M1 und M2 verteilt. Dieses M1/M2-Flow-Zytometrie-Protokoll könnte als Rückgrat in der Mtb-Makrophagenforschung verwendet und für besondere Bedürfnisse in verschiedenen Forschungsbereichen eingesetzt werden.
Einleitung
Makrophagen sind Immunzellen, die wesentlich zur Regulierung von Gewebehomöostase, Entzündungen und Krankheitspathologien beitragen. Als wesentlicher Bestandteil der angeborenen Immunität drückt die Monozyten-Makrophagen-Linie der Zellen heterogene Phänotypen als Reaktion auf veränderte Umwelthinweise aus, die ihre Plastizität und Anpassung an verschiedene anatomische und immunologische Standorte widerspiegeln1. Abhängig von den Wachstumsfaktoren, Zytokinen und anderen Indenzionen, die in der Mikroumgebung vorhanden sind, wurden Makrophagen in zwei hauptumkehrbare Populationen eingeteilt, die jeweils eine andere Rolle bei der bakteriellen Kontrolle und Clearance2haben: die pro-inflammatorischen, klassisch aktivierten M1-polarisierten Makrophagen und die entzündungshemmenden, alternativ aktivierten M2-polarisierten Makrophagen, die ursprünglich als Imitierungs-T-Helfer (Th) bezeichnetwurden. Diese Gruppierung von immunpolarisierten Makrophagen wird oft als vereinfachend angesehen, da Makrophagenaktivierung und -differenzierung nicht linear ist, sondern genauer als Kontinuum dargestellt wird, bei dem jede Population unterschiedliche Eigenschaften und funktionelle Rollen im Ergebnis der Krankheitsentwicklung und progression4,5,6,7hat. Dennoch gibt es mit dem Makrophagenmodell M1/M2 zahlreiche experimentelle Vorteile, die in verschiedenen Forschungsbereichen eingesetzt werden können.
Mycobacterium tuberculosis (Mtb) ist der Erreger von Tuberkulose (TB) und wird geschätzt, um jede Sekunde eine Person zu infizieren und gilt als der tödlichste einzelne Infektionserreger der Welt (Global TB Report 2019). Da die Atemwege der Hauptweg der Mtb-Infektion sind, sind Alveolar-Makrophagen die bevorzugten Wirtszellen, die mit Mtb infiziert werden und sowohl die primären Barrieren als auch das infektiöse Reservoir für Mtb in der Lunge darstellen. Die Makrophagenpolarisation als Reaktion auf verschiedene Reize wurde im Laufe der Jahre7 ausgiebig untersucht und in den meisten veröffentlichten Arbeiten wird die M1-Polarisation von Monozytenkulturen in vitro durch Granulozyt-Macrophage Colony Stimulating Factor (GM-CSF) zusammen mit IFN-γ und LPS8,9induziert, während die M2-Polarisation mit Makrophagen-Kolonie-Stimulierenden Faktor (M-CSF) und IL-410induziertwird. Die M1-Makrophagen sind potente Effektorzellen, die antimikrobielle Reaktionen gegen intrazelluläre Krankheitserreger vermitteln und eine wesentliche Rolle bei der Antitumorimmunität12spielen. M2-Makrophagen hingegen haben eine entzündungshemmende Funktion, eine hohe phagozytische Kapazität und sind hauptsächlich an der Wundheilung und Gewebereparatur sowie an Parasiteninfektionenbeteiligt 12. Dementsprechend werden M1-Makrophagen als effektiver bei der intrazellulären Kontrolle von Mtb im Vergleich zu M2-Makrophagen13angesehen. Jedoch, Mtb Bakterien haben auch das Potenzial, Makrophagen Polarisation zu modulieren angeborene Immunität14,15,16,17zu unterwandern.
Während es üblich ist, Makrophagen aus der Differenzierung von Monozyten aus peripherem Blut18zu erzeugen, könnten Makrophagen auch aus induzierten pluripotenten Stammzellen (iPSCs)19 oder aus Knochenmark-abgeleiteten Makrophagen von Mäusen20,21erzeugt werden. Dies sind praktikable Techniken zur Untersuchung primärer Makrophagenzellen, die aus Monozyten-Makrophagen-Vorläufern gewonnen werden und sich vermehren und sich in eine homogene Population aus reifen Makrophagen-ähnlichen Zellen differenzieren. Diese Protokolle liefern jedoch selten vertieftes Wissen über den Phänotyp und die Funktion der erhaltenen Zellen und berücksichtigen auch nicht die natürliche Heterogenität, die bei den in vivo erhaltenen Makrophagen beobachtet wird. Da Mtb ein strenger menschlicher Erreger ist, gibt es auch einen Vorteil, Mtb in humanisierten Modellsystemen zu studieren. Durchflusszytometrie ist eine leistungsstarke Technologie, die die Möglichkeit bietet, mehrere phänotypische und funktionelle Eigenschaften einzelner Zellen in Suspension22zu bewerten, etwas, das ziemlich herausfordernd mit anhaftenden Zellen wie Makrophagen sein könnte, die auch als autofluoreszierend23,24bekannt sind. Neben der chemischen Ablösung fest anhaftender Makrophagen kann die Mtb-Infektion einen signifikanten Stressfaktor für die Zellen darstellen, der eine weitere Komplexität bei zytometrischen Flussanalysen von Mtb-infizierten Makrophagen hinzufügt.
In diesem experimentellen Protokoll haben wir ein zuvor etabliertes menschliches Makrophageninfektionsmodell verwendet, das auf der Immunpolarisation von primären peripheren Blutmonozyten-abgeleiteten Zellen basiert, die mit dem virulenten Labor-Mtb-Stamm H37Rv infiziert sind, und mit Durchflusszytometrie mit einem 10-Farben-Panel einschließlich expression ausgewählter M1- und M2-Marker25analysiert wurden. Dieses Protokoll bietet eine effiziente und reproduzierbare Methode, um Reaktionen auf Mtb-Infektionen in M1 oder M2 polarisierten Monozyten-abgeleiteten Makrophagen zu untersuchen. Darüber hinaus ermöglicht uns die Verwendung der Durchflusszytometrie an anhaftenden Mtb-infizierten Makrophagen, eine Vielzahl von Oberflächenmarkern zu untersuchen, die mit herkömmlichen M1- und M2-Makrophagen und deren Längsreaktion auf Mtb-Infektionen assoziiert sind. Wichtig ist, dass dieses Protokoll leicht für Untersuchungen von Infektionen mit anderen Krankheitserregern, in Anti-Tumor-Studien oder in Studien zu entzündlichen Erkrankungen, für Arzneimittelscreenings usw. übernommen werden kann und auch für die Beurteilung der M1/M2-Makrophagenpolarisation in menschlichen klinischen Proben genutzt werden könnte.
Protokoll
Menschliches peripheres Blut von gesunden anonymen Blutspendern wurde von der Blutbank des Karolinska Universitätskrankenhauses in Huddinge, Schweden, gewonnen (ethische Zulassung Dnr 2010/603-31/4). Alle experimentellen Schritte mit live virulent Mtb wurden im Labor Biosafety Level-3 (BSL-3) der schwedischen Gesundheitsbehörde (FOHM), Solna, Schweden, durchgeführt.
1. Herstellung von Medien, Puffern und Bakterienkulturen
HINWEIS: Einzelheiten zu allen Reagenzien und Verbrauchsmaterialien finden Sie in der Tabelle der Materialien.
- RPMI Komplettmedium: Ergänzung RPMI 1640 mit 1 mM Natriumpyruvat, 2 mM L-Glutamin, 10 mM HEPES und 10% hitzeinaktiviertem fetalem Rinderserum (FBS). Vermeiden Sie Antibiotika im Zellkulturmedium bei der Arbeit mit Mtb-Infektion.
- Serumfreies RPMI-Medium: Ergänzung RPMI 1640 mit 1 mM Natriumpyruvat, 2 mM L-Glutamin und 10 mM HEPES.
- Waschpuffer: Bereiten Sie Phosphatpuffer-Saline (PBS) mit 0,05% (v/v) Tween-80 vor.
- FACS-Puffer: Bereiten Sie PBS mit 2,5 % (v/v) FBS und 0,5 mM EDTA vor.
- Fixierungspuffer: Bereiten Sie PBS mit 4% Formaldehyd zu PBS vor. Stellen Sie sicher, dass es vor der Verwendung frisch zubereitet wird, z. B. gemischt aus einer Stofflösung von 37% Formaldehyd.
- Permeabilisationspuffer: 0,1% Natriumcitrat und 0,1% Triton X-100 zu entionisiertem Wasser hinzufügen.
- Waschpuffer (für Immunfluoreszenz): Bereiten Sie PBS mit 0,1% BSA und 0,1% Tween-20 vor.
- Sperrpuffer: Bereiten Sie PBS mit 0,1% BSA und 10% normales Ziegenserum (NGS) auf PBS vor.
- Färbepuffer (für Immunfluoreszenz): Bereiten Sie PBS mit 0,1% BSA zu PBS vor.
- TB-Gesamtmedium: Ergänzung Mittlerer Bach 7H9 Brühe mit 0,05% (v/v) Tween-80, 0,5% (v/v) Glycerin, Kanamycin (20 g/ml), 10% (v/v) Middlebrook-Ölsäure, Albumin, Dextrose und Katalaseanreicherung (Middlebrook OADC Enrichment).
- Bakterienkulturen: Verwenden Sie den standardmäßigen virulenten Mtb-Laborstamm H37Rv, der kostitutiv grünes fluoreszierendes Protein (GFP) exemittiert, zur Infektion von Monozyten-abgeleiteten Zellen. Dieser Mtb-Stamm trägt ein pFPV2-Plasmid, das ein Gen enthält, das GFP kodiert, sowie ein Gen für Kanamycin-Resistenz. Die Antibiotikaresistenz ermöglicht eine kontinuierliche Auswahl von Plasmid-exemittierenden Bakterien in Kanamycin-haltigen Kulturen. Speichern Sie Bakterien in TB komplettes Medium und 70% Glycerin (1:1 Verdünnung) bei -80 °C.
2. Periphere mononukleäre Zellisolation von büffelnden Mänteln
HINWEIS: Führen Sie alle Arbeiten mit menschlichem Blut (potenziell ansteckend) in einem Biosicherheitsschrank der Klasse II durch. Restblutprodukte mit Desinfektionsmitteln 15 min vor dem Entsorgen inaktivieren. Blut wurde in diesem Fall von gesunden Freiwilligen gewonnen. Dieses In-vitro-Makrophagendifferenzierungsprotokoll wurde so eingerichtet, dass es 10 x 106 isolierte PBMCs/Spender/Well umfasst. Von jedem Spender enthält ein buffy Mantel etwa 50 ml einer konzentrierten Leukozytensuspension aus Vollblut, die normalerweise 500–800 x 106 PBMCs liefert, aus denen etwa 10% oder 50–80 x 106 Monozyten entnommen werden können.
- 15 ml buffy Mantelblut auf 15 ml Dichtegradientenmedium in 50 ml Rohr aufladen. Überlagern Sie langsam Blut über die Dichtegradientenschicht, indem Sie die Pipettenspitze an die Wand des Rohres lehnen.
- Drehen Sie die Rohre bei 600 x g für 25 min bei Raumtemperatur (RT) mit 0 Beschleunigung und 0 Verzögerung.
HINWEIS: Schließen Sie die Deckel vor der Zentrifugation sorgfältig und überprüfen Sie die Rohrhalter immer auf mögliche Überschüttungen nach der Zentrifugation. - Entfernen Sie die obere Plasmaschicht mit einer sterilen Pasteurpipette und sammeln Sie anschließend die mononukleäre Zellschicht vorsichtig in ein neues 50 ml-Rohr mit einer sterilen Pasteur-Pipette. Fügen Sie dem PBMC-Pellet ein serumfreies RPMI-Medium hinzu, um ein Endvolumen von 50 ml zu erhalten. Mischen Sie sorgfältig, indem Sie das Rohr ein paar Mal vor der Zentrifugation bei 500 x g für 5 min bei RT invertieren.
- Entsorgen Sie den Überstand sorgfältig und setzen Sie das Zellpellet wieder auf, indem Sie den Boden des Rohres in den Fingern umdrehen.
- Um die Dichtegradienten-Medium-Kontamination aus den PBMCs zu entfernen, waschen Sie Zellen 2-3 Mal mit serumfreiem RPMI, um ein Endvolumen von 50 ml zu erhalten. Zentrifuge bei 500 x g für 5 min bei RT. Waschen, bis der Zellüberstand transparent wird.
- Entsorgen Sie den Überstand und setzen Sie die Zellen in 20 ml serumfreiem RPMI-Medium wieder aus.
- Zählen Sie die Zellen durch Trypan-Blaufärbung, manuell mit einem Hämozytometer oder mit einem automatisierten Zellzähler. Verdünnen Sie die Zellsuspension in Trypanblau in 1:2 oder 1:10 Verdünnung, indem Sie die zelltrypanblaue Probe in einer 96-Well-Platte mischen, z. B. 50 l + 50 l (für Hämozytometerzählung) oder 10 l + 10 l (für automatisierte Zellzählung) und die Zellen zählen, um die Anzahl der lebenden Zellen/ml zu erhalten.
VORSICHT: Trypan blue ist giftig und muss in einem separaten chemischen Abfall entsorgt werden.
3. Differenzierung und Polarisation von monozytenabgeleiteten Zellen
HINWEIS: Zur Differenzierung und Polarisation von monozytenabgeleiteten Zellen wurde ein Protokollverfolgt,das wir zuvor für M0-, M1-ähnliche und M2-ähnliche Zellen sowie vollständig M1- und M2-polarisierte Zellen etabliert hatten. Der Einfachheit halber werden hier nur vollständig polarisierte M1- und M2-Makrophagen beschrieben.
- Verwenden Sie die Kunststoffhaftung zur Isolierung von Monozyten. Kurz gesagt, säen Sie frisch isolierte PBMCs in einer 6-Well-Kulturplatte in einer entsprechenden Konzentration, z.B. 10 x 106 PBMCs/well in 2 ml serumfreiem RPMI-Medium und inkubieren bei 37 °C und 5%CO2.
- Nach 2-3 h die nicht haftenden Zellen mit einer Pipette entfernen und die Brunnen 3 mal mit 1 ml serumfreiem Medium waschen. Die angeschlossenen Zellen sind Monozyten und umfassen etwa 10% der gesamten PBMCs, die dem Brunnen zugesetzt werden, d.h. 106 Monozyten, die aus 10 x 106 PBMCs pro Bohrkörper gewonnen werden.
- Für die Makrophagendifferenzierung eine Arbeitslösung mit 50 ng/ml GM-CSF bzw. M-CSF für die Makrophagenpolarisation M1 bzw. M2 vorbereiten, die in 2 ml RPMI-Gesamtmedium pro Bohrgut hinzugefügt wird. Kultur die Zellen in einem 5% CO2-Inkubator in 37 °C für 3 Tage.
- Am 3. Tag 1 ml des Zellkulturmediums vorsichtig aus der obersten Schicht jedes Brunnens entfernen und die Zellkulturen mit 1 ml frischem RPMI-Gesamtmedium ergänzen, das die doppelte Konzentration von M-CSF oder GM-CSF enthält, um eine Endkonzentration von 50 ng/ml in den Brunnen zu erhalten. Fügen Sie die Wachstumsfaktoren in eine vorgefertigte Arbeitslösung von 100 ng/mL/well ein.
- Fügen Sie am 6. Tag verschiedene Reize für die letzten 18–20 h der Zelldifferenzierung hinzu, um vollständig polarisiertes und ausgereiftes M1 (Interferon-γ; IFN-γ und Lipopolysaccharid; LPS (E. coli O55:B5)) oder M2 (Interleukin 4; IL-4) Makrophagen. Für die M1-Polarisation bereiten Sie IFN-γ und LPS in RPMI-Gesamtmedium vor und fügen Sie 50 l pro Bohrkörper hinzu, um eine Endkonzentration von 50 ng/ml IFN-γ und 10 ng/ml LPS in den Zellkulturen zu erhalten. Für die M2-Polarisation il-4 in RPMI-Gesamtmedium vorbereiten und 50 l pro Bohrkörper hinzufügen, um eine Endkonzentration von 20 ng/ml in den Zellkulturen zu erhalten.
- Zur Differenzierung von M0 polarisierten Makrophagen, stimulieren Sie die Zellen mit M-CSF nur, ohne zusätzliche Zytokine (die einen M2-ähnlichen Phänotyp liefern)25.
- Überprüfen Sie die Morphologie von monozytenabgeleiteten Zellkulturen regelmäßig mit Der Lichtmikroskopie, um sicherzustellen, dass kleinere Monozyten in größere Makrophagen-ähnliche Zellen differenziert werden. Überwachen Sie auch mögliche morphologische Unterschiede zwischen der Polarisation M1 und M2, d. h. längliche und gestreckte M1-Zellen im Vergleich zu M2-Zellen mit einer abgerundeteren Form25.
- Übertragen Sie die Platten mit monozytenabgeleiteten Zellen am 7. Tag in ein BSL-3-Labor zur Infektion mit dem virulenten Mtb.
4. Vorbereitung der Mtb-Kulturen
HINWEIS: Die folgenden Schritte müssen in einer BSL-3-Einrichtung ausgeführt werden. Verwenden Sie für alle Arbeiten mit viruliertem Mtb Schutzkleidung, Atemschutz und ethanolresistente Handschuhe.
- Eine Durchstechflasche mit 1 ml bakteriellem Aliquot auftauen und mit 9 ml TB-Gesamtmedium (1:10 Verdünnung) in einem 50 ml gefilterten Kappenrohr mischen. Die Suspension in einem Inkubator bei 37 °C und 5%CO2ankulturieren.
- Nach 24 h die bakterielle Suspension bei 2.300 x g 10 min drehen und vorsichtig aus dem Medium gießen. Das bakterielle Pellet mit 15–20 ml frischem TB-Gesamtmedium in einem neuen 50 ml gefilterten Kappenkulturrohr aussetzen und bei 37 °C und 5%CO2brüten. Mischen Sie die absengelassenen Bakterien in der Röhre alle 2–3 Tage, um eine homogene Nährstoffversorgung für alle Bakterienzellen aufrechtzuerhalten.
- Nach 7-10 Tagen die bakterielle Suspension richtig mischen, indem Sie nach oben und unten pfeifen, bevor Sie sie auf ein 50 ml Schraubverschlussrohr übertragen.
- 35–40 ml steriler Waschpuffer in das 50 ml-Rohr geben und die bakterielle Suspension bei 2.300 x g 10 min drehen. Wiederholen Sie die Waschschritte einmal. Setzen Sie das bakterielle Pellet in 1 ml serumfreiem RPMI-Medium durch Pipettieren mit einer Mikropipette aus.
- Fügen Sie weitere 9 ml serumfreies RPMI-Medium hinzu und beschallen Sie die bakterielle Suspension in einem Biosicherheitsschrank der Klasse II für 5 min bei 37 °C, um die bakteriellen Klumpen zu stören. Tauchen Sie das Rohr wiederholt (3-4 mal) in das Wasserbad Beschallungsgerät, um maximale Störung von bakteriellen Klumpen zu gewährleisten. Messen Sie die optische Dichte (OD) von 1 ml bakterielle Suspension bei 600 nm Wellenlänge mit einem Spektralphotometer, das im Biosicherheitsschrank platziert ist. Verwenden Sie das serumfreie RPMI-Medium, um den Verweis festzulegen.
- Berechnen Sie die Anzahl der koloniebildenden Einheiten (KBE) nach der Formel: (OD+0.155)/0.161 = Y, und Y x 107= Y x 106 KBE/ml, z.B. ergibt ein OD-Wert 0,32 eine bakterielle Konzentration von (0,32 + 0,155)/0,161 = 2,95, 2,95 x 107= 29,5 x 106 KBE/ml.
5. Mtb-Infektion von Monozyten-abgeleiteten Zellen
HINWEIS: Die folgenden Schritte müssen in einer BSL-3-Einrichtung ausgeführt werden.
- Setzen Sie das bakterielle Pellet in einem serumfreien RPMI-Medium in einem neuen sterilen 50 ml-Rohr wieder auf und stellen Sie die endgültige Bakterienkonzentration auf ca. 5 x 106 KBE/ml ein.
- Entfernen Sie das Zellkulturmedium aus den 6 Well-Platten, die monozytenabgeleitete Zellen enthalten. Fügen Sie 1 ml serumfreies RPMI-Medium zu jedem Brunnen hinzu. Fügen Sie 1 ml bakterielle Suspension pro Bohrgut hinzu, um eine Vielzahl von Infektionen (MOI) zu erhalten 5:1, d.h. 5 x 106 KBE pro 106 Makrophagen in 2 ml/Well und inkubieren Sie die Platten für 4 h bei 37 °C und 5%CO2.
- Nach der Infektion, waschen Sie die Zellen 3 mal mit 1 ml sterilen Waschpuffer, um extrazelluläre Bakterien zu entfernen. Neigen Sie die Platte und entfernen Sie vorsichtig den gesamten Waschpuffer aus den Ecken. Setzen Sie die Mtb-infizierten Monozyten-abgeleiteten Zellen in 2 ml RPMI-Gesamtmedium ohne Antibiotika aus und fließen Sie zytometrierisch oder inkubieren Sie die Zellen für weitere 24 h (oder andere Zeitpunkte) vor der Durchflusszytometrie.
6. Durchflusszytometrie-Färbung von Mtb-infizierten Monozyten-abgeleiteten Zellen
HINWEIS: Die folgenden Schritte müssen in einer BSL-3-Einrichtung ausgeführt werden. Die Strömungszytometrie-Färbung könnte in einer 96-Well-Platte anstelle von Rohren durchgeführt werden.
- Lösen Sie die Mtb-infizierten Zellen (und nicht infizierte Kontrollen) von den Brunnen in den 6 Brunnenplatten durch Inkubation mit 1 ml FACS-Puffer pro Brunnen für mindestens 30 min bei 37 °C und 5%CO2.
- Sanft Pipette auf und ab ein paar Mal, um sicherzustellen, dass die Zellen abgetrennt werden. Wenn möglich, bestätigen Sie die Zellablösung mit Mikroskopie. Die Zellsuspension von jedem Brunnen auf ein schraubverklemmtes Mikrozentrifugenrohr übertragen und die Rohre 5 min bei 200 x g drehen. Entsorgen Sie den Überstand sorgfältig durch Pipetten.
- Waschen Sie das Zellpellet in jedem Rohr zweimal mit FACS-Puffer und drehen Sie die Zellen bei 200 x g für 5 min.
- Stain the cells (ca. 0.5 x 106 to 106 cells/tube) with ca. 50 'L cocktail of fluorchrome-conjugated anti-human antibodies including TLR2 (AF647), CD206 (APC-Cy7), CD163 (BV605), CD80 (BV65 0), CCR7 (BV711), CD86 (BV786), CD200R (PE), CD64 (PE-Dazzle 594), HLA-DR (PE-Cy5) (Tabelle 1) in Kombination mit Demherefarbstoff Zombie-UV für 30 min bei 4 °C (Kühlschrank) im Dunkeln.
- Waschen Sie die gebeizten Zellen zweimal mit 400 l FACS-Puffer und drehen Sie die Zellen bei 200 x g für 5 min.
- Fixieren Sie die gebeizten Zellen mit 200 l Fixationspuffer (frisch zubereitet) für 30 min bei RT im Dunkeln, um eine vollständige Inaktivierung von Mykobakterien zu gewährleisten.
- Waschen Sie die Zellen zweimal mit 400 l FACS-Puffer und drehen Sie bei 200 x g für 5 min, um überschüssigen Fixpuffer zu entfernen.
- Setzen Sie die festen Zellen in 400 l FACS-Puffer wieder auf und übertragen Sie die Proben in neue 1 ml Mikrozentrifugenrohre, bevor Sie sie aus dem BSL-3-Labor für Durchflusszytometrie in BSL-2 nehmen. Bewahren Sie die gebeizten Zellen in +4 °C bis zur Probenentnahme auf.
HINWEIS: Sprühen Sie die Rohre mit 70% Ethanol, bevor Sie sie aus dem BSL-3-Labor nehmen. Formaldehyd ist giftig (krebserregend) und muss in einem Biosicherheitsschrank der Klasse II behandelt werden. Entsorgen Sie Formaldehydabfälle in einem separaten chemischen Abfall.
7. Flusszytometrische Datenerfassung und -analyse von Mtb-infizierten Monozyten-abgeleiteten Zellen
HINWEIS: Die Schritte 7.1–7.2 sollten vor der oben beschriebenen Strömungszytometrie-Färbung durchgeführt werden. Um Probleme mit der Zellverklumpung und Dissoziation von Tandemfarbstoffen nach der Zellfixierung zu vermeiden, erfolgt die Probenaufnahme sowohl von Mtb-infizierten als auch von nicht infizierten Zellen innerhalb von 4-10 h nach primärer Antikörperfärbung.
- Kompensieren Sie vor der oben beschriebenen Strömungszytometrie-Färbung das fluoreszierende Signal für jeden fluorchromkonjugierten Antikörper, der in der Färbetafel aufgeführt ist (Tabelle 1), mit Kompensationsperlen (sowohl positive als auch negative).
- Titrate die Antikörperverdünnung für die Färbung von menschlichen Makrophagen, um das optimale Signal für jedes Fluorchrom zu erhalten.
- Verwenden Sie ungefärbte Zellen, um den Grad der Hintergrundfluoreszenz zu bestimmen, der erforderlich ist, um ein Tor für die negative Zellpopulation festzulegen, sodass die gefärbten Zellen visualisiert werden können (Makrophagen sind hochautofluoreszierend).
- Erfassen Sie mindestens 50.000 Zellen/Probe im Durchflusszytometer mit der empfohlenen Software zur Datenerfassung.
- Exportieren Sie die Erfassungsdateien aus dem Durchflusszytometer im FCS-Format (Flow Cytometry Standard) 3.1.
- Analysieren Sie die FCS-Dateien in der Flow-Cytometrie-Analysesoftware.
- Gate-Makrophagen entsprechend ihren Vorwärts- und Seitenstreuungsmerkmalen (FSC und SSC) und schließen abgestorbene Zellen durch lebende/tote Zellgating mit dem Zombie-UV-Lebensfähigkeitsfarbstoff aus.
- Visualisieren Sie H37Rv-GFP-infizierte Makrophagen im FITC-Kanal.
- Identifizieren Sie die Häufigkeit positiv gefärbter Zellen und die geometrische mittlere Fluoreszenzintensität (MFI) für alle Marker (Tabelle 1).
8. Immunfluoreszenzfärbung von Mtb-infizierten Monozyten-abgeleiteten Zellen
HINWEIS: Mtb-Infektion muss in einer BSL-3-Anlage durchgeführt werden.
- Zur Immunfärbung, Samen 2 x 105 PBMCs/well in 500 l serumfreies RPMI-Medium in 8 Well-Kammer-Dias, um 2 x 104 Monozyten/Well zu erhalten. Nach Differenzierung und M1/M2-Polarisation von Monozyten, gehen Sie mit Mtb-Infektion wie oben beschrieben beschrieben. Beheben Sie die Dias nach 24 h Mtb-Infektion mit Fixierungspuffer für 30 min. Feste Dias werden bis zu weiteren Analysen bei -20 °C im Gefrierschrank gelagert.
- Waschen Sie die monozytenabgeleiteten Zellen zweimal mit 200 l PBS für jeweils 10 min.
- Permeabilisieren Sie die Zellen mit 200 L Permeabilisationspuffer für 5 min bei RT.
- Waschen Sie die Zellen 3 mal mit 200 l PBS für jeweils 5 min.
- Waschen Sie die Zellen zweimal mit 200 l Waschpuffer für jeweils 5 min.
- Blockieren Sie unspezifische Bindung mit 200 l Blockierpuffer für 30 min bei RT.
- Verdünnen Sie die primären Antikörper 1:100 im Färbepuffer und inkubieren Sie die M1-Zellen mit einem unkonjugierten CD64-Antikörper (Klon: 10.1) und die M2-Zellen mit einem unkonjugierten CD163-Antikörper (polyklonal) für 2 h bei RT.
- Als nächstes waschen Sie die Zellen 3 mal mit 200 l Waschpuffer für jeweils 10 min.
- Verdünnen Sie die fluoreszierenden markierten Sekundärantikörper 1:1.000 im Färbepuffer und inkubieren Sie die M1-Zellen mit einer Anti-Maus-IgG-Alexa Fluor 594 und die M2-Zellen mit einem Anti-Kaninchen IgG-Alexa Fluor 594 für 1 h bei RT.
- Waschen Sie die Zellen 3 mal mit 200 l Waschpuffer für jeweils 10 min.
- Entfernen Sie das Kammergitter, und fügen Sie in jedem Bohrwert ein DAPI-Montagemedium in der Bohrung von 20 l hinzu und legen Sie einen 1,5 mm-Abdeckungsslip auf jeden Schlitten.
- Versiegeln Sie den Coverslip mit einer Schicht Nagellack.
- Erfassen Sie Bilder mit einem konfokalen Mikroskop mit Lasern, die bei 486 nm zur Anregung von GFP (grüner Kanal), 402 nm für DAPI (blau) bzw. 560 nm für Sekundärantikörper (rot) emittieren.
Ergebnisse
Eine schematische Darstellung der Zytokinstimulationen, die zur Polarisation von monozytenabgeleiteten Zellen zu M0 (M2-ähnliche Zellen), M1 (voll polarisierte M1-Zellen) und M2 (voll polarisierte M2-Zellen) verwendet werden, ist in Abbildung 1Adargestellt, während repräsentative Bilder von M0-, M1- und M2-Zellkulturen sowie M1-Kulturen an Tag 0, 3 und 7 in Abbildung 1Bdargestellt sind. Nicht infizierte M0-Zellen wurden verwendet, um die grundlegende Gating-Strategie zu demonstrieren (Abbildung 2A). Anfangs wurden die myeloischen Zellen (ca. 85 %) wurden nach ihren Vorwärtsstreuungs- (FSC) und Side Scatter (SSC) Eigenschaften, einschließlich der größeren Zellen mit hoher Granularität und ohne die kleinen Ablagerungen mit einem niedrigen SSC und FSC, die in der unteren linken Ecke des Punktdiagramms gefunden werden, abgegrenzt. Im zweiten Diagramm wurden Doublets (d. h. Zellklumpen) als mit einer erhöhten Fläche, aber ähnlicher Höhe im Vergleich zu Einzelzellen definiert und von der weiteren Analyse ausgeschlossen. Daher wurden nur Zellen, die zwischen FSC-Area und FSC-Height (einzelne Zellen) proportional sind, innerhalb des geneigten Formtors einbezogen. Als nächstes wurde der Zombie-UV-Lebensfähigkeitsfarbstoff, der die zytoplasmatischen Proteine in den abgestorbenen Zellen färbt, verwendet, um die abgestorbenen Zellen von der nachfolgenden Analyse auszuschließen. Wie erwartet waren lebensfähige nicht infizierte M0-Zellen negativ für den Mtb-GFP-Ausdruck, der im FITC-Kanal visualisiert wurde.
Als nächstes wendeten wir die gleiche Gating-Strategie auf nicht infizierte sowie Mtb-infizierte M1- und M2-Makrophagen nach 4 Stunden nach der Infektion an(Abbildung 2B,C). Zwei Subpopulationen wurden im FCS/SSC-Tor von nicht infizierten M1 polarisierten Makrophagen nachgewiesen; eine Population mit einer kleineren Größe (FCS) und einer höheren Granularität (SSC) und die andere Population mit einer größeren Größe und geringerer Granularität (Abbildung 2B), während das Haupttor der nicht infizierten M2-Zellen homogener erschien (Abbildung 2C). Sowohl M1- als auch M2-Monozyten-abgeleitete Zellen zeigten eine vertikale Verschiebung zu höherer Granularität und verringerte Zellgröße bei Mtb-Infektion, die eine erhöhte Komplexität innerhalb der Zellen widerspiegeln kann, die durch die Aufnahme intrazellulärer Mtb-Bakterien verursacht wird (Abbildung 2B,C). Darüber hinaus ergab der Lebensfähigkeitsfleck einen verbesserten Zelltod (17-22%) unter den Mtb-infizierten M1- und M2-Zellen bei einem MOI von 5, verglichen mit nicht infizierten M0-Zellen (99%) (Abbildung 2A-C) oder nicht infizierte M1- und M2-Zellen (Daten nicht dargestellt). Repräsentative Daten zeigten, dass die Mtb-GFP-Expression (d. h. die Mtb-Infektion) in M2 (77% GFP-positive Zellen) wesentlich höher war als bei M1-Zellen (19% GFP-positive Zellen) nach 4 Stunden Infektion(Abbildung 2B,C). Nach 24 Stunden Infektion betrug die Mtb-GFP-Expression 43% bzw. 85% in M1- bzw. M2-Zellen, was darauf hindeutet, dass M1-Zellen einen relativ höheren Anstieg der GFP-Expression von 4–24 Stunden nach der Mtb-Infektion im Vergleich zu M2-Zellen hatten, 126% gegenüber 10,4% Anstieg der GFP-Expression in M1- und M2-Zellen von 4–24 Stunden.
Um die Wirksamkeit der M1/M2-Polarisation in nicht infizierten Monozyten-abgeleiteten Zellen zu charakterisieren, wurden Punktdiagramme verwendet, um M1-Zellen zu identifizieren, die für CD64 und CD86 (CD64+CD86+) und M2-Zellen doppelt positiv für CD163 und CD200R (CD163+CD200R+; ; Abbildung 3A,B). Die Auswahl der M1/M2-Marker erfolgte in erster Linie auf der Grundlage der Ergebnisse unserer bisherigen Arbeit25, aber auch aus anderen Studien26,27,28,29. Die Quadranten für die gebeizten Zellen wurden mit entsprechenden Toren für ungefärbte M1/M2-Zellen eingestellt (Abbildung 3A). Keiner dieser Marker wird ausschließlich durch M1- oder M2-Zellen ausgedrückt, aber der Anteil der positiven Zellen sowie die Intensität der Oberflächenexpression sind unterschiedlich. Dies zeigte sich besonders deutlich am M1-Fleck, bei dem etwa 95 % der M1-Zellen und 79 % der M2-Zellen CD64+CD86+waren, aber die Färbeintensität in der M1-Teilmenge wesentlich höher war (Abbildung 3A). Während 27 % der M1-Zellen für die M2-Marker-CD200R positiv waren, waren nur 1 % positiv für CD163, was 0,5 % CD163+CD200R+ M1-Zellen im Vergleich zu 63 % CD163+CD200R+ M2-Zellen(Abbildung 3A) lieferte. Nach 4 Stunden Mtb-Infektion wurde eine Erhöhung der Häufigkeit von CD200R+ Zellen in Mtb-GFP-positiven M1 polarisierten Zellen (16%) beobachtet, während die CD163-Expression in M2-Zellen reduziert wurde (Abbildung 3B). Die Heatmap zeigt eine hohe Intensität der GFP-Expression in CD163+CD200R+ M2-Zellen, aber auch in der CD64+CD86+ M2-Teilmenge im Vergleich zu den entsprechenden M1-Zellen-Teilmengen (Abbildung 3B). Insgesamt wird die Verschiebung der Expression der jeweiligen M1- und M2-Marker auch in den Histogrammen in Abbildung 3Cvisualisiert. Darüber hinaus wurden Mtb-GFP-Bakterien auch in CD64+ M1-Zellen und in CD163+ M2-Zellen durch konfokale Mikroskopie visualisiert, die eine verbesserte intrazelluläre Aufnahme und/oder wachstum von Mtb innerhalb von M2 im Vergleich zu M1-Zellen unterstützten (Abbildung 3D).
Um die Ergebnisse des manuellen Gatings zu verifizieren, haben wir die Maßeinheitsreduktion mit Uniform Manifold Approximation and Projection (UMAP) angewendet. Die UMAP-Analyse zeigte, dass die Mtb-Infektion 4 Stunden lang nicht ausreichte, um die Polarisation von Makrophagen zu beeinflussen, im Gegensatz zu 24 Stunden Infektion, die zu klar getrennten Clustern von M1 und M2 nicht infizierten und infizierten Zellen führte (Abbildung 4A). Nicht infizierte M1-Makrophagen zeigten eine höhere Expression von CD64, CD86, TLR2, HLA-DR und CCR7 im Vergleich zu M2-Makrophagen, während nicht infizierte M2-Zellen eine starke Upregulation der M2-Phänotypmarker CD163, CD200R, CD206 und CD80 aufwiesen (Abbildung 4B,C). In Übereinstimmung mit der manuellen Gating, Mtb-Infektion nach 24 Stunden verursacht eine klare Downregulation von CD163, CD200R und CD206 auf M2-Zellen und Upregulation von CD86 und HLA-DR auf M1-Zellen (Abbildung 4B,C), was darauf hindeutet, dass Mtb Makrophage Polarisation modulieren kann. Die nachfolgende Phenographenanalyse (Abbildung 4D-F) identifizierte 24 verschiedene Cluster unterschiedlicher Größe, die eindeutig auf die nicht infizierten und Mtb-infizierten Zellen M1 und M2 verteilt waren, wie in den UMAP-Diagrammen (Abbildung 4D), Kreisdiagrammen (Abbildung 4E) und Wärmekarten (Abbildung 4F) dargestellt. Insgesamt zeigen diese Ergebnisse eine vielversprechende Effizienz dieses Protokolls zur Erzeugung phänotypischer und funktional vielfältiger M1- und M2-Polarzellen in vitro, die durch die Mtb-Infektion weiter moduliert werden.
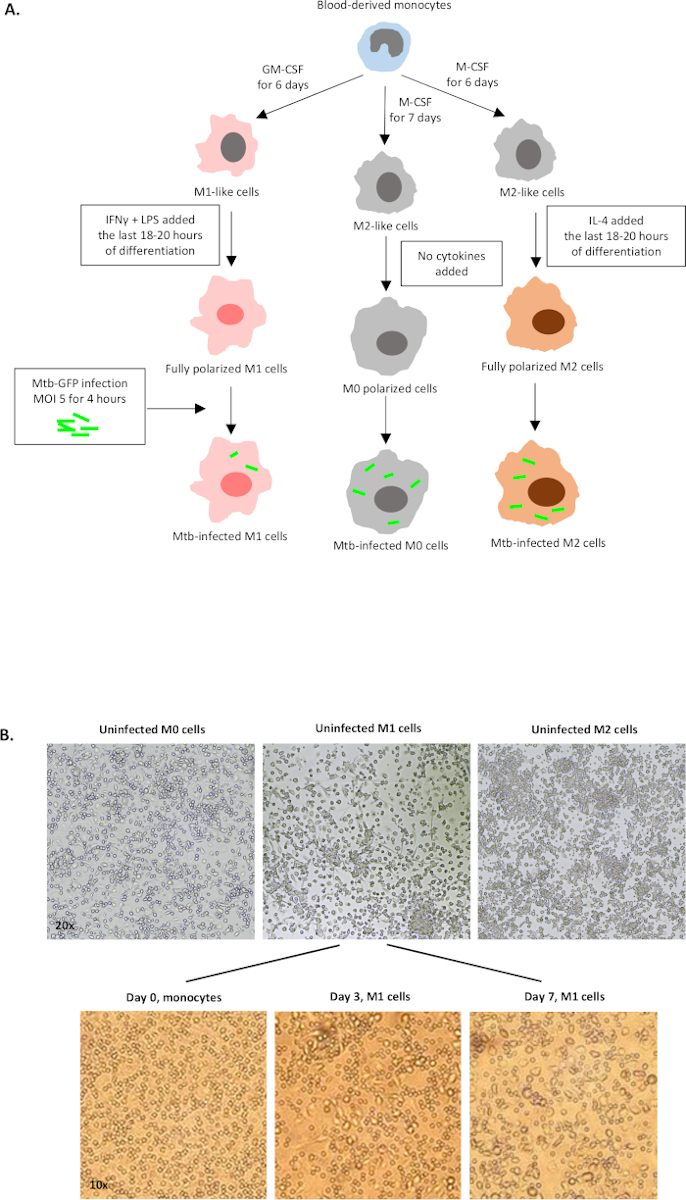
Abbildung 1: Schematische Darstellung der In-vitro-Differenzierung und Polarisation menschlicher myeloiden Zellen. (A) M0 (M2-like), M1 (klassisch aktiviert) und M2 (alternativ aktiviert) Zellen werden dargestellt. Monozyten, die von gesunden Blutspendern gewonnen wurden, wurden mit verschiedenen Zytokinen polarisiert, wie im Protokoll beschrieben, und mit dem GFP-markierten Mtb-Stamm, H37Rv, für 4 Stunden vor der Analyse mit 10-Farben-Flow-Zytometrie infiziert. M1-polarisierte Zellen enthalten in der Regel weniger Bakterien im Vergleich zu M2-polarisierten Zellen. (B) Mikroskopische Bilder von vollständig polarisierten, nicht infizierten M0-, M1- und M2-Zellen in den 6-Well-Platten an Tag 7 und repräsentative Bilder der M1-Zelldifferenzierung von Monozyten an Tag 0, 3 und 7. Die Vergrößerung ist 20x (obere Platte) und 10x (untere Platte). Beachten Sie, dass die M1-Zellen im Vergleich zu den gerundeteren M0- und M2-Zellen (obere M2)-Zellen langgestreckt erstrecken und gestreckt sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
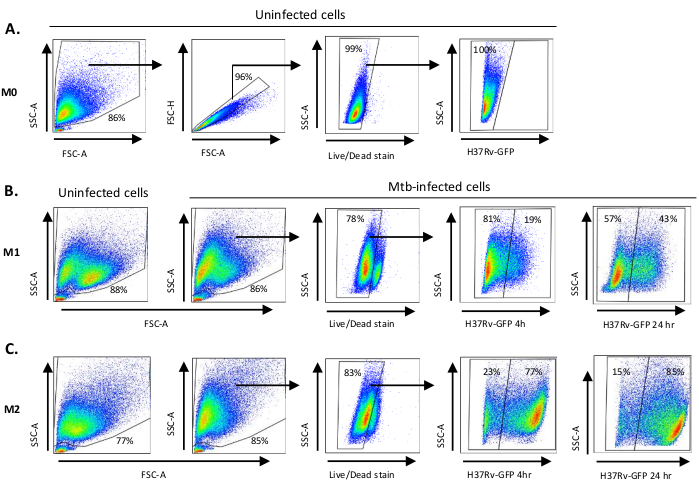
Abbildung 2: Gating-Strategie von differenziell polarisierten myeloiden Zellen. Repräsentative Punktdiagramme, die (A) Vorwärtsstreuung (FSC) und Side Scatter (SSC)-Eigenschaften von nicht infizierten M0-Makrophagen anzeigen. Das FSC-A/FSC-H-Diagramm zeigt das manuelle Gating einzelner Zellen proportional zu Fläche und Höhe. Das lebende Zelltor schloss Zellen aus, die positiv für Zombie-UV (Viability Dye) waren. Intrazelluläre Mtb wurde durch GFP-Expression in lebenden Zellen im FITC-Kanal beobachtet. (B) Gating von M1 und (C) M2 Makrophagen, die FCS/SSC-Punktdiagramme sowohl in nicht infizierten Zellen als auch in Mtb-infizierten Zellen 4 h und 24 h nach der Infektion zeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Wirksamkeit des in vitro M1/M2 Polarisationsprotokolls. Repräsentative Punktdiagramme und Quadranten-Gating zeigen Teilmengenvon M1- und M2-polarisierte Zellen mit CD64 und CD86 (M1) oder CD163 und CD200R (M2) in (A) ungefärbten und gefärbten nicht infizierten Zellen und (B) Mtb-infizierten gefärbten Zellen 4 h nach der Infektion. Die Punktdiagramme in (B) veranschaulichen die Fluoreszenzintensität der GFP-Expression (Wärmekarte) in M1- und M2-polarisierten Makrophagen, die aus verschiedenen Untertoren gewonnen werden. (C) Der geometrische Mittelwert der Fluoreszenzintensität (MFI) wird in Histogrammen eines repräsentativen Spenders nach 4 h Mtb-Infektion dargestellt. Die MFI-Werte in nicht infizierten M1- und M2-Zellen (hellviolett) werden im oberen Panel und Mtb-infizierte M1- und M2-Zellen (tiefviolett) im unteren Panel dargestellt. (D) Repräsentative konfokale Bilder von nicht infizierten und Mtb-infizierten M1- und M2-polarisierten Zellen werden gezeigt. M1- und M2-Zellen wurden für die CD64- bzw. CD163-Expression mit Immunfluoreszenz gefärbt. Positive Oberflächenfärbung ist in rot und GFP-exzelluläre Bakterien in Grün dargestellt. DAPI-gebeizte Kerne werden in blauer Farbe dargestellt. Skala – 10 m. Die Vergrößerung der Bilder auf der rechten Seite ist 350x. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
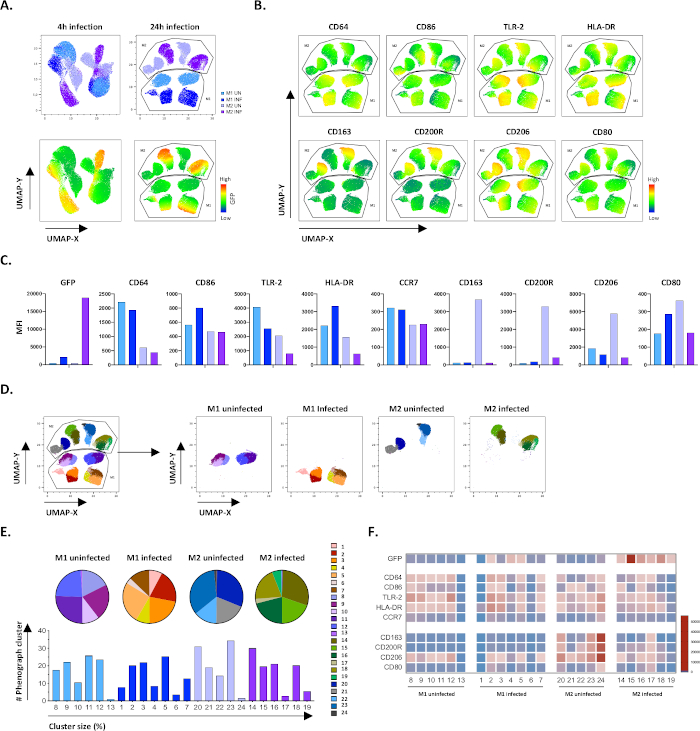
Abbildung 4: Dimensionsreduktion mit Uniform Manifold Approximation and Projection (UMAP) und Phenographenanalyse von nicht infizierten und Mtb-infizierten M1- und M2-Zellen. (A) UMAP, erstellt durch Verketteung von 11000 lebenden Zellen aus nicht infizierten und Mtb-infizierten M1- und M2-Zellkulturen von zwei repräsentativen Blutspendern, 4 h (linke Graphik) oder 24 h (rechte Graphik) nach der Infektion. Die Heatmap für gfP-Expression (unteres Panel) zeigt nicht infizierte und Mtb-infizierte Zellen an. (B-C) MFI von Markern, ausgedrückt in nicht infizierten und Mtb-infizierten M1- und M2-Zellen 24 h nach der Infektion, dargestellt als (B) Heatmap oder (C) Balkendiagramme. (D-F) Die Phenographenanalyse identifizierte 24 Cluster, die differenziell auf die nicht infizierten und Mtb-infizierten M1- und M2-Kulturen verteilt sind. Cluster 8–13 sind einzigartig in nicht infizierten M1-Zellen, Cluster 1–7 sind einzigartig in Mtb-infizierten M1-Zellen, Cluster 20–24 sind in nicht infizierten M2-Zellen einzigartig und Cluster 14–19 sind einzigartig in Mtb-infizierten M2-Zellen. Das MFI jedes Markers in jedem Phenographencluster ist in (F) dargestellt. Die Daten werden als nicht infizierte M1- (hellblau) und M2-Zellen (hellviolett) und Mtb-infizierte M1-Zellen (tiefblau) und M2 (tiefviolett) dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Liste der Antikörper, die für die Durchflusszytometrie verwendet werden.
| Laser | Filter | Fluorochrom | Phänotyp | Funktion | Klon | Katalog-Nr. | Unternehmen |
| 639 | 670/30 | AF647 | TLR2 | Pathogenerkennungsrezeptor | TL2.1 | 309714 | BioLegend |
| 639 | 780/60 | APC-Cy7 | CD206 | Mannose-Rezeptor | 15-2 | 321120 | BioLegend |
| 405 | 610/20 | BV605 | CD163 | Scavenger-Rezeptor | GHI/61 | 333616 | BioLegend |
| 405 | 670/30 | BV650 | CD80 | Kostimulierendes Molekül | 2D10 | 305227 | BioLegend |
| 405 | 710/50 | BV711 | CCR7 | Chemokin-Rezeptor | G043H7 | 353228 | BioLegend |
| 405 | 780/60 | BV785 | CD86 | Kostimulierendes Molekül | IT2.2 | 305442 | BioLegend |
| 488 | 530/30 | GFP | Mtb | Intrazelluläre Bakterien | |||
| 561 | 586/15 | Pe | CD200R | Hemmhemmer Rezeptor | OX-108 | 329306 | BioLegend |
| 561 | 620/14 | PE/DAZZLE 594 | CD64 | Fc Gamma-Rezeptor-I von IgG | 10.1 | 305032 | BioLegend |
| 561 | 661/20 | PE-Cy5 (PC5) | HLA-DR | MHC-Klasse-II-Molekül | L243 | 307608 | BioLegend |
| 355 | 450/50 | BUV395 | Viability Dye | Live/Dead-Zell-Marker | Zombie UV | 423108 | Invitrogen |
Diskussion
Dieses experimentelle Protokoll beschreibt die effektive Polarisation von myeloiden Zellen in M1- oder M2-Phänotypen, einschließlich der Bewertung mit einem 10-farbenigen Durchflusszytometrie-Panel, das die Visualisierung und Tiefencharakterisierung von GFP-beschrifteten Mtb in verschiedenen Makropages-Teilmengen ermöglicht. Obwohl TB eine alte menschliche Krankheit ist, gibt es derzeit kein goldenes Standardmodell, um Mtb-Makrophagen-Wechselwirkungen zu untersuchen, und die mehrfarbige Durchflusszytometrie von Makrophagen könnte im Vergleich zu Analysen von Lymphozytenreaktionen kompliziert sein. Wenige verfügbare Protokolle für die In-vitro-Differenzierung menschlicher Monozyten zu Makrophagen bieten tiefe Kenntnisse über die Art der erzeugten Makrophagen. Ein grundlegendes Protokoll zur Makrophagenpolarisation und zur zytometrischen Durchflussbewertung der Makrophagenaktivierung mit einem soliden Panel von Markern kann eine solche Charakterisierung wahrscheinlich erleichtern und Möglichkeiten bieten, zusätzliche Merkmale polarisierter Zellen zu untersuchen, die unter verschiedenen Bedingungen behandelt werden. Dazu gehören Analysen von in vitro kultivierten Zellen sowie Analysen von Zellen in vivo in klinischen Proben, d.h. sowohl PBMC- als auch einzellige Suspensionen aus Körperflüssigkeiten (d. h. bronchoalveolare Rinhalt) oder homogenisiertem Gewebe. Dementsprechend könnte die Differenzierung und/oder aktivierungsstatus von Monozyten und Makrophagen, die von Patienten erhalten wurden, mit dem Krankheitsergebnis zusammenhängen. Die Ausweitung von CD16+CD163+ Monozyten im peripheren Blut wurde bei Lungen-TB-Patienten30berichtet. Eine erhöhte Häufigkeit von CD163+ Zellen wurde auch in der entzündeten Haut von atopischen Dermatitis-Patienten31nachgewiesen. In ähnlicher Weise hemmen CD206+ M2-ähnliche Makrophagen die Proliferation und Differenzierung von Zellen in der Mikroumgebung von Adipozytengewebe32 und werden in Knochenmarkproben von Patienten mit akuter myeloischer Leukämie (AML)angereichert 29. Es wurde ein erhöhtes Verhältnis von CD64 (M1) zu CD163 (M2)-Zellen im Vollblut von Patienten mit Arthrose festgestellt, die mit der Schwere der Erkrankung in Verbindung gebrachtwerden. Eine andere Studie verwendete CD86 (M1) und CD163 (M2), um zu zeigen, dass eine hohe M1-Expression im Gewebe mit einem schlechteren Ergebnis in einer Untergruppe bösartiger Hirntumorenkorrelierte 34.
Dieses experimentelle M1/M2-Flow-Zytometrieprotokoll hat mehrere wesentliche Vorteile. Dieses Modell bietet die Möglichkeit, angeborene Immunantworten auf virulente Mtb-Infektionen zu untersuchen und kann entwickelt werden, um Studien über adaptive Immunantworten zu enthalten, indem autologe T-Zellen zusammen mit M1- oder M2-Makrophagen bei gemischten Lymphozytenreaktionen (MLRs) hinzugefügt werden. Das Protokoll eignet sich auch für das Screening und die Prüfung verschiedener immunmodulatorischer und antimikrobieller Verbindungen. Hier haben wir zuvor die Auswirkungen von Vitamin D und dem Histon-Deacetylase-Inhibitor Phenylbutyrat auf myeloiden-abgeleiteten Zellen nach Mtb-Infektion25,35untersucht. M1/M2 Durchflusszytometrie könnte auch verwendet werden, um Makrophagenaktivierung nach Derkonditionierung mit Zellkulturüberstand oder Patientenplasma zu bewerten. Während In-vivo-Studien zur TB-Koinfektion mit HIV oder Helminthen oder TB-Diabetes-Komorbidität eine Herausforderung darstellen könnten, kann das weniger komplexe M1/M2-Modell Studien über Komorbiditäten in vitro erleichtern. Ebenso könnte das Protokoll für Übertragungsstudien genutzt werden, um die Mtb-Infektionsfähigkeit von Zellen zu untersuchen oder phagozytische sowie Antigen-Präsentationskapazität einzelner M1/M2-Zellen zu untersuchen. Die M1/M2-Durchflusszytometrie ist auch für den Einsatz in Biomarker- und Impfstoffstudien attraktiv, um die Krankheitsprognose während der Behandlung zu verfolgen und Therapien zu testen, die auf myelooide Zellen abzielen. Wichtig ist, dass eine Reihe verschiedener Methoden parallel zur Durchflusszytometrie zur gleichzeitigen Bewertung von Makrophagenpolarisationsphänotypen und funktionellen Reaktionen mittels konfokaler Mikroskopie (Abbildung 3D), Echtzeit-PCR, Western Blot, Multiplex-Assays und ELISA von löslichen Faktoren im Kulturüberstand sowie Bewertung der intrazellulären bakteriellen Infektiosität und des Wachstums mittels GFP-Expression (Flow-Zytometrie und konfokale Mikroskopie) und koloniebildenden Einheiten (KBE). Die Infektion von M1- oder M2-Zellen mit Mtb-GFP-Bakterien ermöglicht auch die Sortierung der nicht infizierten und Mtb-infizierten Zellen aus derselben Probe für die Einzelzell-RNA-Sequenzierungsanalyse.
Das beschriebene Protokoll hat auch einige Einschränkungen, einschließlich technischer und wissenschaftlicher Nachteile. Der Nachteil bei Monozyten-abgeleiteten Makrophagen von menschlichen Blutspendern ist, dass die Variabilität der Spender oft hoch ist und die Tatsache, dass die Zellen in der physiologischen Umgebung menschlicher Gewebe nicht polarisiert sind. Eine große Variabilität der M1/M2-Polarisationswirksamkeit oder Mtb-Infektion zwischen Spendern kann zu Problemen sowohl mit intra- als auch mit interexperimentellen Schwankungen, geringer statistischer Leistung und der Notwendigkeit führen, viele Spender einzubeziehen, um zuverlässige Ergebnisse zu erzielen. Darüber hinaus führt die plastische Haftung von Monozyten von PBMCs zu einer spenderabhängigen Anzahl von Monozyten/Well, die schließlich eine willkürliche MOI liefern können, die die Makrophagenpolarisation und Zelllebensfähigkeit nach der Mtb-Infektion beeinträchtigen könnte. Kritische Schritte im Protokoll beinhalten eine ordnungsgemäße Wäsche, um zu verhindern, dass andere Zelltypen die Zellkulturen kontaminieren, die sich auch auf die Makrophagenpolarisation auswirken könnten. Während ein zu niedriger MOI latente TB-Infektion imitieren kann, wird ein zu hoher MOI die Zellen abtöten, was die Bedeutung der Verwendung eines geeigneten MOI unterstreicht. Darüber hinaus könnte es schwierig sein, fest anhaftende Zellen nach Ablösung abzurufen, was zu einer voreingenommenen Darstellung bestimmter Makrophagen-Teilmengen führen kann, die für Strömungszytometrie-Analysen verwendet werden. Ein entscheidender Schritt in der Strömungszytometrie-Analyse beinhaltet die richtige Verwendung von Perlenkompensationsmatrix und Negativkontrollen wie ungefärbte Zellen oder FMO (Fluoreszenz Minus One) Kontrollen, um eine korrekte manuelle Gating zu gewährleisten.
Eine weitere Einschränkung beinhaltet die Polarisation von Monozyten, die aus Blut und nicht aus der lokalen Gewebeumgebung gewonnen werden. Das Kennzeichen der menschlichen TB ist die Bildung von Granulomen in Mtb-infizierten Geweben und daher sollte die Immunpathologie bei TB bevorzugt an der lokalen Gewebestelle untersucht werden. Monozyten werden jedoch nach einer Entzündung/Infektion aus peripherem Blut in die Lunge rekrutiert, wo sich Zellen in Makrophagen in Gegenwart von entzündlichen Zytokinen wie GM-CSF12differenzieren können. Wichtig ist, dass es im physiologischen Milieu von Gewebe in vivo wahrscheinlich eine große Heterogenität der Makrophagenpolarisation gibt, einschließlich einer Mischung und verschiedenen Verhältnissen verschiedener M1- und M2-ähnlicher Makrophagenpopulationen, die zum Schicksal der TB-Infektion beitragen36. Wir haben bereits ein humanes organotypisches Lungengewebemodell entwickelt, das 3D-Studien der makrophagenvermittelten Granulombildung bei TB37ermöglicht. Es könnte interessant sein, das aktuelle M1/M2-Polarisationsprotokoll in Kombination mit dem Lungengewebemodell zu nutzen, um die TB-Granulombildung, effektalierende Funktionen und das M1/M2-Verhältnis im experimentellen Gewebe weiter zu untersuchen.
Dieses M1/M2-Flowzytometrie-Protokoll könnte leicht angepasst werden, um ein erweitertes Panel von myeloischen Markern enthalten, die für die Beurteilung von Merkmalen im Zusammenhang mit hemmenden sowie entzündlichen Reaktionen nützlich sind. Es gibt ein großes Forschungsinteresse an hemmenden Immun-Checkpoint-Molekülen wie PD-1, SIRP-α, IDO und Arginasen, die Makrophagen-Antworten modulieren könnten38. In diesem Zusammenhang könnte die Polarisation von myeloischen Zellen auch andere Reize beinhalten, die immunregulierende Makrophagen (Mreg) oder myeloiden-abgeleiteten Suppressorzellen (MDSC) fördern, die nachweislich an mehreren Krankheiten, einschließlich TB38, beteiligt sind. Erweiterte Durchflusszytometrie-Panels von M1/M2/Mreg-Makrophagen-Untergruppen können auch intrazelluläre Färbungen von Zytokinen/Chemokinen IL-1, TNF-α, IL-10 und MCP-1 oder anderen löslichen Faktoren oder Effektormolekülen wie induzieniblem Stickstoffmonoxid (iNOS) und antimikrobiellen Peptiden umfassen. Dies könnte die Möglichkeiten zur Untersuchung polyfunktioneller Makrophagenreaktionen verbessern, ähnlich dem, was für T-Zellen39ausführlich beschrieben wurde.
Derzeit können Strömungszytometrie-Färbeplatten bis zu 30-40 Farben enthalten, was die Möglichkeit bietet, mehrere Zell-Untergruppen und Moleküle gleichzeitig immunphenotypisieren zu können. Die grundlegende versuchsweise Einrichtung dieses M1/M2-Flow-Zytometrieprotokolls kann als Backbone verwendet werden, das sowohl mit den meisten alten als auch mit neuen Durchflusszytometern kompatibel ist und auf individuellen Bedürfnissen aufbauen und zugeschnitten werden kann, einschließlich der Herausforderungen, die sich aus der Arbeit mit dem virulenten Mtb in einer BSL-3-Umgebung ergeben. Heutzutage sind Dimensionalitätsreduktionstechniken wie UMAP in den neuen Versionen der Durchflusszytometrie-Software verfügbar, die die Analyse einer großen Anzahl von Parametern ermöglicht, die in einzelzelligen Studien generiert werden und für eine verbesserte Visualisierung und Interpretation hochdimensionaler Daten unerlässlich sind40. Die ständigen technologischen Verbesserungen in der Durchflusszytometrie werden sich wahrscheinlich in den kommenden Jahren fortsetzen, einschließlich der Kombination von multiparametrischer Phänotypisierung zusammen mit modernen Zellsortierungsfunktionen, bei denen sich dieses Protokoll bei mehreren Makrophagen-basierten Mtb-Infektionstests als nützlich erweisen könnte.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken unseren Kollegen von der schwedischen Gesundheitsbehörde Matilda Svensson und Solomon Ghebremichael für die Unterstützung im BSL-3-Labor.
Diese Arbeit wurde durch Stipendien der Schwedischen Herz- und Lungenstiftung (HLF) (2019-0299 und 2019-0302 an SB), des Schwedischen Forschungsrates (VR) (2014-02592, 2019-01744 und 2019-04720 an SB), die Stiftung zur Verhinderung von Antibiotikaresistenz (Widerstand), Karolinska Institutet Foundations und KID to SB (Teilfinanzierung der Promotion für Marco Loreti) vom Karolinska Institutet. ML wurde von der Schwedischen Kinderkrebsstiftung (TJ2018-0128 und PR2019-0100) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 8-well chamber slides | Lab-Tek | 154534 | |
| BD Comp bead plus | BD | 560497 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | |
| DAPI Mounting media | Vector Laboratories | H-1200-10 | |
| EDTA (0.5 M) | Karolinska University hospital, Huddinge | N/A | |
| Falcon 6-well Flat Bottom plates | Corning Life Sciences | 353046 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| Formaldehyde | Sigma-Aldrich | F8775 | |
| Glycerol (70%) | Karolinska University hospital, Huddinge | N/A | |
| GM-CSF | Peprotech | 300-03 | |
| Goat anti-mouse IgG Alexa Fluor 594 secondary antibody | Invitrogen | R37121 | Secondary antibody for CD64 |
| Goat anti-Rabbit IgG Alexa Fluor 594 secondary antibody | Invitrogen | A-11037 | Secondary antibody for CD163 |
| HEPES | GE Healthcare Life Sciences | SH30237.01 | |
| IFN-γ | Peprotech | 300-02 | |
| IL-4 | Peprotech | 200-04 | |
| L-Glutamine | GE Healthcare Life Sciences | SH30034.01 | |
| LPS (Escherichia coli O55:B5) | Sigma-Aldrich | L6529 | |
| Lymphoprep | Alere Technologies AS | 11508545 | |
| M-CSF | Peprotech | 300-25 | |
| Middle Brook 7H10 agar plates | Karolinska University hospital, Huddinge | N/A | |
| Middle Brook 7H9 media | Karolinska University hospital, Huddinge | N/A | |
| Mouse anti-human CD64 primary antibody | Bio-Rad | MCA756G | Clone: 10.1 |
| Na-pyruvate | GE Healthcare Life Sciences | SH300239.01 | |
| Normal goat serum | Jackson ImmunoResearch | 005-000-121 | |
| Rabbit anti-human CD163 primary antibody | GeneTex | GTX81526 | Polyclonal |
| RPMI 1640 | Life Technologies Corporation | SH30096.01 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| TubeSpin bioreactor tubes | TPP Techno Plastic Products AG | 87050 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Tween-80 | Sigma-Aldrich | P4780 |
Referenzen
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Cassetta, L., Cassol, E., Poli, G. Macrophage polarization in health and disease. Scientific World Journal. 11, 2391-2402 (2011).
- Mills, C. D., Kincaid, K., Alt, J. M., Heilman, M. J., Hill, A. M. M-1/M-2 macrophages and the Th1/Th2 paradigm. Journal of Immunology. 164 (12), 6166-6173 (2000).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000 Prime Reports. 6, 13(2014).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. International Journal of Molecular Sciences. 19 (6), (2018).
- Flynn, J. L., Gideon, H. P., Mattila, J. T., Lin, P. L. Immunology studies in non-human primate models of tuberculosis. Immunological Reviews. 264 (1), 60-73 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Fleetwood, A. J., Lawrence, T., Hamilton, J. A., Cook, A. D. Granulocyte-macrophage colony-stimulating factor (CSF) and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: implications for CSF blockade in inflammation. Journal of Immunology. 178 (8), 5245-5252 (2007).
- Nathan, C. F., Murray, H. W., Wiebe, M. E., Rubin, B. Y. Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. Journal of Experimental Medicine. 158 (3), 670-689 (1983).
- Leidi, M., et al. M2 macrophages phagocytose rituximab-opsonized leukemic targets more efficiently than m1 cells in vitro. Journal of Immunology. 182 (7), 4415-4422 (2009).
- Stein, M., Keshav, S., Harris, N., Gordon, S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. Journal of Experimental Medicine. 176 (1), 287-292 (1992).
- Italiani, P., Boraschi, D. From Monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Frontiers in Immunology. 5, 514(2014).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences. 101 (13), 4560-4565 (2004).
- Redente, E. F., et al. Differential polarization of alveolar macrophages and bone marrow-derived monocytes following chemically and pathogen-induced chronic lung inflammation. Journal of Leukocyte Biology. 88 (1), 159-168 (2010).
- Refai, A., Gritli, S., Barbouche, M. R., Essafi, M. Mycobacterium tuberculosis virulent factor ESAT-6 drives macrophage differentiation toward the pro-inflammatory M1 phenotype and subsequently switches it to the anti-inflammatory M2 phenotype. Frontiers in Cellular and Infection Microbiology. 8, 327(2018).
- Kahnert, A., et al. Alternative activation deprives macrophages of a coordinated defense program to Mycobacterium tuberculosis. European Journal of Immunology. 36 (3), 631-647 (2006).
- Marino, S., et al. Macrophage polarization drives granuloma outcome during Mycobacterium tuberculosis infection. Infection and Immunity. 83 (1), 324-338 (2015).
- Erbel, C., et al. An in vitro model to study heterogeneity of human macrophage differentiation and polarization. Journal of Visualized Experiments. (76), e50332(2013).
- Lee, C. Z. W., Kozaki, T., Ginhoux, F. Publisher Correction: Studying tissue macrophages in vitro: are iPSC-derived cells the answer. Nature Reviews Immunology. 18 (11), 726(2018).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323(2013).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424(2015).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Njoroge, J. M., et al. Characterization of viable autofluorescent macrophages among cultured peripheral blood mononuclear cells. Cytometry. 44 (1), 38-44 (2001).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. Journal of Immunological Methods. 386 (1-2), 101-107 (2012).
- Rao Muvva, J., Parasa, V. R., Lerm, M., Svensson, M., Brighenti, S. Polarization of human monocyte-derived cells with vitamin D promotes control of Mycobacterium tuberculosis infection. Frontiers in Immunology. 10, 3157(2019).
- Tarique, A. A., et al. functional, and plasticity features of classical and alternatively activated human macrophages. American Journal of Respiratory Cell and Molecular Biology. 53 (5), 676-688 (2015).
- Hristodorov, D., et al. Targeting CD64 mediates elimination of M1 but not M2 macrophages in vitro and in cutaneous inflammation in mice and patient biopsies. MAbs. 7 (5), 853-862 (2015).
- Jaguin, M., Houlbert, N., Fardel, O., Lecureur, V. Polarization profiles of human M-CSF-generated macrophages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin. Cellular Immunology. 281 (1), 51-61 (2013).
- Xu, Z. J., et al. The M2 macrophage marker CD206: a novel prognostic indicator for acute myeloid leukemia. Oncoimmunology. 9 (1), 1683347(2020).
- Liu, Q., et al. Differential expression and predictive value of monocyte scavenger receptor CD163 in populations with different tuberculosis infection statuses. BMC Infectious Diseases. 19 (1), 1006(2019).
- Sugaya, M., et al. Association of the numbers of CD163(+) cells in lesional skin and serum levels of soluble CD163 with disease progression of cutaneous T cell lymphoma. Journal of Dermatological Science. 68 (1), 45-51 (2012).
- Nawaz, A., et al. CD206(+) M2-like macrophages regulate systemic glucose metabolism by inhibiting proliferation of adipocyte progenitors. Nature Communications. 8 (1), 286(2017).
- Liu, B., Zhang, M., Zhao, J., Zheng, M., Yang, H. Imbalance of M1/M2 macrophages is linked to severity level of knee osteoarthritis. Experimental and Therapeutic Medicine. 16 (6), 5009-5014 (2018).
- Lee, C., et al. M1 macrophage recruitment correlates with worse outcome in SHH Medulloblastomas. BMC Cancer. 18 (1), 535(2018).
- Rekha, R. S., et al. Phenylbutyrate induces LL-37-dependent autophagy and intracellular killing of Mycobacterium tuberculosis in human macrophages. Autophagy. 11 (9), 1688-1699 (2015).
- Mattila, J. T., et al. Microenvironments in tuberculous granulomas are delineated by distinct populations of macrophage subsets and expression of nitric oxide synthase and arginase isoforms. Journal of Immunology. 191 (2), 773-784 (2013).
- Braian, C., Svensson, M., Brighenti, S., Lerm, M., Parasa, V. R. A 3D Human Lung Tissue Model for Functional Studies on Mycobacterium tuberculosis Infection. Journal of Visualized Experiments. (104), e53084(2015).
- Brighenti, S., Joosten, S. A. Friends and foes of tuberculosis: modulation of protective immunity. Journal of Internal Medicine. , 12778(2018).
- Chattopadhyay, P. K., Roederer, M. Good cell, bad cell: flow cytometry reveals T-cell subsets important in HIV disease. Cytometry Part A. 77 (7), 614-622 (2010).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38-44 (2019).
Erratum
Formal Correction: Erratum: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection
Posted by JoVE Editors on 10/14/2020. Citeable Link.
An erratum was issued for: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection. Author and affiliation information was updated.
The author and affiliation information was updated from:
Akhirunnesa Mily1, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha2, Jagadeeswara Rao Muvva1, Magda Lourda1,3, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
3Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
to:
Akhirunnesa Mily1,2, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha3, Jagadeeswara Rao Muvva1, Magda Lourda1,4, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Infectious Diseases Division, International Centre for Diarrhoeal Disease Research, Bangladesh
3Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
4Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten