Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Probenahme und Verarbeitung von Nasenbürsten mittels digitaler Hochgeschwindigkeits-Ziliar-Videomikroskopie – Anpassung an die COVID-19-Pandemie
In diesem Artikel
Zusammenfassung
Um eine erfolgreiche und qualitativ hochwertige ziliäre Funktionsanalyse für die PCD-Diagnostik zu gewährleisten, ist eine präzise und sorgfältige Methode zur Probenahme und Verarbeitung des respiratorischen Epithels unerlässlich. Um während der COVID-19-Pandemie weiterhin PCD-diagnostische Dienstleistungen anbieten zu können, wurde das ziliäre Videomikroskopieprotokoll aktualisiert, um geeignete Maßnahmen zur Infektionskontrolle aufzunehmen.
Zusammenfassung
Die primäre ziliäre Dyskinesie (PCD) ist eine genetisch bedingte Motilziliopathie, die zu einer signifikanten otosinopulmonalen Erkrankung führt. Die PCD-Diagnose wird aufgrund von Herausforderungen mit unterschiedlichen diagnostischen Modalitäten oft übersehen oder verzögert. Die Ziliar-Videomikroskopie mit digitaler Hochgeschwindigkeits-Videomikroskopie (DHSV), einem der diagnostischen Instrumente für PCD, gilt als die optimale Methode zur Durchführung einer ziliären Funktionsanalyse (CFA), die aus der Analyse der Ziliarschlagfrequenz (CBF) und des Schlagmusters (CBP) besteht. Dem DHSV fehlt jedoch ein standardisiertes, veröffentlichtes Arbeitsverfahren für die Verarbeitung und Analyse von Proben. Es verwendet auch lebendes respiratorisches Epithel, ein wichtiges Problem der Infektionskontrolle während der COVID-19-Pandemie. Um während dieser Gesundheitskrise weiterhin diagnostische Dienstleistungen anbieten zu können, wurde das ziliäre Videomikroskopieprotokoll angepasst, um angemessene Maßnahmen zur Infektionskontrolle zu enthalten.
Hier beschreiben wir ein überarbeitetes Protokoll für die Probenahme und Laborverarbeitung von Flimmeratmungsproben und heben die Anpassungen hervor, die zur Einhaltung der COVID-19-Infektionskontrollmaßnahmen vorgenommen wurden. Repräsentative Ergebnisse von CFA aus Nasenputzproben von 16 gesunden Probanden, die nach diesem Protokoll verarbeitet und analysiert wurden, werden beschrieben. Wir veranschaulichen auch, wie wichtig es ist, epitheliale Flimmerstreifen in optimaler Qualität zu erhalten und zu verarbeiten, da Proben, die nicht den Qualitätsauswahlkriterien entsprechen, nun eine CFA zulassen, was möglicherweise die diagnostische Zuverlässigkeit und die Effizienz dieser Technik verringert.
Einleitung
Die primäre Ziliärdyskinesie (PCD) ist eine vererbte heterogene motile Ziliopathie, bei der die respiratorischen Zilien stationär, langsam oder dyskinetisch sind, was zu einer gestörten mukoziliären Clearance und einer chronischen oto-sino-pulmonalen Erkrankung führt 1,2,3,4. Die klinischen Manifestationen der PCD sind chronischer feuchter Husten und chronische verstopfte Nase ab dem frühen Säuglingsalter, rezidivierende oder chronische Infektionen der oberen und unteren Atemwege, die zu Bronchiektasen führen, sowie rezidivierende oder chronische Mittelohrentzündung und Sinusitis 5,6,7. Etwa die Hälfte der PCD-Patienten weist Organlateralitätsdefekte wie Situs inversus oder Situs ambiguus auf. Einige Patientinnen weisen auch Unfruchtbarkeitsprobleme auf, die auf unbewegliche Spermien bei Männern und unbewegliche Flimmerhärchen in den Eileitern bei Frauen zurückzuführensind 1,2,8. PCD ist selten, aber die Prävalenz ist schwer zu definieren und reicht von 1:10.000 bis 1:20.000 9,10. Es wird jedoch angenommen, dass die tatsächliche Prävalenz der PCD aufgrund von Schwierigkeiten bei der Diagnose und fehlendem klinischem Verdacht höher ist. Die Symptome der PCD ahmen häufige respiratorische Manifestationen anderer akuter oder chronischer Atemwegserkrankungen nach, und die diagnostischen Herausforderungen bei der Bestätigung der Diagnose sind bekannt, was zu einer unzureichenden Behandlung und Nachsorge führt 2,5,9,11.
Die Ziliär-Videomikroskopie mit digitaler Hochgeschwindigkeits-Videomikroskopie (DHSV) ist eines der diagnostischen Instrumente für PCD 4,8,12,13. DHSV gilt als die optimale Methode zur Durchführung einer ziliären Funktionsanalyse (CFA), die aus der Analyse der Ziliarschlagfrequenz (CBF) und des Schlagmusters (CBP) besteht 2,14,15,16. DHSV verwendet lebendes respiratorisches Epithel, das in der Regel durch Nasenbürsten gewonnen wird13.
Angesichts des aktuellen COVID-19-Ausbruchs ist die Bestätigung einer PCD-Diagnose nun noch wichtiger, da es Hinweise darauf gibt, dass eine zugrunde liegende Atemwegserkrankung zu schlechteren Ergebnissen nach einer COVID-19-Infektion führen kann17,18. Eine sichere und effiziente PCD-Diagnostik während der aktuellen Pandemie wird es auch dazu bringen, dass bestätigte PCD-Patienten im Vergleich zur Allgemeinbevölkerung von zusätzlichen Schutzmaßnahmen profitierenkönnen 19.
Die Übertragung von COVID-19 erfolgt hauptsächlich durch Tröpfchenausbreitung20. Ein hohes Übertragungspotenzial von asymptomatischen (oder minimal symptomatischen) Patienten wird durch die hohe Viruslast in der Nasenprobe20 nahegelegt. Wenn Viruspartikel aerosolisiert werden, bleiben sie außerdem mindestens 3 Stunden in der Luft21. Daher sind Beschäftigte in der Atemwegsmedizin einem hohen Reservoir an Viruslast ausgesetzt, während sie die klinische Versorgung und die Probenentnahme für diagnostische Techniken durchführen22. Darüber hinaus setzt die Manipulation lebender Atemwegsproben den Techniker einer COVID-19-Kontamination aus. Während Best-Practice-Empfehlungen für Pneumologen und HNO-Chirurgen, die COVID-19-Patienten betreuen, umgesetzt werden23, fehlt es an Empfehlungen für die Durchführung von DHSV während der COVID-19-Pandemie.
Um weiterhin eine PCD-Diagnostik anbieten zu können und gleichzeitig die Sicherheit des medizinischen Personals (Durchführung der Probenentnahme) und des Technikers (Durchführung der Probenverarbeitung) zu gewährleisten, musste das ziliäre Videomikroskopieprotokoll während der COVID-19-Pandemie angepasst werden. Die Technik der Ziliar-Videomikroskopie ist derzeit auf Forschungsdienste und spezialisierte diagnostische Zentren beschränkt, da CFA eine umfangreiche Ausbildung und Erfahrung erfordert. Darüber hinaus fehlt es derzeit an einer Standardisierung und einem präzisen Arbeitsablauf für die Verarbeitung und Analyse von Proben mit DHSV 4,13.
Das Ziel dieser Arbeit ist es, Standardarbeitsanweisungen für DHSV zu beschreiben, mit besonderem Bezug auf Infektionskontrollmaßnahmen und Sicherheit bei der Probenahme und Verarbeitung von lebendem Nasenepithel. Dies wird es ermöglichen, trotz des aktuellen COVID-19-Ausbruchs eine qualitativ hochwertige PCD-Diagnose und -Versorgung fortzusetzen.
Protokoll
Die Genehmigung wurde von der Ethikkommission des Krankenhauses Lüttich und der Universitätsabteilung für Hygiene und Gesundheitsschutz am Arbeitsplatz eingeholt.
1. Probenahme von respiratorischem Flimmerepithel
- Stellen Sie vor der Probenahme sicher, dass die Probanden mindestens 4-6 Wochen lang frei von Infektionen und frei von nasalen und inhalativen Medikamenten sind.
- Bereiten Sie das ergänzte M199-Präparat vor: Ergänzen Sie das Zellkulturmedium 199 (M199) (500 ml) mit antibiotischer Lösung (5 ml Streptomycin/Penicillin (50 μg/ml)) und antimykotischer Lösung (5 ml Amphotericin B (2,5 μg/ml)).
- Bereiten Sie 2 (eines für jedes Nasenloch) konische 15-ml-Röhrchen mit Deckel vor und füllen Sie jedes von ihnen mit 3 ml ergänztem M199.
- Bereiten Sie eine Bronchialzytologiebürste vor (Dicke: 2 mm und Länge: 11 mm). Schneiden Sie das Ende des Drahtes ab, um sicherzustellen, dass die Bürste ca. 15 cm lang ist (Abbildung 1A,B). Um die Bürste beim Nasenputzen zu halten, verwenden Sie eine Weil-Blakesley-Nasenzange (Abbildung 1B).
- Anpassung an COVID-19: Vermeiden Sie die Verarbeitung einer lebenden Nasenepithelprobe mit unbekanntem Status für COVID-19, testen Sie den Patienten 48 bis 72 Stunden vor dem Nasenputzen für die Ziliarvideomikroskopie auf COVID-19. Dieser COVID-19-Test besteht aus einer Polymerase-Kettenreaktion aus einer Nasen-Rachen-Abstrichprobe24,25. Da der Status des Patienten für COVID-19 zu diesem Zeitpunkt unbekannt ist, müssen Arzt und Personal angemessen geschützt sein23,26, einschließlich FFP2-Maske, Handschuhe, Gesichtsschutz oder Schutzbrille und langärmeliger wasserabweisender Kittel. Im Falle eines nicht verfügbaren, unmöglichen oder zweifelhaften PCR-Tests wird die gesamte Verarbeitung des Nasenbürstens im L2-Biosicherheitslabor durchgeführt. Im Falle eines positiven COVID-19-Status sollten Sie die PCD-Diagnosetests verschieben und alternative Ansätze zur Behandlung des Patienten in Betracht ziehen.
VORSICHT: Diese Nasen-Rachen-Abstrichentnahme für COVID-19-Tests könnte eine sekundäre Ziliärdyskinesie induzieren, indem sie das nasale respiratorische Ziliarepithel schädigt27,28. Um dies zu vermeiden, führen Sie ein dünnes Wattestäbchen unter strenger endoskopischer Kontrolle in die Nasenhöhle bis zum Nasen-Rachen-Raum ein, um Verletzungen der Nasenmuscheln oder der Nasenscheidewand zu vermeiden. Die Probe wird dann aus dem Nasen-Rachen-Raum entnommen und das Wattestäbchen unter Kontrolle des starren Endoskops entnommen. Mit entsprechender Ausstattung kann eine 0° starre Endoskopie bei Erwachsenen und Kindern problemlos ohne Trauma durchgeführt werden.
2. Gewinnung von Proben aus respiratorischem Flimmerepithel
COVID-19-Anpassung: Auch wenn der COVID-19-Status des Patienten aufgrund der Falsch-Negativ-Rate negativ ist, wird der Patient gebeten, während des Eingriffs eine chirurgische Maske auf dem Mund zu tragen, und der Arzt trägt Handschuhe, FFP2-Maske und Gesichtsschutz.
- Vorbereitung auf das Nasenputzen
- Bitten Sie den Patienten, sich die Nase zu putzen.
- Führen Sie das Nasenputzen unter Nasenendoskopie oder verblindet durch. Wenn Sie eine Nasenendoskopie durchführen, untersuchen Sie die 2 Nasenlöcher vor dem Nasenputzen (nicht wiederholen, wenn dies zuvor 48-72 für COVID-19-Nasenabstriche durchgeführt wurde). Die Untersuchung ermöglicht es, den Zustand der Schleimhaut (ein hoher Grad der Entzündung kann beim Nasenputzen Blutungen verursachen, ...), den Zustand der unteren Nasenmuschel (z. B. zum Ausschluss einer Teleangiektasie) und ob die Nasenscheidewand gerade ist (Abbildung 1C) zu überprüfen.
- Bitten Sie den Patienten, sich hinzulegen oder bequem zu sitzen, wobei der Kopf nach hinten auf dem Stuhl ruht (da das Nasenputzen einen Reflex auslöst, um den Kopf nach hinten zu bewegen). Eine zweite Bezugsperson hält den Kopf während des Nasenputzens, insbesondere bei Kindern.
- Schütteln Sie die Bürste vor dem Nasenputzen mit dem beigesetzten M199 (das Befeuchten der Bürste reduziert Reizungen durch das Zähneputzen).
Anmerkungen: Die Bürste kann innerhalb des ergänzten M199 angefeuchtet werden; Wenn der Patient allergisch gegen Antibiotika ist (Penicillin und Streptomycin sind im supplementierten Zellkulturmedium vorhanden), befeuchten Sie die Bürste mit Kochsalzlösung.
- Nasenputzen
- Führen Sie die Nasenbürste sanft ohne Lokalanästhesie oder Vollnarkoseein 13. Wenn Sie eine Nasenendoskopie durchführen, platzieren Sie das Endoskop am Naseneingang, um die untere Nasenmuschel sichtbar zu machen, und führen Sie dann die Zytologiebürste in die Nase ein. Wenn Sie ein "verblindetes" Nasenputzen durchführen, führen Sie die Bürste entlang des Nasenbodens in die Nase ein (Abbildung 1D).
HINWEIS: Einige diagnostische Zentren verwenden eine Lokalanästhesie mit einem Tampon Naphazolin, um das Nasenputzen durchzuführen. - Bewegen Sie die Bürste mehrmals nach hinten und vorne über den hinteren Teil der unteren Nasenmuschel und ziehen Sie sie dann zurück. Der Bediener sollte das Gefühl haben, dass die Bürste das Epithel reibt, und der Patient könnte einseitig tränende Augen an der Seite des Putzens spüren.
HINWEIS: Wenn das Nasenputzen zu anterior durchgeführt wird, werden keine Flimmerzellen erhalten, da die vordere Nasenhöhle mit einem Übergangsepithel ohne Flimmerepithel ausgekleidet ist. - Nach der Probenahme werden die Nasenbürstenproben sofort in das Nährmedium gelegt. Die erhaltenen respiratorischen Epithelstreifen werden durch Rühren der Bürste in dem Röhrchen, das das ergänzte M199 enthält, entfernt und dann das Röhrchen verschlossen (Abbildung 1E).
- Anpassung an COVID-19: Entfernen Sie die Epithelstreifen nicht, indem Sie die Bürste unmittelbar nach der Probenahme in der ergänzten M199 umrühren. Setzen Sie die Bürste in das Rohr ein, schneiden Sie den Draht so ab, dass er vollständig in das Rohr passt, und schließen Sie das Rohr sofort. Legen Sie die Probe in einen luftdichten Doppelbeutel.
- Führen Sie die Nasenbürste sanft ohne Lokalanästhesie oder Vollnarkoseein 13. Wenn Sie eine Nasenendoskopie durchführen, platzieren Sie das Endoskop am Naseneingang, um die untere Nasenmuschel sichtbar zu machen, und führen Sie dann die Zytologiebürste in die Nase ein. Wenn Sie ein "verblindetes" Nasenputzen durchführen, führen Sie die Bürste entlang des Nasenbodens in die Nase ein (Abbildung 1D).
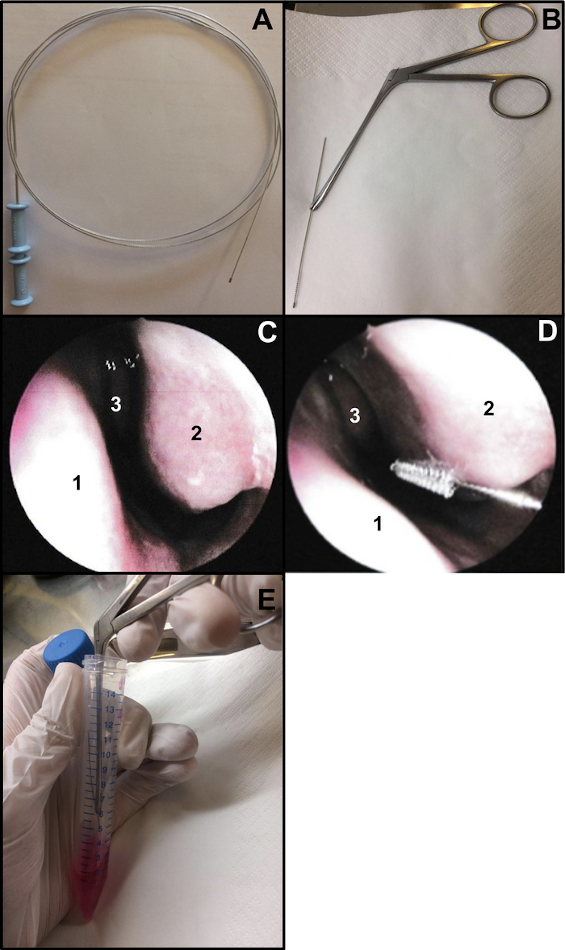
Abbildung 1: Nasenputztechnik. (A) Gesamte Bürste für die Bronchialzytologie (B) Bürstenfertig: Das Bürstenende des Drahtes wird abgeschnitten (ca. 15 cm lang) und von einer Weil-Blakesley-Nasenzange gehalten(C) Endoskopische Ansicht der Nasenhöhle: Nasenscheidewand (1) Nasenscheidewand (2) und Mittelmuschel (3) (D) Das Nasenputzen wird am hinteren Teil der unteren Nasenmuschel (2) durchgeführt. Nasenscheidewand (1) Nasenmuschel (3). (E) Die respiratorischen Epithelstreifen werden durch Schütteln der Bürste in dem zugesetzten M199-Zellkulturmedium entfernt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Verarbeitung des respiratorischen Flimmerepithels
- Analysieren Sie Nasenbürstenproben innerhalb von 9 Stunden nach der Probenahme unter dem Mikroskop, da sowohl CBF als auch CBP innerhalb dieses Zeitrahmens stabil sind (unveröffentlichte Daten).
- Verwenden Sie ein aufrechtes oder inverses Lichtmikroskop mit einem x100 Ölimmersions-Phasenkontrast oder einer Interferenzkontrastlinse. Stellen Sie das Mikroskop idealerweise auf einen Antivibrationstisch, da ziliäre Schläge durch äußere Vibrationen (z. B. vom Labortisch) Artefakten ausgesetzt sein können13.
Anpassung an COVID-19: Der Bediener verwendet persönliche Schutzausrüstung, um die Nasenverarbeitung durchzuführen, einschließlich FFP2-Maske, Handschuhe und langärmeliger wasserabweisender Kittel.
- Bereiten Sie die Visualisierungskammer vor.
- Hängen Sie die Flimmer-Epithelstreifen in einer im Labor gebauten offenen Visualisierungskammer auf, damit die Flimmerhärchen während der Analyse unter dem Mikroskop frei schlagen können. Diese Kammer entsteht durch die Trennung eines Deckglases (22 mm x 40 mm) und eines Glasträgers durch zwei benachbarte quadratische Deckgläser (20 mm x 20 mm), die durch einen Abstand von 15 mm voneinander getrennt und auf den Glasträger12 geklebt werden (Figur 2, Figur 4A).
Anpassung an COVID-19: Die oben beschriebene im Labor gebaute Kammer ist offen und ermöglicht den Gas- und Feuchtigkeitsaustausch zwischen der Probe und der Umgebung13. Im Zusammenhang mit der COVID-19-Pandemie ist es möglich, eine geschlossene Visualisierungskammer mit einem doppelseitig geklebten Abstandshalter mit einer Tiefe von 0,25 mm zu verwenden (Abbildung 3, Abbildung 4B). Der Abstandshalter wird auf den Objektträger geklebt, und dann wird ein Deckglas (22 mm x 40 mm) auf den Abstandshalter geklebt.

Abbildung 2: Montage der im Labor gebauten offenen Kammer. (A) Die 2 quadratischen Deckgläser (20 mm x 20 mm) werden auf den Objektträger gelegt. (B) Die quadratischen Deckgläser werden in einem Abstand von ca. 15 mm voneinander getrennt und auf den Objektträger geklebt. (C) Die Kammer wird zwischen den beiden benachbarten quadratischen Deckgläsern mit einer kleinen Probe (ca. 60 μl) Flimmerepithel in supplementiertem M199 gefüllt. (D) Ein langes rechteckiges Deckglas (22 mm x 40 mm) wird auf die beiden benachbarten quadratischen Deckgläser gelegt und deckt die Kammer ab. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Befestigung der geschlossenen Kammer mit einem beidseitig aufgeklebten Abstandshalter. (A) Der Glasschieber und der doppelseitig verklebte Abstandshalter. (B) Der Schutz wird auf einer Seite des Abstandshalters entfernt und der Abstandshalter wird dann auf den Glasschieber geklebt. (C) Der Schutz wird von der anderen Seite des doppelseitig festsitzenden Abstandshalters entfernt, und dann wird der Abstandshalter mit einer kleinen Probe (ca. 60 μl) Flimmerepithel in ergänztem M199 gefüllt. (D) Ein langes rechteckiges Deckglas (22 mm x 40 mm) wird auf den Abstandshalter geklebt und verschließt die Kammer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
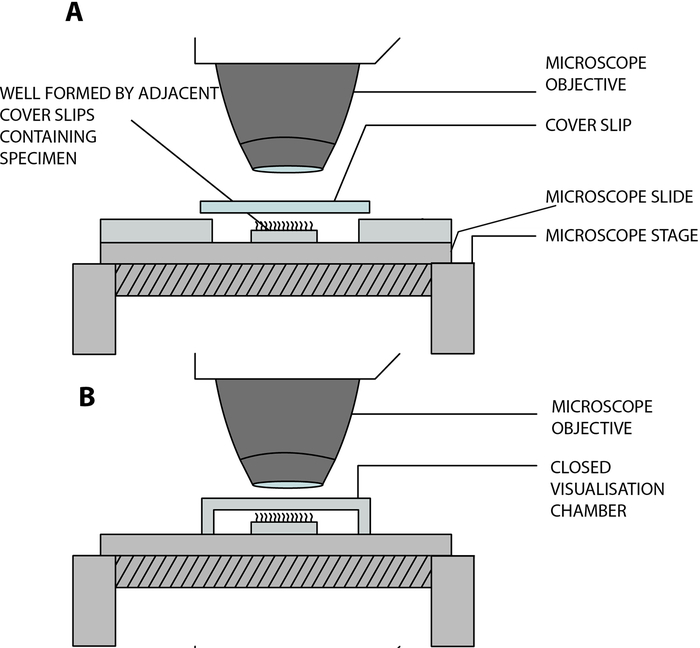
Abbildung 4: Schematische Darstellung der wichtigsten Visualisierungskammern, die für die Durchführung der Ziliarvideomikroskopie mit digitaler Hochgeschwindigkeits-Videomikroskopie (DHSV) verwendet werden. (A) Die Technik des offenen hängenden Tropfens: Die Flimmerprobe wird in einem Tropfen Zellkulturmedium in einer offenen Kammer suspendiert, die durch die Trennung eines Deckglases und eines Glasobjektträgers durch zwei benachbarte Deckgläser entsteht. (B) Die Technik des geschlossenen hängenden Tropfens: Die Flimmerprobe wird in einem Tropfen Zellkulturmedium in einer geschlossenen Kammer suspendiert, die durch einen Abstandshalter entsteht, der zwischen einer Glasseite und einem Deckglas eingeklemmt ist. Der Abstandshalter haftet sowohl auf dem Glasschieber als auch auf dem Deckglas. Reproduziert und modifiziert von Kempeneers et al.13. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Kontrolle der Temperatur
- Umgeben Sie das Mikroskop mit Luftpolsterfolie (Abbildung 5A,B).
- Befestigen Sie die Objektivheizung mit einem Velcro Gurt um das Objektiv (Abbildung 5C)
- Schalten Sie den Regler der Objektivheizung 1 Stunde ein, bevor Sie die Kontrolltemperaturprüfung durchführen.
- Schalten Sie das Mikroskop ein und überprüfen Sie, ob das Mikroskop eingerichtet ist, da die Lichtmenge durch die Probe die Temperatur auf dem Objektträger verändern kann.
- Schalten Sie die Steuerung der beheizten Box ein (Abbildung 5D).
- Überprüfen Sie, ob die Referenzsonde ordnungsgemäß funktioniert, bevor Sie beginnen. Halten Sie die Spitze der Referenzsonde zwischen den Fingern. Es sollte die Körpertemperatur messen.
- Legen Sie freie Medien in die Mitte des Objektträgers, zwischen die beiden nebeneinander liegenden quadratischen Deckgläser (20 mm x 20 mm), die darauf geklebt sind.
- Setzen Sie die Referenzsondenspitze in das beiliegende M199 ein. Deckel mit rechteckigem Deckglas (22 mm x 40 mm). Achten Sie darauf, dass die Sonde vollständig von Medien umgeben ist (sonst könnte die Temperatur sinken).
- Anpassung an COVID-19: Um die Temperaturregelung in der geschlossenen Kammer mit einem Abstandshalter durchzuführen, schneiden Sie eine Seite des Abstandshalters ab (dieses Loch muss die gleiche Größe wie die Referenzsonde haben). Kleben Sie den Abstandshalter auf den Objektträger, legen Sie freie Medien in die Mitte des Abstandshalters. Stecken Sie die Spitze der Referenzsonde durch das Loch des Abstandshalters in die Lösung und kleben Sie dann ein rechteckiges Deckglas (22 mm x 40 mm) auf den Abstandshalter.
- Legen Sie den Objektträger in die Platte der beheizten Box. Verschließen Sie die beheizte Box mit dem Deckel.
- Öl auf das Ölimmersionsobjektiv geben.
- Stellen Sie die beheizte Box auf den Mikroskoptisch.
- Stellen Sie die Temperatur der Platte und des Deckels (die Temperatur des Deckels sollte 2 °C höher sein als die Temperatur der Platte, um Kondensation zu vermeiden) so ein, dass sie mit der Referenzsonde im Medium 37 °C messen.
- Warten Sie 5 Minuten (Zeit, die benötigt wird, um die Temperatur der Probe auf 37 °C zu erhöhen).
- Stellen Sie das Objektiv ein und bewegen Sie es näher an den Objektträger, bis Sie das Deckglas mit der Spitze des Objektivs berühren.
- Bewegen Sie das Objektiv, um die Mitte der Sonde im Mikroskop zu sehen.
Anmerkungen: Stellen Sie sicher, dass die Sonde auf dem Computerbildschirm zu sehen ist (um zu überprüfen, ob das Kamerasystem funktioniert, bevor Sie die Flimmerprobe betrachten). Wenn Sie die Mitte der Sonde betrachten, ist der Bildschirm vollständig schwarz. - Stellen Sie die Temperatur der Objektivheizung ein (um den Temperaturverlust auszugleichen, wenn die Ölimmersionslinse mit dem Deckglas in Kontakt kommt). Achten Sie darauf, mit der Referenzsonde 37 °C im Medium zu messen, wenn das Objektiv das Deckglas berührt.
Anmerkungen: Arbeiten Sie idealerweise in einem Raum mit kontrollierter Temperatur, damit sich diese eingestellten Temperaturen nicht ändern. Wenn die Temperatur des Raumes nicht kontrolliert wird, sollten Sie diese Temperaturkontrolle jeden Tag durchführen, bevor Sie eine Ziliarvideomikroskopie durchführen. - Nachdem Sie die Temperatur überprüft haben, nehmen Sie den Objektträger aus der beheizten Box.
- Reinigen Sie den Objektträger und die Spitze der Referenzsonde mit Alkohol und legen Sie ihn weg.
- Reinigen Sie die Linse mit Isopropanol und Reinigungstüchern mit kreisenden Bewegungen.

Abbildung 5: Geräte, die im DHSV-Labor verwendet werden. (A) Das Mikroskop, das mit einer 100-fachen Ölimmersions-Phasenkontrastlinse ausgestattet ist, wird auf einen Antivibrationstisch gestellt, um zu vermeiden, dass externe Vibrationen Artefakte für die ziliäre Funktionsanalyse verursachen (B) Das Mikroskop ist von Luftpolsterfolie umgeben, um Wärmeverluste durch Umgebungsluft zu verhindern. (C) Das Ölimmersionsobjektiv erzeugt Wärmeverlust. Dies kann mit einer Linsenheizung (Pfeile) verhindert werden. (D) Die Probe wird mit einem Heizkasten erhitzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Präparation der respiratorischen Flimmerepithelproben
- Schütteln Sie die Röhre vorsichtig, damit sich die Flimmerhärchen in der Röhre ausbreiten können (um zu vermeiden, dass Flimmerhärchen an anderen Flimmerstreifen, Schleim oder Schmutz hängen bleiben, die verhindern, dass sie frei schlagen).
HINWEIS: Dieser Schritt ist wichtig, um "optimale Kanten" des Flimmerepithels zu erhalten (Abbildung 12). - Mit einer Pipette werden ca. 50 μl Flimmerepithel in supplementiertem M199 in der Mitte des Röhrchens entnommen.
- Die Probe wird auf die im Labor gebaute Kammer (zwischen den beiden benachbarten quadratischen Deckgläsern (20 mm x 20 mm)) gelegt und mit einem rechteckigen Deckglas (22 mm x 40 mm) abgedeckt. Achten Sie darauf, keine Blasen hinzuzufügen.
- Anpassung an COVID-19: Die Schritte 4.1-4.3 in einer mikrobiologischen Sicherheitswerkbank durchführen. Ablauf in der mikrobiologischen Sicherheitswerkbank.
- Schalten Sie die mikrobiologische Sicherheitswerkbank 10 Minuten vor der Probenvorbereitung ein (um sicherzustellen, dass die Umgebung steril ist).
- Desinfizieren Sie vor jeder Handhabung die gesamte mikrobiologische Sicherheitswerkbank mit 70%igem Ethanol.
- Desinfizieren Sie das gesamte notwendige Material mit 70%igem Ethanol, bevor Sie es in die mikrobiologische Sicherheitswerkbank geben.
- Öffnen Sie die konischen 15-ml-Röhrchen mit den Proben nur einmal unter der mikrobiologischen Sicherheitswerkbank und entfernen Sie dann die Epithelstreifen, indem Sie die Bürste (mit einer Weil-Blakesley-Nasenzange) in der ergänzten M199 bewegen.
- Kleben Sie den Abstandshalter auf den Glasschieber und entfernen Sie den Schutz von dem doppelseitig festsitzenden Abstandshalter.
- Schütteln Sie die Röhre vorsichtig, damit sich die Flimmerhärchen im gesamten Schlauch ausbreiten können.
- Entnehmen Sie eine kleine Probe des Flimmerepithels in supplementiertem M199 aus der Mitte des Röhrchens mit einer Pipette (ca. 60 μL) und füllen Sie den Spacer.
- Kleben Sie das rechteckige Deckglas (22 mm x 40 mm) auf den Abstandshalter, um die Kammer zu verschließen.
- Desinfizieren Sie den Objektträger, bevor Sie die mikrobiologische Sicherheitswerkbank verlassen.
- Entfernen Sie den Objektträger aus der mikrobiologischen Sicherheitswerkbank.
- Wechseln Sie die Handschuhe, wenn Sie die mikrobiologische Sicherheitswerkbank verlassen.
- Warten Sie 10 Minuten, bevor Sie die mikrobiologische Sicherheitswerkbank nach Gebrauch ausschalten (um sicherzustellen, dass die Umgebung der mikrobiologischen Sicherheitswerkbank steril ist, bevor Sie die Tür schließen).
- Legen Sie den Objektträger in die Platte der beheizten Box. Verschließen Sie die beheizte Box mit dem Deckel.
- Öl auf das Ölimmersionsobjektiv geben.
- Stellen Sie die beheizte Box auf den Tisch des Mikroskops.
- Schalten Sie die beheizte Box und die Objektivheizung ein.
Anmerkungen: Die Objektivheizung muss 1 Stunde vor Gebrauch eingeschaltet werden. - Passen Sie die Temperatureinstellungen der beheizten Box und der Linsenheizungsregler entsprechend den in Schritt 3.4 ermittelten Werten an.
- Warten Sie 5 Minuten (Zeit, die erforderlich ist, um die Temperatur der Probe auf 37 °C zu erhöhen, wenn vordefinierte Einstellungen sowohl für die beheizte Box als auch für die Objektivheizung verwendet werden).
- Nähern Sie sich dem Objektträger, bis Sie das Deckglas mit der Spitze des Objektivs berühren.
5. Visualisierung von Wimpernrändern der Atemwege
- Befestigen Sie die Hochgeschwindigkeits-Videokamera am Mikroskop, schließen Sie die Kamera an den Computer an und schalten Sie die Kamera ein.
- Schalten Sie den Computer ein.
- Schließen Sie die digitale Hochgeschwindigkeits-Videomikroskopiekamera über die Software an den Computer an (so dass das durch die Okularlinsen betrachtete Bild auf den Monitor projiziert wird).
- Öffnen Sie die Software, und das Hauptmenü wird automatisch geöffnet (Abbildung 6A).
HINWEIS: Die Software ist das Programm, das im Labor für die Bildaufnahme und -verarbeitung verwendet wird. Das System ermöglicht es, Videosequenzen aufzunehmen und mit reduzierter Bildrate oder Bild für Bild wiederzugeben. Es kann kostenlos heruntergeladen werden. - Öffnen Sie die Kamera (Abbildung 6A).
- Wenn der Kameraenumerationsfilter angezeigt wird, wählen Sie OK aus (Abbildung 6B).
- Wählen Sie Liste aktualisieren. Wählen Sie den Namen der Kamera aus. Wählen Sie " Schnittstelle: Experte" und dann "Öffnen " aus (Abbildung 6C).
- Wählen Sie in der Kamerasteuerungszeile am oberen Rand des angedockten Dialogmenüs Live aus (Abbildung 6D).
- Wählen Sie " Wiedergabe", um das Bild anzuzeigen, und "Stopp", um die Anzeige abzuschließen (Abbildung 6D).
- Öffnen Sie die Software, und das Hauptmenü wird automatisch geöffnet (Abbildung 6A).

Abbildung 6: Beschreibung der Nutzung der Software: Visualisierung von respiratorischen Flimmerrändern auf dem Monitor. (A) Das Hauptmenü erscheint direkt beim Öffnen der Software. (B) Schließen Sie den Kamera-Enumerationsfilter. (C) Wählen Sie die Kamera aus und wählen Sie Schnittstelle: Experte. (D) Der Live-Modus ermöglicht es, das durch das Mikroskop gesehene Bild auf dem Monitor zu visualisieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Passen Sie die Einstellung für die Kameraerfassung (in der oberen rechten Ecke) an (Abbildung 7).
- Wählen Sie unter " Aufnahmeeinstellungen " die Option " Kamera" und passen Sie dann die Bildrate an: Frequenz (Hz): 500 (siehe unten) (Abbildung 7A).
- Wählen Sie unter " Erfassungseinstellungen " die Option " Kamera" und passen Sie dann den Interessenbereich (ROI) an (Abbildung 7A).
HINWEIS: Der ROI wird mit einer Skala berechnet, die mit dem x100-Ölimmersionsobjektiv betrachtet und auf den Monitor projiziert wird, um die Anzahl der Pixel zu definieren, die 50 μm entsprechen (da Sie Flimmerkanten mit einer Größe von ca. 50 μm aufnehmen möchten (siehe unten)). - Wählen Sie unter "Aufnahmeeinstellungen " die Option " Aufzeichnen" und passen Sie dann die Dauer des Videos und die Gesamtzahl der aufgenommenen Bilder an (eine Dauer von 2 Sekunden, entspricht 1000 Bildern, wenn die gewählte Bildrate 5OO Hz beträgt) (Abbildung 7B).
HINWEIS: Unserer Erfahrung nach ist eine Videolänge von mindestens 2 Sekunden erforderlich, um eine vollständige Analyse von CBF und CBP zu ermöglichen. - Wählen Sie " Datei" und dann " Kamera-Cfg speichern", um die neue Erfassungseinstellung zu speichern (geben Sie einen Namen und ggf. einen Kommentar für diese neue Konfiguration ein) (Abbildung 7C,D).
- Um diese neue Kamerakonfiguration zu öffnen, öffnen Sie Datei und laden Sie Camera Cfg (Abbildung 7C).
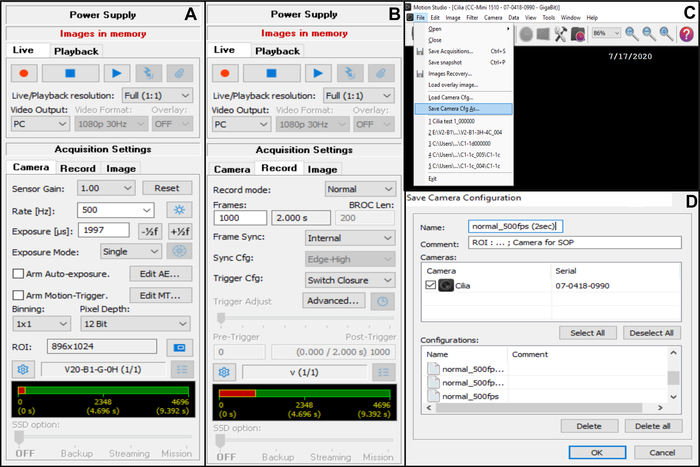
Abbildung 7: Beschreibung der Verwendung der Software: Anpassung der Kameraerfassungseinstellungen für die Videoaufzeichnung der schlagenden Flimmerkanten. (A) Passen Sie in der Erfassungseinstellung Kamera den Interessenbereich (ROI) und die Bildrate für die Videoaufzeichnung (Rate) an. (B) Passen Sie in der Aufnahmeeinstellung Aufnahme die Dauer der Videoaufnahme an (Anzahl der Bilder, die für die gewählte Aufnahmedauer benötigt werden, entsprechend der zuvor gewählten Bildrate). (C) Diese neuen Kamerakonfigurationseinstellungen können mit der Funktion Kamera speichern gespeichert werden. Load Camera Cfg ermöglicht es, die gespeicherten Konfigurationseinstellungen für die weitere Verwendung erneut zu öffnen. (D) Die neuen Kamerakonfigurationseinstellungen können benannt und bei Bedarf mit einem Kommentar versehen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Sehen Sie durch Okularlinsen und suchen Sie nach Zellen oder Ablagerungen in der Probe und fokussieren Sie dann.
- Überprüfen Sie, ob das Bild auf dem Monitor sichtbar ist, und verbessern Sie die Bildqualität, indem Sie den Kondensor (und das DIC-Prisma bei Verwendung einer Interferenzkontrastlinse) einstellen und ggf. den Fokus anpassen.
- Suche nach Streifen von Flimmerepithel.
6. Auswahl der Wimpernränder für die Atemwege
ANMERKUNG: Das experimentelle System ermöglicht es, schlagende Zilien in drei verschiedenen Ebenen zu betrachten: ein seitliches Profil, das direkt auf den Beobachter zuschlägt, und von direkt oben (Abbildung 8).
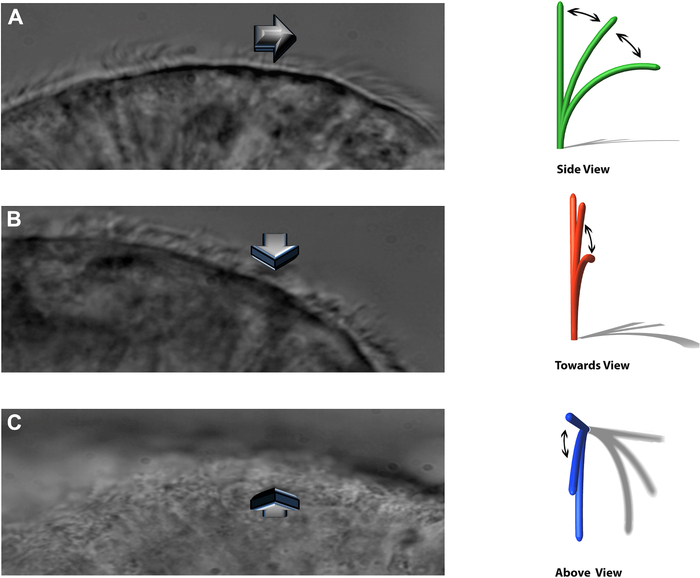
Abbildung 8: Die DHSV-Technik ermöglicht es, schlagende Zilien in drei verschiedenen Ebenen zu betrachten. (A) im seitlichen Profil. (B) direkt auf den Betrachter zuschlagen und. (C) direkt von oben. Reproduziert von Kempeneers et al.16. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Es werden nur intakte, ununterbrochene Flimmerepithelränder mit einer Länge von mindestens 50 μm aufgezeichnet.
- Für Aufzeichnungen, die auf dem seitlichen Profil gemacht wurden, bestimmen Sie die Qualität der Kante gemäß dem Bewertungssystem von Thomas et al.29 (Abbildung 9). Verwenden Sie nur normale Kanten (Abbildung 9A) oder Kanten mit kleineren Projektionen (Abbildung 9B) für die ziliäre Funktionsanalyse. Schließen Sie isolierte Zellen aus (Abbildung 9E).

Abbildung 9: Repräsentatives Bild des Scoring-Systems von Thomas et al.29 für die unterschiedliche Qualität der Flimmerepithelränder. (A) Normalrand: definiert als ein intakter, einheitlich bewimperter Epithelienstreifen > 50 μm Länge (B) Flimmerrand mit geringfügigen Vorsprüngen: definiert als eine Kante >50 μm Länge, mit Zellen, die aus der epithelialen Randlinie herausragen, aber ohne Punkt der apikalen Zellmembran, der über die Spitzen der Flimmerhärchen auf die benachbarten Zellen hinausragt (C) Flimmerrand mit Hauptvorsprüngen: definiert als eine Kante >50 μm Länge, mit Zellen, die aus der epithelialen Randlinie herausragen, wobei mindestens ein Punkt der apikalen Zellmembran über die Spitzen der Flimmerhärchen auf die benachbarten Zellen hinausragt (D) Isolierte Flimmerzelle: definiert als die einzige Flimmerzelle an einem Epithelrand >50 μm Länge (E) Einzelzellen: definiert als Flimmerzellen, die keinen Kontakt untereinander oder zu einem anderen Zelltyp haben. Maßstabsleiste: 5,5 μm. Reproduziert von Thomas et al.29Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Führen Sie die CFA durch, indem Sie nur Zilien verwenden, die frei von Schleim und Schmutz sind, und schlagen Sie in dem Profil, das für die aufgezeichnete Kante ausgewählt wurde. Wählen Sie nur Flimmerkanten aus, die mindestens 2 CBF- und CBP-Auswertungen (siehe unten) entlang der Kante zulassen.
- Verwenden Sie nur für CFA-Proben, die mindestens 6 Kanten ergeben, die im seitlichen Profil schlagen und die oben genannten Kriterien erfüllen. Analysieren Sie maximal 20 Kanten im seitlichen Profil.
- Verwenden Sie mindestens 1 zusätzlichen Rand der Flimmerhärchen, der von oberhalb des Beobachterprofils schlägt, um das CBP zu charakterisieren.
7. Aufnahme von Flimmerrand
- Nehmen Sie die schlagende Zilienkante mit einer Kamerabildrate von 500 Bildern pro Sekunde auf und projizieren Sie sie auf einen hochauflösenden Monitor. Eine minimale Bildrate von 400 Hz ist erforderlich, um die Analyse sowohl von CBF als auch von CBP13 zu ermöglichen. Nehmen Sie eine Kante mit einer Bildrate von 30 Bildern pro Sekunde auf, um die Effizienz der Partikelentfernung zu bewerten.
- Wählen Sie Live in der Kamerasteuerungszeile am oberen Rand des angedockten Dialogmenüs (Abbildung 6D)
- Wählen Sie " Wiedergabe ", um das Bild anzuzeigen, und "Stopp", um die Anzeige abzuschließen (Abbildung 6D)
- Um eine Kante aufzuzeichnen, drücken Sie die Aufnahmetaste (Abbildung 6D). Um die Aufnahme vor dem Speichern anzuzeigen, gehen Sie auf die Kamerasteuerungszeile oben im angedockten Dialogmenü und wählen Sie Wiedergabe. Wählen Sie "Wiedergabe", um das aufgenommene Video anzuzeigen, und "Stopp", um die Wiedergabe zu beenden (Abbildung 10A).
HINWEIS: Beenden Sie die Anzeige der aufgezeichneten Kante vor dem Speichern.
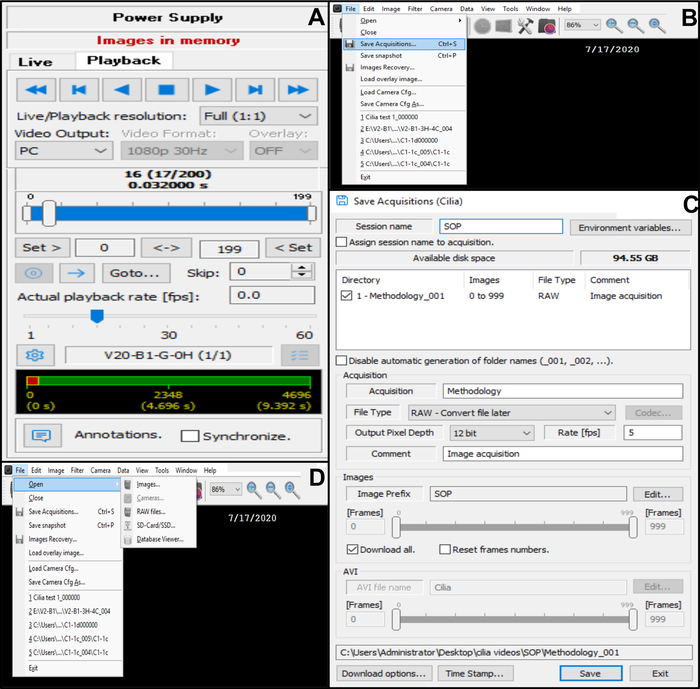
Abbildung 10: Beschreibung der Nutzung der Software. (A) Wiedergabemodus. Um eine aufgezeichnete Videosequenz zu überprüfen, in der eine Wimpernkante geschlagen wird, wählen Sie den Wiedergabemodus. Wählen Sie "Wiedergabe", um das Bild anzuzeigen, und "Stopp", um die Anzeige abzuschließen. Die Fame-Rate kann angepasst werden, um die Analyse der Ziliarfunktion zu verbessern (B, C) Speichern der Videoaufzeichnungen von schlagenden Flimmerrändern (B) Um das Video zu sichern, wählen Sie "Datei" und dann "Akquisitionen speichern". (C) Geben Sie den Namen des aufgenommenen Videos ein und wählen Sie die Platzierung aus, an der das Video aufgenommen wird. Stellen Sie sicher, dass die Aufzeichnung als . RAW-Datei (D) Auswahl einer Aufnahme von zu analysierenden Schwebungskanten: Um eine Videoaufzeichnung zu öffnen, wählen Sie "Datei", dann "Öffnen" und dann "Bilder". Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Speichern Sie das Video in der Datenbank (Abbildung 10B, C).
- Öffnen Sie die Datei in der oberen linken Ecke und speichern Sie die Erfassungen (Abbildung 10B).
- Geben Sie unter Erfassungen speichern den Namen des aufgezeichneten Videos ein und stellen Sie sicher, dass die Aufnahme im RAW-Dateiformat gespeichert ist (Abbildung 10C).
- Wenn das Video gespeichert ist, kehren Sie in den Live-Modus zurück (gehen Sie zurück zur Kamerasteuerungszeile oben im angedockten Dialogmenü und wählen Sie Live) (Abbildung 6D).
- Wiederholen Sie den Vorgang, um die Anzahl der Kanten zu erfassen, die die für CFA erforderlichen Auswahlkriterien erfüllen.
HINWEIS: Es ist möglich, innerhalb von maximal 20 Minuten nach der Präparation des Objektträgers mehrere Schwebkanten, die den Auswahlkriterien entsprechen, von einem Objektträger aufzunehmen (um ein Austrocknen zu vermeiden). Wenn es nach 20 Minuten nicht möglich ist, genügend Kanten zu erhalten, die den Auswahlkriterien entsprechen, bereiten Sie eine neue Folie vor. - Nehmen Sie den Objektträger aus der beheizten Box.
- Entfernen Sie das rechteckige Deckglas und werfen Sie es in den speziellen Behälter für gefährliche medizinische Abfälle.
- Reinigen Sie den Objektträger (mit den beiden aufgeklebten quadratischen Deckgläsern) mit 70%igem Ethanol und saugfähigem Papier. Sobald der Objektträger sauber ist, kann er wieder verwendet werden.
- Anpassung an COVID-19: Legen Sie den Objektträger mit dem Deckglas und dem Abstandshalter in einen luftdichten Beutel, ziehen Sie Handschuhe und Maske aus und legen Sie sie in den luftdichten Beutel. Legen Sie den luftdichten Beutel in den speziellen Behälter für gefährliche medizinische Abfälle.
8. Ziliäre Funktionsanalyse
- Vorbereitende Vorbereitung zur Durchführung der manuellen CBF- und CBP-Auswertung
- Öffnen Sie die Software.
- Öffnen Sie Datei in der oberen linken Ecke, dann Öffnen und dann Bilder (Abbildung 10D).
- Wählen Sie das zu analysierende Video aus.
- Gehen Sie auf die Kamerasteuerungszeile oben im angedockten Dialogmenü und wählen Sie Wiedergabe (Abbildung 10A). Wählen Sie "Wiedergabe", um das aufgenommene Video anzuzeigen, und "Stopp", um die Wiedergabe zu beenden.
- Manuelle Analyse der Ziliarschlagfrequenz (CBF)
- Führen Sie die Auswertung des CBF nur anhand der seitlichen Kanten durch.
- Teilen Sie die Flimmerkanten in ca. 5 benachbarte Bereiche, die jeweils ca. 10 μm messen (Abbildung 11).
- Identifizieren und visualisieren Sie Zilien oder Gruppen von Zilien mit einer reduzierten Bildrate, und es werden maximal 2 CBF-Messungen in jedem Bereich durchgeführt, was zu maximal 10 CBF-Messungen entlang jeder Kante führt (Abbildung 11).
- Zeichnen Sie die Anzahl der Frames auf, die für eine Gruppe von Zilien erforderlich sind, um 5 Schlagzyklen abzuschließen.
- Konvertieren Sie in CBF durch eine einfache Berechnung: (CBF= Aufnahme-Framerate (Hz)/(Anzahl der Frames für 5 Schläge) x 5)13,16,30. Unbewegliche Zilien werden mit einem CBF von 0 Hz13 angegeben.
HINWEIS: Passen Sie die Bildrate bei der Wiedergabe der aufgenommenen Videos an (Abbildung 10A). Dies ist besonders nützlich, wenn die analysierten Flimmerhärchen sehr langsam schlagen. Durch Erhöhen der Bildrate können Sie feststellen, ob die Flimmerhärchen sehr langsam schlagen oder unbeweglich sind. - Berechnen Sie für jede Probe den mittleren CBF als Mittelwert (SD) oder (95%-KI) aller CBF, die im Seitwärtsprofil aufgezeichnet wurden, einschließlich statischer Zilien.
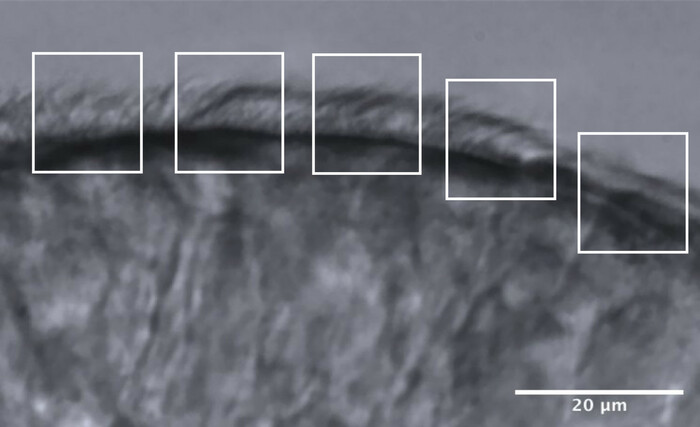
Abbildung 11: Repräsentatives Bild eines optimalen Qualitätsvorteils und die Aufteilung in 5 Bereiche, um eine CFA-Analyse zu ermöglichen. Ein Flimmerepithelrand mit optimaler Qualität wird in 5 benachbarte Bereiche mit einer Größe von jeweils 10 μm fragmentiert. In jedem Bereich werden maximal 2 CBF-Messungen (und 2 CBP-Auswertungen) durchgeführt, was zu maximal 10 CBF-Messungen (und CBP-Auswertungen) entlang jeder Kante führt. Maßstabsleiste = 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Manuelle Analyse des ziliären Schlagmusters (CBP)
- Um die Marker der Dyskinesie zu bewerten, verwenden Sie nur das seitliche Profil. Verwenden Sie die Ebenen in Richtung des Beobachters und von oben, um den Typ von CBP13 zu charakterisieren. Es gibt verschiedene Methoden und Scores für die CBP-Bewertung. Im Folgenden wird die im Labor verwendete Methode mit der Definition der Marker der Dyskinesie beschrieben.
- Der prozentuale Anteil jedes einzelnen CBP innerhalb der Stichprobe
- Führen Sie für jede Zilien oder Gruppe von Zilien, die identifiziert und für eine CBF-Messung verwendet werden (Abbildung 11), eine CBP-Analyse mit reduzierter Bildrate durch: Vergleichen Sie den genauen Weg, den die Zilien während eines vollständigen Schlagzyklus zurückgelegt haben, mit dem normalen CBP, der in der DHSV-Analyse beobachtet wurde12,30.
- Ordnen Sie jeder Zila oder Gruppe von Zilien, die analysiert werden, ein eindeutiges CBP (normal, until, steif, zirkulär, asynchron (unkoordiniertes Ziliarschlagen) oder dyskinetisch13) zu.
- Berechnen Sie für jede Stichprobe den Prozentsatz jedes einzelnen CBP innerhalb der Stichprobe. der CBP, der der Stichprobe zugeschrieben wird, ist der vorherrschende beobachtete CBP.
- Berechnen Sie die 3 Marker der Dyskinesie.
- Berechnen Sie den Imtilitätsindex (IMI): den Prozentsatz der unbeweglichen Zilien innerhalb der Stichprobe (Anzahl der CBF=0/Gesamtzahl der CBF-Messwerte in der Stichprobe X 100). Drücken Sie den IMI als Mittelwert (SD) oder (95%-KI) aus1,16,31.
- Berechnen Sie den Dyskinesie-Score (DKS). Teilen Sie jede Flimmerkante in Quadranten, und die Anzahl der Quadranten mit dyskinetischen (oder abnormal schlagenden) Zilien wird bestimmt. Dadurch kann ein DKS zwischen 0 und 4 berechnet werden (0: normaler CBP am Rand; 1: abnormaler CBP bei ≤ 25 % der Zilien; 2: abnormaler CBP bei ≤ 50 % der Zilien; 3: abnormales Schlagmuster bei ≤ 75 % der Zilien; und 4: abnormaler CBP bei allen Zilien). Der Median DKS (Interquartilsabstand) wird für die Stichprobe16,29 berechnet.
- Berechnen Sie den Prozentsatz des normalen Schlags: definiert als der Prozentsatz der Zilien mit einem normalen CBP innerhalb der Probe (Anzahl der normalen CBP-Messwerte/Gesamtzahl der CBP-Messwerte für die Probe x100).
Ergebnisse
Um die Effizienz der Technik zu veranschaulichen, präsentieren wir die Ergebnisse der CFA in einer Serie von 16 gesunden erwachsenen Probanden (5 Männer, Altersspanne 22-54 Jahre).
Nasenputzproben von 14 (4 Männer, Altersspanne 24-54 Jahre) von insgesamt 16 Probanden lieferten genügend geeignete Epithelränder, die die für die Durchführung einer CFA erforderlichen Auswahlkriterien erfüllten. Von diesen 14 Nasenputzproben wurden insgesamt 242 Flimmerränder erfasst, von denen 212 die def...
Diskussion
Dieses Papier zielt darauf ab, ein Standardverfahren für CFA unter Verwendung von Nasenbürstenproben bereitzustellen, wobei Anpassungen für angemessene Überlegungen zur Infektionskontrolle während der COVID-19-Pandemie vorgenommen wurden. Die PCD-Diagnose ist eine Herausforderung und erfordert derzeit gemäß internationaler Empfehlung eine Reihe verschiedener diagnostischer Tests, darunter nasale Stickstoffmonoxidmessung, CFA mit DHSV, ziliäre Ultrastrukturanalyse mit Transmissionselektronenmikroskopie (TEM), Mark...
Offenlegungen
Diese Autoren haben nichts zu offenbaren.
Danksagungen
Wir bedanken uns bei Jean-François Papon, Bruno Louis, Estelle Escudier und allen Teammitgliedern des PCD-Diagnosezentrums von Paris-Est für ihre Verfügbarkeit und den herzlichen Empfang während des Besuchs in ihrem PCD-Diagnosezentrum und den zahlreichen Austausch. Wir danken auch Robert Hirst und allen Teammitgliedern im PCD-Zentrum von Leicester für ihren Empfang und ihre Zeit, ihren Rat und ihr Fachwissen.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
Referenzen
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten