Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein plattenbasierter Assay zur Messung der endogenen Monoaminfreisetzung in akuten Hirnschnitten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Methode führt eine einfache Technik zum Nachweis der endogenen Monoaminfreisetzung unter Verwendung akuter Hirnschnitte ein. Das Setup verwendet eine 48-Well-Platte, die einen Gewebehalter für die Monoaminfreisetzung enthält. Freigesetztes Monoamin wird mittels HPLC in Verbindung mit elektrochemischem Nachweis analysiert. Darüber hinaus bietet diese Technik eine Screening-Methode für die Arzneimittelentdeckung.
Zusammenfassung
Monoamin-Neurotransmitter sind mit zahlreichen neurologischen und psychiatrischen Erkrankungen verbunden. Tiermodelle solcher Zustände haben Veränderungen in der Freisetzungs- und Aufnahmedynamik von Monoamin-Neurotransmittern gezeigt. Technisch komplexe Methoden wie Elektrophysiologie, Fast Scan Cyclic Voltammetry (FSCV), Bildgebung, In-vivo-Mikrodialyse, Optogenetik oder die Verwendung von Radioaktivität sind erforderlich, um die Monoaminfunktion zu untersuchen. Die hier vorgestellte Methode ist ein optimierter zweistufiger Ansatz zum Nachweis der Monoaminfreisetzung in akuten Hirnschnitten unter Verwendung einer 48-Well-Platte mit Gewebehaltern zur Untersuchung der Monoaminfreisetzung und einer Hochleistungsflüssigkeitschromatographie in Verbindung mit elektrochemischer Detektion (HPLC-ECD) zur Messung der Monoaminfreisetzung. Kurz gesagt, Rattenhirnschnitte, die Regionen von Interesse enthielten, einschließlich präfrontaler Kortex, Hippocampus und dorsales Striatum, wurden mit einem Gewebeschneider oder Vibratom erhalten. Diese interessanten Regionen wurden aus dem gesamten Gehirn seziert und in einem mit Sauerstoff angereicherten physiologischen Puffer inkubiert. Die Lebensfähigkeit wurde während des gesamten Versuchszeitraums durch 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromid (MTT)-Assay untersucht. Die akut sezierten Hirnregionen wurden unter verschiedenen Medikamentenbedingungen inkubiert, von denen bekannt ist, dass sie die Monoaminfreisetzung durch den Transporter (Amphetamin) oder durch die Aktivierung der exozytotischen vesikulären Freisetzung (KCl) induzieren. Nach der Inkubation wurden die freigesetzten Produkte im Überstand gesammelt und durch ein HPLC-ECD-System analysiert. Hier wird die basale Monoaminfreisetzung mittels HPLC aus akuten Hirnschnitten nachgewiesen. Diese Daten unterstützen frühere In-vivo- und In-vitro-Ergebnisse, die zeigen, dass AMPH und KCl die Monoaminfreisetzung induzieren. Diese Methode ist besonders nützlich für die Untersuchung von Mechanismen, die mit einer von Monoamintransportern abhängigen Freisetzung verbunden sind, und bietet die Möglichkeit, Verbindungen, die die Monoaminfreisetzung beeinflussen, schnell und kostengünstig zu screenen.
Einleitung
Eine Vielzahl von neurologischen und psychiatrischen Erkrankungen ist mit einer Dysregulation oder unzureichenden Aufrechterhaltung des Monoamin-Neurotransmitters (Dopamin [DA], Serotonin [5-HT], Noradrenalin [NE]) der Homöostase verbunden1,2,3. Zu diesen Erkrankungen gehören unter anderem Depressionen1,2, Schizophrenie2, Angstzustände2, Sucht4, Menopause5,6,7, Schmerzen8 und Parkinson3. Zum Beispiel haben mehrere Rattenmodelle der Menopause gezeigt, dass die Dysregulation oder Reduktion von Monoaminen im Hippocampus, im präfrontalen Kortex und im Striatum sowohl mit Depressionen als auch mit kognitivem Verfall verbunden sein kann, was bei Frauen in den Wechseljahren beobachtet wird. Die Dysregulation von Monoaminen in diesen Modellen wurde ausführlich mit HPLC-ECD untersucht, obwohl die Studien nicht zwischen dem gemessenen Neurotransmittergehalt und der Freisetzung von Neurotransmittern unterschieden5,6,7. Monoamine werden klassischerweise durch Ca2+-abhängige vesikuläre Freisetzung9 in den extrazellulären Raum freigesetzt und durch ihr jeweiliges Plasmamembran-Wiederaufnahmesystem (Dopamintransporter, DAT; Serotonintransporter, SERT; Noradrenalintransporter, NET) wieder recycelt 10,11. Umgekehrt deuten die Daten darauf hin, dass diese Transporter in der Lage sind, Monoamine freizusetzen oder auszuströmen, da für Missbrauchsdrogen wie Amphetamin (AMPH) und 3,4-Methylendioxymethamphetamin (MDMA) bekannt ist, dass sie DA bzw. 5-HT über ihre Transportersysteme freisetzen12,13,14,15,16,17 . Daher ist ein richtiges mechanistisches Verständnis der Monoaminfreisetzungsdynamik entscheidend für die Entwicklung spezifischer und zielgerichteter Pharmakotherapien.
Zur Untersuchung der Monoaminfreisetzung wurde eine breite Palette von Techniken eingesetzt, wie z. B. Fast Scan Cyclic Voltammetry (FSCV)18, In-vivo-Mikrodialyse13, Bildgebung19, Präinkubation mit radioaktiv markierten Monoaminen20, Optogenetik und in jüngerer Zeit genetisch kodierte Fluoreszenzsensoren und Photometrie21,22 . FSCV und In-vivo-Mikrodialyse sind die primären Techniken zur Untersuchung der Monoaminfreisetzung. FSCV wird verwendet, um die stimulierte exozytotische Freisetzung von hauptsächlich DA in akuten Hirnschnitten und in vivo23 zu untersuchen. Da FSCV Elektroden verwendet, um die Freisetzung zu stimulieren oder hervorzurufen, ist die primäre Quelle der Freisetzung von Neurotransmittern die Ca2 +-abhängige vesikuläre Freisetzung18,24,25,26,27,28,29,30,31 . Die In-vivo-Mikrodialyse in Verbindung mit HPLC misst Veränderungen der extrazellulären Neurotransmitterspiegel mit einer Sonde, die in einem Hirnareal von Interesse platziert wird13,32. Ähnlich wie bei FSCV ist eine wesentliche Einschränkung der In-vivo-Mikrodialyse die Schwierigkeit, die Quelle der Neurotransmitterfreisetzung zu bestimmen: Ca2+-abhängige vesikuläre Freisetzung oder Transporterabhängigkeit. Bemerkenswert ist, dass beide Methoden die direkte Messung der Monoaminfreisetzung ermöglichen. Durch die jüngste Weiterentwicklung der Optogenetik zeigt die Forschung den Nachweis einer 5-HT- und DA-Freisetzung in kurzer Zeit mit exquisiter Zelltypspezifität21,22. Diese Strategien erfordern jedoch komplexe und kostspielige Techniken und Geräte und messen indirekt die Monoaminfreisetzung, insbesondere durch Monoaminbindung an Rezeptoren. Darüber hinaus werden radioaktiv markierte Monoamine auch zur Untersuchung der Monoamindynamik verwendet. Radioaktiv markierte Monoamine können in verschiedene Modellsysteme vorgeladen werden, wie z.B. heterologe Zellen, die jeden Monoamintransporter überexprimieren20,33,34,35,36,37,38,39,40, primäre Neuronen20, Synaptosomen33,39,41, 42 und akute Hirnschnitte43,44. Radioaktivität stellt jedoch einen potenziellen Schaden für den Experimentator dar, und die tritiummarkierten Analyten rekapitulieren möglicherweise nicht getreu die endogene Monoamindynamik45,46. Superfusionssysteme in Kombination mit Offline-Nachweismethoden wie HPLC-ECD haben den Nachweis von Monoaminen aus mehreren Gewebequellen ermöglicht. Hier bietet dieses Protokoll als optimierte und kostengünstige, einfache und präzise Methode unter Verwendung akuter Hirnschnitte, um die endogene basale und stimulierte Monoaminfreisetzung direkt zu messen.
Akute Hirnschnitte ermöglichen das Testen mechanistischer Hypothesen, vor allem, da sie die anatomische In-vivo-Mikroumgebung erhalten und intakte Synapsen beibehalten47,48,49,50,51,52. In einigen Studien wurden akute Hirnschnitte oder gehacktes Hirngewebe in Verbindung mit einer Superfusionstechnik verwendet, bei der KCl zur Stimulierung der Ca2+-vermittelten Freisetzung verwendet wurde53,54,55,56. Superfusionssysteme waren entscheidend, um das Verständnis der Freisetzungsmechanismen von Neurotransmittern, einschließlich Monoaminen, voranzutreiben. Diese Systeme sind jedoch relativ teuer, und die Anzahl der für die Gewebeanalyse verfügbaren Kammern reicht von 4 bis 12. Im Vergleich dazu ist die hier vorgestellte Methode kostengünstig, ermöglicht die Messung von 48 Gewebeproben und kann auf bis zu 96 Gewebeproben verfeinert werden. Jede Vertiefung innerhalb der 48-Well-Platte enthält Gewebehalter, die Filter verwenden, um das freigesetzte Produkt vom Gewebe zu trennen, und freigesetzte Monoamine werden dann gesammelt und durch HPLC-ECD analysiert. Wichtig ist, dass diese Methode die gleichzeitige Messung der 5-HT-, DA- und NE-Freisetzung aus verschiedenen Gehirnbereichen wie dem präfrontalen Kortex, dem Hippocampus und dem dorsalen Striatum nach behandlung mit pharmakologischen Wirkstoffen ermöglicht, die die Monoaminfreisetzung modulieren. So kann der Experimentator mehrere Fragen mit einem kostengünstigen Multi-Well-System beantworten, das die Anzahl der getesteten Proben erhöht und dadurch die Anzahl der verwendeten Tiere reduziert.
Protokoll
Alle Experimente, einschließlich tierexperimenteller Handhabung und Gewebeentnahme, wurden in Übereinstimmung mit der University of Florida und dem City College of New York Institutional Animal Care and Use Committee (IACUC) nach den genehmigten Protokollen 201508873 (UF) und 1071 (CCNY) durchgeführt. Reagenzien und Puffer entnehmen Sie bitte der Ergänzungsdatei.
1. Bereiten Sie akute Rattenhirnschnitte vor
ANMERKUNG: In diesem Versuch wurden erwachsene männliche Ratten (250-350 g) verwendet. Diese Anordnung ist jedoch für verschiedene Entwicklungspunkte, weibliche Ratten und andere Arten funktionsfähig. Wenn Sie ein kleineres Tier wie Mäuse verwenden, kann der Experimentator das Protokoll optimieren, indem er eine andere Anzahl von Gehirnschnitten oder Schlägen pro Bedingung verwendet. Der Dissektionspuffer wird als Puffer 1 bezeichnet. Efflux-Puffer wird als Puffer 2 bezeichnet.
- Bereiten Sie Puffer 1 wie in der Ergänzungsdatei erwähnt vor. Puffer 1 mit Sauerstoff sättigen, indem Sie mit 95%/5% (O2/CO2) für 20 min auf Eis sprudeln. Entfernen Sie 50 ml Puffer 1 und kühlen Sie auf Eis in einem kleinen Becherglas oder einer Petrischale. Dieser Puffer wird verwendet, um das akut geerntete ganze Gehirn zu halten.
- Betäuben Sie eine oder zwei erwachsene Ratten (250-350 g) mit 1% -2% Isofluran, enthaupten Sie sie mit einer Guillotine und entfernen Sie schnell ihr Gehirn. Legen Sie das Gehirn sofort in eiskalten, mit Sauerstoff angereicherten Puffer 1 in den Behälter aus Schritt 1.1.
HINWEIS: Stellen Sie sicher, dass Isofluran und Guillotine sicher verwendet werden. Öffnen Sie Isofluran unter einem Abzug. - Schneiden Sie mit einem Vibratom oder Kompresstom 300 μm koronale Hirnschnitte aus jeder Region von Interesse (Abbildung 1). Bubbling Buffer 1 muss vorhanden sein, während Abschnitte erstellt werden. Mit einem Edelstahlspatel vorsichtig und sofort Gehirnscheiben in eine neue Petrischale geben, die mit eiskaltem, sauerstoffhaltigem Puffer 1 gefüllt ist (Abbildung 2).
- Weitere sezieren Sie Gehirnschnitte (z. B. Stempel, ausgeschnitten), indem Sie die Scheiben vorsichtig zu Glasobjektträgern bewegen (Abbildung 1G) mit Hilfe des Rattengehirnatlas57. Identifizieren Sie zum Beispiel das dorsale Striatum basierend auf seiner dunklen, gestreiften Struktur und identifizieren Sie den Hippocampus basierend auf seiner Nähe zum Kortex und seiner einzigartigen Spiralstruktur. Die rechte und linke Hemisphäre können getrennt werden, um sie als Kontroll- und Versuchsscheiben zu verwenden (Abbildungen 2G - H). Hier wurde das dorsale Striatum weiter in 2 mm Stempel zerlegt (Abbildung 1G).
- Mit einer Kunststoff-Transferpipette mit abgeschnittener Spitze werden Scheiben oder Gehirnstempel in kleine Behälter übertragen, die in sauerstoffhaltigen eiskalten Puffer 1 mit sauerstoffsprudelndem Sauerstoff eingetaucht sind. Diese Behälter können aus Edelstahlgewebe oder kleinen Petrischalen bestehen, die mit Puffer gefüllt sind (Abbildung 1H).
2. Ex-vivo endogene Monoaminfreisetzung aus Hirnschnitten oder -schlägen
HINWEIS: Das für diesen Abschnitt verwendete Gerät besteht aus einer 48-Well-Platte und einem Gewebehalter aus sechs Mikrozentrifugenfiltereinheiten, ohne dass die Einschubfilter an eine Carbogen-Linie angeschlossen sind (Abbildung 2). Um den Halter herzustellen, verwenden Sie einen stabilen Kunststoffstab (z. B. aus einem Zellabstreifer) und kleben Sie die Mikrozentrifugenfiltereinheiten ohne die Einschubfilter darauf. Lassen Sie es 1-2 Tage trocknen. Die für das endogene Monoaminfreisetzungsexperiment erforderliche Zeit und die Konzentrationen von Amphetamin, Fluoxetin und Kokain basieren auf der aktuellen Literatur und früheren Protokollen13,20,58.
-
Gewebeaktivierung
- Übertragen Sie das Hirngewebe von Schritt 1.1.5 in jede Vertiefung der Austrittskammer und ermöglichen Sie die Erholung für 30-50 min bei 37 ° C auf einem Objektträgerwärmer in 0,5-1 ml sauerstoffreichem Puffer 2 mit konstantem, sanftem Blubbern (Abbildung 2B1).
- Verdünnen Sie während dieser Inkubation die Arzneimittel auf die für das Experiment gewünschte Konzentration. Alle Medikamente müssen in Puffer 2 gelöst werden, und die Konzentrationen basieren auf der aktuellen Literatur.
-
Erste Inkubation
- Den Gewebehalter mit Hirngewebe zu Vertiefungen mit 500 μL sauerstoffreichem Puffer 2 bewegen und 20 min bei 37 °C inkubieren. Stellen Sie sicher, dass ein minimaler bis gar kein Puffer transportiert wird, indem Sie auf den Halter am Rand des Bohrlochs klopfen, bis sich kein überschüssiger Puffer mehr im Halter befindet.
- In Experimenten mit pharmakologischen Wirkstoffen wie Monoamintransporter-Inhibitoren werden die Gewebeproben mit den in sauerstoffhaltigem Puffer 2 verdünnten Arzneimitteln (z. B. 10 μM Fluoxetin, 40 μM Kokain; siehe Abbildung 2B2) inkubiert. Das Endvolumen in jeder Vertiefung beträgt 500 μL.
-
Zweite Inkubation
- Bewegen Sie den Halter mit dem Gewebe zu einem neuen Satz von Vertiefungen, die 500 μL Gesamtpuffer 2 mit oder ohne die gewünschte Konzentration jedes Arzneimittels enthalten. Stellen Sie sicher, dass kein überschüssiger Puffer übrig bleibt. Jede Vertiefung stellt ein n = 1 für experimentelle Bedingungen dar. Jede Versuchsbedingung wird in dreifacher Ausfertigung durchgeführt.
- Eine Vertiefung enthält einen sauerstoffhaltigen Puffer 2, die nächste 10-30 μM AMPH und die letzte Vertiefung enthält 10-30 μM AMPH plus Monoamintransporterinhibitoren. Jedes Medikament ist in sauerstoffhaltigem Puffer 2 gelöst.
- Inkubieren Sie das Gewebe für 20 min bei 37 ° C mit 500 μL des Arzneimittelzustands.
HINWEIS: Zusätzliche Vertiefungen können einen sauerstoffhaltigen hohen K+ Puffer 2 mit oder ohne die Monoamintransporterinhibitoren enthalten. Lösen Sie jedes Medikament in dem mit Sauerstoff angereicherten Puffer 2 (500 μL) auf. - Während dieser zweiten Inkubation von 20 min wird die Lösung aus den Vertiefungen aus der ersten Inkubation in Schritt 2.2.1 gesammelt und in Mikrozentrifugenröhrchen mit 50 μL 1 N Perchlorsäure oder Phosphorsäure (abhängig von der Art der HPLC, Endkonzentration 0,1 N) überführt. Das Endvolumen der Probe beträgt 550 μL. Halten Sie die Mikrozentrifugenröhrchen auf Eis und beschriften Sie die Röhrchen Nr. 1.
- Nach der zweiten Inkubation von 20 min den Gewebehalter mit Hirnschnitten oder Schlägen zu einem leeren Brunnen bewegen und die Platte auf Eis halten. Den Überstand in Mikrozentrifugenröhrchen mit 50 μL 1 N Perchlorsäure oder Phosphorsäure überführen. Das Endvolumen der Probe beträgt 550 μL. Halten Sie die Mikrozentrifugenröhrchen auf Eis und beschriften Sie die Röhrchen Nr. 2.
- Fügen Sie 1 ml eiskalten Puffer 1 zu jedem Vertiefungsgewebe hinzu, das Gewebe enthält. Sammeln Sie das gesamte Gewebe mit einer kleinen Pinzette und übertragen Sie es in saubere Mikrozentrifugenröhrchen.
- Schläuche mit Hirngewebe bei -80 °C halten. Verwerfen Sie die 1 ml Puffer 1 (Abbildung 2B4).
- Filterlösungen, die aus jeder Inkubation unter Verwendung von Mikrozentrifugenfilterröhrchen (0,22 μm) bei 2.500 x g für 2 minuten erhalten werden. Verwenden Sie das Filtrat, um den Monoamingehalt mittels HPLC mit elektrochemischem Nachweis zu bestimmen (Abbildung 2B5).
3. Lebensfähigkeit des Gewebes
- MTT-Assay
HINWEIS: Ein wesentliches Problem in Bezug auf diesen Versuchsaufbau ist die Lebensfähigkeit des Gewebes, da das Gewebe bis zu mehreren Stunden verwendet werden kann59. Ein MTT-Assay60,61 wird verwendet, um die Lebensfähigkeit des Gewebes am Ende des Experiments zu bestimmen. Dieser Assay basiert auf der Umwandlung des gelben Tetrazoliumsalzes MTT (3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromid) in violette Formazankristalle durch lebensfähige Zellen mit ausreichendem Metabolismus.- Halten Sie nach dem Experiment eine separate Gruppe von Gewebeproben aufrecht und teilen Sie sie in zwei Gruppen auf.
- Inkubieren einer Gruppe für 20 min bei 37 °C in Triton X-100 (1%), gelöst in Puffer 2 als Kontrolle. Die Behandlung mit Triton X-100 führt zum Zelltod. Behalten Sie die zweite Gruppe in Puffer 2 bei und inkubieren Sie nicht in Triton X-100 (Gewebelebensfähigkeitskontrolle).
- MTT (Stammlösung 5 mg/ml in PBS, pH 7,4) zu beiden Gruppen im sauerstoffhaltigen Puffer 2 bis zu einer Endkonzentration von 0,5 mg/ml gegeben.
- Die Gewebeproben für 20 min bei 37 °C inkubieren, mit PBS waschen und in Mikrozentrifugenröhrchen mit 250 μL einer Mischung aus SDS (10%, w/v), DMF (25%, v/v) und Wasser überführen, um die Formazankristalle aufzulösen.
- Inkubieren Sie die Proben für 24 h.
- Zentrifugieren Sie die Röhrchen bei 10.000 x g für 10 min und messen Sie die Absorption des Überstands (200 μL) bei 562 nm und 690 nm mit einem Mikrotiterplattenleser. Die Lebensfähigkeit des Gewebes wird wie folgt berechnet: (A562-A690) / Gewebegewicht.
4. HPLC-Analyse von Monoaminen
- Quantifizieren Sie die Monoaminfreisetzung aus jeder experimentellen Bedingung unter Verwendung von HPLC-ECD gemäß früheren Protokollen13,44 unter Verwendung einer Umkehrphasensäule.
- Bereiten Sie die für die Erkennung erforderliche mobile Phase vor. Diese besteht aus 100 mM Phosphorsäure, 100 mM Zitronensäure, 0,1 mM EDTA-Na2, 600 mg/L Oktansulfonsäure, 8% v/v Acetonitril (End-pH 6,0). Die Zusammensetzung der mobilen Phase ist abhängig von der Art der HPLC und der verwendeten Säule.
- Stellen Sie das Potential des elektrochemischen Detektors (2 mm glasige Kohlenstoffelektrode) auf 0,46 V und den Durchfluss auf 0,05 ml/min ein.
- Laden Sie 5 μL jeder Probe, einschließlich Neurotransmitterstandards, in die HPLC für die Autoinjektion und den Nachweis. Die Menge jeder zugesetzten Probe hängt von der Art der verwendeten HPLC ab.
- Sobald die HPLC den Lauf abgeschlossen hat, verwenden Sie die angegebene HPLC-Analysesoftware, um die Chromatographendaten zu erfassen und zu analysieren.
- Analysieren Sie den Monoamingehalt anhand einer Standardkurve, die aus jedem Monoamin besteht (Dopamin: DA, Noradrenalin: NE und Serotonin: 5-HT; Abbildung 2C). Verwenden Sie die resultierenden Chromatogramme, um die Fläche unter der Kurve (AUC) basierend auf den Richtlinien des Herstellers zu erhalten.
5. Vorbereitung von Gewebelysaten für die Proteinquantifizierung
-
Protein-Assay
- Fügen Sie eisgekühlten Lysepuffer plus Proteaseinhibitoren (0,1 g/1 ml) zu jedem Mikrozentrifugenröhrchen hinzu, das Gehirnabschnitte / Stempel enthält, und homogenisieren Sie es mit einem Stößelhomogenisator. Die Mikrozentrifugenröhrchen müssen während der Homogenisierung auf Eis gehalten werden, um den Proteinabbau zu verhindern.
- Inkubationsgewebe homogenisiert für 1 h bei 4 °C mit leichter Rotation.
- Zentrifugengewebe homogenisiert bei 16.000 x g für 15 min bei 4 °C und gewinnt den Überstand zurück.
- Bestimmen Sie die Proteinkonzentration in den Überständen mit Rinderserumalbumin (BSA) als Standard.
- Normalisieren Sie den Monoamingehalt in jeder Gehirnprobe auf den Gesamtgehalt an Protein (μg), gemessen in 250 μL des lysierten Hirngewebes. Verwenden Sie die folgende Formel, um das nmol-Monoamin/g-Protein zu bestimmen. df = Verdünnungsfaktor.
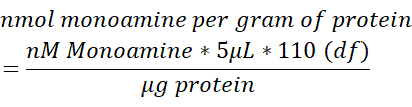
6. Statistische Auswertung
- Analysieren Sie die Monoaminfreisetzung (nmol / g) unter Verwendung einer Einweg-ANOVA, gefolgt von Sidaks Mehrfachvergleichstest für Post-hoc-Vergleiche.
- Analysieren Sie die Lebensfähigkeit des Gewebes mit einem t-Test eines ungepaarten Schülers für unabhängige Gruppen (Kontrolle vs. 1% Triton X-100).
- Legen Sie für alle statistischen Analysen den Alpha-Wert auf ≤ 0,05 fest.
Ergebnisse
Diese Technik beschreibt die Verwendung von Hirnschnitten zur Messung der Freisetzung von endogenen Monoaminen mittels HPLC mit elektrochemischer Detektion basierend auf einer 48-Well-Platte mit einem internen Gewebehalter. Der Versuchsaufbau ist in Abbildung 1 und Abbildung 2 dargestellt. Um die Lebensfähigkeit des Gewebes bis zum Ende der Experimente sicherzustellen, wurde zunächst ein MTT-Assay (3-(4,5-Dimethylthiazol-2-yl)-...
Diskussion
Monoaminfreisetzungsmessungen werden seit Jahren in einer Reihe von Systemen wie heterologen Zellen, neuronalen Kulturen, Gehirnsynaposomen, ex vivo akuten Hirnschnitten und ganzen Tieren durchgeführt13,20,41,42,58,64,65,66,67,68
Offenlegungen
Die Autoren haben keine Offenlegungen.
Danksagungen
Diese Arbeit wurde durch die Zuschüsse Fondecyt Initiation Fund N 11191049 an J.A.P. und den NIH-Zuschuss DA038598 an G.E.T. unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 48 Well plate | NA | NA | Assay |
| Acetonitrile | Fischer Scientific | A998-1 | Mobile Phase |
| Calcium Chloride Ahydrous | Sigma Aldrich | C1016 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Clarity Software | Anetc | ||
| Citric Acid | Sigma Aldrich | Mobile Phase | |
| D-(+)-Glucose | Sigma | 1002608421 | Dissection Buffer |
| DMF | Sigma Aldrich | D4551 | MTT Assay |
| EDTA-Na2 | Sigma Aldrich | Mobile Phase | |
| GraphPad Software | Graphpad Software, Inc | Statistical Analysis | |
| Glycerol | Sigma Aldrich | G5516 | Lysis buffer |
| HEPES | Sigma Aldrich | H3375 | Lysis buffer |
| HPLC, Decade Amperometric | Anetc | HPLC, LC-EC system | |
| HPLC | Amuza | HPLC HTEC-510. | |
| L-Asrobic Acid | Sigma Aldrich | A5960 | Dissection Buffer |
| Magnesium Sulfate | Sigma | 7487-88-9 | KH Buffer |
| Microcentrifuge Filter Units UltraFree | Millipore | C7554 | Assay - 6 to fit in 48 well plate |
| MTT | Thermo Fisher | M6494 | MTT Assay |
| Nanosep | VWR | 29300-606 | Assay; protein assay |
| Octanesulfonic acid | Sigma Aldrich | V800010 | Mobile Phase |
| Pargyline Clorohydrate | Sigma Aldrich | P8013 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Phosphoric Acid | Sigma Aldrich | Mobile Phase | |
| Potassium Chloride | Sigma | 12636 | KH Buffer |
| Potassium Phosphate Monobasic | Sigma | 1001655559 | KH Buffer |
| Precisonary VF-21-0Z | Precissonary | Compresstome | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P2714 | Lysis buffer. |
| Sodium Bicarbonate | Sigma | S5761 | Dissection Buffer |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | Dissection Buffer |
| Sodium Chloride | Sigma | S3014 | KH Buffer |
| Sodium Dodecyl Sulfate | Sigma Aldrich | L3771 | Lysis buffer |
| Triton X-100 | Sigma Aldrich | T8787 | MTT Assay / Lysis buffer |
Referenzen
- Jesulola, E., Micalos, P., Baguley, I. J. Understanding the pathophysiology of depression: From monoamines to the neurogenesis hypothesis model - are we there yet. Behavioural Brain Research. 341, 79-90 (2018).
- Krystal, J. H., D'Souza, D. C., Sanacora, G., Goddard, A. W., Charney, D. S. Current perspectives on the pathophysiology of schizophrenia, depression, and anxiety disorders. Medical Clinics of North America. 85 (3), 559-577 (2001).
- Barone, P. Neurotransmission in Parkinson's disease: beyond dopamine. European Journal of Neurology. 17 (3), 364-376 (2010).
- Howell, L. L., Kimmel, H. L. Monoamine transporters and psychostimulant addiction. Biochemical Pharmacology. 75 (1), 196-217 (2008).
- Kirshner, Z. Z., et al. Impact of estrogen receptor agonists and model of menopause on enzymes involved in brain metabolism, acetyl-CoA production and cholinergic function. Life Sciences. 256, 117975 (2020).
- Long, T., et al. Comparison of transitional vs surgical menopause on monoamine and amino acid levels in the rat brain. Molecular and Cellular Endocrinology. 476, 139-147 (2018).
- Long, T., et al. Estradiol and selective estrogen receptor agonists differentially affect brain monoamines and amino acids levels in transitional and surgical menopausal rat models. Molecular and Cellular Endocrinology. 496, 110533 (2019).
- Burke, N. N., et al. Enhanced nociceptive responding in two rat models of depression is associated with alterations in monoamine levels in discrete brain regions. Neuroscience. 171 (4), 1300-1313 (2010).
- Lane, J. D., Aprison, M. H. Calciumm-dependent release of endogenous serotonin, dopamine and norepinephrine from nerve endings. Life Sciences. 20 (4), 665-671 (1977).
- Ramamoorthy, S., Shippenberg, T. S., Jayanthi, L. D. Regulation of monoamine transporters: Role of transporter phosphorylation. Pharmacology and Therapeutics. 129 (2), 220-238 (2011).
- Torres, G. E., Gainetdinov, R. R., Caron, M. G. Plasma membrane monoamine transporters: structure, regulation and function. Nature Reviews. Neuroscience. 4 (1), 13-25 (2003).
- Hilber, B., et al. Serotonin-transporter mediated efflux: A pharmacological analysis of amphetamines and non-amphetamines. Neuropharmacology. 49 (6), 811-819 (2005).
- Mauna, J. C., et al. G protein βγ subunits play a critical role in the actions of amphetamine. Translational Psychiatry. 9 (1), 81 (2019).
- Sitte, H. H., Freissmuth, M. Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends in Pharmacological Sciences. 36 (1), 41-50 (2015).
- Johnson, L. A., Guptaroy, B., Lund, D., Shamban, S., Gnegy, M. E. Regulation of amphetamine-stimulated dopamine efflux by protein kinase C β. Journal of Biological Chemistry. 280 (12), 10914-10919 (2005).
- Kahlig, K. M., et al. Amphetamine induces dopamine efflux through a dopamine transporter channel. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3495-3500 (2005).
- Kantor, L., Hewlett, G. H. K., Gnegy, M. E. Enhanced amphetamine- and K+ -mediated dopamine release in rat striatum after repeated amphetamine: differential requirements for Ca 2+ - and calmodulin-dependent phosphorylation and synaptic vesicles. The Journal of Neuroscience. 19 (10), 3801-3808 (2018).
- Brodnik, Z. D., et al. Susceptibility to traumatic stress sensitizes the dopaminergic response to cocaine and increases motivation for cocaine. Neuropharmacology. 125, 295-307 (2017).
- Henke, A., et al. Toward serotonin fluorescent false neurotransmitters: development of fluorescent dual serotonin and vesicular monoamine transporter substrates for visualizing serotonin neurons. ACS Chemical Neuroscience. 9 (5), 925-934 (2018).
- Garcia-Olivares, J., et al. Gβγ subunit activation promotes dopamine efflux through the dopamine transporter. Molecular Psychiatry. 22 (12), 1673-1679 (2017).
- Xiao, N., Privman, E., Venton, B. J. Optogenetic control of serotonin and dopamine release in Drosophila larvae. ACS Chemical Neuroscience. 5 (8), 666-673 (2014).
- Bass, C. E., et al. Optogenetic control of striatal dopamine release in rats. Journal of Neurochemistry. 114 (5), 1344-1352 (2010).
- Stamford, J. A. Fast cyclic voltammetry: measuring transmitter release in "real time". Journal of Neuroscience Methods. 34 (1-3), 67-72 (1990).
- Brodnik, Z. D., Ferris, M. J., Jones, S. R., España, R. A. Reinforcing doses of intravenous cocaine produce only modest dopamine uptake inhibition. ACS Chemical Neuroscience. 8 (2), 281-289 (2017).
- Brodnik, Z. D., España, R. A. Dopamine uptake dynamics are preserved under isoflurane anesthesia. Neuroscience Letters. 606, 129-134 (2015).
- Ferris, M. J., Calipari, E. S., Yorgason, J. T., Jones, S. R. Examining the complex regulation and drug-induced plasticity of dopamine release and uptake using voltammetry in brain slices. ACS Chemical Neuroscience. 4 (5), 693-703 (2013).
- Siciliano, C. A., Calipari, E. S., Ferris, M. J., Jones, S. R. Biphasic mechanisms of amphetamine action at the dopamine terminal. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 34 (16), 5575-5582 (2014).
- Rice, M. E., et al. Direct monitoring of dopamine and 5-HT release in substantia nigra and ventral tegmental area in vitro. Experimental Brain Research. 100 (3), 395-406 (1994).
- Bunin, M. A., Prioleau, C., Mailman, R. B., Wightman, R. M. Release and uptake rates of 5-hydroxytryptamine in the dorsal raphe and substantia nigra reticulata of the rat brain. Journal of Neurochemistry. 70 (3), 1077-1087 (1998).
- Park, J., Takmakov, P., Wightman, R. M. In vivo comparison of norepinephrine and dopamine release in rat brain by simultaneous measurements with fast-scan cyclic voltammetry. Journal of Neurochemistry. 119 (5), 932-944 (2011).
- Park, J., Bhimani, R. V., Bass, C. E. In vivo electrochemical measurements of norepinephrine in the brain: current status and remaining challenges. Journal of the Electrochemical Society. 165 (12), 3051-3056 (2018).
- Butcher, S. P., Fairbrother, I. S., Kelly, J. S., Arbuthnott, G. W. Amphetamine-induced dopamine release in the rat striatum: an in vivo microdialysis study. Journal of Neurochemistry. 50 (2), 346-355 (1988).
- Garcia-Olivares, J., et al. Inhibition of dopamine transporter activity by G protein βγ subunits. PLoS One. 8 (3), 1-9 (2013).
- Carneiro, A. M. D., Blakely, R. D. Serotonin-, protein kinase C-, and Hic-5-associated redistribution of the platelet serotonin transporter. Journal of Biological Chemistry. 281 (34), 24769-24780 (2006).
- Rajamanickam, J., et al. Akt-mediated regulation of antidepressant-sensitive serotonin transporter function, cell-surface expression and phosphorylation. The Biochemical Journal. 468 (1), 177-190 (2015).
- Egaña, L. A., et al. Physical and functional interaction between the dopamine transporter and the synaptic vesicle protein synaptogyrin-3. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 29 (14), 4592-4604 (2009).
- Guptaroy, B., Fraser, R., Desai, A., Zhang, M., Gnegy, M. E. Site-directed mutations near transmembrane domain 1 alter conformation and function of norepinephrine and dopamine transporters. Molecular Pharmacology. 79 (3), 520-532 (2011).
- Ordway, G. A., et al. Norepinephrine transporter function and desipramine: Residual drug effects versus short-term regulation. Journal of Neuroscience Methods. 143 (2), 217-225 (2005).
- Steinkellner, T., et al. Amphetamine action at the cocaine- and antidepressant-sensitive serotonin transporter is modulated by CaMKII. Journal of Neuroscience. 35 (21), 8258-8271 (2015).
- Guptaroy, B., et al. A juxtamembrane mutation in the N terminus of the dopamine transporter induces preference for an inward-facing conformation. Molecular Pharmacology. 75 (3), 514-524 (2009).
- Carpenter, C., et al. Direct and systemic administration of a CNS-permeant tamoxifen analog reduces amphetamine-induced dopamine release and reinforcing effects. Neuropsychopharmacology. 42 (10), 1940-1949 (2017).
- Aquino-Miranda, G., Escamilla-Sánchez, J., González-Pantoja, R., Bueno-Nava, A., Arias-Montaño, J. -. A. Histamine H3 receptor activation inhibits dopamine synthesis but not release or uptake in rat nucleus accumbens. Neuropharmacology. 106, 91-101 (2016).
- Reddy, I. A., et al. Glucagon-like peptide 1 receptor activation regulates cocaine actions and dopamine homeostasis in the lateral septum by decreasing arachidonic acid levels. Translational Psychiatry. 6 (5), 809 (2016).
- Koutzoumis, D. N., et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson's disease. Experimental Neurology. 325, 113159 (2020).
- Herdon, H., Strupish, J., Nahorski, S. R. Differences between the release of radiolabelled and endogenous dopamine from superfused rat brain slices: Effects of depolarizing stimuli, amphetamine and synthesis inhibition. Brain Research. 348 (2), 309-320 (1985).
- Thongsaard, W., Kendall, D. A., Bennett, G. W., Marsden, C. A. A simple method for measuring dopamine release from rat brain slices. Journal of Pharmacological and Toxicological Methods. 37 (3), 143-148 (1997).
- Dorris, D. M., Hauser, C. A., Minnehan, C. E., Meitzen, J. An aerator for brain slice experiments in individual cell culture plate wells. Journal of Neuroscience Methods. 238, 1-10 (2014).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Papouin, T., Haydon, P. Obtaining acute brain slices. BIO-PROTOCOL. 8 (2), 477-491 (2018).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of Neuroscience Methods. 59 (1), 5-9 (1995).
- Yamamoto, C., McIlwain, H. Electrical activities in thin sections from the mammalian brain maintained in chemically-defined media in vitro. Journal of Neurochemistry. 13 (12), 1333-1343 (1966).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 4-10 (2014).
- Kako, H., Fukumoto, S., Kobayashi, Y., Yokogoshi, H. Effects of direct exposure of green odour components on dopamine release from rat brain striatal slices and PC12 cells. Brain Research Bulletin. 75 (5), 706-712 (2008).
- McBride, W. J., Murphy, J. M., Lumeng, L., Li, T. -. K. Effects of ethanol on monoamine and amino acid release from cerebral cortical slices of the alcohol-preferring P line of rats. Alcoholism: Clinical and Experimental Research. 10 (2), 205-208 (1986).
- Chen, J. C., Turiak, G., Galler, J., Volicer, L. Effect of prenatal malnutrition on release of monoamines from hippocampal slices. Life Sciences. 57 (16), 1467-1475 (1995).
- Becker, J. B., Castañeda, E., Robinson, T. E., Beer, M. E. A simple in vitro technique to measure the release of endogenous dopamine and dihydroxyphenylacetic acid from striatal tissue using high performance liquid chromatography with electrochemical detection. Journal of Neuroscience Methods. 11 (1), 19-28 (1984).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Dailey, J. W., Reith, M. E. A., Steidley, K. R., Milbrandt, J. C., Jobe, P. C. Carbamazepine-induced release of serotonin from rat hippocampus in vitro. Epilepsia. 39 (10), 1054-1063 (1998).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 5309 (2014).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice-A model for tauopathy studies. PLoS One. 7 (9), (2012).
- Rönicke, R., et al. AB mediated diminution of MTT reduction - An artefact of single cell culture. PLoS One. 3 (9), (2008).
- Ihalainen, J. A., Riekkinen, P., Feenstra, M. G. P. Comparison of dopamine and noradrenaline release in mouse prefrontal cortex, striatum and hippocampus using microdialysis. Neuroscience Letters. 277 (2), 71-74 (1999).
- Richards, D. A., Obrenovitch, T. P., Symon, L., Curzon, G. Extracellular dopamine and serotonin in the rat striatum during transient ischaemia of different severities: a microdialysis study. Journal of Neurochemistry. 60 (1), 128-136 (1993).
- Fog, J. U., et al. Calmodulin kinase II interacts with the dopamine transporter C terminus to regulate amphetamine-induced reverse transport. Neuron. 51 (4), 417-429 (2006).
- Balázsa, T., Bíró, J., Gullai, N., Ledent, C., Sperlágh, B. CB1-cannabinoid receptors are involved in the modulation of non-synaptic [3H]serotonin release from the rat hippocampus. Neurochemistry International. 52 (1), 95-102 (2008).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. The Journal of Pharmacology and Experimental Therapeutics. 282 (1), 262-270 (1997).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Molecular and Cellular Neuroscience. 39 (2), 211-217 (2008).
- Bowyer, J. F., et al. Interactions of MK-801 with glutamate-, glutamine- and methamphetamine-evoked release of [3H]dopamine from striatal slices. The Journal of Pharmacology and Experimental Therapeutics. 257 (1), 262-270 (1991).
- Perszyk, R. E., et al. GluN2D-containing N-methyl-D-aspartate receptors mediate synaptic transmission in hippocampal interneurons and regulate interneuron activity. Molecular Pharmacology. 90 (6), 689-702 (2016).
- Jones, S. R., et al. Profound neuronal plasticity in response to inactivation of the dopamine transporter. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 4029-4034 (1998).
- Jedema, H. P., Narendran, R., Bradberry, C. W. Amphetamine-induced release of dopamine in primate prefrontal cortex and striatum: striking differences in magnitude and timecourse. Journal of Neurochemistry. 130, 490-497 (2014).
- Buchmayer, F., et al. Amphetamine actions at the serotonin transporter rely on the availability of phosphatidylinositol-4,5-bisphosphate. Proceedings of the National Academy of Sciences. 110 (28), 11642-11647 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten