Method Article
Kurzzeit-Hypothermie-Induktion bei Ratten unter Verwendung von Modellen für Studien zur Untersuchung klinischer Relevanz und Mechanismen
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt zwei Methoden der Ganzkörper-Kurzzeit-Hypothermie-Induktion bei Ratten. Die erste, schnelle Induktionsmethode, verwendet eine aktive Kühlung mit Ventilatoren und Ethanolspray für eine schnelle Temperatursenkung. Die zweite Methode ist eine schrittweise Abkühlungsmethode. Dies wird durch die Kombination von Isoflurananästhesie und der Reduzierung der Temperatureinstellungen auf der homöothermischen Wärmematte erreicht. Dies führt zu einer allmählichen Abnahme der Körperkerntemperatur ohne den Einsatz externer Kühlgeräte.
Zusammenfassung
Therapeutische Hypothermie (TH) ist eine leistungsstarke neuroprotektive Strategie, die in präklinischen Studien zu neurologischen Erkrankungen robuste Beweise für die Neuroprotektion erbracht hat. Trotz starker präklinischer Evidenz hat TH in klinischen Studien zu den meisten neurologischen Erkrankungen keine Wirksamkeit gezeigt. Die einzigen erfolgreichen Studien mit therapeutischer Hypothermie betrafen Herzstillstand bei Erwachsenen und hypoxische ischämische Verletzungen bei Neugeborenen. Weitere Untersuchungen der Anwendungsparameter und Studiendesignvergleiche zwischen präklinischen und klinischen Studien sind gerechtfertigt. Dieser Artikel zeigt zwei Methoden der kurzzeitigen Hypothermie-Induktion. Die erste Methode ermöglicht eine schnelle Hypothermie-Induktion bei Ratten mit Ethanolspray und Ventilatoren. Diese Methode funktioniert durch Kühlung der Haut, die in klinischen Studien weniger häufig verwendet wurde und unterschiedliche physiologische Wirkungen haben kann. Die Abkühlung ist mit dieser Technik viel schneller, als dies bei menschlichen Patienten aufgrund von Unterschieden im Verhältnis von Oberfläche zu Volumen möglich ist. Darüber hinaus wird eine zweite Methode vorgestellt, die eine klinisch erreichbare Abkühlrate bei kurzzeitiger Hypothermie ermöglicht. Diese Methode ist einfach zu implementieren, reproduzierbar und erfordert keine aktive Hautkühlung.
Einleitung
TH ist die Praxis der Kühlung der Körper- oder Gehirntemperatur, um die Lebensfähigkeit und Funktion des Organs / Systems zu erhalten1,2. Die Rolle der Hypothermie bei der Neuroprotektion wurde untersucht und hat Vorteile in einer Reihe von präklinischen Modellen neurologischer Erkrankungen wie Schlaganfall3, Subarachnoidalblutung4und traumatischer Hirnverletzung5gezeigt . In Bezug auf klinische Anwendungen hat TH Wirksamkeit bei Patienten nach Herzstillstand und bei neonatalen hypoxisch-ischämischen Verletzungen gezeigt6.
Die TH-Induktion wird entweder mit oberflächen- oder endovaskulären Kühlmethoden erreicht. Die meisten präklinischen Hypothermiestudien führen eine Oberflächenkühlung durch Auftragen von Wasser oder Ethanol auf das Fell des Tieres oder durch Verwenden einer Kühldecke durch, um die Zieltemperatur zu erreichen1. Beim Menschen wird die systemische Oberflächenkühlung durch den Einsatz von Eisbeuteln und Kühldecken7,8erreicht. Eine schnellere Abkühlung wurde bei Patienten mit endovaskulären Methoden gezeigt, die eine Induktionsinfusion von kalter Kochsalzlösung durch einen intravenösen oder intraarteriellen Katheter mit der Platzierung eines endovaskulären Kühlgeräts in der unteren Hohlvene9,10 koppeln. Beispielsweise kann eine moderate Zieltemperatur von 33 °C in 1,5 h mit endovaskulärer Kühlung erreicht werden, verglichen mit 3-4 h mit Oberflächenkühlung bei Patienten11. Der endovaskuläre Ansatz ist in den letzten Jahren auch populärer geworden, da berichtet wurde, dass er einige der Nebenwirkungen reduziert, die bei der systemischen Oberflächenkühlung beobachtet werden, wie z. B. Zittern12,13. Die europäische multizentrische, randomisierte klinische Phase-III-Studie zur Hypothermie bei ischämischem Schlaganfall (EUROHYP-1) verwendete hauptsächlich Oberflächenkühlung14. Die kürzlich veröffentlichten Ergebnisse dieser Studie zeigten, dass Zittern eine große Komplikation war und die Fähigkeit, die Zieltemperatur zu erreichen, eingeschränkt haben könnte10. Es ist bekannt, dass die Schüttelreaktion in erster Linie von der Hauttemperatur angetrieben wird. Es wurden einige Anstrengungen unternommen, um eine endovaskuläre Kühlmethode für Nagetiere zu entwickeln15, aber die sehr invasive Natur der Technik im Vergleich zu der beim Menschen verwendeten könnte die Ergebnisse dieses Modells verwirren.
Die Temperatur ist der Schlüsselmodulator biologischer Prozesse im Körper und wird durch die Homöostase streng reguliert. Daher kann jede Manipulation der Körpertemperatur mit Risiken verbunden sein. Die Abkühldauer ist ein Faktor, der den Erfolg klinischer Hypothermie-Studien eingeschränkt haben könnte. Diese Studien verwenden eine Langzeitkühlmethode, wobei viele die Hypothermie von 24-72 h11 aufrechterhalten. Diese verlängerte Dauer stellt ein Infektionsrisiko während des Kühlprotokolls dar. Lungenentzündung ist die häufigste Komplikation durch Hypothermie und betrifft zwischen 40-50% der Patienten, die sich dem Eingriffunterziehen 13. Dies steht im Gegensatz zu dem, was normalerweise in Tierstudien zur Hypothermie beobachtet wird, wo ein Kurzzeitparadigma verwendet wird (1-6 h)3. Der Erfolg dieser präklinischen Tierversuche wird wahrscheinlich zur Anpassung der Kurzzeithypothermie für den Einsatz in klinischen Studien führen. Infolgedessen ist es notwendig, ein Tiermodell für kurzzeitige Hypothermie zu haben, das den Abkühlraten zukünftiger klinischer Studien ähnelt. Weitere Details zu anderen Temperaturparametern und zur Gültigkeit der kurzzeitigen Hypothermie wurden in mehreren Übersichtsartikeln1,16,17,18diskutiert.
Demonstriert wird hier ein allmähliches Modell der Abkühlung, das klinisch besser erreichbar ist als aktuelle experimentelle Hypothermiemodelle. Diese neuartige Methode hat eine viel langsamere Abkühlungsrate und daher liegt die Zeit bis zur Zieltemperatur näher an dem Bereich, der in klinischen Studien mit Hypothermie beobachtet wurde11. Es vermeidet auch die direkte Oberflächenkühlung, die spezifische physiologische Wirkungen hat, und kann daher eher mit der endovaskulären Kühlung vergleichbar sein, die in klinischen Studien die am häufigsten verwendete Kühlmethode war9,12. Dieses Modell ermöglicht es, die Tiere schrittweise über 2 h zu kühlen, gefolgt von einer kurzen Wartungszeit bei Zieltemperatur. Zusätzlich wird die schnell abkühlende Kurzzeit-Hypothermie-Methode19 demonstriert. Die Schnellkühlmethode ermöglicht es, die Zieltemperatur nach Beginn der Hypothermie schnell zu erreichen. Obwohl dieser Ansatz nicht so klinisch relevant ist wie die schrittweise Kühlmethode, ist er nützlich für Studien, die darauf abzielen, die Mechanismen der Hypothermie-Neuroprotektion zu untersuchen, um möglicherweise ihre starken neuroprotektiven Wirkungen pharmakologisch nachzuahmen. Diese Methode hat auch potenzielle Anwendungen außerhalb der Neurowissenschaften und könnte an eine beliebige Anzahl von präklinischen Studien angepasst werden. Ein weiterer Vorteil beider Methoden gegenüber anderen Ansätzen ist, dass sie kostengünstig sind und keine spezielle Ausrüstung erfordern. Schließlich zeigt dieses Protokoll auch die Implantation von Temperaturdatenloggern, da die postoperative Erwärmung und deren Überwachung wichtig sind, um eine versehentliche postoperative Hypothermie mit ihrem Potenzial zu verhindern, die Studienergebnisse zu verwirren20.
Protokoll
Alle experimentellen Verfahren entsprachen dem Australian Code of Practice for the Care and Use of Animals for Scientific Purposes und wurden von der Animal Care and Ethics Committee der University of Newcastle (A-2013-343 und A-2020-003) genehmigt. Zusätzlich zu den unten beschriebenen Hypothermie-Induktionsmethoden werden die folgenden Protokolle routinemäßig in Verbindung mit Hypothermie durchgeführt: Femurlinienkannulation zur Überwachung von Blutdruck und Herzfrequenz21und experimenteller Schlaganfall22.
1. Implantation des Datenloggers
HINWEIS: Das in diesem Protokoll verwendete Datenloggergerät war nicht in der Lage, die Körpertemperatur in Echtzeit auszulesen. Das Auslesen ist möglich, sobald der Datenlogger vom Tier entfernt und wieder an den Computer angeschlossen wurde. Infolgedessen wird der rektale Temperaturfühler verwendet, um Echtzeitinformationen während des Kühl- und Wiedererwarmungsprozesses bereitzustellen. Darüber hinaus ist die Rektalsonde für diese Methode ebenfalls von entscheidender Bedeutung, da die chirurgische Wärmematte, auf die das Tier während des Eingriffs gelegt wird, durch das rektale Sondensystem reguliert wird. Der Datenlogger dient auch einem wertvollen Zweck, Temperaturdaten bei sich frei bewegenden, wachen Ratten zu liefern und ist wichtig, um sicherzustellen, dass die normale Körpertemperatur nach der Wiederermärmung aufrechterhalten wird. Daher sind beide Temperaturüberwachungsgeräte für dieses Protokoll wichtig.
- Betäubung 10-12 Wochen alter männlicher Wistar-Ratte mit Isofluran (5% für Induktion und 2-2,5% für die Erhaltung) in einer 50% N2 und 50%O2 Mischung.
- Legen Sie die Ratte nach der Induktion in Bauchlage auf eine chirurgische Wärmematte.
- Positionieren Sie die Ratte so, dass die Nase im Nasenkegel sitzt. Sichern Sie die Nase mit chirurgischem Klebeband, um sicherzustellen, dass keine Gase entweichen.
- Rasieren Sie das Fell vom rechten Unterbauch und injizieren Sie die Stelle subkutan mit einem Lokalanästhetikum, Bupivacain 0,2 ml, 0,05%.
- Tragen Sie die antiseptische Lösung auf die frisch rasierte Region auf.
- Machen Sie mit sterilisierten chirurgischen Werkzeugen einen 2 cm langen Schnitt entlang der rechten Bauchregion, proximal zum rechten Oberschenkel. Machen Sie den Schnitt tief genug, um den Raum an der ventralen Oberschenkelfalte freizulegen.
- Verwenden Sie Hämostate und Eine Zette, um eine "Tasche" unter der Haut zu schaffen, die groß genug ist, um das Gerät zu halten.
- Stecken Sie den Temperaturüberwachungs-Datenlogger in die Tasche und verschließen Sie Muskel und Haut mit 5-0 Seidennähten. Die hier beschriebene subkutane Methode wird der intraperitonealen Methode vorgezogen, da sie weniger invasiv ist und eine bessere Genesung nach dem Eingriff ermöglicht.
- Stellen Sie sicher, dass Datenlogger und Rektalsonde für die Temperaturüberwachung kreuzkalibriert sind (siehe Diskussion).
- Stellen Sie sicher, dass der Datenlogger nach dem Einsetzen nicht gegen die Wärmematte des Tieres ruht, da dies die Temperaturmesswerte beeinflusst.
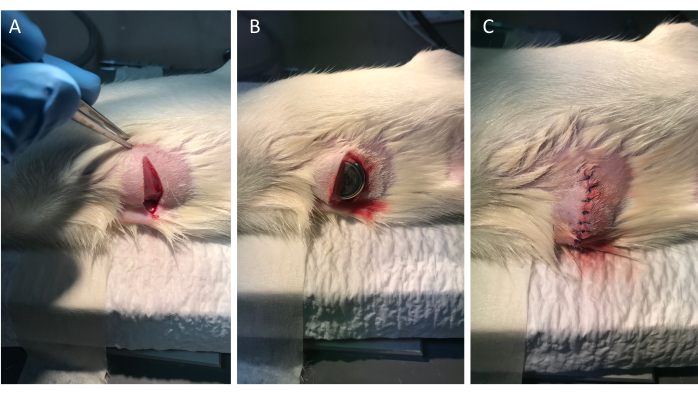
Abbildung 1: Implantation des Datenloggers. (A) Die Paneele von links nach rechts zeigen einen Schnitt von etwa 2 cm auf der rechten Seite des Unterbauchs der Ratte. (B) Der Temperaturüberwachungsdatenlogger wurde subkutan in den Taschenschnitt eingeführt. (C) Der Schnitt wurde mit Nylonnähten verschlossen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Induktion der aktiven (schnellen) Hypothermie für mechanistische Studien
- Für Hypothermie eingerichtet (siehe Abbildung 2). Platzieren Sie zwei Retortenständer mit Klemmen auf beiden Seiten des Rattenkörpers.
- Befestigen Sie an jedem Retortenständer einen 60 mm 12 v/130 mA Lüfter, um sicherzustellen, dass die Lüfter auf die untere Rückseite der Ratte gerichtet sind. Der Abstand zwischen der Klemme und der Ratte beträgt ca. 20 cm. Der verwendete Lüfter muss eine Drehzahl von 4.000 U/min haben.
- Halten Sie eine Tierwärmelampe entweder an der Seite oder auf einem dritten Retortenständer bereit.
- Beginnen Sie mit der Unterkühlung, indem Sie die tierische Wärmematte auf die gewünschte Zieltemperatur einstellen. In diesem Beispiel ist 32,5 °C die Zieltemperatur (3,75 auf dem Temperiergerät).
- Schalten Sie beide Ventilatoren ein und tragen Sie drei bis vier Sprays aus 70% Ethanol (Standard-Kunststoff-Sprühflasche) auf die untere Rückseite der Ratte auf. RüschenTierfell beim Sprühen für eine schnellere Kühlinduktion.
HINWEIS: Ethanol wird als bevorzugte Lösung gegenüber Wasser verwendet, da es eine schnellere Verdunstungsrate auf hat und daher zu einer schnelleren Hypothermieinduktion führt. - Achten Sie darauf, das Fell nicht zu übersättigen, da dies dazu beitragen kann, die Zieltemperatur zu überschießen.
HINWEIS: Die Lüfter beschleunigen die Ethanolverdampfung und den Kühlprozess. - Erlauben Sie kurze Intervalle zwischen Ethanolanwendungen, während Sie die Rektaltemperatur der Ratte genau im Auge behalten.
- Beenden Sie jede weitere Anwendung von Ethanol, sobald die Rektaltemperatur innerhalb von 1 °C der Zieltemperatur liegt.
- Schalten Sie beide Lüfter aus, sobald die Temperatur innerhalb von 0,5 °C der Zieltemperatur (in diesem Fall 33 °C) erreicht ist.
HINWEIS: Das Ausschalten der Lüfter, bevor die Zieltemperatur erreicht ist, verhindert, dass die Ratte über die erforderliche Temperatur hinaus überkühlt. - Lassen Sie die Temperatur auf 32,5 °C fallen.
- Wenn eine Überkühlung auftritt, verwenden Sie die Tierwärmelampe, um das Tier leicht wieder auf das Ziel zu erwärmen. Die Unterstützung eines Lüfters kann verwendet werden, um ein erneutes Überschießen zu verhindern.
- Sobald die Zieltemperatur erreicht ist und sich stabilisiert hat, überwachen Sie die Temperatur weiter. Die Temperatur bleibt in der Regel für den Rest der Hypothermiezeit sehr stabil, ohne dass gesprüht, Ventilatoren oder Wärmelampen verwendet werden müssen.
- Um das Tier am Ende der Unterkühlung wieder aufzuwärmen, stellen Sie die Temperatur der Wärmematte wieder auf 37 °C ein (6 auf der in diesem Beispiel verwendeten Temperaturkontrolleinheit) und lassen Sie das Tier über einen Zeitraum von 30 Minuten thermoregulieren.
HINWEIS: Die Temperatureinstellungen an Temperaturreglern können variieren und es kann daher erforderlich sein, die Einstellungen für Zielhypothermie und Normothermie auf einzelnen Geräten zu bestimmen.
3. Induktion einer klinisch erreichbaren allmählich einsetzenden Hypothermie ohne aktive Hautkühlung
- Erreichen Sie Eine Unterkühlung, indem Sie die Temperatur der kerntemperaturgeregelten homöothermischen Wärmematte in kleinen Schritten auf die erforderliche Zieltemperatur senken. Im dargestellten Beispiel (Abbildung 3B) wurde alle 30 min ein 1 °C-Inkrement verwendet.
- Kühlen Sie das Tier über den gewünschten Zeitraum (2 h im beschriebenen Beispiel) auf Zieltemperatur ab. Nach dem Abkühlen für das gewünschte Intervall am Ziel halten. In der Regel sind keine weiteren Eingriffe erforderlich, wenn sie auf der homöothermischen Wärmematte für die gewünschte Zieltemperatur gehalten werden.
- Bei diesem Protokoll ist keine externe Kühlung erforderlich, da die Anästhesie die normale Regulierung der Körperkerntemperatur verhindert.
HINWEIS: Die Isoflurananforderungen sinken mit Hypothermie. Bei den meisten Tieren kann eine Ausgangsisoflurankonzentration von 2% in Schritten von 0,1% alle 20-30 minuten auf 1,5% reduziert werden, um eine stabile Atemfrequenz (>50 Atemzüge / min), Herzfrequenz und Blutdruck aufrechtzuerhalten und die Unterdrückung von Reflexreaktionen zu erhalten. - Um das Tier nach Unterkühlung wieder aufzuwärmen, stellen Sie die Wärmematte so ein, dass das Tier über das gewünschte Intervall wieder aufwärmen kann. Im Beispiel wurde die Nacherwärmung mit einer einzigen Einstellung auf 37 °C (6 auf dem im Beispiel verwendeten FHC-Temperiergerät) über einen Zeitraum von 30 Minuten erreicht.
- Für längerfristige Studien, die eine Tiererholung erfordern, halten Sie die Tiere in einem Käfig, der zur Hälfte über eine Wärmematte gelegt wird, damit das Tier thermoregulieren und eine versehentliche postoperative Hypothermie vermeiden kann.
- Rektales Paracetamol (250 mg/kg) kann zur Genesung und Linderung von Eileiterschmerzen verabreicht werden. Subkutane Kochsalzinjektionen (2 x 1,5 ml) können auch verabreicht werden, um Austrocknung durch Anästhesie und chirurgische Eingriffe zu verhindern.
Ergebnisse
Abbildung 3A ist eine Darstellung, wie eine Wistar-Ratte mit dem schnellen Abkühlungsansatz auf Unterkühlung reagiert. Hypothermie-Induktion wird durch die Verwendung von Ventilatoren und 70% Ethanol-Spray erreicht. Die Hypothermie auf ein Ziel von 32,5 °C wird in 15 min erreicht. Es muss darauf geachtet werden, dass ein feines Zusammenspiel zwischen der Verwendung der Ventilatoren / Wärmelampe und des Ethanolsprays zur Aufrechterhaltung der Zieltemperatur gewährleistet ist. Wie aus Abbildung 3Aerzielbar ist, wird eine leichte Temperaturüberschreitung beobachtet, die auftreten kann, wenn die Abkühlung ab etwa 0,5 °C über der Zieltemperatur nicht eingestellt wird. Das Ziel wird bei der 30-Minuten-Marke beibehalten und stabilisiert und die Wiedererwarmung wird um 1,5 Uhr eingeleitet.
Abbildung 3B zeigt das allmähliche Protokoll, bei dem die Zieltemperatur bis 33 °C bei 2 h erreicht und für 30 min aufrechterhalten wird, bevor sie um 2,5 h wieder aufgewärmet wird. Hier wird die Temperatur in Schritten angepasst, was die Dauer verlängert, die zum Erreichen der Zieltemperatur erforderlich ist. Vertikale gepunktete Linien in beiden Diagrammen stellen die Dauer der Abkühlung dar.
Abbildung 3A und Abbildung 3B werden vom Datenloggergerät abgerufen. Zu Beginn des Experiments wird der Datenlogger so programmiert, dass er die Aufnahme vor der Implantation einleitet. Am Ende des Experiments wird der Datenlogger vom Tier entfernt und über einen USB-Anschluss mit dem mitgelieferten Temperaturleser verbunden. Die Software (z.B. eTemperature) liest und generiert die Daten, die dann in eine Tabellenkalkulationssoftware exportiert werden können.

Abbildung 2: Aufbau eines Schnellkühlprotokolls. (A) Zwei Ventilatoren (schwarzer Pfeil) befanden sich über dem unteren rückenbereich der Ratte. Zu Beginn der Hypothermie wurden beide Ventilatoren eingeschaltet und Ethanolspray auf den unteren Rücken aufgetragen. Die Kombination von Ethanol und Ventilator erleichtert und beschleunigt die Unterkühlung, um schnell die Zieltemperatur zu erreichen. (B) Eine Wärmelampe (weißer Pfeil) wurde verwendet, um ein Überschießen der Unterkühlung zu verhindern. Sobald die Zieltemperatur erreicht war, wurde die Wärmelampe verwendet, um zu verhindern, dass die Kerntemperatur der Ratte tiefer fällt. Nachdem sich das Ziel stabilisiert hatte, wurde die Wärmelampe und/oder der verbleibende Lüfter ausgeschaltet.
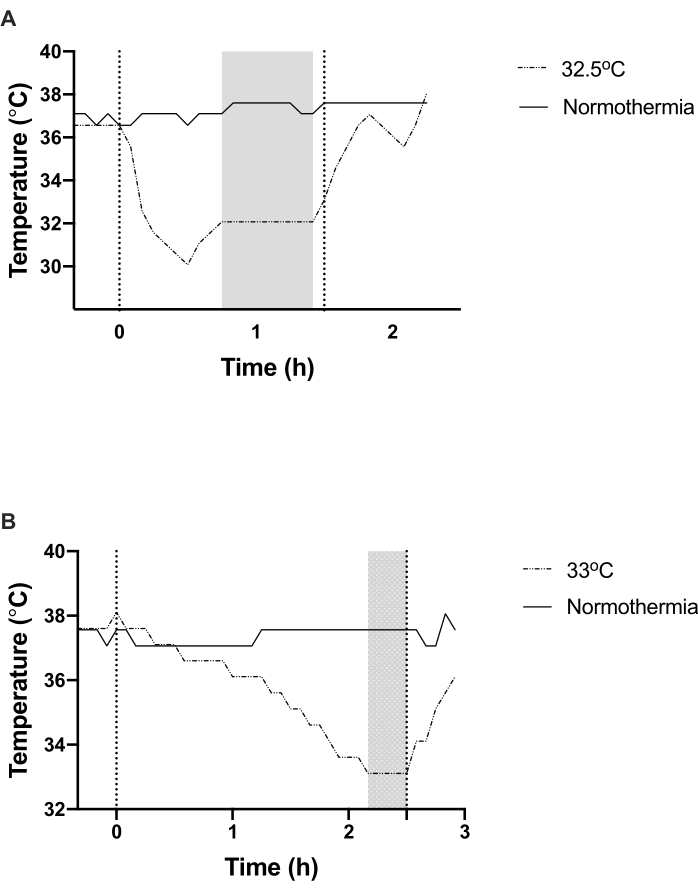
Abbildung 3: Hypothermie-Induktion mit aktiven (A) und schrittweisen (B) Methoden. (A) Die Zieltemperatur wurde in 15 minuten mit dem aktiven Kühlprozess erreicht und im obigen Beispiel für 60 min aufrechterhalten, bevor das Tier wieder aufgewärmt wurde. (B) Die Zieltemperatur wurde nach der schrittweisen Abkühlungsmethode in 2 h erreicht und 30 Minuten lang aufrechterhalten, bevor das Tier wieder aufgewärmet wurde. Schattierte Bereiche in beiden Diagrammen stellen Zeitpunkte dar, in denen die Zieltemperatur beibehalten wurde. Gepunktete senkrechte Linien in beiden Diagrammen beziehen sich auf die Gesamtkühldauer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die hier beschriebenen Verfahren sind einfach zu implementieren, nicht-invasiv und sorgen für eine zuverlässige und reproduzierbare Senkung der Körperkerntemperatur auf eine gewünschte Zieltemperatur.
Es gibt mehrere kritische Schritte in der schnellen Kühlmethode, darunter die folgenden. Übersättigen Sie ethanol spray nicht - es muss darauf geachtet werden, das Tier nicht in Ethanol einzuweichen, da dies die Ergebnisse beeinträchtigt. Überwachen Sie das Tier während der Hypothermie-Induktion - Es muss darauf geachtet werden, die Reaktionen der Tiere auf eine schnelle Hypothermie-Induktion genau zu überwachen. Eine genaue Überwachung der Rektaltemperatur ist wichtig, um sicherzustellen, dass die Temperatur nicht unter das gewünschte Ziel fällt - in diesem Fall schalten Sie die Ventilatoren aus und lassen Sie die Wärmelampe das Tier sanft wieder auf das gewünschte Ziel zurückerwärmen.
Bei beiden Methoden ist eine physiologische Überwachung wichtig, um eine angemessene Anpassung der Anästhesiedosis zu gewährleisten. Bei längerer Abkühlung kann eine unzureichende Anästhesiedosis die Abkühldauer verlängern. In diesem Fall kann die Isoflurankonzentration erhöht werden, bis eine ausreichende Abkühlrate erreicht ist. Ein weiterer kritischer Schritt ist die Kreuzkalibrierung von Temperaturgeräten. Wenn Sie eine Temperaturfühler-geregelte Wärmematte und einen Datenlogger im selben Experiment verwenden, ist es am besten, den Datenlogger mit der Rektalsonde in vivo zu kalibrieren, da es zu geringfügigen Schwankungen der aufgezeichneten Temperatur der beiden Geräte kommt.
Diese Methoden eignen sich für Studien, die den Einsatz von Hypothermie als mögliche Behandlung neurologischer Erkrankungen untersuchen möchten. Das spezifische Ziel der Studie sollte bestimmen, welche Methode verwendet wird. Beide Methoden können als systemische Oberflächenkühlung eingestuft werden, die zweite Methode erfordert jedoch keine aktive Kühlung. Das oben beschriebene modell der allmählichen Abkühlung hat wichtige potenzielle Anwendungen für den Einsatz von Hypothermie in der ischämischen Schlaganfallbehandlung. Langzeithypothermie und die daraus resultierenden Komplikationen stellen eine Herausforderung für ältere Schlaganfallpatienten dar. Darüber hinaus erschwert die Schüttelreaktion bei einigen Patienten das Erreichen der Zieltemperatur10. Während Anti-Zittern-Medikamente helfen können, die Schüttelreaktion zu reduzieren, könnte eine kurzzeitige allmähliche Kühlung das Problem effektiver lindern. Eine kürzere Abkühlzeit reduziert wahrscheinlich auch die Inzidenz von Lungenentzündungen, die häufig in Studien berichtet werden. Ein weiterer potenzieller Vorteil dieser Kurzzeitmethode besteht darin, dass die Geschwindigkeit der Wiedererwarmung im Vergleich zur Langzeitkühlung möglicherweise nicht so wichtig ist. Sehr frühe klinische Studien zur Langzeitkühlung bei Schlaganfallpatienten mit großen Infarkten ergaben, dass eine schnelle Wiedererwarmung zu großen Erhöhungen des intrakraniellen Drucks (ICP) führte, was das Ergebnis verschlechterte und oft tödlich war. Dies führte zur Entwicklung von paradigmen der allmählichen Wiedererwärmung, die die Gesamtdauer der Abkühlung weiter verlängerten. Die Kurzzeitkühlung hält die Zieltemperatur nur für einen kurzen Zeitraum aufrecht und kann weniger wahrscheinlich zu einem Rückprall-ICP führen. Frühere Arbeiten, die die Hypothermiebehandlung für die ICP-Erhöhung unter Verwendung eines ähnlichen schnellen Kühl- und Wiederwarmungsprotokolls wie die hier beschriebenen untersucht haben, haben nach der Erneuterärmung keine Rebound-ICP-Erhöhung gezeigt23,24.
Klinische Studien zur Hypothermie zur Behandlung ischämischer Schlaganfälle konnten die in experimentellen Studien berichteten Vorteile der Hypothermie nicht übersetzen. Die Diskrepanz in Abkühlraten und -dauer zwischen experimentellen Modellen und Patienten sind wichtige Variablen, die diese Diskrepanz erklären können. Ein experimentelles Modell der Hypothermie, das der klinischen Abkühlungsrate besser ähnelt, ermöglicht eine fundiertere Untersuchung der Vorteile der Hypothermie als Behandlungsmaßnahme für Schlaganfallpatienten.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Dieses Projekt wurde von der University of Newcastle, dem Hunter Medical Research Institute (HMRI) Dalara Early Research Career Researcher Fellowship, dem NSW Health Early-Mid Career Research Fellowship und dem National Health and Medical Research Council (NHMRC) Australia finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | ThermoFisher Scientific/ Ajax Finechem | AJA214-20LPL | Diluted with deionized water to give 70 % ethanol |
| Antiseptic solution (Chlorhexidine) | David Craig | A2957 | |
| Anaesthetic (Marcain) | Aspen | PS13977 | |
| Brushless fan motor | Sirocco | YX2505 | 2 x 12 V/130 mA |
| Heat lamp | Reptile One | AC220 | 240 V 50/60 Hz |
| Heat pad | FHC, Inc | 40-90-2 | |
| Rectal probe | FHC, Inc | 40-90-5D-02 | |
| Temperature controller | FHC, Inc | 40-90-8D | |
| Temperature Datalogger | Maxim | DS1922L-F5 |
Referenzen
- Kurisu, K., Yenari, M. A. Therapeutic hypothermia for ischemic stroke; pathophysiology and future promise. Neuropharmacology. 134, 302-309 (2018).
- Polderman, K. H. Induced hypothermia and fever control for prevention and treatment of neurological injuries. Lancet. 371 (9628), 1955-1969 (2008).
- vander Worp, H. B., Sena, E. S., Donnan, G. A., Howells, D. W., Macleod, M. R. Hypothermia in animal models of acute ischaemic stroke: a systematic review and meta-analysis. Brain. 130, 3063-3074 (2007).
- Thomé, C., Schubert, G. A., Schilling, L. Hypothermia as a neuroprotective strategy in subarachnoid hemorrhage: a pathophysiological review focusing on the acute phase. Neurological Research. 27 (3), 229-237 (2005).
- McIntyre, L. A., Fergusson, D. A., Hébert, P. C., Moher, D., Hutchison, J. S. Prolonged therapeutic hypothermia after traumatic brain injury in adults: a systematic review. Journal of the American Medical Association. 289 (22), 2992-2999 (2003).
- Kuczynski, A. M., Demchuk, A. M., Almekhlafi, M. A. Therapeutic hypothermia: Applications in adults with acute ischemic stroke. Brain Circulation. 5 (2), 43-54 (2019).
- Shankaran, S., et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. New England Journal of Medicine. 353 (15), 1574-1584 (2005).
- Jacobs, S. E., et al. Whole-body hypothermia for term and near-term newborns with hypoxic-ischemic encephalopathy: a randomized controlled trial. Archives of Pediatrics and Adolescent Medicine. 165 (8), 692-700 (2011).
- Lyden, P., et al. Results of the ICTuS 2 Trial (Intravascular cooling in the treatment of stroke 2). Stroke. 47 (12), 2888-2895 (2016).
- vander Worp, H. B., et al. Therapeutic hypothermia for acute ischaemic stroke. Results of a European multicentre, randomised, phase III clinical trial. European Stroke Journal. 4 (3), 254-262 (2019).
- Wu, T. C., Grotta, J. C. Hypothermia for acute ischaemic stroke. Lancet Neurology. 12 (3), 275-284 (2013).
- Hemmen, T. M., et al. Intravenous thrombolysis plus hypothermia for acute treatment of ischemic stroke (ICTuS-L): final results. Stroke. 41 (10), 2265-2270 (2010).
- Lyden, P., Ernstrom, K., Raman, R. Determinants of pneumonia risk during endovascular hypothermia. Therapeutic Hypothermia and Temperature Management. 3 (1), 24-27 (2013).
- vander Worp, H. B., et al. EuroHYP-1: European multicenter, randomized, phase III clinical trial of therapeutic hypothermia plus best medical treatment vs. best medical treatment alone for acute ischemic stroke. International Journal of Stroke. 9 (5), 642-645 (2014).
- Lamb, J. A., Rajput, P. S., Lyden, P. D. Novel method for inducing rapid, controllable therapeutic hypothermia in rats using a perivascular implanted closed-loop cooling circuit. Journal of Neuroscience Methods. 267, 55-61 (2016).
- Dumitrascu, O. M., Lamb, J., Lyden, P. D. Still cooling after all these years: Meta-analysis od pre-clinical trials of therapeutic hypothermia for acute ischemic stroke. Journal of Cerebral Blood Flow and Metabolism. 36 (7), 1157-1164 (2016).
- Wu, L., et al. Hypothermia neuroprotection against ischemic stroke: The 2019 update. Journal of Cerebral Blood Flow and Metabolism. 40 (3), 461-481 (2020).
- Hemmen, T. M., Lyden, P. D. Hypothermia after acute ischemic stroke. Journal of Neurotrauma. 26 (3), 387-391 (2009).
- Colbourne, F., Sutherland, G. R., Auer, R. N. An automated system for regulating brain temperature in awake and freely moving rodents. Journal of Neuroscience Methods. 67 (2), 185-190 (1996).
- Campbell, K., Meloni, B. P., Zhu, H., Knuckey, N. W. Magnesium treatment and spontaneous mild hypothermia after transient focal cerebral ischemia in the rat. Brain Research Bulletin. 77 (5), 320-322 (2008).
- Jespersen, B., Knupp, L., Northcott, C. A. Femoral arterial and venous catheterization for blood sampling, drug administration and conscious blood pressure and heart rate measurements. Journal of Visualized Experiments. (59), e3496 (2012).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Gibson, C. L. Middle cerebral artery occlusion allowing reperfusion via common carotid artery repair in mice. Journal of Visualized Experiments. (143), e58191 (2019).
- Murtha, L. A., et al. Short-duration hypothermia after ischemic stroke prevents delayed intracranial pressure rise. International Journal of Stroke. 9, 553-559 (2014).
- Murtha, L. A., et al. Intracranial pressure elevation after ischemic stroke in rats: cerebral edema is not the only cause, and short-duration mild hypothermia is a highly effective preventative therapy. Journal of Cerebral Blood Flow and Metabolism. 35 (4), 592-600 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten