Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Temperaturgesteuerte Montage und Charakterisierung eines Droplet Interface Bilayers
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt den Einsatz eines temperaturgesteuerten Wärmesystems zur Förderung der Lipid-Monolayer-Montage und der Tröpfchen-Schnittstellen-Bilayerbildung für Lipide mit erhöhten Schmelztemperaturen und Kapazitätsmessungen zur Charakterisierung temperaturgetriebener Veränderungen in der Membran.
Zusammenfassung
Die Droplet Interface Bilayer (DIB)-Methode zur Montage von Lipid-Doppelschichten (d.h. DIBs) zwischen lipidbeschichteten wässrigen Tröpfchen in Öl bietet im Vergleich zu anderen Methoden wichtige Vorteile: DIBs sind stabil und oft langlebig, bilayerBereich kann reversibel abgestimmt werden, Prospektasymmetrie wird leicht über Tröpfchenzusammensetzungen gesteuert und gewebeähnliche Netzwerke von Doppeltöten können durch angrenzende. Die Bildung von DIBs erfordert eine spontane Montage von Lipiden in hochdichte Lipidmonolayer an den Oberflächen der Tröpfchen. Während dies bei gemeinsamen synthetischen Lipiden leicht bei Raumtemperatur vorkommt, bildet sich bei Lipiden mit Schmelzpunkten oberhalb der Raumtemperatur, einschließlich einiger zellulärer Lipidextrakte, keine ausreichende Monoschicht oder stabile Doppelschicht. Dieses Verhalten hat wahrscheinlich die Zusammensetzungen – und vielleicht die biologische Relevanz – von DIBs in Modellmembranstudien eingeschränkt. Um dieses Problem anzugehen, wird ein experimentelles Protokoll vorgelegt, um das Ölreservoir, das DIB-Tröpfchen beherbergt, sorgfältig zu erwärmen und die Auswirkungen der Temperatur auf die Lipidmembran zu charakterisieren. Insbesondere zeigt dieses Protokoll, wie eine thermisch leitfähige Aluminiumhalterung und resistive Heizelemente, die durch eine Rückkopplungsschleife gesteuert werden, verwendet werden, um erhöhte Temperaturen vorzuschreiben, was die Monolayer-Montage und Diebesbildung für einen breiteren Satz von Lipidtypen verbessert. Die strukturellen Eigenschaften der Membran sowie die thermotropen Phasenübergänge der Lipide, die die Bilayer umfassen, werden durch Messung der Veränderungen der elektrischen Kapazität des DIB quantifiziert. Zusammen kann dieses Verfahren bei der Bewertung biophysikalischer Phänomene in Modellmembranen über verschiedene Temperaturen helfen, einschließlich der Bestimmung einer effektiven Schmelztemperatur (TM) für Mehrkomponenten-Lipidmischungen. Diese Fähigkeit wird somit eine engere Replikation natürlicher Phasenübergänge in Modellmembranen ermöglichen und die Bildung und Verwendung von Modellmembranen aus einem größeren Spektrum von Membranbestandteilen fördern, einschließlich derjenigen, die die Heterogenität ihrer zellulären Gegenstücke besser erfassen.
Einleitung
Zellmembranen sind selektiv durchlässige Barrieren, die aus Tausenden von Lipidtypen1,Proteinen, Kohlenhydraten und Sterolen bestehen, die alle lebenden Zellen verkapseln und unterteilen. Zu verstehen, wie ihre Zusammensetzungen ihre Funktionen beeinflussen, und zu zeigen, wie natürliche und synthetische Moleküle mit Zellmembranen interagieren, anhaften, stören und translozieren, sind daher wichtige Forschungsbereiche mit weitreichenden Implikationen in Biologie, Medizin, Chemie, Physik und Materialtechnik.
Diese Entdeckungsziele profitieren direkt von bewährten Techniken zur Montage, Manipulation und Untersuchung von Modellmembranen – einschließlich Lipid-Doppelschichten, die aus synthetischen oder natürlich vorkommenden Lipiden zusammengesetzt sind –, die die Zusammensetzung, Struktur und Transporteigenschaften ihrer zellulären Gegenstücke imitieren. In den letzten Jahren hat die Droplet-Schnittstelle Bilayer (DIB) Methode2,3,4 für den Bau einer planaren Lipid-Bilayer zwischen lipidbeschichteten Wassertröpfchen in Öl hat erhebliche Aufmerksamkeit erhalten5,6,7,8,9, 10,11,12,13,14,15,16,17,18,19,20,21,22,23, und hat praktische Vorteile gegenüber anderen Ansätzen für die Modellmembranbildung gezeigt: die DIB-Methode ist einfach durchzuführen, erfordert keine ausgeklügelte Herstellung oder Zubereitung (z. B. "Lackierung") eines Substrats zur Unterstützung der Membran, liefert durchgängig Membranen mit überlegenen Langlebigkeit, ermöglicht Standard-Elektrophysiologie-Messungen und vereinfacht die Bildung von Modellmembranen mit asymmetrischen Packungsbeilage-Zusammensetzungen3. Da sich die Bilayer spontan zwischen Tröpfchen und jedem Tröpfchen in Position und Make-up maßgeschneidert werden können, Die DIB-Technik hat auch großes Interesse an der Entwicklung von zellinspirierten Materialsystemen geweckt, die auf der Verwendung von Reizen-responsiven Membranen18,24,25,26,27,28,29, ausgewogene Abschottung und Transport14,30,31, und gewebeähnliche Materialien17,23,32,33,34,35,36.
Die meisten veröffentlichten Experimente an Modellmembranen, einschließlich der er mit DIBs, wurden bei Raumtemperatur (RT, 20-25 °C) und mit einer Handvoll synthetischer Lipide (z. B. DOPC, DPhPC usw.) durchgeführt. Diese Praxis begrenzt den Umfang biophysikalischer Fragen, die in Modellmembranen untersucht werden können, und kann, basierend auf Beobachtung, auch die Arten von Lipiden einschränken, die zur Montage von DIBs verwendet werden können. Beispielsweise montiert ein synthetisches Lipid wie DPPC, das eine Schmelztemperatur von 42 °C hat, keine eng gepackten Monolayer oder bildet DIBs bei RT37. Die DIB-Bildung bei Raumtemperatur hat sich auch für natürliche Extrakte als schwierig erwiesen, z. B. von Säugetieren (z. B. Gehirn-Gesamtfettextrakt, BTLE)38 oder Bakterien (z.B. Escherichia coli Total LipidExtrakt, ETLE)37, die viele verschiedene Arten von Lipiden enthalten und von Zellen stammen, die bei erhöhten Temperaturen (37 °C) leben. Die Ermöglichung des Studiums unterschiedlicher Zusammensetzungen bietet somit die Möglichkeit, membranvermittelte Prozesse unter biologisch relevanten Bedingungen zu verstehen.
Die Erhöhung der Temperatur des Öls kann zwei Zwecken dienen: Es erhöht die Kinetik der Monolayer-Montage und es kann dazu führen, dass Lipide einen Schmelzübergang durchlaufen, um eine flüssige ungeordnete Phase zu erreichen. Beide Folgen helfen in der Monolayer-Baugruppe39, eine Voraussetzung für ein DIB. Neben der Erwärmung für die Bilayer-Bildung kann die Kühlung der Membran nach der Bildung verwendet werden, um thermotrope Übergänge in einzelnen Lipid-Doppelschichten38zu identifizieren, einschließlich derjenigen in natürlichen Lipidmischungen (z. B. BTLE), die mit Kalorimetrie schwer zu erkennen sind. Neben der Beurteilung thermotroper Lipidübergänge kann die Temperatur des DIB genau variieren, um temperaturinduzierte Veränderungen der Membranstruktur38 zu untersuchen und zu untersuchen, wie Lipidzusammensetzung und Fließfähigkeit die Kinetik membranaktiver Arten (z. B. porenbildende Peptide und Transmembranproteine37) beeinflussen, einschließlich Säugetier- und Bakterienmodellmembranen bei einer physiologisch relevanten Temperatur (37 °C).
Hierin wird eine Beschreibung der Montage eines modifizierten DIB-Ölbehälters und des Betriebs eines Rückkopplungs-Temperaturreglers erläutert, um die Monolayer-Montage und Bilayer-Bildung bei Temperaturen über RT zu ermöglichen. Von einem früheren Protokoll40unterscheidet, sind explizite Details über die Integration von Instrumenten enthalten, die für die Messung und Regelung der Temperatur parallel zur Montage und Charakterisierung des DIB im Ölreservoir erforderlich sind. Das Verfahren wird es dem Anwender somit ermöglichen, diese Methode zur Bildung und Untersuchung von DIBs über einen Temperaturbereich in einer Vielzahl von wissenschaftlichen Kontexten anzuwenden. Darüber hinaus liefern die repräsentativen Ergebnisse spezifische Beispiele für die Arten messbarer Veränderungen sowohl in der Membranstruktur als auch im Ionentransport, die bei unterschiedlicher Temperatur auftreten können. Diese Techniken sind wichtige Ergänzungen zu den vielen biophysikalischen Studien, die effektiv in DIBs entworfen und durchgeführt werden können, einschließlich der Untersuchung der Kinetik membranaktiver Arten in verschiedenen Membranzusammensetzungen.
Protokoll
1. Beheizte Vorrichtungsvorbereitung
- Sammeln Sie 2 Stück von 1 mm dicken isolierenden Gummi auf 25 mm x 40 mm in der Breite und Länge getrimmt, 2 Stück eines 6 mm dicken Gummis, die auch 25 mm x 40 mm sind, eine vorbereitete Aluminium-Basisbefestigung und ein Acrylölreservoir, das in das Sichtfenster der Aluminium-Basishalterung passt (siehe Abbildungen S1, S2 und S3 für Details zur Fertigung und eine explosionsartige Ansicht der Montage). Bereiten Sie die Aluminiumhalterung zuerst vor, indem Sie an der Unterseite der Leuchte ein Glasabdeckungssichtfenster mit UV-härtebarem Klebstoff befestigen und 1 resistives Heizelement an der Oberseite jedes 25 mm x 25 mm Seitenflansch der Leuchte anbringen.
- Legen Sie die dünneren Gummistücke auf die Bühne des Mikroskops, so dass die lange Kante jedes Stückes tangential zur Bühnenöffnung ist, wie in Abbildung1dargestellt.
- Positionieren Sie die Aluminium-Basishalterung auf den Isolierpads mit dem Sichtfenster der Leuchte zentriert über der Objektivlinse. Für die Abbildung der angeschlossenen Tröpfchen ist eine richtige Ausrichtung erforderlich.
- Legen Sie ein dickeres Stück Gummi auf jedes widerstandsfähige Heizelement und verwenden Sie einen Mikroskop-Bühnenclip, um es an Ort und Stelle zu halten. Diese Teile schützen die Heizelemente vor Schäden durch die Bühnenclips und isolieren vor versehentlicher elektrischer Entschärbung zwischen den Heizelementen und sowohl der Aluminiumhalterung als auch der Mikroskopstufe.
- Biegen Sie das Messende eines Thermoelements vorsichtig, um einen 90°-Winkel von 4 mm vom Ende zu erreichen.
- Setzen Sie die gebogene Spitze des Thermoelements in die linke untere Ecke der Aluminiumhalterung ein und befestieren Sie sie vorsichtig mit der Verriegelungsschraube.
- Legen Sie das Acrylreservoir in den Brunnen der Aluminiumhalterung. Dies geschieht vor dem Hinzufügen von Hexadecanöl zum Brunnen (Schritt 1.8) der Aluminiumhalterung, um das Risiko zu minimieren, Luftblasen zwischen dem Sichtfenster und dem Boden des Acrylbehälters einzufangen, was die Sicht auf die Tröpfchen versperren kann.
HINWEIS: Öl, das dem Sichtfach der Aluminiumhalterung zugesetzt wird, wird verwendet, um die Brechungsindizes von Acryl und Glas für eine klarere Abbildung der tröpftigen Tröpfchen im Acrylreservoir zu entsprechen. Daher ist es erwähnenswert, dass Öl im Brunnen der Aluminiumhalterung nicht den Inhalt des Acrylbehälters in Berührung bringt und eine rigorose Reinigung der Aluminiumhalterung nicht erforderlich ist. - Geben Sie 1.000 l Hexadecanöl in den Brunnen der Aluminiumhalterung (d. h. zwischen den Wänden des Acrylbehälters und der Aluminiumhalterung) und achten Sie darauf, nicht zu überfüllen. Der Ölstand im Brunnen der Aluminiumhalterung sollte so hoch wie zulässig sein, um die Oberfläche für die Wärmeübertragung zu maximieren, während es nicht zulässt, dass Öl über die Ränder der Leuchte auf die Mikroskopbühne oder objektive Linse ausläuft.
- Geben Sie das Hexadecanöl mit 1.000 l in das Acrylreservoir aus, während Sie darauf achten, nicht zu überfüllen.
HINWEIS: Das Acrylreservoir sollte zwischen den Experimenten immer gründlich gereinigt werden. Der Benutzer muss ein Regiment verwenden, das aus aufeinanderfolgenden Spülungen mit Ethylalkohol und entionisiertem Wasser besteht, gefolgt von dem Trocknen in einer Trockenschüssel über 12 h.

Abbildung 1:Beheizte Bühnenmontage. Die Bilder zeigen die Montage der thermisch leitfähigen Vorrichtung und des Ölreservoirs für die DIB-Bildung; Zahlen unter jedem Bild den entsprechenden Schritt des Protokolls identifizieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Instrumentierung zur gleichzeitigen Rückkopplungstemperaturregelung und elektrischen Charakterisierung eines DIB
HINWEIS: Dieses Protokoll integriert die folgenden Instrumente zur Steuerung der Rückkopplungstemperatur regelung und gleichzeitige elektrische Charakterisierung eines DIB: ein Pc (PC) mit zwei verfügbaren Usb-Anschlüssen (Universal Serial Bus), ein Patch-Klemmenverstärker gekoppelt mit einem dedizierten Datenerfassungssystem (DAQ-1), ein Wellenformgenerator, ein zweiter programmierbarer Datenerfassungs-Daten-/Datenanschluss mit Spannungsausgangs- und Temperatureingangsmodulen sowie ein Netzteil/Verstärker. Die folgenden Schritte beschreiben die notwendigen Verbindungen dieser Instrumente (wie in Abbildung 2adargestellt), die für die Isolierung der Messung und Kontrolle der Temperatur von der simultanen Elektrophysiologie eines DIB benötigt werden. Bei Bedarf können Ersatzinstrumente ersetzt werden.
- Stellen Sie Ausgangs- und Eingangsverbindungen zu den DAQ-2-Modulen her.
- Wählen Sie zwei Paar Schneckenklemmen am Spannungsausgangsmodul für Differenzspannungsverbindungen aus und befestigen Sie Drahtleitungen an diese Stellen. Ungerade Zahlenklemmen sind gemeinsame Grundverbindungen, und die geraden Nummernklemmen sind ungeerdabgerundete Ausgänge, wie in (Abbildung 2c) dargestellt. Schließen Sie jedes dieser beiden Paar von Bleidrähten an separate Schraubklemmen-BNC-Adapter an und schließen Sie dann jeden Adapter an ein separates BNC-Kabel an, das zum Weiterleiten von Spannungssignalen an andere Instrumente verwendet wird.
HINWEIS: Bei diesem Setup werden Differenzverbindungen an den Klemmen 0 und 1 für den Temperaturregelausgang an den Leistungsverstärker zugewiesen, während ein weiteres Paar von Anschlüssen an den Klemmen 6 und 7 für die Spannungsausgabe vorgesehen ist, die über den Patchklemmenverstärker an die Tröpfchen gesendet werden soll. - Unter Bezugnahme auf (Abbildung 2c) wählen Sie einen Satz von Thermoelementklemmen (z. B. klemmen 2 und 3 sind als TC1-Paar bezeichnet) am Thermoelement-Eingangsmodul aus und schließen Sie die Thermoelementdrähte an.
- Wählen Sie zwei Paar Schneckenklemmen am Spannungsausgangsmodul für Differenzspannungsverbindungen aus und befestigen Sie Drahtleitungen an diese Stellen. Ungerade Zahlenklemmen sind gemeinsame Grundverbindungen, und die geraden Nummernklemmen sind ungeerdabgerundete Ausgänge, wie in (Abbildung 2c) dargestellt. Schließen Sie jedes dieser beiden Paar von Bleidrähten an separate Schraubklemmen-BNC-Adapter an und schließen Sie dann jeden Adapter an ein separates BNC-Kabel an, das zum Weiterleiten von Spannungssignalen an andere Instrumente verwendet wird.
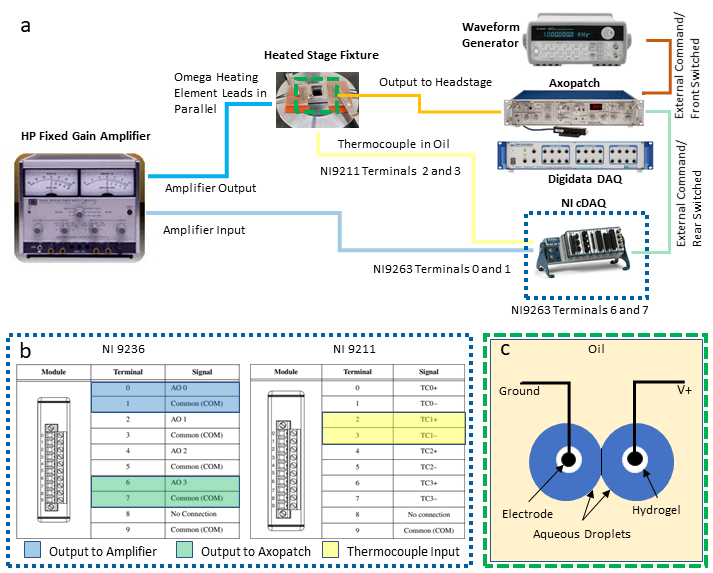
Abbildung 2:Systemverdrahtungsverbindungen. Ein Schaltplan der für das System erforderlichen Geräte und Verdrahtungen ist in (a )dargestellt, während ein detaillierter Blick auf die DAQ-2-Verbindungen in (b) angezeigt wird. Die Abbildung in (c) zeigt wässrige Tröpfchen auf hydrogelbeschichteten Elektroden, die zur DIB-Bildung in Öl getaucht sind. Die beiden Elektroden sind mit den geerdeten bzw. ungeerdeten (V+) Anschlüssen an der Kopfbühneneinheit des Patchklemmverstärkers verbunden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Nachdem die elektrischen Anschlüsse an die DAQ-2-Module hergestellt wurden, schließen Sie das DAQ-2-Chassis über einen USB-Anschluss an einen PC an und schließen Sie es an eine elektrische Stromquelle an. Bestätigen Sie dann die erfolgreiche Treiber- und Softwareinstallation vor der Verwendung mit einer kommerziellen Software.
- Konfigurieren und verbinden Sie einen Leistungsverstärker zwischen DAQ-2 und widerstandsbeständigen Heizelementen.
- Konfigurieren Sie den Verstärker so, dass er im Festverstärkungsmodus mit einer Verstärkung von 10X betrieben wird.
- Schließen Sie das BNC-Kabel der Klemmen 0 und 1 am Spannungsausgangsmodul (Abbildung 2b) mit einem Bananenbuchsen-BNC-Adapter an die Eingangsanschlüsse des Leistungsverstärkers an.
- Schließen Sie die Ausgangsklemmen des Leistungsverstärkers mit zusätzlichen BNC-Adaptern und Verkabelung an beide Heizelemente- und Verstärkersätze an, die parallel zueinander verdrahtet sind, und den Verstärker, um sicherzustellen, dass beide Elemente während des Gebrauchs den gleichen Spannungsabfall beibehalten.
- Stellen Sie die notwendigen Anschlüsse für die elektrophysiologische Ausrüstung her.
- Schließen Sie ein BNC-Kabel von den Klemmen 6 und 7 am Spannungsausgangsmodul(Abbildung 2b) an die HINTERgeschalteten externen Befehls-BNC-Anschlüsse auf der Rückseite des Patchklemmverstärkers an.
- Schließen Sie ein zweites BNC-Kabel zwischen dem Ausgang des Wellenformgenerators und dem Front Switch External Command-Anschluss auf der Rückseite des Patchklemmverstärkers an.
HINWEIS: Diese beiden Anschlüsse bieten alternative Methoden zur Erzeugung von Spannungswellenformen, die über den Patchklemmenverstärker auf die Tröpfchenelektroden aufgebracht werden. Der Wellenformgenerator ist besonders nützlich für die Erzeugung von dreieckigen Wellenformspannungen, die zur Messung der Membrankapazität verwendet werden. Der Benutzer kann entscheiden, welche, wenn entweder, für seine eigene Anwendung notwendig sind. - Schließen Sie mit einem dritten BNC-Kabel den Ausgang des gemessenen Stroms auf der Vorderseite des Patchklemmverstärkers an einen verfügbaren analogen Eingang BNC-Anschluss an der Vorderseite des DAQ-1 an.
- Mit einem vierten BNC-Kabel den Ausgang der gemessenen Membranspannung (auf der Rückseite des Patchklemmenverstärkers) an einen separaten analogen Eingangsanschluss an DAQ-1 anschließen. Dies ermöglicht die Digitalisierung der über die Elektroden angelegten Spannung.
- Mit den beiden Tröpfchenelektroden, die auf Mikromanipulatoren wie in den Schritten 7-9 in Ref.40beschrieben vorbereitet und unterstützt werden, verbinden Sie die Elektrode an die Patchklemmenkopfbühne, die über Kabel an den Patchklemmenverstärker angeschlossen ist.
HINWEIS: Die Rolle der Kopfbühne besteht darin, die Spannung zwischen den Elektroden zu steuern und den resultierenden Strom zu messen, der in eine proportionale Spannung umgewandelt wird, die vom Patchklemmenverstärker zu DAQ-1 ausgegeben wird. - Schließen Sie DAQ-1 über einen USB-Anschluss an einen PC an und schließen Sie die entsprechenden Netzkabel sowohl an den Patchklemmenverstärker als auch an den DAQ-1 an.
- Strom an allen Messgeräten.
HINWEIS: Das vielleicht wichtigste Detail in diesem Setup ist, sicherzustellen, dass die Leistungsverstärker-Ausgangsanschlüsse (mA-A) elektrisch von der Kopfbühneneinheit des Patchklemmenverstärkers isoliert sind, der eine empfindliche Schaltung verwendet, um pA-nA-Pegelströme in einem DIB zu messen.
3. Feedback Temperaturregelung von Tröpfchen-Schnittstelle Bilayer
HINWEIS: Die folgenden Schritte für den Betrieb des Feedback-Temperaturregelungssystems basieren auf einer benutzerdefinierten grafischen Benutzeroberfläche (GUI), die für die Implementierung der proportional-integralen (PI) Feedback-Temperaturregelung40,41 (siehe Ergänzende Codierungsdateien)erstellt wurde. Stattdessen können andere Software- und Steuerungsalgorithmen verwendet werden. Eine Kopie dieses Programms wird dem Leser mit den Zusatzinformationen für das Papier zur Verfügung gestellt, jedoch ist der Benutzer verantwortlich, es für seine eigenen Geräte und Bedürfnisse zu konfigurieren.
- Starten Sie die DAQ-2-Software auf dem PC und öffnen Sie die Programmdatei zur Temperaturregelung. Sobald die GUI geöffnet wird, öffnen Sie das Programm erneut, indem Sie auf das Ordnersymbol in der unteren linken Ecke der GUI klicken und das Temperaturregelungsprogramm auswählen (Abbildung 3).
- Geben Sie die entsprechenden numerischen Werte für die proportionale Kontrollverstärkung (KP) und die integrale Kontrollverstärkung (KI) ein.
HINWEIS: KP und KI Werte von 0,598 bzw. 0,00445 haben sich im Setup gut bewährt. Diese Werte wurden iterativ durch Simulation mithilfe eines Systemmodells ermittelt, das Parameter enthält, die aus gemessenen Open-Loop-Heizantworten gewonnen wurden (siehe Abbildung 4). Beim Open-Loop-Heizenist die vorgeschriebene Heizleistung unabhängig von der gemessenen Temperatur. Im Gegensatz dazu besteht die geschlossene Heizung darin, die aufgebrachte Leistung kontinuierlich an die Heizungen anzupassen, so dass die gemessene Temperatur näher an die gewünschte Temperatur ansteigt. Dies wird hierin mit einem PI-Kontrollschema erreicht. - Um das Temperaturregelungsschema zu testen, geben Sie eine gewünschte Sollwerttemperatur (über Raumtemperatur) ein und aktivieren Sie dann die Rückkopplungstemperaturregelung in der GUI. Beobachten Sie das gemessene Temperatursignal unter der Rückkopplungssteuerung (geschlossene Schleife), die in der GUI für die nächsten Minuten angezeigt wird. Wenn die gemessene Temperatur des Öls die gewünschte Temperatur stark überschreitet, zu langsam auf Veränderungen reagiert oder nicht zum gewünschten Sollwert konvergiert, muss der Benutzer die Steuergewinne anpassen, um die gewünschte Closed-Loop-Leistung zu erreichen.
HINWEIS: Das Programm definiert eine Sättigungsgrenze für die Leistung (und damit Spannung), die den widerstandsbeständigen Heizelementen zugeführt wird. Beispielsweise verbrauchen zwei hier in diesem Element gemeldete Elemente jeweils bis zu 5 W Strom. Die parallele Verdrahtung bedeutet, dass der Gesamtstromverbrauch 10 W nicht überschreiten sollte. Dem Benutzer wird empfohlen, die maximale Leistung zu berücksichtigen, die den Geräten zugeführt werden sollte, und zu wissen, dass diese Grenze die Geschwindigkeit beeinflussen kann, mit der das Closed-Loop-System auf gewünschte Temperaturänderungen reagiert. Höhere Leistungsheizungselemente ermöglichen eine schnellere Erwärmung und höhere Sollwerttemperaturen, erfordern aber höhere zugeführte Ströme für die Heizung. - Wenn das System auf akzeptable Closed-Loop-Leistung abgestimmt ist, geben Sie die gewünschte Öltemperatur für die DIB-Bildung als Sollwert in der GUI ein.
HINWEIS: Beispielsweise lieferte eine Solltemperatur von 60 °C gute Ergebnisse in Experimenten mit BTLE-Liposomen in den wässrigen Tröpfchen37. Der Benutzer wird an anderer Stelle verwiesen2,40 für Protokolle, die die DIB-Montage zwischen Tröpfchen erklären, die an Drahtelektroden hängen, und die Konfiguration von elektrophysiologischen Geräten mit dem Patchklemmenverstärker, DAQ-1 und der elektrophysiologischen Messsoftware. Insbesondere kann das Protokoll von Najem, et al.40 bis Schritt 13 genau befolgt werden. Über diesen Schritt hinaus wird ein etwas anderer Ansatz für eine erfolgreiche Monolayer- und Bilayer-Bildung verwendet, wenn Lipide verwendet werden, die erhitzt werden müssen, um die Monolayer- oder Bilayerbildung zu fördern. - Senken Sie die Spitzen der Silber/Silberchlorid (Ag/AgCl) Elektroden in das Öl, bis sie fast den Boden des Acrylbehälters berühren. Diese Positionierung der Elektrodenspitzen ist entscheidend, um das Tröpfchen auf der Elektrode in beheiztem Öl zu halten, wo konvektive Ströme im Öl beobachtet wurden, um Tröpfchen von den hydrogelbeschichteten Elektroden zu lösen (Abbildung 2c).
- Pipette ein 250 nL Tröpfchen wässriger Lipidlösung mit 2 mg/ml BTLE, 100 mM Kaliumchlorid (KCl) und 10 mM 3-(N-Morpholino) Propanulfonsäure (MOPS) auf jede Elektrodenspitze und sie mindestens 10 Minuten in das erhitzte Öl eintauchen lassen, um die Bildung von Monolayern zu fördern.
- Bedecken Sie die Kopfbühne und die beheizte Bühnenleuchte mit einem geerdeten Faraday-Käfig.
- Bringen Sie die Tröpfchen langsam in leichten Kontakt, indem Sie
Manipulieren der horizontalen Positionen der Elektroden, bis der Benutzer sieht, dass sich die Tröpfchen vom Kontakt verformen oder beginnen, sich gegenseitig zu verdrängen und einige Minuten zu warten, bis die Bilayer-Bildung beginnt. Wenn sich nach einigen Minuten kein Doppelschichtgebildet hat, können die Tröpfchen mehr zusammengezäut werden, um die Bilayerbildung zu erleichtern. Die Bildung einer ausgedünnten Grenzflächen-Bilayer kann durch visuelle Inspektion (Abbildung 5a) oder durch Messung der Erhöhung der Amplitude eines rechteckigen kapazitiven Stroms bestätigt werden, der durch einen Wellenformgenerator induziert wird, der eine 10 mV, 10 Hz Dreiecksspannung22ausgibt. Lassen Sie die Bilayer für mindestens 10 Minuten ausdemadien, um einen stabilen Grenzflächenbereich zu erreichen, bei der Erstausbildung und vor der anschließenden Charakterisierung am ursprünglichen Sollwert.
HINWEIS: Die Art des Öls kann einen erheblichen Einfluss auf die Doppelschichtverdünnung, Membrandicke und den Kontaktwinkel zwischen Tröpfchen haben. Im Allgemeinen gilt: Je kleiner das Ölmolekül, desto leichter kann es im hydrophoben Kern der Von Lipid-Acylketten besetzten Bischicht verbleiben. Die Ölretention erhöht sowohl monolayer als auch bilayer Spannungen und Dicke und verringert den Kontaktbereich und den Kontaktwinkel zwischen Tröpfchen. Diese Metriken bedeuten einen schwächeren Haftungszustand. Größere, sperrigere Moleküle wirken umgekehrt. Squalen ist beispielsweise ein sperrigeres Molekül als Alkane wie Hexadecan, wodurch es während der zweischichtigen Ausdünnung leicht zwischen Monolayern ausgeschlossen werden kann. Als solche sind die in Squalen gebildeten DIBs dünner, sie weisen höhere Kontaktflächen und Winkel auf und weisen höhere freie Energien der Formation22,42 (ein Maß für die Tropfen-Tropfen-Haftung) auf.
4. Charakterisierung temperaturabhängiger Verhaltensweisen in DIBs
HINWEIS: Viele physikalische Prozesse können in DIB-basierten Modellmembranen untersucht werden, einschließlich wie temperaturverändernde Änderungen die Struktur und die Transporteigenschaften der Membran beeinflussen. Die folgenden Schritte sollten nach erfolgreicher Bilayer-Bildung bei einer gewünschten Temperatur durchgeführt werden.
- Messen Sie die Nominalkapazität der Membran und senken Sie gleichzeitig die Temperatur des Ölbades von einem Sollwert, der die Bilayerbildung ermöglicht, thermotrope Phasenübergänge der Lipide in der Membran38zu identifizieren.
- Klicken Sie mit der rechten Maustaste auf das Temperaturdiagramm auf der GUI, und löschen Sie die angezeigten Daten. Dadurch wird sichergestellt, dass genügend Platz im Puffer für nachfolgende Aufnahmen zur Verfügung steht.
- Mit dem an den Patchklemmenverstärker angeschlossenen Wellenformgenerator eine dreieckige Spannungswellenform (z.B. 10 mV, 10 Hz) über die DIB-Elektroden auftragen und die induzierte Stromreaktion durch die Doppelschicht aufzeichnen.
- Kühlen Sie die Doppelschicht, indem Sie die Sollwerttemperatur in 5 °C-Schritten reduzieren und mindestens 5 min auf die neue Konstantatentemperatur zwischen Temperaturänderungen warten, bis die gewünschte Temperatur erreicht ist. Alternativ können Sie die Bilayer passiv abkühlen, indem Sie die Rückkopplungssteuerung ausschalten. Beachten Sie jedoch, dass Experimente zur Durchführung passiver Kühlung von 50-60 °C zu höheren Koaleszenzraten führten.
- Nachdem das Ölbad und die Doppelschicht auf die gewünschte Mindesttemperatur abgekühlt sind, klicken Sie mit der rechten Maustaste erneut auf das Temperaturdiagramm in der GUI und exportieren Sie die Temperaturdaten im Vergleich zur Zeit in eine Tabellenkalkulationssoftware. Beenden Sie die aktuelle Aufzeichnung.
- Berechnen Sie aus dem gemessenen Strom die nominale Kapazität der rechteckigen Wellen-Strom-Antwort im Vergleich zur Zeit während der Kühlperiode.
- Plot Nominelle Kapazität (C) versus Temperatur (T), um zu beobachten, wie sich die Membrankapazität verändert hat. Suchen Sie nichtmonotone Änderungen in C im Vergleich zu T, um TMzu identifizieren.
ANMERKUNG: Die Nominalkapazität kann aus der Amplitude des Rechteckstroms43 (| I|) Verwendung der Beziehung | Ich | = C dv/dt, wobei dv/dt dem Vierfachen des Produkts der Spannungsamplitude entspricht(| V|) und Frequenz (f) der angelegten Dreiecksspannung. Aus diesen Gleichungen wird C = | I|/(4| V|f).
- In ähnlicher Weise bewerten Sie die quasi-statische spezifische Kapazität (Cm) der Bilayer bei festen Temperaturen, indem Sie die Temperatur des Ölbades und des Zweischichtbereichs sukzessive erhöhen.
- Ändern Sie die Sollwerttemperatur in 10 °C-Schritten mit der GUI und lassen Sie das System der neuen Temperatur entsprechen.
- Führen Sie Schritt 4.1.2 durch, um die Messung des kapazitiven Stroms und der Aufzeichnung zu initiieren.
- Ändern Sie den Bilayer-Bereich, indem Sie die Positionen der Elektroden mit den Mikromanipulatoren sorgfältig einstellen (d. h. die Trennung der Elektroden reduziert die Bilayer-Fläche). Ermöglichen Sie es, dass der rechteckige Strom eine stationäre Amplitude erreicht und Bilder des DIB sammelt, um die Berechnung der Membranfläche im Vergleich zur Zeit zu ermöglichen, indem eine am Mikroskop montierte Kamera verwendet wird, um die Bilayer aus der Blende der Mikroskopstufe abzubilden. Fügen Sie gleichzeitig ein digitales Tag in der aktuellen Aufnahmesoftware hinzu, um den entsprechenden Zeitpunkt für die Bildsammlung zu markieren.
HINWEIS: Mikromanipulatoren ermöglichen die präzise Steuerung der Elektroden und damit einen schonenden Kontakt zwischen Tröpfchen. Grobe Manipulation der Tröpfchen kann zu einem fehlgeschlagenen Experiment durch Koaleszenz der Tröpfchen oder durch das Ausfallen eines Tröpfchens von der Elektrode führen. Wie an anderer Stelle22erläutert, wird der bilayer Bereich aus der Kontaktlänge zwischen Tröpfchen berechnet, die als überlappende Kreise in einem Bild in der unteren Ansicht erscheinen. Die Positionen und Abmessungen der Tröpfchen sowie die Länge der Kontaktlinie können mit einer Bildverarbeitungssoftware oder mit anderen wissenschaftlichen Programmierwerkzeugen berechnet werden. - Wiederholen Sie Schritt 4.2.1.2 mindestens 4 Mal, um insgesamt 5 DIB-Bilder und stationäre Regionen mit bilayerm Strom zu erhalten.
- Wiederholen Sie Schritt 4.2.1 bei jeder gewünschten Temperatur.
- Analysieren Sie an den markierten Zeitpunkten, die stationären Bilayer-Bereichen für erfasste Bilder entsprechen, die aktuellen Aufnahmen und DIB-Bilder, um C- und A-Daten für jede Temperatur zu extrahieren.
- Plot C im Vergleich zu A-Daten für jede Temperatur und berechnen die Steigung einer Regression erster Ordnung, die das Cm des Doppellayers bei jeder Temperatur22darstellt.
- Plotwerte von Cm aus Schritt 4.2.4 im Vergleich zu T.
- Untersuchen Sie die C m-im-T-Daten auf nicht-monotone Schwankungen, um Schmelztemperaturen zu identifizieren, TM.
- Ändern Sie die Sollwerttemperatur in 10 °C-Schritten mit der GUI und lassen Sie das System der neuen Temperatur entsprechen.
- Bewerten Sie die Dynamik der spannungsabhängigen Ionenkanalbildung, indem Sie einen DC-Spannungsschritteingang über die Bilayer generieren.
- Stellen Sie die Ausgangsspannung auf den gewünschten Schrittwert in mV (z.B. 100 mV) ein.
- Stellen Sie die Endspannung und Schrittgröße auf einen Wert höher als der gewünschte Schritt (z. B. 110 mV Endspannung und 110 mV Schrittgröße).
- Stellen Sie die gewünschte Dauerzeit für die Schritteingabe in Sekunden (z. B. 90 s) ein.
- Wählen Sie die gewünschte Polarität für den Schritteingang (z.B. positiv).
- Schalten Sie den Patchklemmenverstärker, um die Vom GUI/Spannungsausgangsmodul ausgehende Befehlsspannung an die Kopfbühne zu senden.
- Initiieren Sie aktuelle Aufzeichnungen.
- Schalten Sie die Spannung ein und notieren Sie die induzierte Stromreaktion, die eine S-förmige Reaktion auf eine kritische Spannung aufweisen sollte (z. B. 70 mV für 1 g/ml Mz in 2 mg/ml BTLE).
- Unabhängig davon können dynamische Strom-Spannungs-Beziehungen für eine Membran bei gewünschten Temperaturen erhalten werden, um spannungsabhängige Beziehungen, wie z. B. Ionenkanalverhalten, aufzudecken.
- Schalten Sie den Patchklemmenverstärker, um die vom Wellenformgenerator ausgehende Befehlsspannung an die Kopfbühne zu senden und Stromaufzeichnungen zu initiieren.
- Geben Sie am Wellenformgenerator eine kontinuierliche sinusförmige Wellenform mit einer gewünschten Amplitude, Einem Offset und einer Frequenz aus.
- Zeichnen Sie die induzierte Stromantwort über einen oder mehrere Zyklen auf.
- Wiederholen Sie dies nach Belieben für verschiedene Sinuswellenamplituden sowie Frequenzen und Temperaturen.
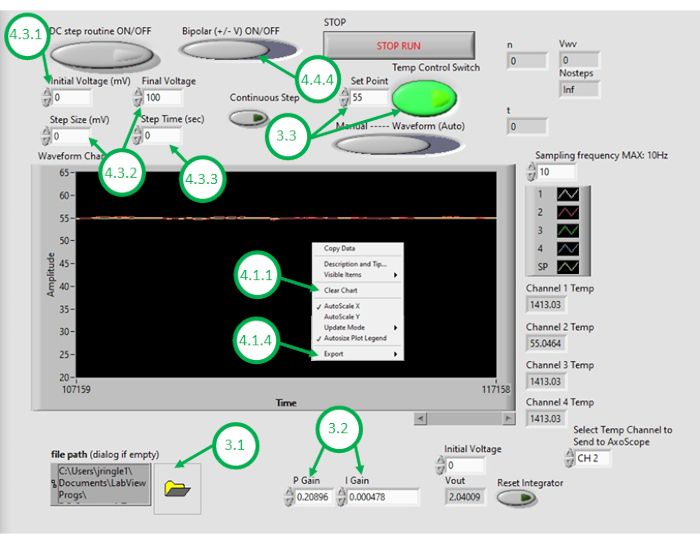
Abbildung 3:Die Temperaturregelungs-GUI. In dieser Abbildung werden die kritischen Schritte hervorgehoben und beschrieben, die erforderlich sind, um die GUI des Programms zu verwenden, um die Temperatur des Ölbades zu steuern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Abbildung 1 zeigt, wie die Aluminiumhalterung und das Acrylölreservoir auf der Mikroskopbühne auf die DIB-Bildung vorbereitet werden. Die Montageschritte 1.2-1.4 dienen dazu, die Leuchte von der Bühne für eine effizientere Erwärmung wärmezudämmen. Die Schritte 1.5-1.7 zeigen, wie das Thermoelement richtig an der Halterung befestigt und das Ölreservoir positioniert wird, und die Schritte 1.8 -1.9 zeigen empfohlene Orte für die Ölabgabe in diese Teile an.
...
Diskussion
Das hier beschriebene Protokoll enthält Anweisungen für die Montage und den Betrieb eines experimentellen Systems zur Steuerung der Temperatur des Öls und der Tröpfchen, die zur Bildung von DIBs verwendet werden. Es ist besonders vorteilhaft für die Aktivierung der DIB-Bildung mit Lipiden, die Schmelztemperaturen über RT haben. Darüber hinaus kann durch präzise Variation der Temperatur des Ölreservoirs die Doppelschichttemperatur manipuliert werden, um die Auswirkungen erhöhter Temperaturen auf verschiedene Mem...
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Finanzielle Unterstützung wurde durch den National Science Foundation Grant CBET-1752197 und das Air Force Office of Scientific Research Grant FA9550-19-1-0213 gewährt.
Materialien
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
Referenzen
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten